
不良事件(AE)的管理
第一部分 AE、ADR、SAE、SADR定义
一、AE的定义
根据GCP定义,不良事件是指受试者接受一种药品后出现的不良医学事件,并不一定与药物有关,包含:
1)任何新发生的事件,如试验期间新发生的感冒、车祸、体检异常等;
2)或者既往已经是异常,但试验期间与基线情况比较在严重程度和频率上有所恶化的事件,如试验期间患
者感冒明显加重、既往肝功能检查异常在试验期间明显加重等。
AE定义的关键点:
1.不良事件发生时间为接受一种药品后,即用药后。
强调以下2点:
⑴起点:从采取试验措施(即进入试验筛选期)开始,而不是从试验用药开始;
⑵终点:注意事项:
①一般以研究结束为终点:无随访期的以研究用药结束为终点,有随访期的以随访结束为终点;
②研究者有权在上述终点到达后出现的不良医学事件填写为AE,如这种情况发生,监查员需要与
研究者协商是否必要。
2.不良事件是不良的医学事件,也就是需要判定为‘不良的’,而且是医学事件。
①不良的:也就是对受试者身心健康有不良影响的,但需注意“妊娠”等特殊现象,“妊娠”一般
需报AE,但妊娠可能是件好事,特别是某些疾病导致受试者难以受孕的情况下;
②医学事件:必须是医学事件,如在试验过程中,受试者因琐事与他人发生争执或打架本身不是不
良事件;但是受试者变成易怒或者在打架的过程中受试者受伤就是不良事件。
3.不良事件不一定与临床试验药物有关:说明可以有关,也可以无关。
4.药物所针对治疗疾病的恶化(即:疗效不佳或无效):一般不是不良事件,除非方案有特殊规定。
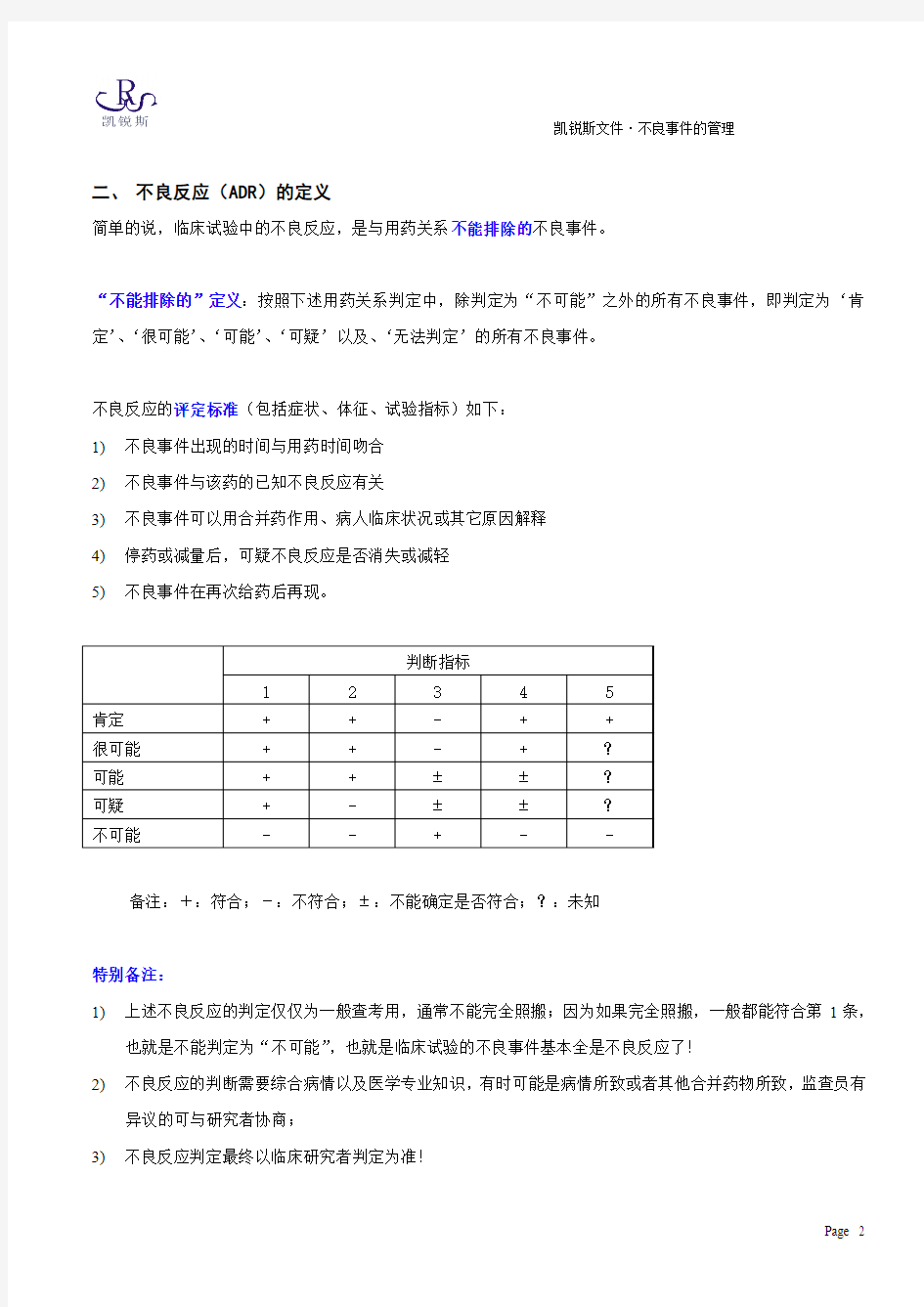
二、不良反应(ADR)的定义
简单的说,临床试验中的不良反应,是与用药关系不能排除的不良事件。
“不能排除的”定义:按照下述用药关系判定中,除判定为“不可能”之外的所有不良事件,即判定为‘肯定’、‘很可能’、‘可能’、‘可疑’以及、‘无法判定’的所有不良事件。
不良反应的评定标准(包括症状、体征、试验指标)如下:
1)不良事件出现的时间与用药时间吻合
2)不良事件与该药的已知不良反应有关
3)不良事件可以用合并药作用、病人临床状况或其它原因解释
4)停药或减量后,可疑不良反应是否消失或减轻
5)不良事件在再次给药后再现。
备注:+:符合;-:不符合;±:不能确定是否符合;?:未知
特别备注:
1)上述不良反应的判定仅仅为一般查考用,通常不能完全照搬;因为如果完全照搬,一般都能符合第1条,
也就是不能判定为“不可能”,也就是临床试验的不良事件基本全是不良反应了!
2)不良反应的判断需要综合病情以及医学专业知识,有时可能是病情所致或者其他合并药物所致,监查员有
异议的可与研究者协商;
3)不良反应判定最终以临床研究者判定为准!
三、严重不良事件(SAE)
临床试验的严重不良事件范围:
1)死亡
2)危及生命:指若不采取抢救措施,患者可能马上死亡
3)住院或住院时间延长
4)造成残废
5)致畸。
视情况而定,下列情况也可纳入SAE:
6)肿瘤
7)重要医学事件:指若不采取措施,会马上危及生命的医学事件
8)项目规定的其他事件:如妊娠等
四、严重不良反应
简单的说,临床试验中的不良反应,是与用药关系不能排除的不良事件。不能排除定义参见《ADR》。
五、非预期的(UNEXPECTED)AE/ADR/SAE/SADR
“非预期的”AE/ADR/SAE/SADR指新发现的AE/ADR/SAE/SADR,判定标准:
1)说明书没有提及,且
2)既往文献没有报道过的。
3)如果是创新药首次在人体使用,也可采用判定标准“药理作用无关的”为“非预期的”(如受体阻滞剂在
治疗高血压时,根据药理作用,应当会降低心率,此时心率降低就不是非预期的),否则按照1)与2)判定都应该都是新发现的。
备注:为尽可能保障受试者安全,国外对UNEXPECTED SAE报告有特别规定,国内尚无此规定。
六、AE/ADR/SAE/SADR的包含关系
如上图,可知下列包含关系:
第二部分不良事件的管理
一、AE所包含的内容
下列事件需要严格按照AE进行管理:
1)患者主诉或医生诊断
①任何新发生的事件:如患者主诉“恶心”,医生诊断“上呼吸道感染”等;
②既往已有事件发生恶化:如上呼吸道感染加重等;
2)体格检查、心电图等文字描述检查结果的发现
①任何新发生的事件且疗后异常有临床意义:如体格检查发现“下颚淋巴结肿大”等;
②既往已有事件发生恶化且疗后异常有临床意义:如“下颚淋巴结肿大,较前为甚”;
3)生命体征、实验室检查等数值型检测结果的发现
①疗前正常(Normal, N)转为疗后异常有临床意义(Clinical Significance,CS);
②疗前异常无意义(Non-Clinical Significance,NCS)转为疗后CS;
③疗前CS,疗后CS且明显恶化。
4)其他方案要求的安全性检查,如神经系统体检等。
①疗前N转为疗后CS;
②疗前NCS转为疗后CS;
③疗前CS,疗后CS且明显恶化;
注意事项:
1)是否CS的判定以及“恶化”的判断:
①是否CS的判定需要综合病情且需要临床专业知识,如ALT有时200,但研究者可能判定NCS,
理由可能为其他检查均正常,且可能非空腹检查;有时ALT=100却判定为CS,理由为AST=500
且体检有肝肿大等;
②是否“恶化”的判定需要综合病情且需要临床专业知识,如上感是否加重,需要结合既往症状加
重,白细胞检查等情况综合判定。
③监查员需与临床研究者协商,请教研究者;
④监查员有时需要善意提醒研究者,如ALT为500,判定为NCS,此时需要研究者核实;
⑤最终以研究者判定为准。
2)AE记录:
①所有上述所有需要进行AE管理的内容,均需要逐行填写CRF不良事件页。
②研究者常常遗忘将实验室检测异常、体检异常、生命体征异常等按照要求填写CRF不良事件页,
监查员必须提醒、督促并核查CRF不良事件页的填写!
二、AE的监查流程
1)患者主诉和医生诊断:核查不良事件页,详见《四、不良事件页监查》
2)体格检查、心电图等文字描述检查结果的监查:
①核查疗后是否有检查有异常;
②核查疗后异常是否CS?;如NCS,且监查员无异议,监查终止;如CS,进一步核查:
③疗前是否异常?;如有异常,进一步核查:
④疗前异常描述是否与疗后完全一致?;如不是完全一致,请教研究者是否前后不同之处有CS?
⑤疗前异常是否CS?;如疗前CS且异常描述疗前疗后不完全一致,请教研究者是否“恶化”?
⑥根据“AE包含内容”判定是否应当按照AE管理?;如是,进一步核查:
⑦核查不良事件页是否如实填写?
⑧是否SAE?;如是,立即按要求汇报!
特别备注:如监查员对CS判定、“恶化”的判定等有疑问,请与研究者协商,最终由研究者判断!
3)生命体征、实验室检查等数值型检测结果的监查:
①核查疗后是否有检查有异常;
②核查疗后异常是否CS?;如NCS,且监查员无异议,监查终止;如CS,进一步核查:
③疗前是否异常?;如有异常,进一步核查:
④疗前异常是否CS?;如疗前CS且疗后数值有较大变化(如上升50%,由+转为+++,或者由低
于正常下限变为高于正常上限),请教研究者是否“恶化”?
⑤根据“AE包含内容”判定是否应当按照AE管理?;如是,进一步核查:
⑥核查不良事件页是否如实填写?
⑦是否SAE?;如是,立即按要求汇报!
特别备注:
①如监查员对CS判定、“恶化”的判定等有疑问,请与研究者协商,最终由研究者判断!
②“异常说明”需要填写内容为:可能的原因解释。而不是结果判定,如血糖检查异常,异常说明
填写“糖尿病或血糖异常”是对结果的判定,如果要说明是既往有糖尿病,应当填写“既往有糖尿病史”;
4)监查其他方案要求的安全性检查项目:根据检查结果类别,参见上述2)或3)。
5)合并用药监查:受试者在临床试验过程中有新的“合并用药”,一般都发生了与临床试验相背的医学
事件,因此有“合并用药”情况,基本可以认为发生了不良事件。
三、管理步骤
1.AE患者的随访要求
随访至何时为止?详见项目方案要求,一般通行标准为:
①症状消失;
②医生已经判定与药物无关;
③受试者症状体征持续时间较长,但已经稳定;
④已经做了必要的努力,患者失访。
2.AE报告的填写
①每个非严重不良事件可填写SFDA《不良事件表》,也可仅填写CRF不良事件页;
②非严重不良事件的随访可再次填写SFDA《不良事件表》,也可仅完善补充填写CRF不良事件页;
③严重不良事件需要填写SFDA《严重不良事件表》;
④严重不良事件的随访再次填写SFDA《严重不良事件表》;
3.SAE的汇报
汇报时间:在收到SAE报告24小时内同时报告药品监督管理部门、卫生行政部门、申办者、合同研究组织和伦理委员会。
通行原则:对于凯锐斯,若发生SAE后,监查员首先立即汇报给项目经理,项目组立即抄送给公司管理层;项目经理需将SAE上报给申办者、临床负责单位、临床参与单位、伦理委员会,其他汇报(如SFDA)由申办者与凯锐斯协商执行。
4.AE管理特别关注点
1)AE内容不全:体格检查、实验室等检查异常等未填写AE页;
2)AE漏报:不良事件发生率明显低于文献报道,甚至为0%,影响试验结果可靠性与真实性,进而影响
产品注册;
3)AE随访不符合要求:特别是实验室等检查异常,常常没有随访结果;
4)AE与药物关系的判定存在一定随意性及较大的研究者间差异;
监查员发现任何任何AE管理问题,必须实时告知研究者并及时跟踪,确保AE管理引起临床研究者足够的重视并及时改进,并确保研究不发生上述重大遗漏!
四、不良事件页监查
CRF不良事件页常见栏目及监查要点如下:
丹徒区人民医院不良事件管理制度 一、不良事件的定义及分级 不良事件指在医疗机构内发生的,预料之外的、不期望的或潜在的危险事件。 主要包括警讯事件、差错及临界差错等。 1、警讯事件:与患者病情的自然发展过程或潜在病情发展无关的、无法预料的意外死亡、器官重大损害或永久性功能丧失的事件。(1)患者意外死亡; (2)与患者病情的自然发展过程或潜在病情发展无关的器官重大损害或永久性功能丧失; (3)手术错误:包括患者错误、手术方式错误、部位错误;(4)诱拐或抱错婴儿。 2、差错:是指病人在接受医疗护理服务过程中,一个或多个环节出现差错,且错误未能被及时发现并得到纠正,导致病人最终接受了错误的医疗护理服务。 3、临界差错:是指由于不经意或经及时介入行动,而使原本可能导致意外、伤害的事件或情况并未真正发生。 二、医院不良事件名称及分类 根据医院不良事件所属类别不同,我院划分为7类: 1、诊治问题:包括错误诊断、严重漏诊、错误治疗、治疗不及时、院内感染等。.
2、不良治疗:包括错用药、多用药、漏用药、药物不良反应、输液反应、输血反应等。 3、意外事件:包括跌倒、坠床、烫伤、自残、自杀、失踪、猝死、锐器伤等。 4、辅助诊查问题:包括报告错误、标本丢失、标本错误、漏做标本,检查过程中出现严重并发症等。 5、手术相关问题:如手术患者、部位和术式选择错误、患者术中死亡、术中术后出现并发症、手术器械、异物遗留在体内、住院期间同一手术的再次手术、麻醉相关事件等。 6、医患沟通:包括医患沟通不良、医患语言冲突、医患行为冲突等。 7、其他非上列导致医疗不良后果的事件。 三、医院不良事件的报告及流程 1、报告责任人:发现不良事件的所有医院员工。 2、报告时限:不良事件(警讯事件)一经发现应在处理的同时口头或电话上报职能科室或总值班,职能科室或总值班核实后再上报分管院领导。 3、报告形式及流程:书面报告,报告表格《医院不良事件报告表》(见附件),特殊不良事件如药物不良反应主、输血反应等按相关科室要求上报。具体接收科室: 1)医疗安全不良事件上报医务科。 )护理安全不良事件上报护理部。2. 3)感染相关安全不良事件上报医院感染管理科。
工艺事故事件管理规定 1术语和定义 1.1工艺事故 因工艺操作失误、巡检不到位、故障处理不及时、技术整改方案落实不力,造成停产、减产或产品质量问题等称为工艺事故。 1.2工艺事件 凡因操作失误,维护不周,操作不当等各种原因,已构成事故发生条件,造成工艺指标偏离范围4小时之内(含4小时),经过采取措施调整,未造成严重后果的,称为工艺事件。2事故的分类 2.1一般工艺事故 生产工艺线因非正常原因或工艺状况出现异常而未能提前主动发现,也未能采取相应的处理措施,造成停产或产品质量下降或关键设备停车12-24小时的。(含24小时)。 2.2重大工艺事故 生产工艺线因非正常原因或工艺状况出现异常而未能提前主动发现,也未能采取相应的处理措施,造成停产或产品质量下降或关键设备停车24小时以上,72小时以下的。(含72小时)。 2.3特大工艺事故 A、生产工艺线因非正常原因或工艺状况出现异常而未能提前主动发现,也未能采取相应的处理措施,造成停产或主机停机72小时以上的。 B、造成人员伤亡事故的。 C、造成设备爆炸、车间火灾、厂房倒塌的。 D、特大工艺事故已构成安全生产事故,依据《中盐吉兰泰盐化集团有限公司生产安全事 故管理办法》由集团安环部或事业部安环部进行处理。
3工艺事故(事件)的上报处理流程 3.1工艺事故事件的报告 3.1.1事故事件报告应当及时、准确、完整,任何部门、分厂和个人对事故不得迟报、漏报、谎报或者瞒报。 3.1.2发生工艺事件立即用电话口头初报分厂调度,在应急处理完毕后3日内以书面形式报告生产技术部备案。 3.1.3事故发生后,现场有关人员应立即采取措施并报告事业部调度室,直接或逐级报告本分厂(部门)负责人,发生火灾事故时,应先报火警。 3.1.4单位(部门)负责人接到事故报告后立即向主管安全与生产的副总经理和安全环保部报告。报告内容包括事故的时间、地点、简要经过、伤亡基本情况、初步原因及损失情况。需向上级部门报告的事故由安全环保部按有关规定执行。 3.2事故事件的调查处理 对于发生的事故事件,均应坚持按照“四不放过”原则(事故原因分析不清楚不放过、事故责任者和员工没有受到教育不放过、没有制定出防范措施不放过和事故责任者没有受到处理不放过)进行调查和处理。 3.2.1事件由责任分厂组织调查处理,并写出事件调查报告,并于事件发生3日内将调查报告报至生产技术部,生产技术部根据事件潜在的危害程度,决定是否需要进一步调查。3.2.2事故由生产技术部组织调查处理,在事故当日或最晚不超过2日必须组织召开事故调查分析会,并在5日内出具调查报告。 3.2.3对事故原因分析不清,则由事业部成立调查小组进行调查,组长由事业部总工程师担任。 3.2.4调查组成员应包括: 1) 发生事故分厂的厂长; 2) 与事故有关人员(当事人及其主操、调度、见证人);
医院不良事件上报及管理制度(试行) 1.目的 为加强医院不良事件的管理,规范医院不良事件上报,提高医院不良事件信息报告的质量和效率,及时发现及排除医院存在的质量缺陷,推动持续医疗质量改进,切实保障医疗安全,建立本制度。 2.适用范围 医院范围内发生的不良事件。 3.支持性文件 《医疗质量安全事件报告暂行规定》卫医管发(2011)4 号, 《医疗器械不良事件监测工作指南》国食药监械(2008)766 号 《药品不良反应报告和监测管理办法》(卫生部令81 号) 4.文件内容 4.1 医院不良事件的定义 是指在医院运行,特别是临床诊疗过程中,任何造成或可能造成患者非预期的人身伤害、痛苦和负担增加的事件和因素,以及影响医院正常运行和危害医院工作人员人身安全的事件和因素。 4.2 医院不良事件的种类。 4.2.1 医疗不良事件 医疗诊断或治疗失误导致患者出现严重并发症、非正常死亡、严重功能障碍、住院时间延长或住院费用增加等事件,包括:医疗信息传递错误事件、治疗错误事件、方法/技术错误事件、药物医嘱/使用错误(医生)、检查事件、麻醉事件、诊疗记录事件、知情同意事件、非预期事件、手术事件、医疗投诉事件、产伤事件、呼吸机事件、择期手术后并发症事件、医源性气胸事件、医源性意外穿刺或撕裂伤事件等。 4.2.2 护理不良事件 病人在住院期间发生的护理意外事件,包括:导管事件、跌倒/坠床事件、烧烫伤事
件、给药错误(护士)、未按医嘱执行禁食禁水事件、误吸/误咽事件、营养与饮食事件、执行消毒隔离事件、压疮事件、窒息事件、约束事件、静脉炎事件、输液药物渗漏事件、 患者自杀自伤事件、患者冲动伤人/损物事件、患者走失事件等。 4.2.3 药品不良事件 在管理及调剂药品时出现的不良事件及严重药物不良反应等事件,包括:、药物调剂 错误(药剂师)、给药阶段错误(护士)、传送过程错误(运送)、信息流转错误(电脑)、药品召回事件、贵重药品丢失及损毁事件、药品监测事件、药物不良反应事件、输液不良 反应事件等。 4.2.4 院感不良事件 在院内发生的严重感染等事件。包括:院感疑似暴发/暴发事件、血液滤过/血液置换 感染事件、环境卫生学监测事件、手卫生依从性、医疗废物事件等。 4.2.5 医疗器械不良事件 因医疗器械或医疗设备的原因给患者或医务人员带来损害等事件。包括:医疗器械不 良反应、医疗仪器设备的召回等。 4.2.6 公共设施、公共设备、环境不良事件。包括:公共设施事件、设备设施使用事件、环境事件、物品运送事件等。 4.2.7 治安消防不良事件。包括:治安事件、危险品管理事件、消防安全事件、放射性(同位素)物品管理、特殊药物管制事件等。 4.2.8 信息不良事件包括:软件故障、电脑硬件故障、信息丢失、篡改、销毁、黑客 攻击、计算机病毒、内部、外部泄密、网络故障或瘫痪、员工跌倒、意外伤害、工伤等事 件等。 4.2.9 职业伤害事件。包括:职业暴露--针头和锐器、职业暴露--体液和血液、职业暴 露--放射线泄露、职业暴露--未行防护、职业暴露--误照射、员工跌倒、员工意外伤害、工 伤事件。 4.2.10 食品安全不良事件。包括:食品安全事件、食品消毒事件等。 4.2.11 输血不良事件。在输血过程中因操作或记录及严重输血不良反应等事件。 4.2.12 工程安全不良事件。包括:基建安全事件等。 4.2.13 生物安全不良事件。包括:试剂与仪器事件、生化污染事件、生物安全突发事 件等。
事件(事故)调查和处理管理制度第一条对发生的事件(事故)及时进行报告、调查、分析和处理,防止类似事件(事故)的重复发生,并最大可能地降低事件(事故)可能造成的损失。 第二条本制度适用于公司所属员工、所属区域内承包商及其他人员发生事件(事故)时的报告、调查、处理、统计分析和防范措施等作业。 第三条规范性引用文件 下列文件对于本标准的应用是必不可少的。凡是标注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。 GB/T 24001—2004 《环境管理体系要求及使用指南》 GB/T 28001—2011 《职业健康安全管理体系要求》 Q/SG EHS1000—2013 《环境与职业健康安全管理手册》 GB 6441-86《企业职工伤亡事故分类》 GB 6442-86《企业职工伤亡事故调查分析规则》 中华人民共和国国务院第375号令《工伤保险条例》 《国务院关于修改〈工伤保险条例〉的决定》 中华人民共和国国务院第493号令《生产安全事故报告和调查处理条例》 第四条术语和定义 (一)事件 发生或可能发生与工作相关的健康损害和人身伤害(无论严重程度),及死亡的情况。 (二)事故
发生人身伤害、健康损害和死亡的事件。 ——微伤事故:因工作原因造成的,但损失工作日小于1日的事故。 ——轻伤事故:指损失工作日1个工作日以上,低于105日的失能伤害(受伤者暂时不能从事原岗位工作)的事故。 ——重伤事故:指造成职工肢体残缺或视觉、听觉等器官受到严重损伤,一般能导致人体功能障碍长期存在的,劳动力有重大损失的失能伤害事故。 一般而言,凡有下列情形之一的,即为重伤事故: a.经医生诊断已成为残废或可能成为残废的; b.伤势严重,需要进行较大的手术才能抢救的; c.人体的要害部位严重烧伤、烫伤,或虽非要害部位,但烧伤、烫伤面积占全身面积的三分之一以上的; d.严重的骨折(胸骨、肋骨、脊椎骨、锁骨、肩胛骨、腕骨、腿骨和脚骨等部位因受伤引起的骨折),严重脑震荡等; e.眼部受伤较重有失明可能的; f.大拇指轧断一节的;食指、中指、无名指、小指任何一指轧断两节或任何两指各轧断一节的;局部肌腱受伤甚剧,引起机能障碍,有不能自由伸曲的残废可能的; g.脚趾轧断三趾以上的;局部肌腱受伤甚剧引起机能障碍,有不能行走自如的残废可能的。 h.内部伤害:内脏损伤、内出血或伤及胸膜的。 ——死亡事故:指事故发生后当即死亡(含急性中毒死亡)或负伤后在30天内死亡的事故。死亡的损失工作日为6000日。
医疗器械不良事件监测管理制度 为加强企业医疗器械不良事件监测管理工作,依据国家《医疗器械监督管理条例》、《医疗医械不良事件监测和再评价管理办法(试行)》制定本制度。 一、建立健全组织结构,明确岗位职责 成立医疗器械不良事件监测领导小组 领导小组负责人:喻雄华 专职监测人员:滕培华 领导小组全面负责医院医疗器械不良事件监测管理相关工作,并履行以下主要职责: (1)负责本企业医疗器械不良事件监测管理工作的规划和相关制度的制定、修改、监督和落实。 (2)负责本企业医疗器械不良事件监测管理的宣教工作。 (3)研究分析医疗器械不良事件监测管理工作的动态和存在问题,定期组织召开日常监测工作会议,讨论并提出改进意见和建议。 (4)制定与完善高风险医疗器械使用的操作规程,组织培训有关人员在经营、使用高风险医疗器械时规范操作。 (5)制定突发、群发的医疗器械不良事件尤其是导致死亡或者严重伤害不良事件的应急预案。 (6)对于上报的不良事件,于一周内组织讨论,制定应对措施。 (7)通报传达上级医疗器械不良事件监测机构的反馈信息。 2、职能部门分工
日常监测:质量负责人负责医疗器械不良事件的日常监测工作。 定期总结:每年1月15日前将上一年度的医疗器械不良事件监测工作的总结报告提交给领导小组。并保存监测的原始资料备查。 监督管理:领导小组通过每季度监督评价上报情况评估医疗器械不良事件监测实施情况,对相关人员进行奖惩。 3、设立医疗器械不良事件兼职联络员 设立兼职联络员,在领导小组及职能部门的领导下开展工作。 二、建立医疗器械使用不良事件报告制度 1、经营过程中发现或可疑发生医疗器械不良事件,立即填写《可疑医疗器械不良事件报告表》一式三份,报质量负责人及领导小组。 2、经领导小组调查核实后,及时上报医疗器械不良事件监测主管部门。 3、经营过程中上报发生医疗器械不良事件后,对导致死亡的事件于发现或者知悉之日起5个工作日内,导致严重伤害、可能导致严重伤害或死亡的事件于15个工作日内向上级医疗器械不良事件监测机构报告;对突发、群发的医疗器械不良事件,立即向上级医疗器械不良事件监测机构报告,并在24小时内报送《可疑医疗器械不良事件报告表》,同时通告相关生产企业与供货企业。 4、经营企业保存医疗器械不良事件监测记录,对于引起不良事件的医疗器械的监测记录保存至医疗器械上标明的使用期限后2年,并且记录保存期不少于5年。 三、建立医疗器械产品使用追溯制度
编号:SM-ZD-18154 事故/事件管理规定Through the process agreement to achieve a unified action policy for different people, so as to coordinate action, reduce blindness, and make the work orderly. 编制:____________________ 审核:____________________ 批准:____________________ 本文档下载后可任意修改
事故/事件管理规定 简介:该制度资料适用于公司或组织通过程序化、标准化的流程约定,达成上下级或不同的人员之间形成统一的行动方针,从而协调行动,增强主动性,减少盲目性,使工作有条不紊地进行。文档可直接下载或修改,使用时请详细阅读内容。 第一条本规定依照国家有关法律法规、国家电力监管委员会(以下简称电监会)《电力生产事故调查暂行规定》和**集团公司《电力生产事故调查规程》等规定、制度的要求制定。 第二条电力生产事故调查,必须实事求是、尊重科学,做到事故原因未查清不放过,责任人员未处理不放过,整改措施未落实不放过,有关人员未受到教育不放过。工作中应坚持“安全第一,预防为主、综合治理”的方针,总结经验教训,研究电力生产事故规律,采取预防措施,防止和减少事故的发生。 第三条公司管理各单位应当根据本规定制定设备二类障碍及设备异常等与生产事故调查有关的不安全事件认定标准或实施细则。 第四条公司管理各单位应当根据本规定制定有关事故/事件管理规定及奖惩实施细则。第五条本规定相关用语及
不良事件(AE)的管理 第一部分 AE、ADR、SAE、SADR定义 一、AE的定义 根据GCP定义,不良事件是指受试者接受一种药品后出现的不良医学事件,并不一定与药物有关,包含: 1)任何新发生的事件,如试验期间新发生的感冒、车祸、体检异常等; 2)或者既往已经是异常,但试验期间与基线情况比较在严重程度和频率上有所恶化的事件,如试验期间患 者感冒明显加重、既往肝功能检查异常在试验期间明显加重等。 AE定义的关键点: 1.不良事件发生时间为接受一种药品后,即用药后。 强调以下2点: ⑴起点:从采取试验措施(即进入试验筛选期)开始,而不是从试验用药开始; ⑵终点:注意事项: ①一般以研究结束为终点:无随访期的以研究用药结束为终点,有随访期的以随访结束为终点; ②研究者有权在上述终点到达后出现的不良医学事件填写为AE,如这种情况发生,监查员需要与 研究者协商是否必要。 2.不良事件是不良的医学事件,也就是需要判定为‘不良的’,而且是医学事件。 ①不良的:也就是对受试者身心健康有不良影响的,但需注意“妊娠”等特殊现象,“妊娠”一般 需报AE,但妊娠可能是件好事,特别是某些疾病导致受试者难以受孕的情况下; ②医学事件:必须是医学事件,如在试验过程中,受试者因琐事与他人发生争执或打架本身不是不 良事件;但是受试者变成易怒或者在打架的过程中受试者受伤就是不良事件。 3.不良事件不一定与临床试验药物有关:说明可以有关,也可以无关。 4.药物所针对治疗疾病的恶化(即:疗效不佳或无效):一般不是不良事件,除非方案有特殊规定。
二、不良反应(ADR)的定义 简单的说,临床试验中的不良反应,是与用药关系不能排除的不良事件。 “不能排除的”定义:按照下述用药关系判定中,除判定为“不可能”之外的所有不良事件,即判定为‘肯定’、‘很可能’、‘可能’、‘可疑’以及、‘无法判定’的所有不良事件。 不良反应的评定标准(包括症状、体征、试验指标)如下: 1)不良事件出现的时间与用药时间吻合 2)不良事件与该药的已知不良反应有关 3)不良事件可以用合并药作用、病人临床状况或其它原因解释 4)停药或减量后,可疑不良反应是否消失或减轻 5)不良事件在再次给药后再现。 备注:+:符合;-:不符合;±:不能确定是否符合;?:未知 特别备注: 1)上述不良反应的判定仅仅为一般查考用,通常不能完全照搬;因为如果完全照搬,一般都能符合第1条, 也就是不能判定为“不可能”,也就是临床试验的不良事件基本全是不良反应了! 2)不良反应的判断需要综合病情以及医学专业知识,有时可能是病情所致或者其他合并药物所致,监查员有 异议的可与研究者协商; 3)不良反应判定最终以临床研究者判定为准!
护理不良事件标准及处理办法 缺陷是指欠缺或不够完善的地方,护理缺陷是指在护理活动中一年违反医疗卫生法律、法规和护理规章与规范等,造成护理技术服务管理等方面的失误,护理缺陷包括护理事故及 差错。 一、护理事故常见原因 护理事故的定义、分级均按国务院颁布的《医疗事故处理条例》及《疗事故分级标准执行,护理事故中常见的原因主要有如下表现形式。 (1)护理人员工作不负责任,交接班不认真,观察病情不细致,不按时巡视病房,病人病情变化发现不及时,丧失抢救时机,造成病人严重不良果的。 (2)护理人员擅离职守,工作失职,直接影个病人护理,造成严重不良后果的。 (3)护理人员不认真执行查对制度,输错血、打错针、发错药;护理不周发生严重烫伤,三度褥疮;对昏迷、躁动病人或小儿未采取安全措施致使病人坠床,造成严重不了后果的。 (4)结扎止血带未及时解除,造成组织坏死,肢体残废等不良后果的。 (5)有关人员无正当理由厌恶供应抢救物品、药品;供应未消毒的器械、敷料、药品引起感染、造成病人严重不良后果的。 (6)护理人员不认真执行医嘱,不按技术操作规程进行操作等,造成病人严重不良后果的。 (7)手术室器械护士或巡回护士。清点纱布、器械有误,以致使纱布或器械等异物滞留在病人体内或软组织内。 (8)护理人员在对及、危、重病员的抢救过程中,抢救药品准备有误,延误抢救时机,造成病人严重不良后果的。
(9)《医疗事故分级标准》中规定:局部注射造成组织坏死,成人大于体表面积2%儿童大于体表面积5%。 二、护理差错的定义和判定标准 《条例》中取消了医疗差错的概念,把《办法》中的医疗差错划归为四级医疗事故。这是因为既往医疗差错,卫生行政部门不予签订和处理,由各医疗机构自行解决,在护理工作中护理事故仅为极少数,常见的经常碰到的多为护理差错,因此抓好护理差错的预防,才能有效地防止护理事故的发生。 (一)护理差错的定义 护理差错失职在护理工作中由于护理人员自身原因或者技术原因的发生的护理人员未 给伤病员造成不良后果或虽有不良后果但未构成事故的差错。 (二)护理差错的判定标准 1、严重差错判定标准 严重差错是指由于护理人员自身原因或者技术原因发生的给伤病员造成不良后果,但为构成护理事故的差错,根据国家及军队有关护理差错处理规定,有下列情形之一的应定为严重差错:(1)对急危重症伤病员推托,延误救治时机的。 (2)急诊入院伤病员在入院后2小时内,非急诊伤病员入院后24小时内,未进行检诊或者未下达医嘱,给予处置的。 (3)对伤病员实施检查治疗时,因准备不认真,检诊不仔细,遗漏主要病史、体征或者阳性结果,延误疾病诊断治疗的. (4)注射、穿刺、活检、窥镜、针灸、理疗等各种诊疗技术操作违反操作规程,造成损伤、断针、断管或者发生局部感染化脓。 (5)开错医嘱、处方、或者特殊检查,不认证执行上级医嘱,并造成不良后果的。
中国石油天然气集团公司 生产安全事件管理办法 第一条为鼓励员工及时报告生产经营活动中的生产安全事件,提高广大员工参与安全生产管理的积极性,营造企业安全文化氛围,进一步预防和避免生产安全事故,依据《中国石油天然气集团公司健康安全环境(HSE)管理原则》,制定本办法。 第二条本办法适用于中国石油天然气集团公司(以下简称集团公司)总部及所属企事业单位(以下简称企业),在生产经营活动中发生的生产安全事件管理。 第三条本办法所称生产安全事件是指在生产经营活动中,由于人为原因可能或已经造成人员伤害或经济损失,但未达到《集团公司生产安全事故管理办法》所规定事故等级的事件。 第四条生产安全事件(以下简称事件)管理应当坚持实事求是、预防为主、全员参与、属地管理的原则。 第五条企业应当按规定报告生产安全事件信息。 第六条企业应当按照直线管理责任组织有关人员分析事件的发生原因,及时制定防范措施并跟踪落实。 第七条事件分为四类: (一)工业生产安全事件:在生产场所内从事生产经营活动中发生的造成人员轻伤以下或直接经济损失小于1000元的情
况; (二)道路交通事件:企业车辆在道路上因过错或者意外造成人员轻伤以下或直接经济损失小于1000元的情况; (三)火灾事件:在企业生产、办公以及生产辅助场所发生的意外燃烧或燃爆事件,造成人员轻伤以下或直接经济损失小于1000元的情况; (四)其他事件:上述三类事件以外的,造成人员轻伤以下或直接经济损失小于1000元的情况。 第八条工业生产安全事件、道路交通事件、火灾事件以及其他事件根据损害程度分为五级: (一)限工事件:人员受伤后下一工作日仍能工作,但不能在整个班次完成所在岗位全部工作,或临时转岗后能在整个班次完成所转岗位全部工作的情况。 (二)医疗事件:人员受伤需要专业医护人员进行治疗,且不影响下一班次工作的情况。 (三)急救箱事件:人员受伤仅需一般性处理,不需要专业医护人员进行治疗,且不影响下一班次工作的情况。 (四)经济损失事件:在企业生产活动中发生,没有造成人员伤害,但导致直接经济损失小于1000元的情况。 (五)未遂事件:已经发生但没有造成人员伤害或直接经济损失的情况。 第九条事件发生后,现场有关人员应当视现场实际情况
护理不良事件报告及管理制度 Through the process agreement to achieve a unified action policy for different people, so as to coordinate action, reduce blindness, and make the work orderly. 编制:___________________ 日期:___________________
护理不良事件报告及管理制度 温馨提示:该文件为本公司员工进行生产和各项管理工作共同的技术依据,通过对具体的工作环节进行规范、约束,以确保生产、管理活动的正常、有序、优质进行。 本文档可根据实际情况进行修改和使用。 1.护理不良事件分为护理差错、护理事故、在院跌倒、护理并发症护理投诉及其他意外或突发事件。 2.护理部及各科室具备防范、处理护理不良事件的预案, 并不断修改完善。 3.发生护理不良事件后, 当班护士要立即向护士长和当班医生汇报, 本着病人安全第一的原则, 迅速采取补救措施, 尽量避免或减轻对病人健康的损害, 或将损害降到最低程度。 4.护士长要逐级上报不良事件的原因、经过、后果, 并按规定填写对应的登记表.情节严重的差错、投诉或病人自杀等突发事件半小时内上报护理部, 其他不良事件12小时内上报护理部, 护理部及时了解情况, 给予处理意见, 尽量降 低对病人的损害. 5.发生护理不良事件的各种有关记录、检验报告、药品、器械等均应妥善保管, 不得擅自涂改、销毁, 必要时封存, 以备鉴定。 6.护理部制定护理投诉和纠纷的接待流程, 热情接待、认真调查、尊重事实、耐心沟通、端正处理态度, 5个工作日内给予答复.重大护理投诉, 上报医院备案、讨论。 7.护理不良事件发生后, 病区和科室要组织护士进行讨论, 分析原因, 提高
事故、事件管理制度示范 文本 In The Actual Work Production Management, In Order To Ensure The Smooth Progress Of The Process, And Consider The Relationship Between Each Link, The Specific Requirements Of Each Link To Achieve Risk Control And Planning 某某管理中心 XX年XX月
事故、事件管理制度示范文本 使用指引:此管理制度资料应用在实际工作生产管理中为了保障过程顺利推进,同时考虑各个环节之间的关系,每个环节实现的具体要求而进行的风险控制与规划,并将危害降低到最小,文档经过下载可进行自定义修改,请根据实际需求进行调整与使用。 1 目的与适用范围 1.1 目的 为加强生产安全事故报告和调查处理,防止和减少生 产安全事故,根据《安全生产法》和《生产安全事故报告 和调查处理条例》等法律法规,结合本企业实际,特制定 本管理制度。 1.2适用范围 本制度适用本公司事故的报告、调查、分析处理和预 防管理。 2 引用文件 2.1《中华人民共和国安全生产法》(中华人民共和国 主席令第70号)
2.2《生产安全事故报告和调查处理条例》(中华人民共和国国务院令第493号) 2.3《冶金等工贸企业安全生产标准化基本规范》安监总管四〔2011〕128号 3 职责 3.1总经理协助事故调查组工亡事故的抢救和调查处理,及时、如实向上级报告生产安全事故。 3.2总经理助理协助总经事组织重大事故的抢救和调查处理。 3.3生产部 3.3.1负责组织轻伤事故、重大未遂事故及中毒事故的调查、分析和处理。 3.3.2协助组织工亡事故的调查、分析工作。 3.3.3负责事故、事件的统计、分析和处理。 3.4工会
管理制度编号:YTO-FS-PD416 护理不良事件报告及管理制度通用版 In Order T o Standardize The Management Of Daily Behavior, The Activities And T asks Are Controlled By The Determined Terms, So As T o Achieve The Effect Of Safe Production And Reduce Hidden Dangers. 标准/ 权威/ 规范/ 实用 Authoritative And Practical Standards
护理不良事件报告及管理制度通用 版 使用提示:本管理制度文件可用于工作中为规范日常行为与作业运行过程的管理,通过对确定的条款对活动和任务实施控制,使活动和任务在受控状态,从而达到安全生产和减少隐患的效果。文件下载后可定制修改,请根据实际需要进行调整和使用。 1.护理不良事件分为护理差错、护理事故、在院跌倒、护理并发症护理投诉及其他意外或突发事件。 2.护理部及各科室具备防范、处理护理不良事件的预案,并不断修改完善。 3.发生护理不良事件后,当班护士要立即向护士长和当班医生汇报,本着病人安全第一的原则,迅速采取补救措施,尽量避免或减轻对病人健康的损害,或将损害降到最低程度。 4.护士长要逐级上报不良事件的原因、经过、后果,并按规定填写对应的登记表.情节严重的差错、投诉或病人自杀等突发事件半小时内上报护理部,其他不良事件12小时内上报护理部,护理部及时了解情况,给予处理意见,尽量降低对病人的损害. 5.发生护理不良事件的各种有关记录、检验报告、药品、器械等均应妥善保管,不得擅自涂改、销毁,必要时封存,以备鉴定。
事故、事件管理规定 1.目的和适用范围 1.1为认真贯彻“安全第一,预防为主”的方针,进一步规范公司事故、事件的管理,确保安全生产,依据《中华人民共和国安全生产法》及国务院《企业职工伤亡事故报告和处理规定》等相关法律、法规,结合公司实际制定本规定。 1.2本规定适用于集团各子公司,适用于生产、安全、设备、质量及管理事故和事件。 2.术语和定义 本术语和定义属参考GB/T28001-2001标准,结合公司实际自定义。 2.1事故:造成死亡、疾病、伤害、损坏或其它财产损失的意外情况,且构成一定经济损失及影响。 2.2事件:造成伤害或财产损失的意外情况,且直接损失较小,影响较少。 2.3事故报告:是指在规定时间内,以书面形式向主管部门报送的以表述事故发生信息的文件。 2.4未遂事故:是指因严重违反规定,造成不可接受的危险程度,且未发生事故。 2.5直接经济损失:是指因事故、事件造成物料等财产损失价值及人身伤害发生的医疗及医疗相关费用,包括医药费、诊查费、住院费、护理费、误工费等。 2.6间接损失:是指因事故、事件造成产品返工费用及停产损失或造成为平息外部社会影响发生的应酬费用等。 2.7相关责任者:是指事故、事件中经确认的非主要责任者,且在事故、事件具有一定责任。 2.8管理责任者:是指在事故、事件中负有隶属管理或职能管理的相应领导。 2.9主要责任者:是指对造成事故、事件负有直接责任或大部分责任的具体人员。 3.相关职责 3.1公司总经理是安全生产第一责任人,对各类特别重大事故负有组织调查、听取汇报、组织事故处理的职责。 3.2分管副总经理对所主管的系统按事故处理权限,具有组织调查处理的职责。 3.3各单位负责人是该单位的安全第一责任人,有对事故、事件报告,参与调查参与事故处理的职责。 3.4监察部有对渎职行为实行监察的职责,并有对事故处理全程监督的职责。3.5公司成立事故调查处理领导小组:
xx人民医院不良事件管理制度 一、不良事件的定义及分级 不良事件指在医疗机构内发生的,预料之外的、不期望的或潜在的危险事件。 主要包括警讯事件、差错及临界差错等。 1、警讯事件:与患者病情的自然发展过程或潜在病情发展无关的、无法预料的意外死亡、器官重大损害或xx功能丧失的事件。 (1)患者意外死亡; (2)与患者病情的自然发展过程或潜在病情发展无关的器官重大损害或xx 功能丧失; (3)手术错误:包括患者错误、手术方式错误、部位错误; (4)诱拐或抱错婴儿。 2、差错:是指病人在接受医疗护理服务过程中,一个或多个环节出现差错,且错误未能被及时发现并得到纠正,导致病人最终接受了错误的医疗护理服务。 3、临界差错:是指由于不经意或经及时介入行动,而使原本可能导致意外、伤害的事件或情况并未真正发生。 二、医院不良事件名称及分类 根据医院不良事件所属类别不同,我院划分为7类: 1、诊治问题:包括错误诊断、严重漏诊、错误治疗、治疗不及时、院内感染等。 2、不良治疗:包括错用药、多用药、漏用药、药物不良反应、输液反应、输血反应等。
3、意外事件:包括跌倒、坠床、烫伤、自残、自杀、失踪、猝死、锐器伤等。 4、辅助诊查问题:包括报告错误、标本丢失、标本错误、漏做标本,检查过程中出现严重并发症等。 5、手术相关问题:如手术患者、部位和术式选择错误、患者术中死亡、术中术后出现并发症、手术器械、异物遗留在体内、住院期间同一手术的再次手术、xx相关事件等。 6、医患沟通:包括医患沟通不良、医患语言冲突、医患行为冲突等。 7、其他非上列导致医疗不良后果的事件。 三、医院不良事件的报告及流程 1、报告责任人:发现不良事件的所有医院员工。 2、报告时限:不良事件(警讯事件)一经发现应在处理的同时口头或电话上报职能科室或总值班,职能科室或总值班核实后再上报分管院领导。 3、报告形式及流程:书面报告,报告表格《医院不良事件报告表》(见附件),特殊不良事件如药物不良反应主、输血反应等按相关科室要求上报。具体接收科室: 1)医疗安全不良事件上报医务科。 2)护理安全不良事件上报护理部。 3)感染相关安全不良事件上报医院感染管理科。 4)药品安全不良事件上报药剂科。 5)器械安全不良事件上报医疗设备科。 6)设施安全不良事件上报总务科。 7)人身安全不良事件上报保卫科。
重大事件管理制度 浙江亚太药业股份有限公司 重大事件处理制度 第一章总则 第一条编制目的 提高公司处理突发事件的能力,最大程度地预防和减少突发事件及其造成的损害,保障公司的人员及财产安全,维护公司利益及企业形象。 第二条分类分级 本预案所称突发事件是指突然发生,造成或者可能造成重大人员伤亡、财产损失、损害公司形象,危及公司安全的紧急事件。 根据突发公共事件的发生过程、性质和机理,突发公共事件主要分为以下六类: (一) 自然灾害。主要包括水旱灾害,气象灾害,地震灾害,地质灾害等。 (二) 公共卫生事件。主要包括传染病疫情,群体性不明原因疾病,食物中 毒,以及其他严重影响公司员工健康和生命安全的事件。 (三) 事故安全。主要包括各类安全事故,交通运输事故,火灾、匪警、人身 伤害、失窃、办公场所及设备发生故障、公司机密外泻以及网络安全事故等。 (四) 经济事件。主要包括诈骗,货物丢失、产品事故及财产赔偿、财务事故 等。 (五) 人事事件。主要包括罢工、员工过激行为、重要员工突然离职或失踪等 造成工作无法开展的恶性事件。 浙江亚太药业股份有限公司 (六) 公关事件。公安、工商、税务等政府行政部门的非常规检查及处罚,媒 体或其他单位、个人散布的影响公司形象的负面新闻。
第三条适用范围 本预案适用于涉及跨部门,或超出事发部门处置能力的特别重大突发事件应对工作。 本预案指导公司总部及全国各办事处的突发事件应对工作。 第四条工作原则 (一) 以人为本,减少危害。 (二) 居安思危,预防为主。 (三) 统一领导,分级负责。 (四) 快速反应,协同应对。 (五) 普及观念,提高素质。 第二章组织体系 第五条领导机构 总经理是突发事件应急管理工作的最高领导。在总经理领导下,由各部门领导组成应急指挥机构,负责突发事件的应急管理工作;必要时,派出工作组指导有关工作。 第六条办事机构 综合管理办公室作为应急管理常设机构,履行值守应急、信息汇总和综合协调职责,发挥运转枢纽作用。 第三章运行机制 浙江亚太药业股份有限公司 第七条预测与预警 各部门要针对各种可能发生的突发事件,完善预测预警机制,建立预测预 警系统,开展风险分析,做到早发现、早报告、早处置。 第八条应急处置方案
护理不良事件管理制度1 护理不良事件管理制度 【护理不良事件定义】 护理不良事件是指与护理相关的损伤。在护理过程中任何可能影响病人的诊疗结果、增加病人痛苦和负担并可能引发护理纠纷或事故的事件或由于护理行为造成患者死亡、住院时间延长,或离院时仍带有某种程度的失能的事件。【护理不良事件分类】 护理不良事件分为不可预防不良事件和可预防性不良事件 (一)不可预防的不良事件是指正确的护理行为造成的不可预防的损伤。(如难免性压疮) (二)可预防的不良事件是指护理过程中由于未能防范的差错或设备故障造成的损伤。 【护理不良事件报告的意义】 报告不良事件,以非惩罚性、主动报告为原则及时发现潜在的不安全因素,可有效避免护理缺陷(护理事故、护理差错、护理纠纷、护理缺点)发生,发现医院安全系统存在的不足,提高医院系统安全水平,提高对错误的识别能力,及时总结经验教训,保证医疗安全,促进医学发展和保护患者利益,可增加医疗水平和服务的透明度。 【护理不良事件的范围】 一、患者在住院期间发生给药错误、导管脱落或拔出、跌倒、
坠床、压疮、自杀倾向、自杀、空气栓塞、输液反应、输血反应、药液外渗、针刺伤、运送中病情变化、误吸/窒息、走失、猝死、咽入异物、识别患者错误、输血错误、暴力行为、咬破体温计、外伤、烫伤、烧伤、失窃、火灾、蓄意破坏、医疗材料故障、仪器故障及其他与患者安全相关的护理意外。 二、因护理失误导致患者出现严重并发症、非正常死亡、严重功能障碍、住院时间延长或住院费用增加等。 三、严重药物不良反应或输血不良反应。 四、严重院内感染。 【护理不良事件报告制度】 一、在护理活动中必须严格遵守医疗卫生管理法律,行政法规,部门规章和诊疗护理规范、常规,遵守护理服务职业道德。 二、各科应建立护理不良事件登记本,发生不良事件后要主动及时上报并做好登记,及时据实登记。 三、发生护理不良事件后,积极采取挽救和抢救措施,尽量减少或消除不良后果。有关的记录、标本、化验结果及相关药品、器械均应妥善保管,不得擅自涂改、销毁,以备鉴定。 四、发生护理不良事件后,当事人应立即报告值班医师、护士长及科主任。由病房护士长当日报科护士长,科护士长上报护理部,并上交书面报告。上报形式以个人或科室为上报单位。周末及节假日向院总值班报告。
事件管理规定 第一章总则 第一条为了规范油田的事件报告、调查、统计分析和经验分享,避免类似事件的重复发生,特制定本规定。 第二条油田鼓励所有的员工报告各类事件和进行安全经验分享。 第三条本规定适用于塔里木油田各单位。 第二章事件的定义 第四条本规定所称的事件是指造成人身伤害、工艺设备损坏、危害物料泄漏,对生产和环境造成不利影响或造成财产损失但没有达到一般B级事故等级的各种意外情况,可分为人员伤害事件、生产事件、设备事件、交通运输事件、火灾事件和其它事件等六类。 (一)人员伤害事件 人员伤害事件是指员工在工作时发生伤害的意外情况,按轻重程度划分为:急救箱事件、医疗事件、限工事件、损工事件。 急救(箱)事件:仅需一般性处理,不需其它专业医疗治理的情况。
医疗事件:需由专业医护人员进行治疗的伤害事件,并且不影响下一班次的工作。 限工事件:因工作受伤,导致下一工作日只能做其部分工作,或不能工作一个完整班次的情况。 损工事件:因工作受伤,导致下一工作日无法工作的情况(下一工作日适逢节假日、计划性休息或休假时,应按休假后的第一个工作日能否正常工作为准)。 (二)生产事件 生产事件是指生产作业过程中发生的停(减)产、跑料、串料、油气泄漏、化学危险品泄漏等,但没有人员受到伤害的意外情况,如发生在油气处理、炼油化工、钻试修井等生产作业过程中的各种意外事件。 (三)设备事件 设备事件是指在生产作业过程中造成机械器具、动力设备、电力通讯设施、仪器仪表、锅炉压力容器、管道等损害,但没有人员受到伤害的意外情况。 (四)交通运输事件 交通运输事件是指油田车辆造成的人身伤害或者财产损失的意外情况。 (五)火灾(爆炸)事件 在油田生产、办公及生产辅助场所发生的燃烧或燃爆等意外情况。
1. 目的 1.1 界定医院内各种不良事件(警讯事件、其它重大不良事件、轻度不良事件、接近差错)的定义并制 定上报和处理流程,确保当医院发生不良事件时能按照制度报告、评估、处理,以期将不良影响和损失降到最低;并分析原因、改进规程,预防类似事件再次发生。 1.2 建立“自愿上报的危机管理意识”,鼓励员工人人参与医院管理,上报可能导致病人及家属、员工和 来访者不安全的事件,并提高警觉及事先预防。 2. 定义 2.1 不良事件:医院内意外发生的、有潜在危险的或已造成受害人伤害的事件。包括以下4种: 2.1.1 警讯事件(包括极严重的医疗差错,但不仅仅局限于此) 2.1.1.1与病人病情的自然发展过程或潜在病情发展无关的非预期死亡(例如:自杀); 2.1.1.2与病人病情的自然发展过程或潜在病情发展无关的永久性功能丧失; 2.1.1.3错误的手术部位,错误的手术,错误的病人。 2.1.2 其它重大不良事件(包括中度的医疗差错,但不仅仅局限于此) 2.1.2.1严重输血反应:如溶血反应、细菌污染等情况导致的明显、严重症状。 2.1.2.2严重的药物不良事件:严重的药物不良反应及毒副反应,危及生命。 2.1.2.3重大用药错误:违反医疗原则、使用配伍禁忌药物、超剂量用药、给药途径错误等情况导致不良 后果或/或引起医疗纠纷。 2.1.2.4手术前后诊断明显不符。 2.1.2.5麻醉和镇静:中、深度镇静和麻醉使用过程中的不良事件和不良事件趋势,导致严重的不良后果 和/或引起医疗纠纷。 2.1.2.6治疗后出现的严重并发症。 2.1.2.7感染性疾病爆发。 2.1.2.8严重的医疗设备器械故障,导致不良后果和/或引起医疗纠纷。 2.1.2.9环境和设施、设备不良事件:如:水污染事件、食物中毒、重大化学物质泄漏事件、辐射源泄漏、 火灾及医用气体事故、压力容器事故、电梯事故、停电事故、网络故障等导致明显不良后果和/或引起纠纷。 2.1.2.10刑事或意外事件:如:病人走失、病人和员工遭外来人攻击、病人和医院财产被盗或被损坏(10 万元以上)、病人之间激烈冲突导致受伤。 2.1.3 轻度不良事件:是指除警讯事件、其他重大不良事件、接近差错(见下)以外的不良事件,包括轻 度的医疗差错,但不仅仅局限于此。 2.1.4 接近差错:病人接受医疗护理服务过程中,一个或多个环节出现错误,但错误到达病人之前就被发现并得到纠正,病人最终没有得到错误的医疗护理服务。
护理安全不良事件事故管理办法
护理安全(不良)事件、事故管理办法 为了增强护理人员的风险管理意识,减少护理缺陷的发生,持续改进护理质量,根据《医疗缺陷管理办法》文件精神,结合医院实际,修订管理办法。 一、非惩罚性护理不良事件报告制度及激励机制 (一)不良事件报告原则及意义 非惩罚性、主动性报告的原则:护理部鼓励护理人员主动、自愿报告不良事件,包括本人的或本科室的,也可报告其它人或其它科室的,对主动报告的科室和个人的有关信息,护理部将严格保密。全院护理人员要提高主动报告护理不良事件的意识,经过报告不良事件,及时发现潜在的不安全因素,可有效避免护理差错与纠纷的发生,保障病人安全,不良事件的全面报告,有利于发现医院安全系统存在的不足,提高医院系统安全水平,促进医院及时发现安全事故隐患,不断提高对错误的识别能力,不良事件报告后的信息共存,能够使相关人员从她人的过失中吸取经验教训,以免重蹈覆辙。 (二)上报形式 1、书面报告:发现护理不良事件后24小时内,当事人或发现者按照要求将不良事件做好登记,填写《护理不良事件报告单》上报护理部。 2、紧急电话报告:发生严重不良事件时,护理人员应立即向护士长、科主任、总值班、护理部口头报告事件情况,并随后履
行书面补报。 (三)激励和处罚机制 1、鼓励自愿报告,对主动及时上报不良事件的人员或科室给予表扬并给予报告人保密。 2、对发生事件且主动上报,对病人未造成不良影响的个人,原则上不予惩罚. 3、对发现事件,并及时采取补救措施的搭班护士,将予以奖励;雷同事件科内一月内发生2起以上的扣护士长100-200元。 3、不良事件发生后,不及时报告,虽未形成医疗纠纷,但被职能部门发现的,给予处罚人民币100-200元。 4、其余参照《医疗缺陷管理办法》文件执行。 二、护理不良事件分类及处理 护理不良事件是指与护理相关的损伤,在诊疗护理过程中任何可能影响病人的诊疗结果、增加病人痛苦和负担并可能引发护理纠纷或事故的事件。包括护理事故、护理差错、护理缺陷。 (一)护理事故 1、定义:指在护理工作中,由于护理人员的过失造成病人死亡、残疾、器官组织损伤,导致功能障碍及明显人身损害的其它后果。 2、分类:分一、二、三、四级 (1)一级护理事故:造成患者死亡、重度残疾的; (2)二级护理事故:造成患者中度残疾、器官组织损伤导致