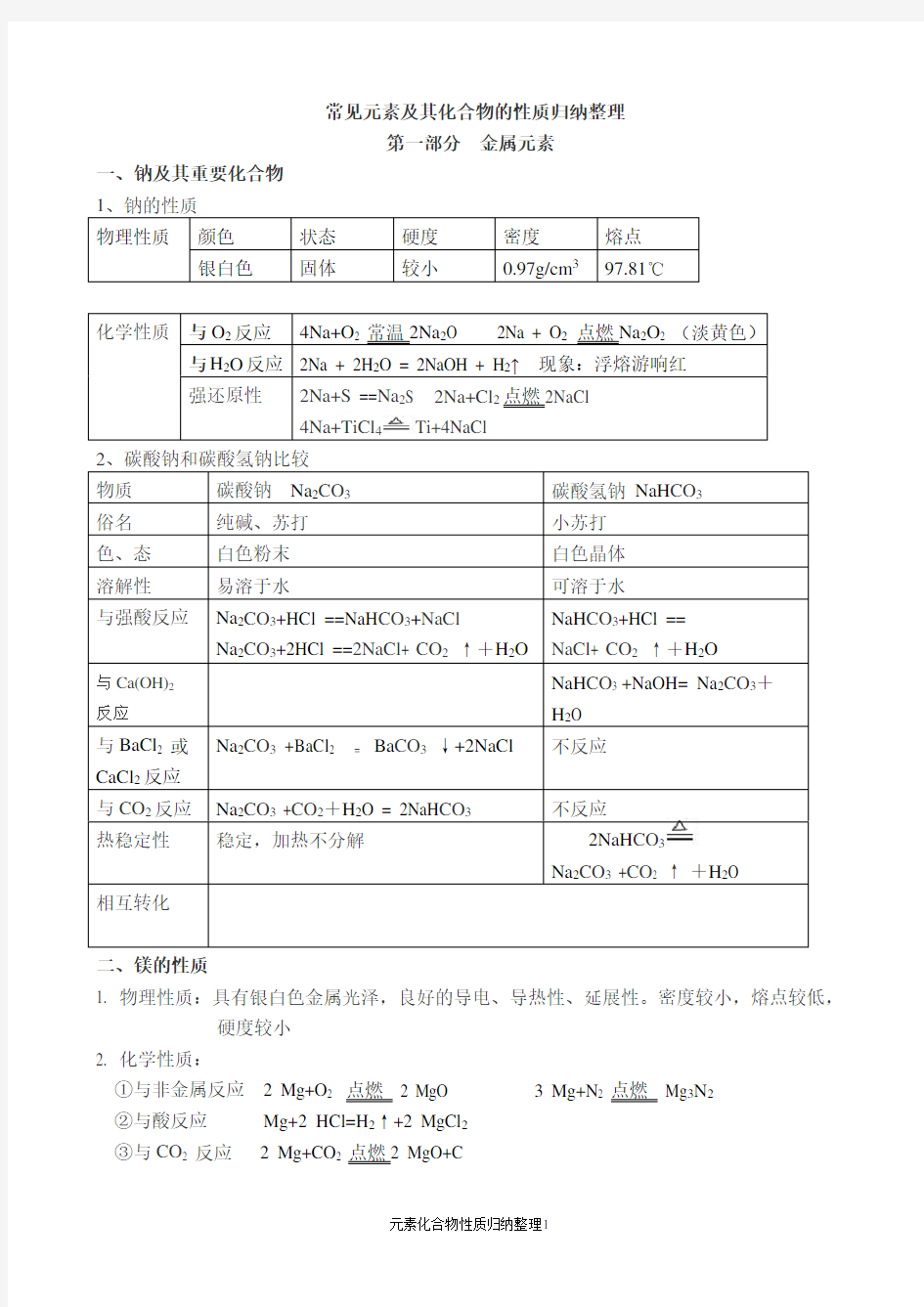

常见元素及其化合物的性质归纳整理
第一部分 金属元素
一、钠及其重要化合物
4
Ti+4NaCl
3
二、镁的性质
1. 物理性质:具有银白色金属光泽,良好的导电、导热性、延展性。密度较小,熔点较低,
硬度较小
2. 化学性质:
三、铝及其化合物的性质
1、铝的性质
①与非金属反应4Al+3O2 点燃 2 Al2O 3
②铝热反应2Al+Fe2O3 高温Al2O3+2Fe(焊接铁轨)
③与酸反应2Al+6HCl == 2AlCl3+3H2 ↑
④与碱反应2Al+2NaOH+2H2O == 2NaAlO2+3H2↑
2、Al2O3(两性氧化物)
①与酸反应Al2O3 +6HCl == 2AlCl3 + 3H2O
Al2O3 + 6H+ ==2Al3+ + 3H2O
②与碱溶液反应Al2O3 + 2NaOH === 2NaAlO2 + H2O
Al2O3+ 2OH- === 2AlO2-+ H2O
3、Al(OH)3(两性氢氧化物)
①与酸反应Al(OH)3 +3HCl ==AlCl3 + 3H2O
②与碱反应Al(OH)3 + NaOH ===NaAlO2 + 2H2O
③受热分解2Al(OH)3Al2O3+ 3H2O
-+ H2O Al(OH)3Al3+ + 3 OH-
④电离方程式H+ + AlO
4、Al(OH)3 制备
AlCl3 +3NH3·H2O=Al(OH)3 ↓+3NH4Cl
NaAlO2 +CO2+ 2H2O =Al(OH)3 ↓+ NaH CO3
5、从铝土矿提取铝(优化32页)
酸溶法
碱溶法
四、铁及其化合物的性质
1、铁的性质
物理性质:纯净的铁是光亮的银白色金属,密度大,熔沸点高,有延展性、导热性和导电性。
化学性质:
①与氧化性不太强的氧化剂反应,生成+2价化合物如S.I2.H+.Fe3+.Cu2+
Fe +CuSO4= Cu + FeSO4 Fe +S点燃FeS
Fe +2Fe3+ ===3 Fe2+
Fe +2HCl == FeCl2 + H2↑
②与强氧化剂反应,生成+3价化合物如Cl2.Br2.HNO3.浓H2SO4(△)等氧化为Fe3+。(若在溶液中反应,若铁过量还有可能生成Fe2+)
2Fe +3Cl2点燃2FeCl3
2、Fe3+ 、Fe2+相互转化
3、Fe3+ 、Fe2+的检验方法
五、铜的化学性质
①与非金属单质反应
2Cu+O2 2CuO Cu+Cl2CuCl22Cu + S Cu2S ②与强氧化性酸反应
3Cu+8HNO3 (稀) =3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
Cu + 2H2SO4(浓) CuSO4+SO2↑+2H2O
③与非氧化性酸不反应,如盐酸、稀硫酸
第二部分非金属元素
一、C、H、O元素
氧气的性质
1. 氧气的物理性质:无色无味的气体,不易溶于水,密度比空气略大。
2. 氧气的化学性质:支持燃烧,有助燃性。可供呼吸用,是常用的氧化剂。
3 Fe + 2 O2点燃Fe3O4
3. 制法①用双氧水制氧气:2 H2O2 MnO2 2 H2O+ O2↑
②加热高锰酸钾 2 KMnO4K2MnO4+MnO2+O2↑
③加热氯酸钾和二氧化锰的混合物 2 KClO3 2 KCl +3 O2↑
④过氧化钠与水的反应2Na2O2 +2H2O=4NaOH+O2↑
氢气的性质
1.氢气的物理性质:无色无味的气体,极难溶于水,密度最小的气体
2. 氢气的化学性质
①可燃性:2 H2+O2 2 H2O
②还原性:H2+CuO Cu+H2O
碳的性质
①可燃性:充分燃烧C +O2CO2
氧气不足 2 C+O2 2 CO
②还原性:C + 2 CuO 2 Cu +CO2↑
C +CO2 2 CO
二氧化碳的性质
1. 二氧化碳的物理性质:可溶于水,密度比空气的大。加压降温易变为固体“干冰”
2. 二氧化碳的化学性质
①跟水反应:二氧化碳通入水中生成碳酸CO2+H2O H2CO3
②用澄清的石灰水检验CO2 +Ca(OH)2=CaCO3↓+H2O
③通常情况下,CO2不支持燃烧,也不可以燃烧。
④ 2 Mg+CO2 点燃2 MgO+C
一氧化碳的性质
1. 一氧化碳的物理性质:无色、无味、比空气的密度略小、难溶于水
2. 一氧化碳的化学性质
①可燃性:2 CO+O22CO2
②还原性:CO +CuO Cu +CO2
3 CO +Fe2O3 2 Fe +3 CO2
③毒性:一氧化碳吸入肺里跟血液的血红蛋白结合,破坏了血红蛋白的输氧能力
二、氯、溴、碘
1、氯气的性质
物理性质:黄绿色、有毒、有刺激性气味,可溶于水
化学性质:
①与金属反应2Na+Cl2=2NaCl Cu+Cl2CuCl22Fe +3Cl2 == 2FeCl3
②与氢气反应H2+Cl2点燃2HCl
+H2O HCl+HClO
③与水反应Cl
④与碱反应2NaOH+Cl2=NaCl+NaClO+H2O
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O(漂白粉生产原理)
Ca(ClO)2+H2O+CO2=CaCO3↓+ 2HClO(漂白粉漂白原理)
2、HClO的性质
①弱酸性
②漂白性
③氧化性
3、 氯、溴、碘元素之间的化学反应
氯、溴、碘等元素在原子结构和性质方面具有一定的相似性,都具有氧化性。单质的氧化能力:Cl 2 >Br 2 > I 2 ,能发生以下反应
Cl 2 + 2 Br —= 2 Cl — + Br 2 Cl 2+ 2 I —= 2 Cl — + I 2 Br 2 + 2 I —= 2 Br — + I 2 4、溴单质、碘单质的物理性质比较
溴、碘不易溶于水,易溶于四氯化碳、酒精等有机溶剂。单质溴有毒,具有腐蚀性,易挥发,常用水封保存。碘易升华,应密闭保存 三、氮及其重要化合物 1、一氧化氮、二氧化氮
化学性质 2NO+O 2===2 NO 2
3 NO 2+ H 2O==== 2HNO 3+ NO
2、硝酸
物理性质:无色、具有挥发性的液体
化学性质:硝酸具有酸性、强氧化性,能和大多数金属及部分非金属在一定条件下反应。 ① 强氧化性
3Cu+8HNO 3 (稀) = 3Cu(NO 3)
2+2NO ↑+4H 2O Cu+4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O C+4HNO 3(浓)
CO 2↑+4NO 2↑+2H 2O
② 不稳定 4HNO 受热或见光 4NO 2↑+2H 2O + O 2↑ ③ 浓硝酸使Fe 、Al 金属发生钝化 3、氨NH 3
物理性质:无色、刺激性气味,极易溶于水
化学性质:与水反应 NH 3+H 2O = NH 3·H 2O NH 4++OH -
与酸反应 NH 3+HCl = NH 4Cl
与氧气反应 4NH 3+ 5O 2 催化剂 4NO +6H 2O (氨的催化氧化)
★氨气的制备 1.实验室制法
(1)加热固态铵盐和碱的混合物:一般加热NH 4Cl 和Ca(OH)2的混合物 ①实验装置:“固体+固体――→△
气体”
②反应原理:2NH 4Cl +Ca(OH)2=====△
2NH 3↑+CaCl 2+2H 2O 。 (2)浓氨水中加固态碱性物质(如固体碱石灰、氢氧化钠,氧化钙) 2、收集:只能用向下排空气法。
3、干燥方法:用碱石灰(NaOH 和CaO 固体的混合物)。
4、检验方法:
a.用湿润的红色石蕊试纸置于试管口,试纸变蓝色;
b.将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生。
⑤尾气处理:一般在管口塞一团用水或稀H 2SO 4浸湿的棉花球,可避免污染空气。
4、铵盐
物理性质:白色、易溶于水的晶体
化学性质:①热稳定性
NH 4HCO 3 NH 3↑+H 2O+ CO 2↑ NH 4Cl
NH 3↑+HCl ↑
②与碱反应放出氨气 2NH 4Cl +Ca(OH)2
2 NH 3↑+CaCl 2+2H 2O (实验室制氨气)
5、铵根离子检验:加碱共热,生成的气体能使湿润的红色石蕊试纸变蓝,则说明原溶液中存
在铵根离子。
四、硫及其重要化合物
2、二氧化硫的化学性质
①酸性氧化物 SO 2+H 2O H 2SO 3 SO 2 + 2 KOH==K 2SO 3+H 2O
②氧化性SO2+2H2S =3S↓+ 2H2O
③还原性,能与溴水、酸性高锰酸钾反应使之褪色。
2SO2 + O2 2SO3 SO2+ Cl2+2H2O==H2SO4 +HCl
④漂白性:能与某些有色物质反应,生成不稳定的无色物质。
检验:能使品红溶液褪色,加热后又恢复红色
3、硫酸
物理性质:无色油状液体,不易挥发,强腐蚀性,密度较大
化学性质:硫酸是强酸,具有酸的通性。浓硫酸有吸水性、脱水性和强氧化性,能和多数金属、部分非金属在一定的条件下发生反应
①Cu + 2H2SO4(浓) CuSO4+SO2↑+2H2O
②C+ 2H2SO4(浓) CO2 ↑+2SO2 ↑+2H2O
③浓硫酸使铁、铝金属钝化
五、硅及其重要化合物
SiO2+ 2NaOH =Na2SiO3+ H2O
SiO2+ CaO 高温CaSiO3
SiO2+ 2C 高温Si+2CO↑
Na2SiO3+ H2O +CO2 =H2SiO3↓+ Na2CO3
第三部分实验
(1)常见气体的检验
常见气体检验方法
氢气纯净的氢气在空气中燃烧呈淡蓝色火焰,混合空气点燃有爆鸣声,生成物只有水。不是只有氢气才产生爆鸣声;能点燃的气体不一定是氢气
氧气可使带火星的木条复燃
氯气黄绿色,能使湿润的碘化钾淀粉试纸变蓝(O3、Br2也能使湿润的碘化钾淀粉试纸变蓝)
氯化氢无色有刺激性气味的气体。在潮湿的空气中形成白雾,能使湿润的蓝色石蕊试纸变红;用蘸有浓氨水的玻璃棒靠近时冒白烟;将气体通入AgNO3溶液时有白色沉淀生成。
二氧化硫无色有刺激性气味的气体。能使品红溶液褪色,加热后又显红色。
氨气无色有刺激性气味,能使湿润的红色石蕊试纸变蓝,用蘸有浓盐酸的玻璃棒靠近时能生成白烟。
几种气体制备的反应原理
1、O22KClO3
O2 2H2O+O2↑2KMnO4K2MnO4+MnO2+O2↑
2H
2、NH32NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
NH3·H2O+CaO==NH3↑+ Ca(OH)2
3、H2Zn+H2SO4(稀)=ZnSO4+H2↑
4、CO2CaCO3+2HCl=CaCl2+CO2↑+H2O
5、SO2Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
6、NO2Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
7、NO 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
8、Cl2MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
几种重要离子的检验
(1)Na+、K+:用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。
(2)Al3+:能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。
(3)NH4+:铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。
(4)Fe2+:能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。
或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。2Fe2++Cl2=2Fe3++2Cl-
(5)Fe3+:能与KSCN溶液反应,变成血红色Fe(SCN)3溶液,能与NaOH溶液反应,生成红褐色Fe(OH)3沉淀。
(6)Cl-:加入硝酸酸化的与硝酸银溶液,若生成白色沉淀,则可证明
(7)SO42-:加入盐酸酸化的氯化钡溶液,若生成白色沉淀,则可证明
几种重要阳离子的检验
(l)H+:能使紫色石蕊试液或橙色的甲基橙试液变为红色。
(2)Na+、K+:用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。
(3)Al3+:能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。
(4)Ag+:能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+。
(5)NH4+:铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。
(6)Fe2+:能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。2Fe2++Cl2=2Fe3++2Cl-
(7)Fe3+:能与KSCN溶液反应,变成血红色Fe(SCN)3溶液,能与NaOH溶液反应,
生成红褐色Fe(OH)3沉淀。
3、几种重要的阴离子的检验
(1)OH-:能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。
(2)Cl-:能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+。
(3)SO42-:能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。
(4)SO32-:浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。
(5)CO32-:能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。
第三部分电化学
一、钢铁的析氢腐蚀和吸氧腐蚀比较
二、燃料电池
美国“阿波罗”宇宙飞船中使用的氢氧燃料电池。其
其反应为:2H2+O2====2H2O,则负极通入的是
__________,电极反应式为:
___________________,
正极通入的是________________。
电极反应式为:______________________。
(2)如把KOH改为稀H2SO4做电解质,则电极反应式为:
负极_______________,
正极_______________________。
(3)如把H2改为CH4,KOH做导电物质,则电极反应式为:
负极______________________________,
正极_________________________
三、
①电解饱和食盐水
阴极
阳极
总方程式
②电解硫酸铜溶液
阴极
阳极
总方程式
第四部分实验(1)常见气体的检验
几种气体制备的反应原理
1、O 2 2KClO 3
2H 2O 22H 2O+O 2↑
2KMnO 4
K 2MnO 4+MnO 2+O 2↑
2、NH 3 2NH 4Cl+Ca(OH)2
CaCl 2+2NH 3↑+2H 2O
NH 3·H 2O+CaO==NH 3↑+ Ca(OH)2
3、H 2 Zn+H 2SO 4(稀)=ZnSO 4+H 2↑
4、CO 2 CaCO 3+2HCl=CaCl 2+CO 2↑+H 2O
5、SO 2 Na 2SO 4+H 2SO 4(浓)=Na 2SO 4+SO 2↑+H 2O
6、NO 2 Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O
7、NO 3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO↑+4H 2O
8、Cl 2 MnO 2+4HCl(浓)MnCl 2+Cl 2↑+2H 2O
几种重要阳离子的检验
(l )H +:能使紫色石蕊试液或橙色的甲基橙试液变为红色。
(2)Na +、K +:用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。 (3)Al 3+:能与适量的NaOH 溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH 溶液。
(4)Ag +:能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl 沉淀,不溶于稀 HNO 3,但溶于氨水,生成[Ag(NH 3)2]+。
(5)NH 4+:铵盐(或浓溶液)与NaOH 浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH 3气体。
(6)Fe 2+:能与少量NaOH 溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN 溶液,不显红色,加入少量新制的氯水后,立即显红色。2Fe 2++Cl 2=2Fe 3++2Cl -
(7)Fe 3+:能与 KSCN 溶液反应,变成血红色 Fe(SCN)3溶液,能与 NaOH 溶液反应,
生成红褐色Fe(OH)3沉淀。
3、几种重要的阴离子的检验
(1)OH-:能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。
(2)Cl-:能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+。
(3)SO42-:能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。
(4)SO32-:浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。
(5)CO32-:能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。
元素及其化合物(选择题) 6.(2014?长葛市三模)下列各组物质中,物质之间通过一步反应就能实现图示变化的是()物质组编号 a b c d ①NO NO2N2HNO3 ②Na2CO3NaOH Na2O2NaHCO3 ③FeCl3FeCl2Fe CuCl2 ④Al2O3NaAlO2Al Al(OH)3 A.①②③B.②③④C.②④D.③④ 答案:C 3.(2014?抚州模拟)下列说法正确的是 A.根据反应5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4?7H2O)是否变质 B.根据反应H3PO3+2NaOH(足量)═Na2HPO3+2H2O可知:H3PO3属于三元酸 C.根据反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性 D.根据反应CuSO4+H2S═CuS↓+H2SO4可知:H2S的酸性比H2SO4强 答案:C 4.(2014?抚州模拟)已知X、M都是中学教材常见元素,下列对甲、乙两个离子反应通式的推断中,(甲)XO3n﹣+X n﹣+H+→X单质+H2O(未配平);(乙)M m++mOH﹣═M(OH)m↓,其中正确的是 ①若n=1,则XO3n﹣中X元素为+5价,X位于周期表第ⅤA族 ②若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同 ③若m=2,则在空气中蒸干MSO4溶液并灼烧一定能得到MSO4 ④若n=2,则X最高价氧化物的水化物可能与它的氢化物反应 ⑤若m=3,则MCl3与足量的碱溶液反应一定生成M(OH)m ⑥若n=2、m=3,则X n﹣和M m+发生的反应是水解反应 A.①③B.②④C.①②③④D.其它组合 答案:B 7.(2014?九江三模)某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构.例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中的电离过程为: 下列判断正确的是 A.凡是酸或碱对水的电离都是抑制的 B.硼酸是三元酸 C.硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH﹣=[B(OH)4]﹣ D.硼酸是两性氢氧化物 答案:C
专练十三常见元素化合物的性质与应用 1.元素及其化合物丰富了物质世界,下列说法正确的是()。A.铜在冷的浓硫酸中会钝化,所以把铜放入冷的浓硫酸中无明显现象B.NaOH溶液和AlCl3溶液相互滴加的现象不同 C.金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 D.Al、Fe、Cu三者对应的氧化物均为碱性氧化物 解析铜与冷的浓H2SO4不反应,并不是铜的钝化,A项错误;NaOH溶液滴入AlCl3溶液中,先产生白色沉淀后沉淀溶解,AlCl3溶液滴入NaOH溶液中,开始没有沉淀,到后来才产生白色沉淀,B项正确;氢气还原氧化铜就是非金属置换金属,C项错误;Al对应的氧化物为两性氧化物,D项错误。 答案 B 2.(2013·启东中学模拟)下列有关物质的性质与应用相对应的是()。A.碳具有强还原性,常用于冶炼钠、镁等金属 B.铝的金属性较强,可用做飞机、火箭的结构材料 C.碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 D.浓硫酸具有强氧化性,可用于与亚硫酸钠反应制取二氧化硫 解析碳不能冶炼钠、镁,一般用电解熔融的NaCl制备钠,电解熔融的MgCl2制备镁,A错误;铝合金因其质轻、强度大而作为制造飞机、火箭的结构材料,B错误;浓硫酸与亚硫酸钠制备SO2利用了硫酸的酸性比亚硫酸强,即强酸制弱酸的原理,同时利用了浓硫酸的难挥发性,并不是利用浓硫酸的强氧化性,D错误。 答案 C 3.下列有关物质的性质与应用不相对应的是()。
A.氢氟酸具有弱酸性,可用于雕刻玻璃 B.MgO、Al2O3熔点高,可用于制作耐火材料 C.ClO2具有强氧化性,可用于自来水的杀菌消毒 D.油脂在碱性条件下易水解,可用于制作肥皂 解析氢氟酸具有弱酸性,但用于雕刻玻璃的原理是4HF+SiO2===SiF4+2H2O,与其弱酸性无关,A错误;MgO、Al2O3熔点高,可用于制作耐火材料,B正确;ClO2具有强氧化性,可用于自来水的杀菌消毒,C正确;油脂在碱性条件下的水解反应称为皂化反应,该反应可用于制作肥皂,D正确。 答案 A 4.下列现象或事实可用同一原理解释的是()。A.浓硫酸和浓盐酸长期暴露在空气中浓度降低 B.SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去 C.漂白粉和水玻璃长期暴露在空气中变质 D.亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质 解析A中浓硫酸变稀是因为吸水,浓盐酸变稀是因为挥发;B中紫色褪去都是因为发生了氧化还原反应;C中漂白粉和水玻璃长期暴露在空气中均会变质,前者是与空气中的水和二氧化碳发生反应,生成的次氯酸又分解,发生了氧化还原反应,而后者只发生了复分解反应;D中前者生成硫酸钠是因为发生了氧化还原反应,后者得到的是氢氧化铝,是因为Al3+水解生成Al(OH)3和HCl,且HCl易挥发,所以答案选B。 答案 B 5.(2013·南师大附中模拟)下列有关物质性质或应用的说法,正确的是 ()。A.制水泥和玻璃都用石灰石做原料 B.利用Al2O3制作的坩埚,可用于熔融烧碱 C.Si可用做太阳能电池和光导纤维的材料 D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 解析制水泥用黏土和石灰石为原料,制玻璃用石灰石、纯碱和石英,A正确;Al2O3是两性氧化物,与烧碱能够反应,只能用铁坩埚熔融烧碱,B错误;光导纤维的材料为SiO2,C错误;根据原电池原理,铁作为正极才能减缓腐蚀,
1.单质硫的颜色_______,______溶于水,______ 于酒精,易溶于_______________。 2.SO2漂白的原理为________________________________________________________ 。 3.CO2(SO2)除杂试剂为_____________________________________________________ 4.实验室制SO2的化学方程式__________________________________________________。 5.设计实验证明SO2气体中含有CO2:___________________________________________。 6.写出一个体现SO2具有氧化性的化学方程式_____________________________________。 7.写出两个体现CO2具有氧化性的方程式_________________________________________ ___________________________________________。 8. SO2通入FeCl3溶液的现象为_____________________________,写出反应的离子方程式 __________________________________________。 9. SO2能使酸性高锰酸钾溶液褪色,写出反应的离子方程式___________________________ ___________________________________________。 10. SO2催化氧化的化学方程式___________________________________________________。 11. Cu与S加热条件下反应方程式:_____________________________________________。 12. 写出两种鉴别CO2与SO2的方法_______________________、____________________。 13. 检验SO2的试剂为_________________________________________; 检验水的试剂为______________________;检验CO2的试剂为_____________________。 14. 检验Clˉ的试剂是_________________________;检验SO42-的试剂是_______________ _____________________;检验Cl2的试剂是_____________________________________。 15. SO2通入BaCl2溶液中的现象为_______________,SO2通入Ba(NO3)2溶液中的现象为 __________________,SO2通入FeCl3和BaCl2溶液中的现象为_______________________。 16. SO2和Cl21:1混合通入品红溶液中,现象为_____________,反应的离子方程式为 __________________________________________________。 17. SO2通入紫色石蕊试液中的现象是_______________,体现了SO2的________性。 18. Cl2通入紫色石蕊试液中的现象是______________________________________________。 19. SO2使溴水褪色的化学方程式为_______________________________________________。 20. Na2SO3既有氧化性又有还原性,证明Na2SO3具有氧化性的试剂是____________和 ____________,反应方程式是_________________________________________证明Na2SO3具有还原性的试剂是_________,反应的离子方程式为_____________________________。 21. 常见离子的还原性由大到小的顺序为_________________________________(写六个)。 22. SO2使碘水褪色,说明SO2具有__________________性。 23. 氢气在氯气__________燃烧,发出_________色火焰,集气瓶口有__________产生。 24. 铜丝在氯气中燃烧的现象为__________________________________________。 25. 氯气的水溶液叫_______________,Cl2___________溶于水,溶于水的Cl2约有________ 与水反应,化学方程式为___________________________________________。 26. 新制氯水的成分有_____________________________,颜色为___________________, 溶质为_____________,久置氯水的成分为_______________________。 27. 家用消毒液的制备原理:___________________________________________,其有效成分 为__________________。 28. 工业漂白粉的制备原理_____________________________________________,其主要成分 为______________________,有效成分为________________________。 29. 漂白粉久置在空气中失效的原理为____________________________________________。 30. 增强漂白粉和家用消毒液的漂白消毒作用的方法是______________________________。 31. Cl2的尾气处理原理:_______________________________________________________。 32. 除去Cl2中的HCl的试剂是________________,验满Cl2的方法为__________________。
专题三元素及其化合物 建知识网络明内在联系 提炼1 常见物质的特殊颜色 1.有色气体:NO 2(红棕色)、Cl 2 (黄绿色);无色、有刺激性气味的气体:SO 2 、NH 3 、HCl。 2.溶液中的有色物质:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)、MnO- 4[紫(红)色]。Br 2 在水中显黄(橙) 色,在有机溶剂中显橙(红)色;I 2 在水中显黄(褐)色,在有机溶剂中显紫(红)色。 3.有色固体:(淡)黄(棕)色固体:Na 2O 2 、S、FeS 2 、FeCl 3 ;黑色固体:MnO 2 、C、CuO、FeO、Fe 3 O 4 ;紫(黑) 色固体:KMnO 4、I 2 ;(紫)红色固体:Cu。 4.有色沉淀:(1)白色沉淀:H 2SiO 3 、AgCl、BaSO 4 (不溶于酸)、BaSO 3 、Mg(OH) 2 、Al(OH) 3 、BaCO 3 、CaCO 3 、
CaSO 4、MgCO 3等;(2)红褐色沉淀:Fe(OH)3;(3)蓝色沉淀:Cu(OH)2;(4)黑(褐)色沉淀:CuS 、FeS ;(5)砖红色沉淀:Cu 2O 。 提炼2 特征反应1.产生气体 (1)与酸反应产生气体 金属+HCl(或稀H 2SO 4)―→H 2↑; 金属+H 2SO 4(浓)―→SO 2↑; 金属+HNO 3(稀)―→NO↑; 金属+HNO 3(浓)―→NO 2↑; C +2H 2SO 4(浓)=====△ CO 2↑+2SO 2↑+2H 2O ; C +4HNO 3(浓)=====△ CO 2↑+4NO 2↑+2H 2O ; CO 2-3(HCO -3)+H +― →CO 2↑+H 2O ; S 2-(HS -)+H +―→H 2S↑; SO 2-3(HSO -3)+H +― →SO 2↑+H 2O 。 (2)与碱反应产生气体 2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑; NH +4 +OH - =====△ NH 3↑+H 2O 。 (3)与水反应产生气体 2Na +2H 2O===2NaOH +H 2↑; Mg +2H 2O=====△ Mg(OH)2+H 2↑; 3Fe +4H 2O(g)=====高温 Fe 3O 4+4H 2; C +H 2O(g)=====高温 CO +H 2; 2Na 2O 2+2H 2O===4NaOH +O 2↑; CaC 2+2H 2O===Ca(OH)2+C 2H 2↑。 2.两溶液混合产生沉淀和气体 (1)Ba(OH)2与(NH 4)2SO 4溶液:Ba 2+ +2OH - +2NH +4 +SO 2-4 =====△ BaSO 4↓+2NH 3↑+2H 2O 。 (2)硫代硫酸盐与强酸反应:S 2O 2-3+2H + ===S↓+SO 2↑+H 2O 。 (3)互相促进的水解反应:Al 3+与CO 2-3(HCO -3)、S 2-(HS -)、Fe 3+与CO 2-3(HCO -3)。
专题一元素及其化合物 1.重要无机物的特性 (1)常温下呈液态的非金属单质是; (2)能与二氧化硅反应而能雕刻玻璃的是; (3)能与水剧烈反应生成非金属单质是; (4)能与NaOH溶液反应放出氢气的是; (5)遇淀粉变蓝色的是;(6)具有磁性的是。…… 2.重要无机物的工业制法 (1)漂粉精: (2)硫酸的制法(接触法): (3)硝酸的制法(氨氧化法): (4)氯气的制备: (5)钠、镁、铝的制备: (6)工业制玻璃: (7)煅烧石灰石: (8)工业制粗硅: (9)工业制水煤气: (10)工业制纯碱(侯德榜法): 3.常见物质燃烧时的火焰颜色 (1)苍白色——(2)蓝色—— (3)淡蓝色(4)黄色—— (5)紫色(透过蓝色钴玻璃) 4.重要物质的用途 (1)呼吸面具和潜水艇的供氧剂; (2) 用于自来水的消毒杀菌; (3) 用于制造发酵粉; (4) 在医疗上作造影剂; (5) 用作感光材料;(6) 用于焊接钢轨、冶炼难熔金属; (7) 用于腐蚀印刷电路板。 5.物质结构方面 熟悉常见的分子或单质、化合物的结构(水、氨气、二氧化碳、金刚石、二氧化硅的结构
特点)。 (1)具有正四面体结构的有甲烷、白磷、NH+4等; (2)不含金属元素的离子化合物为铵盐; (3)组成为1∶1型的化合物可能为H2O2、C2H2、Na2O2、C6H6等。6.物质的特有颜色 常见的有颜色的物质 7.特殊反应条件 (1)高温:铝热反应,制水煤气,制粗硅,水蒸气与Fe反应等。 (2)高温高压、催化剂 N2+3H2 (3)加热、催化剂 2KClO3 2SO2+O2 4NH3+5O2 (4)放电 3O2 N2+O2 8.三角关系
第五章元素及化合物的性质 实验十九碱金属和碱土金属 一、目的要求 1. 比较碱金属、碱土金属的活泼性。 2. 比较碱土金属氢氧化物及其盐类溶解度。 3. 了解碱金属和碱土金属离子的定性鉴定方法。 二、仪器和药品 仪器:离心机,试管,烧杯,坩埚,漏斗,镊子,钴玻璃片 药品:HCl(2 mol·L-1,6 mol·L-1),HNO3(6 mol·L-1),H2SO4(2 mol·L-1),HAc(2 mol·L-1),NaOH(2 mol·L-1),NH4Cl(2 mol·L-1),Na2CO3(0.1 mol·L-1),LiCl(0.1 mol·L-1),NaF(0.1 mol·L-1),Na2CO3(0.1 mol·L-1),Na2HPO4(0.1 mol·L-1),MgCl2(0.1 mol·L-1),CaCl2(0.1 mol·L-1),BaCl2(0.1 mol·L-1),Na2SO4(0.5 mol·L-1),CaSO4(饱和),(NH4)2C2O4(饱和),(NH4)2CO3(0.5 mol·L-1),K2CrO4(0.1 mol·L-1),K[Sb(OH)6] (饱和),NaHC4H4O6(饱和),NH3·H2O-NH4Cl缓冲液(浓度各为1 mol·L-1),HAc-NH4Ac缓冲液(浓度各为1 mol·L-1),Na+,K+,Ca2+,Sr2+,Ba2+试液(10 g·L-1),pH试纸,Na(s),K(s),Mg(s),Ca(s),铂丝 三、实验内容 1. 碱金属、碱土金属活泼性的比较 1) 金属钠和氧的反应用镊子夹取一小块(绿豆大小)金属钠,用滤纸吸干其表面的煤油,切去表面氧化膜,放入干燥的坩埚中加热。当钠刚开始燃烧时,停止加热,观察反应现象及产物的颜色和状态。 2) 观察镁条在空气中燃烧取一小段镁条,用砂纸除去表面的氧化膜。点燃,观察燃烧情况和所得产物。 3) 钠、钾、镁、钙与水的反应分别取一小块金属钠和金属钾,用滤纸吸干其表面煤油,放入两个盛有1/4体积水的250 mL烧杯中,并用合适大小的漏斗盖好,观察反应情况。检验反应后水溶液的酸碱性。(安全提示:金属钾在空气中易自燃,与水反应剧烈。) 取一段擦干净的镁条,投入盛有蒸馏水的试管中,观察反应情况。水浴加热,反应是否明显?检验反应后水溶液的酸碱性。 取一小块金属钙置于试管中,加入少量水,观察现象,检验水溶液的酸碱性。 2. 碱土金属氢氧化物溶解性的比较 在3支试管中分别加入1 mL 0.1mol·L-1MgCl2,CaCl2和BaCl2溶液,然后加入等体积新配制的2 mol·L-1NaOH溶液,观察沉淀的生成。根据沉淀的多少,比较这三种氢氧化物的溶解性。
元素及其化合物 1、元素化合物知识包括金属和非金属两部分,是高中化学的基础知识之一。知识特点是作为化学基本概念、原理、实验和计算的载体,其信息量大,反应复杂,常作为综合试题的知识背景或突破思维的解题题眼。 2、注意处理好两个关系,必须先处理好元素化合物知识的内部关系,方法是:“抓重点,理关系,用规律,全考虑”。 ①抓重点:以每族典型元素为代表,以化学性质为抓手,依次学习其存在、制法、用途、检验等“一条龙”知识,做到牵一发而动全身 ②理关系:依据知识内在联系,按单质→氧化物→氧化物的水化物→盐的顺序,将零碎的知识编织成网络,建立起完整的知识结构,做到滴水不漏 ③用规律:用好化学反应特有的规律,如以强置弱等规律,弄清物质间相互反应。 ④全考虑:将元素化合物作为一个整体、一个系统理解,从而达到解综合试题时能将所需的元素化合物知识信手拈来。 另一方面是处理好元素化合物知识与本学科理论、计算或跨学科知识间的外部关系,采取的方法是“分析与综合、抽象与具体”。 ①分析:将综合试题拆分思考。 ②综合:将分散的“点”衔接到已有的元素化合物知识“块”中。 ③抽象:在分析综合基础上,提取相关信息。 ④具体:将提取出的信息具体化,衔接到综合试题中,从而完整解题。 (一)元素非金属性的强弱规律 ⑴常见非金属元素的非金属性由强到弱的顺序如下:F、O、Cl、N、Br、I、S、P、C、Si、H。 ⑵元素非金属性与非金属单质活泼性的区别: 元素的非金属性是元素的原子吸引电子的能力,影响其强弱的结构因素有:①原子半径:原子半径越小,吸引电子能力越强;②核电荷数:核电荷数越大,吸引电子能力越强;③最外层电子数:同周期元素,最外层电子越多,吸引电子能力越强。但由于某些非金属单质是双原子分子,原子是以强列的共价键相结合(如N N等),当参加化学反应时,必须消耗很大的能量才能形成原子,表现为单质的稳定性。这种现象不一定说明这种元素的非金属性弱。 ⑶非金属性强弱的判断依据及其应用 元素的非金属性的本质是元素的原子吸引电子的能力。这种能力的大小取决于原子半径、核
高一化学金属及其化合物知识点总结 1.元素的存在形式有两种:游离态和化合态。 (1)钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。 (2)铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。 2.金属单质的用途: (1)利用钠元素的特征焰色(黄色)制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。 (2)镁条燃烧发出耀眼的白光,用来做照明弹。 (3)利用铝的良好导电性,做导线。利用铝块和铝粉的颜色都是银白色,铝粉制成银粉(白色涂料)。 3.金属化合物的用途: (1)过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。 (2)氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。 (3)明矾做净水剂。 4.金属的分类: (1)根据冶金工业标准分类:铁(铬、锰)为黑色金属,其余金属(钠镁铝等)为有色金属。 (2)根据密度分类:密度大于4.5g/cm3的金属是重金属:如铁、铜、铅、钡,密度小于4.5g/cm3的金属是轻金属:如钠、镁、铝。 5.氧化物的分类:二元化合物,其中一种元素是氧元素,并且氧元素呈负二价的化合物是氧化物。 (1)氧化物(根据氧化物中非氧元素的种类)分为金属氧化物和非金属氧化物。 (2)金属氧化物分为酸性氧化物、碱性氧化物、两性氧化物。 (3)非金属氧化物分为酸性氧化物、不成盐氧化物。
常见元素及其化合物的性质归纳整理 第一部分金属元素 一、钠及其重要化合物 1、钠的性质 物理性质颜色状态硬度密度熔点银白色固体较小0.97g/cm397.81℃ 化学性质与O 2反应4Na+O 2 常温2Na 2 O 2Na + O 2 点燃Na 2 O 2 (淡黄色) 与H 2O反应2Na + 2H 2 O = 2NaOH + H 2 ↑现象:浮熔游响红 强还原性2Na+S ==Na 2S 2Na+Cl 2 点燃2NaCl 4Na+TiCl 4 Ti+4NaCl 物质碳酸钠Na 2CO 3 碳酸氢钠NaH CO 3 俗名纯碱、打小打色、态白色粉末白色晶体溶解性易溶于水可溶于水 与强酸反应Na 2CO 3 +HCl ==NaH CO 3 +NaCl Na 2CO 3 +2HCl ==2NaCl+ CO 2 ↑+H 2 O NaH CO 3 +HCl == NaCl+ CO 2 ↑+H 2 O 与Ca(OH)2反应NaH CO 3 +NaOH= Na 2 CO 3 +H 2 O 与BaCl 2 或 CaCl 2反应 Na 2 CO 3 +BaCl 2 = Ba CO 3 ↓+2NaCl不反应 与CO 2反应Na 2 CO 3 +CO 2 +H 2 O = 2NaH CO 3 不反应 热稳定性稳定,加热不分解2NaH CO 3 Na 2CO 3 +CO 2 ↑+H 2 O 相互转化 二、镁的性质 1. 物理性质:具有银白色金属光泽,良好的导电、导热性、延展性。密度较小,熔点较低, 硬度较小 2. 化学性质: ①与非金属反应2Mg+O 2点燃2MgO 3 Mg+N 2 点燃Mg 3 N 2 ②与酸反应Mg+2HCl=H 2↑+2MgCl 2 ③与CO 2反应2Mg+CO 2 点燃2MgO+C
组成细胞的元素 1.细胞中常见的化学元素有20多种。根据含量的多少,分为大量元素与微量元素。 2.大量元素有_等。 3.微量元素有_等。 4.构成细胞的元素中,最基本的元素就是;其中4种元素含量最多。 鲜重状态下,4种基本元素的含量就是O > C > H > N ; 干重状态下,4种基本元素的含量就是C > O > N > H。 组成细胞的化合物 1.细胞中的化合物包括:________与________。 细胞中的无机物主要包括____________与____________,_________就是细胞中含量最多的化合物,______________大多数以___________的形式存在。 2.水在细胞中以_____________与___________两种形式存在,其中_____________就是细胞 结构的重要组成成分,_____________占细胞中水的绝大部分,以形式存在,可以自由流动。 3.细胞中无机盐的主要功能包括维持___________________________________________, 维持____________________________________________________。 细胞中的水 自由水/结合水的比值对生命活动的影响 (1)当自由水/结合水比值高(即自由水含量高时),代谢强度高,抗寒、抗旱性等抗逆性差。如种子萌发时,先要吸收大量的水分,以增加自由水的含量,并加快代谢速度。 (2)当自由水/结合水比值低(即结合水含量高时),抗寒、抗旱性强,代谢强度差。如冬季,植物吸水减少时,细胞内结合水相对含量升高,由于结合水不易结冰与蒸腾,从而使植被抗寒性加强。 自由水与结合水的存在及其功能的验证 (1)鲜种子放在阳光下暴晒,重量减轻―→自由水散失,代谢减弱。 (2)干种子用水浸泡后仍能萌发―→失去自由水的种子仍保持其生理活性。 (3)干种子放在试管中,用酒精灯加热,试管壁上有水珠―→失去结合水。种子浸泡后不萌发―→失去结合水的细胞丧失生理活性。 [特别提醒] 一般情况下,温度略升高,自由水含量将升高,反之则自由水含量降低。相同条件下,自由水含量高的细胞,代谢旺盛。结合水含量高的细胞代谢较弱。 环境恶化——自由水↓,结合水↑。 细胞衰老——自由水↓,结合水↑。生命活动增强——自由水↑,结合水↓。 细胞中的无机物 1、含量:无机盐在生物体中含量很少,仅占细胞鲜重的1%-1、5%。 2、存在形式:大部分以离子形式存在。少数无机盐与其她化合物结合,如Mg2+就是叶绿素的成分
★碳族元素基础知识点 一、知识网络 1.碳及其化合物的知识网络 2.硅及其化合物的知识网络 二、基础知识 1.碳族元素 ①特征:最外层电子数为4,既不容易失去电子,又不容易得到电子,易形成共价键。 碳族元素形成的单质在同周期中硬度最大,熔沸点最高(如金刚石、晶体硅)。 C CO 2 CaCO 3 CaC 2 C 2H 2 CO 有机物 NH 4HCO 3 CH 4 H 2CO 3 Na 2CO 3 NaHCO 3 O 2 SiC 、CCl 4 不完全燃烧 O 2(不足) O 2 ( 不足 ) ①O 2 ②CuO 炽 热的碳 NH 3·H 2O O 2 ( 点 燃 ) △ H 2O CaO △ Si 、Cl 2 (△) Mg (点燃) ①O 2 (点) ②CuO (△) C 、CO Na 2O 2 NaOH H 2O NaOH H + C a (O H )2 ①高温②H + Ca 2+ CO 2 、H 2O △ C a (O H )2 CO 2 (水) ①OH ― ②加热 Na 2SiO 3 CO 2,H 2O NaOH H 2SiO 3 SiH 4 Si SiO 2 CaSiO 3 SiF 4 H 4SiO 4 SiC SiCl 4 O 2 (自燃) H 2 ①O 2(△) ②FeO (高温) F 2 HF Cl 2 (高温) H 2 (高温) C( 高温) C(高温)足量 Na 2CO 3 ( 高 温 ) NaOH( 溶液) ①CaO(△) ②CaCO 3 (△) Ca 2+ -H 2O C(适量)
几种同素异形体:碳:金刚石、石墨、C 60、C 70等;硅:晶体硅,无定形硅 2.碳 在常温下碳很稳定,只在高温下能发生反应,通常表现为还原性。 ① 燃烧反应 ② 与某些氧化物的反应:Cu CO CuO C CO CO C 22; 222+↑?→?+?? →?+? 高温 O H CO O H C 22+??→?+高温(CO 、H 2的混合气体叫水煤气); ↑+??→?+2CO Si SiO 2C 2电炉 ③ 与氧化性酸反应: C +2H 2SO 4(浓)?→?? CO 2↑+2SO 2↑+2H 2O ; C +4HNO 3(浓)?→?? CO 2↑+4NO 2↑+2H 2O 3.CO :不溶于水,有毒(CO 和血红蛋白结合,使血红蛋白无法和O 2结合,而使细胞缺氧引起 中毒),但由于CO 无色无味因此具有更大的危险性。 ①可燃性 ②还原性:CO+CuO ?→? ? CO 2+Cu ,CO+H 2O(g)CO 2+H 2O 4.CO 2:直线型(O =C =O )非极性分子,无色能溶于水,密度大于空气,可倾倒,易液化。 固态CO 2俗称干冰,能升华,常用于人工降雨。 实验室制法:CaCO 3+2HCl =CaCl 2+CO 2↑+H 2O 。 5.碳酸盐 ①溶解性:Ca(HCO 3)2>CaCO 3;Na 2CO 3>NaHCO 3。 ②热稳定性:Na 2CO 3>CaCO 3;碱金属正盐>碱金属酸式盐: Na 2CO 3>NaHCO 3。 ③相互转化:碳酸正盐碳酸酸式盐(除杂用) 6.硅 ① 硅在地壳中只有化合态,没有游离态。其含量在地壳中居第二,仅次于氧,是构成矿物和岩石的主要成分。 ② 晶体硅是灰黑色,有金属光泽,硬而脆的固体,是半导体,具有较高的硬度和熔点。 ③ 硅的化学性质不活泼,常温下,只能与氟气、氢氟酸及强碱溶液反应: Si+2F 2→SiF 4、 Si+4HF →SiF 4+2H 2↑、Si+2NaOH+H 2O →Na 2SiO 3+2H 2↑; 在加热条件下,能与氧气、氯气等少数非金属单质化合:Si +O 2?→? ? SiO 2。 7.SiO 2 ①SiO 2为原子晶体,是一种坚硬难熔的固体,硬度、熔点都很高。 ② 二氧化硅的化学性质很稳定,不能跟酸(氢氟酸除外)发生反应。由于它是一种酸性氧化物, 所以能跟碱性氧化物或强碱反应 SiO 2+CaO ??→ ?高温 CaSiO 3 SiO 2+2NaOH →Na 2SiO 3+H 2O(碱溶液不能在使用磨口玻璃塞的试剂瓶中) ③ 二氧化硅是一种特殊的酸性氧化物 a .酸性氧化物大都能直接跟水化合生成酸,但二氧化硅却不能直接跟水化合,它的对应水 化物(硅酸)只能用相应的可溶性硅酸盐跟盐酸作用制得 b .酸性氧化物一般不跟酸作用,但二氧化硅却能跟氢氟酸起反应: SiO 2+4HF →SiF 4+2H 2O(氢氟酸不能盛放在玻璃容器中)。
元素及其化合物的性质 1.下列说法不正确 ...的是 A.金属单质和盐溶液的反应都属于置换反应 B.质量数相等的不同核素,一定属于不同种元素 C.室温下,等浓度的酸HA 比盐酸的导电能力弱,所以HA属于弱电解质 D.Al2O3既能与强酸反应,又能与强碱反应,所以Al2O3属于两性氧化物 2.已知甲、乙、丙、X是4 略去)。下列说法中,正确的是 A.若甲为单质铁,则丙一定为FeCl3 B.若甲为强碱,则X一定为CO2 C.若乙是一种白色胶状沉淀,则甲溶液中一定含有Al3+ D.若甲为单质,则此关系中涉及的反应一定都是氧化还原反应 3.下列说法正确的是 A.不用其它试剂,无法鉴别AlCl3浴液和NaOH溶液 B.苯酚、火碱、碳酸氢钠分别属于酸、碱、盐 C.SO2使溴水褪色,不能说明SO2具有漂白性 D.HCl、NO2溶于水都有化学键断裂,因此均属于化学变化 元素周期律,元素周期表 1.现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍。下列说法正确的是 A.简单阳离子的氧化性:Y > X B.气态氢化物的稳定性:Z > M C.简单离子半径由大到小的顺序是:Z>M>Y D.等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z > Y2Z 2.下列说法中,不正确 ...的是 A.HF稳定性比HCl强 B.Mg失电子能力比Ca弱 C.NaCl与NH4Cl含有的化学键类型相同 D.等物质的量的C2H6和H2O2含电子数相同 3. 化合物X2Y由短周期元素X和Y组成。下列说法一定正确的是 A.X的原子半径大于Y B.若X为ⅠA族元素,则该化合物中含离子键 C.若X2Y的焰色为黄色,则它的电子式是
一、常见物理性质: 1、颜色: A、红色世界 (1)基态:Fe2O3 (红棕色)、Fe (OH)3(红褐色)、[Fe (SCN)]2+(血红色)、Cu (紫红色)、Cu2O (砖红色)、NO2(红棕色)、P(红磷、暗红色)、Br2(深红棕色)、红色石蕊试纸、品红溶液。在空气中久置的苯酚(红色) (2)化学变化: ①紫色石蕊在酸性溶液(p H<5.0)中变红; ②润湿的蓝色石蕊试纸遇酸性气体(C O2、S O2、H2S、H C l)变红; ③酚酞在碱性溶液中呈浅红色(8.2<p H<10.0)或红色(p H>10); ④甲基橙在酸性溶液(p H<3.1)中呈红色; ⑤已经被二氧化硫褪色的品红溶液在加热时会出现红色。 B、橙色世界: (1)基态:浓溴水、甲基橙试剂、B r2(C C l4)呈橙红色。 C、黄色世界: (1)基态:工业盐酸(含有Fe3+)、Au 、S(淡黄色)、Na2O2 (淡黄色)、AgBr(淡黄色)、AgI、Ag3PO4、碘水(黄色)、三硝基甲苯(黄色)、蛋白质加浓硝酸 (2)激发态:钠元素焰色呈黄色 (3)化学变化:久置的浓硝酸因溶有自身分解产生的二氧化氮而变黄 D、绿色世界 (1)基态:F2(浅黄绿色)、Cl2(黄绿色)、Cu 2(OH)2CO3(绿色)、 CuCl2(浓溶液呈绿色)、F e S O4(浅绿色) (2)化学变化:F e(O H)2(白色)——灰绿色——F e(O H)3(红褐色)
E、青(黑)世界:F e F e O F e3O4F e S C u S A g2S M n O2石墨(灰黑) F、蓝色世界 (1)基态:C u S O4(溶液)、C u S O4·5H2O(晶体)、液氧、臭氧 (2)化学变化: ①紫色石蕊在碱性溶液(p H>8)中变蓝; ②润湿的红色石蕊试纸遇碱性气体变蓝; ③无水C u S O4(白色粉末)遇水变蓝; ④H2、H2S、C H4、C2H5O H燃烧火焰呈淡蓝色,C O燃烧火焰呈蓝色; ⑤S在空气中燃烧呈淡蓝色火焰,在纯氧中燃烧呈现明亮的蓝紫色火焰; ⑥淀粉遇I2(a q)变蓝; ⑦C l2、B r2、N O2、O3遇湿润的淀粉碘化钾试纸变蓝。 G、紫色世界 (1)基态:K M n O4(H+)、紫色石蕊、碘单质呈紫黑色; (2)激发态:钾元素的焰色呈紫色(透过蓝色钴玻璃观察); (3)化学变化: ①I2升华生紫烟; ②N H4I受热生紫烟; ③紫色石蕊在(5.0<p H<8.0)溶液中呈紫色。 H、白色世界 (1)基态:Hg、铝粉、大多数块状金属、PbSO4、BaSO4、AgCl、BaCO3、Ba3(PO4)2、BaSO3、CaCO3、 Fe (O H)2(不稳定)、M g(O H)2、A l(O H)3等。 (2)化学变化:
高三化学总复习――金属及其化合物知识点总结 5.18一.金属的通性 1.位置:金属元素位于周期表的左下角,最外层电子数大部分少于4个。 2.物理通性:大部分有延展性、金属光泽,都有导热导电性等。 3.化学性质:易失电子,被氧化,金属表现还原性。 4.钠、铝、铁、铜单质的重要性质 钠铝铁铜 与非金属单质O24Na+O2=2Na2O O2+2Na Na2O2 4Al+3O22Al2O33Fe+2O2Fe3O42Cu+O2 2CuO Cl22Na+Cl22NaCl 2Al+3Cl22AlCl32Fe+3Cl22FeCl3 Cu+Cl2 CuCl2 S 2Na+S Na 2 S 2Al+3S Al2S3Fe+S FeS 2Cu+S Cu2S H2O 2Na+2H2O=2NaOH+H2↑2Al+6H 2 O 2Al(OH)3+3H2↑3Fe+4H2O Fe3O4+4H2 不反应 HCl溶液2Na+2HCl=2NaCl+H2↑2Al+6HCl=2AlCl3+3H2↑Fe+2HCl=FeCl2+H2↑不反应NaOH溶液与水反应2Al+2NaOH+2H2O= 2NaAlO2+3H2↑ 不反应不反应 CuSO4溶液2Na+2H2O+CuSO4= Na2SO4+Cu(OH)2↓+H2↑ 较复杂较复杂不反应 制备 2NaCl 2Na+Cl2↑2Al2O34Al+3O2↑Fe2O3+3CO 2Fe+3CO2 CuO+CO Cu+CO2 二.钠及其化合物 1.钠 ⑴钠的物理性质 状态颜色硬度密度熔点导电、导热性 固体银白色较小(比水大)较小(比水小)较低(用酒精灯加热,很快 熔化) 是电和热的良导体 ⑵钠的化学性质 ①钠与非金属单质的反应 A:与氧气:4Na+O2=2Na2O(变暗);O2+2Na Na2O2(燃烧生成淡黄色固体) B:与氯气:2Na+Cl22NaCl; C:与S:2Na+S Na2S ②钠与水的反应(水中先滴入酚酞) 2Na+2H2O=2NaOH+H2↑ 现象概述现象描述原因浮浮在水面钠的密度比水小 游四处游动钠与水反应产生气体 熔融化成银白色小球钠的熔点较低,且该反应放出大量热响发出咝咝的响声钠与水反应剧烈 红溶液由无色变为红色生成了碱性物质
第五章 元素及化合物的性质 实验十九 碱金属和碱土金属 一、目的要求 1. 比较碱金属、碱土金属的活泼性。 2. 比较碱土金属氢氧化物及其盐类溶解度。 3. 了解碱金属和碱土金属离子的定性鉴定方法。 二、仪器和药品 仪器:离心机,试管,烧杯,坩埚,漏斗,镊子,钴玻璃片 药品:HCl(2 mol·L -1,6 mol·L -1),HNO 3(6 mol·L -1),H 2SO 4(2 mol·L -1),HAc(2 mol·L -1),NaOH(2 mol·L -1),NH 4Cl(2 mol·L -1),Na 2CO 3(0.1 mol·L -1),LiCl(0.1 mol·L -1),NaF(0.1 mol·L -1),Na 2CO 3(0.1 mol·L -1),Na 2HPO 4(0.1 mol·L -1),MgCl 2(0.1 mol·L -1),CaCl 2(0.1 mol·L -1),BaCl 2(0.1 mol·L -1),Na 2SO 4(0.5 mol·L -1),CaSO 4(饱和),(NH 4)2C 2O 4(饱和),(NH 4)2CO 3(0.5 mol·L -1),K 2CrO 4(0.1 mol·L -1),K[Sb(OH)6] (饱和),NaHC 4H 4O 6(饱和),NH 3·H 2O -NH 4Cl 缓冲液(浓度各为1 mol·L -1),HAc -NH 4Ac 缓冲液(浓度各为1 mol·L -1),Na +,K +,Ca 2+,Sr 2+,Ba 2+试液(10 g·L -1),pH 试纸,Na(s),K(s),Mg(s),Ca(s),铂丝 三、实验内容 1. 碱金属、碱土金属活泼性的比较 1) 金属钠和氧的反应 用镊子夹取一小块(绿豆大小)金属钠,用滤纸吸干其表面的煤油,切去表面氧化膜,放入干燥的坩埚中加热。当钠刚开始燃烧时,停止加热,观察反应现象及产物的颜色和状态。
模块一常见元素及其化合物性质与转化一、典型元素及其化合物的转化关系 1.氯气及其化合物间的转化关系 2.硫及其化合物间的转化关系 3.氮气及其化合物间的转化关系 4.钠及其化合物间的转化关系 5.铝及其化合物间的转化关系
6.铁及其化合物间的转化关系 二、典型非金属单质的化学性质
三、典型非金属氧化物性质 四、典型金属氧化物性质
五、典型金属氢氧化物性质 六、物质的特殊转化关系1.交叉型转化
2.三角型转化 七、特征反应 既能与强酸溶液反应又能与强碱溶液反应的物质 Al 、Al 2O 3、Al(OH)3、氨基酸等。 弱酸弱碱盐:如(NH 4)2CO 3、NH 4HCO 3、(NH 4)2SO 3、NH 4HSO 3等。注意:此时B 、C 均为气体,A 可能是正盐、也可能是酸式盐。 弱酸的酸式盐:如NaHCO 3、Ca(HCO 3)2、NaHSO 3等 固体加热后不留残渣的物质 I 2、NH 4Cl 、(NH 4)2CO 3、NH 4HCO 3 常温与水反应产生气体的物质 Na 、K 、Na 2O 2 能同碱反应的单质 硫、硅、铝、卤素单质 有MnO 2参与的化学反应 2H 2O 2 2H 2O +O 2↑ 2KClO 3 2KCl +3O 2↑ MnO 2+4HCl(浓) MnCl 2+2H 2O +Cl 2↑ 化合物+化合物→单质+化合物 化合物+单质→化合物+化合物 Cl 2+H 2O=HCl+HClO 2H 2S+3O 2=2SO 2+2H 2O 4NH 3+5O 24NO+6H 2O 3Cl 2+2FeBr 2=2Br 2+2FeCl 3 化合物+单质→ 化合物 2Na 2SO 3+O 2=2Na 2SO 4 2FeCl 3+Fe=3FeCl 2 2NO+O 2=2NO 2 2FeCl 2+Cl 2=2FeCl 3 2CO+O 2 2CO 2 C+CO 22CO 2Na 2O+O 2 2Na 2O 2 2SO 2+O 2 2SO 3 MnO 2 △ 催化剂 △ 点燃 点燃 催化剂 加热