
第二章空气、物质的构成
考点一、空气的成分
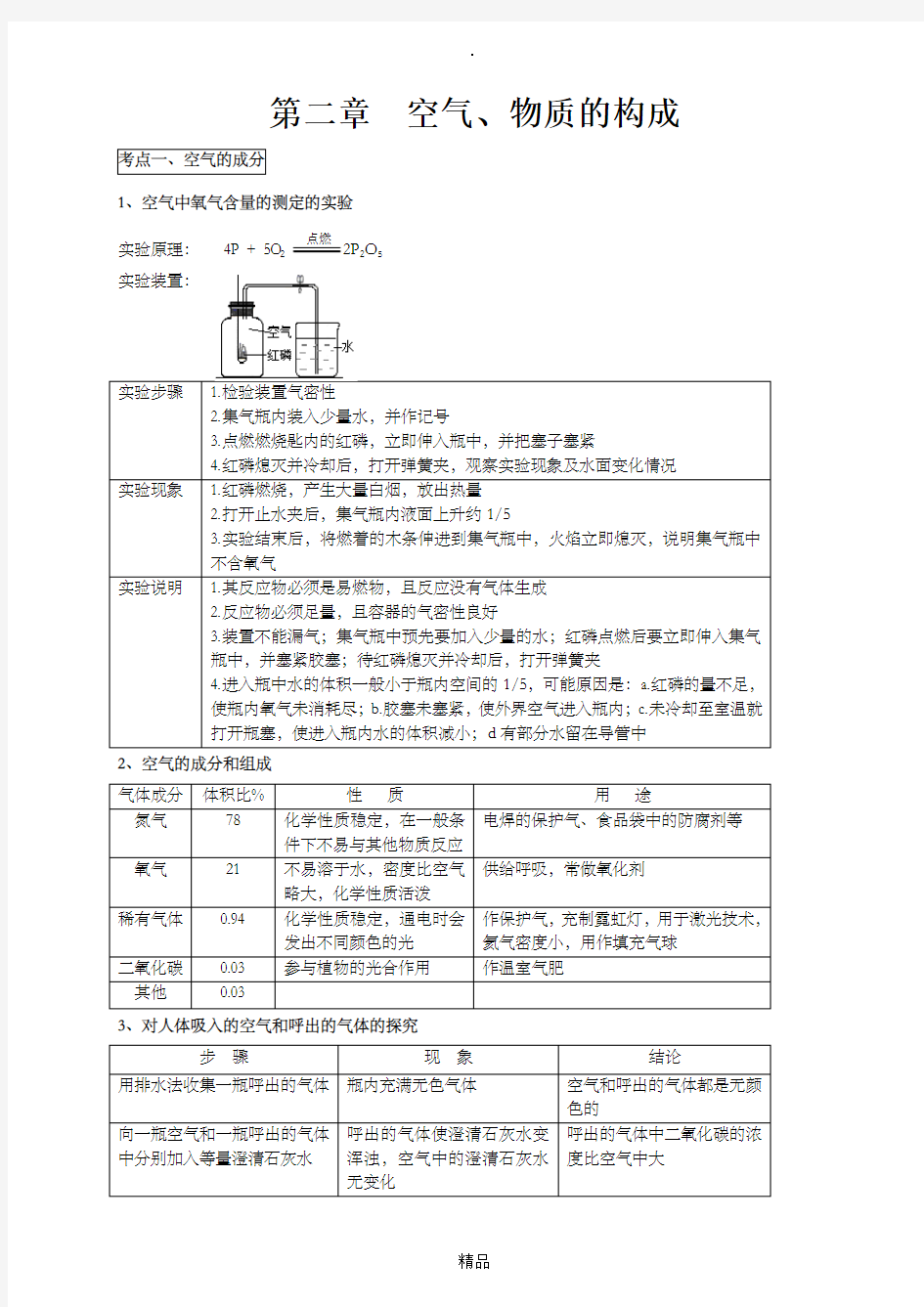
1、空气中氧气含量的测定的实验
实验原理:4P + 5O2点燃2P2O5
实验装置:
实验步骤 1.检验装置气密性
2.集气瓶内装入少量水,并作记号
3.点燃燃烧匙内的红磷,立即伸入瓶中,并把塞子塞紧
4.红磷熄灭并冷却后,打开弹簧夹,观察实验现象及水面变化情况
实验现象 1.红磷燃烧,产生大量白烟,放出热量
2.打开止水夹后,集气瓶内液面上升约1/5
3.实验结束后,将燃着的木条伸进到集气瓶中,火焰立即熄灭,说明集气瓶中
不含氧气
实验说明 1.其反应物必须是易燃物,且反应没有气体生成
2.反应物必须足量,且容器的气密性良好
3.装置不能漏气;集气瓶中预先要加入少量的水;红磷点燃后要立即伸入集气
瓶中,并塞紧胶塞;待红磷熄灭并冷却后,打开弹簧夹
4.进入瓶中水的体积一般小于瓶内空间的1/5,可能原因是:a.红磷的量不足,
使瓶内氧气未消耗尽;b.胶塞未塞紧,使外界空气进入瓶内;c.未冷却至室温就
打开瓶塞,使进入瓶内水的体积减小;d有部分水留在导管中
2、空气的成分和组成
气体成分体积比%性质用途
氮气78化学性质稳定,在一般条
件下不易与其他物质反应
电焊的保护气、食品袋中的防腐剂等
氧气21不易溶于水,密度比空气
略大,化学性质活泼
供给呼吸,常做氧化剂
稀有气体0.94化学性质稳定,通电时会
发出不同颜色的光作保护气,充制霓虹灯,用于激光技术,氦气密度小,用作填充气球
二氧化碳0.03参与植物的光合作用作温室气肥
其他0.03
3、对人体吸入的空气和呼出的气体的探究
步骤现象结论
用排水法收集一瓶呼出的气体瓶内充满无色气体空气和呼出的气体都是无颜
色的
向一瓶空气和一瓶呼出的气体中分别加入等量澄清石灰水呼出的气体使澄清石灰水变
浑浊,空气中的澄清石灰水
无变化
呼出的气体中二氧化碳的浓
度比空气中大
混合物:是由两种或两种以上的物质混合而成(或由不同种物质组成)。
例如,空气,溶液(盐酸、澄清的石灰水、碘酒、矿泉水),矿物(煤、石油、天然气、铁矿石、石灰石),合金(生铁、钢)
注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。
纯净物:由一种物质组成的。
例如:水、水银、蓝矾(CuSO4·5H2O)都是纯净物;冰与水混合是纯净物。
单质:有同种元素组成的纯净物。(金属单质,非金属单质)
化合物:有不同种元素组成的纯净物。(酸、碱、盐、氧化物)
氧化物:如果化合物仅由两种元素组成,且其中一种元素是氧元素。
构成物质的微粒
微观的粒子有:原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。分子、原子、离子都是构成物质的粒子。
A、金属单质和稀有气体由原子直接构成;
B、非金属单质、非金属与非金属形成的化合物由分子构成。
C、化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
分子是保持物质化学性质的最小粒子。分子由原子构成。
A、分子是构成物质的一种微粒,常见由分子构成的物质:水、氢气、氧气、氮气、二氧化硫、二氧化碳等。【由分子构成的物质,在物理变化中,分子本身不发生改变;在化学变化中,分子本身发生改变,生成新的分子。】
B、分子的微观特性:分子总是在不断地运动着;分子之间存在间隔;分子的质量很小。
原子是构成物质的另一种微粒。原子构成分子,原子也可直接构成物质,如金属汞、稀有气体等。 1. 分子与原子的比较
原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子和不带电的中子构成。 原子结构示意图:
核电荷数=质子数=核外电子数=原子序数
核外电子排布的规律:核外电子按能量由低到高从里往外排,第一层最多容纳2个电子,第二、三层最多容纳8个电子。 3. 相对原子质量:以一种碳原子(碳-12)质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,是该种原子的相对原子质量。
相对原子质量=一个碳原子的质量
一个某原子的质量×12 (相对原子质量是个比,单位为
1)
相对原子质量≈质子数
+中子数
1. 含义:具有相同质子数(或核电荷数)的一类原子的总称。 注意:元素是一类原子的总称;这类原子的质子数相同
因此:元素的种类由原子的质子数决定,质子数不同,元素种类不同。 2. 3. 4. 元素的分布:
①地壳中含量前四位的元素:O 、Si 、Al 、Fe ②生物细胞中含量前四位的元素:O 、C 、H 、N ③空气中前二位的元素:N 、O 注意:在化学反应前后元素种类不变
5. 元素符号
书写原则:第一个字母大写,第二个字母小写。
表示的意义;表示某种元素、表示某种元素的一个原子。例如:O:表示氧元素;表示一个氧原子。原子个数的表示方法:在元素符号前面加系数。因此当元素符号前面有了系数后,这个符号就只能表示原子的个数。例如:表示2个氢原子:2H;2H:表示2个氢原子。
元素符号前面的数字的含义;表示原子的个数。例如:6.N:6表示6个氮原子。
1. 元素的种类
①金属元素:原子的最外层电子数一般少于4个(是不稳定结构),在化学变化中易失去最外层电子,而使次外层成为最外层,形成稳定结构。这种性质叫做金属性。
②非金属元素:原子的最外层电子数一般多于或等于4个(是不稳定结构),在化学变化中易获得电子,而使最外层达到8电子的稳定结构。这种性质叫做非金属性。
③稀有气体元素:原子的最外层有8个电子(He为2个),为相对稳定结构。
在化学反应中,金属元素原子失去最外层电子,非金属元素原子得到电子,从而使参加反应的原子带上电荷。
带电荷的原子叫做离子。带正电荷的原子叫做阳离子,带负电荷的原子叫做阴离子。
3. 阴、阳离子由于静电作用互相吸引,结合形成稳定的、不带电性的化合物。
离子内质子数不等于核外电子数,离子的最外层电子一般是8(氢是0)个电子的稳定结构。
原子通过得失电子变成离子,离子也可以通过得失电子变回原子。
4. 离子符号
离子用离子符号表示:在原子团或元素符号的右上角标出离子所带的电荷的多少及电荷的正负(数字在前,符号在后),当离子所带电荷数为1时,1可以不写。如Na+(钠离子)、Ca2+(钙离子)、H+(氢离子)、Cl-(氯离子)、O2-(氧离子)、OH-(氢氧根离子)等。
离子符号表示的意义:Mg2+表示1个镁离子带2个单位的负电荷。2O2-表示2个氧离子。
1. 化学式:用元素符号和数字组合来表示物质组成的式子。
2. 化学式(如H2O)的意义:
表示一种物质(宏观意义)——表示水这种物质;
表示一个分子(微观意义)——表示1个水分子;
表示某物质是由什么元素组成的(宏观意义)——表示水是由氢元素、氧元素组成;
表示某物质是由什么粒子构成(微观意义)——表示水由水分子构成;
表示某物质的分子由什么粒子构成(微观意义)——表示1个水分子由2个氢原子和1个氧原子构成;
3. 化学式的写法:
书写化合物的化学式时,首先要弄清以下两点: ① 这种物质由哪种物质组成;
② 化合物中各元素的原子个数比是多少。 4. 化合价:元素化合价是一个原子在化合时表现出来的性质。在元素符号或原子团的上方标出化合价,“+”、“-”写在前,数字写在后。 5. 化合价的一般规律:
金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。氧元素通常显-2价,氢元素通常显+1价。在化合物里正负化合价的代数和为0。在单质中元素的化合价为0。
同一元素在不同物质里可显不同的化合价。在同一种物质里,同一元素也可显不同的化合价(如NH 4NO 3)。
6. 根据化合价写化学式:“正价前,负价后,十字交叉右下处,化简才是原子数”。如 P 2O 5
7. 数字的意义:
① 元素符号前的数字表示几个某原子。如2H 中的“2”表示2个氢原子。 ② 化学式前的数字表示几个某分子。如2H 2O 中的“2”表示2个水分子。
③ 元素符号右下角数字表示一个某分子或离子中有几个某原子。如CO 2中的“2”表示1个二氧化碳分子中有2个氧原子。
④ 元素符号右上角的数字表示一个某离子中带几个单位的正或负电荷。如Fe 3+中的“3”表示1个铁离子带3个单位的正电荷。
⑤ 元素符号正上方数字表示某元素的化合价。如FeCl 3表示铁元素的化合价是+3。 8. 根据化学式进行计算(计算时要注意式子的化学意义)
1)相对分子质量=(相对原子质量×原子个数)之和 2)组成元素的质量比=(相对原子质量×原子个数)之比 3)原子个数之比=(元素质量÷相对原子质量)之比
4)化合物中某元素的质量分数=%100??量
该化合物的相对分子质原子个数该元素的相对原子质量
5)某元素的质量=某化合物的质量×某元素质量分数
%100???
量
该化合物的相对分子质原子个数
该元素的相对原子质量某化合物的质量
附表1 一些常见元素的名称、符号和相对原子质量
纯净物
单质
化合物
金属单质、稀有气体单质、其他由原子构成的物质——直接用元素符号表示(如Fe 、Al )
常温下为固态的非金属单质——用元素符号表示(如S 、P 、C )
由双原子分子或多原子分子构成——在元素符号右下角标出原子个数(如O 2、H 2、Cl 2)
正价元素或原子团写在前,负价元素或原子团写在后(特例:NH 3氨气、CH 4甲烷)。在元素符号
右下角写出该种元素的原子数目,所有元素的原子个数比为最简比(特例:H 2O 2)。当原子团不是 一个时需要加括号,把个数写在括号的右下角(1省略不写)。
附表2 一些常见元素、根的化合价和离子符号
1、含义
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。 说明:①质量守恒定律只适用于化学变化....,不适用于物理变化....; ②没有参加反应的物质质量及不是反应生成的物质质量不能..计入“总和”中; ③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏。 2、微观解释
在化学反应前后,原子的种类、数目、质量均保持不变(原子的“三不变”)。 3、化学反应前后 (1)一定不变....
宏观:反应物、生成物的总质量不变;元素种类、质量不变
微观:原子的种类、数目、质量不变 (2)一定改变.... 宏观:物质的种类一定变 微观:分子种类一定变 (3)可能改变....: 分子总数可能变
1、化学方程式 1、含义:
化学方程式——用化学式表示化学反应的式子。 反应物——参加反应的物质。
生成物——化学反应后产生的物质。 2、表示的意义:
⑴表示反应物、生成物和反应条件
⑵表示各物质间的质量比(质量比=各物质的相对分子质量×各化学式前面的系数的积的比) ⑶表示各物质的微粒个数比(即各化学式前面的系数比)
例如:以2H 2+O 2 2H 2O 为例 ①表示氢气与氧气在点燃条件下生成水
②表示氢气、氧气与水的质量比为4:32:36
③表示氢分子、氧分子与水分子的个数比为2:1:2
3、化学方程式的读法 以2H 2+O 2 2H 2O 为例 ①从反应物、生成物和反应条件角度:氢气与氧气在点燃条件下生成水
②从各物质的质量比角度:每4份质量的氢气与32份质量的氧气在点燃条件下生成36份质量的水 ③从各物质的微粒个数比角度:每2个氢分子与1个氧分子在点燃条件下生成2个水分子。 2、如何正确书写化学方程式
一、书写原则:
1、以客观事实为基础
2、遵守质量守恒定律(标准:两边原子的种类和数目相等) 二、方程式的配平
1、标准:方程式两边原子种类和数目相等即配平了
2、配平的原则:在化学式前面加上适当的系数来保证方程式两边原子种类和数目相等。
3、方法:最小公倍数法
最小公倍数法配平化学方程式的步骤
⑴.确定配平的起点元素:横线两边出现次数最少,且原子个数的最小公倍数最大的元素作为起点元素。
⑵.确定起点元素原子个数的最小公倍数。
⑶.确定含有起点元素的化学式的系数:用最小公倍数除以化学式中起点元素原子的个数的商作为该化学式前面的系数。
⑷.确定其它化学式前面的系数的顺序:依次确定含有除起点元素以外,横线两边出现次数由少到多的元素的化学式前面的系数。
⑸.最后将各系数调整为最简整数比。 举例:配平化学方程式: FeS 2 + O 2
Fe 2O 3 + SO 2 ⑴确定起点元素:由于Fe 、S 元素在横线两边只出现了一次,且最小公倍数都为2,因此Fe 、S 元
点燃
点燃
点燃
素都可作为起点元素。
⑵若选择Fe 作为起点元素,则原子个数的最小公倍数为2。 ⑶确定FeS 2 、SO 2前面的系数:用最小公倍数2除以FeS 2中Fe 元素的原子个数1的商2作为的FeS 2系数;用最小公倍数2除以Fe 2O 3中Fe 元素的原子个数2的商1作为Fe 2O 3的系数;
2FeS 2 + O 2
1Fe 2O 3 + SO 2
⑷确定O 2 、SO 2的系数:
①由于O 2 、SO 2中只含有O 、S 两种元素,S 元素在方程式两边只出现了一次,因此先确定SO 2 的系数,再确定O 2的系数。由于方程式左边S 原子的个数已确定为4,所以右边S 原子的个数也为4。因此SO 2的系数为4除以SO 2中S 元素的原子个数1的商4作为SO 2。的系数。
2FeS 2 + O 2
1Fe 2O 3 + 4SO 2
②由于方程式右边O 原子的个数已确定为11,因此左边O 原子的个数也为11。所以O 2的系数为11除以O 2中O 元素的原子个数2的商11/2作为SO 2。的系数。
2FeS 2 + 11/2O 2
1Fe 2O 3 + 4SO 2
⑸再将各系数调整为最简整数比:即在方程式两边同时乘以2就可以。
4FeS 2 + 11O 2 2Fe 2O 3 + 8SO 2 三、书写的步骤
1、写 写出反应物、生成物的化学式
2、配 配平方程式
3、注 注明反应条件和生成物的状态
4、等 将横线改为等号 3、利用化学方程式的简单计算
1、依据:利用化学方程式能反映物质间的质量比,且质量比呈正比例关系。
2、步骤:①设未知数;②根据题意写出方程式;③根据化学方程式找出已知量与未知量的质量比;④列出比例式;⑤求出未知数;○6答
注意:
①由于方程式只能反应物质间的质量比,因此代入方程式中的各个量必须是质量。 ②由于方程式中各物质是纯净物,因此代入方程式中的量必须是纯净物的质量。 ③单位必须统一。
如有侵权请联系告知删除,感谢你们的配合!
点燃
点燃
点燃
点燃