
医疗器械中英文对照--心血管心血管器械(Cardiovascular Devices)
1.1结构性心脏病器械未来10年是器械创新升级的主旋律领域 ?根据Frost&Sullivan数据,2018年心血管器械出厂市场规模约412亿(+13%)。 ?我们预计其中以耗材为主(约290亿),介入耗材耗材约为250~260亿元,结构性心脏病介入耗材不足10亿。 结构性心脏病器械市场在心血管器械领域所处位置 2018年市场规模 120亿元左右 30~40亿元 174亿元 70亿左右 1~2亿元 1~2亿元 5~6亿元
160 140 120 150.8 100 80 60 40 20 81.6 90.4 全球结构性心脏病器械市场规模 12% 1.2全球看:结构性心脏病器械有望持续增长 ?结构性心脏病(Structural heart disease,SHD)泛指一大类先天性或获得性的以心脏和大血管结构异常为主要表现的心脏疾病,如传统定义的先天性心脏病、心脏瓣膜病和心肌病等。 ?从全球市场来看,结构性心脏病是近十余年心血管疾病领域一个新型的亚专业。伴随着介入手术的发展,结构性心脏病器械逐渐成为一个高增长、大体量、高价值的成长行业,预计2023年全球结构性心脏病植介入器械行业规模有望达到150.8亿美元,2017~2023复合增速10.8%。结构性心脏病介入器械主要包括经皮瓣膜修复与置换和介入封堵术,其中TAVR产品、MitraClip、LAAC、先心病封堵器等比较成熟的领域和产品在2018年收入合计超过55亿美元,包括这些手术的配套器械(如通道产品)预计行业空间超过60亿美元,占2018年行业规模90.4亿美元的66%。 ?从区域分布看,北美(38%)、欧洲(20%)、亚太(30%)为主要的市场,预计发达国家占比约80%。 其他地区, 北美, 38% 亚太, 30% 2017 2018 2019 2020E 2021E 2022E 2023E 全球结构性心脏病器械市场规模(亿美元)欧洲, 20% 2017年全球结构性心脏病器械市场分布
医疗器械行业研究报告研究员:知根知底
1资料目录 1资料目录 (2) 2行业界定 (3) 2.1医疗器械的界定 (3) 2.2医疗器械的分类 (4) 2.3国家监管分类 (5) 2.4行业统计分类 (5) 3市场规模 (5) 3.1全球医疗市场 (5) 3.1.1全球医药技术市场需求持续快速增长 (5) 3.1.22013 年我国医疗器械销售仅占医药的9.2%,与全球总体相比增长的空间巨大 (6) 3.1.3欧美引领全球医疗器械发展潮流 (7) 3.1.4拉美国家经济势头良好,市场空间广阔。 (8) 3.1.5欧盟医疗器械行业发展特点 (8) 3.1.6日本医疗器械行业发展特点 (9) 3.1.7俄罗斯、印度、巴西、南非医疗器械行业发展特点 (9) 3.1.8印度2013年医疗器械工业总值预计为54亿美元 (9) 3.1.9以色列医疗器械行业发展特点 (9) 3.2中国医疗器械市场预测 (10) 3.2.1市场驱动因素 (10) 3.2.2市场预测 (13) 3.2.3我国医疗器械产业出口现状 (14) 3.3细分行业行业 (17) 3.3.1体外诊断(IVD) (17) 3.3.2影像设备 (21) 4行业发展现状 (22) 4.1我国医疗器械产业发展三阶段 (22) 4.2医疗器械产业链生态系统独特: (23) 4.3器械产品纷繁复杂,多样化和个性化程度高: (23) 4.4小众而多样化决定了医疗器械单体扩张的难度 (23) 4.5医疗器械新品创新比药品快,单品种体量小。 (24) 4.6医疗器械销售对售后服务要求很高,单一代理商覆盖的医院面很窄,渠道中存货很少。 (24) 5行业发展趋势 (24) 5.1未来器械行业的专业化和平台化的发展会成为趋势。 (24) 5.2互联网信息技术革命导致的跨界整合与创新智慧医疗可能是下一个十年的发展趋势 (26) 5.3医疗器械国产化将向中高端深入 (27) 5.4内部:技术进步提高性价比和服务质量 (27) 6行业政策 (27) 7产业链 (28) 8成长性与盈利性 (29) 8.1成长性 (29) 8.2盈利性 (30) 9中国市场竞争格局 (30) 9.1国际市场占有率 (30) 9.2我国五力竞争分析 (32) 9.3细分领域竞争态势 (33) 9.4中国医械产业:集中度偏低,中高端主要依赖进口 (33)
药店药品与医疗器械专项监督检查要点 一、药品方面 1.药店、医疗机构在药品购进、储存、养护、调配、使用等相关环节质量管理制度制定和执行情况; 2.药店、医疗机构药学技术人员配备情况,培训及健康档案的建立情况; 3.药店、医疗机构药品进货渠道的合法性,相关资质证明文件、购进票据、检验报告、冷链数据的留存情况,是否做到票、账、货相符;是否建立真实完整的药品购进验收记录; 4.药店、医疗机构药品储存与养护所需的设施设备是否齐全,是否能够满足药品存储的需要; 5.药店、医疗机构对近效期药品管理是否采取足够的措施,能否防止过期失效药品的继续出售及使用; 6.医疗机构是否擅自使用其他医疗机构配制的制剂或未经批准擅自配制制剂; 7.疫苗配送单位、接种点的疫苗配送、领用和存储情况,领用和存储是否符合冷链要求; 8.是否存在以下违法违规行为:使用假劣药品;从非法渠道购进药品;非药品冒充药品使用;采用邮售、互联网交易、柜台开价自选等方式直接向公众销售药品; 9.是否按照相关法律法规的规定严格管理特殊药品;
10.是否按规定设置满足药品贮存的常温库、阴凉库、冷库或冷柜,是否配备了药品储存、养护、调配过程中必需的设施设备。是否按照药品属性、药品说明书标明的条件分库、分区、分垛存放药品,并实行色标管理。是否按制度要求开展药品保管、养护工作并建立相应的养护档案。 二、医疗器械方面 1.是否按规定由指定的部门或者人员统一采购医疗器械; 2.医疗器械采购、验收、贮存、养护、维护、使用等相关环节质量管理制度制定和执行情况; 3.是否按规定对本单位从事医疗器械维护维修的相关技术人员进行培训考核、建立培训档案的; 4.购进医疗器械,是否收集并查验了供货者的资质和医疗器械产品注册证书等合格证明文件,建立验收记录,记录具有真实性和可追溯性,并按照规定的期限予以保存; 5.是否有与医疗器械品种、数量相适应的贮存场所和条件,需冷藏、冷冻的医疗器械(如诊断试剂),是否监测、记录贮存区域或设备的温度,库存产品是否分类、分区摆放,效期产品是否有显著标识;医疗器械贮存、养护、出库、复核制度和相应的记录是否内容齐全、符合规定; 6.对需要定期检查、检验、校准、保养、维护的医疗器械,是否按照产品说明书的要求进行检查、检验、校准、保养、维护并予以记录;对使用期限长的大型医疗器械,是否逐台建立使用档案,记录保
一、医疗器械的采购程序: 在销售医疗器械之前,先了解客户的组织结构和工作程序,可以帮助我们理顺工作顺序和工作重点。 1,组织结构 医院里申请采购的部门是使用科室或者使用的人;申请方式有口头要求或书面呈述,填写采购申请。 决策部门是院长(分管院长)或者是院长会。 执行部门是器械科,少数是科室自己采购,到器械科报帐。 2,采购程序 2.1低值易耗医疗器械采购 耗材采购,对正在使用的耗材,使用人做计划,报给器械科(处或设备科/处,以下简称器械科)采购。 如果其它品牌的耗材进入,需要使用人建议,使用人所在科室领导同意,报给器械科或者呈报到院长那里,由院长批准后,小批量采购试用。 2.2常规使用的小设备采购(万元以下的设备) 由科室做消耗计划,报设备科采购。 2.3大设备的采购(每个医院,对大设备的限定不一样,我们的仪器属于大设备范围。) 基本程序是: 科室主任根据临床诊断治疗和科室经营的需要,对新项目进行论证和制定计划,判断临床价值和经济价值;决定因素是经济和临床价值以及科室能否开展这个项目。销售人员必须把相关的内容传导给主任,并帮助主任制定一个合理的方案。如果科主任认为上这个项目可以获得临床和经济价值,并认可你的公司价值观和服务,以及对你个人的信任和认可,就会按照程序填写申请购买表,递到器械科(特殊情况是递给院长);或者先与院长沟通以后,获得许可才书写申请。 医院根据当年采购计划,按照常规处理;或者根据你的工作力度,进行相应处理。由院长批准或院长会或采购办批准后,交器械科采购。 器械科长会根据产品情况选择一家或多家供应商进行多次谈判。如工作做的好,很快就会和院长或医院谈判委员会进行谈判,确定合同细节。 还有一个情况,当医院采用其它途径的资金来购买,会把项目提供给出资金的单位或组织,由他们和供应商谈判。比如政府拨款,外国政府或社会捐赠,企业医院由上级部门拨款,还有许多外国政府贷款。不同的资金来源决定你的成单时间和方式以及回款。 二、销售的基本模式: 1.框图 2.步骤一:主任拜访 2.1首先针对临床科室主任进行拜访。在拜访中可以预先搜集资料拜访;也可以对主任直接拜访,获得第一手资料。
药品医疗器械自查报告 认真执行药品医疗器械入库制度,是为了保证入库医疗器械的合法及质量,我们来看看药品医疗器械自查报告是怎么样的吧。 篇一为贯彻落实《**市整治全市医疗器械流通领域经营行为工作方案》(百食药监办{XX}88号)文件精神,我公司高度重视,于XX年7月8日由公司质量管理部组织公司相关岗位员工按照公告内容结合公司实际逐条逐项认真开展了自查工作,现将自查情况汇报如下: (一)从事医疗器械批发业务的经营企业销售给不具有资质的经营企业或者使用单位的;医疗器械经营企业从不具有资质的生产、经营企业购进医疗器械的。 自查情况:我公司购销渠道合法,严格按国家有关要求审核供货单位和购货单位的合法资质,公司所有供货单位和购货单位资质合法,有效。 (二)经营条件发生变化,不再符合医疗器械经营质量管理规范要求,未按照规定进行整改的;擅自变更经营场所或者库房地址、扩大经营范围或者擅自设立库房的。自查情况:我公司严格按照医疗器械经营质量管理规范要求开展经营工作,不存在擅自变更经营场所或者库房地址、扩大经营范围或者擅自设立库房的违法行为。
(三)提供虚假资料或者采取其他欺骗手段取得《医疗器械经营许可证》的;未办理备案或者备案时提供虚假资料的;伪造、变造、买卖、出租、出借《医疗器械经营许可证》或《医疗器械经营备案凭证》的。 自查情况:我公司郑重承诺:办理《医疗器械经营许可证》所提供资料真实、准确、完整,不存在伪造、变造、买卖、出租、出借《医疗器械经营许可证》的违法行为。 (四)未经许可从事第三类医疗器械经营活动的,或者《医疗器械经营许可证》有效期届满后未依法办理延续、仍继续从事医疗器械经营的。 自查情况:我公司《医疗器械经营许可证》有效期至XX 年9月27日,目前我公司正在积极筹备换证工作。 (五)经营未取得医疗器械注册证的第二类、第三类医疗器械的,特别是进口医疗器械境内代理商经营无证产品的。 自查情况:我公司购销渠道合法,未超范围经营。 (六)经营不符合强制性标准或者不符合经注册或者备案的产品技术要求的医疗器械的;经营无合格证明文件、过期、失效、淘汰的医疗器械的。 自查情况:我公司按批准的经营方式、经营范围从事经营医疗器械;未经营无合格证明文件、过期、失效、淘汰的医疗器械。 (七)经营的医疗器械的说明书、标签不符合有关规定的;
(此文档为word格式,可任意修改编辑!) 2017年1月
正文目录 一、心血管疾病——最应得到控制的死亡因素 (4) (一)心血管疾病死亡率高,严重影响国民健康 (4) (二)药物治疗长期应用,手术器械不断进步 (7) 二、血管支架,研发取向决定未来市场 (9) (一)血管支架历史悠久,国内应用持续增长 (9) (二)研发创新竞争激烈,国内药物洗脱支架跟随主流 (11) (三)内皮化是研发最终目标,路径选择仍有争议 (12) (四)国产支架企业加强研发,最终结果由市场检验 (16) 三、人工心脏研发取得进步,或解决“核心”问题 (19) 四、相关建议 (25) 五、风险提示 (26) 图目录 图 1:心脑血管疾病是我国城市第一大致死因素 (4) 图 2:心脑血管死亡率继续上升趋势(例/十万人) (5) 图 3:西亚太发展中国家心血管疾病风险(胆固醇可测情况) (6) 图 4:西亚太发展中国家心血管疾病风险(胆固醇不可测情况) (7) 图 5:常见心外手术种类 (8) 图 6:我国PCI手术数量增长较快 (10) 图 7:冠脉支架市场规模不断上升 (10) 图 8:雅培将全吸收支架视为血管支架的全新一代产品 (11) 图 9:雅培Absorb GT1生物可降解血管支架随时间逐步降解 (12) 图 10:Igaki-Tamai支架是最早应用于人体的可降解支架 (13) 图 11:有临床试验表示SYNERGY支架系统相比Absorb内皮化更快 (15)
图 12:药物洗脱支架占我国血管支架超九成 (17) 图 13:急性冠状综合征比例上升,病死率持续下降 (17) 图 14:美国(部分)整体人工心脏移植一年期生存率 (20) 图 15:SynCardia人工心脏可使用便携电源并支持适度运动 (20) 图 16:人工心脏植入数量逐年上升(Intermacs数据) (21) 图 17:美国(部分)辅助人工心脏移植一年期生存率 (22) 图 18:美国(部分)人工辅助心脏用途分类 (23) 图 19:心脏移植手术主要集中在美国和欧洲 (24) 图 20:美国心脏捐献者来源分布与采用率 (24) 图 21:美国心脏捐献者数量趋向稳定 (25) 表目录 表 1:部分心血管类疾病药物 (8) 表 2:PLA支架主要问题 (14) 表 3:2014年各省级地区冠心病介入治疗情况 (17) 表 4:金属可降解支架主要性能对比 (18) 表 5:主要人工辅助心脏产品 (23)
塑料在医疗器械中的应用及前景 一、概括 塑料作为一种十分重要的材料,在医疗领域得到广泛的应用,从药品、药剂的包装,到一次性医疗器械(如输液瓶,注射器等)和非一次性医疗器械(如计量器非外科器械等)的应用,都有塑料的参与。据预测今后10年医用塑料领域将是塑料工业最具发展潜力的领域之一。 二、塑料的特点 自从20世纪30年代人的首次使用高分子材料赛璐珞作为透析膜制成人工肾应用与临床获得成功以来,高分子材料正在逐步替代传统的无机材料,正由于它的优良的性质,可靠的性能,方便的成型工艺使其极具发展前景。因为,塑料高分子材料具有良好的物理力学性能和化学稳定性,较适合在医疗领域使用。高分子材料来源丰富,价格低廉,适合制作一次性医疗用品。免除了传统材料的多次消毒成本和杜绝交叉感染问题。塑材具有易塑性和良好的组织相容性,血液相容性。塑料加工方便,制作成本低。 便于加工成复杂的形状并开发新型医疗产品。 三、塑料医疗器械的临床应用 1.循环系统人工心脏应用的塑料主要是聚醚氨酯类材料,具有弹性好抗老化组织相容性和血液相容性好。产品性能可通过分子设计来调节改变等优点。其他产品还有人工心脏瓣膜、心脏补片、人工血管、心导管等 2.呼吸系统与呼吸机相关的塑料制品是塑料在医疗器械领域中应用最集中的领域之一,比价网https://www.doczj.com/doc/bd7912434.html,相关制品包括面罩、鼻罩、气管插管,气管切开插管,支气管导管,呼吸机连接管,各种套管等,大多由聚氯乙烯、聚丙烯橡胶等材料制备而成。人工肺又称氧合器,是由聚丙烯中空纤维、聚砜中空纤维等组成,这种人工膜式氧合器效果好,安全可靠。 3.消化系统在消化系统中齿科是应用塑料较大的领域,包括义齿,牙托粉,全口托牙,托牙组织衬垫,补牙树脂等,主要由聚甲基丙烯酸酯类极其共聚物制成。并在人工喉、人工食道、胆管、鼻饲管、胃导管、肠导管等处也广泛应用。
全球医疗器械现状 大型高端医疗器械产品对科技含量要求高、单个产品价值较高,适合小批量生产;中小型基础医疗器械产品对质量要求高、单个产品价值不高,适合大批量生产。医疗器械行业是一个多学科交叉、知识密集、资金密集型的高技术产业,进入门槛较高。医疗器械工业是一个国家综合工业水平的体现,综合了各种高新技术成果,将传统工业与生物医学工程、电子信息技术和现代医学影像技术等高新技术结合起来的行业。与发达国家相比,我国医疗器械工业基础薄弱,规模较小,发展较为滞后。但同时我国落后的医疗器械装备水平与社会日益增长的医疗需求之间的巨大矛盾,促进了我国近几年医疗器械市场的快速增长,增长速度快于国内其他工业,也快于世界发达国家和其它发展中国家医疗器械市场的增长。 医疗器械行业产品品种繁多,制造技术涉及医药、机械、电子、塑料等多个技术交叉领域,企业生产规模大小不一。大型高端医疗器械产品对科技含量要求高、单个产品价值较高,适合小批量生产;中小型基础医疗器械产品对质量要求高、单个产品价值不高,适合大批量生产。医疗器械行业的上述特点给我国医疗器械产业发展留下巨大的空间,近年来随着我国精密制造和机电一体化设备的制造能力增强,使医疗器械行业发展迅速。 目前,中国医疗器械市场仍将保持较高的增长幅度,作为多学科交叉的行业,其产业外延在不断扩大,这将带来新增的领域市场。同时,人口老龄时代的来临,以及消费能力的提升,将进一步拉动市场需求,导致行业发展增速较高。与发达国家比较,中国医疗器械市场成长空间仍然较大,但是近年来中国在CT,DR,核磁共振,超声影像,等等方面也取得的长足的进步。 一、全球医疗器械市场发展现状 (一)全球医疗器械市场需求巨大 美欧日等发达国家和地区的医疗器械产业发展时间早,国内居民生活水平高,对医疗器械产品的技术水平和质量要求较高,市场需求以最新产品的升级换代为主,市场规模庞大、需求增长稳定。 中国、印度等亚洲国家,以及墨西哥、巴西等拉美国家,俄罗斯等东欧国家的医疗电子设备市场发展较快,设备普及和升级换代的需求同时大量存在,常规医疗
药品与医疗器械管理规定 Prepared on 22 November 2020
药品和医疗器械管理制度 药品、器械管理制度 1、认真贯彻执行《药品管理法》、《医疗器械监督管理条例》等法律法规和各项质量管理制度,药品和医疗器械从上级医疗机构统一配送。 2、检查验收人员应按有关规定,对入库药品和医疗器械内、外包装、标签、说明书和外观质量,进行逐批检查验收,不得漏验。 3、特殊管理药品应由两人共同检查验收;麻醉药品和一类精神病药应由两人逐盒检查验收到最小包装,填写完整的验收记录,并双人签字。 4、已检查验收质量合格的药品和医疗器械,验收人员办理药品和医疗器械入库手续,并签名或盖章。 5、经检查验收认为不合格的药品和医疗器械或质量有疑问的药品和医疗器械按有关规定处理。 6、按规定认真做好药品和医疗器械质量检查验收各项记录,内容包括:到货日期、药品和医疗器械名称、规格、剂型、数量、批号、有效期、生产企业、批准文号、质量状况、验收结论、验收人等,记录应整洁,真实、完整,不得撕毁或任意涂改,记录应妥善保存五年。 药品医疗器械储存养护制度 一、医疗机构应当设立与其规模相适应的药房(药库)。药房
(药库)应当与生活、办公和医疗区域分开,并具备必要的避光、通风、防虫、防鼠条件以及温度、湿度控制设备。 二、药品、医疗器械应当按照产品说明书标明的储存条件,分别存放于常温区(库)、阴凉区(库)、及冷藏区(库)。并监测和记录储存区域的温度、湿度,每日上、下午各记录一次温湿度,并根据温湿度情况采取相应的措施。 三、药品、医疗器械储存陈列应分类存放。中药材、中药饮片应当与其他药品分开存放;过期、变质、失效等不合格的药品、医疗器械应当集中存放,按规定处理。 四、需要在急诊室、病区护士站等场所临时储存药品、医疗器械的,应当配备药品、医疗器械储存专柜。对需要冷藏的药品、医疗器械,应当配备相应设备。 五、保持药品、医疗器械存放区的清洁卫生,做好防潮、防腐、防污染、防虫、防鼠等工作。 六、医疗机构应当定期对药品、医疗器械进行检查与养护,对储存设施设备进行定期维护。 药品医疗器械采购验收制度 一、购进药品应以保证药品质量为前提,向合法的企业购进药品。 二、首次从药品、医疗器械生产企业采购药品、医疗器械的,应当查验《药品生产许可证》、药品批准证明文件或者《医疗器械生产企业许可证》、医疗器械产品注册证书;首次从药品
医疗器械营销感受 作为经历过两类医疗设备的企业的我,曾经目睹和参与其营销演变历程,从一个市场经理的角度谈谈自己的一些感受,希望与同行们沟通探讨。有关这类设备的营销经验尚未见有高手专著,甚至零星的心得体会之类的文章也寥寥无几。因此,本文作为引玉之砖奉献给大家。 现代营销学之父菲利普.科特勒(Philip.Kotler)肯定没有认真研究过大型医疗设备营销。事实上,营销作为一种理论对这类企业没有直接的应用价值。当大型医疗设备诞生之际,其产品、价格、销路和推广模式也随之确定,基本上没有营销说话的余地,只有执行操作的本份。技术导向始终处于主导地位,通常是一种医疗技术经过工程包装就成了医疗设备,然后通过销售人员推销到医院使用即可。大型医疗设备技术之复杂,导致每一次改进和提高都需要伤筋动骨。因此,所谓市场导向被迫处于次要和从属地位。在整个营销过程中,最具能动性的是销售人员能力。因此,这类企业最活跃的是销售人员,其次才是市场、策划、方案、管理。三年不开张,开张吃三年,独特的盈利模式使得这类企业并不像其他企业一样,对销售业绩孜孜以求,斤斤计较。在强大的资本支持下,甚至可以采取投放模式,将市场占有率放在企业盈利之先。这是其他大型设备所不具有的特点。 然而,真理就是真理。现代营销学作为人类营销经验的提炼和总结,必定有其深刻的道理,尽管其基础是大宗消费品营销的研究。营
销理论的指导意义不仅在于帮助营销经理起草一份“规范的营销计划书”,更重要的是能够活学活用之,面对新情况建立起正确的营销战略思维。很多从事医疗设备销售多年的老手,往往对理论和方案不屑一顾,心中只有两个最重要的东西:客户和提成。这种心态,也深深影响了这类企业的决策者和管理层,所以营销作为一个部门和职能完全不重要,有的企业甚至连与营销、销售或市场沾边的部门都没有,只有安装、调试、售后服务是经常与客户联系的部门。所谓战略、思路、理念、组织都是可有可无的,特别是经济效益还不错的时候。因此,缺乏营销战略思维是这类企业的普遍现象,但这并不影响其照常运作,因为经验是最好的导师,“学着别人做”成为最有效的行动方针。 以下从一些营销常用概念谈谈大型医疗设备营销: 需求与客户 很多医疗设备销售人员说,医疗设备销售其实很简单,只要搞掂3个人就行:主管院长、设备科长和科主任。这话确实一点也不错,尤其是中国的市场环境下。客户通常指购买单位—医院。与大宗消费品不同,大型医疗设备购买决策者和临床使用者是分离的,这使得客户涵盖范围比较复杂。基于营销属于需求管理过程这一原理,我认为大型医疗设备的客户概念应定义在医师、患者及互动(治疗)过程范畴,满足这种需求是产品核心价值所在;而带给院长、设备科长等购买决策者的是产品的附加价值,如设备的档次、声誉、品牌、行业地位、经济和社会效益等等。
医疗器械产业行动计划
随着我国居民经济生活水平的提高,其对医疗保健的意识逐渐加强,因此对医疗器械产品的需求也在不断攀升,因此下游需求空间的快速扩容使我国医疗器械行业的市场规模得到快速增长,并且在各类细分市场中,影像诊断领域的医疗器械产品销售业绩最好。尽管我国医疗器械行业市场容量扩张速度快,但由于相关基础科学和制造工艺的落后,其国产医疗器械产品仍集中在中低端品种,高端医疗器械主要依赖进口。《中国制造2025》的提出,预示着我国医疗器械行业的转型升级正在加快,研发趋势也正在向国际靠拢。 改革开放以来,相关产业得到较快的发展,整体素质明显提高。随着我国工业化和城镇化进程的加快,相关产品及服务消费将继续保持较高的水平,产业也将进入新的发展时期。 为加快区域产业结构调整和优化升级,依据国家和xx省产业发展规划,结合区域产业xx年发展情况,制定该规划,请结合实际情况认真贯彻执行。 第一章发展思路 牢固树立创新、协调、绿色、开放、共享的发展理念,在区域一体化协同发展的大背景下,紧紧抓住供给侧结构性改革重大机遇,主动适应产业发展趋势,加快优势产业发展转型升级,提升示范引领产
业发展协同发展的能力,使区域产业发展在更好地服务经济建设中实现提质增效。 第二章指导原则 1、协同推进。以区域协同发展为契机,找准产业发展定位和发展方向,完善产业协同创新体系,积极对接本地创新资源和优质产业,主动延伸产业链条,构建具有国际竞争力的产业集群和产业链,促进产业结构优化升级和协调发展,打造产业创新中心。 2、系统推进,突出重点。在推进产业发展的过程中,充分考虑细分领域的差异性,按照合理分级、梯度推进,整体强制、部分先行的原则,从整体上推动产业发展,并注重集中资金和政策,支持行业重点项目率先突破。 3、坚持融合发展。推进业态和模式创新,促进信息技术与产业深度融合,强化产业与上下游产业跨界互动,加快产业跨越式发展。 4、坚持创新驱动。依托企业、高校、科研院所打造一批省级、国家级产业技术创新平台,推动新技术、新产业、新业态的发展,通过全面创新培育新的增长动力,形成新的经济增长点。 第三章产业环境分析
精心整理 药品和医疗器械管理制度 药品、器械管理制度 1、认真贯彻执行《药品管理法》、《医疗器械监督管理条例》等法律法规和各项质量管理制度,药品和医疗器械从上级医疗机构统一配送。 ?2?3?4?5?6药品医疗器械储存养护制度 ????一、医疗机构应当设立与其规模相适应的药房(药库)。药房(药库)应当与生活、办公和医疗区域分开,并具备必要的避光、通风、防虫、防鼠条件以及温度、湿度控制设备。?? ????二、药品、医疗器械应当按照产品说明书标明的储存条件,分别存放于常
温区(库)、阴凉区(库)、及冷藏区(库)。并监测和记录储存区域的温度、湿度,每日上、下午各记录一次温湿度,并根据温湿度情况采取相应的措施。? ?????三、药品、医疗器械储存陈列应分类存放。中药材、中药饮片应当与其他药品分开存放;过期、变质、失效等不合格的药品、医疗器械应当集中存放,按规定处理。??? ????四、需要在急诊室、病区护士站等场所临时储存药品、医疗器械的,应当 设备。 ???? ???? ?????? ????《药 器械的,应当查验《药品经营许可证》、药品批准证明文件或者《医疗器械经营企业许可证》、医疗器械产品注册证书。?? ????三、采购进口药品,应当查验药品进口批准证明文件和进口检验质量报告书;采购进口医疗器械,应当查验医疗器械进口注册证书,有进口质量检验要求的,应当同时查验进口检验质量报告书。?? ????四、购进的药品、医疗器械必须及时进行验收,并做好验收记录。?? ????五、药品验收记录应当包括药品通用名称、规格、批号、有效期、生产厂
商、供货单位、购货数量、购进价格、购货日期、验收日期、验收结论等内容。?? ????六、医疗器械验收记录应当包括产品名称、规格型号、产品批号(生产日期)、生产厂商、供货单位、购货数量、购进价格、购货日期、验收日期、验收结论等内容;有灭菌批号、有效期的,应当记录灭菌批号、有效期;医疗仪器、设备的验收记录还应当包括相关配置和技术性指标。?? ????七、验收记录由验收人员签字或者盖章后,归档保存。验收记录以及相关 ???? ?? ???? 作。?? ???? 章。? 或者重新开具处方;认为处方存在不合理用药或者用药错误时,应当拒绝调配,及时告知处方医师,并按照有关规定书面报告。?? ????四、配发药品应当按照诊疗规范的要求,并在交付药品时提供用药指导。配发儿童使用药品的,应当详细说明服用方法和注意事项。? ????五、使用医疗器械应当按照使用说明书的要求。?一次性使用的医疗器械不得重复使用,对已经使用过的,应当按照国家有关规定予以处理,并作出记录。?????
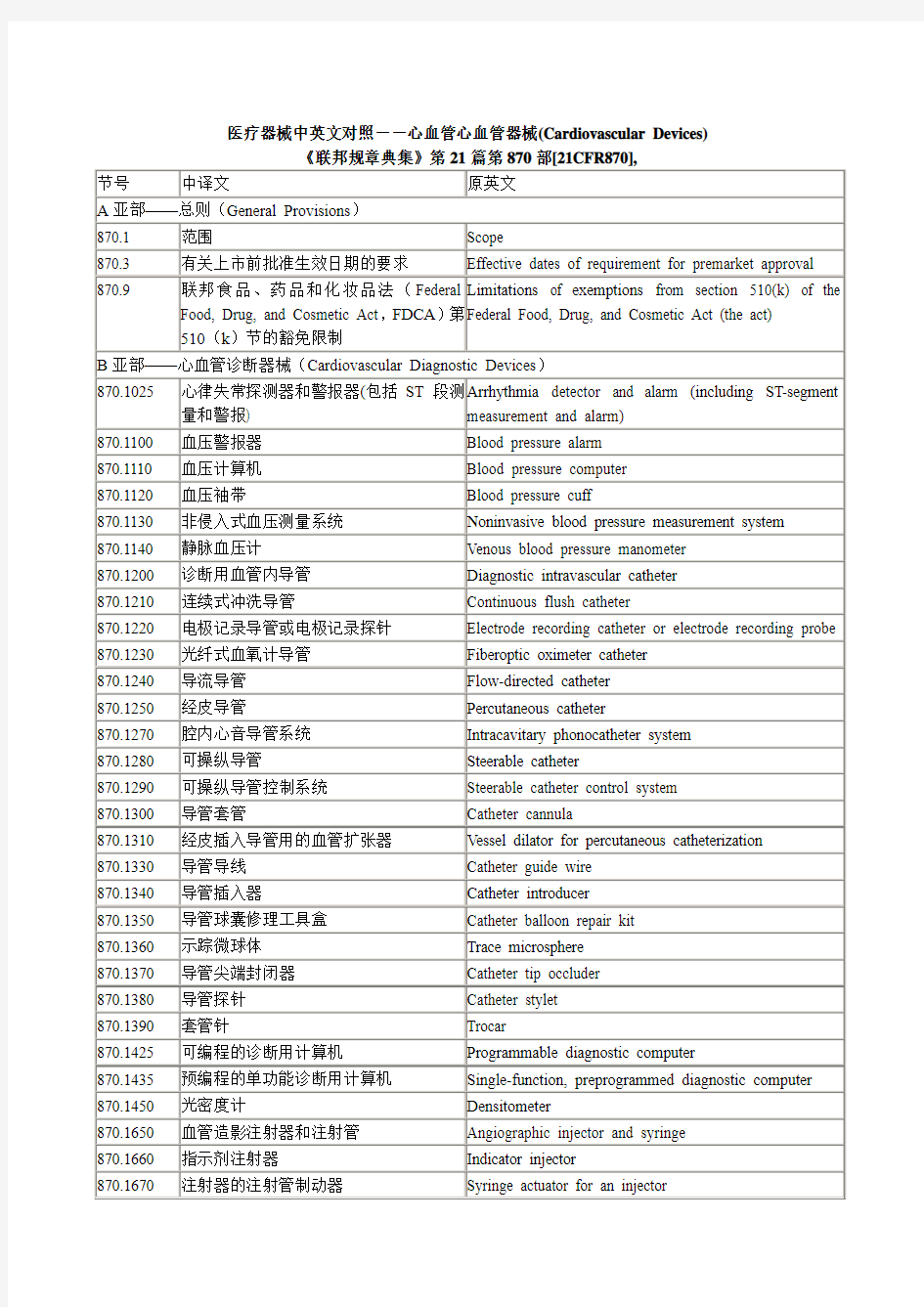
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 中英对照——心血管器械 心血管器械心血管器械 Cardiovascular Devices 节号中译文原英文 A 亚部总则(General Provisions) 870.1 范围 Scope 870.3 有关上市前批准生效日期的要求Effective dates of requirement for premarket approval 870.9 联邦食品、药品和化妆品法(Federal Food, Drug, and Cosmetic Act, FDCA)第 510(k)节的豁免限制 Limitations of exemptions from section 510(k) of the Federal Food, Drug, and Cosmetic Act (the act)B 亚部心血管诊断器械(Cardiovascular Diagnostic Devices)870.1025 心律失常探测器和警报器(包括 ST段测量和警报)Arrhythmia detector and alarm (including ST-segment measurement and alarm) 870.1100 血压警报器 Blood pressure alarm 870.1110 血压计算机 Blood pressure computer 870.1120 血压袖带 Blood pressure cuff 870.1130 非侵入式血压测量系统Noninvasive blood pressure measurement system 870.1140 静脉血压计 Venous blood pressure manometer 870.1200 诊断用血管内导管 Diagnostic intravascular catheter 870.1210 连续式冲洗导管 Continuous flush catheter 870.1220 电极记录导管或电极记录探针 Electrode recording catheter or electrode recording probe 870.1230 光纤式血氧计导管Fiberoptic oximeter catheter 870.1240 导流导管 Flow-directed catheter 870.1250 经皮导管 1 / 8
药品和医疗器械管理制度
药品、器械管理制度 1、认真贯彻执行《药品管理法》、《医疗器械监督管理条例》等法律法规和各项质量管理制度,药品和医疗器械从上级医疗机构统一配送。 2、检查验收人员应按有关规定,对入库药品和医疗器械内、外包装、标签、说明书和外观质量,进行逐批检查验收,不得漏验。 3、特殊管理药品应由两人共同检查验收;麻醉药品和一类精神病药应由两人逐盒检查验收到最小包装,填写完整的验收记录,并双人签字。 4、已检查验收质量合格的药品和医疗器械,验收人员办理药品和医疗器械入库手续,并签名或盖章。 5、经检查验收认为不合格的药品和医疗器械或质量有疑问的药品和医疗器械按有关规定处理。 6、按规定认真做好药品和医疗器械质量检查验收各项记录,内容包括:到货日期、药品和医疗器械名称、规格、剂型、数量、批号、有效期、生产企业、批准文号、质量状况、验收结论、验收人等,记录应整洁,真实、完整,不得撕毁或任意涂改,记录应妥善保存五年。
药品医疗器械储存养护制度 一、医疗机构应当设立与其规模相适应的药房(药库)。药房(药库)应当与生活、办公和医疗区域分开,并具备必要的避光、通风、防虫、防鼠条件以及温度、湿度控制设备。 二、药品、医疗器械应当按照产品说明书标明的储存条件,分别存放于常温区(库)、阴凉区(库)、及冷藏区(库)。并监测和记录储存区域的温度、湿度,每日上、下午各记录一次温湿度,并根据温湿度情况采取相应的措施。 三、药品、医疗器械储存陈列应分类存放。中药材、中药饮片应当与其他药品分开存放;过期、变质、失效等不合格的药品、医疗器械应当集中存放,按规定处理。 四、需要在急诊室、病区护士站等场所临时储存药品、医疗器械的,应当配备药品、医疗器械储存专柜。对需要冷藏的药品、医疗器械,应当配备相应设备。 五、保持药品、医疗器械存放区的清洁卫生,做好防潮、防腐、防污染、防虫、防鼠等工作。 六、医疗机构应当定期对药品、医疗器械进行检查与养护,对储存设施设备进行定期维护。
Intervention · implant · Thematic Forum 介入器械分类及其发展趋势 刘洋1吴远浩2郑玉峰1,2奚廷斐2 1 北京大学工学院材料科学与工程系(北京 100871) 2 北京大学前沿交叉学科研究院生物医用材料与组织工程中心(北京 100871) 文章编号:1006-6586(2014)09-0001-08 中图分类号: R318.08 文献标识码:A 收稿日期: 2014-07-08 根据世界卫生组织的数据,心血管疾病是全球的头号死因,在2008年,有约1730万人死于心血管疾病,占全球死亡总数的30%。到2030年心血管疾病将造成大约2500万人死亡[1]。由于人口老龄化以及社会经济发展带来居民饮食结构的改变,我国心血管疾病发病率逐年提高,中国正成为心脑血管疾病发病率最高的国家之一,因此,在相当长的一段时间内,心脑血管疾病的有 内容摘要:根据世界卫生组织的数据,心血管疾病是全球的头号死因,到2030年心血管疾病将造成 大约2500万人死亡。由于人口老龄化以及社会经济发展带来居民饮食结构的改变,我国 心血管疾病发病率逐年提高,中国正成为心血管疾病发病率最高的国家之一。因此,在 相当长的一段时间内,心脑血管疾病的有效治疗都将会是一个重大命题。介入治疗具有 介入创伤小、手术危险小、疗效明显等特点,成为治疗心脑血管疾病的主要治疗方式。 本文回顾了介入治疗装置及器械的发展现状,对国际产业发展趋势进行介绍,同时对国 内介入治疗产业发展面临的机遇与挑战进行分析。 关键词:介入装置及器械微创发展趋势预测 The Classification and Development Trend of Interventional Medical Devices LIU Yang1 WU Yuan-hao2 ZHENG Yu-feng1,2 XI Ting-fei2 1 Engineering college of Beijing university department of materials science and engineering (Beijing 100871) 2 Center for Biomedical Materials and Tissue Engineering, Academy for Advanced Interdisciplinary Studies, Peking University (Beijing 100871) Abstract: According to the statistics from WHO, cardiovascular diseases have become the leading cause of death and about 25million people will die from cardiovascular disease around the world by 2030. In China, the morbidity of cardiovascular disease rises year by year due to ageing populations, as long as the changes of dietary structure with economy development. Interventional therapy is the most popular way for cardiovascular disease nowadays with the advantage of minimal invasiveness, low surgical risk and good curative effect. In this paper, we reviewed the development of interventional therapy devices, analysis and predict the current statue and tendency of global interventional therapy device industry. Key words: interventional devices, minimal invasiveness, tendency, prediction 1.介入医学工程器械分类及其发展情况 . 1 China Medical Device Information |中国医疗器械信息
医疗器械销售行业每年以14%~15%的增长率迅速发展 医疗器械行业具有知识密集和资金密集的特点。 但是产品价格高,使用周期长,客户要求严 在销售医疗器械之前,先了解客户的组织结构和工作程序,可以帮助我们理顺工作顺序和工作重点。 一、医疗器械的采购程序: 1、组织结构 使用科室申请采购(申请方式:口头要求、书面呈述,填写采购申请)。 院长决策(分管院长)或者是院长会。 器械科执行,(部分是科室自己采购,到器械科报帐)。 2、采购程序 2.1低值易耗医疗器械采购 耗材采购,对正用的耗材,谁用谁做计划,报器械科或设备科采购。 其它品牌的耗材选用,需要使用人建议,所在科室领导同意,报给器械科或者呈报到院长那里,院长批准后小批量采购试用。 2.2常规使用的小设备采购(万元以下的设备) 由科室做消耗计划,报设备科采购。 2.3大设备的采购(每个医院,对大设备的限定不一样。) 基本程序: 科室主任根据临床诊断治疗和科室经营的需要,对新项目进行论证和定计划,判断临床价值和经济价值; 决定因素是经济和临床价值以及科室能否开展这个项目。 销售人员必须把相关的内容传导给主任,并帮助主任制定一个合理的方案。如果科主任认为上这个项目可以获得临床和经济价值,并认可你的公司价值观和服务,以及对你个人的信任和认可,就会按照程序填写申请购买表,递到器械科(特殊情况是递给院长);或者先与院长沟通以后,获得许可才书写申请。 医院根据当年采购计划,按常规处理;或者根据你的工作力度,进行相应处理。由院长批准或院长会或采购办批准后,交器械科采购。 器械科长会根据产品情况选择一家或多家供应商进行多次谈判。如工作做的好,很快就会和院长或医院谈判委员会进行谈判,确定合同细节。 还有一个情况,当医院采用其它途径的资金来购买,会把项目提供给出资金的单位或组织,由他们和供应商谈判。比如政府拨款,外国政府或社会捐赠,企业医院由上级部门拨款,还有许多外国政府贷款。不同的资金来源决定你的成单时间和方式以及回款。 二、销售的基本模式: 1.分析各类客户心理 目前,医用器械的销售方式可大致分为三种: 一是社区定点或不定点销售,俗称“跑腿式”。
医疗器械的现状和基本知识 医疗器械行业是一个多学科交叉、知识密集、资金密集型的高技术产业,进入门槛较高,是高利润和高附加值产品。在发达国家,医疗设备与器械产业和制药业的产值大体相当。而在我国,医疗器械的产值只是制药的1/5,这种比例的严重失调预示着医疗器械产业在我国还有巨大的发展空间,行业前景广阔。 一、医疗器械行业发展现状 中国医疗器械工业是在1949年以后逐步发展起来的,主要经历了三个阶段:一是仿制,从建国初期到上世纪80年代初期;二是合资引进技术,从上世纪80年代到90年代中期;三是创新,从上世纪90年代中期开始到现在,从自主设计到自主创新(在目前注册产品中占约15%)。中国的医疗器械产业虽然基础差。底子薄,但是近年来发展很快。目前世界医疗器械产业年增长率在5%-8%,中国则达到13%-15%(同期经济增长约为9%)。医疗器械生产企业2008年底达到13,141 家,非公有制经济类型占99%以上,产值过亿的企业中外资、合资企业占半数以上。2008年全行业实现生产总值2200亿元,同比增长15%;工业销售:2100亿元,同比增长15%;实现利润:超过200亿元,同比增长15%;产值过亿的企业超过120家。 目前形成了三大医疗器械生产区:1、珠江三角洲区域:广东、深圳;2、长江三角洲区域:苏、浙、沪;3、环渤海湾区域:京津。截止2007年底共批准医疗器械注册55,682件,其中:进口器械14,419件,国内医疗器械52,321件,其中:I&II类:42,864件,III类:9215 件,港澳台:242 件。截止2007年底,全国持有《医
疗器械经营许可证》的公司近160,952家,医疗器械经营企业最多的是北京超过13000多家。 二、我国医疗器械行业存在的问题 (一)高端产品主要依赖进口 医疗器械产业是事关人类生命健康的新兴产业,许多医疗器械是医学与多种学科相结合的产物,其发展水平代表了一个国家的综合实力与科学技术发展水平。高技术医疗设备产业是当今世界发展最快的产业之一,仅大型医疗设备每年的市场规模就达100多亿元,但国际高技术医疗设备市场,主要被美国、日本、德国等少数国家的几个跨国公司垄断。 由于我国医疗器械市场竞争能力不足,我国的医疗器械研发力量远远不能满足医疗器械产业发展的需求。目前,我国医疗器械产品只占国内医疗器械市场年容量的50%~60%,进口产品大量占据国内市场。相关调查报告显示,目前我国药品与器械人均消费比例仅为10:1,而目前发达国家人均医药卫生消费药品和器械的比例已达到1:1。我国医疗器械行业存在的问题,主要是研发能力不足、创新能力薄弱、研究设备和基础条件差、研发投入不足、科技成果转化能力薄弱。 (二)进口设备开发利用率低 由于我国对于临床工程没有规范的立法和认证制度,而且一些医院为了提高声誉和收益,盲目攀比,超前配置各种大型医疗设备,造成设备使用率低、资源浪费。目前各大医院普遍存在着仪器设备引进购置与应用开发、效益评估脱节的情况。我国三甲医院的医疗设备是全球最先进的,但管理却很不到位。诸如CT等仪器的功能开发率
心血管介入考试器械植 入模拟题 Document serial number【KKGB-LBS98YT-BS8CB-BSUT-BST108】
心脏起搏器植入与除颤治疗 一、单选题 1)感知安全界限是多少(A) a)>2.0 b)>1.0 c)>3.0 d)>5.0 2)起搏器置入时对心房P波振幅的要求( 3)C) 4) a)>1.5mV b)>1.0mV c)>2.5mV d)>2.0mV 5)起搏器置入时对心室R波振幅的要求(B) a)>3.5mV b)>5.0mV c)>6.5mV d)>8.0mV 6)以下哪种情况属于交叉感知(D) a)感知T波 b)感知极化电位 c)感知肌电位 d)双腔起搏器中感知另一个通道的刺激信号 7)以下关于PMT哪一个是正确的(B) a)任何起搏器都可能发生PMT b)PMT是双腔起搏器特有的并发症 c)药物是最常用终止发作的方法 d)传导阻滞的患者不会发生PMT 8)安全起搏是为了避免以下哪种情况(A) a)心室交叉感知 b)心房交叉感知 c)电池电量下降 d)电磁干扰 9)安全起搏时AV间期通常设置值是多少(B) a)依心率情况而定 b)110-120ms c)120-130ms d)130-150ms 10)以下哪种情况可以鉴别电极导线断裂和绝缘层破裂(C)
a)起搏功能障碍 b)感知功能障碍 c)电极导线阻抗改变 d)起搏方式改变 11)以下哪种方法可以避免肌电干扰(A) a)使用双极感知 b)使用双极起搏 c)使用单极感知 d)使用双极起搏 12)起搏器植入术后早期感染多由以下何种细菌引起( 13)A) 14) a)金黄色葡萄球菌 b)草绿色链球菌 c)表皮葡萄球菌 d)绿脓杆菌 15)起搏器植入术后后期感染多由以下何种细菌引起( 16)C) 17) a)金黄色葡萄球菌 b)草绿色链球菌 c)表皮葡萄球菌 d)绿脓杆菌 18)以下哪个不能被作为频率适应性起搏的感知器(D) a)体动感知器 b)加速度感知器 c)经胸阻抗感知器 d)中心静脉压感知器 19)以下哪个不是起搏器随访的目的(D) a)了解起搏器工作状况 b)发现起搏系统故障和功能异常 c)个体化起搏参数,最大限度满足患者需要 d)参加临床实验的要求 20)以下哪些检查不被用于起搏随访(D) a)心电图 b)动态心电图 c)胸片 d)CT 21)以下哪个不是起搏器程控的目的(D) a)个体化起搏参数 b)通过程控优化血流动力学 c)诊断、处理故障 d)了解起搏器型号 22)以下哪个是按压程控仪上紧急起搏键(Emergency)后的工作方式 (A)