
不合格品处理情况汇总分析表
西安市建设工程质量安全监督站 建筑工程不合格检测报告监督处理办法 一、目前需监督处理的建筑工程不合格检测报告 1、混凝土抗压强度不合格报告; 2、钢筋原材检验不合格报告; 3、钢筋焊接检验不合格报告。 二、监督处理依据 1、《混凝土结构工程施工质量验收规范》(GB50204-2002); 2、《混凝土强度检验评定标准》(GB/T50107-2010)。 三、需进行监督处理的混凝土抗压强度的界定和范围 《混凝土强度检验评定标准》(GB/T50107-2010)规定,按照样本容量大小,允许混凝土抗压强度的最小值低于标准值一定范围,其中当样本容量小于10组时,混凝土抗压强度的最小值不得低于标准值的95%。 因此,当标准养护或同条件养护的混凝土试件的抗压强度值低于其标准值的95%时,进行监督处理;而且,处理范围限定在该混凝土试件所在的同一批次浇筑的混凝土构件。 四、监督处理程序 1、混凝土抗压强度不合格报告的监督处理程序 '.
标养试块抗压强度低于95%标准值 检查对应部位的同养试块抗压强度 同养试块抗压强度不低于95%标准值同养试块抗压强度也低于95%标准值或无同养试块 混凝土结构实体判为合格 同养试块抗压强度 也低于95%标准值 委托市检测中心对 该批次浇筑的混凝 土构件强度进行检 测鉴定 混凝土检测鉴定结 果达到设计要求 处理完毕 混凝土结构实体判 为合格 混凝土检测鉴定结 果未达到设计要求 将相关数据报设计 单位进行核算 设计单位核算确认 仍可满足结构安全 和使用功能 处理完毕 设计单位核算不能 满足结构安全和使 用功能 处理完毕进行加固处理 加固结果经设计单 位和加固设计单位 共同确认 处理完毕
不合格药品确认及处理程序 1、为加强对不合格药品的管理,防止质量事故的发生和不合格药品流入市场,保证人民用药安全有效。质量管理小组负责不合格药品的确认、通报、查询、报损和监督处理。 2、上报 2.1验收人员在验收时发现质量可疑药品,通知质量管理小组确认,可疑药品暂时停止入库; 2.2养护员、保管员在工作中发现有质量可疑药品,挂“黄色暂停发货牌”,填写《药品质量复查报告单》上报质量管理小组确认; 2.3销售、使用人员在销售工作中发现质量可疑药品,暂时停止销售、使用,将样品送质量管理小组,质量管理科到现场取样、检查; 2.4质量管理小组在质量检验中发现不合格药品,应立即通知保管员将不合格药品放入不合格区; 2.5食品药品监督管理部门在检查和抽检中发现不合格药品,保管员应立即将其放置到不合格药品区。 3、确认 3.1依据 a、根据《中华人民共和国药品管理法》对假药或劣药的介定; b、法定药检所的检验报告书; c、国家食品药品监督管理部门下达的有关药品质量方面的文件、通知、质量通报等; d、《中华人民共和国药典》。 3.2确认程序 a、质量管理小组接到《药品质量复查报告单》后,在1个工作日内到现场复查,当不能确认时送市药检所检验; b、确认后,由质量管理科在《药品质量复查报告单》上填写复查情况和质量复查结论及处理意见。 4、追回。不合格药品确认后,立即组织人员将出库或已销售的不合格的药品追回。 5、保管。将库存和追回的不合格药品通知保管员放入不合格区,并做好不合格药品记录。记录内容:日期、品名、规格、数量、生产厂商、批号、质量情况、质量管理人员签字等。 6、报损。半年或一年一次,质量管理员填写不合格药品报损表,报损表上应有财务科、质量管理科、业务科负责人签写意见,然后上报分管质量领导批准。 7、销毁。批准销毁的药品由业务科室人员、保管员、质量管理科参加,邀请食品药品监督部门监督销毁。质量管理小组做好销毁记录。记录内容:品名、规格、数量、批号、生产厂商、销毁原因、销毁方法、销毁地址、监督人、时间等。 8、总结。对不合格药品进行汇总、分析,找出原因,制定防范措施。 9、流程图
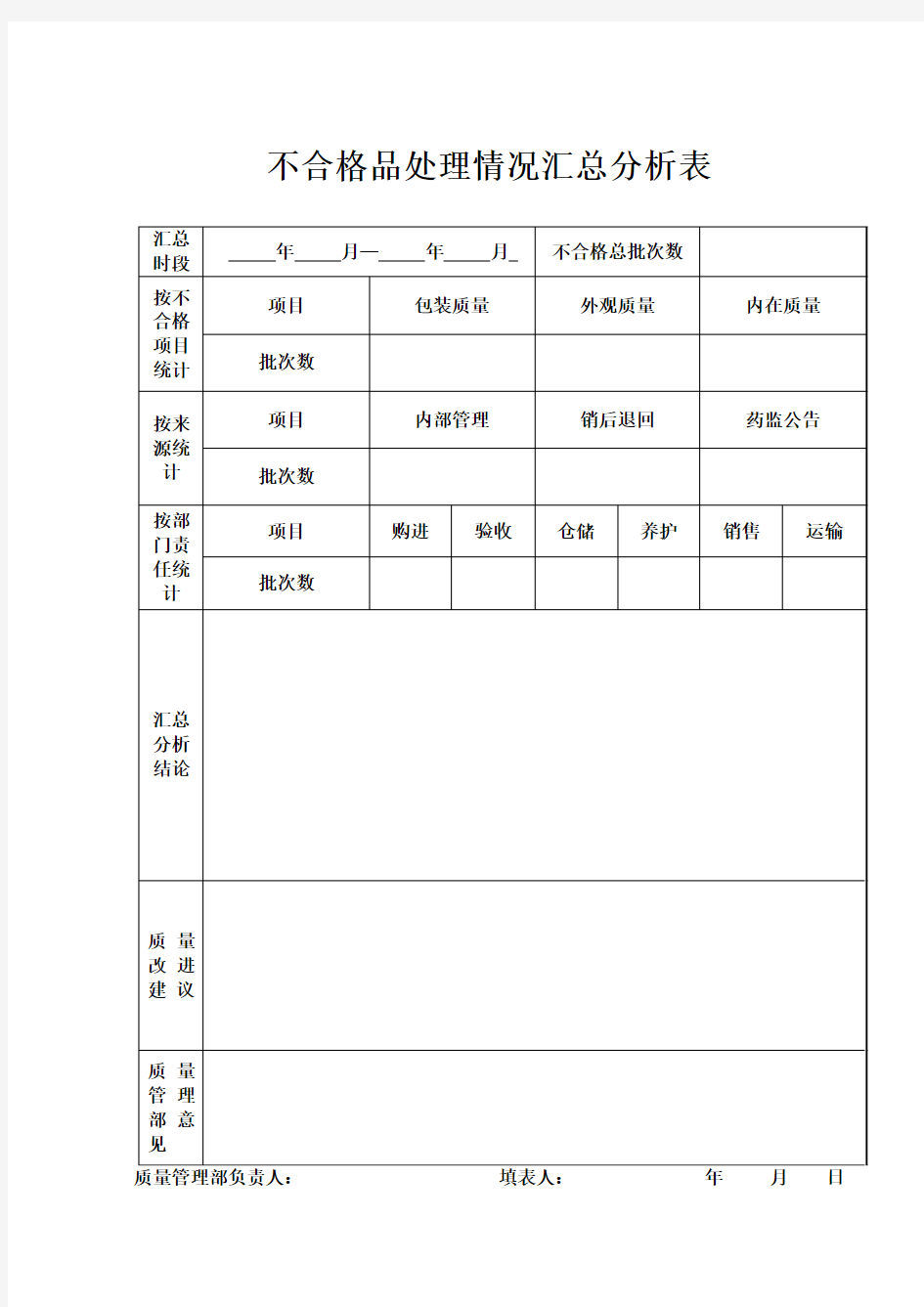
1 目的 为了对不合格药品实行严格管理,杜绝购进和销售不合格药品,特制定本制度。 2 适用范围 本制度适用于本公司各经营环节发现的所有不合格药品处理控制的全过程。 3 依据 《中华人民共和国药品管理法》及其实施条例。 《药品经营质量管理规范》(国家食品药品监督管理总局令第13号)。 《药品说明书和标签管理规定》等。 4 内容 职责 4.1.1 质量管理部负责对公司经营全过程发现的不合格药品实行有效控制管理。 4.1.2 仓储部部长或保管员负责落实不合格药品的有效控制和保管。 不合格药品的判断依据 4.2.1《中华人民共和国药品管理法》及其实施条例。 4.2.2《药品说明书和标签管理规定》。 4.2.3各级食品药品监督管理部门发文通知禁止销售的药品。 4.2.4各级食品药品监督管理部门公告抽检不合格的药品。 不合格药品的定义:凡与法定的药品质量标准及以下有关规定不符的药品均属不合格药品,包括:4.3.1药品的内在质量不符合国家法定质量标准及有关规定的药品; 4.3.2药品的外观质量不符合国家法定质量标准及有关规定的药品; 4.3.3药品包装、标签及说明书不符合国家有关规定的药品。 不合格药品的范围界定:包括内在质量不合格、外观质量不合格药品和包装不合格药品。 4.4.1内在质量不合格是指药品本身发生了物理变化或化学变化的药品,在本制度中是指质量管理部依据药品监督管理部门的质量公告及药品抽检结果而确认的不合格药品。 4.4.2 外观质量不合格是指药品出现破损、污染、变形、批号不清、标签破损或脱落等情况。 4.4.3 包装不合格是指包装不符合《药品说明书和标签管理规定》的药品。 不合格药品的认定:有以下情况之一的可确认为不合格药品: 4.5.1 在验收、陈列药品质量检查及销售过程中发现的外观质量及包装质量不符合法定质量标准的药品,如药品过期、失效、霉烂、变质、包装破损、污染、变形、批号不清、标签破损或脱落等情况; 4.5.2 各级食品药品监督管理部门公布的抽检检验不合格的药品; 4.5.3 各级食品药品监督管理部门发文通知禁止销售的药品; 4.5.4 质量管理部确认的不合格药品; 不合格药品的处理按照《不合格药品确认和控制处理操作规程》进行,不合格药品一经确认,应认真查清原因,明确责任。 质量管理部负责对不合格药品调查并分析原因,填写《不合格药品汇总分析记录表》,找出质量管理工作中的缺陷,改进和完善质量管理控制过程,有效地杜绝类似问题的再次发生。
不合格品处理办法Q/ZS-C 质 14-2016B 1.目的 本办法是根据《不合格品控制程序》规定,对“不合格品”处理的方式、方法进行了细化和补充,规定了相关部门在处理不合品过程中的职责,以防止不合格品的非预期使用或交付,确保产品质量符合规定要求。 2.适用范围 适用于公司所有自制加工件、生产半成品、生产成品、采购物料、 外购外协零部件、售后返回物料、营销返回生产成品等过程所出现的不合格品的处理。 3.职责 3.1质量部 3.1.1质量部负责不合格的识别,对自制加工件、生产半成品、生产成品、采购 物料、外购外协零部件、售后返回物料、营销返回生产成品等进行检验和判定,并出具检验报告或《不合格品报告单》(见附录 A)交给报检部门。 3.1.2对检验和判定的不合格品,提出初步处理建议。 3.1.3对于能判定立即返工或返修的少量一般不合格品,可要求加工部门立即 进行返工或返修,做好检验记录。返工、返修后的产品必须二次检验,做好检验记录。 3.1.4负责召集研发部、生产部对顾客退回的产品(设备)根据《退货产品处理 单》进行评审,落实责任及预防纠正措施。 3.1.5负责的对顾客退回的产品(设备)拆解零部件,合格及报废的判定。 3.1.6质量部质量分析师按月对《不合格品报告单》内容进行统计分析,总结不 合格类别、比例、发展趋势,为质量专题会提供质量改进和预防的依据。
3.1.7负责跟踪不合格品的处理结果和纠正措施执行情况。 3.2生产部 3.2.1生产加工制造过程中,要严格执行“三按”,“三检”和“三自一 控”,严格执行工艺纪律。 3.2.2负责对公司生产制造和装配的零部件和产成品例行报检。 3.2.3负责对生产过程中发现和产生的不合格品进行标识、隔离。 3.2.4负责对生产加工制造过程中发现和产生的不合格品,按规定办理相关手续, 进行处理。 3.2.5负责对生产加工制造过程中发现和产生不合格品,采取纠正和 预防措施。 3.2.6生产装配过程中发现的不合格品,进行报(复)检,填写现场物资验证 单,由质量判定,在采购供应部仓库办理零部件退换。 3.2.7对于质量部质检员要求返工或返修的不合格品,安排责任者立即进行返工 或返修,做好自检互检记录和二次交验。 3.2.8负责对生产加工制造过程中出现的不合格品按月进行统计汇总, 及不合格品损失核算。 3.2.9不合格品统计汇总核算表,每月报总经办和质量部,纳入绩效考核。 3.2.10在质量部组织评审后,协助对顾客退回的产品(设备)进行维修或拆解 为零部件,由质检人员登记填写《退回产品零部件拆解清单》,清单中应包括零件图号、名称、数量等,在清单备注栏中注明合格或报废;生产部协助将合格或报废零部件送仓库,仓库办理入库手续并归类存放。) 3.3研发部 3.3.1研发部应提供完整、正确、统一的产品图纸技术文件和相关验收技术标
建筑工程不合格检测报告处理汇总表 工程名称 嘉乐城·A4地块商住用房 签字 建设单位 苏州市嘉得宝置业有限公司 项目负责人 施工单位 吴江市建设工程(集团)有限公司 项目经理 监理单位 江苏建信工程监理咨询有限公司 总监理工程师 序号 不合格项名称 代表 部 位 报 告 编 号 处理结果 报 告 编 号 31 砼试块C30 10#楼27-58轴十七层 墙柱 E03210411515372 回弹 E03220421500330 32 水泥混合砂浆试块M7.5 5#楼一层内墙抹灰 E03210451504930 实测 E03221641600012 33 水泥砂浆M15 10#楼5层、6层厨房卫生间内墙抹灰 E03210451600121 实测 E03221641600013 34 砼试块C45 地下室底板后浇带 E03210411521546 E0321041152154 7 回弹 E03220421600007 35 水泥混合砂浆试M10 地下室10-1~10-58轴 E03210451500865 贯入法检测 E03220611600004 36 砼试块C25 10#楼十二层二次结 构 E03210411521677 回弹 E03220421600134 37 砼试块C45 地下室顶板后浇带 E03210411521909 E03210411521910 回弹 E03220421600135 38 电渣压力焊 10#楼27-58轴十七层 墙柱 E03210221502546 双倍复试 E03210221502614 39 复合材料保温板300*300*40 1#楼10#楼外墙保温 E03221311500246 复试 E03221311600164 40 复合材料保温板300*300*40 1#楼10#楼外墙保温 E03221311500247 41 复合材料保温板300*300*40 1#楼10#楼外墙保温 E03221311500248 42 砼试块C40 9#楼1-7层八层顶板 E03210411515664 同条件拆模 43 砼试块(同条件) 2#7#地下室外墙 E03210411428400 44 砼试块(标养) 2#7#地下室外墙 E03210411428164 注:建设单位、施工单位、监理单位签字盖章
不合格报告处理制度 对原材料、半成品及成品进行规定的检验,以保证工程质量符合要求。不合格产品严禁流入工程。相关规范规定检测材料,材料员、质检员应严格按照规定进行验收。检测不合格的材料,应登记在不合格材料检测台帐上,并按东莞市的相关规定进行上报。 相关材料检测及不合格材料处理: 1、热轧带肋钢筋每批应由同厂.同炉号.同级别.同规格.同生产工艺,同一进场时间,进入同一施工现场,每批重量不大于60T的钢筋组成;每批送样钢筋长度50cm的7根,30cm的2根。初次检测不合格时加倍取样进行复试,如复试合格则允许用于本工程,不合格应予以退场。 2、水泥,本工程所使用的水泥由宜兴市金墅水泥有限公司提供。水泥进场应提供水泥3天及28天强度检测报告、合格证等质量证明文件。进场后应由建设单位、监理单位、施工单位共同见证取样,并送检测单位进行检测,如检测不合格,将由建设单位、监理单位、施工单位加倍取样进行复试,如复试合格则允许用于本工程,不合格应予以退场。 3、砖每3.5万块为一批,每批次10块。初次检测不合格时加倍取样进行复试,如复试合格则允许用于本工程,不合格应予以退场。 4、砂检测应以在施工现场堆放的同产地,同规格分批验收,以400立方米或600吨为一验收批,不足上述数量者以一批计。对于一次进场数量较少,且随进随用者,当质量比较稳定时,可以一个月为一周期以400
立方米或600吨为一检验批,不足者亦为一个批次进行抽检。每次从8个不同部位,取样22kg。当砂初次检测不合格时,应加倍取样,如加倍取样仍不合格的,由材料员负责将不合格的砂进行退场,并通知监理甲方及上级主管部门。 5、砼试块砼试样应在砼浇筑地点随机取样。本工程使用苏州新天地混凝土公司的商品混凝土,每100m3取样一次,一组三块,不足100m3应取样一次。同条件试块应该在砼浇筑部位养护,当同条件试块达到等效养护龄期时,方可对同条件养护试件进行强度试验。所谓等效养护龄期,就是逐日累计养护温度达到600℃.d,且龄期宜取14d~60d。一般情况,温度取当天的平均温度;标准试块送至标准实验室进行养护,28天后进行强度试验。混凝土抗渗试块在连续浇筑混凝土量500立方米以下时,应留置一组抗渗试块,养护期不得少于28天。当混凝土试块检测不合格时,将通知监理甲方及上级主管部门,并请检测单位来鉴定并确认不合格检验批实物强度值是否符合要求,如符合,就可予以承认并通过验收;如不符合,由原设计单位根据实物强度复核能否满足安全与功能的最低要求,若仍达不到,将委托原设计单位,设计加固方案进行加固。 6、砂浆试块每一楼层或每250立方米砌体中各种强度等级的砂浆,取样不少于一次。每次取样标养试块至少留置一组,送至标准实验室进行养护,养护期为28天。当砂浆试块检测不合格时,将通知监理甲方及上级主管部门,并请检测单位来鉴定并确认不合格检验批实物强度值是否符合要求,如符合,就可予以承认并通过验收;如不符合,由原设计单位根据实物强度复核能否满足安全与功能的最低要求,若仍达不到,将委
广西建工集团第一安装有限公司建筑分公司 不合格信息数据统计分析报告 编写: 审核: 批准: 2010年6月30日
不合格品数据统计分析 分公司项目科于6月30日前收集了各项目部的不合格信息,并对不合格品的分布进行了统计,形成了分公司上半年不合格台帐,作为不合格品采取纠正措施和预防措施的信息输入。 上半年共收集不合格品信息项,从收集到有不合格信息来看,分公司的不合格信息主要存在以下几个方面: 1、成品保护工作未做好,加工完成的钢筋堆放不合理,浇筑完成的混凝土养护不及时。 2、钢筋绑扎安装时,施工人员不按规范操作,缺少垫块,钢筋加密不足,少数钢筋偏位等。 3、模板安装时,施工人员不按规范图纸施工,加固不当,楼层架子未按要求搭设,造成混凝土结构涨模、偏位等现象。 4、混凝土浇筑时,施工人员未按规范要求施工,或技术交底不足,振动棒振捣不足,造成部分混凝土结构出现蜂窝、麻面、露筋、烂根等现象。 5、在砌体施工中,施工人员未按规范要求施工,造成墙体砌块砂浆不饱满,或部分位置无砂浆等现象。 6、在装饰装修工作中,施工人员未按规范要求施工,抹灰不平直,墙面未修整。 造成以上不合格原因的分析: 1、施工人员工作责任心不强,对质量的意识不强,技术交底工作不到位,不按规范要求施工,作业时随意性大。 2、作业人员专业技术掌握不够,各的专业水平参差不齐。 3、现场监督检查力度不够,没能及时发现存在的质量问题,或者没能得到及时整改。
4、分公司的监管管理工作不到位。分公司、项目部对一些工序的要求在技术交底时不够细化,要求不严,对工程质量没能引起高度的重视。 5、对架子工这些专业性较强的工种培训力度不够。 针对以上产生不合格的原因,分公司拟采取以下纠正预防措施,避免今后此类不合格的重复发生。 1、分公司加强对项目部,项目部要加强对施工质量的检查力度。 2、对于经常出现及容易出现的质量问题,分公司编制成工程质量通病的预防措施,在工程开工前交底到项目部,项目部在施工前对作业人员做好技术交底。 3、对长期合作的劳务队组进行有针对性的培训。 通过对不合格信息的统计分析,掌握了不合格信息的动态及分布情况,为今后的工作确定了目标。 建分项目科 2011年7月1日
为了对不合格药品实行严格管理,杜绝购进和销售不合格药品,特制定本制度。 2 适用范围 本制度适用于本公司各经营环节发现的所有不合格药品处理控制的全过程。 3 依据 《中华人民共和国药品管理法》及其实施条例。 《药品经营质量管理规范》(国家食品药品监督管理总局令第13号)。 《药品说明书和标签管理规定》等。 4 内容 4.1 职责 4.1.1 质量管理部负责对公司经营全过程发现的不合格药品实行有效控制管理。 4.1.2 仓储部部长或保管员负责落实不合格药品的有效控制和保管。 4.2 不合格药品的判断依据 4.2.1《中华人民共和国药品管理法》及其实施条例。 4.2.2《药品说明书和标签管理规定》。 4.2.3各级食品药品监督管理部门发文通知禁止销售的药品。 4.2.4各级食品药品监督管理部门公告抽检不合格的药品。 4.3不合格药品的定义:凡与法定的药品质量标准及以下有关规定不符的药品均属不合格药品,包括:4.3.1药品的内在质量不符合国家法定质量标准及有关规定的药品; 4.3.2药品的外观质量不符合国家法定质量标准及有关规定的药品; 4.3.3药品包装、标签及说明书不符合国家有关规定的药品。 4.4不合格药品的范围界定:包括内在质量不合格、外观质量不合格药品和包装不合格药品。 4.4.1内在质量不合格是指药品本身发生了物理变化或化学变化的药品,在本制度中是指质量管理部依据药品监督管理部门的质量公告及药品抽检结果而确认的不合格药品。 4.4.2 外观质量不合格是指药品出现破损、污染、变形、批号不清、标签破损或脱落等情况。 4.4.3 包装不合格是指包装不符合《药品说明书和标签管理规定》的药品。 4.5 不合格药品的认定:有以下情况之一的可确认为不合格药品: 4.5.1 在验收、陈列药品质量检查及销售过程中发现的外观质量及包装质量不符合法定质量标准的药品,如药品过期、失效、霉烂、变质、包装破损、污染、变形、批号不清、标签破损或脱落等情况; 4.5.2 各级食品药品监督管理部门公布的抽检检验不合格的药品; 4.5.3 各级食品药品监督管理部门发文通知禁止销售的药品; 4.5.4 质量管理部确认的不合格药品; 4.6不合格药品的处理按照《不合格药品确认和控制处理操作规程》进行,不合格药品一经确认,应认真查清原因,明确责任。
XXX有限公司 不合格药品汇总分析报告 公司在2011年度通过对不合格药品实行控制性的管理,本年度从药品购进、在库储存养护、销售几个环节未发现不合格药品和质量可疑的药品。在售后退回的环节中,验收员对其进行质量验收时,发现存在包装破损、药液渗漏污染包装的药品。此类药品经质管部被确认为不合格药品,移入不合格品库实行色标管理,由专人保管。 对这些不合格药品,公司根据“不合格药品管理制度”的规定,实行逐级审批、报损、销毁,并作相关记录备案,做到有据可查。 一、一般统计资料: 二、报损统计分析: 1、破碎药品9个品种,金额:176.90元,所占报损品种比例约:30﹪,所占金额比例约:37.4﹪; 2、包装破损药品19个品种,金额:246.00元,所占报损品种比例约:63.3﹪,所占金额比例约:52.1﹪。 3、包装污染药品2个品种,金额:49.50元,所占报损品种比例约:6.7﹪,所占金额比例约:10.5﹪; 三、不合格药品分类分析: 四、不合格药品产生原因分析: 从以上数据分析可知,包装破损、污染为不合格药品产生的主要原因,其中包装破损所占金额最大,从剂型看,颗粒剂、散剂发生不合格情况最多,其次是液体制剂。产生不合格药品的原因可以归纳如下: 1、药品包装易碎,药品运输过程中产生不合格药品; 2、医疗需求改变导致退货,客户退货时对药品装箱不仔细、马虎; 3、产地不符合用药习惯导致退货,退货过程中产生不合格药品; 4、发货过程中不小心打碎药品,装箱时不合理。 五、预防措施: 1、加强药品运输管理,严格按照包装图示装卸操作,运输途中控制车速,防止碰撞、挤压以免造成不必要的损失;
2、加强药品流通信息管理,积极调整医疗机构供货目录,减少不必要的退货; 3、实行采购计划责任制,采购计划失误给予处理; 4、严格要求发货时必须轻拿轻放,按规定仔细装箱。 XXXx公司质管部 年月日
工程质量检测报告汇总表 工程名称南通太洋高新材料科技有 限公司新建厂房项目 建设单位南通太洋高新材料科技有限公司 施工单位江苏海瀛腾飞市政建设工 程有限公司 监理单位南通市建设监理有限责任公司检测单位南通市建筑工程质量检测中心 序号检测项目 报告 份(组) 数 检测结论(份数) 备注 合格 不 合 格 需复 检 异常无效 应处理的 其他结论 虽合格 应处理 1 电渣压力焊 工艺检测 5 5 2 电线电缆 2 2 3 防水材料 2 2 4 防水涂料 1 1 5 钢管 1 1 6 钢筋保护层 厚度 1 1 7 管材 2 2 8 钢筋直螺纹 工艺检验 2 2 9 钢筋机械连 接 4 4 10 钢筋28 28 11 扣件 3 3 12 钢筋焊接57 56 1 13 给水管材、管 件 2 2 14 混凝土试块158 158 15 胶粘剂 1 1 小计 检测单位 小计 总计 施工单位监理单位检测单位检测单位 本表已包括本工程全部检测单位的所有检测报告。 项目经理: (单位公章) 年月日 经审核,并比对见 证取样记录,检测报 告汇总(是□/否□) 齐全。 总监理工程师: (单位公章) 年月日 经核对,我单位出 具的检测报告汇总 (是□/否□)齐全。 核实对人: (单位公章) 年月日 经核对,我单位出 具的检测报告汇总 (是□/否□)齐全。 核实对人: (单位公章) 年月日 工程质量检测报告汇总表
工程名称南通太洋高新材料科技有 限公司新建厂房项目 建设单位南通太洋高新材料科技有限公司 施工单位江苏海瀛腾飞市政建设工 程有限公司 监理单位南通市建设监理有限责任公司检测单位南通市建筑工程质量检测中心 序号检测项目 报告 份(组) 数 检测结论(份数) 备注 合格 不 合 格 需复 检 异常无效 应处理的 其他结论 虽合格 应处理 16 混凝土抗渗 5 5 17 门窗 1 1 18 抗裂砂浆 1 1 19 门窗中空玻 璃 1 1 20 硬泡聚氨酯 复合板 3 2 1 21 砂浆试块18 18 22 专用砂浆 4 4 23 简易击实 1 1 24 简易土工 4 4 25 耐碱玻璃纤 维网格布 1 1 26 铝合金建筑 型材 1 1 27 燃烧性能 2 1 1 28 预制桩 2 2 29 砖 2 2 30 防雷接地电 阻 4 4 小计319 315 3 1 检测单位 小计 总计319 315 3 1 施工单位监理单位检测单位检测单位 本表已包括本工程全部检测单位的所有检测报告。 项目经理: (单位公章) 年月日 经审核,并比对见 证取样记录,检测报 告汇总(是□/否□) 齐全。 总监理工程师: (单位公章) 年月日 经核对,我单位出 具的检测报告汇总 (是□/否□)齐全。 核实对人: (单位公章) 年月日 经核对,我单位出 具的检测报告汇总 (是□/否□)齐全。 核实对人: (单位公章) 年月日 反映的问题施工单位闭合处理情况的检查,预验收时将抽查闭合处理资料。 2、经评定可通过的不合格报告仍需统计在“不合格”栏内,闭合资料为经监理审查的评定 资料。 3、需复检的不合格只填在“需复检”统计栏内,“不合格”栏不填。
不合格品统计分析报告 不合格品统计分析报告 药品质量分析调研报告 XX~XX年,在市局的统一领导和统筹安排下,全市各市、县、分局及直属单位认真贯彻《药品管理法》和《药品质量监督抽验管理规定》,坚持监督检查和抽样检验相结合,加强抽样的靶向性、针对性,严格药品抽验程序,以最小的抽验成本,达到了最大的抽验效能。按照省局下达的任务,对全市范围内药品生产、经营企业和医疗机构进行了监督抽样,保证了人民群众用药的安全有效。为了进一步提高工作效率,提高药品监督抽验的不合格率,为今后的药品抽验工作提供科学可靠的依据,现将我市XX~XX年度药品质量情况分析如下: 一、药品抽验完成情况 XX~XX年总计抽验化学药、生化药、抗生素、中成药、中药材、中药饮片2620批。其中不合格药品277批,抽验不合格率10、6%。其中计划性抽验2210批,不合格药品84批,不合格率3、8%。日常监督抽验410批,不合格药品193批,不合格率47、1%。 铁力市抽验药品496批,不合格药品66批,不合格率13、3%。 嘉荫县抽验药品183批,不合格药品24批,不合格率13、1%。 一分局抽验药品172批,不合格药品31批,不合格率18、0%。 二分局抽验药品380批,不合格药品26批,不合格率6、8%。 三分局抽验药品182批,不合格药品41批,不合格率22、5%。 稽查队抽验药品388批,不合格药品56批,不合格率14、4%。
药检所抽验药品818批,不合格药品33批,不合格率4、0%。 药品抽验不合格率由高到低依次是: 三分局>一分局>稽查队>铁力市>嘉荫县>二分局>药检所 (一)计划抽验 三年共完成计划抽验2210批,不合格药品84批,不合格率3、8%。 按抽验单位分类: 1、从生产单位抽验2批,不合格率为0、 2、从经营单位抽验1330批,不合格药品48批,不合格率为 3、6%。 3、从使用单位抽验880批,不合格药品36批,不合格率为 4、1%。 按药品分类: 1、抽验化学药品648批,不合格率为0、 2、抽验抗生素药品274批,不合格率为0、 3、抽验生化药品9批,不合格率为0、 4、抽验中成药708批,不合格药品35批,不合格率为4、9%。 5、抽验中药材、中药饮片571批,不合格药品49批,不合格率8、6%。 (二)日常监督抽验 三年共完成日常监督抽验410批,不合格药品193批,不合格率47、1%。 按抽验单位分类: 1、从生产单位抽验37批,不合药品8批,不合格率为21、6%。 2、经营单位抽验192批,不合药品76批,不合格率为39、6%。
质量管理制度 编号:xx-xx-xx 内容: 1.不合格药品系指: (1)《药品管理法》第四十八、四十九条规定的假药、劣药。 (2)国家药品监督管理部门禁止使用或明令淘汰的药品,药品监督管理部门通知不得销售的药品;质量证明文件不符合规定的药品。 (3)包装、标签、说明书内容不符合规定的药品。 (4)包装破损但未污染药品,而影响销售的药品。 2.对于不合格药品,不得购进和销售。 3.对药品内在质量有怀疑而不能确定其质量状况时,应抽样送药监部门检验。(1)在药品购进验收时发现疑似不合格药品,不得入库;验收员应填写《质量复检通知单》,报质量管理员进行复核;经质量管理人员确认为不合格药品,移入不合格品区等候处理。药品购进人员应将情况通报给供货单位。 (2)在库养护检查中,经质量管理员复核确认为不合格的药品,应通知保
管员将其存放在红色标志的不合格品区,不得继续销售。 (3)对于出现严重质量事故的,必须立即停止销售,就地封存,并向药品监督管理部门报告。 4、不属于药品管理法规定的假劣药品和药监部门规定就地封存的药品,可与供应单位办理退货,但不合格品库应符合储存药品的温湿度要求。 5、对于需报损的不合格药品,保管员填写“不合格药品报损审批表”,经质量管理员、企业负责人审批后,保管员凭审批同意的《不合格药品报损审批表》做报损药品的销帐销卡手续。 6、保管员将准备销毁的不合格药品登记备案后,在质量管理人员的监督下,到药监部门指定地点销毁。并填写《不合格药品销毁记录》。 7、质量管理员对不合格药品的处理情况应定期进行汇总分析。 8、《不合格药品报损审批表》和《不合格药品销毁记录》留质量管理员归档保管。 9、药品的召回是指:药品生产企业(包括进口药品的境外制药厂商,下同)按照规定的程序收回已上市销售的存在安全隐患的药品。 10、协助药品生产企业履行召回义务,按照召回计划的要求及时传达、反馈药品召回信息,控制和收回存在安全隐患的药品。 11、发现其经营、使用的药品存在安全隐患的,应当立即停止销售或者使用该药品,通知药品生产企业或者供货商,并向药品监督管理部门报告。 12、不合格药品的处理要有记录,包括:日期、品名、规格、数量、批号、有效期、生产厂商、不合格原因、经手人等。 13、不合格药品的销毁管理: (1)质量管理员在计算机系统内报损操作,经理批准后,消减账目。 (2)已报损的不合格药品由质量管理人员监督销毁。