
第三章环烷烃环烷烃指碳原子的单键相互连接成环的碳氢化合物,原指环族化合物。P12
将链烃变为环烃,要在分子中增加如C-C单键,同时减少两个氢原子,因此,单环烷烃的通式为C n H2n 。分子中每增加一个环,就要增加一个C-C键,减少两个氢原子。如果一个环烷烃的分子式为C10H18=C n H2n-2。这是个几环烷烃?
3.1环烷烃的异构和命名
3.1.1 环烷烃的异构
环烷烃由于环的大小,侧链的长短及位置的不同而产生构造异构体。例如:C5H10当分子中,两个甲基可以在环平面的同侧,也可以在环平面
的异侧,形成顺反异构:
顺反异构体由于环的存在,不能互变(断键)。其物理性质有差异。
3.1.2 环烷烃的命名
1.单环体系
1)根据环中碳原子数目和环某烷。
2)有取代基时,编号应使取代基位次尽可能小。
3)有不同取代基时,编号从小基团开始。
例如:
C
C
C
C
C
C
C
C
1-甲基-3-异丙基环戊烷
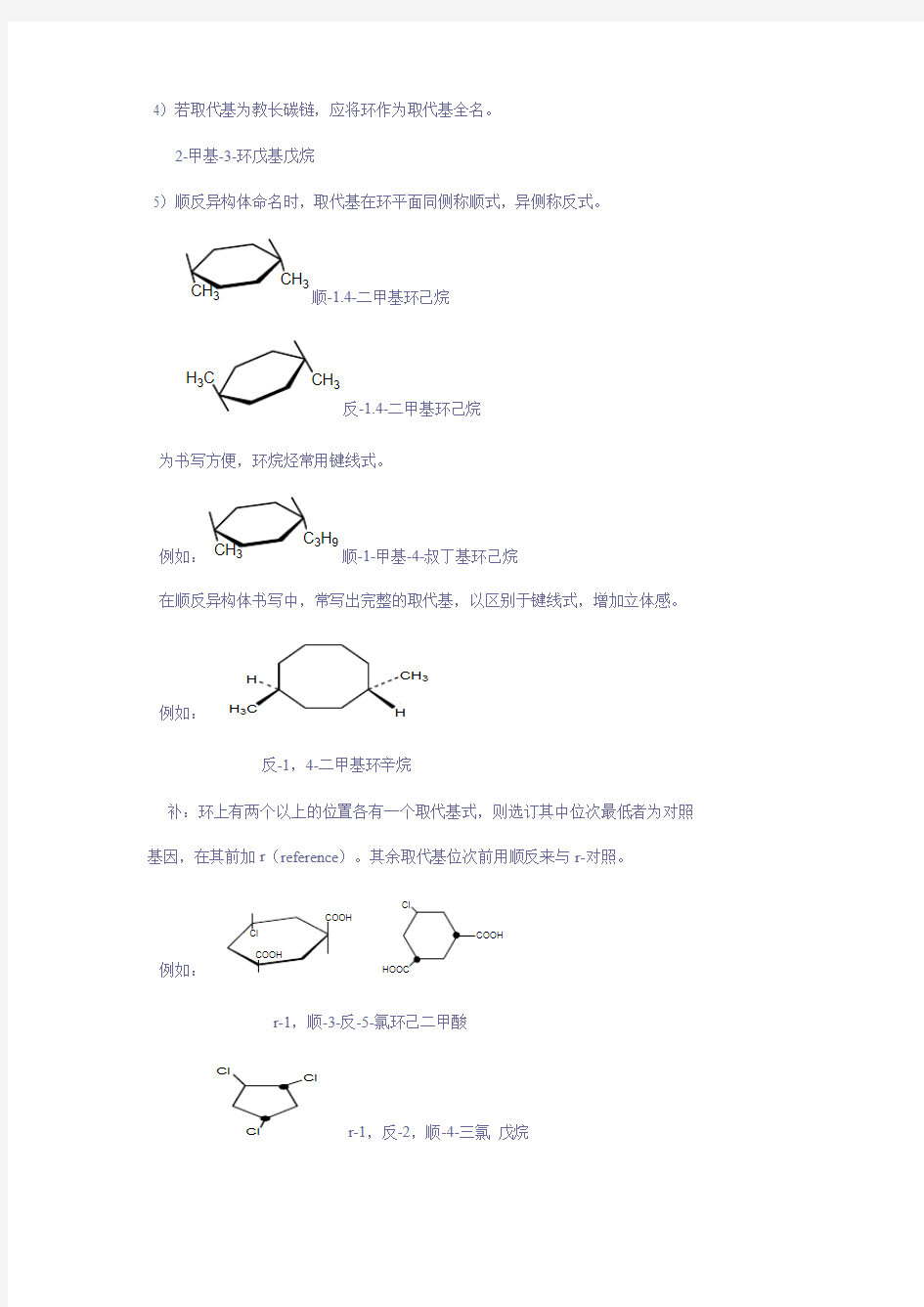
4)若取代基为教长碳链,应将环作为取代基全名。
2-甲基-3-环戊基戊烷
5)顺反异构体命名时,取代基在环平面同侧称顺式,异侧称反式。
3顺-1.4-二甲基环己烷
H
33反-1.4-二甲基环己烷
为书写方便,环烷烃常用键线式。
3H 9顺-1-甲基-4-叔丁基环己烷
在顺反异构体书写中,常写出完整的取代基,以区别于键线式,增加立体感。
例如: H 3
3
反-1,4-二甲基环辛烷
补:环上有两个以上的位置各有一个取代基式,则选订其中位次最低者为对照 基因,在其前加r (reference )。其余取代基位次前用顺反来与r-对照。
例如:
r-1,顺-3-反-5-氯环己二甲酸
r-1,反-2,顺-4-三氯 戊烷
2.多环体系
1)螺环:
两环共用一个碳原子的环烷烃。
根据碳原子数,称螺某烷,在方括号中标出除共用碳以外两环的碳数。编号从
较小环中与共用碳相邻的碳原子开始,从小环经共用碳到大环,并使取代基位数最小。
7-甲基螺[4.5] 烷
取代基螺[X.Y]某烷
2)桥环:两环共用两个以上碳原子的环烃。
*以环数为词头,按环上碳总数称某烷。
*找出桥头碳,排出长短桥,编号从桥头开始从大桥到小桥,并使取代基位数最小。 *方括号内由大到小注明各桥的碳数。
取代基-环数[
例如: 2-甲基二环[2,2,0]己烷
例如:1-甲基-2-乙基-6-氯二环[
3.2 环烷烃的性质
3.2.1 物理性质
环烷烃熔.沸点,密度较相应的开链烷烃高。因环烷烃的环状结构,分子较有
序,排列较紧密,分子间作用力较大。而直链烷烃分子自由摇摆,有序度小,分子间作用力较弱,故
3.2.2 化学性质
环烷烃与直链烃结构相似,所表现出的化学性质也相似,常温下,不与强酸.强碱.强氧化剂.强还原剂起反应,可以起燃烧.热解.卤代等反应。但小环烷烃有一些特殊的性质,即容易开环生成开链化合物。
1.加氢
环戊烷,环己烷需要在高温.活性催化剂下才开环。
2.加溴
环戊烷以上的烷烃与溴光照起取代反应,不开环。
3.加卤代氢
三员环以上不起反应。
开环规则:卤原子加在含氢最少的碳原子上,氢原子加在含氢最多的碳原子上。
4.加水
5.氧化.
小环烷烃对氧化剂相当稳定。
若被氧化,Csp3Csp2
角很大,能量升高。
3.3 环的张力
3.3.1 拜尔张力学说
由上面化学性质可看出,环的稳定性与环的大小有关。小环不稳定,大环较稳定。为了解释这一事实拜尔在1885年提出了张力学说。
要点是:环烷烃中碳原子(饱和,SP3杂化),与其他原子结合时,任何两键
角都是109028,。但环丙烷是三角形,其夹角是60,环丁烷是四方形,夹角是900,
这样环中的C-与-C键角不能是109028,,必须压缩到600,900以适应环的几何形状。这种由于与正常键角的偏差,引起分子的张力,称角张力。这样的环称张力环。
张力环为减小张力,有生成更稳定的开链化合物的倾向。与正常键角偏差越大,
环张力越大,越易起开环反应。书中给出了几种环烷烃键角偏转大小,正值表示键
角向内压缩,负值表示键角向外扩张。根据张力学说,环己烷以上因键角向外扩张
而存在张力,且环越大,键角扩张越大,环越不稳定,而事实上,它的都是稳定的。拜尔张力学说对小环的结论是正确的,但无法解释负环以上大环的稳定性,其
原因是成环碳原子都处于同平面这个假设是错误的,它们实际上不是共平面!
3.3.2 环烷烃的燃烧热
上章我们学过,利用燃烧热可以判断异构体的稳定性,在化学上,我们说某化
合物不稳定,意思是说分子的内能较高,易起化学反应。小环烷烃不稳定,内能较高,可以从其燃烧热数据得到证实。
开链烷烃,不论含碳较少,每个CH2的燃烧热都接近658.6KJ/MOL,而环烷烃每个CH2的燃烧热则因环的大小而不同,大多数都大于开链烷烃的658.6KJ/MOL。这高出的能量叫张力能。例如:环丙烷:CH2燃烧热697.1KJ/MOL
CH2张力能697.1-658.6=38.5KJ/MOL
分子总张力能3*38.5=115.5KJ/MOL
P50 表中给出了多种环烷烃的有关数据。
可见张力越大,环越不稳定,张力越小,环越稳定,环己烷,及大环烷烃几乎
为无张力环,都很稳定。
3.3.3 张力能
在有机化合物中,有四种因素不产生张力能。
1.非键作用
分子中两非键合原子或基因由于几何原因互相靠近,当其间距小于两者范德华
半径之和时,这两个原子或基团就强烈的排斥,引起体系能量升高,且升高的数值最大。E nb
2.键长变化
分子中由于几何原因,必须使某一个键伸长或缩短(象弹簧),体系能量随之
升高,EL,升高数值越大,但〈E nb
3.键角变化
分子中由于几何原因要使键角的大小发生变化,就引起的体系的能量升高,E
其升高数值越大,但〈E l
4.扭转角变化
分子中由于几何原因,使扭转角发生变化就引起能量升高,E,其数值高升最小。比如:一个分子由于几何原因使两非键合原子或基团靠的太近时,因相互排斥,体系能量升高,为降低能量,扭转角发生变化,以使它们彼此分开。如果扭
转角变化还不是以使两个原子或基团分开,这时某些键角,键长就会发生必要的
变化,使其分开并能够容纳在有限的空间内,而范德华半径很少变化。
3.3.4 近代结构理论的解释
从近代价键理论观点来看,两个原子轨道重迭越多则键越稳定。烷烃碳为SP3杂化,键角为109028,,而在环丙烷分子中,键角为600,故SP3杂化轨道很难头对头重叠,即重叠角较少,形成的键也较不稳定,易开环。根据量子化学计算,认为环丙烷分子中C-C键是弯曲的,键角为1050,形如香蕉,又称香蕉键,不仅重叠程度较少,且电子云分布4在C-C键连线外侧,易受试剂进攻而起开环反应。
3.4 构象
3.4.1 乙烷的构象
在乙烷分子中,两个甲基以单链相连,若使一甲基不动,另一甲基绕C-C单键旋转,则分子中H原子在空间的排列形成将不断改变,模型讲解
构象--这种由于围绕单键旋转而产生的分子中原子在空间的不同排列,称构象。
构象与构型一样都是表示分子中原子在空间的排列方式,但不同的是,构象异构体可通过单键的旋转而互变,这种互变不产生键的断裂与形成。互变所需活化能很小,常温下分子热运动产生的能量就可使其互变,故一般情况下,构象异构体不能分离开来。
构型异购体互变时,必将伴随键的断裂与形成的过程,所需活化能较高,通常
情况下,可以分离开来。我们再来看乙烷分子(模型),他可以有无穷多的构象,其中只有两种极限情况我们最感兴趣,也最重要。一种是扭转角为0度的全重叠式构象,另一种是扭转角为60度时的全交叉式构象。
3.4.2 丁烷的构象
略
3.4.3 环己烷的构象
略
第二章 烷烃 一、命名下列化合物 1.CH CH 3CH 3C CH 2CH 23CH 3CH 3 2. C 2H 5CH CH 3CH 3C CH 2CH 2CH 33CH 2CH 2 3. C 2H 5CHCH CH 3CH 3 CH 3 4. CH C 2H 5CH CH CH 33CH 2CH 2CH 3CH 3CH 2 5. CH C 2H 5CH CH CH 33CH 3 CH 3CH 2 6.CH C 2H 5CH CH CH 3CH 3C 2H 5CH 3CH 2 7. CH C 2H 5CH CH 3CH 32CH 2CH 3 CH 2CH 2CH 3 8.CH 2CH 3C (C 2H 5)2(CH 3) 9. CH 2CH 2CH CH 2CH 3 CH CH 332CH 2CH 3 10. (CH 3)2CH CH 2CH 2(C 2H 5)2 二、写出下列化合物的结构式 1. 2,2,4-三甲基戊烷 2 . 4-甲基-5-异丙基辛烷 3.2-甲基-3-乙基庚烷 4. 4-异丙基-5-丁基癸烷 5.2-甲基-3-乙基己烷 6. 2,4-二甲基-3-乙基己烷 7.2,2,3,3-四甲基戊烷 8 .2,4-二甲基-4-乙基庚烷 9. 2,5-二甲基己烷 10. 2,2,3 -三甲基丁烷
三、回答问题 1.将下列烷烃按其沸点由高到低的顺序排列 。 (A) 正戊烷 (B) 异戊烷 (C) 正丁烷 (D) 正己烷 2.将下列烷烃中沸点最高的是( ),沸点最低的是( )。 (A) 3-甲基庚烷;(B) 2,2,3,3-四甲基丁烷;(C) 正辛烷;(D) 2,3-二甲基己烷 3.将下面化合物按其沸点由高到低的顺序排列 。 (A) 辛烷 (B) 3-甲基庚烷 (C) 2,3-二甲基戊烷 (D) 2-甲基己烷 4.将下列烷烃中沸点最高的是( ),沸点最低的是( )。 (A) 新戊烷 (B) 异戊烷 (C) 正己烷 (D) 正辛烷 5.下列自由基中最稳定的是( ),最不稳定的是( )。 (A) CH 3· (B) C(CH 3)3· (C) CH(CH 3)2· (D) CH 2CH 3· 6. 下列自由基中最稳定的是( )。 (A) CH 2CH (CH 3)2CH 2· (B) CH CH 3CH (CH 3)2· (C) CH 2CH 3(CH 3)2C · (D) CH 2CH 3 CH CH 2CH 3· 7.试将下列烷基自由基按其稳定性大小顺序排列 。 (A) CH 3· (B) (C 2H 5)3C · (C) (C 2H 5)2CH · (D) CH 2C 2H 5· 8.写出1,2-二溴乙烷Newman 投影式的优势构象。 9.用Newman 投影式画出戊烷的最优势构象。 10.画出1-氯丙烷的Newman 投影式的最稳定构象。 11.把下列两个透视式写成Newman 投影式。 (A) CH 3F H Br H F (B) Cl CH 3F H Br H 12.把下列两个楔型透视式写成Newman 投影式。 (A) 3 (B) CH 13.把下列两个Newman 投影式改写成锯架式。 (A) 3 (B)
《有机化学》(第五版,李景宁主编)习题答案 第一章 3、指出下列各化合物所含官能团的名称。 (1) CH 3CH=CHCH 3 答:碳碳双键 (2) CH 3CH 2Cl 答:卤素(氯) (3) CH 3CHCH 3 OH 答:羟基 (4) CH 3CH 2 C=O 答:羰基 (醛基) H (5) CH 3CCH 3 答:羰基 (酮基) (6) CH 3CH 2COOH 答:羧基 (7) NH 2 答:氨基 (8) CH 3-C ≡C-CH 3 答:碳碳叁键 4、根据电负性数据,用和标明下列键或分子中带部分正电荷和负电荷的原子。 答: 6、下列各化合物哪个有偶极矩?画出其方向 (1)Br 2 (2) CH 2Cl 2 (3)HI (4) CHCl 3 (5)CH 3OH (6)CH 3OCH 3 答:以上化合物中(2)、(3)、(4)、(5)、(6)均有偶极矩 (2) H 2C Cl (3 )I (4 ) Cl 3 (5)H 3C OH (6) H 3C CH 3 7、一种化合物,在燃烧分析中发现含有84%的碳[Ar (C )=12.0]和16的氢[Ar (H )=1.0],这个化合物的分子式可能是
(1)CH 4O (2)C 6H 14O 2 (3)C 7H 16 (4)C 6H 10 (5)C 14H 22 答:根据分析结果,化合物中没有氧元素,因而不可能是化合物(1)和(2); 在化合物(3)、(4)、(5)中根据碳、氢的比例计算(计算略)可判断这个化合物的分子式可能是(3)。 第二章 习题解答 1、用系统命名法命名下列化合物 (1)2,5-二甲基-3-乙基己烷 (3)3,4,4,6-四甲基辛烷 (5)3,3,6,7-四甲基癸烷 (6)4-甲基-3,3-二乙基-5-异丙基辛烷 2、写出下列化合物的构造式和键线式,并用系统命名法命名之。 (3)仅含有伯氢和仲氢的C 5H 12 答:符合条件的构造式为CH 3CH 2CH 2CH 2CH 3; 键线式为; 命名:戊烷。 3、写出下令化合物的构造简式 (2)由一个丁基和一个异丙基组成的烷烃 (4) 相对分子质量为100,同时含有伯、叔、季碳原子的烷烃 答:该烷烃的分子式为C 7H 16。由此可以推测同时含有伯、叔、季碳原子的烷烃的构造式为(CH 3)3CCH(CH 3)2 (6) 2,2,5-trimethyl-4-propylnonane (2,2,5-三甲基-4-丙基壬烷) CH 3CH 2CH 2CH 2CHCHCH 2CCH 3 CH 3 CH 3CH 3 nC 3H 7
第二章烷烃 学习指导:1.烷烃的命名;脂环烃的命名(包括环烷、环烯等各类化合物的命名); 2. 基的概念、常见取代基结构和命名; 3. 构象(乙烷和丁烷的各种构象,环己烷和取代环己烷的构象)稳定构象的判断; 4. 脂环化合物的顺反异构; 5. 环的稳定性; 6. 烷烃沸点变化规律。 7、碳原子轨道的sp3杂化 习题 一、命名下列各物种或写出结构式。 1、写出2,6-二甲基-3,,6-二乙基辛烷的构造式。 2、写出 的系统名称。 3、写出 的系统名称。 二、完成下列各反应式(把正确答案填在题中括号内)。 1、 三、理化性质比较题(根据题目要求解答下列各题)。 1、将下列自由基按稳定性大小排列成序: 2、将2,3-二甲基己烷(A)、2,3,3-三甲基戊烷(B)、己烷(C)、2,2-二甲基丁烷(D)按沸点高低排列成序。 3、将下列两组化合物分别按稳定性的大小排列成序: 1.(A) 顺-1,2-二甲基环己烷(B) 反-1,2-二甲基环己烷 2.(A) 顺-1,3-二甲基环己烷(B) 反-1,3-二甲基环己烷 四、用简便的化学方法鉴别下列各组化合物。 (A)乙基环丙烷(B) 甲基环丁烷(C) 环戊烷 答案: 一、命名下列各物种或写出结构式。
1、2、4,4-二甲基-5-乙基辛烷 3、2-甲基-4-异丙基-5-叔丁基壬烷 二、完成下列各反应式(把正确答案填在题中括号内)。 1、 三、理化性质比较题(根据题目要求解答下列各题)。 1、(C)>(A)>(B) 2、(A)>(B)>(C)>(D) 3、1.(B)>(A); 2.(A)>(B) 四、用简便的化学方法鉴别下列各组化合物。 室温下使Br2-CCl4褪色的是(A)。 温热时才能使Br2-CCl4褪色的是(B)
第三章不饱和烃 学习指导: 1.烯烃的异构和命名:构造异构和顺反异构(顺式、反式和Z、E表示法); 2. 烯烃的化学性质:双键的加成反应—催化加氢和亲电加成(亲电加成反应历程,不对称加成规则,诱 导效应,过氧化物效应、双键的氧化反应(高锰酸钾氧化,臭氧化,催化氧化)、?—氢原子的反应(氯化); 3、炔烃的命名和异构; 4、炔烃的化学性质:亲电加成反应;氧化反应(高锰酸钾氧化,臭氧化);炔烃的 活泼氢反应(酸性,金属炔化物的生成) 5、烯烃的制备(醇脱水,氯代烷脱氯化氢);炔烃的制备(二卤代烷脱卤化氢,炔烃的烷基化)。 6. 二烯烃的分类和命名; 7. 共轭二烯烃的化学性质:加成反应(1、4—加成和1、2—加成)双烯合成(Diels-Alder反应) 习题 一、命名下列各物种或写出结构式。 1、写出的系统名称。 2、写出(Z)-3-甲基-4-异丙基-3-庚烯的构型式。 3、写出的系统名称。 写出的系统名称。 4、 二、完成下列各反应式(把正确答案填在题中括号内)。 1、 2、( ) 3、 4、 5、 6、 7、 三、理化性质比较题(根据题目要求解答下列各题)。 1、排列下列烯烃与HCl加成的活性次序: (A) (CH3)2C == CH2 (B) CH 2 == CH2 (C) CH3CH == CH2 (D) CF3CH == CH2 2、将下列碳正离子按稳定性大小排序: 3、将下列碳正离子按稳定性大小排列: 4、排列与下列化合物进行双烯加成的活性次序:
5、比较下列化合物与1, 3-丁二烯进行Diels-Alder反应的活性大小: 6、由下列哪一组试剂经Diels-Alder反应生成产物? 四、用简便的化学方法鉴别下列各组化合物。 1、用简便的化学方法鉴别以下化合物: (A) 异丁烯 (B) 甲基环己烷 (C) 1, 2-二甲基环丙烷 2、用简便的化学方法鉴别以下化合物: (A) 己烷 (B) 1-己烯 (C) 1-己炔 (D) 2-己炔 五、用化学方法分离或提纯下列各组化合物。 1、用化学方法除去2-丁烯中的少量1-丁炔。 2、用化学方法除去环己烷中的少量3-己炔和3-己烯。 六、有机合成题(完成题意要求)。 1、用C2以下的烃类为原料合成1-丁烯(无机试剂任选)。 2、用C4以下的不饱和烃为原料合成1, 4-壬二烯(其它试剂任选)。 七、推结构 1、分子式为C6H12的化合物,能使溴褪色,能溶于浓硫酸,能催化加氢生成正己烷,用酸性高锰酸钾溶 液氧化生成两种不同的羧酸。推测该化合物的构造。 2、有两种烯烃A和B,经催化加氢都得到烷烃C。A与臭氧作用后在锌粉存在下水解得CH3CHO和(CH3)2CHCHO;B在同样条件下反应得CH3CH2CHO和CH3COCH3。请写出A,B,C的构造式。 3、三种烃A,B,C的分子式均为C5H10,并具有如下性质: 1. A和B能使Br2/CCl4溶液褪色,其中A生成(CH3)2CBrCH2CH2Br, C不与Br2/CCl4溶液反应。 2. A和C都不能使稀KMnO4水溶液褪色,也不发生臭氧化反应。 3. B经臭氧化及锌粉水解后生成CH3COCH3和一个醛。 求A,B,C的构造式。 答案: 一、命名下列各物种或写出结构式。 1、2, 3, 5-三甲基-4-乙基-3-己烯 2、 3、 3, 5, 5-三甲基环己烯 4、(E)-3, 5-二甲基-2-己烯 二、完成下列各反应式(把正确答案填在题中括号内)。 1、 2、 3、
大学有机化学知识点提纲(一)绪论 共价键 价键理论(杂化轨道理论);分子轨道理论;共振论. 共价键的属性:键能;键长;键角;键的极性. 键的极性和分子极性的关系;分子的偶极矩. 有机化合物的特征 (二)烷烃和环烷烃 基本概念 烃及其分类;同分异构现象;同系物;分子间作用力;a键,e键;构型,构象,构象分析,构象异构体;烷基;碳原子和氢原子的分类(即1,2,3碳,氢;4碳);反应机理,活化能. 对于基本概念,不是要求记住其定义,而是要求理解它们,应用它们说明问题. 命名 开链烷烃和环烷烃的IUPAC命名,简单的桥环和螺环的命名. 烷烃和环烷烃的结构 碳原子sp3杂化和四面体构型;环烷烃的结构(小环的张力). 烷烃的构象 开链烷烃的构象,能量变化;环烷烃的构象:重点理解环己烷和取代环己烷的构象及能 量变化,稳定构象,十氢萘及其它桥环的稳定构象. 烷烃的化学性质 自由基取代反应—卤代反应及机理;碳游离基中间体—结构,稳定性;不同的卤素在反应中的活性和选择性;反应过程中的能量变化. 环烷烃的化学性质 自由基取代反应(与烷烃一致);小环(3,4元环)性质的特殊性—加成. (三)烯烃 烯烃的结构特点 碳的sp2杂化和烯烃的平面结构;键和键. 烯烃的同分异构,命名 碳架异构,双键位置异构,顺反异构(Z,E). 烯烃的物理和化学性质 烯烃的亲电加成及其机理,马氏规则;碳正离子中间体—结构,稳定性,重排. 其它加成反应:催化加氢(立体化学,氢化热);硼氢化—氧化(加成取向,立体化学);羟汞化—脱汞(加成取向);与HBr/过氧化物加成(加成取向);其它游离基加成. 氧化反应:羟基化反应—邻二醇的形成;KMnO4/H+的氧化,臭氧化反应,烯烃结构的测定. α-位取代反应:烯丙基型取代反应(高温卤代和NBS卤代)及机理—烯丙基自由基. (四)炔烃和二烯烃 炔烃 ①结构:碳的sp杂化和碳-碳三键;sp杂化,sp2杂化和sp3杂化的碳的电负性的差异及相应化合物的偶极矩. ②同分异构体 ③化学性质:末端炔烃的酸性及相关的反应;三键的加成:催化加氢,亲电加成,亲核加成;碳—碳三键与H2/Lindlar催化剂反应(顺式烯烃);碳—碳三键与Na/液氨的反应(反式烯烃);加卤素;加HX(马氏规则);加H2O(羰基化合物的形成);加HBr/过氧化物;硼氢化—氧化;加HCN及乙炔的二聚;氧化反应:KMnO4氧化和臭氧化. 二烯烃 ①共轭二烯烃的稳定性:键能和键长平均化,共轭效应.
第一章 习题 (一)用简单的文字解释下列术语: (1) 有机化合物:碳氢化合物及其衍生物。 (2) 键能:形成共价鍵时体系所放出的能量。 (3) 极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。 (4) 官能团:决定有机化合物的主要性质的原子或原子团。 (5) 实验式:能够反映有机化合物元素组成的相对比例的化学式。 (6) 构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。 (7) 均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。 (8) 异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离 子。 (9) sp 2杂化:由1个s 轨道和2个p 轨道进行线性组合,形成的3个能量介于s 轨道和p 轨道 之间的、能量完全相同的新的原子轨道。sp 2杂化轨道的形状也不同于s 轨道或p 轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。 (10) 诱导效应:由于成键原子的电负性不同而引起的电子云的转移。诱导效应只能通过σ键传 递,并且随着碳链增长,诱导效应迅速减弱。 (11) 氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间 或分子内作用力。氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kJ/mol 。 (12) Lewis 酸:能够接受的电子的分子或离子。 (二)下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis 结构式。 (1)C H 3 N H 2(2)C H 3O C H 3(3) CH 3 C OH O (4)C H 3C H =C H 2(5)C H 3 C C H (6)CH 2O 解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的Lewis 结构式如下: (1) H H H H 。。。 N 。(2) H H 。。。。H H 。。(3)C O H C H H 。。 。。 (4)C H H H H 。。C 。。(5)C H H H H 。 。。 C 。 (6)H H 。。
第三章 问题3-1 写出分子式为C 5H 10(戊烯)的链状单烯烃的同分异构体的构造式和键线式。 解: 构造简式 键线式 H 2C CHCH 2CH 2CH 3 H 2C CHCHCH 3 CH 3 H 2C CCH 2CH 3 CH 3 C C CH 2CH 3H H 3C H H H CH 2CH 3 H 3C C C H 3CC CHCH3 CH 3 问题3-2 试排列下列基团的优先次序:-CH=CH 2,-C(CH 3)3,-CH(CH 3)2,-C ≡CH 解:基团的优先顺序: C CH C(CH 3)3 CH CH 2 CH(CH 3)2 > > > 问题3-3 1. 命名下列各烯烃,构造式以键线式表示之,键线式以构造式表示之。
(1) ( CH 3) 3CCCH 2CH 3 CH 2 (2) H C CH 3 C 2H 5 C CH 3 (3) (4) 2. 试判断下列化合物有无顺反异构,如果有则写出其构型和名称: 异丁烯 (2)4-甲基-3-庚烯 (3)2-己烯 解:(1) 3,3-二甲基-2-乙基-1-丁烯 (2) (Z )-3-甲基-2-戊烯 (3) 2,4-二甲基-1-己烯 CH 3 CH 3CCH 2CHCH 2CH 3H 2C (4) (E )-2,3-二甲基-3-己烯 CH 2CH 3 H 3C (CH 3)2HC H C C CHCH 2CH 3 HCC )2(H 3C 2. 解:(1)无顺反异构。 H 2C C 3CH 3 (2)
CH 2CH 2CH 3 CH 3 H 3CH 2C H C C CH 2CH 2CH 3 H H 3C H 2C C CH 3 C (Z )-4-甲基-3-庚烯 (E )-4-甲基-3-庚烯 (3) C C CH 2CH 2CH 3 H 3C H H CH 2CH 2CH 3C C H 3C H H (Z )-2-己烯 (E )-2-己烯 或 顺-2-己烯 或 反-2-己烯 问题3-4 为什么顺-2-丁烯的沸点比反-2-丁烯高 解:液体沸点的高低决定于分子间作用力的大小,而分子间作用力即范德华引力包括了静电引力,诱导引力和色散力。烯烃是弱极性或非极性分子。引力主要由色散力所产生。色散力是由于原子核和电子在不断运动过程中,产生一瞬间的相对位移,使分子的正电荷中心暂时不相重合,从而产生分子间的一种很弱的吸引力。范-2-丁烯有较高的对称性,产生色散力的趋势较小,因此沸点比顺-2-丁烯低。 问题3-5 下列化合物与溴化氢起加成反应时,主要产物是什么 异丁烯,3-甲基-1-丁烯,2,4-二甲基-2-戊烯 解:不对称烯烃与溴化氢加成,加成取向符合马氏规则: H 2C C CH 3 CH 3 HBr H 3C C CH 3 Br CH 3 2-甲基-2-溴丙烷
欢迎阅读 有机化学复习总结 一.有机化合物的命名 1.能够用系统命名法命名各种类型化合物: 包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。 2.根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。 立体结构的表示方法: 1)伞形式:C COOH OH H 3C H 2)锯架式:CH 3 OH H H OH C 2H 5 3)纽曼投影式: H H H H H H H H H H H H 4)菲舍尔投影式:COOH CH 3 OH H 5)构象(conformation) (1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。 (2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。 (3) 环己烷构象:最稳定构象是椅式构象。一取代环己烷最稳定构象是e 取代的椅式构象。多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。 立体结构的标记方法 1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。 2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。 3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。然后将最不优先的基团放在远离观察者,再以次观察其它三个基团,如果优先顺序是顺时针,则为R 构型,如果是逆时针,则为S 构型。 注:将伞状透视式与菲舍尔投影式互换的方法是:先按要求书写其透视式或投影式,然后分别标出其R/S 构型,如果两者构型相同,则为同一化合物,否则为其对映体。 二.有机化学反应及特点 1.反应类型 还原反应(包括催化加氢):烯烃、炔烃、环烷烃、芳烃、卤代烃
第三章 炔烃和二烯烃(习题和答案) 一、给出下列化合物的名称 1. H C CH 3H C CH 3C C H H 2. CH CH CH 2CH 2C (2Z ,4E)-2,4-己二烯 1-戊烯-4-炔 3. CH CH 2CH 3C 2H 5CH 3C C C 4. (CH 3)2CH C(CH 3)3C C 4-乙基-4-庚烯-2-炔 2,2,5-三甲基-3-己炔 5. CH CH CH CH 2CH C 6. CH CH CH CH 3C C C 1,3-己二烯-5-炔 5-庚烯-1,3-二炔 7. (CH 3)2CH H C C 2H 5 C H C C 8. CH 2CH 2CH=CH 2CH 3CH 2CH 3 CH C C (E)-2-甲基-3-辛烯-5-炔 3-乙基-1-辛烯-6-炔 9. H H C C 2H 5 C CH 3C C H H 10. CH H C CH CH 3 C CH 3CH 3C (2Z ,4Z)-2,4-庚二烯 3,5-二甲基-4-己烯-1-炔 二、写出下列化合物的结构 1. 丙烯基乙炔 2. 环戊基乙炔 CH CH CH CH 3C CH C 3.(E)-2-庚烯-4-炔 4.3-乙基-4-己烯-1-炔 CH 2CH 3H C CH 3C H C C CH CH 2CH 3CH CH 3CH C 5.(Z)-3-甲基-4-乙基-1,3-己二烯-1-炔 6.1-己烯-5-炔 CH CH 2CH 3 CH CH 2C CH 3C C CH CH CH 2CH 2CH 2C 7.(Z ,E)-6-甲基-2,5-辛二烯 8.3-甲基-5-戊烯-1-炔 H H C C 2H 5CH 2 CH 3 C CH 3C C H 9.甲基异丙基乙炔 10.3-戊烯-1-炔 CH (CH 3)2CH 3C C CHCH 3CH CH C 三、完成下列反应式 1.Cl 2 CH 2CH 2CH CH C Cl CH 2CH 2CH CH C 2. 稀H 2SO 4 CH 3CH 2CH C HgSO 4 O CH 3CH 3CH 2 3. + CH CH CH CH 3O CH=CH 2C C CH O O O CH 3 C C O O
第五章教学要点和复习一.重要反应纵横 + C2H5C2H5 C2H5C2H5 3 烷基化试剂 卤代烃、烯烃、醇 容易重排 二.重要概念和原理 1. 多功能团有机物的命名 教材列出了主要官能团的优先次序,其作用是:当有机物分子中含有两个或两个以上官能团时,优先次序在前的优先为母体,其余的则作为取代基处理。 有机物命名基本原则:(1)按优先的官能团,确定有机物类别。(2)主官能团位次需最低。(3)按次序规则确定取代基排列前后次序。(4)按照最低系列原则为取代基进行编号。 注意:(1)有机物命名有多种原则,但每一种原则都有其适用的范围,不能互相混淆和乱用。(2)本章介绍的命名基本原则,同样适用于其他有机物命名,后续章节中会进一步涉及。 2. 亲电取代反应及其机理 机理:亲电离子产生——亲电试剂进攻——苯环共轭体系恢复 中间体:σ络合物: H E + 理解:(1)环状碳正离子,但很难说E+从某一个碳原子上得到π电子。
(2)可看作亲电加成产物产物,但不会停留于此:σ络合物失去质子可以恢复为稳定的苯环结构。 3. 苯取代定位规律及其解释 本章重点和难点,教材以共振论结合电子效应解释。教学中主要以电子效应进行解释。 理解:(1)苯环上的取代基,改变了苯环上电子云密度分布。(2)供电子取代基,苯环上电子云密度分布提高,且邻对位上提高更多;吸电子取代基,苯环上电子云密度分布降低,但间位上降低较少。(3)诱导和共轭效应均有供和吸电子两类,效应不一样的主要是卤素(吸电子诱导和供电子共轭) 4. 芳香性及其判断 原则:体系平面(碳杂化为SP 2),π电子符合:4n+2 注意:π电子计算:碳碳双键每一个碳1个,碳正离子0个,碳负离子2个 三.重要考点示范 1. 下列亲电取代反应速率由快到慢的顺序为 。 (A) NO 2 (B) CH 3 (C) OCH 3 (D) 答案: (C) (B) (D) (A) 注意:亲电取代反应的速率主要与苯环上电子云密度有关,第一类定位基,且定位效应越强,则亲电取代反应速率越快。 2. 写出下列反应主要产物: 3)3CH 2CH 3 NBS 答案:C(CH 3)3CHCH 3 Br 注意:(1)NBS 是自由基反应中常用的溴源,自由基取代和自由基加成反应均可以用NBS 发生溴自由基。 (2)苯环侧链α-H 优先发生自由基取代。 3. 写出下列反应主要产物: CH 2CH 3O CH 3O CH COCl CH 2 3 答案:CH 3O CH 3O O 2 注意:分子内的F-K 酰基化反应,优先发生在电子云密度大的苯环上。
大学有机化学各章重点(总13 页) -CAL-FENGHAI.-(YICAI)-Company One1 -CAL-本页仅作为文档封面,使用请直接删除
大学有机化学各章重点 第一章绪论 教学目的:了解有机化合物的定义、特性和研究程序,有机化学发展简史,有机化学的任务和作用。在无机化学的基础上进一步熟悉价键理论、杂化轨道理论、分子轨道理论、共价键的键参数和分子间作用力。掌握分子间作用力与有机化合物熔点、沸点、相对密度、溶解度等物理性质之间的关系。熟悉有机化合物的分类,有机反应试剂的种类、有机反应及反应历程的类型。掌握有机化合物的结构与性质之间的内在联系。 教学重点、难点:本章重点是有机化学的研究对象与任务;共价键理论;共价键断裂方式和有机反应类型。难点是共价键理论。 教学内容: 一、有机化学的发生和发展及研究对象 二、有机化合物中的化学键与分子结构 1、共价键理论:价键理论、分子轨道理论、杂化轨道理论、σ键和π键的电子结构及其反应性能。 2、共价键的参数:键长、键角、键能、元素的电负性和键的极性。 3、分子间力及有机化合物的一般特点 4、共价键断裂方式和有机反应类型 三、研究有机化合物的一般方法:分离提纯、分子式的确定、构造式的确定。 四、有机化合物的分类:按碳胳分类;按官能团分类。 第二章饱和烃(烷烃) 教学目的:掌握烷烃的命名、结构及其表示方法、构象、化学性质。了解烷烃的同系列和同分异构,物理性质等。 教学重点、难点:本章重点是烷烃的结构、构象及化学性质。难点是烷烃的构象及构象分析。 教学内容: 一、有机化合物的几种命名方法。 二、烷烃的命名:系统命名法、普通命名法。
有机化学总结 一.有机化合物的命名 1.能够用系统命名法命名各种类型化合物: 包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。 2.根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。 立体结构的表示方法: 1 )伞形式:COOH OH 3 2)锯架式:CH 3 OH H H OH C 2H 5 3 )纽曼投影式: 4)菲舍尔投影式:COOH 3 OH H 5)构象(conformation) (1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。 (2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。 (3) 环己烷构象:最稳定构象是椅式构象。一取代环己烷最稳定构象是e 取代的椅式构象。多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。 立体结构的标记方法 1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。 2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。 3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。然后将最不优先的基团放在远离观察者,再以次观察其它三个基团,如果优先顺序是顺时针,则为R 构型,如果是逆时针,则为S 构型。 注:将伞状透视式与菲舍尔投影式互换的方法是:先按要求书写其透视式或投影式,然后分别标出其R/S 构型,如果两者构型相同,则为同一化合物,否则为其对映体。 二.有机化学反应及特点 1.反应类型 还原反应(包括催化加氢):烯烃、炔烃、环烷烃、芳烃、卤代烃
第二章 烷烃和环烷烃 有机化合物(简称有机物)中有一类数量众多,组成上只含碳、氢两种元素的化合物,称为碳氢化合物,简称烃(hydrocarbon )。烃分子中的氢原子被其他种类原子或原子团替代后,衍生出许多其他类别的有机物。因此,烃可看成是有机物的母体,是最简单的一类有机物。根据结构的不同,烃可分为如下若干种类。 烃在自然界中主要存在于天然气、石油和煤炭中,是古老生物埋藏于地下经历特殊地质作用形成的,是不可再生的宝贵资源,是社会经济发展的主要能源物质,也是合成各类生活用品和临床药物的基础原料。本章讨论两类饱和烃——烷烃和环烷烃。 第一节 烷烃 分子中碳原子彼此连接成开放的链状结构的烃称为开链烃,因其结构与人不饱和开链烃 烃 饱和开链烃—烷烃 脂环烃(环烷烃、环烯烃等) 闭链烃 (环烃) 开链烃 (脂肪烃) 芳香烃 烯烃 炔烃
体脂肪酸链状结构相似又称脂肪烃,具有这种结构特点的有机物统称脂肪族化合物。分子中原子间均以单键连接的开链烃称为饱和开链烃,简称烷烃(alkane)。 一、烷烃的结构、分类和命名 (一)烷烃的结构 1.甲烷分子结构甲烷是家用天然气的主要成分,也是农村沼气和煤矿瓦斯的主要成分,广泛存在于自然界中,是最简单的烷烃。 甲烷分子式是CH4,由一个碳原子与四个氢原子分别共用一对电子,以四个共价单键结合而成。如下图2-1(a)所示。 图2-1 甲烷分子结构示意图 结构式并不能反映甲烷分子中的五个原子在空间的位置关系。原子的空间位置关系属于分子结构的一部分,因而也是决定该物质性质的重要因素。化学学科常借助球棍模型来形象地表示有机物分子的空间结构(不同颜色和大小的球表示不同原子,小棍表示共价键)。根据现代物理方法研究结果表明,甲烷分子空间结构如图2-1(b)所示。但是球棍模型这种表示书写起来极不方便,要将甲烷的立体结构在纸平面上表示出来,常通过实线和虚线来实现。如图2-1(c)所示,虚线表示在纸平面后方,远离观察者,粗实线(楔形)表示在纸平面前方,靠近观察者,实线表示在纸平面上,这种表示方式称透视式。 将甲烷透视式中的每两个原子用线连接起来,甲烷在空间形成四面体。根据现代物理方法测定,甲烷分子为正四面体结构,碳原子处于四面体中心,四个氢原子位于四面体四个顶点。四个碳氢键的键长都为0.109 nm,键能为414.9kJ?mol-1,所有H-C-H的键角都是109.5o。 碳原子核外价电子层结构为2s22p2,按照经典价键理论,共价键的形成是电子配对的过程。碳原子价电子层上只有两个单电子,因而碳原子应该只能形
《有机化学》(第五版,李景宁主编)习题答案 第一章 3、指出下列各化合物所含官能团的名称。 (1) CH 3CH=CHCH 3答:碳碳双键 (2) CH 3CH 2Cl 答:卤素(氯) (3) CH 3CHCH 3 OH 答:羟基 (4)CH 3CH 2 C=O 答:羰基(醛基) H (5) CH 3CCH 3 答:羰基(酮基) (6) CH 3CH 2COOH 答:羧基 (7) NH 2答:氨基 (8) CH 3-C ≡C-CH 3 答:碳碳叁键 4、根据电负性数据,用和标明下列键或分子中带部分正电荷和负电荷的原子。 答: 6、下列各化合物哪个有偶极矩?画出其方向 (1)Br 2(2) CH 2Cl 2(3)HI (4) CHCl 3(5)CH 3OH (6)CH 3OCH 3 答:以上化合物中(2)、(3)、(4)、(5)、(6)均有偶极矩 (2) H 2C Cl (3 )I (4 ) Cl 3 (5)H 3C OH (6) H 3C CH 3 7、一种化合物,在燃烧分析中发现含有84%的碳[Ar (C )=12.0]和16的氢[Ar (H )=1.0],这个化合物的分子式可能是 (1)CH 4O (2)C 6H 14O 2 (3)C 7H 16 (4)C 6H 10 (5)C 14H 22 答:根据分析结果,化合物中没有氧元素,因而不可能是化合物(1)和(2); 在化合物(3)、(4)、(5)中根据碳、氢的比例计算(计算略)可判断这个化合物的分子式可能是(3)。
第二章 习题解答 1、用系统命名法命名下列化合物 (1)2,5-二甲基-3-乙基己烷 (3)3,4,4,6-四甲基辛烷 (5)3,3,6,7-四甲基癸烷 (6)4-甲基-3,3-二乙基-5-异丙基辛烷 2、写出下列化合物的构造式和键线式,并用系统命名法命名之。 (3)仅含有伯氢和仲氢的C 5H 12 答:符合条件的构造式为CH 3CH 2CH 2CH 2CH 3; 键线式为;命名:戊烷。 3、写出下令化合物的构造简式 (2)由一个丁基和一个异丙基组成的烷烃 (4) 相对分子质量为100,同时含有伯、叔、季碳原子的烷烃 答:该烷烃的分子式为C 7H 16。由此可以推测同时含有伯、叔、季碳原子的烷烃的构造式为(CH 3)3CCH(CH 3)2 (6) 2,2,5-trimethyl-4-propylnonane (2,2,5-三甲基-4-丙基壬烷) CH 3CH 2CH 2CH 2CHCHCH 2CCH 3 CH 3CH 3 3nC 3H 7 8、将下列烷烃按其沸点由高至低排列成序。 (1) 2-甲基戊烷 (2) 正已烷 (3) 正庚烷 (4) 十二烷 答:对于饱和烷烃,随着分子量的逐渐增大,分子间的范德华引力增大,沸点升高。支链的存在会阻碍分子间的接近,使分子间的作用力下降,沸点下降。由此可以判断,沸点由高到低的次序为:十二烷>正庚烷>正己烷>2-甲基戊烷。[(4)>(3)>(2)>(1)] 10、根据以下溴代反应事实,推测相对分子质量为72的烷烃异构式的构造简式。 答:相对分子质量为72的烷烃的分子式应该是C 5H 12。溴化产物的种类取决于烷烃分子内氢的种类(指核磁共振概念中的氢),既氢的种类组与溴取代产物数相同。 (1)只含有一种氢的化合物的构造式为(CH 3)3CCH 3
第三章不饱与烃 学习指导: 1、烯烃的异构与命名:构造异构与顺反异构(顺式、反式与Z、E表示法); 2、烯烃的化学性质:双键的加成反应—催化加氢与亲电加成(亲电加成反应历程,不对称加成规则,诱导效 应,过氧化物效应、双键的氧化反应(高锰酸钾氧化,臭氧化,催化氧化)、 —氢原子的反应(氯化); 3、炔烃的命名与异构; 4、炔烃的化学性质:亲电加成反应;氧化反应(高锰酸钾氧化,臭氧化); 炔烃的活泼 氢反应(酸性,金属炔化物的生成) 5、烯烃的制备(醇脱水,氯代烷脱氯化氢);炔烃的制备(二卤代烷脱卤化氢,炔烃的烷基化)。 6、二烯烃的分类与命名; 7、共轭二烯烃的化学性质:加成反应(1、4—加成与1、2—加成)双烯合成(Diels-Alder反应) 习题 一、命名下列各物种或写出结构式。 1、写出的系统名称。 2、写出(Z)-3-甲基-4-异丙基-3-庚烯的构型式。 3、写出的系统名称。 写出的系统名称。 二、完成下列各反应式(把正确答案填在题中括号内)。 1、 2、( ) 3、 4、 5、
6、 7、 三、理化性质比较题(根据题目要求解答下列各题)。 1、排列下列烯烃与HCl加成的活性次序: (A) (CH3)2C == CH2(B) CH2 == CH2 (C) CH3CH == CH2(D) CF3CH == CH2 : 2、将下列碳正离子按稳定性大小排序 : 4、排列与下列化合物进行双烯加成的活性次序 : ? 6、由下列哪一组试剂经Diels-Alder反应生成产物 四、用简便的化学方法鉴别下列各组化合物。 1、用简便的化学方法鉴别以下化合物: (A) 异丁烯(B) 甲基环己烷(C) 1, 2-二甲基环丙烷 2、用简便的化学方法鉴别以下化合物: (A) 己烷(B) 1-己烯(C) 1-己炔(D) 2-己炔 五、用化学方法分离或提纯下列各组化合物。 1、用化学方法除去2-丁烯中的少量1-丁炔。
大学有机化学性质总结 有机化学复习资料—化学性质 烷烃及环烷烃的化学性质: 1.烷烃卤代反应 2.环烷烃加成反应(加氢,加卤素,加卤化氢) 烯烃的化学性质: 1.加成反应(加氢,加水,加卤素,加次卤酸反式加成,自由基加成ROOR ) 马氏规则的应用(形成稳定的正碳离子);个别化合物,要考虑甲基、氢的重排。 在过氧化物存在下,与HBr的自由基加成,反马氏规则。 烯烃的硼氢化-氧化反应条件:BH3或B2H6 →H2O2/OH-→H2O 反马氏规则, 顺型加成,产物是醇。 2.氧化反应 1.KMnO4溶液(碱性或中性) 产物邻二醇,顺式; KMnO4溶液(酸性) 产物双键发生断裂。 (烯烃C=C 氧化为C=O; C=C 上的氢被氧化成羟基(-OH)。) 2.臭氧化反应:反应条件:O3→Zn/H2O 产物是醛、酮 炔烃的化学性质: 1.酸性(炔化银和炔化亚酮的生成与复原) 2.加成反应(加卤素,加卤化氢,加水H2O, HgSO4-H2SO4<互变异构>) 炔键在中间,生成反式加成产物。 在过氧化物存在下,与HBr的自由基加成,反马氏规则。 3. 氧化反应(KMnO4溶液(酸性),臭氧化反应) 炔烃的硼氢化-氧化反马氏规则, 顺型加成,产物是醛酮。 炔烃的加氢1)Lindlar Pd (顺式烯烃) 2)Na, NH3(反式烯烃) 共轭二烯烃性质: 1.1,2加成-80°C 优势和1,4加成40°C 优势 2.狄尔斯-阿尔德反应 共轭二烯烃与含有碳碳双键或三键的化合物作用形成六元环产物的反应。 芳香烃的化学性质: 1.亲电取代反应(卤化FeCl3/Fe,硝化浓H2SO4,磺化<可逆,增加水溶性>,F-C反应<烷基化无水AlCl3,酰基化AlCl3>)。 2. 苯及其同系物的氧化反应(具有α-H 的苯同系物——苯甲酸) 3. 苯环侧链的氧化反应(主要产物是α-H被取代的卤代芳香烃)、 卤代烃的化学性质: 1.各种亲核取代反应 (生成醇,醚,硫醇,氰(多一个c羧酸),胺,硝酸酯)。 2..与金属的反应(主要掌握Grignard试剂) (a.烷烃 b.(1)CO2(2)H+/H2O多一个c羧酸)。 3.消去反应 1 / 4
第九章 教学要点和复习 一.重要反应纵横 R OH 2 酸性 KMnO 4/H +等:无选择性PCC:具选择性 C 活性:烯丙、苄基纯>叔醇>仲醇>伯醇主要按SN1,有重排可能 一般无重排 活性:烯丙、苄基纯>叔醇>仲醇>伯醇主要按E1,有重排可能。用Al 2O 3无重排 OH 二.重要概念和原理 1. 醇、酚的酸碱性 醇:极弱的酸性——烷氧基负离子形成;极弱的碱性——醇羟基的质子化 酚:弱酸性——苯氧负离子稳定
苯环上有吸电子基,酸性增强;有供电子基,酸性减弱。 2. 醇的SN 和E 反应 与卤代烃相应的反应类似,不同在于醇羟基有一定碱性,不易离去,需要酸催化形成质子化羟基(H 2O +),有利于离去。 注意:醇分子间脱水成醚是SN 反应,适合用于单醚制备;醇分子内脱水是E 反应,一般温度较高,但这两反应存在互相竞争的问题。 3. 醇的氧化反应 醇的氧化与分子中存在α-H 有关,叔醇不能氧化。 选择性氧化剂:Sarett 试剂——CrO 3/吡啶 氧化为醛且不氧化碳碳双键 α-二醇氧化:HIO 4,产物醛、酮或酸 4. 酚的酯化和F-K 反应 酚与酰卤或者酸酐在酸或碱催化下发生酯化反应,类似与醇的酯化反应,形成酚酯; 酚在酸(HF 、BF 3、H 3PO4、H 2SO 4)催化下与卤代烃(少用)、烯烃和醇发生苯环上烷基化反应,AlCl3与羧酸发生苯环上的酰基化反应。 注意:酚与羧酸很难发生酯化反应;酚的F-K 反应很少用Al 2O 3催化剂。 5. 醇酚性质的差异 本质:苯环与羟基p-π共轭效应 表现:(1)酚的酸性强(酚氧负离子更稳定);(2)酚氧负离子亲核能力弱(酚难与羧酸形成酯);(3)酚难发生脱水的消除反应;(4)芳环上电子云密度大,易发生环上亲电取代(-OH 是强的第一类定位基) 三.重要考点示范 1. 命名:C CHCH 3H OH H HO CH 3O 答案:Z-4-(4-羟基-3-甲氧基苯基)-3-丁烯-2-醇 注意:多功能团的命名方法,主官能团羟基位次尽可能小,但不总是1位。 2. 命名: 答案:4-环己烯-1,3-二醇 注意:环状不饱和二醇,应使两国羟基位次最小前提下,再使双键位次尽可能小。 3. 下列化合物酸催化下,消除反应活性由小到大次序是: (A) CHCH 3 OH (B) CHCH 3 (C) C(CH 3)2OH ( D) CH 2CH 2OH 答案:( D) (A) (B) (C) 注意:上述醇发生消除反应,形成的中间体碳正离子稳定性由大到小是: CHCH 3 CHCH 3 C(CH 3)2 CH 2CH 2 + + ++ > > > 4. 写出下列反应主要产物: