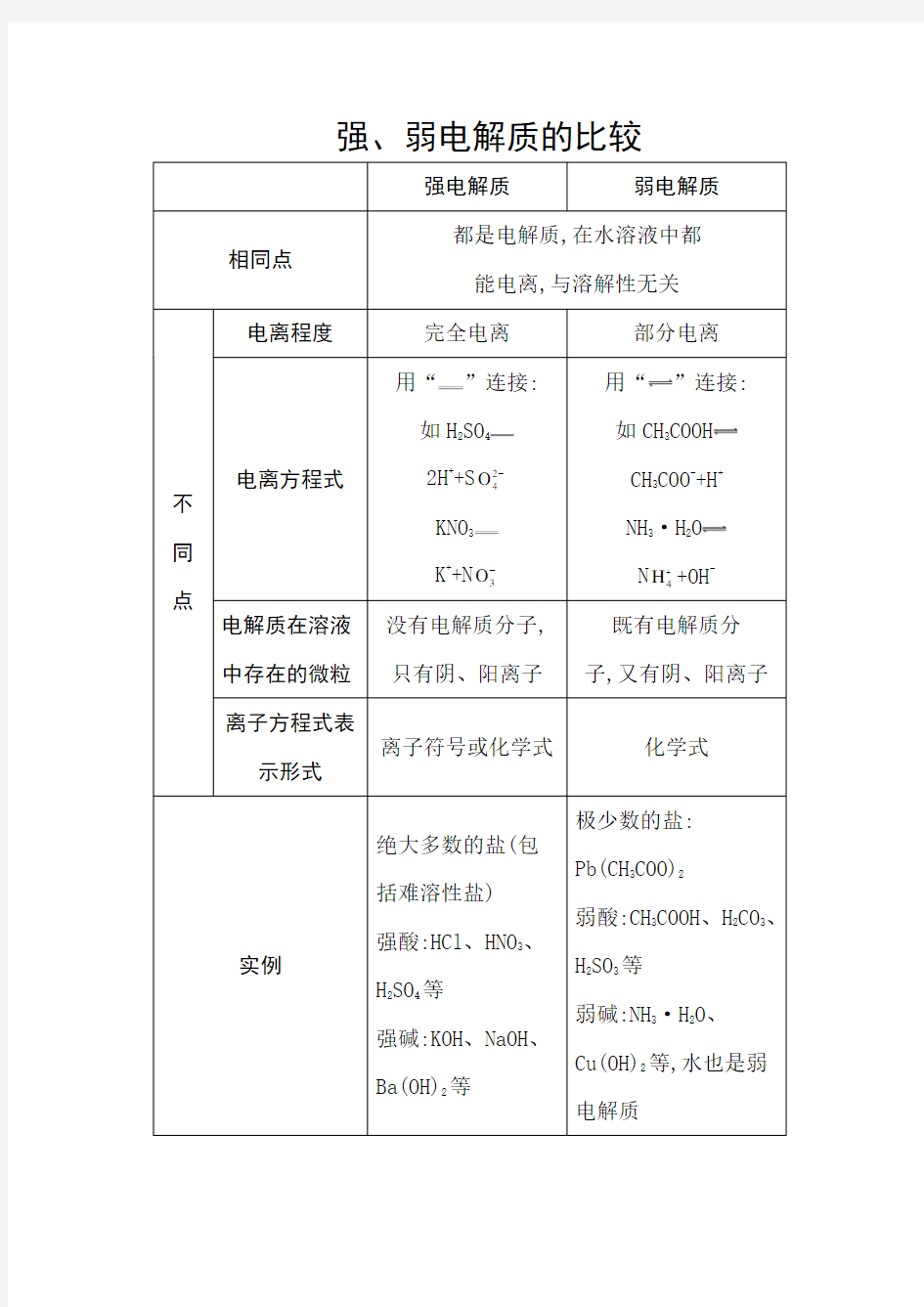
强、弱电解质的比较
强电解质弱电解质相同点
都是电解质,在水溶液中都
能电离,与溶解性无关
不同点
电离程度完全电离部分电离
电离方程式
用“”连接:
如H2SO4
2H++S2
4
O-
KNO3
K++N
3
O-
用“”连接:
如CH3COOH
CH3COO-+H+
NH3·H2O
N+
4
H+OH-
电解质在溶液
中存在的微粒
没有电解质分子,
只有阴、阳离子
既有电解质分
子,又有阴、阳离子离子方程式表
示形式
离子符号或化学式化学式
实例
绝大多数的盐(包
括难溶性盐)
强酸:HCl、HNO3、
H2SO4等
强碱:KOH、NaOH、
Ba(OH)2等
极少数的盐:
Pb(CH3COO)2
弱酸:CH3COOH、H2CO3、
H2SO3等
弱碱:NH3·H2O、
Cu(OH)2等,水也是弱
电解质