
第14章 碳、硅、硼
14.1. 对比等电子体CO 与N 2的分子结构及主要物理、化学性质。
解:CO 和N 2是等电子体(14e ),分子轨道能级图相似,分子中都有三重键:∶N ≡N ∶、
C O δ+
δ-
∶
∶
,键能相近。一般条件下,两种物质都是气体,很少溶于水;熔、沸点,
临界压力,临界温度等一些物理性质也相似。
但CO 和N 2分子中三重键特点并不完全相同,N 2分子中负电荷分布是对称的,而CO 却是不对称的。C 原子略带负电荷,再加上C 的电负性比N 小,因此CO 比N 2较易给出电子对向过渡金属原子(离子)配位,除形成σ―配键外,还有π―反馈键形成,故生成的配合物较稳定。而N 2的配位能力远不如CO ,分子氮配合物远不如羰基化合物稳定。所以CO 的键能虽比N 2略大,但化学性质却比N 2要活泼,不象N 2那样“惰性”。
14.2 概述CO 的实验室制法及收集方法,写出CO 与下列物质起反应的方程式并注明反应的条件:
(1)Ni ;(2)CuCl ;(3)NaOH ;(4)H 2 ;(5)PdCl 2 解:CO 的实验室制法:
HCOOH
浓H 2SO 4
2O
用排水集气法收集。 (1)
Ni + 4CO
100 -250atm 423 -493K
Ni(CO)4
(2)
(3)
CO + NaOH HCOONa
1.01×103kPa
473K
(4)
CO + 3H 2
CH 4 + H 2O Fe 、Co 、Ni
523K,101kPa
(5) CO + PdCl 2 + H 2O === Pd ↓ + CO 2 + 2HCl
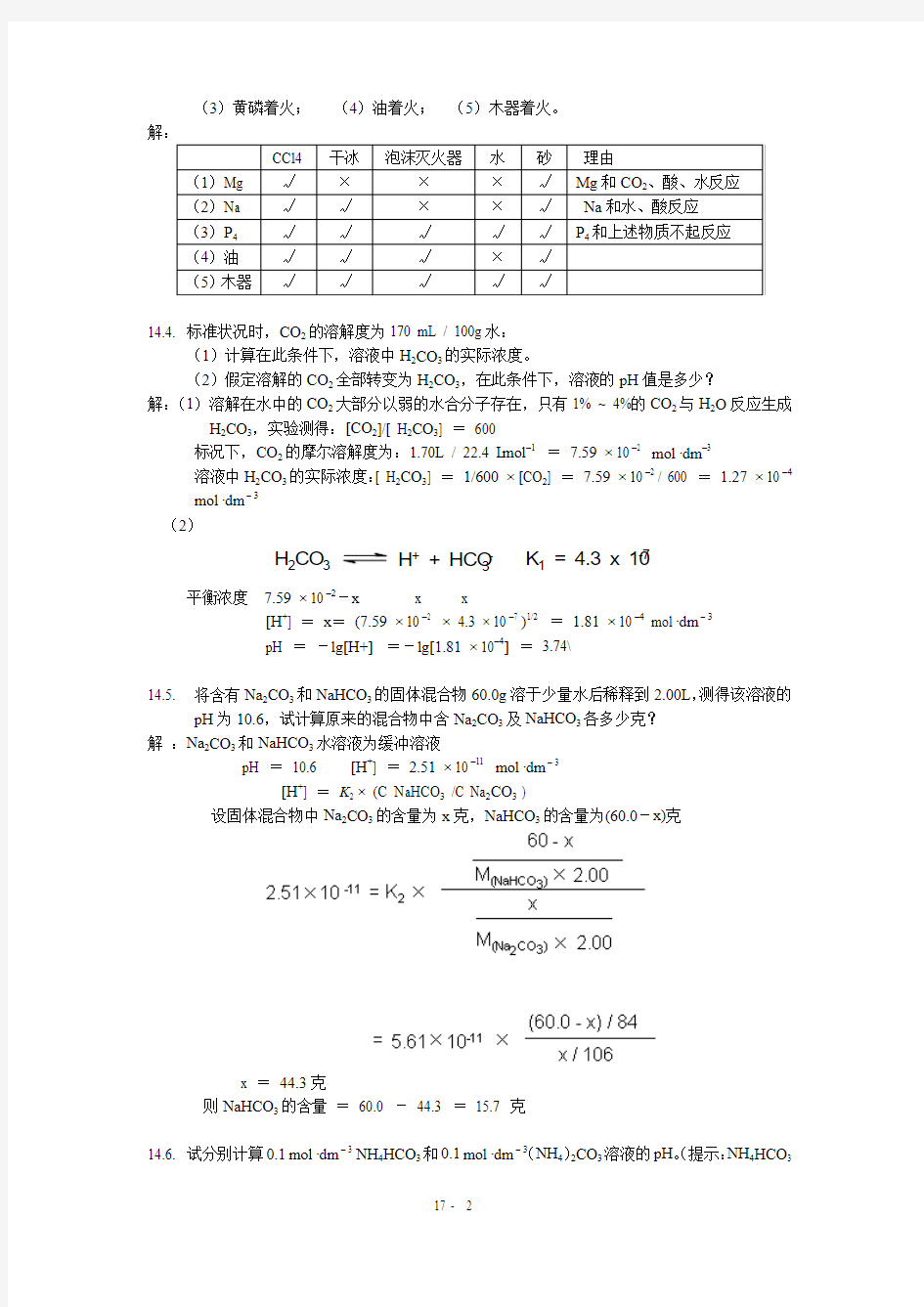
14.3. 某实验室备有CCl 4、干冰和泡沫灭火器(内为Al 2(SO 4)3和NaHCO 3),还有水源和砂。若
有下列失火情况,各宜用哪种方法灭火并说明理由: (1)金属镁着火; (2)金属钠着火;
(3)黄磷着火; (4)油着火; (5)木器着火。
解:
14.4. 标准状况时,CO 2的溶解度为170 mL / 100g 水:
(1)计算在此条件下,溶液中H 2CO 3的实际浓度。
(2)假定溶解的CO 2全部转变为H 2CO 3,在此条件下,溶液的pH 值是多少?
解:(1)溶解在水中的CO 2大部分以弱的水合分子存在,只有1% ~ 4%的CO 2与H 2O 反应生成
H 2CO 3,实验测得:[CO 2]/[ H 2CO 3] = 600
标况下,CO 2的摩尔溶解度为:1.70L / 22.4 L·mol –1 = 7.59 × 10 –2 mol ·dm –3
溶液中H 2CO 3的实际浓度:[ H 2CO 3] = 1/600 × [CO 2] = 7.59 × 10 –2 / 600 = 1.27 × 10 –4
mol ·dm -3
(2)
H 2CO 3H + + HCO 3-K 1 = 4.3 x 10 -7
平衡浓度 7.59 × 10 –2-x x x
[H +] = x = (7.59 × 10 –2 × 4.3 × 10 –7 )1/2 = 1.81 × 10 –4 mol ·dm -3 pH = -lg[H+] =-lg[1.81 × 10–4] = 3.74\
14.5. 将含有Na 2CO 3和NaHCO 3的固体混合物60.0g 溶于少量水后稀释到2.00L ,测得该溶液的
pH 为10.6,试计算原来的混合物中含Na 2CO 3及NaHCO 3各多少克?
解 :Na 2CO 3和NaHCO 3水溶液为缓冲溶液
pH = 10.6 [H +] = 2.51 × 10 –11 mol ·dm -3 [H +] = K 2 × (C NaHCO 3 /C Na 2CO 3 )
设固体混合物中Na 2CO 3的含量为x 克,NaHCO 3的含量为(60.0-x)克
x = 44.3克
则NaHCO 3的含量 = 60.0 - 44.3 = 15.7 克
14.6. 试分别计算0.1 mol ·dm -3 NH 4HCO 3和0.1 mol ·dm -3
(NH 4)2CO 3溶液的pH 。
(提示:NH 4HCO 3
按弱酸弱碱盐水解计算。)
(已知:NH3·H2O K b=1.77×10–5;H2CO3 K1=4.3×10–7 ,K2=5.61×10–11)
(1)0.1mol·dm-3 NH4HCO3溶液pH值:
平衡浓度(mol·dm-3)0.1-x 0.1-x x x
K h=K w / K NH3·H2O ·K1H2CO3 = 1.0×10–14 / (1.77×10–5×4.3×10–7)=1.31×10–3 [x / (0.1-x )]2=1.31×10–3
x / (0.1-x )=3.62 ×10–2
x =[H2CO3] =3.49 ×10–3
[HCO3–] =0.1-3.49 ×10–3 =0.0996 ≈ 0.1mol·dm-3
[H+] = K1·[H2CO3] / [HCO3–] =(4.3×10–7×3.49 ×10–3) / 0.1 =1.5×10–8
pH =-lg[H+] =-lg[1.5 × 10 –8] =7.82
(2)0.1mol·dm-3 (NH4)2CO3溶液pH值:
平衡浓度(mol·L–1)0.2-x 0.1-x x x K h=K w / K NH3·H2O· K2 H2CO3 =1.0×10–14 / (1.77×10–5×5.61×10–11) = 10.07
x2 / (0.2-x)(0.1-x) =10.07 x =0.0922
[H+] =K2·[HCO3–] / [CO32–] =(5.61×10–11×0.0922) / (0.1-0.0922) =6.63 ×10–10 pH=-lg[H+]=-lg [6.63 ×10 –10]=9.18
14.7在0.2mol·dm-3的Ca2+盐溶液中,加入等浓度、等体积的Na2CO3溶液,将得到什么产物?
若以0.2mol·dm-3的Cu2+代替Ca2+盐,产物是什么?再以0.2mol·dm-3的Al3+盐代替Ca2+盐,产物又是什么?试从溶度积计算说明。
解:已知CaCO3 K sp = 4.96 ×10–9 CuCO3 K sp =1.4 ×10–10
Ca(OH)2 K sp = 4.68 ×10–6 Cu(OH)2 K sp =2.6 ×10–19
Al(OH)3 K sp =1.3 ×10–33
溶液中[Ca2+] =[Cu2+] =[Al3+] =[CO32–] =0.1mol·dm-3
[OH–] =(K w / K2 ×Ca盐)1/2=[(1.0×10–14 / 5.61×10–11 )×0.1]1/2 =4.22 ×10–3(1)[Ca2+][CO32–] =102> 4.68 ×10–6 (K sp CaCO3)
[Ca2+][OH–]2 =0.1 × (4.22 ×10–3)2 = 1.78 ×10–6 < 4.68 ×10–6 (K sp Ca(OH)2 )
故有CaCO3沉淀析出
(2)[Cu2+][CO32–] =102 > 1.4 ×10–10 (K sp CuCO3)
[Cu2+][OH–]2 =0.1 × (4.22 ×10–3)2 = 1.78 ×10–6 >2.6 ×10–19 (K sp Cu(OH)2 )
故有Cu2(OH)2 CO3沉淀析出
(3)Al(OH)3的溶度积极小,Al3+ 和CO32–完全水解,故生成氢氧化物沉淀。
[Al3+][OH–]3 =0.1 × (4.22 ×10–3)3 =7.5 ×10–4 >1.3 ×10–33 (K sp Al(OH)3 )
14.8. 比较下列各对碳酸盐热稳定性的大小
(1)Na2CO3 和BeCO3(2)NaHCO3和Na2CO3
(3)MgCO3和BaCO3(4)PbCO3和CaCO3
解:含氧酸盐热稳定性和金属离子的极化力大小有关,离子势(Z/r)大、或18 、18+2电子构型的金属离子,对酸根的反极化作用大,酸根中R-O键易断,含氧酸盐变得不稳定。(1)Na2CO3 >BeCO3,因为Be2+的离子势(Z/r)比Na+的大。对CO32–的反极化作用强。(2)NaHCO3 < Na2CO3,因为H+是裸露质子,半径又很小,正电荷密度大,反极化作用特别强。
(3)MgCO3 < BaCO3 ,因为r Mg2+< r Ba2+ ,Mg2+的Z/r比Ba2+的大,极化能力比Ba2+强。(4)PbCO3 < CaCO3 ,因为Pb2+为18+2电子构型,极化能力比8电子构型的Ca2+大。
14.9. 如何鉴别下列各组物质:
(1)Na2CO3 、Na2SiO3 、Na2B4O7·10H2O
(2)NaHCO3、Na2CO3
(3)CH4、SiH4
解:(1)分别于三种溶液中加酸,有气体(CO2)放出者为Na2CO3 ,有白色沉淀析出者可能是Na2SiO3或Na2B4O7·10H2O 。再分别取二者溶液,加入浓H2SO4和甲醇,并点燃,有绿色火焰产生者为Na2B4O7·10H2O。
(2)分别用pH试纸检验两溶液,pH ≈11,溶液呈强碱性者为Na2CO3 ,pH在8左右为弱碱性者为NaHCO3 。也可以分别将两固体加热,容易分解产生CO2气体者为NaHCO3 ,而Na2CO3加热到熔化也不分解。
(3)分别将两种气体通入AgNO3溶液中,有黑色Ag析出者为SiH4 。
14.10. 怎样净化下列两种气体:
(1)含有少量CO2、O2和H2O等杂质的CO气体。
(2)含有少量H2O、CO、O2、N2及微量H2S和SO2杂质的CO2气体。
解:(1)将含有杂质的CO气体,首先通过连二亚硫酸钠的碱性溶液吸收O2 :
2Na2S2O4 + O2 + 4NaOH =4Na2SO3 + 2H2O
然后,再依次通过Ca(OH)2溶液、浓H2SO4以吸收CO2和H2O。
(2)将含有杂质的CO2气体通过冷的、浓K2CO3溶液吸收CO2 ,CO、O2、N2不被吸收,H2S、SO2也同时被吸收,但产物不同:
CO2 + K2CO3 + H2O =2KHCO3
SO2 + K2CO3 =K2SO3 + CO2↑
H2S+ K2CO3 =K2S + H2O+ CO2↑
将吸收过CO2的KHCO3溶液再加热,CO2即逸出。
经浓H2SO4干燥后即可得纯净、干燥的CO2 。
14.11. 试说明下列现象的原因:
(1)制备纯硼或硅时,用氢气作还原剂比用活泼金属或碳好;
(2)硼砂的水溶液是缓冲溶液。
(3)装有水玻璃的试剂瓶长期敞开瓶口后,水玻璃变浑浊。
(4)石棉和滑石都是硅酸盐,石棉具有纤维性质,而滑石可作润滑剂。
解:(1)用活泼金属或碳作还原剂,制备出来的硼或硅会和金属或碳生成金属化合物或碳化物。
(2)硼砂Na2B4O5 (OH)4·8H2O水解产生共轭酸碱对:
H3BO3是酸,B(OH)4–是共轭碱。
(3)水玻璃Na2SiO3接触空气后,与CO2作用,加速水解。
SiO32– + 2H2O =H2SiO3 + 2OH–
H2SiO3不溶于水,故使溶液变浑浊。
(4)石棉为链状硅酸盐结构,故具有纤维性质;而滑石组分中的硅酸盐阴离子为片状结构,金属离子存在于片层之间,片与片之间容易相对滑动,故滑石有润滑感。
14.12. 试说明下列事实的原因;
(1)常温常压下,CO2为气体而SiO2为固体。
(2)CF4不水解,而BF3和SiF4都水解。
(3)BF3和SiF4水解产物中,除有相应的含氧酸外,前者生成BF4–,而后者却是SiF62–。解:(1)C 、O均为第二周期元素,形成p―pπ键的倾向强,CO2分子中除有σ键外,还有两个键,加强了分子的稳定性。因此,它的晶体类型是以小分子CO2为结构单元组成的分子晶体,熔、沸点低,故常温常压下为气体。
Si是第三周期元素,形成p―pπ键的能力弱,倾向于形成多个单键以增加键能,降低体系能量,因此SiO2是以Si―O四面体为结构单元组成的原子晶体,熔沸点极高,常温常压下为固体。
(2)非金属卤化物水解条件之一是中心原子要有空轨道,接受水分子中氧原子的孤对电子。
CF4中C的配位数已饱和,没有空轨道接受H2O配位。BF3为缺电子分子,尚有一个空
的p轨道可利用;SiF4中原子有空的3d轨道,它们都能接受H2O分子配位,故能水解。
(3)4BF3 + 3H2O =H3BO3 + 3H+ + 3BF4–
3SiF4 + 4H2O =H4SiO4 + 4H+ + 2SiF62–
因为B的最大配位数只能是4,故生成BF4–,而Si可利用空的3d轨道成键,配位数可扩大到6,故生成SiF62–。
14.13. 试说明硅为何不溶于氧化性的酸(如浓硝酸)溶液中,却分别溶于碱溶液及HNO3与HF
组成的混合溶液中。
解:在氧化性酸中,Si被氧化时在其表面形成阻止进一步反应的致密的氧化物薄膜,故不溶于氧化性酸中。HF的存在可消除Si表面的氧化物薄膜,生成可溶性的[SiF62–],所以Si 可溶于HNO3和HF的混合溶液中。
Si是非金属,可和碱反应放出H2,同时生成的碱金属硅酸盐可溶,也促使了反应的进行。
14.14. 试解释下列现象:
(1)甲烷既没有酸性,也没有碱性;
(2)硅烷的还原性比烷烃强;
(3)硅的卤化物比氢化物容易成链;
(4)BH3有二聚物B2H6,而BX3却不形成二聚体。
解:(1)C-H键是共价性的,又因C和H原子半径均较小,具有较小的极化性,因此在H2O 分子的影响下,CH4不产生H+,故不显酸性。又因在CH4分子中,C原子外层无孤对
电子及空轨道,不能接受H+,故也不显碱性。
(2)H的电负性(x p=2.1)介于C(x p=2.5)和Si(x p=1.8)之间,SiH4中H表现负氧化态;
同时E Si-Si 和E Si-H 均分别比E C-C 和E C-H 小,硅烷不稳定。所以硅烷的还原性比烷烃强。 (3)硅的卤化物中存在着d-p π配键,使Si —X 键键能增加,故易于成链。
(4)BH 3为缺电子分子,通过形成3C -2e 的多中心键以B 2H 6二聚体形式存在,解决了缺电
子问题。BF 3虽也是缺电子分子,但F 有孤对电子,可提供占有电子对的p 轨道与B 原
子形成离域π键,增加了B —F 键键能,缓和了缺电子的问题。
14.15说明下列物质的组成、制法及用途。
(1)泡花碱 ;(2)硅胶 ;(3)人造分子筛;
解:(1)泡花碱是市售水玻璃的俗名,它是多种硅酸盐的混合物,其化学组成为Na 2O·nSiO 2,
工业生产方法是将石英砂(SiO 2),Na 2SO 4和煤粉(C)混合后置于反射炉内于1373K -1623K 时反应,产品是玻璃块状物,主要用途是作粘合剂、防腐剂、软水剂。也是制硅胶及分子筛的原料。
(2) 硅胶:在硅酸钠Na 2SiO 3溶液中加酸,单个硅酸分子逐渐缩合为多硅酸的胶体溶液——
硅酸溶液,当浓度足够大时,就得到硅酸凝胶(含水量较大、软和透明的、有弹性的物质),将硅酸凝胶洗涤,干燥,脱去部分水后就得到硅胶(多孔性、稍透明的白色固体),因其表面积大,主要用作干燥剂和催化剂载体。
(3) 人造分子筛:它是一类人工制造的铝硅酸盐,以实验室常用的A 型分子筛为例,它的组
成一般为:Na 2O·Al 2O 3·2SiO 2·5H 2O ,是用水玻璃、偏铝酸钠、氢氧化钠和水按一定的配比,控制适当的温度使其充分反应而制得。分子筛具有极强的吸附能力和离子交换能力,主要用作吸附剂、干燥剂以及催化剂和催化剂载体。
14.16. 为什么BH 3的二聚过程不能用分子中形成氢键来解释?B 2H 6分子中的化学键有什么特殊
性?“三中心二电子键”和一般的共价键有什么不同?
解: 因为B 原子没有未共用的电子对,并且也不带有负的有效电荷,故BH 3分子间不可能形成
氢键。B 2H 6分子中共有14个原子轨道,却只有12个电子,不可能都形成2C -2e 的正常共价键,只能通过形成缺电子的多中心键,充分利用B 的空轨道又解决了缺电子问题,所以在B 2H 6中,除有4个B —H 共价键外,还有2个3C -2e 的氢桥键,它和一般的共价键不同处就是成键的电子数小于成键的轨道数。
14.17. B 6H 10的结构中有多少种形式的化学键?各有多少个? 解: B 6H 10中有4种形式的化学键:
2C -2e B -H 共价键 6个 3C -2e B
B H
氢桥键 4个
闭合式 3C -2e B
B B 硼键 2个
2C -2e B -B 共价键 2个
14.18. H 3BO 3和H 3PO 3组成相似,为什么前者为一元路易斯酸,而后者则为二元质子酸,试从
结构上加以解释。
解: H 3BO 3为缺电子分子,每个硼原子用3个sp 2杂化轨道与3个氢氧根成键,尚余1个空的
p 轨道可接受来自H 2O 分子中OH –上的孤对电子而释放出H +,故为一元路易斯酸。
H3PO3分子中含有2个羟基氧
P
H
H
H
O
O
,故为二元质子酸。
14.19. 写出以硼砂为原料制备下列物质的反应方程式。
(1)硼酸(2)三氟化硼(3)硼氢化钠
解:(1)
(2)
B2O3 + 3H2SO4 + 3CaF2=2BF3 + 3CaSO4 + 3H2O
(3) BF3 + 4NaH =NaBH4 + 3NaF
14.20. 完成并配平下列反应:
(1) Si + HNO3 + HF → (2) Na2B4O7 + HCl + H2O →
(3) BF3 + Na2CO3 + H2O → (4) Ca2Si+ HCl →
(5)(6)Be2C+ H2O →
(7) SiO2 + C + Cl2→ (8) B2H6 + Cl2 →
(9)(10) Si2H6 + H2O →
(11) B2H6 + NH3 → (12) B2H6 + Li H →
(13) Na2SO4 + C+ SiO2 →
解:(1) 3Si + 4HNO3 + 18HF =3H2SiF6 + 4NO↑ + 8H2O
(2) Na2B4O7 + 2HCl + 3H2O =4H3BO3↓+ 2NaCl
(3) 4BF3 + 2Na2CO3 =3NaBF4 + 2CO2↑ + NaBO2
(4) Ca2Si+ 4HCl =2CaCl2 + SiH4
(5)
(6) Be2C + 4H2O =2Be(OH)2 + CH4↑
(7)
(8) B2H6 + 6Cl2=2BCl3 + 6HCl
(9)
(10) Si2H6 +(4+n) H2O =2SiO2·nH2O + 7H2↑
(11) 2B2H6 + 6NH3=2B3N3H6 + 12H2
(12) B2H6 + 2LiH =2LiBH4
(13) Na2SO4 + C+ SiO2 =Na2SiO3 + SO2 + CO
14.21. 试计算:
(1)把1.5g H3BO3溶于100mL水中,所得溶液pH为多少?
(2)把足量Na2CO3加入75吨的纯硬硼钙石中,假定转化率为85%,问所得硼砂的质量是
多少?(已知H 3BO 3 K 1 = 7.3 × 10 ?10 )
解:(1)
H 3BO 3 + H 2O
B(OH)4- + H +
H 3BO 3的摩尔质量= 61.81 g·mol ?1
H 3BO 3的摩尔浓度 = 1.5 × 1000 / (61.81 × 100) = 0.2426 mol·L ?1 [H +] =(7.3 × 10 ?10 × 0.2426 )1/2 = 1.33 × 10 ?5 pH = 4.88 (2)硬硼钙石组成:Ca 2B 6O 11· 5H 2O
Ca 2B 6O 11· 5H 2O + 2Na 2CO 3 + 5H 2O = Na 2B 4O 5 (OH)4· 8H 2O + 2NaBO 2 + 2CaCO 3↓ 4NaBO 2 + CO 2 + 10H 2O = Na 2B 4O 5 (OH)4· 8H 2O + Na 2CO 3 1份 Ca 2B 6O 11· 5H 2O → 1.5份Na 2B 4O 5 (OH)4· 8H 2O 412 573 75 x x = 573 × 75 / 412 = 104.3(吨) 按转化率85%计算,所得硼砂质量为: 104.3×85% = 88.66(吨)即8.9× 10 4 kg
14.22.两种气态硼氢化物的化学式和密度如下:BH 3在290K 和53978Pa 时的密度为0.629 g·L ?1 ;
B 2H 5在292K 和6916Pa 时的密度为0.1553 g·L ?1 。这两种化合物的相对分子质量各是多少?写出它们的分子式。
解:BH 3的相对分子质量 = (0.629 / 53.978) × 8.314 × 290 = 28.1
分子量为最简式BH 3式量(14)的2倍,故分子式为B 2H 6 。 B 2H 5的相对分子质量 = (0.1553 / 6.916) × 8.314 × 292=54.51 分子量为最简式B 2H 5式量(27)的2倍,故分子式为B 4H 10 。
14.23. 有人根据下列反应制备了一些硼烷:
4BF 3(g) + 3LiAlH 4(s)
2B 2H 6(g) + 3LiF(s) + 3AlF 3(s)
乙醚
若产率为100%,用5g BF 3和10.0g LiAlH 4反应能得到多少克B 2H 6?制备时,由于用了未经很好干燥的乙醚,有些B 2H 6与水反应损失了,若水的质量为0.01g ,试计算损失了多少克B 2H 6?
解:BF 3 的摩尔质量= 67.81 g·mol ?1 LiAlH 4的摩尔质量 = 37.92 g·mol ?1
反应中BF 3 的摩尔数 = 5 / 67.81 = 0.0737 mol
按反应式中BF 3和LiAlH 4 的计量关系,LiAlH 4 的用量是过量的,故生成B 2H 6 的量按BF 3的用量计算。 4BF 32B 2H 6
4×67.81 2×27.62
5 x x = 2 × 27.62 × 5 / (4 × 67.81) =1.018g
B 2H 6与少量水反应后,损失的量为: B 2H 6 + 6H 2O = 2H 3BO 3 + 6H 2 27.62 108
x 0.01 x = 27.62 × 0.01 / 108= 0.0026g
14.24. 体积为50mL 的CO 、CO 2和H 2组成的混合气体与25mL O 2在室温及1.01 ×103 kPa 压力
下点燃,爆炸后在上述同样的温度和压力下测得总体积为37mL 。把这37mL 气体用KOH 溶液吸收,最后剩下5mL 不能吸收的气体,计算原混合气体中各组分气体的体积分数。 解:设原混合气体中:CO -a mL CO 2-b mL H 2-c mL
由题意可知: a + b + c = 50mL
V 1(O 2) = 25mL a + b + c + V 1(O 2) = 75mL
该混合气体与O 2在室温和1.01 ×103 kPa 下点燃,其反应为:
2CO(g) + O 2(g) 2CO 2(g)点燃2H 2(g) + O 2(g)
2H 2O(l)
点燃
①②
反应后的混合气体经KOH 吸收CO 2后,还剩余5mL “残气”。 从反应①可知,1体积CO 转变为1体积CO 2 , 故 a + b = 37-5 = 32 mL c = 50-32 = 18 mL
从反应②可知,18mL H 2需9mLO 2与之完全反应生成水,因此,混合气体与O 2点燃反应后,由于H 2与O 2反应气体体积减少了27mL ;由于CO 氧化为CO 2 ,气体体积减少了11mL , 即:75-27-37=11mL
由反应①可知,原来混合气体中CO 的体积为22 mL , 则CO 2的体积 b = 32-22 = 10 mL
反应后剩余O 2的体积V 2(O 2) = 25-11-9 = 5 mL 原混合气体中各组分气体的体积分数: V(CO) = 22/50 × 100%= 44% V(CO 2)= 10/50 × 100% = 20% V(H 2 ) = 18/50 × 100% = 36%
精心整理 第八章水溶液 8-1现需1200克80%(质量分数)的酒精作溶剂。实验室存有浓度为70%的回收酒精和95%的酒精,应各取多少进行配置? 解:令用浓度为70%的酒精X 克,95%的酒精Y 克。 (70%X+95%Y )/(X+Y )=80%① X+Y =1200② 由①②得,X =720Y =480 8-2(1(2(3(4解:(1所以c (2(3)(4)同理c(NH 3)=)()(233O H n NH n +=18 /)28100()17/28(-+×100%=29.17% 8-3如何将25克NaCl 配制成质量分数为0.25的食盐水溶液? 解:令加水X 克,依题意得0.25=25/(25+X),所以X =75克 所以加水75克,使25克NaCl 配成25%的食盐水。 8-4现有100.00mLNa 2CrO 4饱和溶液119.40g ,将它蒸干后得固体23.88g ,试计算: (1)Na 2CrO 4溶解度;
(2)溶质的质量分数; (3)溶液的物质的量浓度; (4)Na2CrO4的摩尔分数。 解:(1)令Na2CrO4溶解度为S所以S/(S+100)=23.88g/119.40g 所以S=25g (2)ω(Na2CrO4)=23.88g/119.40g×100%=20% (3)M(Na2CrO4)=162g/mol; mol g g 3) / 162 /( 88 . 23 - -1 (4) 8-5在-1H2SO4 g/100g (H2O 8-6纯甲解:m 8-7 解:由 解得: 8-8 ⑴胰岛素的摩尔质量; ⑵溶液蒸气压下降Δp(已知在25℃时水的饱和蒸气压为3.17kPa)。 解:(1)C=Π/RT =4.34KP a/8.314P a·L·mol-1×(273+25)K =0.00175mol·L-1 摩尔质量=0.101g/0.00175mol·L-1×0.01L=5771.43g/mol (2)△P=P B*×X A=3170P a×n1/(n1+n2) ≈3170P a×n1/n2=3170P a×(0.101g/5771.43g/mol)×(18g/mol)/(10×1g)=0.0998P a 8-9烟草的有害成分尼古丁的实验式为C5H7N,今有496mg尼古丁溶于10.0g水中,所得溶液在101kPa下的沸点为100.17°C,求尼古丁的相对分子质量。
药学院无机化学试题及参考答案 (无机化学试题部分) 一、填空题(每空1分,共20分) 1.NH3分子的空间构型是,中心原子N原子采取杂化。 2.原子轨道以方式重叠,轨道重叠部分是沿着键轴呈圆柱形对称而分布的共价键叫键。 3.BeCl2分子为型分子,中心原子采取杂化,分子的固有偶极矩μ(>0,=0)。 4.某反应的△H和△S皆为负值,当温度升高时,△G(增大,减小)。 5.具有ns2np1~6电子构型的是区元素,具有(n-1)d5ns2电子构型的是族元素。 6.酸碱质子理论认为, 是酸,是碱。 7.在含有AgCl固体的饱和溶液中加入盐酸,则AgCl的溶解度;如加入氨水,则其溶解度;若加入KNO3,则其溶解 度。 8.298K时,Mg(OH)2的K sp为1.2×10-11;Ag2CrO4的K sp为9×10-12,则溶解度较大的是 者。 9.产生渗透现象必须具备两个条件,一是,二 是。 10.将0.115g奎宁(M=329.12克/摩)溶解在1.36g樟脑中,其凝固点为442.6K(T f=452.8K,K f=39.70)则凝固点降低为,m 为。 二、选择题(请在备选答案中选择一个正确的答案,并用“√”符号表示。每小题1分,共 20分) 1.下列各组物质中,属于等电子体系的是:( ) A.NO和CN— B.CO和N2 C.O2和NO D.NO和O2 2.第二主族元素的+2价阳离子的碳酸盐(MCO3)中最稳定的是:( )
A.MgCO3 B.CaCO3 C.SrCO3 D.BaCO3 3.下列各分子或离子的稳定性按递增顺序排列的是:( ) A.NO+< NO < NO— B.NO—< NO < NO+ C.NO< NO—< NO+ D.NO< NO+ < NO— 4.下列各组量子数中,不合理的一组是:( ) A.3,0,0,+1/2 B.3,2,3,1/2 C.2,1,0,-1/2 D.4,2,0,1/2 5.298K和101.3kPa下,下列化学方程式所表示的化学反应中属于熵减少的是:( ) A.C(s)+ O2(g) = CO2(g) B.S(s)+ O2(g) = SO2(g) C.2Na(s)+ O2(g) = Na2O2(s) D.N2(g)+ O2(g) = 2NO(g) 6.已知NH3(g)的标准生成热,则反应N2(g)+3H2(g)=2NH3 (g)的热效应为(): A.-46.2; B.46.2 C.-92.4 D.92.4 7.a,b,c三个电子具有的量子数(n,l,m)为a:3,2,0;b:3,1,0;c:3,1,-1。 三个电子的能量大小顺序为:( ) A.a>b>c; B.a> c > b; C.a>b=>c; D. c> a>b; 8.稀溶液依数性的本质是() A、渗透压 B、沸点升高 C、蒸气压降低 D、凝固点降低 9.现有蔗糖(C12H22O11)、氯化钠、氯化钙三种溶液,它们的浓度均为0.1mol?L-1,则渗透压由低到高的顺序是() A、CaCl2 第一章物质存在的状态………………………………………………………………2 一、气体 .......................................................................................................... 2 二、液体 .......................................................................................................... 3 ①溶液与蒸汽压 ................................................................................................ 3 ②溶液的沸点升高和凝固点的下降 ................................................................... 3 ③渗透压 .......................................................................................................... 4 ④非电解质稀溶液的依数性 .............................................................................. 4 三、胶体 .......................................................................................................... 4 第二章 化学动力学初步……………………………………………………………5 一、化学反应速率 ............................................................................................ 5 二、化学反应速率理论 ..................................................................................... 6 三、影响化学反应速率的因素 .......................................................................... 6 2、温度 ............................................................................................................ 7 第三章 化学热力学初步……………………………………………………………8 一、热力学定律及基本定律 .............................................................................. 8 二、化学热力学四个重要的状态函数 ................................................................ 9 4、自由能 ....................................................................................................... 10 ①吉布斯自由能 .............................................................................................. 10 ②自由能G ——反应自发性的判据 .................................................................. 11 ③标准摩尔生成自由能θ m f G ? (11) 第13章 氢和稀有气体 13-1 氢作为能源,其优点是?目前开发中的困难是什么? 1、解:氢作为能源,具有以下特点: (1)原料来源于地球上储量丰富的水,因而资源不受限制; (2)氢气燃烧时放出的热量很大; (3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境; (4)有可能实现能量的储存,也有可能实现经济高效的输送。 发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用 13-2按室温和常压下的状态(气态 液态 固态)将下列化合物分类,哪一种固体可能是电的良导体? BaH 2;SiH 4;NH 3;AsH 3;PdH 0.9;HI 13-3试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。 3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。 13-4试说明稀有气体的熔点 、沸点、密度等性质的变化趋势和原因? 4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。 这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。分子量越大,分子间相互作用力越大,熔点沸点越来越高。 密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。 13-5你会选择哪种稀有气体作为:(a )温度最低的液体冷冻剂;(b )电离能最低 安全的放电光源;(c )最廉价的惰性气氛。 13-6用价键理论和分子轨道理论解释HeH 、HeH + 、He 2+ 粒子存在的可能性。为什么氦没有双原子分子存在? 13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型: (a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF 7、 解: 4XeF 平面四边形 2XeF 直线形 3XeO 三角锥 XeO 直线形 下列电子的量子数(n, l, m和m s)不合理的是 收藏 A. 3, 0, 0, +1/2 B. 3, 1 , 0, -1/2 C. 3, 0, 0, -1/2 D. 3, 3, 0, +1/2 回答错误!正确答案:D NaH2PO4的共轴酸是 收藏 A. Na2HPO4 B. Na3PO4 C. NaHCO3 D. H3PO4 回答错误!正确答案:D ■?…一 . . 、?…、...... 12 . . 一■.一.... 、一种元素的相对原子质量,是该元素的一定质量与核素6C的摩尔质量的1/12的比值,这 一质量是 收藏 A. 原子质量 B. 各核素原子质量的平均质量 C. 平均质量 D. 1mol原子平均质量 回答错误!正确答案:D 下列说法错误的是 收藏 A. 基元反应都是多分子反应。 B. 一步完成的反应是基元反应。 C. 由一个基元反应构成的化学反应称简单反应 D. 由两个或两个以上基元反应构成的化学反应称复杂反应。 回答错误!正确答案:A 需配制Ph=5的缓冲溶液,选用收藏 A. HAc-NaAc (pKa=4.75) B. NaH2PO4-Na2HPO4 (pKa2=7.2 ) C. Na2CO3-NaHCO3 ( pKa2=10.25 ) D. NH3.H2O-NH4Cl (pKb=4.75 ) 回答错误!正确答案:A 某元素的电子构型为[A门3d64s0的离子是收藏 A. Fe3+ B. Ni2+ C. Mn2+ D. Co3+ 回答错误!正确答案:D 配合离子[CuCl5]3-的中心离子收藏 A. sp2 B. dsp3 C. sp3 D. dsp2 回答错误!正确答案:B 以下平衡不属于化学平衡的是收藏 A. 沉淀溶解平衡和配位平衡 B. 常温下水的蒸发与凝结平衡 C. 酸碱电离平衡和氧化还原平衡 D. N2 + 3H2 == 2NH3 回答错误!正确答案:B 催化剂是通过改变反应进行的历程来加速反应速率,这一历程影响收藏 无机化学复习总结 无机化学复习不完全攻略(原创,有不足,请指点)5 j5 K# N. x2 r) 转载自free kao yan6 n! Z+ E9 T; _) m/ U 首先说明一下,我是复习考有机专业的,因为接触无机比较早,也看过一些无机的教材,对无机的知识点略有了解,同时应版主要求,把版中无机的讨论带动起来,故介绍一下个人学的无机的心得,供大家参考,仅代表个人观点. & B$ {0 `1 t3 h7 ~ 无机的东西比较杂,并且比较松散,主要可以分为理论部分和元素化合物部分! V% q* h7 C' G+ O 理论部分主要分为四大结构和四大平衡,以及化学热力学,动力学初步和溶液 四大结构:原子结构,分子结构,配合物结构,晶体结构 四大平衡:酸碱平衡,沉淀溶解平衡,配位离解平衡,氧化还原平衡 如果你考物化的话化学热力学和动力学基础就不用看了,物化讲的比这个透彻得多,平衡的总纲以及溶液部分在物化里面也是讲的很详细; 如果你分析化学学得好的话,四大平衡也可以少看很多,因为分析化学就是建立在四大平衡的基础上的(仪器分析不算,呵呵); 5 `2 f: h; A$ f/ f+ F5 k 而结构化学里面所涉及到的结构问题又比无机的四大结构深多了,同样如果你在这方面比较强,那四大结构又省了很多事. 但是如果每门掌握的都不透彻怎么办呢?不要担心,无机的理论部分 仅仅是是一个大纲性质的东西,也就是总结性的概括.所以每种理论都有,但是每种理论要求都比较简单,按照四大结构-四大平衡-化学热力学初步-化学动力学初步-溶液的顺序自己仔细地过一遍也不是很难的事情,起码我感觉比自学有机容易多了,呵呵 如果你的化学基础比较扎实,也不要在旁边偷偷笑,正所谓"结构决定性质",无机尽管理论比较简单,但是其精髓在于用简单的理论解释大量的现象和物质性质,在你掌握相关理论的基础上要能够灵活地把它们运用到平时见到的单质和化合物的性质解释.这样才算真正掌握了无机的理论. 总的来说无机的理论部分重点在运用. s5 V [. M$ }# E) Z 而无机化学的重点则元素部分,这个也是无机主要讲的东西以及无机的特点., Y2 A. _0 I, {& Q3 Y4 ^" z- G" a 首先建议周期表最好是背过,认识并且会写除f区以外的元素,镧系最好能背过,一些重要的比如说La Ce也要知道的.* ~8 E+ ?2 e3 m$ G2 @ 个人感觉主族元素里面比较重要的是B,P,S,Sn,Pb,As,Bi,4 W' N: X5 ?8 h 副族里Hg,Co,Cr,Mn,Ti,V,Cu等比较重要,下面分主族和副族元素分开介绍:, I* Q6 y8 _- _' l' b, U7 Y w 第一主族里面要注意过氧化物,超氧化物,臭氧化物的结构和生成条件,焰色反应的火焰颜色(包括碱土金属和少量过渡金属的都要知道),以及碱金属的不溶盐; 第四版无机化学习题及 答案 Company Document number:WUUT-WUUY-WBBGB-BWYTT-1982GT 第一章原子结构和原子周期系 1-1根据原子序数给出下列元素的基态原子的核外电子组态: (a)K (b)Al (c)Cl (d)Ti(Z=22)(e)Zn(Z=30)(f)As (Z=33) 答:(a)[Ar]4s1(b)[Ne]3s23p1(c)[Ne]3s23p5(d)[Ar]3d54s2(e)[Ar] 3d104s1(f)[Ar]4s24p3 1-2给出下列原子或离子的价电子层电子组态,并用方框图表示轨道,填入轨道的电子用箭头表示。 (a)Be (b)N (c)F (d)Cl-(e)Ne+(f)Fe3+(g)As3+ 1-3 Li+、Na+、K+、Rb+、Cs+的基态的最外层电子组态与次外层电子组态分别如何 1-4以下+3价离子那些具有8电子外壳Al3+、Ga3+、Bi3+、Mn3+、Sc3+ 答:Al3+和Sc3+具有8电子外壳。 1-5已知电中性的基态原子的价电子层电子组态分别为: (a)3s23p5(b)3d64s2(c)5s2(d)4f96s2(e)5d106s1 试根据这个信息确定它们在周期表中属于那个区、哪个族、哪个周期。 答:(a)p区,ⅦA族,第三周期(b)d区,Ⅷ族,第四周期(c)s区,ⅡA族,第五周期(d)f区,ⅢB族,第六周期(e)ds区,ⅠB族,第六周期1-6根据Ti、Ge、Ag、Rb、Ne在周期表中的位置,推出它们的基态原子的电子组态。 答:Ti位于第四周期ⅣB族,它的基态原子的电子组态为[Ar]3d24s2; Ge位于第四周期ⅣA族,它的基态原子的电子组态为[Ar]3d104s24p2; Ag位于第五周期ⅠB族,它的基态原子的电子组态为[Kr] 4d105s1; Rb位于第五周期ⅠA族,它的基态原子的电子组态为[Kr] 5s1; Ne位于第二周期0族,它的基态原子的电子组态为[He] 2s22p6。 1-7某元素的基态价层电子构型为5d36s2,给出比该元素的原子序数小4的元素的基态原子电子组态。 答:该元素的基态原子电子组态为[Xe] 4f126s2。 1-8某元素基态原子最外层为5s2,最高氧化态为+4,它位于周期表哪个去是第几周期第几族元素写出它的+4氧化态离子的电子构型。若用A代表它的元素符号,写出相应氧化物的化学式。 答:该元素的基态原子电子组态为[Kr] 4d25s2,即第40号元素锆(Zr)。它位于d区,第五周期ⅣB族,+4氧化态离子的电子构型为[Kr],即 1s22s22p63s23p63d104s24p6, 相应氧化物为AO2。 第二章分子结构 2-1用VSEPR模型讨论CO2、H2O、NH3、CO32-、PO33-、PO3-、PO43-的分子模型,画出他们的立体结构,用短横代表σ键骨架,标明分子构型的几何图形的名称。 无机化学复习题 一、选择题(每题1分,共20分) ( )1.已知H 2和He 的相对分子质量分别为2和4。2g H 2与2gHe 混合后体系的压力为3300kPa ,则混合气体中He 的分压为: A 、3300 kPa B 、2200 kPa C 、1100 kPa D 、1650 kPa ( )2.关于氧的相对原子质量下列叙述正确的是: A 、 等于8O 16核素一个原子的质量 B 、等于氧的平均原子质量 C 、等于氧的平均原子质量与碳—12核素质量的121之比值 D 、等于一个氧原子的质量与碳—12核素质量的121之比值 ( )3.下列关系式中错误的是: A 、H=U+PV B 、ΔU(体系)+ ΔU(环境)=0 C 、ΔG=ΔH-T ΔS D 、ΔG(正反应)×ΔG(逆反应)=1 ( )4.反应 2NO 2(g)(红棕色)==N 2O 4(g)(无色) Δr H m <0 达平衡后,将体系的温度降低,则混合气体颜色: A 、变浅 B 、变深 C 、不变 D 、无法判断 ( )5.反应 C(s)+O 2(g)===CO 2(g),Δr H m <0 下列不能使正反应速度增大的措施是: A 、缩小体系的体积 B 、升高体系温度 C 、增大氧气的分压 D 、减小CO 2(g)的分压 ( )6.在298K 的温度下石墨的标准生成自由能为: A 、等于零 B 、大于零 C 、小于零 D 、无法确定 ( )7.NO(g)+CO(g)===2 1N 2(g)+CO 2(g) Δr H m = -373.4kJ ·mol -1 ,欲使有害气体NO 和CO 取得最高转化率,则应选择的操作是: A 、增大NO 浓度 B 、增大CO 浓度 C 、降低温度、增大压力 D 、使用高效催化剂 ( )8.对于等温等压下进行的任一反应,下列叙述正确的是: A 、Δr S m 越小反应速度越快 B 、Δr H m 越小反应速度越快 C 、Δr G m 越小反应速度越快 D 、Ea 越小反应速度越快 ( )9.下列四个量子数(依次为n ,l ,m ,m s )不合理的一组是: A 、(3、1、0、+21) B 、(4、3、1、-2 1) C 、(4、0、0、+21) D 、(2、0、1、-2 1) ( )10.下列四个量子数所描述的电子运动状态中,能量最高的电子是: A 、(4、1、0、+21) B 、(4、2、1、-2 1) C 、(4、0、0、+21) D 、(4、1、1、-2 1) ( )11.下列分子中C 原子形成共价键时,原子轨道采取SP 3杂化的是: 第四章氧化和还原 1、在下列两种物质中,分别按Mn,N元素的氧化值由低到高的顺序将各物质进行排列: (1)MnO, MnSO4, KMnO4, MnO(OH), K2MnO4, Mn (2) N2, NO2, N2O5, N2O, NH3, N2H4 2、指出下列反应中的氧化剂,还原剂以及它们相应的还原,氧化产物。 (1)SO2+ I2 + 2H2O →H2SO4 + 2HI (2)SnCl2 + 2HgCl2→SnCl4 + Hg2Cl2 (3) 3I2 + 6NaOH →5NaI + NaIO3 + 3H2O 3、用氧化值法配平下列氧化还原反应方程式: (1)Cu + H2SO4 (浓)→CuSO4 + SO2 + H2O (2)KMnO4 + S →MnO2 + K2SO4 (3) As2S3+ HNO3 + H2O →H3AsO4 + H2SO4 + NO (4) (NH4)2Cr2O7→N2 + Cr2O3 + H2O (5) P4 + NaOH →PH3+ NaH2PO2 4、用离子-电子法配平下列氧化还原反应方程式: (1)Cr2O72-+ SO32+ + H+→Cr3+ + SO42- (2) PbO2(s) + Cl- + H+→Pb2+ (实际是PbCl42-) + Cl2 (3) H2S + I2→I- + S (4) CrO2- + H2O2 + OH-→CrO42- (5) ClO3- + S2-→Cl- + S + OH- (6) KMnO4+ FeSO4+ H2SO4→MnSO4+ Fe2(SO4)3+ K2SO4 + H2O (7) KI + KIO3 + H2SO4→I2+ K2SO4 (8) Ca(OH)2 + Cl2→Ca(ClO) 2 + CaCl2 (9) Fe(OH)2 + H2O2→Fe(OH)3 (10) Al + NO3-→[Al(OH) 4] - + NH3 (11) ClO- + Fe(OH)3→Cl- + FeO42- (12) P + CuSO4→Cu3P + H3PO4 + H2SO4 5、把镁片和铁片分别放入浓度均为1 mol .L-1的镁盐和亚铁盐的溶液中,并组成一个原电池。写出原电池的电池符号,指出正极和负极,写出正、负极的电极反应,并指出哪种金属会溶解? 6、从铁、镍、铜、银四种金属及其盐溶液[c(M2+)=1.0 mol .L-1]中选出两种,组成一个具有最大电动势的原电池,写出其电池符号。 7、标准状态下,下列各组物种内,哪种是较强的氧化剂?说明理由。 (1)PbO2或Sn4+(2) I2或Ag+ (3) Cl2或Br2(4)HNO2或H2SO3 8、标准状态下,下列各组物种内,哪种是较强的还原剂?说明理由。 (1) F-或Cu (2) I2或Ag+ (3) Cl2或Br2(4) HNO2或H2SO3 9、查出下列各电对的标准电极电势E aθ,判断各组电对中,哪一个 高中无机化学习题与答案 绪论 一.是非题: 1.化学变化有新物质产生,而物理变化无新物质产生. 2.化学变化是由于构成分子的原子外层电子运动状态的改变而引起的、原子核不变的一类变化 3.元素的变化为物理变化而非化学变化. 4.化学变化的特点是原子核不变分子组成或原子间结合方式发生变化. 5.化学反应常伴有发光现象,但并非所有的发光现象都属于化学反应. 二.选择题: 1.化学研究的对象是具有宏观实体的物质,它不包括 A.希有气体 B:混合物 C.电子流或γ──射线 D.地球外的物质 2.纯的无机物不包括 A.碳元素 B.碳化合物 C.二者都对 D.二者都错 3.下列哪一过程不存在化学变化 A.氨溶于水 B.蔗糖溶在水中 C.电解质溶液导电 D.照相底片感光 第一章原子结构和元素周期系 一.是非题 1.电子在原子核外运动的能量越高,它与原子核的距离就越远.任何时候,1s电 子总比2s电子更靠近原子核, 因为 E 2s > E 1s . 2.原子中某电子的各种波函数,代表了该电子可能存在的各种运动状态,每一种状态可视为一个轨道. 3.氢原子中,2s与2p轨道是简并轨道,其简并度为4;在钪原子中,2s与2p 轨道 不是简并轨道, 2p x ,2p y ,2p z 为简并轨道,简并度为3. 4.从原子轨道能级图上可知,任何原子在相同主量子数的轨道上,能量高低的顺序总是f > d > p > s;在不同主量子数的轨道上,总是(n-1)p > (n-2)f > (n-1)d > ns. 5.在元素周期表中, 每一周期的元素个数正好等于该周期元素最外电子层轨道可以容纳的电子个数. 6.所有非金属元素(H,He除外)都在p区,但p区所有元素并非都是非金属元素. 7.就热效应而言,电离能一定是吸热的,电子亲和能一定是放热的. 8.铬原子的电子排布为Cr[Ar]4s13d5,由此得出: 洪特规则在与能量最低原理出现矛盾时,首先应服从洪特规则. 9.s区元素原子丢失最外层的s电子得到相应的离子,d区元素的原子丢失处于最高能级的d电子而得到相应的离子. 10.在原子核里因质子数和中子数不同,就组成了不同的核素;同样在原子核里因质子数和中子数不等,就构成了同位素.可见,核素也就是同位素. 二.选择题 1.玻尔在他的原子理论中 A.证明了电子在核外圆形轨道上运动; B.推导出原子半径与量子数平方成反比; C.应用了量子力学的概念和方法; D.解决了氢原子光谱和电子能量之间的关系问题. 2.波函数和原子轨道二者之间的关系是 A.波函数是函数式,原子轨道是电子轨迹; B.波函数和原子轨道是同义词; C.只有轨道波函数与原子轨道才是同义的; D.以上三种说法都不对. 3.多电子原子的原子轨道能级顺序随着原子序数的增加 A.轨道能量逐渐降低,但能级顺序不变; B.轨道能量基本不变,但能级顺序改变; C.轨道能量逐渐增加,能级顺序不变; D.轨道能量逐渐降低,能级顺序也会改变. 4.周期表中各周期元素数目是由什么决定的 A.2n2(n为主量子数); B.相应能级组中所含轨道总数; C.相应能级组中所含电子总数 D. n + 0.7规则 5.下列电子构型中,电离能最低的是 第一章物质的结构 1-20 氦首先发现于日冕。1868年后30年间,太阳是研究氦的物理,化学性质的唯一源泉。 (a)观察到太阳可见光谱中有波长为4338A,4540A,4858A,5410A,6558A 的吸收(1A=10-10m来分析,这些吸收是由哪一种类氢原子激发造成的?是 He,He +还是He2+ ? (b)以上跃迁都是由n i=4向较高能级(n f)的跃迁。试确定 n f值,求里德堡常数R He i+。(c)求上述跃迁所涉及的粒子的电离能I(He j+),用电子伏特为单位。 (d)已知 I(He+)/ I(He)=2.180。这两个电离能的和是表观能A(He2+),即从He 得到He2+的能量。A(He2+)是最小的能量子。试计算能够引起He 电离成He2+所需要的最低能量子。在太阳光中,在地球上,有没有这种能量子的有效源泉? (c=2.997925×108 ms-1;h=6.626×10-34Js;1eV=96.486KJ.mol-1=2.4180×1014Hz) 38、第8周期的最后一个元素的原子序数为:148。电子组态:8S26P6 39、二维化的周期表可叫宝塔式或滴水钟式周期表。这种周期表的优点是能够十分清楚地看到元素周期系是如何由于核外电子能级的增多而螺旋发展的,缺点是每个横列不是一个周期,纵列元素的相互关系不容易看清。 40、“类铝”熔点在1110K~1941K之间,沸点在1757~3560K之间,密度在1.55g/m3 ~4.50 g/m3之间。 41、最高氧化态+3,最低氧化态-5。 1、解:O=O (12e-); H-O-O-H 14(e-); C=O (10e-);0=C=O(16e-);Cl-N-Cl(26e-);F–S - F (34e-) F F 2、解:共13种,如: 无机化学试题 一、选择题 1. 对于H2O2和N2H4,下列叙述正确的是…………………………………………() (A) 都是二元弱酸(B) 都是二元弱碱 (C) 都具有氧化性和还原性(D) 都可与氧气作用 2. 下列含氧酸中属于三元酸的是…………………………………………………() (A) H3BO3(B) H3PO2(C) H3PO3(D) H3AsO4 3. 下列各对含氧酸盐热稳定性的大小顺序,正确的是……………………………() (A) BaCO3 > K2CO3(B) CaCO3 < CdCO3 (C) BeCO3 > MgCO3(D) Na2SO3 > NaHSO3 4. 铝在空气中燃烧时,生成…………………………………………………………() (A) 单一化合物Al2O3(B) Al2O3和Al2N3 (C) 单一化合物Al2N3(D) Al2O3和AlN 5. 下列含氧酸根中,属于环状结构的是…………………………………………() (A) (B) (C) (D) 6. 下列化合物与水反应放出HCl 的是……………………………………………() (A) CCl4(B) NCl3(C) POCl3(D) Cl2O7 7. InCl2为逆磁性化合物,其中In的化合价为……………………………………() (A) +1 (B) +2 (C) +3 (D) +1和+3 8. 鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………() (A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量) 9. 下列各组化合物中,都有颜色的一组化合物是………………………………() (A) SiCl4,SnCl4,PbO (B) CCl4,NO2,HgI2 (C) SiC,B2H6,N2O4 (D) PbO2,PbI2,SnS 10. 将过量SiF4通入NaOH溶液中,主要产物是……………………………………() (A) H4SiO4,NaF (B) Na2SiO3,NaF (C) Na2SiO3,Na2SiF6(D) SiO2,HF 11. 将NCl3通入碱性溶液,其水解产物是…………………………………………() (A) NH3和ClO-(B) NH3和Cl- (C)和Cl-(D)和Cl- 12. PCl3和水反应的产物是…………………………………………………………() (A) POCl3和HCl (B) H3PO3和HCl 第一章 物质的状态 理想气体:是设定气体分子本身不占空间、分子间也没有相互作用力的假想情况下的气体。 实际气体:处于高温(高于273 K )、低压(低于数百千帕)的条件下,由于气体分子间距离相当大,使得气体分子自身的体积与气体体积相比可以忽略不计,且分子间作用力非常小,可近似地将实际气体看成是理想气体。 pV = nRT (理想气体状态方程式) R 称为比例常数,也称为摩尔气体常数。 R = Pa·m3·mol-1·K-1 = kPa·L·mol-1·K-1 = ·mol-1·K-1(Pa·m3=N·m-2·m3=N·m = J ) 道尔顿理想气体分压定律 式中 xi 为某组分气体的摩尔分数。理想气体混合物中某组分气体的分压等于该组分气体的摩尔分数与总压力的乘积。 分体积定律 当几种气体混合时,起初每一种气体在各处的密度是不同的,气体总是从密度大的地方向密度小的地方迁移,直至密度达到完全相同的状态,这种现象称为扩散。 相同温度、相同压力下,某种气体的扩散速度与其密度的平方根成反比,这就是气体扩散定律。用u i 表示扩散速度,ρi 表示密度,则有: 或 式中u A 、u B 分别表示A 、B 两种气体的扩散速度,ρA 、ρB 分别表示A 、B 两种气体的密度。 同温同压下,气体的密度(ρ)与其摩尔质量(M )成正比,据此可以表示为: 对理想气体状态方程进行修正 对n = 1 mol 实际气体,其状态方程为: 气体分子运动论的主要内容包括以下几个假设: (1)气体由不停地作无规则运动的分子所组成; (2)气体分子本身不占体积,视为数学上的一个质点; i i RT RT p p n n V V =∑=∑=i i i i i p n n p p x p p n n === 或1212= = +++ i i i i n RT n RT n RT nRT V V V V p p p p =???=+???=∑ ∑ i u A B u u A B u u 2 2()()an p V nb nRT V +-=2()()m m a p V b RT V +-= 无机化学习题册及答案 Revised as of 23 November 2020 《无机化学》课程习题册及答案 第一章溶液和胶体 一、是非题:(以“+”表示正确,“-”表示错误填入括号) 1.渗透压力比较高的溶液,其物质的量浓度也一定比较大。()2.相同温度下,物质的量浓度均为200mmol·L-1的NaCl溶液和葡萄糖溶液,其渗透压相等() 3.相同温度下,渗透浓度均为200mmol·L-1的NaCl溶液和CaCl2溶液,其渗透压相等() 4.临床上的两种等渗溶液只有以相同的体积混合时,才能得到等渗溶液。() 5. 两种等渗溶液以任意比例混合所得溶液在临床上必定是等渗溶液()6.临床上,渗透浓度高于320 mmolL-1的溶液称高渗液() 7.在相同温度下, molL-1的葡萄糖溶液与 molL-1的蔗糖溶液的渗透压力是相等的() 8. 物质的量浓度均为·L-1的NaCl液和葡萄糖液渗透浓度相等() 9. 对于强电解质溶液,其依数性要用校正因子i来校正。() 二、选择题 1.使红细胞发生溶血的溶液是() A.·L-1 NaCl B.·L-1葡萄糖 C.·L-1葡萄糖 D.·L-1 NaCl 2.物质的量浓度均为 mol·L-1的下列溶液,其渗透压最大的是() A.葡萄糖 B.NaCl C.CaCl2 D.无法比较 3.使红细胞发生皱缩的溶液是() A.·L-1 NaCl B.·L-1葡萄糖 C.·L-1葡萄糖 D.·L-1 NaCl 4.在相同温度下,物质的量浓度均为 mol·L-1的下列溶液,其渗透压最小的是() A.葡萄糖 B.NaCl C.CaCl2 D.无法比较 5.物质的量浓度均为 mol·L-1的下列溶液,在临床上属于等渗溶液的是 ()A.葡萄糖 B.NaCl C.CaCl2 D.蔗糖 6. 试排出在相同温度下下列溶液渗透压由大到小的顺序 ( ) a. c(C6H12O6)= mol·L-1 b. c[(1/2)Na2CO3]= mol·L-1 c. c[(1/3)Na3PO4]= mol·L-1 d. c(NaCl)= mol·L-1 A. d>b>c>a B. a>b>c>d C. d>c>b>a D. b>c>d>a 7. 医学上的等渗溶液,其渗透浓度为() A. 大于280 mmol·L-1 B. 小于280 mmol·L-1 C. 大于320 mmol·L-1 D. 280-320 mmol·L-1 8. 欲使同温度的A、B两种稀溶液间不发生渗透,应使两溶液(A、B中的基本单元均以溶质的“分子”式表示) ( ) A 质量摩尔浓度相同 B 物质的量浓度相同 C 质量浓度相同 D 渗透浓度相同 9. 质量浓度为11.1g·L-1CaCl2 (M=111.0 g·mol-1)溶液的渗透浓度是 ( ) ·L-1·-1 C ·L-1·L-1 三、填充题: 第19章d区金属(一) 第四周期d区金属 19.1 试以原子结构理论说明: (1)第四周期过渡金属元素在性质上的基本共同点; (2)讨论第一过渡系元素的金属性、氧化态、氧化还原稳定性以及酸碱稳定性变化规律; (3)阐述第一过渡系金属水合离子颜色及含氧酸根颜色产生的原因。 答:(1)①第四周期过渡金属元素都具有未充满的3d轨道,特征电子构型为(n-1)d1~10ns1~2,具有可变的氧化态。电离能和电负性都比较小,易失去电子呈金属性,故具有较强的还原性。 ②与同周围主族元素的金属相比,第一过渡系金属原子一般具有较小的原子半径和较大 的密度。 ③由于过渡金属的d电子和s电子均可作为价电子参与金属键的形成,金属键较强,因此 它们有较大的硬度,有较高的熔、沸点。 (2)第一过渡系元素为Sc、Ti、V、C r、Mn、F e、C o、N i、C u、Zn 从Sc→Zn,金属性:逐渐减弱;最高氧化态:先逐渐升高,到锰为最高,再逐渐降低; 氧化还原性:金属的还原性逐渐减弱,最高氧化态含氧酸(盐)的氧化性逐渐增强;酸碱稳定性:从钪到锰最高氧化态氧化物及其水合物酸性增强、碱性减弱,同一元素不同氧化态氧化物及水合物一般是低氧化态的呈碱性,最高氧化态的呈酸性。 (3)①由于过渡金属离子具有未成对d电子,易吸收可见光而发生d-d跃迁,故过渡系金属水合离子常具有颜色。 ②第一过渡系金属含氧酸根离子VO3-、CrO42-、MnO4-,呈现颜色是因为化合物吸收 可见光后电子从一个原子转移到另一个原子而产生了荷移跃迁,即电子从主要是定域在配体上的轨道跃迁到主要是定域在金属上的轨道(M←L),对于含氧酸根离子则是发生O22-→M n+的荷移跃迁。 19.2 Sc2O3在哪些性质上与Al2O3相似,为什么? 答:(1)都为碱性氧化物。在Sc3+、Al3+溶液中加碱得水合氧化物M2O3·nH2O(M=Sc、Al)。 (2)其水合氧化物都是两性的,溶于浓碱NaOH得Na3[M(OH)6],溶于酸得到M3+盐,其水溶液易水解。 原因:Sc的电子层结构为[Ar]3d14s2与第Ⅲ族Al同属是Sc、Y、La、Ac分族的第一个成员,故相似。 19.3 简述从钛铁矿制备钛白颜料的反应原理,写出反应方程式。试从热力学原理讨论用氯化法 从TiO2制金属钛中为什么一定要加碳? 答:先用磁选法将钛铁矿进行富集得钛精矿,然后用浓H2SO4和磨细的矿石反应。(或:工业上从钛铁矿制钛白粉,大致可分四步:1.酸解;2.冷却结晶;3.加热水解;4.焙烧)。加铁屑,在低温下结晶出FeSO4·7H2O,过滤后稀释并加热使TiOSO4水解: 大学无机化学试题集及答案 第一章气体、液体和溶液的性质 1. 敞口烧瓶在7℃所盛的气体,必须加热到什么温度,才能使1/3气体逸出烧瓶? 2. 已知一气筒在27℃,30.0atm时,含480g的氧气。若此筒被加热到100℃,然后启开 阀门(温度保持在100℃),一直到气体压力降到 1.00atm时,共放出多少克氧气? 3. 在30℃时,把8.0gCO2、6.0gO2和未知量的N2放入10dm3的容器中,总压力达800 mmHg。试求: (1) 容器中气体的总摩尔数为多少?(2) 每种气体的摩尔分数为多少? (3) 每种气体的分压为多少?(4) 容器中氮气为多少克? 4. CO和CO2的混合密度为 1.82g dm-3(在STP下)。问CO的重量百分数为多少? 5. 已知某混合气体组成为:20份氦气,20份氮气,50份一氧化氮,50份二氧化氮。问:在0℃,760mmHg下200dm3此混合气体中,氮气为多少克? 6. S2F10的沸点为29℃,问:在此温度和1atm下,该气体的密度为多少? 7. 体积为8.2dm3的长颈瓶中,含有 4.0g氢气,0.50mol氧气和分压为2atm 的氩气。这 时的温度为127℃。问: (1) 此长颈瓶中混合气体的混合密度为多少? (2) 此长颈瓶内的总压多大? (3) 氢的摩尔分数为多少? (4) 假设在长颈瓶中点火花,使之发生如下反应,直到反应完全: 2H2(g) + O2(g) =2H2O(g) 当温度仍然保持在127℃时,此长颈瓶中的总压又为多大? 8. 在通常的条件下,二氧化氮实际上是二氧化氮和四氧化二氮的两种混合气体。在45℃,总压为1atm时,混合气体的密度为 2.56g dm-3。计算: (1) 这两种气体的分压。(2) 这两种气体的重量百分比。 9. 在1.00atm和100℃时,混合300cm3H2和100 cm3O2,并使之反应。反应后温度和压力 回到原来的状态。问此时混合气体的体积为多少毫升?若反应完成后把温度降低到27℃,压力仍为 1.00atm,则混合气体的体积为多少毫升? (已知27℃时水的饱和蒸汽压为26.7mmHg) 10. 当0.75mol的“A4”固体与2mol的气态O2在一密闭的容器中加热,若反应物完全消 耗仅能生成一种化合物,已知当温度降回到初温时,容器内所施的压力等于原来的一半,从这些数据,你对反应生成物如何下结论? 11. 有两个容器A和B,各装有氧气和氮气。在25℃时: 容器A:O2 体积500 cm3,压力1atm。考研无机化学_知识点总结
《无机化学下》第四版习题答案
无机化学(药学专)——考试题库及答案.docx
无机化学考研复习总结笔记
第四版无机化学习题及答案
无机化学复习题及答案
无机化学第四章课后习题参考答案
高中无机化学习题与答案
2015北师大版无机化学习题答案(上册)
大学无机化学试题及答案
无机化学重点笔记
无机化学习题册及答案
北师大无机化学四版习题答案19章d区金属一
最新大学无机化学试题集及答案