
探究课题:生物组织中蛋白质的鉴定
一、课题分析
1.教学目标
(1)初步学会蛋白质的鉴定方法,领悟并能描述该实验的实验原理。
(2)探索该实验的最佳实验材料及稀释浓度,培养学生的科学素质和创新意识。
(3)如实观察并记录实验现象和结果,提高学生的实验操作能力和观察能力,
(3)分析实验过程中出现的问题,培养学生分析问题和解决问题的能力。
2.背景描述
组成蛋白质的氨基酸分子是通过肽键互相连接起来的,其中的肽键结构与双缩脲(尿素加热至180℃左右,生成双缩脲并放出一分子氨)相似,双缩脲(H2NOC—NH—CONH2)在碱性环境中能与Cu2+作用,形成紫色或紫红色的络合物,这个反应叫做双缩脲反应。反应式如下:
但双缩脲反应不仅为含有两个以上肽键的物质所有。含有一个肽键和一个-CS-NH2,-CH2- NH2 NH2
NH2,-CRH-NH2或-CHOH-CHNH2等基因的物质以及乙二酰二氨(O=C-C=O)等物质也有此反应。因此,一切蛋白质或二肽以上的多肽都有双缩脲反应,但有双缩脲反应的物质不一定都是蛋白质或多肽。
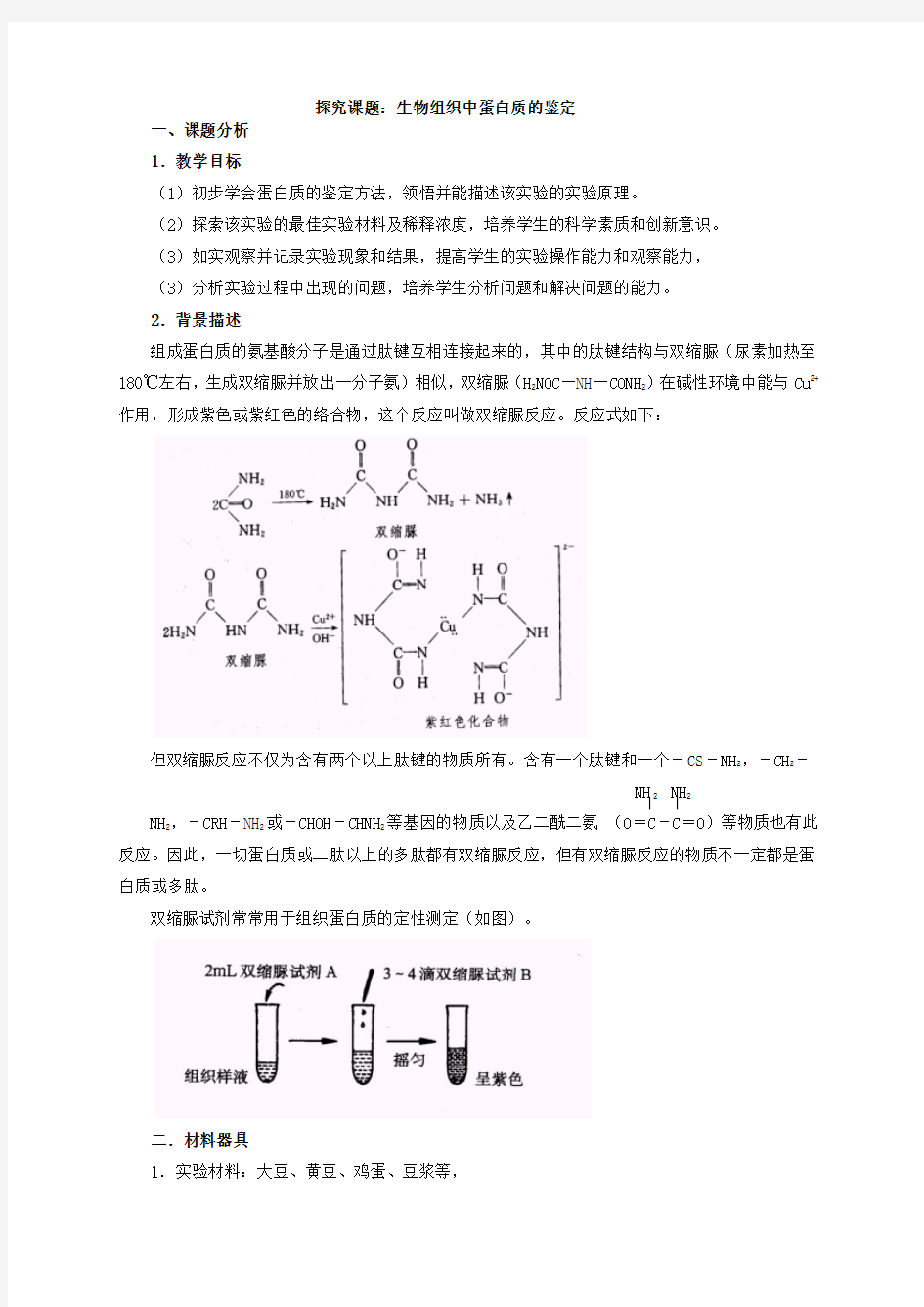
双缩脲试剂常常用于组织蛋白质的定性测定(如图)。
二.材料器具
稀释2倍~10倍的蛋清等)。
2.仪器:双面刀片,研钵,石英砂,玻璃漏斗,试管,试管架,试管夹,纱布,镊子,吸管,小烧杯,试管刷。
3.试剂:双缩脲试剂,蒸馏水
三.教学建议
本课题的重点是初步学会蛋白质的鉴定方法,领悟该实验的实验原理。难点是规范地完成该实验的操作步骤,并能分析实验过程中出现的问题,从实验中找出该实验的最佳实验材料。根据实验内容,建议教师采用探究性实验和验证性实验相结合的教学方法。
学生可以按4人为一组进行实验,通过颜色反应定性地验证生物组织中的蛋白质成分,让学生了解构成细胞的化合物中含有蛋白质,并学会蛋白质鉴定的操作方法,学会获得新知识、新的科学知识的途径和方法。
可以让同组内不同的学生分别选择不同的实验材料、不同浓度的实验材料,如选择提前浸泡的黄豆与没有浸泡的黄豆;豆浆;没有稀释的蛋清与稀释2倍~10倍的蛋清等。实验时要求学生能分工合作,体现合作精神。通过相互探讨,提高学生对实验材料进行选择和处理的能力,更深刻地理解教材中实验设计的科学之处,有利于培养学生科学的研究态度,提高学生的实验操作能力、观察能力和设计能力。通过让学生分析实验现象、撰写实验报告、提出改进实验的措施、改进实验的器具等方面让学生开展探究学习,使学生更好地理解知识,提高利用科学的研究方法来解决实际问题的能力,体现学生学习的主体性,利于激发学生的创新意识。
本实验所用的双缩脲试剂必须现配现用,否则实验不会成功。双缩脲试剂使用时,应先加试剂A(0.1g/mL的NaOH溶液),造成碱性的反应环境,再加试剂B(0.01g/mL的CuSO4溶液)。
配制双缩脲试剂的方法:配制取10g氢氧化钠放入量筒中,加水至100mL,待充分溶解后倒入试剂瓶中,配成质量浓度为0.1g/mL的氢氧化钠溶液,瓶口塞上胶塞,贴上标签,写上试剂A。取1g硫酸铜放入量筒中,加水至100mL,待充分溶解后倒入试剂瓶中,配成质量浓度为0.01g/mL的硫酸铜溶液(蓝色)。瓶口塞上胶塞,贴上标签,写上试剂B 。
在鉴定前,可以留出一部分样液,以便与鉴定后的样液的颜色变化作对比,这样可以增强说服力。
四.探究活动
步骤之一探索实现原理创设探究实验情景
设疑:生物组织细胞内的蛋白质是如何鉴定的?
步骤之二探索实验材料探索实验过程
包括对实验材料的探索,以及研究获得较好实验效果的蛋清浓度稀释倍数,颜色反应的规范操作等。通过预习,让学生描述:蛋白质分子与双缩脲试剂发生颜色反应的原理是怎样的?
设疑1:该实验的实验材料应该如何选择?
教师引导学生从以下几方面考虑:①注意材料中蛋白质含量 的多少,含量多则实验效果明显;②考虑材料是否容易得到(成本问题);③实验前材料的处理是否方便。
设疑2:如何取得蛋白质组织样液?
(1)制备含蛋白质的生物组织样液(以黄豆为例): ①取几粒浸泡过(或没浸泡过)的黄豆(或大豆),去皮,切成薄片。②将黄豆薄片放进研钵中,加少许石英砂和5mL 水,充分研磨。③将玻璃漏斗插入试管中,在漏斗上垫上一层纱布,过虑黄豆组织研磨液。
(2)用现成的食用豆浆、牛奶作实验材料。 (3)制备不同浓度的蛋清稀释液
取一个鸡蛋,用镊子在一端轻轻敲破一小块蛋壳,用吸管从蛋壳的破孔处吸取0.5mL 蛋白液滴入若干个小烧杯中,分别向小烧杯中加入0、2.5mL 、5mL 、7.5mL 、10mL 水,搅拌均匀,加以稀释。
让学生思考:你认为哪些材料
可以作该实验的材料?
让学生试一试:浸泡与未浸泡的种子进行实验操作,效果一样吗?
让学生思考:事先需要留出一些黄豆组织样液的目的是什么?
让学生仔细观察:黄豆组织样液的颜色是怎样的?
让学生思考:把蛋清稀释成不同浓度的设计目的是什么?
让学生仔细观察:蛋清组织样液的颜色是怎样的?
设疑3:蛋白质鉴定的实验如何操作?要注意些什么?
步骤:①取1支试管,向试管内注入黄豆组织样液2mL(或者向1支试管内注入豆浆、或牛奶、或蛋白稀释液2mL)。②向试管中加入双缩脲试剂A(质量浓度为0.1g/mL的氢氧化钠溶液),摇荡均匀。注意观察试管内溶液的颜色有什么变化。③再向试管中加入3~4滴双缩脲试剂B(质量浓度为0.01g/mL的硫酸铜溶液),摇荡均匀。
试管内溶液的颜色有什么变化
试管内溶液的颜色有什么变化
试管内溶液的颜色有什么变化
步骤之三实验结果的讨论及小结
在教师指导下,让学生们大胆讨论,自己总结实验经验,得出结论。让学生思考:双缩脲试剂A 和双缩脲试剂B的用量及加入的顺序可以改变吗?若加入的顺序颠倒,请预测结果会怎样?
让学生生试一试:用豆浆、牛奶、蛋清等做实验,结果是否一样?用稀释不同浓度的蛋清做实验,哪一浓度效果最好?
让学生生试一试:把加入的双缩脲试剂A和双缩脲试剂B 顺序颠倒,结果怎样?
让学生想一想:设置对照组2的目的是什么?
对照组1 对照组2
实验所得结论参考:①实验材料最好选用富含蛋白质的生物组织(或器官),植物材料常用大豆、黄豆,动物材料常用的是鸡蛋(卵白)。如用大豆、黄豆,必须提前浸泡1~2d。这样容易
研磨成浆(豆浆的实验效果也不错,因此有条件的学校,可以直接采用现成的大豆磨成的豆浆,豆浆可以购买,也可以用小型的榨汁机制)。②用蛋清做实验必须经过稀释,如蛋清液稀释不够,与双缩脲试剂反应后会粘固在试管的内壁上,使反应不容易彻底,并且试管也不容易刷洗干净。③双缩脲试剂A和双缩脲试剂B的加入的顺序不可以改变。因为蛋白质只有在碱性环境中才能与CuSO4发生紫色反应,否则紫色反应会被Cu(OH) 2遮蔽。让学生反思:这次探索实验的心得。
五.讨论与思考
1.在实验中,最后的实验结果紫色反应不明显,试管内溶液的颜色还是呈现CuSO4的蓝色,这是为什么?
简析:这是因为双缩脲试剂B(质量浓度为0.01g/mL的蓝色CuSO4溶液)加得过多。
2.如何稀释蛋清才能取得较好的实验效果?
简析:在蛋白质的鉴定实验中,若用蛋白质作实验材料,必须稀释,以免实验后粘住试管,不易洗刷。方法:将鸡蛋一端轻轻敲破一小口,让蛋清流入容器中,然后按比例蛋清∶蒸馏水=1∶9的比例混合搅匀,再用4层纱布过滤,放入滴瓶备用,这样配出的蛋清稀释液与双缩脲试剂发生反应后不会粘固在试管的内壁上,反应也彻底,试管也易刷洗干净。
3.对斐林试剂和双缩脲试剂的配方,叙述不正确的是( )
A.都含有NaOH溶液和CuSO
4
B.斐林试剂的配制是将4~5滴0.05g/mL的CuSO4溶液滴入2mL0.1g/mL的NaOH
溶液中即
C.双缩脲试剂是将3~4滴0.01g/mL的CuSO4溶液滴入2mL0.1g/mL的NaOH
溶液中混合而
D..双缩脲试剂含有两种试剂:质量浓度为0.1g/mL的NaOH溶液和质量浓度为0.01g/mL的CuSO4溶液
答案:C
4.在用双缩脲试剂鉴定蛋白质实验时,正确的操作是( ) A.2mL蛋白稀释液先加2mL0.1g/mL的NaOH溶液,再加3~4滴0.01g/mL的CuSO4溶液CuSO4 B.2mL蛋白稀释液先加3~4滴0.01g/mL的CuSO4溶液,再加2mL0.1g/mL的NaOH溶液
D.在2mL 0.1g/mL的NaOH和3~4滴0.01g/mL的CuSO4混合液中加入2mL蛋白稀释液答案:A
六.深化拓展
1.用徒手切片法鉴定组织中的蛋白质
取新鲜的大豆种子(去种皮),用刀片切下极薄的一片放在载玻片上,先滴2滴质量浓度为0.1g/mL的NaOH溶液,片刻后,再加质量浓度为0.01g/mL的CuSO4溶液2滴,充分混合反应后,盖上盖玻片,在高倍显微镜下,可看到大豆细胞含有圆形的紫色颗粒。
(摘自2003年《生物学通报》第4期第36页)
2.蛋白质的颜色反应
(1)蛋白质的黄色反应
①蛋白质中含有苯环结构的氨基酸,如酪氨酸、色氨酸、苯丙氨酸等。这类蛋白质可被浓硝酸硝化生成黄色的硝基苯衍生物。该物质在酸性环境中呈黄色,在碱性环境中转变为橙黄色的硝醌酸钠。反应如下:
绝大多数蛋白质含有带苯环中氨基酸,因此都有黄色反应。皮肤、毛发、指甲等遇浓HNO3变黄即发生此类黄色反应。
注:浓硝酸(d=1.42g/mL)
②鉴定方法:
取一支试管加入稀释20倍的鸡蛋清溶液4滴,再加入2滴浓硝酸,用微火加热并观察现象,待试管出现黄色后,于室温下逐滴加入10%氢氧化钠溶液至碱性,观察颜色变化。
蛋白质的颜色反应表:
3.蛋白质含量的测定与纯度鉴定
在蛋白质分离提纯的过程中,经常需要测定蛋白质的含量和检查某一蛋白质的提纯程度。这些工作包括:测定蛋白质的总量,测定蛋白质混合物中某一特定蛋白质的含量和测定最后制品的纯度。
测定蛋白质总量常用的方法有:凯氏定氮法、双缩脲法、Folin-酚试剂法和紫外吸收法等。
测定蛋白质混合物中某一特定蛋白质的含量通常要用具有高度特异性的生物学方法。如具有酶或激素性质的蛋白质可以利用它们的酶活性或激素活性来测定含量;利用抗体-抗原反应,也可测定某一特定的蛋白质含量。这些生物学方法的测定与总蛋白质测定配合起来,可以用来研究蛋白质分离过程中某一特定蛋白质的提纯程度。
蛋白质制品纯度的鉴定通常采用物理化学的方法,例如电泳分析、沉降分析、扩散分析等。(摘自沈同王镜岩主编《生物化学》上册第223页-第224页)
七.文献链接
1.施忆等编著《探索·实验·研究》浙江教育出版社2002年版第41页-第42页2.人民教育出版社生物自然室编著全日制普通高级中学教科书(试验修订本·必修)生物第一册2002年12月第18页-第19页。
3.人民教育出版社生物自然室编著全日制普通高级中学教科书(试验修订本·必修)生物第一册《教师教学用书》2002年11月第16页-第17页。
4.陈允飞主编《教与学整体设计》高中生物(第一册)2002年12月
第22页-第23页。
5.郑光美主编《生物学通报》2000年第10期第28页
6.相关网址:https://www.doczj.com/doc/b813734379.html,/readnews.asp?NewsID=32
萧山区第三高级中学金小英
第十五章蛋白质的生物合成 一:填空题 1.蛋白质的生物合成是以________________作为模板,________________作为运输氨基酸的工具, ________________作为合成的场所。 2.细胞内多肽链合成的方向是从________________端到________________端,而阅读mRNA的方向是从________________端到________________端。 3.核糖体上能够结合tRNA的部位有________________部位、________________部位和 ________________部位。 4.ORF是指________________,已发现最小的ORF只编码________________个氨基酸。 5.蛋白质的生物合成通常以________________作为起始密码子,有时也以________________作为起始密码子,以________________、________________和________________作为终止密码子。 6.SD序列是指原核细胞mRNA的5′-端富含________________碱基的序列,它可以和16SrRNA的3′-端的________________序列互补配对,而帮助起始密码子的识别。 7.含硒半胱氨酸的密码子是________________。 8.原核生物蛋白质合成的起始因子(IF)有________________种,延伸因子(EF)有________________种,终止释放因子(RF)有________________种;而真核生物细胞质蛋白质合成的延伸因子通常有 ________________种,真菌有________________种,终止释放因子有________________种。 9.密码子的第2个核苷酸如果是嘧啶核苷酸,那么该密码子所决定氨基酸通常是________________。 10.原核生物蛋白质合成中第一个被参入的氨基酸是________________。 11.真核生物细胞质蛋白质合成对起始密码子的识别主要通过________________机制进行。 12.无细胞翻译系统翻译出来的多肽链通常比在完整的细胞中翻译的产物要长,这是因为 ________________。 13.蛋白质的半寿期通常与________________端的氨基酸性质有关。 14.tmRNA是指________________。 15.同工受体tRNA是指________________。 16.疯牛病的致病因子是一种________________。 17.已发现体内大多数蛋白质正确的构象的形成需要________________的帮助,某些蛋白质的折叠还需要________________和________________酶的催化。 18.SRP是指________________,它是一种由________________和________________组成的超分子体系,它的功能是________________。 19.蛋白质定位于溶酶体的信号是________________。 20.分子伴侣通常具有________________酶的活性。 答案:1. 2 3 4
第十五章蛋白质生物合成 一、填空题: 1.三联体密码子共有 64 个,其中终止密码子共有 3 个,分别为 UAA 、 UAG 、 UGA 。2.密码子的基本特点有四个分别为从5′→3′无间断性、简并性、变偶性、通用性。3.次黄嘌呤具有广泛的配对能力,它可与 U 、 C 、 A 三个碱基配对,因此当它出现在反密码子中时,会使反密码子具有最大限度的阅读能力。 4.原核生物核糖体为 70 S,其中大亚基为 50 S,小亚基为 30 S;而真核生物核糖体为 80 S,大亚基为 60 S,小亚基为 40 S。 5.原核起始tRNA,可表示为 tRNA f甲硫,而起始氨酰tRNA表示为f Met-tRNA f甲硫;真核生物起始tRNA可表示为 tRNA I甲硫,而起始氨酰-tRNA表示为 Met-tRNA f甲硫。 6.肽链延伸过程需要进位、转肽、移位三步循环往复,每循环一次肽链延长 1 个氨基酸残基,原核生物中循环的第一步需要 EF-Tu 和 EF-Ts 延伸因子;第三步需要 EF-G 延伸因子。 7.原核生物mRNA分子中在距起始密码子上游约10个核苷酸的地方往往有一段富含嘌呤碱基的序列称为Shine-Dalgrano序列,它可与16S-rRNA 3′-端核苷酸序列互补。 8.氨酰-tRNA的结构通式可表示为: O tRNA-O-C-R NH2, 与氨基酸键联的核苷酸是 A(腺嘌呤核苷酸)。 9.氨酰-tRNA合成酶对氨基酸和相应tRNA都具有较高专一性,此酶促反应过程中由 ATP 水解提供能量。 10.肽链合成的终止阶段, RF1因子和 RF2因子能识别终止密码子,以终止肽链延伸,而 RF3因子虽不能识别任何终止密码子,但能协助肽链释放。 11.蛋白质合成后加工常见的方式有磷酸化、糖基化、脱甲基化、信号肽切除。12.真核生物细胞合成多肽的起始氨基酸为甲硫氨酸,起始tRNA为 tRNA I甲硫,此tRNA 分子中不含 T C 序列。这是tRNA家庭中十分特殊的。 二、选择题(只有一个最佳答案): 1.下列有关mRAN的论述,正确的一项是( C ) A、mRNA是基因表达的最终产物 B、mRNA遗传密码的阅读方向是3′→5′ C、mRNA遗传密码的阅读方向是5′→3′ D、mRNA密码子与tRNA反密码子通过A-T,G-C配对结合 E、每分子mRNA有3个终止密码子 2.下列反密码子中能与密码子UAC配对的是( D ) A、AUG B、AUI C、ACU D、GUA 3.下列密码子中,终止密码子是( B ) A、UUA B、UGA C、UGU D、UAU
一、对与错 1、PLLA和PCL通常比其共聚物有着更高的结晶度。 2、聚酯类生物材料的可降解性由分子链中碳酸含量而定,因此说PCL的降解速率快于 PLA。 3、In vitro组织再生就是让组织在体内再生。 4、组织再生需要有一个多孔支架,此支架可以支持细胞并使之增值成组织,许多材料像明 胶和PLA都被用于组织再生支架材料。 5、合成聚合物通常比天然材料有更强的免疫反应。 6、TCP被认为是一种生物活性和可降解性生物材料。 7、合成材料通常比天然材料有更好的力学性能 8、水凝胶是交联聚合物在分子间相互作用力与溶胀力之间的平衡状态。 9、水接触角通常被用于测定材料的亲水性。 10、材料的亲水性随着接触角的降低而下降。 11、自由基聚合就是加成聚合反应。 12、In vivo 组织再生就是让组织在体内再生。 13、天然材料在体内主要靠酶降解。 14、生物玻璃可以与接触组织产生牢固的结合界面。 二、名词解释 1、什么是生物材料?给出定义并举例说明。 2、什么是生物相容性?如何评价材料的生物相容性? 3、什么是生物玻璃? 4、什么是生物降解材料?什么是非生物降解材料?举例说明。 5、什么是复合材料?列出可能的复合材料制备医用制品或器材的方法。 6、什么是组织工程?有哪三要素? 7、描述静电纺纳米纤维的原理,及对纺丝液的性能要求。 8、描述用于提高生物相容性的表面改性的方法。 9、什么是医用代用品?举例出你所知道的例子。
10、列出甲壳素的医用应用并说明其特有的生物学活性。 11、什么是药物缓释?为什么要进行药物缓释? 12、什么是天然生物材料?举出几个种类。 13、什么是合成生物材料?有几种合成方法? 三、论述题 1、下列有关天然生物材料的描述是对还是错? ①大多数天然材料都来自于动物体和植物体。 ②多数是由水解而降解。 ③与合成聚合物相比,用于医用材料的成型方法较少。 ④生物相容性较好。 ⑤总是被看成是用于体内移植的安全材料。 2、陶瓷类生物材料可以以不同的方式来应用,即生物惰性、生物活性及可吸收降解性,讨 论HA、TCP、Al2O3 和Na2O-CaO-P2O5-SiO2 的生物可降解性及生物活性。 3、探讨PLA作为手性聚合物的立构规整性,有哪几种立构规整性产物,并对其结构及性能 关系进行描述。 4、描述胶原蛋白的化学结构和物理结构,并探讨导致其物理结构变化的条件是什么?其变 性产物是什么? 5、描述接触角测定材料的亲水性方法。并给出接触角与亲水性之间的关系。 6.组织工程支架的特点是什么?列出理想支架制备的可行性方法。 7.有哪几种表面改性的方法?它们的原理是什么? 8.描述将肝素固定在生物材料表面的方法。
第11章组织工程相关纳米生物材料 组织工程学(Tissue Engineering)一门多学科交叉的边缘学科,其研究涉及到细胞生物学、分子生物学、发育生物学、免疫学、临床医学、生物材料学、计算机科学等多个相关学科。它是继细胞生物学和分子生物学之后,生命科学发展史上又一个新的里程碑,标志着医学将走出器官移植的范畴,步入制造组织和器官的新时代,人们试图通过组织工程学的研究,真正建造出替代人每一种组织甚至器官功能的生物性替代物。它的提出、建立和发展是对医学领域组织、器官缺损和功能障碍传统治疗方法和模式的一次革命,孕育着巨大的科学价值和广阔的临床应用前景,是21世纪生命科学研究领域的焦点之一,必将产生巨大的社会和经济效益【1-2】。 目前国内外对组织工程学研究极为重视,组织工程相关产品正逐步形成高附加值的高科技产业,有些产品已开始进入临床。如人工皮肤TransCyte、Apligraf、人工软骨Carticel TM等。其它领域如骨、膀胱、血管、角膜、神经、输尿管、肝、胰、心脏瓣膜、血细胞、食管、肠管等的研究也正处于积极的实验阶段。 但是,目前组织工程研究尚存在许多基本问题亟待解决,主要表现在:①生命现象的本质及活动规律,即各种细胞、组织和器官的基本结构及其与功能的关系;②如何调控种子细胞的特异性粘附、增殖、定向分化以使其获得良好的生物学活性,充分发挥其特定的功能;③生长因子等组织诱导因子的大规模制备及持续控制释放;④具有良好表面相容性、结构相容性、适当生物降解性和特定生物活性的仿生“智能”基质材料的研制,以引发人们所需的特异性、可控性生物反应等等【3-4】。 纳米科技给上述问题的解决带来了新的发展机遇。和它在生物医用材料领域中的意义与应用前景一样,纳米科技在组织工程学各领域的研究中也有重大的科学意义及广阔的应用前景,人们可以将纳米科技在其它领域的研究成果广泛地应用于组织工程学各相关领域【5-8】。组织工程学和纳米科技的有机结合,标志着组织工程学研究进入一个崭新的时代——纳米组织工程学时代。纳米组织工程学(Nano tissue engineering)就是将纳米科学与技术和组织工程学有机结合,从原子、分子水平认识细胞和组织的基本结构及其与功能的关系,阐明生命现象的本质及活动规律,并研制具有特定功能的仿生纳米装置和材料,为更好地恢复、维持或改善病损组织的功能奠定基础【1-4】。 纳米组织工程学的首要任务是利用纳米科学的原理和技术,从原子、分子水平进一步深入认识真核细胞基因组的结构及功能调控、基因产物如何构建成细胞结构、如何调节和行使细胞功能等,从而认识各种细胞、组织和器官的基本结构及其与功能的关系,阐明生命现象的本质及活动规律。然后从科学认识发展到工程技术,设计和制造出相应的纳米器件、纳米药物、纳米仿生“智能”基质材料,
广州辉骏生物科技有限公司 蛋白质质谱鉴定 一、技术概述 质谱是将待测物质变为气态离子并将离子按质荷比(m/z)进行分离,检测各种离子谱峰的强度而实现分析的一种方法。 蛋白质定性通常采用质谱分析结合数据库检索的方法,所分析的样本可以是蛋白质溶液、蛋白质胶条或胶点。 简单蛋白样本,例如双向电泳斑点或纯化蛋白,通常采用MALDI-TOF/TOF质谱(MS/MS)进行分析。 混合蛋白样本,例如蛋白溶液,或SDS-PAGE条带,通常采用液相色谱-质谱联用(LC-MS/MS)技术进行分析。应用领域有:亚细胞组分的全谱分析,IP、co-IP、Pull-down后的互作蛋白鉴定,或其他中等复杂蛋白样本的鉴定。 二、技术原理 串联质谱(MS/MS)检测蛋白的原理是:蛋白先经胰酶消化成肽段,肽段在质谱仪中离子化后,会带上一定量的电荷,通过检测器分析,可得到各肽段的质荷比(m/z),从而得知各肽段的相对分子质量。为获得肽段的序列信息,质谱仪会选取某些肽段进行破碎,再次分析,获得二级质谱。用检索软件选择相应的数据库对质谱数据进行分析,同时以打分的形式评判鉴定结果,当打分大于某个阈值时,即判定质谱鉴定成功,反之则鉴定失败。 LC-MS/MS方法是将蛋白酶切消化为肽段混合物,之后这些肽段先经高效液相色谱分离形成简单的组分,再进行串联质谱(MS/MS)分析;因此适合于混合蛋白样本的鉴定。 三、技术优势 1. 采用高效液相色谱和质谱联用的分析方法,可以一次性鉴定成百上千种蛋白质。 2. 鉴定准确性和灵敏度高。 四、技术流程 蛋白样本制备——蛋白酶解——串联质谱分析(或LC-MS/MS分析)——数据库检索——蛋白质鉴定结果
第十二章蛋白质的生物合成 一、知识要点 (一)蛋白质生物合成体系的重要组分 蛋白质生物合成体系的重要组分主要包括mRNA 、tRNA 、rRNA、有关的酶以及几十种蛋白质因子。其中,mRNA是蛋白质生物合成的直接模板。tRNA的作用体现在三个方面:3ˊCCA接受氨基酸;反密码子识别mRNA链上的密码子;连接多肽链和核糖体。rRNA和几十种蛋白质组成合成蛋白质的场所——核糖体。 遗传密码的特点:无标点性、无重叠性;通用性和例外;简并性;变偶性。 (二)蛋白质白质生物合成的过程 蛋白质生物合成的过程分四个步骤:氨基酸活化、肽链合成的起始、延伸、终止和释放。 其中,氨基酸活化即氨酰tRNA的合成,反应由特异的氨酰tRNA合成酶催化,在胞液中进行。氨酰tRNA合成酶既能识别特异的氨基酸,又能辩认携带该氨酰基的一组同功受体tRNA分子。 肽链合成的起始对于大肠杆菌等原核细胞来说,是70S起始复合物的形成。它需要核糖体30S和50S亚基、带有起始密码子AUG的mRNA、fMet-tRNA f 、起始因子IF1、IF2、IF3(分子量分别为10 000、80 000和21 000的蛋白质)以及GTP和Mg2+的参加。 肽链合成的延伸需要70S起始复合物、氨酰-tRNA、三种延伸因子:一种是热不稳定的EF-Tu,另一种是热稳定的EF-Ts,第三种是依赖GTP的EF-G以及GTP和Mg2+。 肽链合成的终止和释放需要三个终止因子RF1、RF2、RF3蛋白的参与。 比较真核细胞蛋白质生物合成与原核细胞的不同。 (三)蛋白质合成后的修饰 蛋白质合成后的几种修饰方式:氨基末端的甲酰甲硫氨酸的切除、肽链的折叠、氨基酸残基的修饰、切去一段肽链。 二、习题 (一)(一)名词解释 1.密码子(codon) 2.反义密码子(synonymous codon) 3.反密码子(anticodon) 4.变偶假说(wobble hypothesis) 5.移码突变(frameshift mutant) 6.氨基酸同功受体(isoacceptor) 7.反义RNA(antisense RNA) 8.信号肽(signal peptide) 9.简并密码(degenerate code) 10.核糖体(ribosome) 11.多核糖体(poly some) 12.氨酰基部位(aminoacyl site) 13.肽酰基部位(peptidy site) 14.肽基转移酶(peptidyl transferase) 15.氨酰- tRNA合成酶(amino acy-tRNA synthetase) 16.蛋白质折叠(protein folding) 17.核蛋白体循环(polyribosome) 18.锌指(zine finger) 19.亮氨酸拉链(leucine zipper) 20.顺式作用元件(cis-acting element) 21.反式作用因子(trans-acting factor)
SDS-PAGE测定蛋白质分子量及蛋白质的纯度鉴定一、实验目的与原理 蛋白质在聚丙烯酰胺凝胶中电泳时,它的迁移取决于它所带电荷以及分子大小和形状等因素。1967年Shapiro等人发现,如果在聚丙烯酰胺系统中加入阴离子去污剂十二烷基磺酸钠(SDS),大多数蛋白质能与SDS按一定比例结合,即每克蛋白质结合1.4g的SDS-复合物都带上相同密度的负电荷,它的量大大超过了蛋白质分子原有的电荷量,因而消除了蛋白质原有的电荷差别,使蛋白质分子电泳的迁移率主要取决于本身的分子量,而与蛋白质所带的电荷无关,在一定条件下,蛋白质的分子量的对数与电泳迁移率间呈负相关。 本实验的目的是对多酚氧化酶的纯化度鉴定及分子量的测定,通过实验,学习和掌握SDS聚丙烯酰胺凝胶电泳法蛋白质纯度和分子量的鉴定。 二、仪器与试剂 1、材料: 硫酸铵盐析沉淀的多酚氧化酶粗酶样品、DEAE-纤维素DE52柱层析的样品,Sephadex G-100柱层析的样品。 2、试剂: (1)丙稀酰胺(Acr母液):30%Acr (Acr/Bis) (2)10%的SDS溶液 (3)10%的过硫酸铵溶液 (4)四甲基乙二胺(TEMED) (5)分离胶缓冲液:1.5M Tris,PH8.8 (6)浓缩胶缓冲液:1.0M Tris,PH6.8 (7)电极缓冲液:10×30g Tris,125g 甘氨酸和5g SDS,加水溶解定容至1000ml,pH8.3 (8)样品缓冲液:0.2M Tris,PH6.8,1%SDS,30%甘油,巯基乙醇及溴酚兰 (9)染色液:0.15%考马斯亮蓝R250,溶于脱色液
(10)脱色液:50%的甲醇,7%的冰醋酸的水溶液 (11)标准分子量蛋白。 3、仪器设备: 电泳仪、垂直电泳槽等。 三、操作步骤 1、凝胶制备: 用两块电泳玻璃板制成垂直板槽(不能漏胶),垂直放置。将配制好的分离胶溶液倒入,滴加入无离子水,待凝胶聚集后,倒出无离子水,用吸水纸吸干,倒入浓缩胶,再插入梳子。 2、上样: 分别取样品若干ml于离心管中,按1/1~1/5比例加入5×样品缓冲液,再沸水浴中加热3~5min,取出待用。用微量注射器分别吸取不超过30μl不同浓度的标准蛋白样品和试验样品注入样品槽。点样结束后,调节电泳仪电流到10mA(2~3mA/em),保持电流稳定不变,当溴酚蓝迁移到离分离胶底1~2cm时,即可停止电泳。 3、染色: 电泳完毕后,取出凝胶板,浸入染色液中,在37℃温箱中保温过夜。倒掉染色液,24h后,即可看到清晰的蛋白质条带。 四、结果(略) 五、注意事项 1、SDS与蛋白质的结合按质量成比例(即:1.4gSDS/g蛋白质),如果比例不当,就不能得到准确的数据。 2、用SDS-聚丙烯酰胺凝胶电泳法测定蛋白质相对分子量时,必须同时作标准曲线。不能利用这次的标准曲线作为下次用。 3、有些蛋白质由亚基(如血红蛋白)或两条以上肽链(α-胰凝乳蛋白酶)组成的,它们在巯基乙醇和SDS的作用下解离成亚基或多条单肽链。因此,对于这一类蛋白质,SDS-聚丙烯酰胺凝胶电泳法测定的只是它们的亚基或是单条肽链的相对分子量。 4、有的蛋白质(如:电荷异常或结构异常的蛋白质;带有较大辅基的蛋白质)不能采用该法测相对分子量。 5、如果该电泳中出现拖尾、染色带的背景不清晰等现象,可能是SDS不纯引起。
生物材料在组织工程学中发挥的作用 MD+DI 访问了DSM 生物医学公司(荷兰马斯特里赫特)研发及技术总监Marc Hendriks,请他谈谈对于生物材料的看法。这篇专题访谈共分四部分,在第一部分中,DSM 生物医学公司(荷兰马斯特里赫特)的Hendriks 探讨了生物材料在应对医疗领域未来需求方面的巨大潜力,并且思考了生物材料在今后几年中对组织工程学的重要性。Hendriks 还解释了何为“三代生物材料。” 作者: Brian Buntz 2011年12月27日 行业新闻, 生物材料 [View] MD+DI:您能否简要描述一下生物材料当前以及未来可能对组织工程学发挥的作用? Hendriks:组织工程和再生医学领域(TERM) 是最前沿的现代医学领域。外科手术将人体组织移换位置,但由于对新位置的排斥反应,已经产生了生物变化。采用可植入异物材料的技术与不良事件有关,如移位、植入物/组织界面感染、骨折以及随时间推移产生的迁移。个体之间的移植有严格限制,必须能获得足够的捐献组织和器官,但也会产生免疫问题,随着时间的推移可能产生慢性排斥反应和严重破坏。 TERM 包括新的功能性活体组织的制造——无论体外或体内(包括原位)——使用通常与母体或支架相关的生物活性提示(例如,细胞、生长因子、多核苷酸),引导组织发展。直至80年代中期,TERM 才被定义为一个领域。TERM 从几个相互关联、完善的学科,包括细胞和干细
胞生物学、生物化学、分子生物学中吸收了大量新知识,这些学科分别并共同增进了对于复杂活体系统的理解。同样,在材料科学、化学工程和生物工程取得的突破,使活体系统中可合理应用工程原理。TERM可以说属于生命科学材料科学领域。 自从定义了TERM原理,其广泛的医疗和社会经济价值被认可,TERM也已取得了巨大进展。然而,迄今为止,只有相对较少的TERM产品已获得监管部门批准,甚至更少有产品已取得任何意义上的市场渗透。在数以百万计的患者获得可能从中受益的TERM疗法之前,必须克服技术和经济上的发展障碍。 如上所述,实质上,没有专为组织工程和再生医学设计的材料。当致力于设计和开发适合再生医学的生物材料时,再生医学才有发展前景。 TERM可使用多种生物材料形式,可根据使用指示选用,重点关注手术过程或组织发展中的难题。我通常将TERM产品类别根据四个主要材料进行划分: 1、细胞传递生物材料。细胞治疗,即通过对选定、增殖和药理治疗或体外改变的细胞进行管理,预防或治疗人类疾病。细胞管理中的破裂不佳和移植细胞整合,是最大难题。通常认为通过使用聚合物水凝胶,以微创的方式或手术轻便的方法允许注射或微创插入细胞和聚合物组合,可改善疗效。为使有效,水凝胶必须符合一系列设计标准,以发挥正常功能,并促进新组织的形成。这些标准包括物理参数(例如,退化和机械性能)以及生物性能参数(例如,生物相容性和细胞粘附)。不完全符合这些设计标准,可能会导致不良组织的形成。因此,这种生物材料发展的关键是充分了解手术前及手术中的程序和操作。 2、受控交付生长因子生物材料。与细胞治疗相反,使用生长因子(蛋白质或激素)侧重于利用内源性组织的再生潜力。这些物质旨在,在管理层面,调节多种细胞过程:补充、生长、增殖和分化。 第一次需采用弹丸注射——经动物测试有一定疗效——但普遍未经人体临床研究证实。直接交付生长因子可加速组织愈合和增长,但往往是与生长因子的最初爆发和在体内的半衰期短有关。生长因子的失控扩散也可能引起不良的副作用。这就需要利用基于创新材料的技术来更好地控制空间和时间上的交付。 3、组织工程支架材料。TERM 最“简单”的产品类别包括通常加工成能够支持三维组织形成的多孔结构的支架材料。TERM 支架通常有下述用途:
第十四章蛋白质的生物合成 一、单项选择题 1、原核生物中起始氨基酰-tRNA是 A.fMet-tRNA fMet B.Met-tRNA Met C. Arg-tRNA Arg D.leu- tRNA leu E.Asn--tRNA Asn 2、与mRNA上5′-ACG-3′密码子相应的tRNA反密码子(5′→3′)是 A.CGA B.IGC C.CIG D.CGI E.GGC 3、tRNA分子具有下列结构特征 A.密码环 B.有5'端-C-C-AOH末端 C.有反密码环和5'端-C-C-AOH末端 D.有多聚A尾 E. 3'端有C-C-AOH末端,另一侧有反密码环 4、在蛋白质生物合成中催化氨基酸之间形成肽键的酶是 A.氨基酸合成酶 B.羧基肽酶 C.转肽酶 D.氨基肽酶 E.氨基酸连接酶 5、原核生物翻译起始复合物有下列组分 A. DNA模板+RNA+RNA聚合酶 B. 翻译起始因子+核糖体 C. 核糖体+fMet-tRNA fMet+mRNA D. 核糖体+起始-tRNA E.氨基酰-tRNA合成酶 6、催化氨基酸活化的酶是 A.氨基酸- tRNA 转移酶 B.氨基酰- tRNA 合成酶 C.氨基肽酶 D.氨基酸转移酶 E.羧基肽酶 7、蛋白质生物合成的终止信号由下列哪种因子识别? A. σ B. RF C. EF D. IF E. ρ 8、通过结合细菌的核糖体大亚基而杀灭或抑制细菌的抗生素是 A.四环素 B.氯霉素 C.链霉素 D.嘌呤霉素 E.放线菌酮 9、翻译延长阶段所需的酶是 A. 转肽酶 B. 磷酸化酶 C. 肽链聚合酶 D. 氨基酰-tRNA合成酶 E.氨基肽酶 10、肽链延长时接受氨基酰-tRNA的部位是 A.小亚基 B.大亚基 C.A位 D.P位 E.肽位 11、氨基酸是通过那种化学键与tRNA 结合的 A. 肽键 B.磷酸酯键 C.酐键 D.酯键 E.氢键 12、在mRNA分子的5'端,下列密码子具有起始信号作用 A. UAA B. UAG C. UGA D.GUA E.AUG
中国组织工程研究与临床康复 第14卷 第38期 2010–09–17出版 Journal of Clinical Rehabilitative Tissue Engineering Research September 17, 2010 Vol.14, No.38 ISSN 1673-8225 CN 21-1539/R CODEN: Z LKHAH 7165www.CRTER .org Laboratory of Human Movement Science, Henan Engineering Technical School, Jiaozuo 454000, Henan Province, China Wang Rui ★, Master, Laboratory of Human Movement Science, Henan Engineering Technical School, Jiaozuo 454000, Henan Province, China sqh@https://www.doczj.com/doc/b813734379.html, Received: 2010-05-20 Accepted: 2010-06-28 河南工程技术学校 运动人体科学实验室,河南省焦作市 454000 王睿★,男,1967年生,汉族,河南省焦作市人,1989年河南师范大学毕业,硕士,主要从事运动人体科学方面的研究。 sqh@https://www.doczj.com/doc/b813734379.html, 中图分类号:R318 文献标识码:B 文章编号:1673-8225 (2010)38-07165-04 收稿日期:2010-05-20 修回日期:2010-06-28 (20100628011/ZS?Y) 人工生物材料及组织工程学手段修复腕关节韧带损伤★ 王 睿 Artificial biomaterials and tissue engineering technologies for repair of wrist articular ligament injury Wang Rui Abstract OBJECTIVE: To summarize and analyze the characteristics of artificial biomaterials intervention for wrist articular ligament injury. METHODS: A computer search was performed on PubMed database (https://www.doczj.com/doc/b813734379.html,/PubMed) and CNKI database (https://www.doczj.com/doc/b813734379.html, / index.htm), using key words of "wrist joint, ligament, rehabilitation, treatment" in English or in Chinese in the titles and abstracts. Articles related to wrist articular ligament injury and treatment, material science characteristics, biocompatibility and its application effect were selected, those recently published or published in the authority journals were preferred to the same field, a total of 22 literatures were included. RESULTS: The wrist joint is a very complex connection system, due to wrist joint physiological structure and biomechanical complexity, exercise-induced wrist ligament injury is common. At present, many studies have been performed addressing wrist ligament anatomy, histology and biomechanics, but few reports the use of artificial biomaterials and tissue engineering means to repair or reconstruct the wrist ligament injury. CONCLUSION: With the advances in cell biology and molecular biology methods and technology, ligament injury repair research has entered a new stage, artificial biomaterials and tissue engineering provide a new research direction for the treatment and rehabilitation measures of wrist articular ligament injury. Wang R. Artificial biomaterials and tissue engineering technologies for repair of wrist articular ligament injury. Zhongguo Zuzhi Gongcheng Yanjiu yu Linchuang Kangfu. 2010;14(38):7165-7168. [https://www.doczj.com/doc/b813734379.html, https://www.doczj.com/doc/b813734379.html,] 摘要 目的:总结分析人工生物材料干预腕关节韧带损伤的特点。 方法:作者应用计算机检索PubMed 数据库(https://www.doczj.com/doc/b813734379.html,/PubMed)及CNKI 数据库(https://www.doczj.com/doc/b813734379.html,/ index.htm),在标题和摘要中以“腕关节,韧带,康复,治疗”或“Wrist Joint ,Ligament ,Rehabilitation ,Treatment ” 为检索词进行检索。选择文章内容与腕关节韧带损伤与治疗手段、材料学特点、生物相容性及其应用效果相关,同一领域文献则选择近期发表或发表在权威杂志的文章,共纳入22篇文献。 结果:腕关节属于非常复杂的连接系统,由于腕关节生理结构及其生物力学的特殊性,体育运动中腕关节韧带损伤较为常见。目前,国内外已对腕关节韧带做过较多的解剖学、组织学及生物力学特性的研究,但针对腕关节韧带损伤后运用人工生物材料及组织工程学手段修复或重建方面的报告甚为少见。 结论:随着细胞生物学和分子生物学方法和技术的进步,韧带组织损伤修复研究进入了崭新阶段,人工生物材料及组织工程学的兴起为腕关节韧带损伤后的治疗与康复措施提供了新的研究方向。 关键词:腕关节;韧带;损伤;康复;治疗;组织工程;支架;生物材料 doi:10.3969/j.issn.1673-8225.2010.38.033 王睿.人工生物材料及组织工程学手段修复腕关节韧带损伤[J].中国组织工程研究与临床康复,2010,14(38):7165-7168. [https://www.doczj.com/doc/b813734379.html, https://www.doczj.com/doc/b813734379.html,] 0 引言 腕关节为前臂与手的连接结构,主要作用是使腕背伸、屈及前臂旋转,除由8块腕骨之间所构成的腕骨间关节外,还有桡骨远端与近端腕骨构成的桡腕关节,远侧腕骨与多掌骨近端构成的掌腕关节,以及下桡关节。桡尺骨远端由掌侧、背侧韧带所附着固定,在桡侧有桡侧副韧带,尺侧有尺侧副韧带,它们都具有加强腕关节稳定的功能。腕关节既是人体关节中结构复杂、活动频率很高的关节之一,又是上肢在支撑、推力等运 动中承受负荷较大的重要部位,故在很多的体育运动中容易发生急性韧带损伤。从大量研究资料来看,目前运用人工生物材料干预韧带损伤后的愈合与康复手段日趋成熟与多样,为腕关节韧带的康复提供了崭新的研究方向。作者应用计算机 通过对PubMed 数据库及CNKI 数据库进行检索,将目前相关人工生物材料在腕关节韧带损伤康复中的运用研究成果进行综述。 1 资料和方法 纳入标准:阐释腕关节韧带生理特点、损伤机
本文部分内容来自网络整理,本司不为其真实性负责,如有异议或侵权请及时联系,本司将立即删除! == 本文为word格式,下载后可方便编辑和修改! == 高三生物微生物发酵及其应用知识点汇总 发酵工程的概念和内容 发酵工程是指采用现代工程技术手段,利用微生物的某些特定功能,为人类生产有用的产品,或直接把微生物应用于工业生产过程的一种新技术。发酵工程的内容包括菌种的选育、培养基的配制、灭菌、扩大培养和接种、发酵过程和产品的分离提纯等方面。 (1)“发酵”有“微生物生理学严格定义的发酵”和“工业发酵”,词条“发酵工程”中的“发酵”应该是“工业发酵”。 (2)工业生产上通过“工业发酵”来加工或制作产品,其对应的加工或制作工艺被称为“发酵工艺”。为实现工业化生产,就必须解决实现这些工艺(发酵工艺)的工业生产环境、设备和过程控制的工程学的问题,因此,就有了“发酵工程”。 (3)发酵工程是用来解决按发酵工艺进行工业化生产的工程学问题的学科。发酵工程从工程学的角度把实现发酵工艺的发酵工业过程分为菌种、发酵和提炼(包括废水处理)等三个阶段,这三个阶段都有各自的工程学问题,一般分别把它们称为发酵工程的上游、中游和下游工程。 (4)微生物是发酵工程的灵魂。近年来,对于发酵工程的生物学属性的认识愈益明朗化,发酵工程正在走近科学。 (5)发酵工程最基本的原理是发酵工程的生物学原理。 (6)发酵工程有三个发展阶段。 现代意义上的发酵工程是一个由多学科交叉、融合而形成的技术性和应用性较强的开放性的学科。发酵工程经历了“农产手工加工——近代发酵工程——现代发酵工程”三个发展阶段。 发酵工程发源于家庭或作坊式的发酵制作(农产手工加工),后来借鉴于化学工程实现了工业化生产(近代发酵工程),最后返璞归真以微生物生命活动为中心研究、设计和指导工业发酵生产(现代发酵工程),跨入生物工程的行列。
蛋白质工程的崛起 (建议用时:40分钟) 1.下列有关蛋白质工程的叙述,不正确的是( ) A.收集大量的蛋白质分子结构的信息,以便分析结构与功能之间的关系 B.可以预测具有一定氨基酸序列的蛋白质的空间结构和生物功能 C.根据特定的生物功能,设计蛋白质的氨基酸序列和空间结构 D.根据人们的需要,直接对氨基酸的分子结构进行改造 D解析蛋白质工程是根据人们的需要,通过对基因的改造从而实现对蛋白质的改造,而不是对氨基酸的分子结构进行改造。 2.当前,蛋白质工程是发展较好、较快的分子工程。它将蛋白质与酶的研究推进到崭新的时代,为蛋白质和酶在工业、农业和医药方面的应用开拓了诱人的前景。蛋白质工程开创了按照人类意愿改造、创造符合人类需要的蛋白质的新时期。那么,蛋白质工程中需要直接进行操作的对象是( ) A.氨基酸的结构 B.蛋白质的空间结构 C.肽链的结构 D.基因结构 D解析蛋白质工程是指以蛋白质分子的结构规律及其与生物功能的关系为基础,通过基因修饰或基因合成,对现有蛋白质进行改造,或制造一种新的蛋白质,以满足人类的生产和生活的需求。 3.某种微生物合成的蛋白酶与人体消化液中的蛋白酶的结构和功能很相似,只是其热稳定性较差,进入人体后容易失效。现要将此酶开发成一种片剂,用于治疗临床消化不良,最佳方案是( ) A.替换此酶中的少数氨基酸,以改善其热稳定性 B.将此酶与人蛋白酶进行拼接,形成新的蛋白酶 C.重新设计与创造一种蛋白酶 D.减少此酶在片剂中的含量 A解析要想使蛋白酶热稳定性有所提高,就要改变蛋白质的结构,解决此类问题的方法一般是将蛋白质中的个别氨基酸进行替换。 4.2008年诺贝尔化学奖授予了三位在研究绿色荧光蛋白(GFP)方面做出突出贡献的科
《生物材料学》课程教学大纲 课程组人员:张胜民、王朝元、刘晓军 一、课程名称:生物材料学 二、英文名称:Biomaterials 三、课程编码: 四、学时与学分:32/2 五、先修课程:无机及有机化学 六、课程教学目标 1.帮助学生获得必要的生物材料学的基本知识,了解本学科发展的前沿动态,掌握研究本门学科的一般方法; 2. 使学生了解生物材料学在生物医学工程、生物科学、生物技术及医学中的地位和作用,培养和增强学生学习和应用本门学科的兴趣和社会责任感; 3.培养学生的自主学习能力、口头与书面表达能力,以及团队协作精神。 七、适用学科专业 生物医学工程、生物技术、生物科学、医学、材料学、化学 八、基本教学内容与学时安排 ●生物医学材料总论I(2学时) 生物材料发展 生物材料定义与特性 ●生物医学材料总论II(2学时) 生物医学材料的分类 生物医学材料的研究内容 ●生物惰性材料I(2学时) 生物惰性陶瓷 碳质生物材料 ●生物惰性材料II(2学时) 生物惰性金属材料 生物惰性高分子 生物惰性复合材料 ●生物活性材料I(2学时)
多孔陶瓷 生物活性玻璃和玻璃—陶瓷 ●生物活性材料II(2学时) 钙磷陶瓷 生物水泥 生物活性高分子材料 ●生物活性材料III(2学时) 复合生物活性材料 生物活性涂层 ●生物可降解材料(2学时) 生物无机可降解材料 生物有机高分子可降解材料 生物复合可降解材料 ●细胞与基因活性生物材料(2学时) 基因控制与活化 细胞与基因活性材料的制备 细胞与基因活性材料的利用 ●仿生生物材料(2学时) 天然生物材料的特性、结构特征 生物材料的仿生设计及研究实例 ●纳米生物材料(2学时) 纳米生物材料概念、特性 纳米生物材料制备 纳米生物材料应用 ●基因、药物与DNA控释材料与系统(2学时)控释材料的基本要求及释放装置类型 常用的控释材料 ●生物材料前沿专题I(2学时) 纳米复合生物材料 纳米杂化生物材料 ●生物材料前沿专题II(2学时) 生物材料表面
附件10 “生物医用材料研发与组织器官修复替代” 重点专项2018年度项目申报指南 “生物医用材料研发与组织器官修复替代”重点专项旨在面向国家发展大健康产业和转变经济发展方式对生物医用材料的重大战略需求,把握生物医用材料科学与产业发展的趋势和前沿,抢抓生物医用材料革命性变革的重大机遇,充分利用我国生物医用材料科学与工程研究方面的基础和优势,以新型骨骼—肌肉系统、心血管系统材料、植入器械及高值医用耗材为重点,开发一批新产品,突破一批关键技术,培育一批具有国际竞争力的高集中度多元化生产的龙头企业以及创新团队,构建我国新一代生物医用材料产业体系,引领生物医用材料产业技术进步,为我国生物医用材料产业跻身国际先进行列提供科技支撑。 本专项按照多学科结合、全链条部署、一体化实施的原则,鼓励产、学、研、医联合申报,围绕项目的总体目标,部署前沿科学及基础创新、关键核心技术、产品开发、典型示范4大研究任务,以及涉及前沿科学及基础创新、关键核心技术、产品开发、典型示范等的医用级原材料的研发及产业化、标准和规范研究、临床及临床转化研究3项重点任务。 —1—
2018年将继续围绕前沿科学及基础创新、关键核心技术、产品开发、典型示范4大研究任务部署12个方向,拟支持19个项目,国拨经费约为3亿元。实施周期为2018—2020年。 1. 前沿科学及基础创新 1.1纳米生物材料及其纳米生物学效应与风险的基础研究 研究内容:自然组织的纳米结构及其装配;合成纳米生物材料的积极和负面的纳米生物学效应及其临床应用前景和风险,包括:特定自然组织的纳米分层结构及其自装配原理及高通量计算模拟和实验研究,纳米粒子对细胞选择性凋亡和增殖的作用机制研究,纳米生物材料在体内的降解机制、降解产物对组织再生的影响及生物学风险研究,纳米生物陶瓷及复合材料的高生物活性及其产生的机制及与纳米晶粒的化学组成、尺度和结构的关系,模拟自然组织装配或制备纳米生物材料的软纳米技术探索等。 考核指标:在国内外一流期刊发表12篇以上高水平学术论文(被SCI收录且他引多次,或被学术期刊或权威机构正面点评或推荐等),申请或获得发明专利不少于8项;实验装配或制备硬、软组织纳米材料各1~2种,提供第三方理化检测及生物学试验报告。 拟支持项目数:1~2项。 有关说明:鼓励学科交叉联合申报,并且鼓励海外团队参与合作研究。 —2—
第七章蛋白质的生物合成——翻译 (一)名词解释 1.翻译2.密码子3.密码的简并性4.同义密码子5.变偶假说6.移码突变7.同功受体8.多核糖体 (二)问答题 1.参与蛋白质生物合成体系的组分有哪些?它们具有什么功能? 2.遗传密码是如何破译的? 3.遗传密码有什么特点? 4.简述三种RNA在蛋白质生物合成中的作用。 5.简述核糖体的活性中心的二位点模型及三位点模型的内容。 6.氨基酸在蛋白质合成过程中是怎样被活化的? 7.简述蛋白质生物合成过程。 8.蛋白质合成中如何保证其翻译的正确性? 9.原核细胞和真核细胞在合成蛋白质的起始过程有什么区别。 10.蛋白质合成后的加工修饰有哪些内容? 11.蛋白质的高级结构是怎样形成的? 12.真核细胞与原核细胞核糖体组成有什么不同?如何证明核糖体是蛋白质的合成场所? 13. 已知一种突变的噬菌体蛋白是由于单个核苷酸插入引起的移码突变的,将正常的蛋白质和突变体蛋白质用胰蛋白酶消化后,进行指纹图分析。结果发现只有一个肽段的差异,测得其基酸顺序如下:正常肽段Met-Val-Cys-Val-Arg 突变体肽段Met-Ala-Met-Arg (1)什么核苷酸插入到什么地方导致了氨基酸顺序的改变? (2)推导出编码正常肽段和突变体肽段的核苷酸序列. 提示:有关氨基酸的简并密码分别为 Val:GUU GUC GUA GUG Arg:CGU CGC CGA CG AGA AGG Cys:UGU UGC Ala:GCU GCC GCA CGC 14. 试列表比较核酸与蛋白质的结构。 15. 试比较原核生物与真核生物的翻译。 (三)填空题 1.蛋白质的生物合成是以___________为模板,以___________为原料直接供体,以_________为合成杨所。 2.生物界共有______________个密码子,其中___________个为氨基酸编码,起始密码子为_________;终止密码子为_______、__________、____________。 3.原核生物的起始tRNA以___________表示,真核生物的起始tRNA以___________表示,延伸中的甲硫氨酰tRNA以__________表示。 4.植物细胞中蛋白质生物合成可在__________、___________和___________三种细胞器内进行。 5.延长因子T由Tu和Ts两个亚基组成,Tu为对热___________蛋白质,Ts为对热________蛋白质。 6.原核生物中的释放因子有三种,其中RF-1识别终止密码子_____________、____________;RF-2识别__________、____________;真核中的释放因子只有___________一种。 7.氨酰-tRNA合成酶对__________和相应的________有高度的选择性。