西红柿中维生素C含量的测定
- 格式:doc
- 大小:95.00 KB
- 文档页数:10

蕃茄中维生素c含量的测定。
碘量法测西红柿中维生素c的含量本文旨在简要介绍测定蕃茄中维生素C含量的重要性以及碘量法测定西红柿中维生素C含量的方法。
测定蕃茄中维生素C含量的重要性维生素C是一种重要的营养物质,对人体健康具有重要作用。
蕃茄作为广泛食用的蔬果之一,含有丰富的维生素C。
因此,准确测定蕃茄中的维生素C含量对于评估其营养价值以及制定健康饮食建议是非常重要的。
碘量法测定西红柿中维生素C含量的方法碘量法是一种常用的测定西红柿中维生素C含量的方法。
具体步骤如下:准备样品:选择新鲜的西红柿作为测定样品,并将其洗净、去皮和去籽。
挤出汁液:将去皮和去籽的西红柿挤压成汁液。
碘滴加入:将一滴含有碘的溶液滴入样品中。
反应观察:观察溶液颜色的变化。
维生素C会与碘反应生成蓝色化合物,颜色的深浅与维生素C的含量成正比。
计算含量:根据溶液颜色的深浅,可通过标准曲线或浓度计算方法来测定样品中维生素C的含量。
以上方法是一种简单且常用的碘量法测定西红柿中维生素C含量的方法,可以应用于蕃茄及其他水果蔬菜中维生素C的测定。
诸多因素如温度、湿度、氧气等会对测定结果产生影响。
在实验过程中应注意控制这些因素以获得准确的测定结果。
碘量法是一种常用的测定食物中维生素C含量的方法。
下面是使用碘量法测定蕃茄中维生素C含量的具体步骤和操作流程:准备材料和仪器:获得新鲜的蕃茄样品,碘液,维生素C标准溶液,磷酸,滴定管,量筒等必要仪器。
样品制备:将蕃茄样品洗净并切碎成均匀的细小颗粒。
提取维生素C:将切碎的蕃茄样品加入磷酸中,置于搅拌器中搅拌片刻。
然后,用滤纸过滤提取液,得到带有维生素C的溶液。
纳溶液:将提取液与碘液混合,反应一段时间,直到明显观察到颜色变化。
滴定:使用维生素C标准溶液进行滴定,直到反应被彻底消耗。
计算维生素C含量:通过滴定所需的维生素C标准溶液体积,可以计算出蕃茄样品中维生素C的含量。
重复实验:重复以上步骤多次,取平均值以增加结果的准确性。

毕业论文(设计)论文题目:分光光度法测定维生素C的含量院(系):化学与生物科学学院摘要本实验的目的是测定西红柿中维生素C的含量,测定西红柿中维生素C含量的方法有很多种,本实验中我们采用2,4-二硝基苯肼分光光度法测定西红柿样品溶液的维生素C含量的测定。
经测定计算,每百克新疆鲜西红柿中维生素C含量为:1.7mg/100g,西红柿干中为0.44mg/100g,内地的小西红柿中为1.6mg/100g,新疆大西红柿中维生素C含量高于内地小西红柿。
三种西红柿中,新疆鲜西红柿维生素C含量高,西红柿干中维生素C含量低。
新疆大西红柿维生素C含量高与内地小西红柿的。
文献中西红柿中维生素C的含量为11mg/100g。
由于各种原因西红柿中维生素C含量的测定与文献值很远,以上测出的结果均出现在文章里。
关键词:西红柿;维生素C;2,4-二硝基苯肼分光光度法目录摘要...............................................................Ⅰ目录...............................................................Ⅱ一、引言.........................................................11. 文献综述.....................................................11.1西红柿概况..................................................11.2西红柿的药用,营养价值.......................................11.3维生素C的作用...............................................21.3.1 缺乏维生素C..............................................3 1.3.2 维生素C过量的危害........................................4二、选题依据....................................................4三、实验部分.....................................................53.1实验原理....................................................53.2材料........................................................53.3实验仪器和药品..............................................63.4实验步骤....................................................73.4.1样品的处理................................................7 3.4.2定量分析..................................................73.4. 2.1标准曲线绘制............................................73. 4.3样品测定.................................................93.4.3.1显色反应...............................................103.4.3.2 85%硫酸处理...........................................103.4.4 样品比色测定.............................................103.4.5计算结果.................................................10四、结果与讨论..................................................11参考文献.......................................................13 致谢........................................................ (14)一、引言1、文献综述随着我国经济发展和人民的生活水平的提高,人们对食品的安全与营养的要求越来越高,对绿色食品的要求也不断提高。

紫外分光光度法测定常见水果维生素C的含量1 序言1.1 研究的目的和意义维生素是必须得从食物中获取并且在物质代谢过程中起到了极其重要的作用的一种物质[1]。
这类物质在生物体内不能合成或者合成量特别少,不足以维持生物体的正常的生理功能,虽然生物体对维生素的需要量很少,但所需量必须经常从食物中获得,所以我们研究维生素具有重要的意义[2]。
维生素C是维生素的一种,维生素C在医学上被称作抗坏血酸,具有防治坏血病的功效,它是显示抗坏血酸生物活性的一类有机化合物的总称[3]。
维生素C广泛的存在于我们常见的水果和蔬菜中,所以我们能够准确地测定出水果中地维生素C的含量,对我们的日常饮食和健康的生活具有重要的指导意义。
1.2维生素C含量的研究史中国是人口众多的国家,人口密度相对较大,病毒发病率较高,我国在对抗病毒的战争中起到一个关键作用。
SARS病毒首先出现在我们中国,死于SARS 病毒的90%是我们中国人。
国内对于维生素C的生产水平已经处于领先地位,可以彻底解决病毒的问题,只是生产的维生素C大部分都外销,我们中国人服用维生素C的平均剂量,远远低于一些欧美国家和日本。
目前,围绕着维生素C 含量的测定产生了一系列的研究课题和任务,因为它对人们日常饮食具有重要指导意义,成为了现今国内外研究的热点,现在主要有2,4-二硝基苯肼比色法、碘量法、高效液相色谱法、紫外分光光度法等来测定维生素C的含量。
1.2.1碘量法武文等[4]利用I₂的氧化性,用淀粉作指示剂,采用I₂作标准溶液进行直接滴定,这叫做直接碘量法。
直接碘量法的滴定原理:维生素C分子中的二烯醇基可被I₂氧化成二酮基,当维生素C分子中的二烯醇基被I₂完全氧化后,过量的I₂与淀粉指示剂发生显色作用,使溶液变蓝,所以当滴定到溶液中有蓝色出现时,即为滴定终点。
直接碘量法测定水果和蔬菜中维生素C的含量时,要求所测的果蔬溶液为无色和浅色的是样溶液或者提取液,该方法测维生素C不需要特殊的测定仪器,操作非常简便、准确。

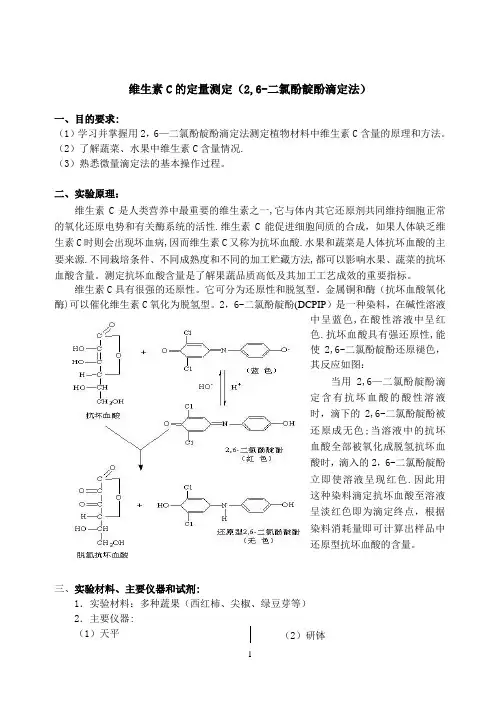
维生素C的定量测定(2,6-二氯酚靛酚滴定法)一、目的要求:(1)学习并掌握用2,6—二氯酚靛酚滴定法测定植物材料中维生素C含量的原理和方法。
(2)了解蔬菜、水果中维生素C含量情况.(3)熟悉微量滴定法的基本操作过程。
二、实验原理:维生素C是人类营养中最重要的维生素之一,它与体内其它还原剂共同维持细胞正常的氧化还原电势和有关酶系统的活性.维生素C能促进细胞间质的合成,如果人体缺乏维生素C时则会出现坏血病,因而维生素C又称为抗坏血酸.水果和蔬菜是人体抗坏血酸的主要来源.不同栽培条件、不同成熟度和不同的加工贮藏方法,都可以影响水果、蔬菜的抗坏血酸含量。
测定抗坏血酸含量是了解果蔬品质高低及其加工工艺成效的重要指标。
维生素C具有很强的还原性。
它可分为还原性和脱氢型。
金属铜和酶(抗坏血酸氧化酶)可以催化维生素C氧化为脱氢型。
2,6-二氯酚靛酚(DCPIP)是一种染料,在碱性溶液中呈蓝色,在酸性溶液中呈红色.抗坏血酸具有强还原性,能使2,6-二氯酚靛酚还原褪色,其反应如图:当用2,6—二氯酚靛酚滴定含有抗坏血酸的酸性溶液时,滴下的2,6-二氯酚靛酚被还原成无色;当溶液中的抗坏血酸全部被氧化成脱氢抗坏血酸时,滴入的2,6-二氯酚靛酚立即使溶液呈现红色.因此用这种染料滴定抗坏血酸至溶液呈淡红色即为滴定终点,根据染料消耗量即可计算出样品中还原型抗坏血酸的含量。
三、实验材料、主要仪器和试剂:1.实验材料:多种蔬果(西红柿、尖椒、绿豆芽等)2.主要仪器:(1)天平(2)研钵(3)容量瓶(50mL) (4)刻度吸管(5mL,10mL) (5)锥形瓶(100mL)(6)微量滴定管(3mL) (7)漏斗(8)脱脂纱布(9)滤纸3.试剂:(1)2% HCl(2)标准抗坏血酸溶液精确称量抗坏血酸(应为洁白色,如变为黄色则不能用)25mg,溶于25ml 4%HCl中,移入50ml容量瓶中,用蒸馏水稀释至刻度,贮于棕色瓶中,冷藏,最好临用前配制,此溶液每ml 中含抗坏血酸0.5mg,.(3)0.01M 2,6-二氯酚靛酚准确称0。
![[精彩]碘量法测生果蔬菜中维生素c的含量](https://uimg.taocdn.com/d3b2993e905f804d2b160b4e767f5acfa1c783d6.webp)
碘量法测水果蔬菜中维生素C 的含量库尔班江1,赛丽曼2(1.伊犁师范学院 化学与生物科学学院;2.伊犁州技工学校,新疆 伊宁 835000)摘 要:采用碘量法测定了当地产水果、蔬菜中维生素C 的含量. 因抗坏血酸有极强的还原性,而I 2有强的氧化性,二者可定量地发生反应,因此先用纯品抗坏血酸配成的标准溶液标定配制的I 2溶液,再用已标定的I 2溶液滴定样品的提取液,用1%的淀粉溶液为指示剂,当滴至褪色且在30s 不变色,则为滴定终点,计算出维生素C 的含量. 结果表明,此法较为成熟,条件易控制,操作快速方便、仪器简单,平均回收率为105.02%,其回归方程为Y=1.9144X+0.1962,R=0.9985.为一般基层机构对水果、蔬菜的质量控制提供了科学依据和可靠的方法.关键词:碘量法;水果;蔬菜;抗坏血酸;维生素C;含量;测定中图分类号:O629.4 文献标识码:A 文章编号:1673—999X (2007)03—0028—05维生素C (L-ascorbic Acid )又名抗坏血酸,分子式为C 6H 8O 6,分子量为176.13,纯品为白色结晶或结晶性粉末,无臭、味酸,久置色渐变微黄,水溶液呈酸性. 易溶于水中,能溶于乙醇中,而不溶于氯仿或乙醚中,熔点为190~192℃,熔融时同时分解[1].OOC CH 2OH H OHO H OH C 6H 8O 6维生素C 应用广泛,其对人体新陈代谢及生命活动中的许多方面具有重要的影响. 由于维生素C 在体内不能合成,所以必须依靠膳食供给. 而水果、蔬菜中维生素C 的含量较高,常见维生素C 含量较高的食用植物有:猕猴桃、青椒、苦瓜、黄瓜、西红柿、草莓、萝卜等[2]. 若缺乏维生素C 则会得坏血病、易疲倦、虚弱、关节疼痛、牙龈出血、发炎、易瘀青、易感染疾病、身体骨骼易损伤且不易愈合. 另外,在食品加工中常用作抗氧化剂、酸味剂等. 可见,维生素C 对人类的健康和日常生活有着极其重要的影响. 因此,对维生素C 的研究得到日益广泛的重视[3].维生素C 是水果、蔬菜质量检验中的重要指标之一. 由于品种和产地的不同,水果、蔬菜中维生素C 的含量也不同. 因此本文采用碘量法测定了当地产的几种水果、蔬菜中维生素C 的含量. 结果表明,此法较为成熟,条件易控制,操作快速方便、仪器简单,精密度和准确度较高,数据可靠. 为一般基层机构对水果蔬菜的质量控制提供了科学依据和可靠的方法.1 测定原理收稿日期:2007—03—08作者简介:库尔班江·巴拉提(1962—),男(维吾尔族),副教授,研究方向为天然有机分析及中草药研究.第3期 库尔班江,赛丽曼:碘量法测水果蔬菜中维生素C 的含量 29维生素C 分子结构中具有二烯醇结构,具有内酯环,且有两个手性碳原子(C 4、C 5),因此使维生素C 性质极为活泼,且具有旋光性. 维生素C 易溶于水中,水溶液呈酸性. 分子中的二烯醇基具极强的还原性,易被氧化为二酮基而成为去氢抗坏血酸,加氢又可还原为抗坏血酸,在碱性溶液或强酸性溶液中能进一步水解为二酮古罗糖酸[3]. 维生素C 含量测定大多基于其有较强的还原性,可被不同的氧化剂定量氧化[4]. 在中性或碱性环境中或有微量的金属离子(特别是Fe 2+、Cu 2+等)存在时,维生素C 更易氧化分解. 所以为确保该实验的准确性,应使其处于酸性条件下. 反应式如下:OOCCH 2OH H OHO H OHCH 2OHCOONa(H)H O HOHO O目前测维生素C 含量的主要方法有:2,6-二氯靛酚法、2,4-二硝基苯肼法、荧光分光光度法、比浊测定法、极谱法等[3]. 本文采用碘量法[5]对水果、蔬菜中的维生素C 进行定量测定. 因维生素C 具有强还原性,I 2有强氧化性,I 2可将维生素C 氧化为去氢抗坏血酸,同时依据淀粉溶液变蓝指示终点. 其反应式如下:OOCCH 2OH HOHOH OH OC CH 2OH HOHOO+H+I 2+2HI2 仪器、试剂及样品2.1 仪器榨汁机、粉碎机、离心机、抽滤装置. 2.2 试剂草酸(四川成都化学试剂厂),抗坏血酸(郑州市化学试剂三厂),碘化钾(天津市北方化玻采购销售中心),可湿性淀粉(上海三浦化工有限公司),碘,活性炭. 上述试剂均为分析纯. 2.3 待测样品在本实验中选择了当地市场上出售的西红柿、萝卜、白菜、黄瓜、草莓五种水果、蔬菜作为待测样品,因为这几种样品在日常生活中比较常见,实际应用价值较大,与这几种样品中维生素C 含量相关的报道很多,由于受到各地的气候条件、土壤等诸多因素的影响测定结果相差较大. 本实验所用样品于2005年5月下旬购买于新疆伊宁市农四师菜市场,并通过伊犁师范学院化学与生物科学学院有关专家鉴定.西红柿(L.esculenttum Mill )茄目番茄属萝卜(Raphanus stativus L.)白菜花目十字花科白菜(B.pekinensis Rupr.)白菜花目十字花科黄瓜(Cucumis stativus )堇菜目葫芦科草莓(Fragaria ananassa Duch.)蔷薇目蔷薇亚科3 方法与结果3.1 溶液的配制和标定3.1.1 1%草酸溶液的配制称取草酸10g ,倒入烧杯中加少量蒸馏水溶解,转入1000mL 容量瓶中,用蒸馏水定容至刻度,保存30 伊犁师范学院学报(自然科学版) 2007年备用.3.1.2 抗坏血酸标准溶液的配制准确称取抗坏血酸标准样品250.0mg,将其倒入装有少量1%草酸溶液的250mL容量瓶中,振荡使其溶解,再用1%草酸溶液定容至250mL,其浓度为1mg/mL,即C vc=0.00568mol/L,保存备用.3.1.3 1%淀粉溶液的配制称取1g可湿性淀粉,倒入小烧杯中,先加入10mL蒸馏水调匀,然后加90mL蒸馏水煮沸,边煮边搅,使其呈透明状为止,冷却后转入100mL容量瓶中,定容,备用.3.1.4 I2溶液的配制称取2gKI倒入小烧杯中,加入少量蒸馏水使KI溶解,再称取1.3gI2,加入烧杯中使其完全溶解,再转入1000mL容量瓶中用蒸馏水溶解并定容至刻度,(因I2在蒸馏水中的溶解度较小,加KI的作用是为了增大I2在蒸馏水中的溶解度)避光保存,备用.3.1.5 I2溶液的标定准确移取50mL标准抗坏血酸溶液于100mL容量瓶中,用蒸馏水定容至刻度,摇匀,准确移取10mL稀释后的溶液于锥形瓶中,加入20mL1%的草酸溶液和1mL 1%的淀粉溶液,再用标准抗坏血酸溶液滴定,当锥形瓶中的溶液出现棕红色时,已接近氧化还原反应的终点,此时,要放慢滴定的速度,滴至微蓝色并在30s内不褪色即为滴定终点. 滴定五次,记录体积V1,取平均值. 取30mL1%草酸溶液和1mL1%淀粉溶液于锥形瓶中,用I2溶液滴定做空白实验,滴定五次,记录体积V2,计算空白值,从平均值中扣除空白值即为标定抗坏血酸溶液所消耗的I2溶液的体积V12,根据下式计算I2溶液的浓度:表-1 I2溶液的标定平均体积序号 1 2 3 4 5消耗体积V1 5.91 5.93 5.94 5.96 5.91 5.93空白值V20.14 0.15 0.15 0.16 0.15 0.15V I2/ / / / / 5.78C I2V I2=C VC V VC,C I2= C VC V VC/ V I2=0.00568×5×10-3/5.78×10-3=0.00491mol/L3.2 标准曲线的绘制分别准确吸取抗坏血酸标准溶液(1mg/mL)5、10、20、30、40、50、60、70、80、90、100mL,稀释至100mL. 各取10mL,加入20mL 1%草酸溶液和1mL 1%淀粉溶液,用已标定的I2溶液进行滴定,记录所消耗的I2溶液的体积,滴定五次,取平均值,并扣除空白值.表-2 维生素C标准溶液浓度与所消耗的I2溶液的体积的关系未稀释的标准V C溶液的体积(mL)稀释后的体积(mL)稀释后的浓度(×10-3 mol/L) 消耗I2的体积(mL)0.595 1000.291.160.5710 1001.142.3320 1001.713.4730 1004.652.2840 1002.855.8050 1003.426.9760 1008.053.9970 1009.134.5680 1005.139.8590 10010.735.70100 100根据维生素C标准溶液浓度与所消耗的I2溶液的体积进行线性回归,得方程Y=1.9144X+0.1962,第3期库尔班江,赛丽曼:碘量法测水果蔬菜中维生素C的含量31R=0.9985(n=11). 结果表明:用碘量法测定维生素C的含量在5mg~100mg的范围内呈良好的线性关系,符合线性回归方程.图-1 维生素C标准溶液浓度与所消耗的I2溶液的体积的关系3.3 样品溶液的提取将新鲜的样品去皮、去核,准确称取可食用部分100g,置于榨汁机中,加入40mL草酸溶液,余下10mL草酸溶液用于冲洗粉碎机内残余的果蔬组织,尽量将其粉碎、抽滤,对于西红柿和草莓,因其滤液的颜色较深,不利于观察指示剂终点,为减小误差,加入活性炭进行脱色,再次抽滤,并将所得滤液移入量筒中并记下体积V.3.4 试样中维生素C的含量测定用移液管移取10mL样品提取液,加入20mL 1%草酸溶液和1mL 1%淀粉溶液,用已标定的I2溶液进行滴定,记录所消耗的I2溶液的体积. 滴定五次取平均值,并扣除空白值,根据下式计算维生素C的含量,100g样品中V C的含量= C I2V I2M vc×V/10.表-3 果蔬中维生素C的含量序号 样品 维生素C平均含量(mg/100g)相对标准偏差RSD%(n=5)1 西红柿7.17 3.512 萝卜15.13 3.073 白菜17.2 3.844 黄瓜8.53 4.485 草莓28.27 2.113.5 加样回收率的测定精确称取已知含量的样品四份,每份加入抗坏血酸纯品,按上法处理,测其所消耗的已标定的I2溶液的体积. 用差减法求出抗坏血酸的回收率:R=(A-B)×100/CA— 加入纯维生素C后的测得总量B— 样品中所含维生素C的量C— 加入纯维生素C的量表-4 加样回收率的测定序号 样品V C含量(mg) 加入纯V C量(mg) 测得总量(mg)回收率(%)1 1.776 10 12.008 102.322 1.776 9.8 12.194 106.313 1.776 10.3 12.714 106.214 0.556 8 8.976 105.24平均回收率=105.02%,RSD(n-4)=1.77%32 伊犁师范学院学报(自然科学版) 2007年 4 讨论本文采用碘量法对水果、蔬菜中维生素C的含量进行定量分析,在用本法操作的过程中应注意以下方面:4.1 在制备样品提取液时,要尽量将样品粉碎,确保维生素C最大程度地溶于提取液中.4.2 因维生素C在碱性条件下易被空气中的氧氧化,所以为确保维生素C尽可能不被氧化,应使其处于酸性条件下. 整个操作过程要迅速,防止还原型抗坏血酸被氧化.4.3 对于有色滤液,笔者经过活性炭和白陶土的脱色对比实验发现,活性炭的脱色效果较好. 所以在本实验中采用活性炭对西红柿和草莓的滤液进行脱色.4.4 用I2溶液滴定时,速度要缓慢,接近终点时更要放慢速度,滴至微蓝色且在30s内不褪色,即为滴定终点.4.5 因为I2见光易分解及配制I2溶液时未能将其完全溶解的原因,都会使I2溶液的浓度有所变化. 所以在每次测样品之前,都应先用维生素C的标准溶液重新标定I2溶液的浓度.4.6 测定样品溶液时必须同时作空白对照,从滴定值中扣除空白值,尽量减少滴定误差.据研究表明:对于一个健康人来说,每日维生素C的需要量为50—150mg[6]. 从实验数据中可得知,每人每天食用250g左右的水果、蔬菜即可满足人体对维生素C的需要.另外,植物体内的维生素C往往跟维生素C酶同时存在. 维生素C酶与空气接触时,就会促进维生素C的氧化作用. 当温度较高时,这种作用更强烈. 本来维生素C受热时比较稳定,但在高温下也会因维生素C酶的作用而受到破坏. 因此,在炒蔬菜时最好用急火快炒,这样短时间的高温有利于保护维生素C不受破坏;同时新鲜的蔬菜不宜久储,否则维生素C的含量会逐渐降低[6].参考文献:[1]中国大百科全书出版社编辑部,编.中国大百科全书·化学[M].中国大百科全书出版社,1989.1001.[2]方雪梅,曹稳根.豆腐柴鲜叶β-胡萝卜素及维生素C的含量测定[J].淮北煤炭师范学院学报,2004,25(4):66-68.[3]黄伟坤.食品检验与分析[M].北京:中国轻工业出版社,1997.96—104.[4]刘文英,主编.药物分析[M].北京:人民卫生出版社,2001.209—214.[5]武汉大学化学与分子科学学院实验中心,编.分析化学实验[M].武汉大学出版社,2003.131—132.[6]季鸿崑,主编.烹饪化学[M].北京:中国轻工业出版社,2000.442.[责任编辑:何苗苗]Determination of Ascorbic Acid in Vegetables and Fruits by IodimetryKorbanjhon1,Salimam2(1. Chemistry and Bioscience Department, Yili Normal University; 2.Yili Technical School, Yining 835000, Xinjiang)Abstract:This experiment adopts iodimetry to ascertain the concentration of Vc in common fruits and vegetables. First, using the standard solution which is made up with pure Ascorbic Acid to standardize I2 solution that have been made up, then using the I2solution which is standard to titration the extracted solution of the sample and the indicator should be 1% starch solution. That is not the end of titration until the titration solution change into slight blue and it won’t fade in 30 minutes. Finally, we can calculate the concentration of Vc in fruits and vegetables. This experiment shows that iodimetry is easy to operate. In this experiment the average rate of recovery is R=105.02% and the standard linear equation is Y=1.9144X+0.1962,R=0.9985.Key words: Iodimetry; Ascorbic Acid; Concentration of determination; fruit and vegetable。
西红柿vc多还是橘子西红柿可以和橘子一起吃吗维生素C是一种人体生长发育所必需的维生素,摄入不足的话可能会引起身体不适,一般都是从食物中摄取,西红柿和橘子都是维C 含量比较丰富的食物,那哪一个维C含量多呢?一、西红柿vc多还是橘子橘子。
橘子每100克维生素C的含量大约为35毫克左右,而西红柿每100克的维生素C含量为19毫克左右,橘子的维C含量要多于西红柿。
但是西红柿中含有丰富的番茄红素,是橘子所没有的,这种番茄红素具有一定的抗氧化能力,能够清除导致衰老和疾病的自由基,预防心脑血管及多种疾病的发生。
西红柿和橘子都是维生素含量非常丰富的食物,食用后都对身体健康有一定的好处,建议可以搭配食用。
二、西红柿可以和橘子一起吃吗可以。
西红柿和橘子在成分上并没有配伍禁忌,搭配在一起也不会发生反应产生有毒物质,一般人群均可食用,而且两者营养丰富,搭配在一起后还可以互补不足,会更加有利于人体的营养吸收。
但是需要注意的是西红柿和橘子都不宜空腹食用,空腹食用时可以刺激胃酸的分泌,胃酸过多时可能会出现胃痛、反酸、烧心等胃部不适的症状,建议在吃饭时或者是饭后食用,这样就能降低胃酸的浓度,会更有利于胃部的健康。
三、vc和西红柿可以一起吃吗不建议过量补充维生素C。
虽然维C对于人体的健康来说是有利的,但是过量的话不仅会造成浪费,还会对身体的肝肾造成过大的负担,影响身体钙质的吸收,长期过量摄入严重者还可能会增加患结石的可能性。
对于正常人来说每天维C的推荐摄入量为100mg,维C片的含量一般为每片100毫克,已经足够正常人群的摄入量了。
而西红柿的维C含量为每100克19毫克,少量西红柿搭配维C 一起吃是没有很大关系的,如果是大量食用西红柿的话就有可能造成维C过量的情况。
四、每天吃多少西红柿可以补充vc100-200克。
正常人群推荐每天维C摄入量为100毫克,而西红柿每100克维C含量为19毫克,这样计算下来的话是每天需要吃500克的西红柿,但实际上因为其它食物也同样含有维C,所以每天吃100-200克西红柿,就差不多能满足身体对于维生素C的需要了。
创新型设计方案(碘量法测西红柿中Vc含量)西红柿中Vc含量的测定(直接碘量法)卫凌松化学学院高分子材料与工程专业6班学号:33080619【前言】西红柿简介:(Sola num lycopersicum)是茄科茄属番茄亚属的多年生草本植物,又叫西红柿、洋柿子。
番茄原产于中美洲和南美洲,中国各地均普遍栽培,夏秋季出产较多。
现作为食用蔬果在全世界范围内广泛种植,通常认为是一种营养丰富的食品。
每100克番茄的营养成分能量11千卡,维生素B60.06毫克,蛋白质0.9克,脂肪0.2克,碳水化合物3.3克叶酸5.6微克,膳食纤维1.9克,维生素A63微克,胡萝卜素37 5 微克,硫胺素0.02毫克核黄素0.01毫克,烟酸0.49毫克,维生素C14毫克,维生素E0.42 毫克,钙4 毫克磷24 毫克钾179毫克,钠9.7毫克,碘2.5微克,镁12毫克,铁0.2毫克,锌0.12毫克,铜0.04毫克锰0.06 毫克食疗作用】1.促进消化西红柿中的柠檬酸、苹果酸和糖类,有促进消化作用,番茄素对多种细菌有抑制作用,同时也具有帮助消化的功能。
2.保护皮肤弹性,促进骨骼发育西红柿中含有胡萝卜素,可保护皮肤弹性,促进骨骼钙化,还可以防治小儿佝偻病,夜盲症和眼干燥症。
3.防治心血管疾病胆固醇产生的生物盐可与西红柿纤维相联结,通过消化系统排出体外,并由于人体需要生物盐分解肠内脂肪,而人体需要用胆固醇补充生物盐,使血中胆固醇含量减少,起到防治动脉粥样硬化作用;西红柿的维生素B 还可保护血管,防治高血压。
4.抗癌,防衰老西红柿内含有谷胱甘肽的一种物质,这种物质在体内含量上升时,癌症发病率则明显下降。
此外,这种物质可抑制酪氨酸酶的活性,使人沉着的色素减退消失,雀斑减少,起到美容作用。
5.抗疲劳,护肝西红柿中所含的维生素B1 有利于大脑发育,缓解脑细胞疲劳;所含的氯化汞,对肝脏疾病有辅助治疗作用。
【植物学分类】被子植物门,双子叶植物纲,茄目,茄科,茄属,番茄亚属维生素C 简介:维生素C 又称抗坏血酸, 分子式为C6H8O6 , 相对分子量为176.1,由于分子中的烯二醇基具有强还原性, 可降低毛细血管通透性,降低血脂,增强机体的抵抗能力,并有一定的解毒功能和抗组胺作用。
维生素C的定量测定(2,6-二氯酚靛酚滴定法)维生素C的定量测定(2,6-二氯酚靛酚滴定法)一、目的要求:(1)学习并掌握用2,6-二氯酚靛酚滴定法测定植物材料中维生素C含量的原理和方法。
(2)了解蔬菜、水果中维生素C含量情况。
(3)熟悉微量滴定法的基本操作过程。
二、实验原理:维生素C是人类营养中最重要的维生素之一,它与体内其它还原剂共同维持细胞正常的氧化还原电势和有关酶系统的活性。
维生素C能促进细胞间质的合成,如果人体缺乏维生素C时则会出现坏血病,因而维生素C又称为抗坏血酸。
水果和蔬菜是人体抗坏血酸的主要来源。
不同栽培条件、不同成熟度和不同的加工贮藏方法,都可以影响水果、蔬菜的抗坏血酸含量。
测定抗坏血酸含量是了解果蔬品质高低及其加工工艺成效的重要指标。
维生素C具有很强的还原性。
它可分为还原性和脱氢型。
金属铜和酶(抗坏血酸氧化酶)可以催化维生素C氧化为脱氢型。
2,6-二氯酚靛酚(DCPIP)是一种染料,在碱性溶液中呈蓝色,在酸性溶液中呈红色。
抗坏血酸具有强还原性,能使2,6-二氯酚靛酚还原褪色,其反应如图:当用2,6-二氯酚靛酚滴定含有抗坏血酸的酸性溶液时,滴下的2,6-二氯酚靛酚被还原成无色;当溶液中的抗坏血酸全部被氧化成脱氢抗坏血酸时,滴入的2,6-二氯酚靛酚立即使溶液呈现红色。
因此用这种染料滴定抗坏血酸至溶液呈淡红色即为滴定终点,根据染料消耗量即可计算出样品中还原型抗坏血酸的含量。
三、实验材料、主要仪器和试剂:1(实验材料:多种蔬果(西红柿、尖椒、绿豆芽等)2(主要仪器:(1)天平 (2)研钵1(3)容量瓶(50mL) (7)漏斗(4)刻度吸管(5mL,10mL) (8)脱脂纱布(9)滤纸 (5)锥形瓶(100mL)(6)微量滴定管(3mL)3(试剂:(1)2, HCl)标准抗坏血酸溶液精确称量抗坏血酸(应为洁白色,如变为黄色则不能用)(2 25mg,溶于25ml 4,HCl中,移入50ml容量瓶中,用蒸馏水稀释至刻度,贮于棕色瓶中,冷藏,最好临用前配制,此溶液每ml 中含抗坏血酸0.5mg,。
创新型设计方案(碘量法测西红柿中Vc含量)西红柿中Vc含量的测定(直接碘量法)卫凌松化学学院高分子材料与工程专业6班学号:33080619【前言】西红柿简介:(Solanum lycopersicum)是茄科茄属番茄亚属的多年生草本植物,又叫西红柿、洋柿子。
番茄原产于中美洲和南美洲,中国各地均普遍栽培,夏秋季出产较多。
现作为食用蔬果在全世界范围内广泛种植,通常认为是一种营养丰富的食品。
每100克番茄的营养成分能量11千卡,维生素B60.06毫克,蛋白质0.9克,脂肪0.2克,碳水化合物3.3克叶酸5.6微克,膳食纤维1.9克,维生素A63微克,胡萝卜素37 5微克,硫胺素0.02毫克核黄素0.01毫克,烟酸0.49毫克,维生素C14毫克,维生素E0. 42毫克,钙4毫克磷24毫克钾179毫克,钠9.7毫克,碘2.5微克,镁12毫克,铁0.2毫克,锌0.12毫克,铜0.04毫克锰0.06 毫克【食疗作用】1.促进消化西红柿中的柠檬酸、苹果酸和糖类,有促进消化作用,番茄素对多种细菌有抑制作用,同时也具有帮助消化的功能。
2.保护皮肤弹性,促进骨骼发育西红柿中含有胡萝卜素,可保护皮肤弹性,促进骨骼钙化,还可以防治小儿佝偻病,夜盲症和眼干燥症。
3.防治心血管疾病胆固醇产生的生物盐可与西红柿纤维相联结,通过消化系统排出体外,并由于人体需要生物盐分解肠内脂肪,而人体需要用胆固醇补充生物盐,使血中胆固醇含量减少,起到防治动脉粥样硬化作用;西红柿的维生素B还可保护血管,防治高血压。
4.抗癌,防衰老西红柿内含有谷胱甘肽的一种物质,这种物质在体内含量上升时,癌症发病率则明显下降。
此外,这种物质可抑制酪氨酸酶的活性,使人沉着的色素减退消失,雀斑减少,起到美容作用。
5.抗疲劳,护肝西红柿中所含的维生素B1有利于大脑发育,缓解脑细胞疲劳;所含的氯化汞,对肝脏疾病有辅助治疗作用。
【植物学分类】被子植物门,双子叶植物纲,茄目,茄科,茄属,番茄亚属维生素C简介:维生素C 又称抗坏血酸, 分子式为C6H8O6 , 相对分子量为176.1,由于分子中的烯二醇基具有强还原性, 可降低毛细血管通透性,降低血脂,增强机体的抵抗能力,并有一定的解毒功能和抗组胺作用。
能与I2按1 ∶1 的关系定量反应生成二酮基, 从而可用碘量法来测定样品中抗坏血酸的含量。
在医药和化学上应用广泛,同时V C也具有很多生理功能。
如:1、促进骨胶原的生物合成。
利于组织创伤口的更快愈合;2、促进氨基酸中酪氨酸和色氨酸的代谢,延长肌体寿命。
3、改善铁、钙和叶酸的利用。
4、改善脂肪和类脂特别是胆固醇的代谢,预防心血管病。
5、促进牙齿和骨骼的生长,防止牙床出血。
;6、增强肌体对外界环境的抗应激能力和免疫力。
因此我们应每天补充足量VC。
成人维生素C的推荐摄入量为100mg/d。
在樱桃,番石榴,柑橘等很多水果中都含有丰富的VC。
本次实验目的在于通过测量橘子中Vc含量来确定每天摄入多少橘子可满足人体所需Vc。
【实验目的】1.掌握直接碘量法测定维生素C的原理和方法。
2.了解间接碘量法的原理。
3.通过维生素C的含量测定,熟悉直接碘量法基本原理及操作过程。
4.了解日常食用的蔬菜水果中维生素C的含量,注意饮食质量,提高健康意识。
【设计原理】【 主要的反应方程式】维生素C 又称抗坏血酸Vc,分子式C 6H 8O 6.Vc 具有还原性,可被I 2定量氧化,因而可用I 2标准溶液直接测定.其滴定反应式:C 6H 8O 6+I 2= C 6H 6O 6+2HI通过消耗碘溶液的体积及其浓度,计算试样中维生素C 的含量。
22()()()()100%()1000c I V I M Vc Vc m ω⨯⨯=⨯⨯试样 ()176.1/M Vc g mol =用直接碘量法可测定药片,注射液,饮料,蔬菜,水果等的V 含量. 游离I 2容易挥发损失,这是影响碘溶液稳定性的原因之一.因此溶液中应维持适当过量的I-离子 ,以减少I 2的挥发.空气能氧化I -离子,引起I 2浓度增加:4 I -+O 2+4H +=2I 2+2H 2O此氧化作用缓慢,但能为光,热,及酸的作用而加速,因此I 2溶液应处于棕色瓶中置冷暗处保存.I 2能缓慢腐蚀橡胶和其他有机物,所以I 2应避免与这类物质接触.I 2 溶液的标定用Na 2S 2O 3标定.而Na 2S 2O 3一般含有少量杂质,在PH=9-10间稳定,所以在Na 2S 2O 3溶液中加入少量的Na 2CO 3· Na 2S 2O 3见光易分解可用棕色瓶储于暗处,经8-14天,用K 2Cr 2O 7做基准物间接碘量法标定Na 2S 2O 3溶液的浓度.其过程为:K 2Cr 2O 7与KI 先反应析出I 2:析出的I 2再用标准的Na 2S 2O 3溶液滴定:从而求得Na 2S 2O 3的浓度.这个标定Na 2S 2O 3的方法为间接碘量法.碘量法的基本反应式:2S 2O 32-+I 2=S 4O 62-+2I -标定Na 2S 2O 3溶液时有:6I -+Cr 2O 72-+14H +=2Cr 3++3I 2+7H 2O 2S 2O 32-+I 2=S 4O 62-+2I - Na 2S 2O 3标定时有:n(K 2Cr 2O 7): 6n(Na 2S 2O 3)=1:6由于Vc 的还原性很强,较容易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生.考虑到I 2在强酸性中也易被氧化,故一般选在PH 为3-4的弱酸性溶液中进行滴定.【总体思路】【理论计算】根据:C6H8O6+I2= C6H6O6+2HII2 + 2S2O32- =2 I- +S4O62-Cr2O72- + 6 I- + 14H+ = 2Cr3+ +3I2 + 7H2O西红柿的参考值为18mg/100g.为了满足分析实验要求T.E<0.2%,滴定体积范围20ml~25ml.经计算可得:(1)C(I2)=0.005mol/L(由于仪器限制和实际情况推算出来)(2)西红柿样品m1=20×0.005×176.12×100/18=97.84gm2=25×0.005×176.12×100/18=122.3g(3)C(Na2S2O3 )= 2×C(I2 )V (I2)/V(Na2S2O3)=0.008mol/L~0.01mol/L(4)C(K2Cr2O7)=C(Na2S2O3)×V(Na2S2O3)/V(K2Cr2O7)/6=0.0013~0.0021 mol/L(5)m(K2Cr2O7固体)=C(K2Cr2O7固体)×294.18×0.250=0.096~0.154g 【数据结果公式】C(K2Cr2O7)=m/(K2Cr2O7固体) (294.18×0.250 )(mol/L )C(Na2S2O3 固体)=C (K2Cr2O7)×20.00×6/V(Na2S2O3)C(I2)=0.5×C(Na2S2O3)×20.00/V(I2)水果中V质量分数=[C(I2 )V (I2)×M(果浆)÷m(V C)÷1000]×100%C【实验步骤】一、Na2S2O3溶液的配制及标定1、用量筒量取3mL0.1mol/LNa2S2O3 溶液,在烧杯中稀释至300mL,放入细口瓶中。
2、用K2Cr2O7标准溶液标定Na2S2O3:(1)准确称取0.106g的K2Cr2O7 固体于小烧杯中,加20毫升蒸馏水溶解,转移入250毫升容量瓶,定容称取KI固体于小烧杯中,加蒸馏水稀释至30毫升(2)取10毫升浓盐酸,加水稀释至20毫升(3)移取20.00mL K2Cr2O7溶液于250毫升锥形瓶,加入5毫升KI,再加入2毫升1:1HCl,置于暗处反应5分钟,然后加蒸馏水50毫升,用Na2S2O3滴定至黄绿色,加入2毫升淀粉溶液,继续滴定至溶液呈亮绿色为终点,记下消耗Na2S2O3体积平行滴定三次。
二、标准碘液的配制及标定(1)用小量筒量取3mL0.5mol/LI溶液放入细口瓶中,加蒸馏2水稀释至300ml。
置于避光处保存。
(2)移取Na2S2O3标准溶液20毫升于250毫升锥形瓶中,加50毫升水,5ml 0.5%淀粉溶液,然后用I2溶液滴定至溶液呈浅蓝色,30s内不褪色即为终点.平行三次,计算I2溶液的浓度.三、西红柿中V含量的测定C1将大约300多克的西红柿放入多功能食物粉碎机中,然后进行粉碎。
2.分别称取100.3,100.3,119.9g的果汁,放入三个洁净的锥形瓶中。
2mL淀粉溶液,立即用标准碘液滴定至刚呈现蓝色,30秒内不退色为终点。
记下消耗碘液体积。
平行滴定三次。
【仪器用具】西红柿若干,容量瓶(250mL),酸式滴定管(25 mL),碱式滴定管(25 mL),锥形瓶,量筒,玻璃棒,天平,榨汁机,烧杯,Na2S2O3固体,K2Cr2O7固体,I2溶液,KI固体,浓盐酸(1:1)【数据记录及结果处理】表一、Na 2S 2O 3 溶液的配制及标定注:c (K 2Cr 2O 7)=m ×1000/294.18×250.0c (Na 2S 2O 3 固体)=C (K 2Cr 2O 7)×20.00×6/V(Na 2S 2O 3)表二、标准碘液的配制及标定1 2 3 V (Na 2S 2O 3 )/ mLV (消耗I 2) / mLC(I 2) /mol/LC(I 2)平均/mol/L注:c (I 2)=0.5×C(Na 2S 2O 3)×20.00/V(I 2)表三、橘子果肉中V C 含量的测定1 2 3 M 果汁 / gV (消耗I 2) / mL维c 的含量ω(VC)维c 的平均含量ω(VC)注:水果中VC质量分数=[C(I2 )V (I2)×M(果浆)÷m(VC)÷1000]×100%()176.1/M Vc g mol西红柿中Vc 含量为11.79mg/100g【参考文献】《基础化学实验》上册,徐家宁,门瑞芝,张寒琦主编,高等教育出 1 2 3m K 2Cr 2O 7 / gC K 2Cr 2O 7 /mol/LV Na 2S 2O 3 / mLC Na 2S 2O 3 /mol/LC Na 2S 2O 3平均/mol/L版社,2006。
网络资料。
【设计总结】一.误差分析:实际测量值比参考值小6mg,分析原因如下:(1)在实验操作中会带来一些误差(如读数误差,称量过程中误差)。