
荧光定量PCR完全攻略
1、什么是定量PCR?
以参照物为标准,对PCR终产物进行分析或对PCR过程进行监测,从而达到评估样本中靶基因的拷贝数,称为定量PCR。定量PCR的可行性定量一般是在PCR扩增的指数期进行的。
2、定量PCR定量的理论依据是什么?
特定的待扩增基因片段起始含量越大,则指数扩增过程越短,当扩增速率趋于稳定后,则无论原来样品中起始模板含量多少,最终扩增片段的含量通常是一样的。理想的扩增结果:Y=X×2n其中Y代表扩增产物量,X代表PCR反应体中的原始模板数n为扩增次数;理论上PCR扩增效率为100%,PCR产物随着循环的进行成指数增长,但实际上:DNA的每一次复制都不完全,即每一次扩增中,模板不是呈2的倍增长;实际应为:Y= X(1+E)n,其中E 代表扩增效率:E = 参与复制的模板/总模板,通常E≤1,E在整个PCR扩增过程中不是固定不变的。通常X 在1~105拷贝、循环次数n≤30时,E 相对稳定,原始模板以相对固定的指数形式增加,适合定量分析,这也就是所谓的指数期;随着循环次数n的增加(>30次),E值逐渐减少,Y 呈非固定的指数形式增加,最后进入平台期。
3、荧光定量PCR定量的理论模式又是什么?
PCR是对原始待测模板核酸的一个扩增过程,任何干扰PCR指数扩增的因素都会影响扩增产物的量,使得PCR扩增终产物的数量与原始模板数量之间没有一个固定的比例关系,通过检测扩增终产物很难对原始模板进行准确定量。近年来研究人员通过大量的实践,研究了相对准确的定量PCR方法,即荧光定量PCR。
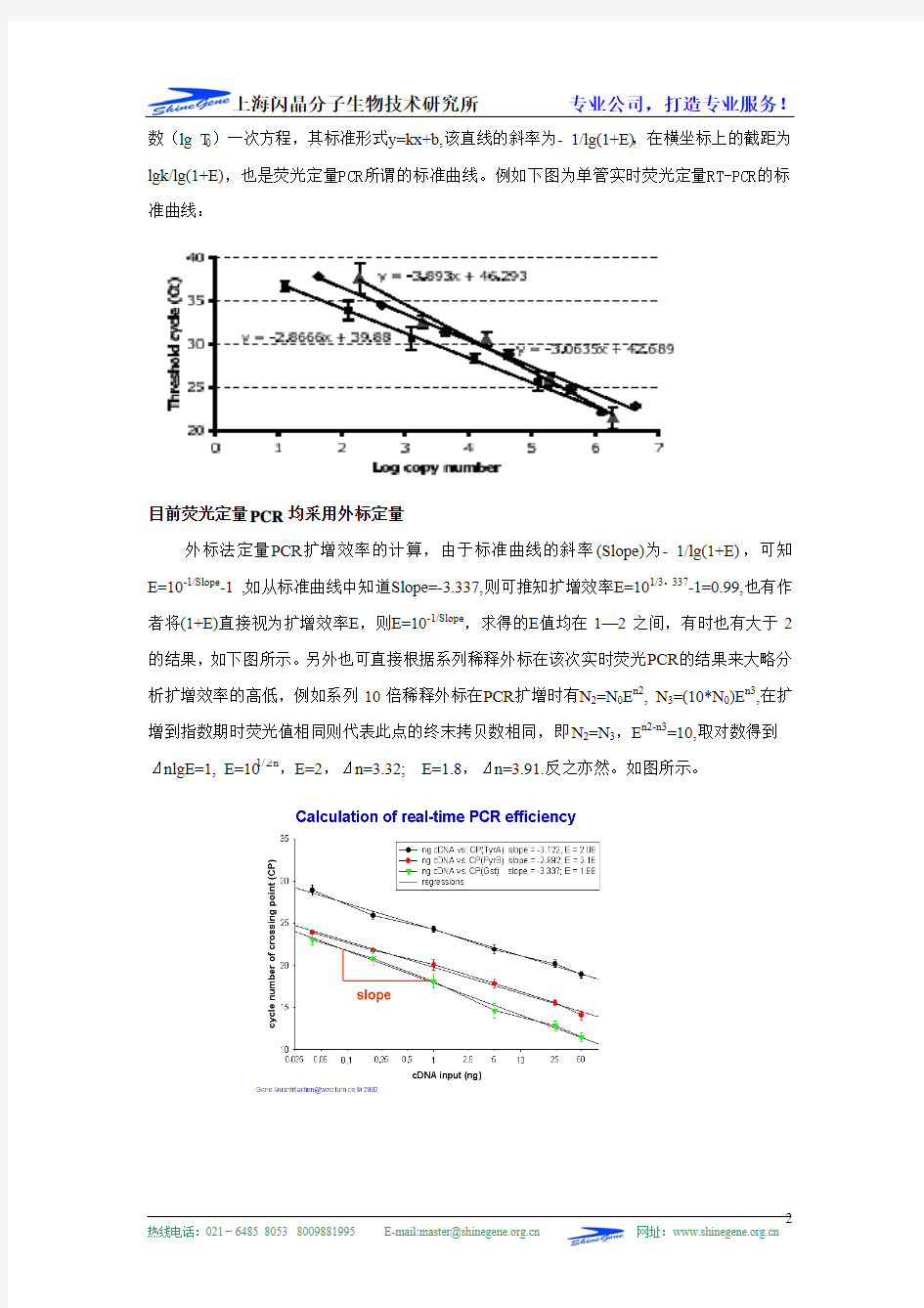
PCR扩增通式:① T n=T0(1+E)n
② T n=Tn-1(1+E)n 注:[0 其中E表示扩增效率,n为循环数,T n表示在n个周期后PCR产物的数量,Tn-1表示在n-1个周期后PCR产物的数量,T0为原始模板数量。设定PCR到达指数扩增期时,产生一定的荧光(荧光依赖于某一循环扩增产物的总量,即特定的拷贝数K,为常数,大约在1010左右)高于背景为仪器所识别,此时的循环数为CP(crossing point),也就是K= T0(1+E)CP,取对数即: lg K=lg T0+CP*lg(1+E) CP=- 1/lg(1+E)*lg T0 +lgk/lg(1+E) 由于对一特定的PCR而言,E与K均为常数,故上式为循环数(CP)对原始模板拷贝数的对 数(lg T0)一次方程,其标准形式y=kx+b,该直线的斜率为- 1/lg(1+E),在横坐标上的截距为lgk/lg(1+E),也是荧光定量PCR所谓的标准曲线。例如下图为单管实时荧光定量RT-PCR的标准曲线: 目前荧光定量PCR均采用外标定量 外标法定量PCR扩增效率的计算,由于标准曲线的斜率(Slope)为- 1/lg(1+E),可知E=10-1/Slope-1 ,如从标准曲线中知道Slope=-3.337,则可推知扩增效率E=101/3。337-1=0.99,也有作者将(1+E)直接视为扩增效率E,则E=10-1/Slope,求得的E值均在1—2之间,有时也有大于2的结果,如下图所示。另外也可直接根据系列稀释外标在该次实时荧光PCR的结果来大略分析扩增效率的高低,例如系列10倍稀释外标在PCR扩增时有N2=N0E n2, N3=(10*N0)E n3,在扩增到指数期时荧光值相同则代表此点的终末拷贝数相同,即N2=N3,E n2-n3=10,取对数得到⊿n gE=1, E=10 l1/⊿n,E=2,⊿n=3.32; E=1.8,⊿n=3.91.反之亦然。如图所示。 4、定量PCR 根据反应体系是否设有参照物以及是否与标本在同一管中进行扩增,定量PCR 可分为四种方法: ①有限稀释法,即倍比稀释法:通过稀释阳性样品直至靶基因不能再扩增为止,来设置已知浓度的参照品;根据阳性结果的最大稀释度及内参标或外参标的极限检出底线,计算出待检标本中原始模板的分子数;利用最大稀释度来进行标本核酸定量时的注意点 A、PCR 产物的最低可检测极限须有重复性;B、对每个稀释度必须作多次PCR ,一般先对模板 DNA 作10倍连续稀释后作PCR,首先找到 PCR 结果呈阴性的接近稀释点 ,然后再对各稀释度作系列的2倍稀释,每个稀释点作5次PCR;C、必须严格控制污染 。优点:不需要特殊设备;缺点:扩增反应条件的标准化、严格注意污染,避免假阳性的产生。 ②使用外参照物的定量PCR,以已知浓度的目的基因为模板,按一定的倍比稀释,然后做出标准曲线图,未知的标本按这标准曲线找出对应的拷贝数。荧光定量PCR 通常使用该法做标准曲线。 ③使用非竞争性内参照物的定量:PCR 反应条件同样,在同一试管内,用两对引物,同步扩增来自同一DNA 的一段靶序列和另一段内标序列。通过比较两种序列的扩增产量可对靶序列定量。方法: A、 设计并合成PCR 扩增靶基因及无关基因的引物,优化引物配比的条件。B、 在指数增长期实现对靶基因及一系列已知含量无关基因的PCR 扩增。 C、 PCR 产物琼脂糖凝胶电泳,EB 染色。 D、 电泳条带的紫外光下分析。 E、 二者荧光强度相等管的DNA 含量亦相等。 该方法只有当靶序列和内标序列以相同的量存在时,才能对两者相对定量;也可以分成哪几类? 是对处于扩增指数期的PCR 产物定量。 ④使用竞争性内参照物的定量PCR :同样的反应条件,同一个试管,用同一对引物,同步扩增靶序列和内参照序列。靶基因的量可通基本条件是靶序列和竞争性序列均用相同的引物以相同的效率扩增,两序列的初始化比值在整个反应过程中保持不变。 目的DNA 内参照DNA 变性(同一对引物) PCR 竞争性模板的设置:通过改变克隆的靶基因的序列来设计竞争性模板插入新的限制性酶切位点或使原来的酶切位点缺失通过基因重组技术插入一个与特异性蛋白结合的DNA 片段,或者使靶序列发生定点诱变人工合成竞争性模板 竞争性模板设计目的:使其与靶基因的PCR 扩增产物相区别(通过酶切、杂交、显色等手段实现)。 根据PCR 扩增过程中是否加入某种标记物、标记物的种类以及最后检测的信号的不同可分为四种类型: ①直接定量检测法, ②同位素标记定量③酶标记定量检测法 ④荧光定量PCR 技术 荧光定量PCR 主要原理发射波长与受体荧光染料光染料吸收供体荧光传递的能量而激发出另一波长的荧光,同时将供体荧光淬灭。 依据PCR 过程的监测检测模式又可分为如下几种 (1) Sybr Green I 检测模式 SYBR Green I 是一种能与双链DNA 结合发光的荧光大增强。因此, SYBR Green I 的检测出PCR 体系存在的双链DNA 数量。SYBR Green I 的最大吸收波长约为497nm,发射波长最大约为520nm。PCR 扩增程序一般为94℃~55℃~72℃三步法,40个循环。 SYBR Green I 的缺点:由于SYBR Green I 没有特异性,不能识别特定的双链,只要是双链就会结合发光,对PCR 反应中的非特异性扩增或引物二聚体也会产生荧光,通常本所以在临床上使用可能会有假阳性发生。 SYBR Green I 的优点:SYBR Green I 的优点是因为其缺点产生,由于它能所有的双链DNA 相结合,所以对不同模板不需特别定制不同的这对科研是很有利的,因此国内外在科研中使用比较普遍。 过与产生相同产物的竞争物的量相比较而得到。其检测法, :荧光共振能量转移,外来光源激发供体荧光染料发出荧光,当其的吸收波长部分重叠,且两者距离很近(约10~100埃)时,受体荧染料。其与双链DNA 结合后, 荧光大荧光信号强度与双链DNA 的数量相关,可以根据荧光信号底较高,特异性探针,通用性较好,并且价格相对较低。 SYBR GREEN I 工作原理 (2) 水解探针模式(Taqman) TaqMan 探针是一种寡核苷酸探针’末端, 而淬灭剂则在3’末端。当探针与靶序列配对时,荧光基团发射的荧光因与3’端的淬灭剂接近而被淬灭。在进行延伸反应时,聚合酶的5’外切酶活性将探针切断, 使得荧光基团与淬灭剂分离,发射荧光。一分子的产物生成就伴随着一分子的荧光信号的产生。随着扩增循环数的增加,释放出来的荧光基团不断积累。因此Taqman 探针检测的是积累荧光。PCR 扩增程序通常是:94℃~60 ℃ 40个循环。常用的荧光基团是FAM,TET,VIC,HEX。 Taqman 探针工作原理 (3) 杂交探针模式(Beacon、FRET) 分子信标是一种呈发夹结构的茎环因此标记在一端的荧光基团与标记在另一端的淬灭基团紧紧靠近。荧光基团被激发后产生的光子被,荧光基团连接在探针的5双标记寡核苷酸探针, 两端的核酸序列互补配对, 淬灭剂淬灭,由荧光基团产生的能量以红构中,环一般为15-30 个核苷酸长,并与目标序列互补;茎一般5-7 个核苷酸长,并相互配对形成茎的结构。荧光基团标记在探针的一端,而淬灭剂则标记在另一端。在复性温度下,因为模板不存在时形成茎环结构,当加热变性会互补配对的茎环双链解开,如果有模板存在环序列将与模板配对。与模板配对后,分子信标将成链状而非发夹状,使得荧光基团与淬灭剂分开。当荧光基团被激发时,因淬灭作用被解除,发出激发光子。由于是酶切作用的存在,分子信标也是积累荧光。常用的荧光基团:FAM ,Texas Red 。PCR 扩增程序通常是:94~55~72 ℃三步法,40个循环。 外而不是可见光形式释放出来。分子信标的茎环结 ET 探针又称双杂交探针,FRET 探针由两条相邻探针组成,在一条探针的5`端标记FAM 荧光基团,另一探针的3`端标记Red 640荧光基团。当复性时,探针结合在模板上,FAM 基团和Red640基团相邻,激发FAM 产生的荧光,作为Red640基团的激发光被吸收,使Red640 分子信标工作原理 FR 发出波长为640的荧光。当变性时,探针游离,两基团距离远,不能产生640波长的荧光。由于FRET 探针是靠近发光,所以检测信号是实时信号,非累积信号。常用的荧光基团是:LC-Red640,LC-Red705。 FRET工作原理 能用于实时荧光PCR定量的方法很多,各有优缺点,应根据实验的需要和当前的实验条件选择适合自己的方法。 SYBR GREEN FRET探针Taqman 分子信标 性 质 可逆荧光 积累荧光 熔点分析 能 不能 特异性 引物(非特异性扩 增或引物二聚体有 影响) 引物+2探针引物+探针 引物+探针 探 针 不需要 需要 需要 需要 通用性 通用 专用 专用 专用 5、为什么要用荧光定量PCR技术进行定量?它与传统的定量PCR有什么不同? 如前所述的,传统的定量PCR有很多,主要是倍比稀释法、内参照法、竞争法、PCR-ELISA 法,但这些定量PCR技术的难点主要在于:(1)如何确定PCR正处于线性扩增范围内(只有在此范围内PCR产物信号才与初始模板的拷贝数成比例)。(2)一旦线性扩增范围确定 以后,如何找到一个合适的方法检测结果。为了保证线性,研究者要扩增一系列梯度稀释的cDNA或者对每个基因的扩增循环数作适当的调整;有的研究者加一个竞争性模板,有的做限制性的稀释梯度分析,或者加一个PCR模拟(mimic)反应,即用相似的引物与目标产物共扩增,而扩增产物的检测通常在跑胶以后通过染料、放射活性或者探针进行检测。(3)大多数是终点检测,即PCR到达平台期后进行检测,而PCR经过对数期扩增到达平台期时,检测重现性极差。同一个模板在96孔PCR仪上做96次重复实验,所得结果有很大差异(如下图所示),因此无法直接从终点产物量推算出起始模板量;虽然加入内标后,可部分消除终产物定量所造成的不准确性。但即使如此,传统的定量方法也都只能算作半定量、粗略定量的方法,所以传统定量PCR的缺点是:劳动强度大、定量不准确、重复性差。 而荧光定量PCR有如下显著的优点: 1、特异性好,使用特异性探针对定量分子进行识别,具有很高的准确性。同时,靶序列由引物和探针双重控制,特异性好、假阳性低。 2、灵敏度高,荧光PCR检测技术是综合了PCR技术、荧光标记技术、激光技术、数码显象技术为一体的技术,因此它的检测灵敏度很高。 3、线性关系好、线性范围宽,由于荧光信号的产生和每次扩增产物成一一对应的关系,通过荧光信号的检测可以直接对产物进行定量;定量范围可在0-1010拷贝/毫升。 4、操作简单、安全、自动化程度高、防污染。扩增和检测可以在同一管内检测,不需要开盖,不易污染;同时扩增和检测一步完成,不需要后期处理,不再需要担心放射性污染。 5、速度快、高通量,可在2-3小时完成96个样品的定量分析。 6、荧光定量PCR为什么使用外标定量,而不是内标定量? A、内标对实时荧光定量PCR的影响 若在待测样品中加入已知起始拷贝数的内标,则PCR反应变为双重PCR,双重PCR反应中存在两种模板之间的干扰和竞争,尤其当两种模板的起始拷贝数相差比较大时,这种竞争会表现得更为显著。但由于待测样品的起始拷贝数是未知的,所以无法加入合适数量的已知模板作为内标。也正是这个原因,传统定量方法虽然加入内标,但仍然只是一种半定量的方法。 B、荧光定量PCR无需内标定量 实时荧光定量PCR技术有效地解决了传统定量只能终点检测的局限,实现了每一轮循环均检测一次荧光信号的强度,并记录在电脑软件之中,通过对每个样品Ct值的计算,根据标准曲线获得定量结果。实时荧光定量PCR无需内标是建立在两个基础之上的: (1)Ct值的高度重现性 PCR循环在到达Ct值所在的循环数时,刚刚进入真正的指数扩增期(对数期),此时微小误差尚未放大,因此Ct值的重现性极好,即同一模板不同时间扩增或同一时间不同管内扩增,得到的Ct值是恒定的。 (2)Ct值与起始模板的线性关系 由于Ct值与起始模板的对数存在线性关系,可利用标准曲线对未知样品进行定量测定,因此,实时荧光定量PCR是一种采用外标准曲线定量的方法。 美国Texas大学的科研人员进行了外标法定量和内标法定量的方法学比较,得出的结论是:内标法作为定量或半定量的手段是不可靠的,而外标准曲线的定量方法是一种准确的、值得信赖的科学方法。 7、为什么要用定量PCR而不是定性PCR? 在实验生物学及临床医学的一些场合,由单纯PCR所提供的阳性或阴性结果还远远不够,在阐述许多问题的本质时,基因及其表达的定量起着至关重要的作用。定量PCR常用来研究发病机制、估计病毒的负荷量、监测临床治疗进展或用于诊断遗传缺陷等。通过对靶基因量的检测,将其与疾病的临床表现、临床分型以及各种标志酶的值联系起来,为疾病的诊断和药物疗效监测提供科学的依据。与非定量PCR分析方法不同,定量PCR分析的操作程序有助于评估污染的情况,即测出污染的程度,即使负对照产生了正的信号,只要这些信号比实验样品的低得多,依据这样的结果,至少可以推测出实验中所得出的信号是真实的。 在一定程度上消除了单纯PCR过于敏感、假阳性率高的缺点。 8、如何设计荧光定量PCR实验方案? 下面是一些简要的操作流程,希望能起抛砖引玉的作用,当然具体问题要具体分析: 1)、大量阅读相关的背景资料后,根据自己所要研究的基因名称,在genebank中找到相应的基因序列。(https://www.doczj.com/doc/b67023065.html,) 2)、用引物设计软件Primer5.0、Oligo6.0或beacon designs3.0进行引物探针的设计;(该软件可在https://www.doczj.com/doc/b67023065.html,下载) 引物设计通常遵守如下原则: A、引物与模板的序列要紧密互补。 B、引物与引物之间避免形成稳定的二聚体或发夹结构。 C、引物不能在模板的非目的位点引发DNA 聚合反应(即错配)。 D、引物长度通常在20-25bp,Tm值在55-65℃,GC含量在40%-60%,产物大小在100-250bp之间。 E、引物的3’端避免使用碱基A;引物3’端避免出现3 个以上连续相同的碱基。 F、为避免基因组的扩增,引物设计最好能跨两个外显子。 探针设计通常遵守如下原则: A、探针位置尽可能地靠近上游引物。 B、探针长度通常在20-30bp,Tm值在65-70℃,通常比引物高5-10℃,GC含量在40%-70%。 C、探针的5’端应避免使用碱基G。 D、整条探针中,碱基C的含量要明显高于G的含量。 3)、为确保引物探针的特异性,最好将设计好的序列在blast中核实一次,如果发现有非特异性互补区,建议重新设计引物探针。(www.ncbi.nlm.nih/blast) 4)、根据仪器特点和个人的喜好,选择标记的荧光素种类。如:FAM、Texas red、LC-Red640,LC-Red705等,同时确定荧光定量PCR的方法,选择Taqman或beacon等,可参考前面所述。5)、选择高品质的引物探针合成商,如闪晶生物等。 6)、外标准品的制备:一种是化学合成目的基因,它的优点是纯度高、定量准确,缺点是受化学合成工艺的限制,只能合成120bp以下的长度;一种是将PCR扩增产物直接梯度稀释,它的优点是方便、简单,缺点是不准确、不稳定;另一种是将PCR产物克隆到载体上,然后抽提出质粒,经过测量浓度和拷贝数的换算,可准确定量,它的优点是稳定、准确。如果是转基因食品,则要求转基因食品与非转基因食品按一定的比例混合做成标准品。稀释液可以是TE或者是闪晶生物提供的DNA保存液。拷贝数=(质量÷分子量)×6.0×1023。通常外标由4个点到5个点组成,模板的浓度分别为107/ml、106/ml、105/ml、104/ml、103/ml。7)、合成好的引物探针,最好用双蒸水稀释成25pmol/ul的浓度,然后放-20℃保存,还应该注意避光保存探针。如果是配成25pmol/ul的浓度,那么所加水的量是(ul): (OD数×33)÷分子量×40000 8)、PCR反应液的配制 1×PCR buffer、0.3-0.5pmol/ul的引物、0.1-0.3pmol/ul的探针、2.5-4.0mM的Mg2+、1-2U的Taq酶、0.2-0.4mM的dNTPs、0.2-1U的UNG酶、0.3-0.6mMdUTP、通常取2-5ul的模板、反应总体积通常为20-50ul(以上所有的浓度都是指终浓度) 9)、PCR扩增程序的设定 在lightcycler上通常是:先50℃2℃3分钟,然后93℃5℃20秒,循环 40次,在60℃时,设定荧光检测点。 在其它荧光仪器上,通常是:先50℃2℃5分钟,然后93℃20℃30秒, 循环40次,在60℃时,设定荧光检测点。 10)、为确保实验数据的有效性,每次实验都设阴性对照和4个标准品,每个样品都平行做2个复孔。 11)、基线或阀值的设定 通常是以10-15个循环的荧光值作为阀值,也可以以阴性对照荧光值的最高点作为基线。 9、荧光定量PCR常见的几个问题 1)、文献上找到的引物和探针序列能否直接使用? 通常国外的文献可信度比较高,可直接使用;但为了保险起见,最好用blast对引物探针的序列进行必要的验证;或者再进一步用primer软件对引物探针的二级结构和退火温度进行分析,这样更有利于您对整个实验的把握。 2)、在实验之前要进行哪些准备工作? 首先要不加探针做常规的PCR实验,验证引物是否工作、模板是否降解、模板纯度是否合适,同时确定实验的最佳反应体系和反应条件。 3)、标本的采集和处理应该注意什么问题? 根据实验要求和目的,有针对性采集病灶部位的标本;采集好的标本,最好根据每次实验用量,用冻存管分成几小份,放在-80℃保存,以免反复冻融;标本通常分成3类,如细胞组织、分泌物、血清全血;如果是血清,不能有融血现象的发生,否则会影响PCR的扩增;如果是全血,最好不用EDTA作为抗凝剂,选用柠檬酸作为抗凝剂,否则会影响PCR的扩增;如果是组织,最好用蛋白酶K消化;如果是提RNA的标本,更应该防止反复冻融和保持标本的新鲜。 4)、在做荧光定量实验时要注意些什么呢? A、在操作中,应使用不含荧光物质的一次性手套(经常替换)、一次性移液器吸头(带滤嘴自卸式),并不能用手直接触摸毛细管、离心管吗底部。 B、在试剂准备和标本处理时应使用超净工作台(负压式)或防污染罩,以防止对环境的污染。 C、操作台、移液器、离心机、PCR扩增仪等仪器设备应经常用10%次氯酸或75%乙醇擦拭消毒。每次实验前后用10%次氯酸和70%乙醇擦拭移液器、操作台。 D、实验中涉及的有害有毒的标本及试剂应妥善放置,专人保管;废弃物应置专门容器中,妥善处理。 E、荧光探针应避光保存,加入反应液中后,应尽快配制好反应体系进行扩增。 F、配制反应体系时,应注意移液器的使用方法,所有的液体都要缓慢加至管底,不要加至管壁,所有液体的混匀要用振荡器进行,不能用移液器吹打,反应体系配制完毕后低速离心数秒,避免产生气泡。 G、配制反应体系过程中若需标记,请在试管架或离心机管架上标记,不要直接标记在离心管上。 5)、为什么阳性对照一直没有扩增曲线? 首先确定没有少加漏加反应成分,确定反应条件是否合适,模板是否降解;但也可能是体系 有问题,如:镁离子浓度不对、酶浓度不对等;最大的可能是酶不工作或是探针不工作了;6)、为什么阴性对照一直有扩增曲线出现? 最大的可能是有污染了;但也可能是体系有问题,如:镁离子浓度不对、酶浓度不对等。7)、如果出现污染该怎么办? 以替换法确定污染从何而来,对症下药,值得注意的是,因荧光定量PCR的敏感度极高,从防止污染的角度出发,最好在体系中加有dUTP,一旦出现污染现象,可以用UNG酶消除;同时将实验室分成4个区,即试剂储存和准备区、标本制备区、扩增反应混合物配制、扩增和产物分析区。 18、酶或探针不工作怎么办? 在有充分证据的情况下,找供应商的责任,所以在买酶和探针时要找有质量保证和信用的供应商,譬如闪晶生物,以免不必要的麻烦。 19、客户需要提供什么? 一般只需要提供基因序列和样品就可以了。 上海闪晶分子生物科技有限公司 地址:上海市宜山路705号B座18楼 邮编:200233 联系:市场部 电话:64858053 800-988-1995 E-mail:master@https://www.doczj.com/doc/b67023065.html, 网址:https://www.doczj.com/doc/b67023065.html, 实时荧光定量PCR原理和实验 陈云地 作者单位:200030 美国应用生物系统公司(Applied Biosystems) 无论是对遗传病(如地中海贫血和血友病)、传染病(如肝炎和艾滋病)或肿瘤进行基因诊断,还是研究药物对基因表达水平的影响,或者监控药物和疗法的治疗效果,定量PCR技术都可以发挥很大作用。定量PCR技术的最新进展是实时荧光定量。该技术借助于荧光信号来检测PCR产物,一方面提高了灵敏度,另一方面还可以做到PCR每循环一次就收集一个数据,建立实时扩增曲线,准确地确定CT值,从而根据CT值确定起始DNA拷贝数,做到了真正意义上的DNA定量。这是DNA定量技术的一次飞跃。 根据最终得到的数据不同,定量PCR可以分为相对定量和绝对定量两种。典型的相对定量如比较经过不同方式处理的两个样本中基因表达水平的高低变化,得到的结果是百分比;绝对定量则需要使用标准曲线确定样本中基因的拷贝数或浓度。根据所使用的技术不同,荧光定量PCR 又可以分为TaqMan探针和SYBR Green I 荧光染料两种方法。比较而言,探针杂交技术在原理上更为严格,所得数据更为精确;荧光染料技术则成本更为低廉,实验设计更 为简便。在选择实验方案时要根据实验目的和对数据精度的要求来决定。 定量实验与定性实验最大的不同,是要考虑统计学要求并对数据进行严格的校正,以消除偶然误差。因此重复实验和设立内对照非常重要。由于各种各样的客观原因,这一点在实践中往往被轻视或忽视,需要着重强调。当然,与定性实验一样,定量PCR也要设立阴性和阳性对照,以监控试剂和实验操作方面可能出现的问题。 1 为什么终点定量不准确? 我们都知道理论上PCR是一个指数增长的过程,但是实际的PCR扩增曲线并不是标准的指数曲线,而是S形曲线。这是因为随着PCR循环的增多,扩增规模迅速增大,Taq酶、dNTP、引物,甚至DNA模板等各种PCR要素逐渐不敷需求,PCR的效率越来越低,产物增长的速度就逐渐减缓。当所有的Taq酶都被饱和以后,PCR就进入了平台期。由于各种环境因素的复杂相互作用,不同的PCR反应体系进入平台期的时机和平台期的高低都有很大变化,难以精确控制。所以,即使是重复实验,各种条件基本一致,最后得到的DNA拷贝数也是完全不一样的,波动很大(图1)。 实时荧光定量PCR(Real-Time PCR)实验流程 一、RNA的提取(详见RNA提取及反转录) 不同组织样本的RNA提取适用不同的提取方法,因为Real-Time PCR对RNA样品的质量要求较高,所以,正式实验前要选择一款适合自己样品的提取方法,在实验过程中要防止RNA的降解,保持RNA的完整性。 在总RNA的提取过程中,注意避免mRNA的断裂;取2ug进行RNA的甲醛变性胶电泳检测,如果存在DNA污染时,要用DNase I进行消化(因为在处理过程中RNA极易降解,建议体系中加入适量RNA酶抑制剂)。 二、DNase I 消化样品RNA 中的DNA 用DNase I 消化DNA 组份加量 模板(RNA) 10ug RNase Inhibitor 4ul DNase I buffer 10ul DNase I 10ul DEPC处理H2O 至100ul 混匀,37℃ 90min 三、RNA琼脂糖凝胶电泳 1.1%的琼脂糖凝胶电泳凝胶的配制: 1)称取琼脂糖0.45g放入三角瓶中,向其中加入4.5ml的10×MOPS缓冲液和39.5ml 的DEPC水,放微波炉里溶化。 2)待冷却到60摄氏度左右时,加入1ml甲醛,摇匀(避免产生气泡)。倒入凝胶板上凝固30min。 2.取各个RNA样品4μl,加入6×RNA电泳上样缓冲液2μl混匀,加入变性胶加样孔中。3.120V电压下电泳25min。用凝胶紫外分析仪观察,照相保存。 4.RNA电泳结果如下图所示。可见28S和18S两条明亮条带,无DNA条带污染。 四.RNA反转录为cDNA 反转录程序(以MBI的M-MLV为例) 组份加量(20ul体系) 加量(40ul体系) 模板(RNA) 0.1~2.5ug(根据条带的亮度适当调整) 3ug(根据条带的亮度适当调整) 引物T18(50uM)(或其他引物) 2.0ul 4.0ul DEPC处理H2O 至12.5ul 至25ul 08 年第一期螺旋课堂--“荧光定量 PCR 技术” 08 年第一期螺旋课堂--“荧光定量 PCR 技术” 实时荧光定量PCR方法简介 一.实时荧光定量PCR的基本原理 理论上,PCR过程是按照2n(n代表PCR循环的次数)指数的方式进行模板的扩增。但在实际的PCR反应过程中,随着反应的进行由于体系中各成分的消耗(主要是由于聚合酶活力的衰减)使得靶序列并非按指数方式扩增,而是按线性的方式增长进入平台期。因此在起始模板量与终点的荧光信号强度间没有可靠的相关性。如采用常规的终点检测法(利用EB染色来判断扩增产物的多少,从而间接的判断起始拷贝量),即使起始模板量相同经PCR 扩增、EB染色后也完全有可能得到不同的终点荧光信号强度。 为了能准确判断样品中某基因转录产物(mRNA)的起始拷贝数,实时荧光定量PCR采用新的参数——Ct值,定量的根本原理是Ct值与样品中起始模板的拷贝数的对数成线性反比关系。 Ct值是如何得到的 在实时荧光定量PCR的过程中,靶序列的扩增与荧光信号的检测同时进行,定量PCR仪全程采集荧光信号,实验结束后分析软件自动按数学算法扣除荧光本底信号并设定阈值从而得到每个样品的Ct值。 Ct值的定义 Ct值中的“C”代表Cycle(循环),“t”代表检测threshhold(阈值),其含义是PCR扩增过程中荧光信号强度达到阈值所需要的循环数;也可以理解为扩增曲线与阈值线交点所对 应的横坐标。 Ct值与样品中模板的对应关系 Ct值与样品中起始模板的拷贝数的对数成线性反比关系(y=ax+b,x代表起始模板拷贝数的对数,y代表Ct值)。 与终点法相比利用Ct值的优势 由于Ct值是反映实际PCR反应过程中扩增即将进入指数期的参数,该参数几乎不受试剂消耗等因素的影响,因此利用Ct值判断的起始模板拷贝数更加精确,重复性也更好。传统的终点检测法是在PCR扩增经历了指数扩增期进入平台期后利用EB等染料染色来判断扩增产物的多少,从而间接的判断起始拷贝量,这种方法的精确度不高、重复性也不好。 下图中是96个复孔的实时扩增曲线(完全相同的反应体系、相同的反应protocol、相同的样品起始浓度),可以看到Ct值具有很好的重复性,而终点的荧光信号强度差异达到300个单位。 此外,采用实时荧光定量PCR还能从方法学上有效的防止PCR实验中交叉污染的问题。因为荧光定量PCR中模板的扩增与检测是同时进行的,当实验完成后即可获得定量结果, 实时荧光定量PCR仪ViiA 7 操作步骤 ——以RNase P示例实验为例 一、定义384孔样品模块的实验属性 打开电脑访问ViiA 7 软件,然后打开左侧仪器开关。单击Experiment Setup图标。单击Experiment Properties以访问Experiment Properties屏幕。 在ViiA 7 软件中设计RNase P实验示例时,请输入: 二、使用Define屏幕定义RNase P示例实验的目标基因、样品。 1. 单击Define以访问Define屏幕。 2. 定义目标基因 a. 单击New以增加和定义目标基因。 b. 在目标基因表中,单击Target Name列中的一个单元格,并输入: c. (可选)单击Save以便将新增或原有的正在编辑的目标基因保存到Target Library。 d. 单击Add Saved从目标基因库添加目标基因。 3. 定义样品 a. 单击New以增加和命名样品。 b. 在样品表中,单击Sample Name列中的一个单元格,并输入: c. (可选)单击Save以将新增或原有的正在编辑的样品保存到Sample Library。 d. 单击Add Saved从样品库添加样品。 4. (可选)定义生物学平行测定 a. 在Define Biological Replicates Groups表中,单击New以增加和命名生物学平行 测定组。 b. 从下拉菜单选择Color。 c. 单击Comments列,以便为该生物学平行测定组添加注释。 注:实验示例不使用生物学平行测定组。保留Biological Replicate Groups空白。 5. 选择用作参比荧光的染料ROX。 TaqMan实时荧光定量RT-PCR检测ERCC1变异剪接体 检测平台的建立 前言 对一个基因的各个变异剪接体分别进行精确定检测是深入研究变异剪接的基础。在TaqMan实时荧光定量RT-PCR技术( TaqMan real-time quantity RT-PCR)出现前,传统的检测方法有4种[1, 2]:(1)Northern blot; (2)核酶保护分析;(3)相对定量RT-PCR,(4)竞争定量RT-PCR这些方法都有其内在的局限性。Northern blot耗时,随时面临RNA降解的困扰,而且灵敏度不高,需要相对大量的RNA 才能检测出来,仅仅适合相对定量分析[3]。核酶保护分析比Northern blot相对灵敏,但是仍然耗时而且需要相对大量的RNA才方便检测[4-8]。相对定量RT-PCR 则需要在每个反应的指数扩增期停止反应后进行凝胶电泳分析,由于每个样本的起始拷贝数不一致,很难确保每个样本均处于相同的指数扩增期。而且此方法需要将PCR产物进行琼脂糖或聚丙烯酰胺凝胶电泳分析,增加了步骤,而且增加了污染的可能性[9]。竞争定量RT-PCR则需要根据不同的目的基因片断构建相应的竞争子,然后需要确定每个反应体系中竞争子和目的基因的不同比例,不仅仅耗时而且繁琐,更重要的是竞争子的构建不仅仅需要很大的技巧性,而是是一件极其艰难的工作[10, 11]。这些传统技术不仅繁琐耗时,而且对mRNA的质量要求较高,结果不稳定。而且,这些传统的方法由于方法学上的差异性,导致研究结果不十分可靠,各研究机构之间的结果差异较大。 应用TaqMan实时荧光定量RT-PCR技术则可以分别精确检测各个变异剪接体的表达量,结果稳定,可重复性高,方便快捷,程序简单,无需后续处理,几无污染[1, 12-14]。本研究拟建立对切除修复交叉互补基因1即ERCC1(excision repair cross-complementation group 1)变异剪接体的TaqMan实时荧光定量RT-PCR检测平台,为深入研究ERCC1的变异剪接奠定基础[15]。 TaqMan实时荧光定量RT-PCR技术的基本原理是通过设计与目的序列互补的一段寡核苷酸作为TaqMan探针,在此探针的5’端标记报告基团(如FAM), 荧光定量PCR实验指南(一) 一、基本步骤: 1、目的基因(DNA和mRNA)的查找和比对; 2、引物、探针的设计; 3、引物探针的合成; 4、反应体系的配制; 5、反应条件的设定; 6、反应体系和条件的优化; 7、荧光曲线和数据分析; 8、标准品的制备; 二、技术关键: 1、目的基因(DNA和mRNA)的查找和比对; 从https://www.doczj.com/doc/b67023065.html,/网点的genbank中下载所需要的序列。下载的方式有两种:一为打开某个序列后,直接点击“save”,保存格式为“.txt”文件。保存的名称中要包括序列的物种、序列的亚型、序列的注册号。然后,再打开DNAstar软件中的Editseq 软件,点击“file”菜单中的“import”,打开后点击“save”,保存为“.seq”文件。另一种直接用DNAstar软件中的Editseq软件,点击“file”菜单中的“open entrez sequence”,导入后保存为“.seq”文件,保存的名称中要包括序列的物种、序列的亚型、序列的注册号。然后要对所有的序列进行排序。用DNAstar软件中的Seqman软件,点击“sequence”菜单中的“add”,选择要比较的“.seq”的所有文件,点击“add”或“add all”,然后点击“Done”导入要比较的序列,再点击“assemble”进行比较。横线的上列为一致性序列,所有红色的碱基是不同的序列,一致的序列用黑色碱基表示。有时要设定 比较序列的开始与结尾。有时因为参数设置的原因,可能分为几组(contig),若想全部放在一组中进行比较,就调整“project”菜单下的“parameter”,在“assembling”内的“minimum math percentage”默认设置为80,可调低即可。再选择几个组,点击“contig”菜单下的“reassemble contig”即可。选择高低的原则是在保证所分析的序列在一个“contig”内的前提下,尽量提高“minimum math percentage”的值。有时因此个别序列原因,会出现重复序列,碱基的缺失或插入,要对“contig”的序列的排列进行修改,确保排列是每个序列的真实且排列同源性最好的排列。然后,点击“save”保存即可。分析时,主要是观察是否全部为一致性的黑色或红色,对于弥散性的红色是不可用的。 2、引物和探针设计 2.1引物设计 细心地进行引物设计是PCR中最重要的一步。理想的引物对只同目的序列两侧的单一序列而非其他序列退火。设计糟糕的引物可能会同扩增其他的非目的序列。下面的指导描述了一个可以增加特异性的引物所具有的令人满意的特点: 序列选取应在基因的保守区段; 扩增片段长度根据技术的不同有所分别: sybr green I技术对片段长度没有特殊要求; Taqman探针技术要求片段长度在50bp-150bp; 避免引物自身或与引物之间形成4个或4个以上连续配对; 避免引物自身形成环状发卡结构; 典型的引物18到24个核苷长。引物需要足够长,保证序列独特性,并降低序列存在于非目的序列位点的可能性。但是长度大于24核苷的引物并不意味着更高的特异性。较长的序列可能会与错误配对序列杂交,降低了特异性,而且比短序列杂交慢,从而降低了产量。 创新助手报告——主题分析报告 创新助手平台提供 北京万方软件股份有限公司 2014-07-10 报告目录 报告核心要素......................................................................................................... I 一、主题简介 (1) 二、主题相关科研产出总体分析 (1) 2.1 文献总体产出统计 (1) 2.2 学术关注趋势分析 (2) 三、主题相关科技论文产出分析 (2) 3.1 中文期刊论文 (2) 3.1.1 近十年中文期刊论文分布列表 (2) 3.1.2 中文期刊论文增长趋势 (3) 3.1.3 发文较多期刊 (4) 3.1.4 发文较多的机构 (4) 3.1.5 发文较多的人物 (4) 3.1.6 核心期刊分布数量对比 (4) 3.1.7最近相关中文期刊论文 (5) 3.1.8被引较多的相关期刊论文 (6) 3.2 学位论文 (7) 3.2.1 近十年学位论文年代分布列表 (7) 3.2.2 学位论文增长趋势 (8) 3.2.3 硕博学位论文数量对比 (8) 3.2.4 发文较多的机构 (9) 3.2.5 发文较多的人物 (9) 3.2.6 最近相关学位论文 (9) 3.3 中文会议论文 (10) 3.3.1 近十年中文会议论文年代分布列表 (10) 3.3.2 中文会议论文增长趋势 (11) 3.3.3 中文会议论文主办单位分布 (11) 3.3.4 发文较多的机构 (12) 3.3.5发文较多的人物 (12) 3.3.6最近相关中文会议论文 (13) 3.4 外文期刊论文 (13) 3.4.1 近十年外文期刊论文年代分布列表 (13) 3.4.2 外文期刊论文增长趋势 (14) 3.4.3 最近相关外文期刊论文 (14) 3.5 外文会议论文 (15) I 以下实验步骤仅供参考: 1 样品RNA的抽提 ①取冻存已裂解的细胞,室温放置5分钟使其完全溶解。 ②两相分离每1ml的TRIZOL试剂裂解的样品中加入0.2ml的氯仿,盖紧管盖。手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。4℃下12000rpm离心15分钟。离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。RNA全部被分配于水相中。水相上层的体积大约是匀浆时加入的TRIZOL 试剂的60%。 ③RNA沉淀将水相上层转移到一干净无RNA酶的离心管中。加等体积异丙醇混合以沉淀其中的RNA,混匀后15到30℃孵育10分钟后,于4℃下12000rpm 离心10分钟。此时离心前不可见的RNA沉淀将在管底部和侧壁上形成胶状沉淀块。 ④RNA清洗移去上清液,每1mlTRIZOL试剂裂解的样品中加入至少1ml的75%乙醇(75%乙醇用DEPCH2O配制),清洗RNA沉淀。混匀后,4℃下7000rpm 离心5分钟。 ⑤RNA干燥小心吸去大部分乙醇溶液,使RNA沉淀在室温空气中干燥5-10分钟。 ⑥溶解RNA沉淀溶解RNA时,先加入无RNA酶的水40μl用枪反复吹打几次,使其完全溶解,获得的RNA溶液保存于-80℃待用。 2 RNA质量检测 1)紫外吸收法测定 先用稀释用的TE溶液将分光光度计调零。然后取少量RNA溶液用TE稀释(1:100)后,读取其在分光光度计260nm和280nm处的吸收值,测定RNA 溶液浓度和纯度。 ①浓度测定 A260下读值为1表示40 μg RNA/ml。样品RNA浓度(μg/ml)计算公式为:A260 ×稀释倍数× 40 μg/ml。具体计算如下: RNA溶于40 μl DEPC水中,取5ul,1:100稀释至495μl的TE中,测得A260 = 0.21 RNA 浓度= 0.21 ×100 ×40 μg/ml = 840 μg/ml 或0.84 μg/μl 取5ul用来测量以后,剩余样品RNA为35 μl,剩余RNA总量为: 35 μl × 0.84 μg/μl = 29.4 μg ②纯度检测 RNA溶液的A260/A280的比值即为RNA纯度,比值范围1.8到2.1。 2)变性琼脂糖凝胶电泳测定 ①制胶 1g琼脂糖溶于72ml水中,冷却至60℃,10 ml的10× MOPS电泳缓冲液和18 ml的37% 甲醛溶液(12.3 M)。 10×MOPS电泳缓冲液 浓度成分 0.4M MOPS,pH 7.0 0.1M 乙酸钠 0.01M EDTA 灌制凝胶板,预留加样孔至少可以加入25 μl溶液。胶凝后取下梳子,将凝胶板 中图分类号:S 852.62 文献标志码:A 文章编号:1673-4696(2012)12-1268- 05猪肺炎支原体P97TaqMan-BHQ荧光定量 PCR检测方法的建立及应用 武昱孜1,靳蒙蒙1,2 ,白方方1,张 旭1,华利忠1,雷治海2,邵国青1* (1. 江苏省农业科学院兽医研究所农业部兽用生物制品工程技术重点实验室国家兽用生物制品工程技术研究中心,江苏南京 210014;2.南京农业大学动物医学院,江苏南京 210014 ) 摘要:根据猪肺炎支原体(Mhp)P97基因的保守序列设计合成了引物和Taq Man-BHQ探针,建立了快速检测Mhp的TaqMan-BHQ荧光定量PCR方法。结果显示,该方法特异性良好,与其他病原不发生交叉反应;最低检测限可达10copies/μ L,敏感性高;不同梯度定量模板的拷贝数的对数值与Ct值之间的线性关系表达式为Ct=-3.426×lg(conc)+43.343,有良好的线性关系,标准曲线的相关系数为0.997,扩增效率为95.85%,重复性良好。对江苏省某猪场的48份猪肺组织进行荧光定量PCR检测,结果有43份肺组织呈现阳性,阳性检出率为89.58%,比巢式PCR的敏感性高。表明,该检测方法能用于Mhp的快速检测, 可对猪支原体肺炎的早期诊断和流行病学调查提供新的技术手段。 关键词:猪肺炎支原体;P97基因;荧光定量PCR;Taq Man-BHQ探针Development and application of TaqMan-BHQ real time PCR assayfor detection of Mycoplasma hyop neumoniae P97WU Yu-zi 1,JIN Meng-meng1,2,BAI Fang-fang1,ZHANG Xu1,HUA Li-zhong1 , LEI Zhi-hai 2,SHAO Guo-qing 1(1.Institute of Veterinary Medicine,Jiangsu Academy of Agricultural Sciences/Key Laboratory of VeterinaryBiological Engineering and Technology,the Ministry of Agriculture/National Center for Engineering Research ofVeterinary Bio-p roducts,Nanjing210014,China;2.College of Veterinary Medicine,Nanjing AgriculturalUniversity,Nanjing2 10014,China) Abstract:A pair of primers and TaqMan-BHQ probe were designed according to the Mycoplasma hyo-pneumoniae(Mhp)P97sequence,and TaqMan-BHQ real time PCR assay was successfully established fordetection of Mhp.In result,the developed method could specifically detect Mhp,and had no cross-reactionwith pathogens of other swine diseases.There was an excellent linear correlation during the DNA concen-tration from 101 copies/μL to 107 copies/μL.The analytic sensitivity of the assay was 10copies/μL.Theequation of the assay was Ct=-3.426×lg(conc)+43.343,the correlation coefficient of the standard curvewas 0.997,and amplification efficiency was 95.85%with good repeatability.The 48pig lung tissues frompig farms in Jiangsu Province were detected,and the positive rates were 89.58%.The result showed thatthe TaqMan-BHQ real time PCR can be useful for rapid detection of Mhp in clinic detection and for epi-demic investigation of mycoplasmal p neumonia of swine in field study.Key words:Mycoplasma hyopneumoniae;P97gene;real time PCR;TaqMan-BHQ probe 猪支原体肺炎(mycoplasmal p neumonia ofswine,MPS) 又称“气喘病”,是由猪肺炎支原体(Mycoplasma hyop neumoniae,Mhp)引起的一种慢性接触性传染病,以高发病率和低死亡率为特点,世 收稿日期:2012-06-28;修回日期:2012-09- 29基金项目:江苏省农业自主创新基金项目[CX(11)2059];国家自然科学基金项目(31100135)作者简介:武昱孜(1984-) ,女,山西太谷人,硕士。*通讯作者,E-mail:84391973@163.com中国兽医科学 2012,42(12):1268- 1272Chinese Veterinary Science 实时荧光定量PCR操作步骤 以下实验步骤仅供参考: 1 样品RNA的抽提 ①取冻存已裂解的细胞,室温放臵5分钟使其完全溶解。 ②两相分离每1ml的TRIZOL试剂裂解的样品中加入0.2ml的氯仿,盖紧管盖。手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。4℃下12000rpm离心15分钟。离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。RNA全部被分配于水相中。水相上层的体积大约是匀浆时加入的TRIZOL试剂的60%。 ③RNA沉淀将水相上层转移到一干净无RNA酶的离心管中。加等体积异丙醇混合以沉淀其中的RNA,混匀后15到30℃孵育10分钟后,于4℃下12000rpm 离心10分钟。此时离心前不可见的RNA沉淀将在管底部和侧壁上形成胶状沉淀块。 ④RNA清洗移去上清液,每1mlTRIZOL试剂裂解的样品中加入至少1ml的75% O配制),清洗RNA沉淀。混匀后,4℃下7000rpm离心乙醇(75%乙醇用DEPCH 2 5分钟。 ⑤RNA干燥小心吸去大部分乙醇溶液,使RNA沉淀在室温空气中干燥5-10分钟。 ⑥溶解RNA沉淀溶解RNA时,先加入无RNA酶的水40μl用枪反复吹打几次,使其完全溶解,获得的RNA溶液保存于-80℃待用。 2 RNA质量检测 1)紫外吸收法测定 先用稀释用的TE溶液将分光光度计调零。然后取少量RNA溶液用TE稀释(1:100)后,读取其在分光光度计260nm和280nm处的吸收值,测定RNA溶液浓度和纯度。 ①浓度测定 A260下读值为1表示40 μg RNA/ml。样品RNA浓度(μg/ml)计算公式为:A260 ×稀释倍数× 40 μg/ml。具体计算如下: RNA溶于40 μl DEPC水中,取5ul,1:100稀释至495μl的TE中,测得A260 = 0.21 RNA 浓度= 0.21 ×100 ×40 μg/ml = 840 μg/ml 或 0.84 μg/μl 取5ul用来测量以后,剩余样品RNA为35 μl,剩余RNA总量为: 35 μl × 0.84 μg/μl = 29.4 μg ②纯度检测 RNA溶液的A260/A280的比值即为RNA纯度,比值范围1.8到2.1。 2)变性琼脂糖凝胶电泳测定 ①制胶 1g琼脂糖溶于72ml水中,冷却至60℃,10 ml的10× MOPS电泳缓冲液和18 ml 的37% 甲醛溶液(12.3 M)。 10×MOPS电泳缓冲液 浓度成分 0.4M MOPS,pH 7.0 0.1M乙酸钠 0.01M EDTA 灌制凝胶板,预留加样孔至少可以加入25 μl溶液。胶凝后取下梳子,将凝胶板 TaqMan探针荧光定量PCR反应试剂盒使用说明书 (Cat#Yu-R01-2) 【产品介绍】 TaqMan荧光探针的5’末端连接荧光基团,而淬灭剂则在3’末端。PCR扩增时在加入引物的同时加入特异性的荧光探针。探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5'-3'外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号。本公司专利技术生产的TaqMan探针荧光定量PCR反应试剂盒含有荧光增强剂,对FAM、HEX和VIC等荧光物质的有明显的荧光增强效果,灵敏度高,结果可靠,性能优良,在许多性能上完全超越国外同类产品。 【产品特点】 1. 适用于使用Taqman-TAMRA和Taqman-BHQ1等探针的实时荧光定量PCR,对FAM、HEX和VIC等荧光物质的有明显的荧光增强效果。结合本公司的各种游离DNA提取试剂盒(Cat#Yu-CF-01-1,Cat#Yu-CF-01-2,Cat#Yu-CF-02-1,Cat#Yu-CF-02-2),可以进行游离DNA的定量检测。 2. 灵敏度高:本产品的扩增效率明显高于进口产品(图1)。 3. 稳定性好:本产品重复好,CV值<2%。 4. 操作简单:只需在反应体系中加入引物、探针、模板和ROX。 5. 本产品使用热启动酶,可以进行Hot Start法PCR反应。 6. 本产品无本品无OSHA规定的危险物品,安全无化学污染。 【适用仪器】 Thermal Cycler系列荧光定量PCR仪、Applied Biosystems系列荧光定量PCR 仪、Roche Diagnostics LightCycler系列荧光定量PCR仪、Bio-Rad CFX96 Real-Time PCR Detection System等。 实时荧光定量pcr步骤: 荧光定量PCR 实验步骤:①取冻存已裂解的细胞,室温放置5分钟使其完全溶解。②两相分离每1ml的TRIZOL试剂裂解的样品中加入0.2ml的氯仿,盖紧管盖。手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。4℃下12000rpm离心15分钟。离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。RNA全部被分配于水相中。水相上层的体积大约是匀浆时加入的TRIZOL试剂的60%。③RNA沉淀将水相上层转移到一干净无RNA 酶的离心管中。加等体积异丙醇混合以沉淀其中的RNA,混匀后15到30℃孵育10分钟后,于4℃下12000rpm 离心10分钟。此时离心前不可见的RNA沉淀将在管底部和侧壁上形成胶状沉淀块。 ④RNA清洗移去上清液,每1mlTRIZOL试剂裂解的样品中加入至少1ml的75%乙醇(75%乙醇用DEPCH2O配制),清洗RNA沉淀。混匀后,4℃下7000rpm离心5分钟。⑤RNA干燥小心吸去大部分乙醇溶液,使RNA沉淀在室温空气中干燥5-10分钟。⑥溶解RNA 沉淀溶解RNA时,先加入无RNA酶的水40μl用枪反复吹打几次,使其完全溶解,获得的RNA溶液保存于-80℃待用。1)紫外吸收法测定先用稀释用的TE溶液将分光光度计调零。然后取少量RNA 溶液用TE稀释(1:100)后,读取其在分光光度计260nm和280nm 处的吸收值,测定RNA溶液浓度和纯度。① 浓度测定A260下读值为1表示40 μg RNA/ml。样品RNA浓度(μg/ml)计算公式为:A260 ×稀释倍数× 40 μg/ml。具体计算如下:RNA溶于40 μl DEPC Real-time qPCR手册---手把手教你从菜鸟到高手 由于Real-time qPCR的众多优点,现在已经是生命科学领域的一项常规技术。越来越多的研究文章中涉及RT-PCR的实验,也基本上被real-time qPCR所代替。由于real-time aPCR输出的数据不同于常规的PCR 电泳检测,很多没有做过real-time qPCR的研究者常常感到高深莫测,不知从何入手;甚至一些做过次实验的研究者也会对数据处理分析感到迷惑,不知所措。 本文就从real-time qPCR的发展史说起,包括real-time qPCR的原理,实验设计,实际操作,数据分析,常见问题解答五个方面,手把手教你从各个方面了解real-time qPCR,彻底的从菜鸟到高手! 一、Real-time qPCR发展史 Real-time qPCR就是在PCR扩增过程中,通过荧光信号,对PCR进程进行实时检测。由于在PCR扩增的指数时期,模板的Ct 值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。由于常规的PCR的缺点,real-time qPCR由于其操作简便,灵敏度高,重复性好等优点发展非常迅速。现在已经涉及到生命科学研究的各个领域,比如基因的差异表达分析,SNP检测,等位基因的检测,药物开发,临床诊断,转基因研究等。 在Real-time qPCR技术的发展过程中,定量PCR仪的发展起了至关重要的作用。1995年,美国PE公司(已经并入Invitrogen公司)成功研制了Taqman技术,1996年推出了首台荧光定量PCR检测系统,通过检测每个循环的荧光强度,通过Ct值进行数据分析。从而荧光定量PCR获得广泛应用。现在的定量PCR仪有ABI7000、7300、7500,7700、7900HT、StepOnePlus TM、StepOne TM、PRISM@StepOne TM系列;BIO-RAD的CFX96、iCycler iQ5@、MyiQ@、MJ Research Chromo4TM Opticon系列;StratageneMx TM系列;Roche LightCycler@系列;Eppendorf Masercycler@;Corbett Rotor-Gene TM;Cepheid SmartCycler@和BIOER的LineGene 系列。 随国内生命科学的快速发展,科研水平不断提高,发高水平文章已不再是新鲜事。与其同时,国内公司经过长期不懈的努力,也有自主研发的real-time PCR仪器生产比如西安天隆科技公司的TL系列仪器。 二、Real-time qPCR概述 1. Real-time qPCR原理 实时PCR就是在PCR扩增过程中,通过荧光信号,对PCR进程进行实时检测。一般来讲,定量PCR仪包括:实时荧光定量PCR仪主要由样品载台、基因扩增热循环组件、微量荧光检测光学系统、微电路控制系统、计算机及应用软件组成。其中基因扩增热循环组件工作原理与传统基因扩增仪大致相同,不同厂家不同型号的产品分别采用空气加热、压缩机制冷、半导体加热制冷等工作方式。独特是这个微量荧光检测系统。有由荧光激发光学部件、微量荧光检测部件、光路、控制系统组成。 常用的荧光激发方式有两种:卤钨灯和LED;荧光检测元件常用两种方式:光电倍增管和冷光CCD摄像机,光单色元件有滤光片和光栅。在实时PCR扩增过程中,荧光信号被收集,转化为成为扩增和熔解曲线。具体数据就是基线,荧光阈值和Ct值。 2. Real-time qPCR的数学原理 实时荧光定量PCR (Quantitative Real-time PCR)是一种在DNA扩增反应中,以荧光化学物质测每次聚合酶链式反应(PCR)循环后产物总量的方法。通过内参或者外参法对待测样品中的特定DNA序列进行定量分析的方法。· Real-timePCR是在PCR扩增过程中,通过荧光信号,对PCR 进程进行实时检测。由于在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。 ①取冻存已裂解的细胞,室温放置5分钟使其完全溶解。 ②两相分离每1ml的TRIZOL试剂裂解的样品中加入0.2ml的氯仿,盖紧管盖。手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。4℃下12000rpm离心15分钟。离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。RNA全部被分配于水相中。水相上层的体积大约是匀浆时加入的TRIZOL试剂的60%。 ③RNA沉淀将水相上层转移到一干净无RNA酶的离心管中。加等体积异丙醇混合以沉淀其中的RNA,混匀后15到30℃孵育10分钟后,于4℃下12000rpm 离心10分钟。此时离心前不可见的RNA沉淀将在管底部和侧壁上形成胶状沉淀块。 ④RNA清洗移去上清液,每1mlTRIZOL试剂裂解的样品中加入至少1ml的75%乙醇(75%乙醇用DEPCH2O配制),清洗RNA 沉淀。混匀后,4℃下7000rpm离心5分钟。 ⑤RNA干燥小心吸去大部分乙醇溶液,使RNA沉淀在室温空气中干燥5-10分钟。 ⑥溶解RNA沉淀溶解RNA时,先加入无RNA酶的水40μl 用枪反复吹打几次,使其完全溶解,获得的RNA溶液保存于-80℃待用。 相对定量方法实际操作 (三种常用方法) 本人用的是相对荧光定量PCR法,在分子水平上比较课题中5种新基因的表达差异。实验进行很多次,感受颇深,同时遇到了一些问题:扩增效率、标准品选择(及赋值)、标准曲线、重复性等问题,希望有同行朋友一起探讨和指教。 1. Comparative Delta-delta Ct法定量流程(RG6000软件设置) 1).先对样品中的目的基因与看家基因分别做标准曲线,通过标准曲线确定两个 基因的扩增效率是否一致或接近;将扩增效率优化为一致。 2).同一样品分别进行看家基因和目的基因的扩增,分列在两页中 公式: P1 P2 相同的样品在两页里命名成相 同的名称,并定义为unknown 分别分析P1和P2页 选delta-delta Ct选项 依次填入,并定义对照样品 完成分析 F=2— 待检样品看对照组目的 基因平均Ct 对照组看家 — 待检样品目 —— Comparative Delta-delta Ct法的特点、注意事项及实际应用 1). Comparative Delta-delta Ct法是很常用的一种相对定量方法,其最大特点 是,当优化的体系已经建立后,在每次实验中无需再对看家基因和目的基因做标准曲线,而只需对待测样品分别进行PCR扩增即可。 2). 其缺点是,每次实验都默认目的基因和看家基因的扩增效率一致,而并非真 实扩增情况的反映,这里势必存在一定的误差。 3). Comparative Delta-delta Ct法展开定量实验前,在预实验中,必需对目的基 因和看家基因做两组标准曲线。Rotor-Gene 的软件会自动给出两组标准曲线的R值、扩增效率等信息,如果两组标准曲线的斜率,即M值的差小于 0.1,那么后续实验中就可以用Comparative Delta-delta Ct法进行相对定量 分析。反之,如果M差值大于0.1,就无法用该方法进行相对定量分析。此时的解决方法有两种,一是优化实验,使两组标准曲线的斜率差值小于0.1,二是换用其它的相对定量方法。 应用实例: 3.3 TaqMan法进行实时定量PCR鉴定 较普通PCR而言,实时定量PCR有更高的灵敏度,因此需要进一步优化反应条件。PCR反应在Applied Biosystems StepOneTM Real-Time PCR System (ABI公司仪器)sequence detector中进行。采TaqMan法进行绝对定量ρ0 HeLa细胞中mtDNA 的拷贝数。 3.3.1荧光定量试剂及探针 (1) Premix Ex Taq TM (Perfect Real Time),购自宝生物工程(大连)有限公司。 (2) PCR 反应引物以及探针均由宝生物工程(大连)有限公司合成。 3.3.2构建质粒标准品的目的片段的扩增及纯化 本试验对以往所报道拷贝数的文献进行了筛选,通过比较选用了常用的核基因中的β-actin基因做为的参照,Cox-I基因做为正常线粒体基因[40],其中β-actin基因的引物为实时荧光定量的引物,Cox-I基因的引物则为本实验室扩增线粒体全序列的引物中的第九对引物[41]。引物所在位置、引物序列、目的片段的长度以及复性温度见表6。引物处理、PCR试剂、反应体系等同前面扩增PCR,复性温度依据表6。扩增目的片段并纯化之后与T载体连接。 引物名称引物位置引物序列(5’→3’)目的片段长度复性温度β-actin F 1997-2017 ACCCACACTGTGCCCATCTAC 107 bp 58 ℃β-actin R 2103-2081 TCGGTGAGGATCTTCATGAGGTA Cox-I F1 5835-5855 GAGGCCTAACCCCTGTCTTT 827 bp 59 ℃Cox-I R1 6661-6642 ATTCCGAAGCCTGGTAGGAT 表6 F表示正向引物,R表示反向引物。β-actin F与β-actin R用于扩增β-actin基因的一段区域缺失区域,引物序列同荧光定量时引物序列;Cox-I 1 F与Cox-I R1用于扩增Cox-I基因的一段序列。 3.3.3感受态的制备(于超净工作台无菌条件下及冰上操作) (1) 取上述1 ml培养液于1.5 ml EP管。 (2) 4 ℃ 4000 rpm 离心5 min,弃上清。 (3)加入100 μl冰中预冷的Solution A,轻轻弹动使沉淀悬浮(可轻轻吹打)。 (4) 4 ℃ 4000 rpm 离心5 min,弃上清。 (5) 加入100 μl 冰中预冷的Solution B, 轻轻弹动使沉淀悬浮。 (6) 感受态细胞制作完成(可直接用于DNA转化实验或-80 ℃保存,以备后用)。 3.3.4目的DNA片段的连接及感受态细胞的DNA转化 (1) 在微量离心管中配制下列DNA 溶液,总量为5 μl。 pMD TM 18-T Vector 1 μl Insert DNA 0.1 pmol~0.3 pmol dH2O 补至5 μl实时荧光定量PCR原理和实验
实时荧光定量PCR(Real-Time-PCR)实验流程
【定量数据分析】荧光定量PCR_完整版
螺旋网(https://www.doczj.com/doc/b67023065.html,/)
是一个以分子生物学实验及对实验结果进行处理为核心,以生物技术前沿发 展为导向的一个专业型科学技术讨论社区。 本着“共分享,同成长”的理念,给广大生物科研工作者一个交流经验、分 享资料的平台。
螺旋网版块设置主要分为三个部分:
实验技术交流(实验互助) 实验结果处理(生物信息学) 实验之余的生活 螺旋网的特色: 1、毕赤酵母表达系统; 2、发酵工艺 3、螺旋课堂; 4、Seminar; 5、生物学科研究进展; 6、实验交流及生物信息学。
欢迎广大生物专业的同学和爱好生物学的朋友加盟,共同学习, 共同进步!
螺旋网:https://www.doczj.com/doc/b67023065.html,
祝大家新年快乐,万事如意!
2008 年螺旋课堂的课程计划!
2007 年已悄然逝去,2008 年已向我们扑面而来。08 年是共和国发展的关键 一年,也是螺旋网抓住机遇,加快发展的关键一年。今年螺旋网将为各位螺友提 供大量的关于生命科学的讨论主题,让各位螺友对生命科学的灵感相互碰撞,达 到共鸣。还有螺旋网将联合一批一线生命科学人员为您的研究保驾护航。同时还 将为大家提供各种资源包括各类电子书、生命科学研究进展、生物软件等。 为此,螺旋课堂 08 年的课程将围绕着最新的研究方法、研究进展进行课程 设置。具体安排如下: 第一期:荧光定量 PCR 技术 第二期:原位杂交技术 第三期:引物的设计原理及方法 第四期:BAC 库的构建技术 第五期:手把手教你进行序列分析
..................... 除以上技术外,欢迎大家点播!
以上讲座的具体时间详见论坛通知!
螺旋网:https://www.doczj.com/doc/b67023065.html,
祝大家新年快乐,万事如意!实时荧光定量PCR方法简介
实时荧光定量PCR仪ViiA7操作步骤
TaqMan实时荧光定量RT
荧光定量PCR实验指南(一)
taqman荧光定量pcr
实时荧光定量PCR具体实验步骤
猪肺炎支原体P97TaqMan_BHQ荧光定量PCR检测方法的建立及应用
实时荧光定量PCR操作步骤
TaqMan探针荧光定量PCR反应试剂盒
实时荧光定量pcr步骤
荧光定量PCR的概述
实时荧光定量pcr步骤
相对荧光定量PCR三种常用方法、注意事项
TaqMan法进行实时定量PCR鉴定