
第十六章 含氮不饱和键的化学 具有含氮不饱和键的化合物,主要有亚胺、腈(异腈)、偶氮化合物、硝基化合物以及异腈酸酯等。以下分别进行介绍。 16.1亚胺 亚胺及其衍生物又称希夫碱(Schiff base ),是含有C=N 键的化合物。它是由羰基化合物(醛或酮)与氨(伯胺)的缩合产物,分子中含有的C=N 键是一种类似于C=O 键的极性不饱和键,能与许多化合物发生加成、还原等反应,在有机合成特别是不对称合成中有着广泛的应用。这类化合物具有良好的配位化学性能和独特的光、电、磁等物理材料性能,许多亚胺本身还具有广泛的生物活性(如抗菌、抗癌、除草等)。亚胺是烯胺的互变异构体: N H N H O + NH 2 16.1.1 还原反应 亚胺的还原反应是制备胺类化合物的重要方法,主要包括催化氢化和化学还原两个方面。 一、化学还原 化学还原是有机合成常用的方法,氢化铝锂、金属硼氢化物等是常用的还原剂。用NaBH 4 可以很方便地将亚胺还原成仲胺: R 1C R 2 N R NaBH 4 R 1CH R 2 N R H 利用这个反应,可以通过醛、酮来合成仲胺。如: 4CHO H 2NCH 2CH 2NH 2 3 2 CH NCH 2CH 2N HC CH 2 2CH 2CH 2 H H 在手性试剂或手性催化剂的诱导下,亚胺可以进行不对称还原。用含氢聚硅氧烷(polymethylhydrosiloxane ,PMHS)作还原剂,可选择性地将亚胺还原成手性胺,联二萘酚(R )-3是很好的手性配体。
Ph N Ph CH 3 (R )-3, Sn(OTf)2, 2 mol%Ph NH Ph CH 3 r.t, 6 h Yield 85% ee 60% (R )-3 = Br 近年来,有关亚胺的不对称还原已经成为研究的热点。 二、催化氢化 亚胺通过催化氢化反应还原为高级胺,这是有机合成特别是在不对称合成中常用的方法。脂肪族醛的亚胺可在过渡金属催化下加氢,被还原为仲胺,但产率不高。常用的金属催化剂大多数为第八副族的过渡金属,如Ni 、Pt 、Pd 、Ru 、Rh 等。 N R 2 R 1 H 250C, EtOH CH 2HN R 2 R 1R 1 = Et, Pr, Bu; R 2 = Pr, Bu. yield 40~65% 如果是脂肪酮的亚胺,则产率将有很大的提高: N H Pt, H 2, 80o C C 6H 6, 86% N 当用(S )-BINAP -Ir(III)催化氢化芳酮亚胺时,化学产率较高,而光学产率ee 稍低。如: CH 3 N OMe CH 3H , 30o C, 8.5 h S -BINP, THF/CH 2CL 2 N CH 3 yield 100%, ee 67% (S ) 若用双磷配体(R )-bdpp -Ir(III)催化氢化,化学产率为100%,84% ee (R )。 转移氢化反应是还原亚胺的另一有效方法。如用含聚合物的甲酸盐作氢源,醋酸钯催化还原亚胺,该方法方便、有效、对环境友好,收率85%。
第12章 含氮化合物 12-1 命名下列化合物或写出结构式。 (1)2-甲基-3-硝基己烷 (2)N-甲基间甲苯胺 (3)3-甲氨基戊烷 (4)N-乙基苯磺酰胺 (5)氯化三甲基对氯苯铵 (6)氢氧化二甲基二乙基铵 (7)氯化重氮苯 N C O COOC 2H 5 2 CH 3CHCH 2CHCH 2CH 3 NH 2NHCH 3N N H 2NCH 2(CH 2)3CHCH 2NH 2 3 (8) (9) (10)(11) (12) 知识点:含氮化合物的命名。 12-2 比较下列各对化合物的酸性强弱。 CH 2NH 3 (1)(3)(2)NH 3 CH 3NH 3 NH 3 NH 3 3 NH 3 2 A. B. A. B. A. B. (1)B >A ; (2)A >B ; (3)B >A 。 知识点:胺的活性。 12-3 将下列各组化合物按碱性由强至弱的次序排列。 (CH 3)4NOH CH 3CONH 2(1)(2)NH 2 2 A. B. C.D. E. CH 3NH 2 NH 2 SO 2NH 2 (CH 3)3N NH 2 3 NH 2 2 NO 2 (CH 3)2NH A. D. B. E.C. (1)A >C >D >B >E ; (2)E >A >B >C >D 。 知识点:胺的碱性。 12-4 完成下列反应。
(1) HCOOEt NO 2 EtONa CH 3 +NO 2 CH 2CHO (2) NaOCH 3 CH 3OH NO 2 +Cl NO 2 OCH 3 Cl (3) CH 2CH 2NH 2 CH 3COCl (1)LiAlH 4 (2)CH 3OH CH 2CH 2NHCCH 3O CH 2CH 2NHCH 2CH 3 (4) NaNO 2/H 2SO 4 NH 2NO 2 NO 2 室温 N 2HSO 4 2 NO 2 2 2 (5)NaNO 2Ph C CH 2NH 2 OH 3 H 3C C CH 2Ph O (6) N 2 CH 2I +Ag 2O 2CN N CN CH 3 H 3C I N CN CH 3 H 3C OH (7) KOH H 2O,OH, △ NH O O NK O O H 2C PhCH 2NH 2 H N N H (8) H CH 3 H 3C 2N H 3C CH 3 NH 2
基础有机化学知识整理 (1) 烷烃 卤代——自由基取代反应 链引发: ??? →?? X X hv 2/2 链转移: ?+?→? +?R HX RH X ?+?→?+?X RX X R 2 链终止: RX R X ?→? ?+? 2X X X ?→??+? R R R R -?→??+? 反应控制:H H H ?>?>?123 (2) 热裂解——自由基反应 ?'+??→?'-? R R R R 2222CH CH R CH CH R =+??→??---断裂:β 2. 硝化、磺化(自由基)——与卤代类似。 3. 小环开环 (1) 2H 引发的开环:自由基机理,区域选择性小。 CH 3 H 2 C 3CH 3 + CH 3 C H 3H 3 (2) 2X 、HI 引发的开环:离子机理,倾向于生成稳定的碳正离子。 I - C H 3CH 3 I C H 3H 3I 优势产物 (仲碳正离子比伯碳正离子稳定) 在断键时,一般断极性最大的键(如取代最多的C 原子和取代最少的C 原子之间的键)。 二、 亲核取代 1. 共轭效应和诱导效应:要区别对待。H Cl 原子的吸电子诱导效应使双键整体电子云密 度降低,表现在反应性降低;给电子共轭效应使双键π电子云向C -β迁移,C -β相对 C -α带部分负电荷。判断基团共轭效应的性质: (1) 吸电子基团中直接相连的原子电负性较小且与电负性较大的原子相连,电子云密度 低;直接相连的原子多没有孤对电子。如:2NO -,CN -,COOH -,CHO -, COR -等。 (2) 给电子基团中直接相连的原子电负性较大且与电负性较小的原子相连,电子云密度 大;直接相连的原子均有孤对电子。如:2NH -,NHCOR -,OH -,OR -, OCOR -等。 (3) 苯环的共轭效应:相当于一个电子“仓库”,与电子云密度小的原子相连时给电子,与电子 云密度大的原子相连时吸电子(如苯酚显酸性)。在共轭体系中,判断双键的极性时仅考虑共轭效应。
§9 醇、酚、醚
简单含氧化合物
§9.1 醇、酚、醚的分类及命名
1、醇的分类:
A.按分子内所含羟基的个数分类 a.一元醇 b.二元醇 c.多元醇
CH3OH 甲醇 H2C
OH
CH2
OH
CH2CHCH2
OH OH OH
CH3CH2OH 乙醇
乙二醇 OH-
丙三醇(甘油)
CH2OH
CH3CHO + HCHO (过量)
HOH2C
C
CH2OH
CH2OH
季戊四醇
B.按羟基所连的碳分类
主要用于一元醇的细分 a. 1°(伯)醇 b. 2°(仲)醇 c. 3°(叔)醇 羟基所连的碳为伯碳 羟基所连的碳为仲碳 羟基所连的碳为叔碳
如:
CH3CH2CH2OH CH3CHCH3 OH CH3 CH3C OH CH3
1
o
2o
3o
2、酚的分类:
A. 单酚--分子中只含一个酚羟基
OH OH OH CHO OH COOH
B.多酚--分子中含两个或两个以上酚羟基
OH OH
CH3
HO
OH
OH HO
OH
3、醚的分类:
?
?
A.(简)单醚-O两侧连两个相同的烃基 CH3CH2OCH2CH3 CH3CH2CH2OCH2CH2CH3 B. 混(合)醚-O两侧连两个不同的烃基
CH3 OCH2CH3 CH3 CH3OC CH3
CH3OCH2CH3
第十三章 含氮有机化合物 含氮有机化合物是指含有碳氮键的有机化合物,它们在生物体中起着重要的作用。 第一节 胺 一、胺的分类和命名 胺是氨的烃基衍生物,它可看作是氨分子中的1个氢或几个氢原子被烃基取代后的产物。 (一)胺的分类 1.根据胺分子中氮原子上所连烃基的数目不同,可分为伯胺、仲胺和叔胺。 R —NH 2 R —NH —R ′ R R ′ R ″ 伯胺 肿胺 叔胺 2.根据胺分子中氮原子上所连的烃基种类不同,可分为脂肪胺和芳香胺。 R —NH 2 Ar —NH 2 脂肪胺 芳香胺 氮原子与脂肪烃基直接相连为脂肪胺,与芳环直接相连为芳香胺。 3.根据胺分子中氨基的数目不同,可分为一元胺、二元胺和多元胺。 一元胺:CH 3—CH 2—NH 2 二元胺:H 2N —CH 2—CH 2—NH 2 例如: 脂肪胺 芳香胺 CH 3NH 2 苯胺 甲胺 伯胺: NH 2 NH CH 2 仲胺:二苯胺 甲乙胺 CH 3 CH 3 NH 叔胺:三苯胺 甲乙丙胺 CH 2CH 2CH 2 N CH 3CH 3 CH 3
请注意:伯胺、仲胺、叔胺与伯醇、仲醇、叔醇的区别,胺是根据氮原子上所连烃基数目来分为伯胺、仲胺、叔胺,而醇则是根据羟基所连的烃基来分为伯醇、仲醇、叔醇。例如: C NH 2 CH 3 CH 3 C OH CH 3CH 3 伯胺叔醇 CH 3 CH 3 (二)胺的命名 1.简单的胺以胺为母体,按烃基的名称称为某胺。例如: CH 2 丙胺 CH 2 NH 2 CH 3NH 2 苯胺 甲胺NH 2 CH 3 2.仲胺和叔胺的氮原子上连的烃基相同时,用二或三标明烃基的数目,写在烃基名称前;烃基不同时,从简单到复杂依次写出烃基的名称。例如: (CH 3)2NH (CH 3CH 2)3N (C 6H 5)3N 二甲胺 三乙胺 三苯胺 NH CH 2 甲乙胺CH 3 CH 3 甲乙丙胺 CH 2 CH 2 CH 2 CH 3CH 3 CH 3 3.芳香仲胺和叔胺的氮原子上连有烃基时,以芳香胺为母体,在烃基前标上“N-”,以区别连接在芳环上的烃基。例如: N-甲基苯胺 N ,N-二甲基苯胺 N-甲基-N-乙基苯胺NHCH 3 N (CH 3)2 N CH 3 CH 2CH 3 4.多元胺可参照多元醇命名,二元胺称为某二胺。例如: H 2N —CH 2—CH 2—NH 2 H 2N —CH 2—CH 2—CH 2—CH 2—NH 2 乙二胺 1,4-丁二胺 5.对于结构复杂的胺,则以烃为母体,氨基用为取代基命名。例如:
第4章烷烃自由基取代反应 习题4-1查阅下列化合物的沸点,将它们按大小排列成序,并对此作出解释。 解: 对于正烷烃及其卤代物,相对分子质量越高,其沸点也越高。 对于分子式相同的烷烃,正烷烃的沸点最高,叉链烷烃的分子沸点较低;碳原子相同的链烷烃沸点低于环烷烃的沸点。 习题4-2化合物A转为化合物B时的焓变为一7kJ·mol-1(25℃),可忽略不计,请计算平衡常数,并指出A与B的百分含量。 解:根据热力学,平衡常数与势能变化的关系为 可忽略不计,得
所以, 设A的百分含量为a,B的百分含量为b,则 解得, 习题4-3下列反应在某温度的反应速率常数k=4.8×10-6mol-1·L·s-1,请根据已给的浓度计算反应速率。 解:
习题4-4将下列自由基按稳定性顺序由大到小排列。 解: 因为既是烯丙型自由基,又是苯甲型自由基,离域范围很大,比单纯的烯丙型自由基和单纯的额苯甲型自由基更稳定;解离能越低的碳自由基越稳定,因此有。 习题4-5溶剂的极性、酸或碱性催化剂对自由基反应有无影响?为什么? 解:没有影响。因为自由基的反应是由于键的均裂产生自由基而引起的,而溶剂的极性、酸性催化剂、碱性催化剂利于键的异裂,而对键的均裂没有影响,所以对自由基反应也不会产生影响。 习题4-6写出新戊烷在光作用下溴化产生溴代新戊烷的反应机理。 解:链引发: 链转移:
链终止: 习题4-7写出C5H11Br的所有可能异构体的结构式(如有构型问题,须用伞形式表示),写出每个异构体的中英文系统名称。指出与溴原子相连的碳原子的级数。 解:
习题4-8定性画出溴与甲基环己烷反应生成1-甲基-1-溴代环己烷链转移反应阶段的反应势能变化图。标明反应物、中间体、生成物、过渡态的结构及其相应位置,并指出反应的速控步是那一步。(溴的键解离能:192.5kJ﹒mol-1,三级碳氢键的键解离能:389.1kJ ﹒mol-1) 解:查表得知键的键解离能为192.5kJ·mol-1,所以 H—Br键的键解离能为366.1kJ·mol-1,三级碳氢键的键解离能为389.1kJ·mol-1所
基础有机化学邢其毅复习经验分享 525616659(2011-06-20 14:16) 下面的是比较广泛的一个经验当时写个别人的参考一下吧 暑假的时候,很多人都会留在学校为考研积极备战。其实这个时候更大的是心理战,很多人回家呆久了之后,一想到正在学校努力学习的竞争对手就会有自己输在起点的感觉。暑期在校虽然不能保证复习多少内容,但起码能给自己一个心理安慰,一个警示:我要考研了。有一部分人还没最终确定自己要考哪里,但是已经有几个备选的学校或研究所,其实这都不是特别重要,毕竟可以先看看英语、政治等公共课,但有一点越早确定目标对后面的复习计划越有利,并且目标确定了不要轻易更改(我们班一回族同学当时要考上海XX,复习了挺长时间了才发现那的餐厅没有清真窗口,又临时改考上海**了)。这个时候可以适当腾出些坐在自习室的时间,上网查一查到底哪个更适合自己,不仅从学科兴趣、师资、地理、以后的出路等等,不过好像更多的时候更多的人对某个要报考的地方是一见钟情…… 每一年考研过后都会有很多考的好的师兄师姐出来讲成功的经验,我觉得成功的 经验不能听太多,尤其是讲自己如何在几天内突破某一科,非常轻松之类的话,那都是扯淡,即使真有也是运气成分……当一个人成功了,再讲他的成功之路时,经常会居高临下的面对一群崇拜者描述的很easy,因为他现在的心情就是很easy的,很难找到当时处于 困境的感觉。都说考研难,首先表现心理上。虽然暑期时候大家见面都在抱怨考试内容多,但这都不是真正的抱怨。见面抱怨考试难是学生的通病,就好像街坊邻居见了面总爱问:“吃了没?”。考研最考验一个人心理承受能力是在最后的那几天,现在没还必要细想这个。(通常越临近考试越烦躁,越紧张,去年我们那个时候很多人就不在自习室学习了,嫌气 氛压抑,受不了……话说回来了,紧张还是因为心里没底,要是每一科都认真复习了,习题认真做了,真题认真研究了,就会很淡定地盼着考试来证明自己,抑或是结束现在的痛苦生活呵呵。) 考研复习时有可能会跟当学期的课冲突,很多人选择逃课,我觉得上不上 课问题不大,关键是要下定决心:我这节课铁定不上了,就安心复习;或者是我这节课去好好听听老师都讲些什么。忌讳想逃课又怕点名或者上课时候只低头看自己的考研书,因为这样基本都是在浪费时间,正所谓一心不可二用。考研重在坚持,三天打鱼两天晒网肯定不行。既然总觉的内容多,有时候还老爱忘,那就要连续复习,勤翻,勤看,勤写。复习过程的放松也很必要,我说的不是一上午放松几回,而是一周,一个月的问题,我那时候基本上是两个星期打一次球,一个多小时就够了,因为老觉得时间不够呵呵。关于复习的方法问题,每个人的习惯不一样,所以没有固定的模式。只要自己觉得有效,觉得舒服、不枯燥、不烦躁就行。我当时喜欢拿整个的时间来复习某一科,比如一上午只看有机,一晚上只看物化。其实我巴不得一整天都看有机,不过那样确实不太合理呵呵。而有的人喜欢一天里把所有的科目都照顾一遍。根据我个人的经验,有机需要连续看的时间长一点才
基础有机化学邢其毅第4版上册配套练习题库 邢其毅《基础有机化学》(第4版)(上册)配套题库【考研真题精选+章节题库】 目录 第一部分考研真题精选 一、选择题 二、填空题 三、简答题 第二部分章节题库 第1章绪论 第2章有机化合物的分类表示方法命名 第3章立体化学 第4章烷烃自由基取代反应 第5章紫外光谱红外光谱核磁共振和质谱 第6章卤代烃饱和碳原子上的亲核取代反应β-消除反应 第7章醇和醚 第8章烯烃炔烃加成反应(一) 第9章共轭烯烃周环反应 第10章醛和酮加成反应(二)
第11章羧酸 第12章羧酸衍生物酰基碳上的亲核取代反应 第13章缩合反应 ? 试看部分内容 考研真题精选 一、选择题 1下列不属于Lewi s酸的有()。[中山大学2009年研] A.CuCl2 B.Ag+ C.H+ D. 【答案】D查看答案 【解析】Lewis酸是电子的接受体,只有D项不能再接受电子。 2下列物质酸性最小的是()。[中山大学2009年研] A.
B. C.CH3OH D.C H3C N 【答案】C查看答案 【解析】一般地,酚类的酸性强于醇类的酸性,而醇类的酸性又强于烷基的酸性,所以D项的酸性最小。 3下列化合物酸性由大到小的次序是()。[首都师范大学20 10年研] a.苯酚 b.戊醇 c.对硝基苯酚 d.间硝基苯酚 A.c>d>a>b B.a>c>d>b C.b>a>d>c D.c>a>d>b 【答案】A查看答案 【解析】本题考查有机化合物的酸性的大小比较,四个选项中有两类物质,即醇和酚,由于苯环的共轭结构,使得酚类的酸性大于醇类,则排除C项,苯酚中苯环上含有吸电子取代基时其酸性增强,则排除B、D项。
分子量较小的胺,如甲胺、二甲胺、乙胺等在常温下是气体,其余胺为液体或固体。低级胺可溶于水,这是因为氨基可以与水形成氢键。但随胺中烃基碳原子数的增多,水溶性减小,甚至不溶。 伯胺、仲胺都可以形成分子间氢键,故沸点较分子量相近的烷烃高,但比相应的醇低。而叔胺的沸点则与烃相近。 常见的胺的物理常数见表13-1 表13-1 胺的物理常数 名称结构简式沸点/℃熔点/℃ 氨NH3-33.35 -77.7 甲胺CH3NH2-6.3 -93.5 二甲胺(CH3)2NH 7.4 -93 三甲胺(CH3)3N 2.9 -117.2 乙胺C2H5NH216.6 -81 二乙胺(C2H5)2NH 56.3 -48 三乙胺(C2H5)3N 89.3 -114.7 苯胺C6H5NH2184 -6.3 N-甲基苯胺C6H5NHCH3196.3 -57 N,N-二甲基苯胺C6H5N (CH3)2194 2.45 邻甲基苯胺o-CH3C6H4NH2200.2 -14.7 间甲基苯胺m-CH3C6H4NH2203.3 -30.4 对甲基苯胺p-CH3C6H4NH2200.5 44 邻硝基苯胺o-NO2C6H4NH2284 71.5 间硝基苯胺m-NO2C6H4NH2305 114 对硝基苯胺p-NO2C6H4NH2331.7 148 红外吸收光谱:在3500~3300cm-1的N-H伸缩振动区,伯胺有双峰,仲胺有单峰,叔胺因无N-H键,故在此频区无吸收。伯胺在1650~1590cm-1有强的N-H面内弯曲振动吸收峰,而仲胺在1650~1550cm-1的峰很弱,只可用于参考。正丁胺和苯胺的红外光谱见图13-4和图13-5。
有机化学基础知识 专题三、生命的基础有机化学物质 一、知识框架 二、糖类 1、糖类的分类 根据所含碳原子数目分类 单糖 醛糖或酮糖 糖低聚糖——不到二十个单糖缩合而成的糖类,常见的为二糖 多糖——含有几百个甚至更多葡萄糖单元的天然高分子物质2、各类糖中常见糖的结构及性质 (1)、单糖
① 葡萄糖 分子式:C 6H 12O 6 结构简式:CH 2OH CH OH 4 CHO 所属类型:己糖、醛糖 物理性质:白色固体,有甜味,易溶于水 化学性质: A 能发生银镜反应 B 能与菲林试剂反应 ②果糖 分子式:C 6H 12O 6 与葡萄糖互为同分异构体 结构简式: CH 2OH CH OH 3 C O CH 2OH 所属类型:己糖、酮糖 果糖也能发生银镜反应 (2)低聚糖——不到二十个单糖缩合而成的糖类,常见的为二糖 常见的二糖:蔗糖、麦芽糖、乳糖、纤维二糖 分子式:都是C 12H 22O 11,它们互为同分异构体 化学性质:二糖在稀硫酸催化下都能发生水解反应 (3)多糖 多糖在自然界中分布广泛,是生物体的重要组成部分。常见的多糖有:淀粉和纤维素 ① 淀粉 物理性质:淀粉是一种白色常温下难溶于水的粉末,没有甜味。 分子式:(C 6H 10O 5)n 化学性质:本身不能发生银镜反应,能在无机酸或酶的催化下,发生水解反应 (C 6H 10O 5)n + nH 2O n C 6H 12O 6 淀粉 葡萄糖 ② 纤维素 自然界中的存在:构成植物细胞壁的基础物质 分子式:(C 6H 10O 5)n 化学性质及用途: 稀H 2SO 4 △
A 本身不能发生银镜反应,能在无机酸或酶的催化下,发生水解反应 (C 6H 10O 5)n + nH 2O n C 6H 12O 6 纤维素 葡萄糖 B 制备硝化纤维 硝化纤维的制备:硝化纤维是纤维素与浓硝酸在一定条件下发生酯化反应的产物 + 3nHNO 3 + 3nH 2O 硝化纤维俗称火棉,是一种烈性炸药。 C 制备醋酸纤维 纤维素还能与乙酸酐作用生成纤维素乙酸酯(俗称醋酸纤维),醋酸纤维常用于生产电影胶片片基。 + 3n + 3nCH 3COOH D 粘胶纤维的制备 纤维素 粘胶液 粘胶纤维 长纤维称为人造丝,短纤维称为人造棉。 E 铜氨纤维的制备 纤维素溶于铜氨溶液,再压如稀硫酸中便可形成铜氨纤维。 三、油脂 1、油脂的组成及结构特点 (1)油脂的存在及在生物体内的作用 油脂也是人体所需的六大营养素之一,是生物体内储存能量的物质,油脂主要贮存在动物的脂肪细胞和某些植物的种子、果实细胞中。人类摄入的营养物中,油脂的热能最高。 (2) 油脂的结构 (1)主要成份——高级脂肪酸甘油酯 (2)结构简式: (R1、R2、R3为烃基) 稀H 2SO 4 △ (C 6H 7O 2)OH OH OH n 浓H 2SO 4 △ (C 6H 7O 2)ONO 2ONO 2ONO 2 n 浓NaOH 溶液、CS 2 稀H 2SO 4 (C 6H 7O 2)OH OH OH n CH 3C O CH 3C O O 催化剂 OOCH 3(C 6H 7O 2)OOCH 3n OOCH 3 R1R2R3O O CH 2 C O O CH O O CH 2
光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压 催化剂 催化剂 △ 催化剂 △ 催化剂 催化剂 催化剂 催化剂 △ 催化剂 催化剂 浓硫酸 △ △ 高中基础有机化学方程式总汇 1. CH 4 + Cl 2 CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl 2 + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 2 6. C 16H 34 C 8H 18 + C 8H 16 7. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2 + H 2O CH 3CH 2OH 10. CH 2 = CH 2 + HBr CH 3—CH 2Br 11. CH 2 = CH 2 + H 2 CH 3—CH 3 12. nCH 2 = CH 2 [ CH 2—CH 2 ] n 13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n 14. 2CH 2 = CH 2 + O 2 2CH 3CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO 20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 21. + Br 2 Br + HBr 22. + HO -NO 2 NO 2 +H 2O 23. + HO -SO 3H SO 3H+H 2O
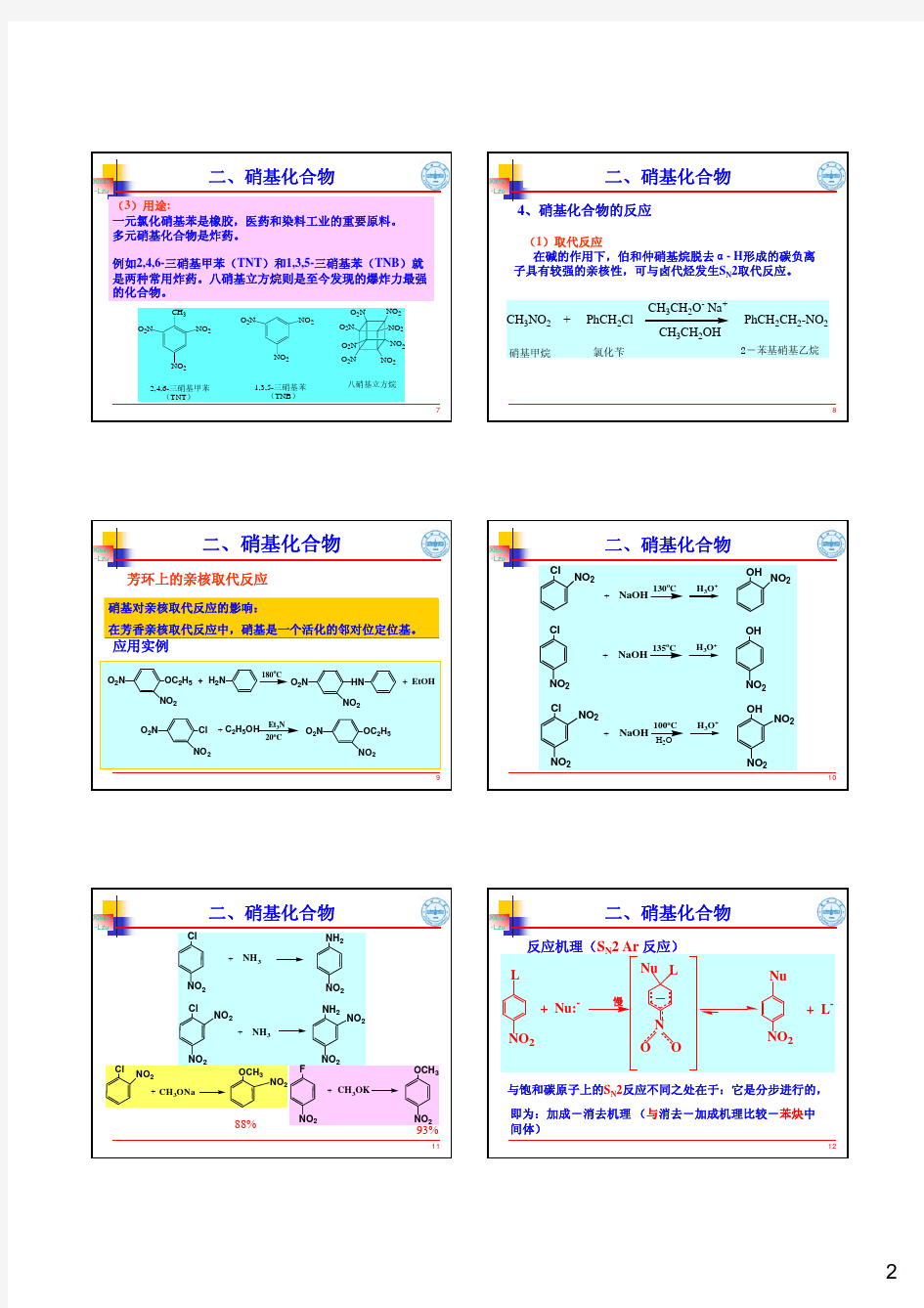
第十三章含氮化合物(6学时) 目标要求 1.掌握硝基化合物的性质 2.了解硝基化合物的制备 3.掌握季铵盐的性质及霍夫曼规则 4.了解胺的制法 5.掌握重氮化合物和偶氮化合物的结构 6.掌握重氮盐的取代反应和偶联反应及其在有机合成上的应用 7.掌握各类分子重排机理 教学重点: 硝基化合物、胺类化合物、重氮化合物,分子偶联反应、分子重排机理 教学难点: 硝基化合物、胺类化合物、重氮化合物,分子重排机理 主要内容 1.硝基化合物的性质及制备 2.胺的分类、结构和重要的化学性质 3.季铵盐的性质及霍夫曼规则 4.胺的制法 5.重氮化合物和偶氮化合物的结构 6.重氮盐的取代反应和偶联反应及其在有机合成上的应用 7.各类分子重排机理 胺可以看作是氨中的氢被烃基取代的衍生物。胺类和它们的衍生物是十分重要的化合物,其与生命活动有密切的关系。 第一节胺的分类和命名 一、胺的分类 1、根据胺分子中氮上连接的烃基不同,分为脂肪胺与芳香胺。 2、根据胺分子中与氮相连的烃基的数目,可分为一级、二级或三级胺。 3、根据胺分子中所含氨基的数目,可以有一元、二元或多元胺。 胺盐或氢氧化胺中的四个氢被烃基取代而生成的化合物称为季铵盐或碱。 NH2 CH3NH2 甲胺苯胺CH2CH2 NH2 NH2 乙二胺 [R4N]+ X-[R4N]+OH- 季胺盐季胺碱 二、胺的命名 1、简单的胺的命名可以用它们所含的烃基命名。 2、比较复杂的胺的是以烃基作为母体,氨基作为取代基来命名。 3、胺盐可看作是铵的衍生物。
(CH 3)2CHCH CH 3 2 CH 3CH 2CH CHCH 3 2H 5)2 CH 32-氨-3-甲基丁烷 2-(N,N-二乙氨基)-3-甲基戊烷 第二节 胺的物理性质 氨和胺分子具有四面体棱锥形结构。状态:甲胺、二甲胺、三甲胺是气体。低级胺是液体。 高级胺是固体。有氨的刺激性气味及腥臭味。芳胺的毒性很大。伯、仲胺能形成分子间氢键,也能与水形成氢键。 一、 溶解性 低级易溶于水,随烃基的增大,水溶解度降低。 二、 熔沸点 沸点:比相应的醇、酸低,并且伯胺 > 仲胺 > 叔胺;芳胺是高沸点液体或低熔点固体。 三、 光谱性质 (1)、红外光谱: N-H 键:在3500~3600cm-1有伸缩吸收峰。叔胺没有N-H 键,所以在该区域没有吸收峰。 C-N 键:1350~1000 cm-1有伸缩吸收峰。 (2)、核磁共振谱 : 胺的核磁共振特征类似于醇和醚。 氨基质子: δ 0.6~5.0,可变,不易鉴定。 α-碳上质子:δ 2.7~3.1 β-碳上质子:δ 1.1~1.7 第三节 胺的反应 一、 碱性 ?路易斯酸碱的定义:碱是电子对的给予体,酸是电子对的接受体。 N 原子有未共用的电子对,能接受质子,胺是路易斯碱,是亲核试剂。胺是弱碱,所以胺盐遇强碱则释放出游离胺,可分离提纯胺。 RNH 2+RNH 3Cl - H 2O NaCl +NaOH RNH 2++ 1、 胺的碱性: (1)Kb 值越大,或pKb 越小,碱性越强。 (2)从电子效应考虑,烷基愈多碱性愈强。 (3)从溶剂化考虑,烷基愈多碱性愈弱。 (4)还有立体效应的影响。 2、碱性秩序: (1) 脂肪胺 气态: Me 3N > Me 2NH > MeNH 2 > NH 3 水溶液中:Me 2NH > MeNH 2 > Me 3N > NH 3 (2)芳胺 < NH 3 < 脂肪胺 (3)芳胺:
十醛、酮知识点 [知识要点] 一、醛酮的结构和命名 二、醛酮结构、光谱性质(羰基的特征吸收峰) 三、化学性质(重点) 1.亲核加成反应 1.与HCN的加成,产物为丙烯腈,在水解产物为羧酸。 2.与NaHSO3加成 3.与H2O的加成,生成偕二醇,但不稳定。只有当羰基碳上连有吸电子基时,产物才稳定。 4.与ROH加成,发生醛缩反应,产物为缩醛或缩酮。反应可逆,可以用来保护羰基。 5.与金属有机物加成,主要与格氏试剂,有机锂试剂反应,水解最终产物为醇。 6.与氨及其衍生物的加成反应。 7.Wittig 试剂加成:即与磷叶立徳的加成反应,此反应也叫维西蒂反应。 2.还原反应 1.金属氢化物的还原(LiAlH4 NaBH4); 2.催化加氢(氢化):分子中的双键、三键、羰基、氰基、硝基也一并被还原。 3.麦尔外因—庞多夫—维尔莱还原:醛酮在异丙醇和异丙醇铝的作用下,被还原为醇的反应。 4.克莱门森还原:醛酮在Zn/Hg +HCl的条件下被直接还原为烃的反应。 5.凯希尔—伍尔夫—黄鸣龙还原:醛酮与NH2-NH2在强OH-的条件下还原为烃的反应。该方法与上述克莱门森还原法互补使用,一个适用于耐酸醛酮,一个适用于耐碱醛酮。 3. 氧化反应 1.O2氧化。 2.高锰酸钾、重铬酸钾法氧化:高锰酸钾的氧化性通常强于重铬酸钾,高锰酸钾的还原产物复杂,如果是二氧化锰将很难从反应体系中分离出来。 3.醛的托伦试剂(新制的银氨溶液)和斐林试剂(新制的斐林试剂)氧化反应,氧化产物为羧酸,或羧酸盐。 4.酮与过氧酸发生贝耶尔—维林格反应:产物为酯。
4.歧化反应 康尼查罗反应:无α-H的醛与强OH-共热时,会歧化,其中一分子被还原为醇,另一分子被氧化为羧酸。 5.α-H 的酸性 1.互变异构:酮式与烯醇式的互变异构 2.α-H 的卤代反应:醛酮分子中有多少个α-H,就可以被多少个卤原子取代。如果分子中有3个α-H是被I取代,生成物叫“碘仿”,发生碘仿反应,而碘仿是黄色晶体,水溶性极小。所以可以用来鉴别甲基酮、甲基仲醇。 3.羟醛缩合反应: 4. Perkin 反应 5.安息香缩合 四、亲核加成反应历程及影响因素(电子效应、空间位阻) 1.简单的亲核加成反应历程 2.复杂的亲核加成反应历程 3.羰基加成反应的立体化学 4.羟醛缩合反应历程 五、醛酮的制法 1.醇的氧化 2.烃的氧化 3.羧酸及其衍生物的还原(酰氯、酰胺、腈、酯的还原) 4.偕二卤代物的水解 5.Friedel-Crafts 酰基化 5.Gattermann-Koch 反应:加特曼—科克反应,苯、甲醛、氯化氢在三氯化铝的催化下合成苯甲醛。 6.Vilsmeyer 反应:维路斯梅尔反应,指用N,N—二取代甲酰胺和POCl3使芳环甲酰化的反应。 六、重要的醛酮:甲醛、乙醛、丙酮、苯甲醛、环己酮。 七、不饱和羰基化合物:( 1 ,4- 加成、Michael 反应)
第十三章 有机含氮化合物习题答案 1. 命名下列化合物或写出构造式 (1)(2) (3) NHCH 3 CH 3 (CH 3)2CHNH 2 NHCH 2CH 3 (4)对硝基苄胺 (5)2,4,7-三硝基萘酚 (8) β-苯基丙胺 解: (1) 异丙基胺 (2) N-乙基苯胺 (3)N-甲基间甲苯胺 CH 2NH 2O 2N OH NO 2 NO 2 O 2N CHCH 2NH 2CH 3 (6) (5) (4) 2. 用化学方法鉴别下列各组化合物:乙醇、乙醛、乙酸、乙胺 乙醇乙醛乙酸 乙胺 NaHCO 3 气泡 乙酸 无气泡 银氨溶液 银镜 乙醛 无银镜乙醇 乙胺 乙醇 乙醛乙胺 NaNO 2乙胺 无气体 HCl 气体 乙醇 3. 按碱性强弱次序排列下列各组化合物 (1) A. 苯胺 B. 对甲基苯胺 C. 对甲氧基苯胺 D. 对硝基苯胺 (2) A. 苄胺 B. 间氯苄胺 C. 间甲苄胺 D. N 甲基苄胺 (1) C>B>A>D (2) D>C>A>B 4. 完成反应式。 (1) CH 3 (CH 3CO)2O CH 3 NO 2混酸 ,60℃ Fe +HCl CH 3NH 2 CH 3 NHCOCH 3 HNO 3 + H 2SO 4 CH 3 NHCOCH 3 NO 2 OH -/H 2O CH 3 NH 2 NO 2 CH 3 N 2+Cl -NO 2 CH 3 NO 2 NaNO 2/HCl 0-5℃ H 3PO 2 (2)CH 3CH 2CN (1)OH -/H 2O (2)H + CH 3CH 2COOH SOCl 2 CH 3CH 2COCl CH 3CH 2CO-NH(CH 2CH 2CH 3)2LiAlH 4(CH 3CH 2CH 2)2NH CH 3CH 2CH 2NH(CH 2CH 2CH 3)2 O 2N Cl Cl CH 3ONa/CH 3OH (3)O 2N Cl OCH 3 5. 完成下列转变
第14章羧酸衍生物酰基碳上的亲核取代反应 14.1复习笔记 一、羧酸衍生物的结构 羧基中的羟基被-X,,—OR,—NH2(或—NHR、—NR2)置换后产生羧酸衍生物,包括酰卤(acylhalide)、酸酐(acid anhydride)、酯(ester)、酰胺(amide)。 1.酰胺中的C—N键较胺中的C—N键短,主要因为: (1)酰胺与胺中C—N键的碳分别采用是sp2与sp3杂化轨道与氮成键,前者杂化轨道中的s成分比后者多; (2)羰基与氨基的氮共轭,从而使C—N键具有某些双键的性质。 2.由于共轭作用,酯基中的C—O键也比醇中的C—O键短。 3.酰氯中C—Cl键比氯代烷中的C—Cl键长,这是因为氯在酰氯中的吸电子诱导效应远远强于与羰基的共轭效应。 4.这种具有相反电荷的偶极结构在羧酸衍生物中的重要性:酰胺>酯>酰氯。 二、羧酸衍生物的物理性质 1.低级酰氯与酸酐是有刺鼻气味的液体,高级的为固体;酰氯与酸酐不溶于水,低级
的遇水分解。 2.低级酯具有芳香的气味,存在于水果中,可用作香料;十四碳酸以下的甲酯、乙酯均为液体,酯在水中溶解度很小。 3.酰胺除甲酰胺外,均是固体,脂肪族的N-取代酰胺常为液体,低级的酰胺可溶于水。 酸酐与酰胺的沸点比相应的羧酸高,酰氯和酯的沸点比相应的羧酸低。 这些羧酸衍生物都可溶于有机溶剂,而乙酸乙酯是很好的有机溶剂,大量用于油漆。 三、羧酸衍生物的反应 1.酰基碳上的亲核取代反应 (1)酰基碳上的一个基团被亲核试剂所取代: ①碱催化的反应机理: 四面体中间体 反应分为两步: a.羰基碳上亲核加成,形成一个带负电荷的四面体中间体(tetrahedral intermediate)。 b.消除一个负离子。消除反应决定于离去基团的性质,越易离去的基团,反应越易发生。 在羧酸衍生物中,基团离去能力的次序是:
第17章胺 17.1 复习笔记 一、胺的分类 1.概念 氨上的氢被烃基取代后的物质称为胺(amine)。氨基(一NH2、--NHR、NR2,amino)是胺的官能团。 2.分类 (1)根据胺分子中烃基的种类不同,可以分为脂肪胺(aliphatic amine)和芳香胺(aromatic amine)。例如: CH3CH2NHCH3 对甲基苯胺(芳香胺)甲基乙基胺(脂肪胺)(2)根据在氮上烃基取代的数目,胺可分为一级(伯)胺(primary amine)、二级(仲)胺(secondaryamine)、三级(叔)胺(tertiary amine)和四级(季)铵盐(quaternary ammonium salt)。 这里所指的一级、二级和三级胺是指氮与几个烃基相连,而不是烃基本身的结构。 二、胺的结构 1.氨
(1)氮是用sp3杂化轨道和其它原子成键的。氨具有棱锥形的结构,氮用sp3杂化轨道与三个氢的S轨道重叠,形成三个sp3-s σ键,成棱锥体,氮上尚有一对孤电子,占据另一个sp3杂化轨道,处于棱锥体的顶端,类似第四个“基团”。 (2)氨的空间排布基本上近似碳的四面体结构,氮在四面体的中心。 2.胺 (1)与氨的结构相似,在胺中,氮上的三个sp3杂化轨道与氢的s轨道或别的基团的碳的杂化轨道重叠,亦具有棱锥形的结构。 如图l7-l所示: 氨的结构甲胺的结构三甲胺的结构 图l7-l 氨及胺的结构 (2)在苯胺中,氮仍是棱锥形的结构,H—N—H键角为ll3.9°,H—N—H平面与苯环平面交叉的角度为39.4°,如图l7-2所示: 图17-2 苯胺的结构 (3)胺对映体之间的互相转化,需要能量很低,故两个对映体在室温就可以很快地互相转化,见图17-3。 (4)在四级铵盐中,氮上的四个sp3杂化轨道都用于成键。氮构型的翻转不易发生,可确实分离得到这种旋光相反的对映体,例如图17-4所示的化合物可以拆分为(+)及(-)
第十七章 杂环化合物 (heterocyclic Ring compounds ) 一、教学目的和要求 1.掌握杂环化合物的分类和命名。 2.掌握五元单杂环、六元单杂环化合物的化学性质。 3.理解杂环化合物的结构与芳香性。 4.理解吡咯、吡啶的结构与性质的关系。 二、教学重点与重点 重点:杂环化合物、甾体化合物结构特征与命名(俗名)。 难点:杂环化合物的结构。 三、教学方法和教学学时 (1)教学方法:以课堂讲授为主,结合必要的课堂讨论。教学手段以板书和多媒体相结合。 (2)教学学时:4学时 四、教学内容 1、杂环化合物 (1)杂环化合物概述 (2)吡咯及其衍生物 (3)吡啶及其衍生物 (4)吲哚及其衍生物 (5)苯并吡喃及其衍生物 (6)嘧啶和嘌呤及其衍生物 2、生物碱 (1)生物碱概述 (2)生物碱举例 五、总结、布置作业 17.1 几种基本杂环 (分类和命名) 杂环化合物定义 :杂环化合物是指环比较稳定、含杂原子的环状化合物,包括芳香性杂环和非芳香杂环。 杂环化合物的种类很多,有单环,也有与芳香环或其他杂环并联成的稠杂环。环上的杂原子可以是一个、两个或更多个,而且可以是相同的或是不同的。一般最常见的杂环是五元或六元环。 根据1980年中国化学会颁布的有机化学命名原则,杂环化合物的命名按外文名称音译,并以一口字旁表示是环状化合物。以下是几种常见的杂环化合物的结构与名称。 O S N S N N N H H 呋喃 噻吩 吡咯 噻唑 咪唑 Furan Thiophene Pyrrole Thiazole Imidazole N O N N N N N N
吡啶 吡喃 哒嗪 嘧啶 吡嗪 Pyridine Pyran Pyridazine Pyrimidine Pyrazine H N O N N N N 吲哚 苯并呋喃 嘌呤 N N N 喹啉 异喹啉 吖啶 17.2 几种重要杂环化合物的结构 吡咯、吡啶 、呋喃、噻吩 ----C 、N 、O 、S 皆为 SP2 杂化 ,符合休克尔规则,有芳香性。但根据具体情况的不同,有的是富电子芳杂环,有的是缺电子芳杂环。 1. 1. 五元杂环 吡咯的共轭体系及比例模型如下: 吡咯是富电子芳杂环。 2. 2. 六元杂环 吡啶的共轭体系及比例模型如下: 吡啶是缺电子芳杂环。 富电子芳杂环与缺电子芳杂环因为结构特点的不同而表现出不同的化学 性质,其中亲电取代反应的差异尤为明显。
第十二章有机含氮化合物 【教学重点】 胺类化合物的化学性质、重氮和偶氮化合物。 【教学难点】 季铵碱的热分解。 【教学基本内容】 硝基化合物的结构;硝基化合物的化学性质(α-氢的活泼性、还原反应、硝基对苯环的影响)。 胺的结构;胺的制备方法(氨或胺的烃基化、腈和酰胺的还原、醛和酮的氨化还原、酰胺的降解、硝基化合物的还原、Gabriel合成法);胺的化学性质——碱性及影响碱性强度的因素、烃基化、酰基化、磺酰化、与亚硝酸反应、芳环上的取代反应。 季铵盐和季铵碱、季铵碱的热分解。 重氮盐的制备方法及重氮盐的结构;重氮盐的化学性质(放氮反应、保留氮的反应)及在合成上的应用。 Ⅰ目的要求 前面我们已经讨论了烃、卤代烃和烃的含氧衍生物,本章对含氮有机化合物加以讨论。 从广义上讲,分子中含有氮元素的有机化合物统称为含氮有机化合物。常见的含氮有机化合物有如下几种类型:硝酸酯(-ONO2)、亚硝酸酯(-ONO)、酰胺、肼、腙、肟(以上几类以在前面有关章节中加以介绍);硝基(-NO2)、亚硝基(-NO)、胺(-NH2、-NHR、- ⊕ NR2)、腈(-C≡N)、异腈(-N≡C)、异氰酸酯(-N=C=O)、重氮化合物(-N≡N-Y)偶氮化合物(-N=N-)。这些都是着重讨论的化合物。生命的基础物质—氨基酸和蛋白质,甚至连含氮的杂环化合物也认为是属于含氮化合物的范围,由于它们在天然化合物中占有重要地位,另有专章讨论。 通常所说的含氮化合物是指含有碳氮键的化合物。它们可以看作是烃分子中氮原子被含氮官能团取代的产物。含氮有机物比含氧化合物的种类还要多。本章重点介绍硝基化合物、胺、重氮和偶氮化合物。 本章学习的具体要求: 1、了解硝基化合物的主要性质; 2、掌握胺的分类、结构及其性质; 3、在掌握重氮化,偶合等重要反应的基础上,熟悉它们在有机合成上的重要应用。 4、掌握季铵盐在相转移催化反应中的应用,以及季铵碱受热反应的规律。 5、了解腈、异氰酸酯。 在含氮化合物的学习中,特别要注意含氮官能团的特征及其变化,因为氮原子在化合物中的价态是有变化的。这是含氧化合物所没有的现象。