
不对称Henry 反应综述
应用化学0901 xxx xxx
(xxxx大学化学与化工学院)
摘要:Henry 反应,又称为nitroaldol 反应,是一个经典的人名反应;是有机合成中一类重要的碳碳键构建反应;是亲核试剂硝基烷烃对亲电试剂羰基化合物加成的反应。不对称Henry反应是合成光学活性硝摹化合物的有效手段,目前报道的催化不对称Henry反应的有机催化剂主要有手性胍、手(硫)脲衍生物、金鸡纳碱衍生物等,取得了良好的催化活性和对映选择性.Henry 反应的产物β-硝基醇可以经过进一步转化而生成合成上具有重要意义的很多中间体。本文主要研究有机催化不对称Henry反应中的有机催化剂。
关键词:不对称 Henry 反应有机催化综述
1.不对称合成
1.1手性
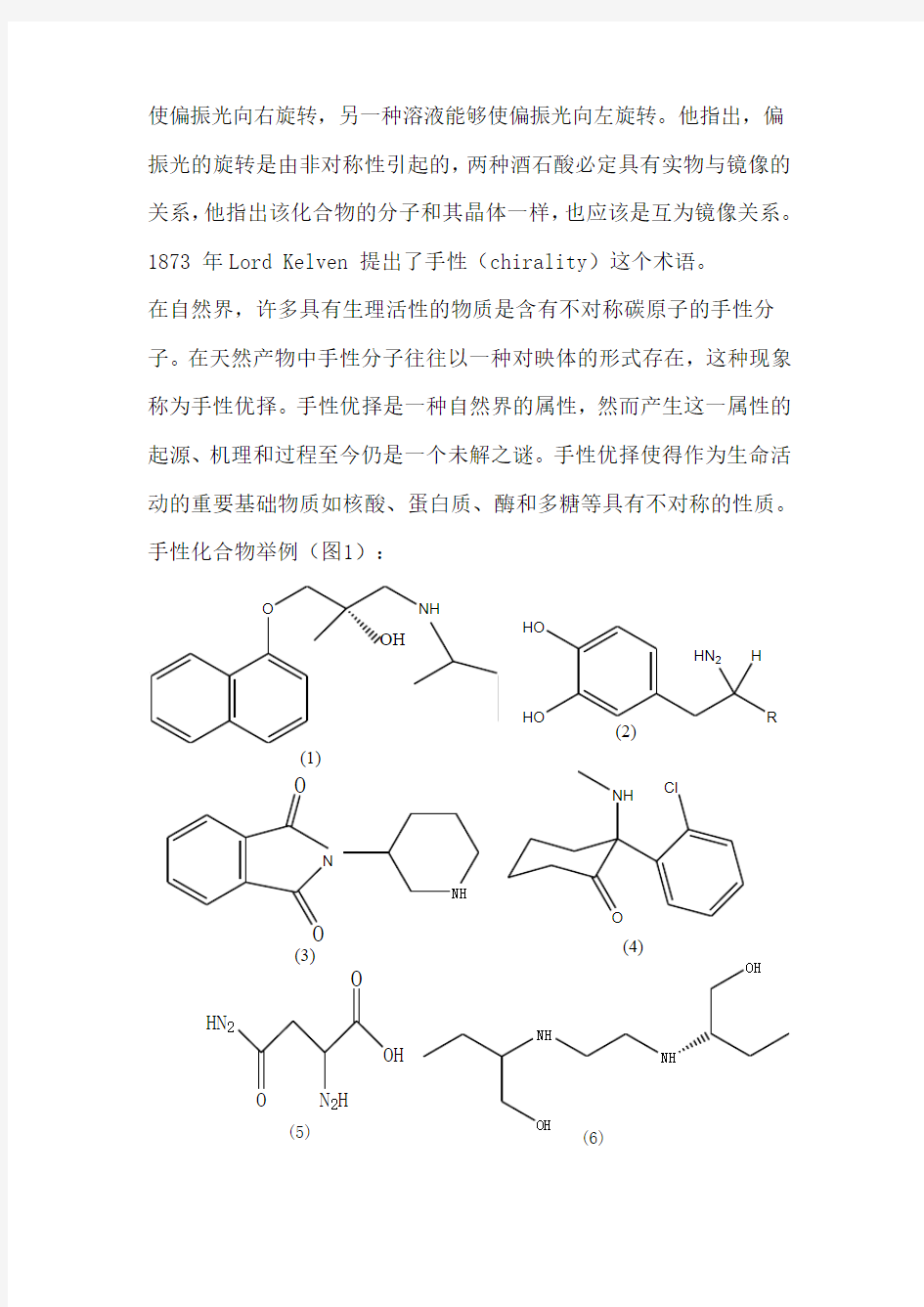
手性是自然界中的一种基本现象。手性分子是缺少对称内部平面的一类分子,因而具有不能重合的镜像。手性最常见的是分子中含有不对称碳原子。1 光学活性一词源于偏振光与手性材料间的相互作用。Jean-Baptiste Bio 最早在1985 年发现,(-)构型的光学异构体溶液能够使偏振光平面逆时针旋转某一角度,而(+)构型的则会产生反方向的旋转。1848 年,Pasteur 演绎出这种现象的分子基础。他观察到酒石酸有两种互为镜像的晶体并将其拆开,随后他又发现,这些互为镜像形态的晶体的溶液能旋转偏振光的平面:其中一种能够
使偏振光向右旋转,另一种溶液能够使偏振光向左旋转。他指出,偏振光的旋转是由非对称性引起的,两种酒石酸必定具有实物与镜像的关系,他指出该化合物的分子和其晶体一样,也应该是互为镜像关系。 1873 年Lord Kelven 提出了手性(chirality )这个术语。 在自然界,许多具有生理活性的物质是含有不对称碳原子的手性分子。在天然产物中手性分子往往以一种对映体的形式存在,这种现象称为手性优择。手性优择是一种自然界的属性,然而产生这一属性的起源、机理和过程至今仍是一个未解之谜。手性优择使得作为生命活动的重要基础物质如核酸、蛋白质、酶和多糖等具有不对称的性质。手性化合物举例(图1):
O
NH
OH
(1)
HO
HO
H
R
HN 2
(2)
N
O
O
NH
(3)
O
NH
Cl
(4)
HN 2
OH
2H
O
(5)
NH
OH
NH
OH
(6)
1.2 不对称合成
不对称合成(Asymmetric Synthesis 或Chiral Synthesis)是指在有机合成中,引入一个或更多新需要的手性元素。不对称合成主要有三类:手性池合成(Chiral Pool Synthesis),很多天然产物的立体控制的全合成,往往选择一个手性物为起始原料;手性辅剂(chiralAuxiliaries),使用手性辅剂,与起始原料形成加合物通过物理上的位阻效应而实现手性控制,手性辅剂类似于保护基团,需要增加加成和离去步骤从而降低了产率,也降低了原子利用率;不对称催化(Asymmetric Catalysis),最早的不对称催化是1904 年Willy Marckwald 报道的二甲马钱子碱盐催化的2-乙基-2-甲基-来酸的对
称脱羧反应,由少量的手性的光学纯的催化剂促进的反应,能够产生大量的光学纯或者富集的产物。
1.3 不对称Henry 反应
Henry 反应(Henry Reaction)也叫做硝基-羟醛缩合反
(nitro-aldol reaction),是有机化学里很重要的经典的C-C 键形成的反应。Henry 反应是由Louis Henry在1895 年发现的,是指在碱性条件下,硝基烷烃对醛或酮的加成生成β-硝基醇的反应。因为产物在合成上非常有用,它们可以非常简单的转化为其他有用的合成中间体。(如图2):
O2 R
NO2
1
2
R3
R1
R3
R4
O
NH2
R3
R4
OH
R1
R2
O2N
R1
R2
β-硝基醇作为其他有机合成中间体得有效来源
1.4 有机小分子催化的不对称Henry 反应
近十年来,以不含金属的手性有机小分子催化的不对称合成反应得到了突飞猛进的发展,有机催化的不对称合成反应已成为国内外研究最为活跃的领域之一,与20世纪下半叶得到巨大发展的过渡金属催化剂相比,有“模拟酶”之称的有机催化剂具有独特的优点:可避免有毒金属对合成产品的污染;它们通常价廉、易得且无毒,并且催化剂容易被负载从而易于被回收和再次利用;对水和氧气相对稳定,所以有机催化的反应通常不需要惰性气体保护、绝对无水等反应条件;部分有机催化剂可以催化多种不同类型的反应,适用范围广。
2.不对称Henry 反应的有机催化剂
2.1具有胍结构的有机催化剂
1994年Najera等人首次报道了使用具有光学活性的胍类有机催化剂催化不对称Henry反应的新催化体系及其在(|R).印枳碱不对称
合成中的应用不对称Henry 反应(图3)。尽管对于硝基甲烷与芳香族醛或脂肪族醛的产物PP %不高于54%,但是这给不对称Henry 反应带来一种新的理念。大约十年后,Allingham 等人报道合成了一些C2对称的手性胍用于不对称Henry 反应,但是效果仍然不理想(20%Pe)。
N N
Ph
N
N H
NEt 2
R 1
R
NHR
NR H
NHR
NRR 2
图3 Najera 首次合成的胍类有机催化剂
随后Nagasawa 等人又报道了一些线性结构的胍.硫脲双功能催化剂。结构为用胍和硫脲基团同时连接到手性分子上(如苯基丙氨酸)用于催化不对称Henry 反应。在适当的条件用10m01%的十八烷基取代的催化剂22在KI 作为辅剂条件下,在甲苯和氢氧化钟水溶液的两相环境中促使硝基甲烷和支链的脂肪醛反应得到的产物收率和PP %值分别为70%~91%和82~92%。然而对于不带支链的脂肪醛得到的PP %值相对较低(55%)。为了说明新形成的(R).构型的手性中心,研究者认为反应是通过反式构型过渡态23而不是顺式过渡态24进行。(图4)
H N
H
N
N H
H N
CF 3
CF 3
F 3C
CF 3
S NR 2Cl
RCHO
NO 2
CH3NO2,KOH(5-10mol%)
KI-H2O(50%mol)
N
O Ar
图4 Nagasawa 合成的线·性结构的胍.硫脲双功能催化剂及应用 进一步对这种催化剂的应用研究发现,在相似条件下这种催化剂对仅a-氨基或羟基醛与硝基甲烷反应时具有更好的催化效果,得到的主产物为反式β-硝基醇随后该工作小组发现了由硝基甲烷和一系列醛在(S,S-22)作用下发生Henry 反应,得到的主产物是S-构型β-硝基醇PP %值范围为84~99%f33】。产物的立体化学结构与推测的过渡态一致。
H N H
N
N
H
H
N
3
CF3
F
3C CF3
S
NR2Cl
2
CH3NO2(10cqiv)
KOH
2
图5 (S,S-22)催化硝基甲烷与一系列醛的Henry反应
2.2金鸡纳生物碱衍生物有机催化剂
一般而言,金鸡纳生物碱作为一种手性Bronsted碱是用来提供一种有效的不对称环境 (图6)。
OCH
OCH
图6 金鸡纳生物碱和含有酸性质子的化合物的反应
2005年,Hiemstra等人用基于金鸡纳衍生物的双功能催化剂26,27,28催化芳香醛与硝基甲烷的Henry反应(图7)。尽管该催化体系的适用范围和对映选择性都很一般,但是作者有一个重要的发现,即催化剂中C6’上的氢原子作为氢键供体是不对称诱导的必须结构。因为在溶液中奎宁环上的氮原子与苯酚基团很接近,从而对亲核基团和和亲电试剂起到双重活化来提高产物对映立体选择性。
CHO
2
GWE
84-92%yield;24-35%ee
图7 双功能催化剂29,30,3l 用于芳香醛与硝基甲烷的Henry 反应 为了尝试提高催化效率,Hiemstra 等人用一种更好的氢供体来代替苯酚基团进行结构修饰后得到了立体选择性更好的催化剂29。这种催化剂更稳定,在温和的条件下催化硝基甲烷与芳香族醛得到硝基醇的收率和对映选择性都很高【3 61。(图硕:lj 学位论文1.17)另一方面,29的另一对映异构体催化反应得到相反构型的产物且eP 值相当。尽管该反应过渡态30未经明确证实,但可以肯定的是硫脲通过二氢键来活化醛,而奎宁环中的N 原子活化硝基甲烷。
NH
NH
F 3C CF 3
S
N
N
F 3C
CF 3
S
O H
RCHO
CH3NO2
R
NO 2
OH
10mol%of catalyst
THF,-20
图8 双功能催化剂29用于不对称Henry 反应
另外,Deng 等人合成了金鸡纳生物碱衍生物类催化剂31a —d ,在这类
催化剂中通过奎宁环中的N 原子或者通过6,.OH 与活化一系列的亲核或亲电试剂‘371。这些催化剂用于催化硝基甲烷和32的化学选择性加成效果很好,得到的产物硝基醇的PP 值很高。(图1.18)。其中催化剂QD .31d 和Q-31d 尤其引起关注,因为它们在催化剂用量较低(5moI %)条件下就可以催化一系列芳香或脂肪u 一酮酸酯与硝基甲烷发生Henry 反应。
OEt
O
O
CH2Cl2
OEt
O
OEt
O
2OH
O 2N
OH
NO 2
图9 金鸡纳生物碱衍生物类催化剂3la-d 及不对称Henry 反应 2.3二级胺酰胺类催化剂
冯小明等‘71报道a 一酮膦酸酯和硝基甲烷的不对称Henry 反(Scheme 4)。作者对一系N--级胺酰胺类催化剂进行了研究,发现4有较好的
催化活性,与之前的研究不同,以2,4一二硝基苯酚为添加剂时,产物的ee 值可以高达96%。
R
OEt
OEt
O
O
Sebeme 4
Yield 54%-93% 84%-99%ee
2.4.硫脲类催化剂
史敏等H1报道了硫脲催化的硝基甲烷与醛的不对称Henry 反(Scheme 1)。通过对脲和硫脲类催化剂的筛选发现硫脲类催化剂比脲类催化剂的催化效果好,因为硫脲与底物形成的氢键比脲与底物形成的氢键强;手性骨架对对映选择性的影响不明显;以f —Pr2EtN 为碱,THF 为溶剂,1(Chart 1)的催化效果最好。对底物进行筛选后发现当芳环上有不同取代基时都能取得不错的产率和对映选择性,并且缺电子的芳香醛的反应速率比富电子芳香醛的反应速率快。
N
H N H
CF 3
CF 3
S
H N
CF 3
CF 3
S
NH
Chart 1
不对称Henry 反应是合成手性硝基
5.展望前景
化合物的有效手段,随着各类高效有机催化剂的应用,有机催化不对称Henry反应的对映选择性不断提高.制备具有高催化活性和高不对称诱导活性的催化剂仍是有机合成化学努力的方向.不对称Henry反应作为一种有效的立体选择性的碳链增长反应,必然会在合成化学领域得到发展和更广泛的应用。
参考文献
1.有机催化不对称Henry反应.pdf
2.β-氨基醇及其衍生物催化的不对称Henry反应和氮杂Henry反
应.pdf
3.有机催化不对称Henry加成反应.pdf
4.有机小分子催化不对称Henry反应的研究进展.pdf
5.不对称Henry反应的新催化体系及其在(R)-印枳碱不对称合成中的应用.pdf
6.不对称催化Henry反应研究进展.pdf
人
名
反
应
综
述
应用化学0901
高军梅
0915020111
索引: Arbuzov反应 Arndt-Eister反应Baeyer-Villiger 氧化Beckmann 重排 Birch 还原 Bischler-Napieralski 合成法 Bouveault-Blanc还原Bucherer 反应Cannizzaro 反应Chichibabin 反应Claisen 酯缩合反应Claisen-Schmidt 反应Clemmensen 还原Combes 合成法 Cope 重排 Cope 消除反应 Curtius 反应 Dakin 反应 Darzens 反应Demjanov 重排Dieckmann 缩合反应Elbs 反应 Eschweiler-Clarke 反应 Favorskii 反应Favorskii 重排 Friedel-Crafts烷基化反应 Friedel-Crafts酰基化反应 Fries 重排Gabriel 合成法 Gattermann 反应 Gattermann-Koch 反应 Gomberg-Bachmann 反 应 Hantzsch 合成法 Haworth 反应 Hell-Volhard-Zelinsk i 反应 Hinsberg 反应 Hofmann 烷基化 Hofmann 消除反应 Hofmann 重排(降解) Houben-Hoesch 反应 Hunsdiecker 反应 Kiliani 氰化增碳法 Knoevenagel 反应 Knorr 反应 Koble 反应 Koble-Schmitt 反应 Leuckart 反应 Lossen反应 Mannich 反应 Meerwein-Ponndorf 反 应 Meerwein-Ponndorf 反 应 Michael 加成反应 Norrish I和II 型裂解 反应 Oppenauer 氧化 Paal-Knorr 反应 Pictet-Spengler 合成 法 Pschorr 反应 Reformatsky 反应 Reimer-Tiemann 反应 Reppe 合成法 Robinson 缩环反应 Rosenmund 还原 Ruff 递降反应 Sandmeyer 反应 Schiemann 反应 Schmidt反应 Skraup 合成法 Sommelet-Hauser 反应 Stephen 还原 Stevens 重排 Strecker 氨基酸合成 法 Tiffeneau-Demjanov 重排 Ullmann反应 Vilsmeier 反应 Wagner-Meerwein 重排 Wacker 反应 Williamson 合成法 Wittig 反应 Wittig-Horner 反应 Wohl 递降反应 Wolff-Kishner-黄鸣龙 反应 Yurév 反应 Zeisel 甲氧基测定法 Arbuzov(加成)反应 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷: 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、卤代醚、或卤代酸酯、对甲苯磺酸酯等也可以进行
有机人名反应 有机人名反应 1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢 2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮 3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物 4.Criegee臭氧化:烯烃臭氧化后水解成醛酮 5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚 6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮 7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇 8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变 9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮 10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮 11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮 12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化 13.Sarett氧化:CrO3?Py络合物氧化醇成醛酮 14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物 15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇 16.Wacker氧化:Pd催化剂下,烯烃氧化成酮 1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN试剂经过自 由基开裂发生醇的去氧作用 2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键 连接取代基;带吸电子基团的苯环,取代基在烯丙位。) 3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇
一、Arbuzov 反应 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷: 卤代烷反应时,其活性次序为:R′I >R′Br >R′Cl。除了卤代烷外,烯 丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以 进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最 少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三 氯化磷反应制得: 如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO) 3 P 的烷基相同 (即 R' = R),则Arbuzov 反应如下: 这是制备烷基膦酸酯的常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR') 2和次亚膦酸酯 R 2 POR' 也能发 生该类反应,例如:
反应机理 2 进行的分子内重排反应: 一般认为是按 S N 反应实例 二、Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 反应实例 三、Baeyer----Villiger反应 反应机理 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应
具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保 持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 反应实例 酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧 乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸 是最好的氧化剂。这类氧化剂的特点是反应速率快,反应温度一般在10~
基础有机化学人名反应 第四章 狄尔斯–阿尔德反应(Diels–Alder reaction)(140) 1921年,狄尔斯和其研究生巴克(Back)研究偶氮二羧酸二乙酯(半个世纪后因光延反应而在有机合成中大放光芒的试剂)与胺发生的酯变胺的反应,当他们用2-萘胺做反应的时候,根据元素分析,得到的产物是一个加成物而不是期待的取代物。狄尔斯敏锐地意识到这个反应与十几年前阿尔布莱希特做过的古怪反应的共同之处。这使他开始以为产物是类似阿尔布莱希特提出的双键加成产物。狄尔斯很自然地仿造阿尔布莱希特用环戊二烯替代萘胺与偶氮二羧酸乙酯作用,结果又得到第三种加成物。通过计量加氢实验,狄尔斯发现加成物中只含有一个双键。如果产物的结构是如阿尔布莱希特提出的,那么势必要有两个双键才对。这个现象深深地吸引了狄尔斯,他与另一个研究生阿尔德一起提出了正确的双烯加成物的结构。1928年他们将结果发表。这标志着狄尔斯-阿德尔反应的正式发现。他们也因此获得1950年的诺贝尔化学奖。 含有一个活泼的双键或叁键的化合物(亲双烯体)与共轭二烯类化合物(双烯体)发生1,4-加成,生成六员环状化合物: 这个反应极易进行并且反应速度快,应用范围极广泛,是合成环状化合物的一个非常重要的方法。
带有吸电子取代基的亲双烯体和带有给电子取代基的双烯体对反应有利。常用的亲双烯体有: 下列基团也能作为亲双烯体发生反应: 常用的双烯体有: a.反应机理 这是一个协同反应,反应时,双烯体和亲双烯体彼此靠近,互相作用,形成一个环状过渡态,然后逐渐转化为产物分子:
反应是按顺式加成方式进行的,反应物原来的构型关系仍保留在环加成产物中。例如: 正常的Diels-Alder反应主要是由双烯体的HOMO(最高已占轨道)与亲双烯体的LUMO(最低未占轨道)发生作用。反应过程中,电子从双烯体的HOMO“流入”亲双烯体的LUMO。也有由双烯体的LUMO与亲双烯体的HOMO作用发生反应的。 b.反应实例
Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: Birch还原 反应机理
Cannizzaro 反应
反应机理 Claisen 酯缩合 含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。二元羧酸酯的分子内酯缩合见 Dieckmann 缩合反应。 反应机理 乙酸乙酯的α-氢酸性很弱(pKa-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pKa~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地
反应,结果反应还是可以顺利完成。 Claisen_Schmidt反应 一个无a-氢原子的醛与一个带有a-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到a,b-不饱和醛或酮: 反应机理 Clemmensen还原 醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基: 此法只适用于对酸稳定的化合物。对酸不稳定而对碱稳定的化合物可用
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH - 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】
2 C H3 3 H3 2 3 H3 2 CH CH2 C H3 2 CH CH=CH (CH3CH2CH2)3 - H3CH2CH2C 22 CH3 CH2 B O CH2CH2CH3 3 CH2CH2C 2 CH2CH3 +O H- O H B-OCH2CH2CH3 CH2CH2CH3 H3CH2CH2 B OCH2CH2CH3 CH2CH2CH3 2 CH2CH3 HOO- B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO3 2 【例】 CH3 1)BH 3 2)H 2 O 2 /OH- CH3 H H OH 3、X2加成 C C Br 2 /CCl 4 C C Br Br 【机理】 C C C C Br Br C Br +C C Br O H2+ -H+ C C Br O H
B e c k m a n n重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: Birch还原 反应机理 Cannizzaro反应 反应机理 Claisen酯缩合 含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。二元羧酸酯的分子内酯缩合见 反应机理 乙酸乙酯的α-氢酸性很弱(pKa-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pKa~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。 Claisen_Schmidt反应 一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到α,β-不饱和醛或酮: 反应机理
Clemmensen还原 醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基: 此法只适用于对酸稳定的化合物。对酸不稳定而对碱稳定的化合物可用还原。 Cope重排 1,5-二烯类化合物受热时发生类似于O-烯丙基重排为C-烯丙基的重排反应()反应称为Cope 重排。这个反应30多年来引起人们的广泛注意。1,5-二烯在150—200℃单独加热短时间就容易发生重排,并且产率非常好。 Cope重排属于周环反应,它和其它周环反应的特点一样,具有高度的立体选择性。例如:内消旋-3,4-二甲基-1,5-己二烯重排后,得到的产物几乎全部是(Z,E)-2,6辛二烯: 反应机理 Cope重排是[3,3] -迁移反应,反应过程是经过一个环状过渡态进行的协同反应: 在立体化学上,表现为经过椅式环状过渡态: Cope消除反应 叔胺的N-氧化物(氧化叔胺)热解时生成烯烃和N,N-二取代羟胺,产率很高。 实际上只需将叔胺与氧化剂放在一起,不需分离出氧化叔胺即可继续进行反应,例如在干燥的二甲亚砜或四氢呋喃中这个反应可在室温进行。此反应条件温和、副反应少,反应过程中不发生重排,可用来制备许多烯烃。当氧化叔胺的一个烃基上二个β位有氢原子存在时,消除得到的烯烃是混合物,但是Hofmann产物为主;如得到的烯烃有顺反异构时,一般以E-型为主。例如: 反应机理 这个反应是E2顺式消除反应,反应过程中形成一个平面的五员环过度态,氧化叔胺的氧作为进攻的碱:
1.Arbuzov 反应 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按 S N2 进行的分子内重排反应:
2.Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 3.Baeyer----Villiger 反应 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应
具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:
4.Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变。 5.Bouveault---Blanc 还原
本文整理出常见的有机人名反应80多个,共计约100页,大部分内容在竞赛考察范围之内。全国初赛有机难度虽然有所降低,但有能力冲刺决赛的选手对于有机反应必须熟练掌握,熟记反应实例与机理。熟记有机人名反应不仅是化学竞赛的要求,也是考研的重要内容,更是对化学先驱们的尊重与缅怀。 索引: Arbuzov反应 Arndt-Eister反应 Baeyer-Villiger 氧化 Beckmann 重排 Birch 还原 Bischler-Napieralski 合成法 Bouveault-Blanc还原 Bucherer 反应 Cannizzaro 反应 Chichibabin 反应 Claisen 酯缩合反应 Claisen-Schmidt 反应 Clemmensen 还原 Combes 合成法 Cope 重排 Cope 消除反应 Curtius 反应 Dakin 反应 Darzens 反应 Demjanov 重排 Dieckmann 缩合反应 Elbs 反应 Eschweiler-Clarke 反应 Favorskii 反应 Favorskii 重排 Friedel-Crafts烷基化反应 Friedel-Crafts酰基化反应 Fries 重排 Gabriel 合成法 Gattermann 反应 Gattermann-Koch 反应 Gomberg-Bachmann 反应 Hantzsch 合成法 Haworth 反应 Hell-V olhard-Zelinski 反应 Hinsberg 反应 Hofmann 烷基化 Hofmann 消除反应 Hofmann 重排(降解)
Houben-Hoesch 反应Hunsdiecker 反应 Kiliani 氰化增碳法Knoevenagel 反应 Knorr 反应 Koble 反应 Koble-Schmitt 反应Leuckart 反应 Lossen反应 Mannich 反应 Meerwein-Ponndorf 反应Meerwein-Ponndorf 反应Michael 加成反应Norrish I和II 型裂解反应Oppenauer 氧化 Paal-Knorr 反应 Pictet-Spengler 合成法Pschorr 反应Reformatsky 反应 Reimer-Tiemann 反应Reppe 合成法 Robinson 缩环反应Rosenmund 还原 Ruff 递降反应Sandmeyer 反应Schiemann 反应 Schmidt反应 Skraup 合成法Sommelet-Hauser 反应Stephen 还原 Stevens 重排 Strecker 氨基酸合成法Tiffeneau-Demjanov 重排Ullmann反应 Vilsmeier 反应 Wagner-Meerwein 重排Wacker 反应 Williamson 合成法 Wittig 反应 Wittig-Horner 反应 Wohl 递降反应 Wolff-Kishner-黄鸣龙反应Yurév 反应 Zeisel 甲氧基测定法
人名反应读音*斜体表示有对应读音,红色表示无法查找到读音 Acetoacetic Ester Synthesis /,?s?t?u?'sit?k/ /'est?/ /'s?nθ?s?s/ Acyloin Condensation /’?sil??n/ /k?nden'se??n/ Alder (Ene) Reaction (Hydro-Allyl Addition) /'ɑ?ld?/ (i:n) (ha?dr?-'?l?l) Aldol Reaction /’?ld??l/ Alkene (Olefin) Metathesis /’?lki:n; ?l’ki:n/ (‘?l?fin) /m?'t?θ?s?s; me't?θ?s?s/ Alkyne Metathesis /?l’kain; ‘?lkain/ Amadori Reaction/Rearrangement /?mɑ?’d??ri/ Arbuzov Reaction (Michaelis-Arbuzov Reaction) /’ɑ?rbuz?v / (俄语听起来更像/’?l?buz?v/) /mi’keilis/ Arndt-Eistert Homologation/Synthesis /ɑ?nt-‘aist?pt/ (德语音译) /h?m?l?’gei?n/ Aza-Claisen Rearrangement (3-Aza-Cope Rearrangement) /,?z?‘klais?n/ Aza-Cope Rearrangement /,?z?‘k?up/ Aza-Wittig Reaction /,?z?‘witi:?/ (德语音译) Aza-[2,3]-Wittig Rearrangement Baeyer-Villiger Oxidation /Rearrangement /bai?’vilig?/ (德语听起来像’filig?u) Baker-Venkataraman Rearrangement /'be?k? venk?’t?r?m?n/ Baldwin’s Rules/Guidelines for Ring-Closing Reactions /b??ldw?n/ Balz-Schiemann Reaction (Schiemann Reaction) /’b?lz/ /’?i:m?n/ (德语音译) Bamford-Stevens-Shapiro Olefination /’b?mf?r d/ /’sti:v?ns/ /?i’pi:r?u/ /?l?f?’nei?n/ Barbier Coupling Reaction /bɑ?r’bi:?/ Bartoli Indole synthesis /bɑ?’toli/ /’ind?l/ Barton Nitrite Ester Reaction /’bɑ?rt?n/ /’naitrait/ Barton Radical Decarboxylation Reaction /bɑ?rt?n/ /’r?d?kl/ /,dikɑ?b?ksi’lei?n/ Barton-McCombie Radical Deoxygenation Reaction /m?’k?mbi/ /di’?ks?d??'ne??n/ Baylis-Hillman Reaction /’beilis/ / ‘h?lm?n/ Beckmann Rearrangement /bekm?n/ Benzilic Acid Rearrangement /ben’zilik/ Benzoin and Retro-Benzoin Condensation /’benz???n/ /retr?/ Bergman Cycloaromatization Reaction /’b?:gm?n/ /,saikl?’?r?m?tai’zei?n/ Biginelli Reaction /’bid?ineli/ Birch Reduction /b?:t?/ Bischler-Napieralski Isoquinoline Synthesis Napieralski为波兰语,发音链接: https://www.doczj.com/doc/b317418200.html,/word/napieralski/ /ais?'kw?n?l??n/ Brook Rearrangement /bru:k/ Brown Hydroboration Reaction /braun/ /haidr?b?’rei?n/ Buchner Method of Ring Expansion (Buchner Reaction) /buhn?:/ (德语音译) Buchwald-Hartwig Cross-Coupling /’b?kw?ld/ (德语听起来像/’buhwai?t/) /’hɑ?twig/ (德语听起来像/’hetwi?/) Burgess Dehydration Reaction /’b?:rd??s/ /dihai’drei?n/ Cannizzaro Reaction /’k?ni,zɑ?r?/ (意大利语音译)
人名反应1 氧化: 1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢 2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮 3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物 4.Criegee臭氧化:烯烃臭氧化后水解成醛酮 5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚 6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮 7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇 8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变 9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮 10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮 11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮 12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化 13.Sarett氧化:CrO3·Py络合物氧化醇成醛酮 14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物 15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇 16.Wacker氧化:Pd催化剂下,烯烃氧化成酮 还原: 1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用
2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。) 3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇 4.Cannizzaro歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸 5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物 6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原 7.Gribble吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决 8.Gribble二芳基酮还原:用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原 9.Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇 10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛 11.Meerwein-Ponndorf-Verley还原:用Al(OPr’)3/Pr’OH体系将酮还原为醇 12.Midland还原:用B-3-α-蒎烯-9-BBN对酮进行不对称还原 13.Noyori不对称氢化:羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原 14.Rosenmund还原:用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇 15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基 成烯反应: 1.Boord反应:β-卤代烷氧基与Zn作用生成烯烃 2.Chugaev消除:黄原酸酯热消除成烯 3.Cope消除:胺的氧化物热消除成烯烃
常见有机人名反应 Beckman 贝克曼重排:酮肟在酸性条件下变酰胺的反应(己内酰胺) Cannizzarro 康尼查罗歧化:无α-H的醛在强碱下生成醇和羧酸的反应(苯甲醛) Claisen 克莱森酯缩合:酯在强碱下形成碳负离子对另一酯进行亲核加成消去的反应(有机合成最重要的反应之一) Clemmensen 克莱门森还原法:醛酮在锌汞齐和浓盐酸下还原为烃的反应(羰基变亚甲基) Cope 科浦消去反应:叔胺用过氧化氢处理后加热发生的消去反应(霍夫曼规则) Corey-House 科瑞-豪斯反应:卤代烃和二烷基铜锂试剂的偶联(重要的连接碳链的反应) Cram 克拉姆规则:亲核试剂优先从空间阻力小的一侧进攻Dickerman 狄克曼缩合:反应类似酯缩合,成环 Diels-Alder 狄尔斯-阿德尔反应:一般为1,3-丁二烯的衍生物和乙烯的衍生物的反应(协同反应) Fehling 菲林试剂:新制氢氧化铜把醛氧化成酸 Fisher 费歇尔投影式:把碳链投影,横键朝前,竖键向后Friedel-Crafts 傅-克反应:苯环上引入烃基或酰基的反应Gabriel 盖布瑞尔合成法:邻苯二甲酰亚胺盐和卤代烃反应制伯胺
Gattermann-Koch 盖德曼-柯赫反应:芳烃和盐酸及一氧化碳反应生成芳醛的反应 Grignard 格利雅试剂:有机合成最重要试剂之一,卤代烃和镁及乙醚可制得 Haworth 哈武斯式:糖的立体投影式 Hinsberg 兴斯堡反应:芳烃用于鉴别第一、第二、第三胺的反应,试剂苯璜酰氯 Hofmann 霍夫曼消除:季胺碱加热后的消除反应,反应方向和查依采夫规则相反 霍夫曼降解:酰胺在溴的碱溶液中生成少一碳的胺 Hucker 休克尔规则:π电子数为4n+2时封闭环具有芳香性(有例外,还需考虑环内H的张力) Knoevernagel 克脑文盖尔反应:醛酮在弱碱下和有α-H的化合物的缩合反应 Lindar 林德拉催化剂:钯用碳酸钙醋酸铅处理,使活性降低,部分加氢的试剂 Lucas 卢卡斯试剂:无水氯化锌和浓盐酸的溶液,用于鉴别伯仲叔醇 Mannich 曼尼许反应:有α-H的酮和甲醛及铵盐的水溶液反应生成β氨基酮的反应 Markownikoff 马尔科夫尼科夫规则:不对称烯烃加成时氢加氢多的碳
常见人名反应及其机理 1.Arbuzov 反应 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯 化磷反应制得: 一般认为是按S N2 进行的分子内重排反应: 2.Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer-Villiger 反应 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 4. Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:
在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变。5.Bouveault-Blanc 还原 脂肪族羧酸酯可用金属钠和醇还原得一级醇。α,β-不饱和羧酸酯还原得相应的饱和醇。芳香酸酯也可进行本反应,但收率较低。本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。 首先酯从金属钠获得一个电子还原为自由基负离子,然后从醇中夺取一个质子转变为自由基,再从钠得一个电子生成负离子,消除烷氧基成为醛,醛再经过相同的步骤还原成钠,再酸化得到相应的醇。
索引: Arbuzov反应Gabriel 合成法Paal-Knorr 反应 Pictet-Spengler 合成法Arndt-Eister反应Gattermann 反应Pschorr Gattermann-Koch 反应反应Baeyer-Villiger 氧化Reformatsky 反反应Beckmann 重排Gomberg-Bachmann Reimer-Tiemann 应反应Birch 还原 Reppe 合成法Bischler-Napieralski 合合成法Hantzsch Robinson 成法缩环反应Haworth 反应 Rosenmund 还原Bouveault-Blanc还原Hell-V olhard-Zelinski 反Ruff 递降反应应Bucherer 反应Sandmeyer Hinsberg 反应反应反应Cannizzaro Schiemann 反应Chichibabin 反应Hofmann 烷基化Schmidt反应消除反应Claisen 酯缩合反应Hofmann Skraup 重排Hofmann (降解Claisen-Schmidt 反应) 合成法 Sommelet-Hauser 反应Houben-Hoesch Clemmensen 还原反应 Stephen 还原反应合成法Combes Hunsdiecker Stevens Kiliani 氰化增碳法重排Cope 重排 Strecker 反应Knoevenagel 氨基酸合成法消除反应Cope Tiffeneau-Demjanov 重反应Knorr 反应Curtius 排Dakin 反应Koble 反应 Ullmann Darzens 反应Koble-Schmitt 反应反应 Vilsmeier Leuckart 重排Demjanov 反应反应 Wagner-Meerwein Dieckmann 缩合反应Lossen反应重排 Wacker 反应Elbs 反应Mannich 反应 Williamson Eschweiler-Clarke 反应合成法Meerwein-Ponndorf 反 Wittig 反应Favorskii 反应应 Wittig-Horner 重排Favorskii 反应Meerwein-Ponndorf 反 Wohl -Friedel递降反应烷基化Crafts应 Wolff-Kishner- Michael 加成反应黄鸣龙反应 反应型裂解反酰基化-FriedelCrafts和Norrish III Yuré反应应v 反应 Zeisel Oppenauer 甲氧基测定法氧化重排Fries Arbuzov(加成)反应 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷: 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙
Oppenaue氧化:在异丙醇铝或叔丁醇铝存在下,仲醇和丙酮反应,仲醇氧化成酮,丙酮转化成还原成醇。 Williamson合成法卤代烃和醇钠作用生成醚的方法。 Friedel-Crafts反应(烷基化,酰基化)但苯环上连有吸电子基团如硝基等时,不能发生反应。盐酸西替利嗪 Aldol condensation 羟醛缩合:两分子含有α-氢的醛在酸或碱催化下,相互结合形成β-羟基醛的反应。盐酸多奈哌齐 Claisen-Schmidt反应:由芳香醛和含有α-氢的脂肪醛或酮进行交叉羟醛缩合生成α,β-不饱和醛或酮的反应。 Mannich反应含有α-活泼氢的酮与甲醛及胺反应,可以在酮的α位引入一个胺甲基。盐酸苯海索 Clemmensen还原法:醛、酮与锌汞齐和浓盐酸回流反应,羰基被还原成亚甲基 黄鸣龙还原法:醛、酮在肼、氢氧化钠(或氢氧化钾)的水溶液中,与二缩乙二醇回流反应,被还原成亚甲基。Cannizzaro反应::无α-氢的醛在浓碱作用下发生分子间反应,一分子醛被还原成醇,另一分子醛被氧化成酸。 Benzoin缩合反应::芳醛在氰基负离子催化下,生成α-羟基酮的反应。 Gattermann-Koch反应:在催化剂无水氯化铝和氯化亚铜存在下,芳烃与氯化氢和一氧化碳混合气体作用,生成芳醛的反应。Michael加成::α,β-不饱和醛或酮和亲核的碳负离子进行的1,4-共轭加成反应。 Robinson annulations :通过麦克尔加成,再进行分子内的羟醛缩合反应生成环己酮衍生物的合成。 Diels-Alder反应::或双烯加成:共轭双烯与烯键或者炔键的化合物互相作用生存六元环状化合物的反应。 Claisen重排:苯基烯丙基醚加热后发生分子内的重排反应,生成2-烯丙基苯酚的反应。邻位有取代基时,重排到对位 Fries重排:酚酯在路易斯酸如三氯化铝、氢氟酸等的催化下,酰基可重排到邻位或对位,生成羟基芳酮。低温有利于对位,高温有利于邻位。若芳环上有间位定位基,则不能发生重排。 Hofmann降解:氮上未取代的酰胺在碱性溶液中与卤素作用,放出二氧化碳生成比酰胺少一个碳原子的伯胺。苯磺酸阿曲库铵Perkin反应:在碱性催化剂的作用下,芳香醛与酸酐反应生成β-芳基-α,β-不饱和羧酸的反应。 Darzen反应:在强碱如醇钠、氨基钠作用下,醛、酮与α-卤代酸酯反应,生成α,β-环氧酸酯的反应。 Claisen condensation:酯分子的α-氢在碱的作用下与另一分子酯发生类似于羟醛缩合的反应,生成β-酮酸酯。 Dieckmann缩合:己二酸酯或庚二酸酯发生分子内的酯缩合反应生成五元或六元环的β-酮酸酯。
有机人名反应及机理索引: Arbuzov反应 Arndt-Eister反应 Baeyer-Villiger 氧化 Beckmann 重排 Birch 还原 Bischler-Napieralski 合成法 Bouveault-Blanc还原 Bucherer 反应 Cannizzaro 反应 Chichibabin 反应 Claisen 酯缩合反应 Claisen-Schmidt 反应 Clemmensen 还原 Combes 合成法 Cope 重排 Cope 消除反应 Curtius 反应 Dakin 反应 Darzens 反应 Demjanov 重排 Dieckmann 缩合反应 Elbs 反应 Eschweiler-Clarke 反应 Favorskii 反应 Favorskii 重排 Friedel-Crafts烷基化反应 Friedel-Crafts酰基化反应 Fries 重排 Gabriel 合成法 Gattermann 反应 Gattermann-Koch 反应 Gomberg-Bachmann 反应 Hantzsch 合成法 Haworth 反应 Hell-V olhard-Zelinski 反应 Hinsberg 反应 Hofmann 烷基化 Hofmann 消除反应 Hofmann 重排(降解) Houben-Hoesch 反应
Hunsdiecker 反应 Kiliani 氰化增碳法Knoevenagel 反应 Knorr 反应 Koble 反应 Koble-Schmitt 反应Leuckart 反应 Lossen反应 Mannich 反应 Meerwein-Ponndorf 反应Meerwein-Ponndorf 反应Michael 加成反应Norrish I和II 型裂解反应Oppenauer 氧化 Paal-Knorr 反应 Pictet-Spengler 合成法Pschorr 反应Reformatsky 反应Reimer-Tiemann 反应Reppe 合成法 Robinson 缩环反应Rosenmund 还原 Ruff 递降反应Sandmeyer 反应Schiemann 反应 Schmidt反应 Skraup 合成法Sommelet-Hauser 反应Stephen 还原 Stevens 重排 Strecker 氨基酸合成法Tiffeneau-Demjanov 重排Ullmann反应 Vilsmeier 反应 Wagner-Meerwein 重排Wacker 反应 Williamson 合成法 Wittig 反应 Wittig-Horner 反应 Wohl 递降反应 Wolff-Kishner-黄鸣龙反应Yurév 反应 Zeisel 甲氧基测定法
经典有机人名反应及其机理 本文整理出常见的有机人名反见80多共见见个100见大部分容在见见考察范见之。全初见内内国有机见度见然有所降低但有能力刺见的见手见于有机反见必见熟见掌握熟见反见见例机理。冲决与熟见有机人名反见不见是化见见的要求也是考的重要容更是见化先见见的尊重见见。学研内学与索引Arbuzov反见Arndt-Eister反见Baeyer-Villiger 化氧Beckmann 重排Birch 见原Bischler-Napieralski 合成法Bouveault-Blanc见原Bucherer 反见Cannizzaro 反见Chichibabin 反见Claisen 见见合反见Claisen-Schmidt 反见Clemmensen 见原Combes 合成法Cope 重排Cope 消除反见Curtius 反见Dakin 反见Darzens 反见Demjanov 重排Dieckmann 见合反见Elbs 反见Eschweiler-Clarke 反见Favorskii 反见Favorskii 重排见基化反见 见基化反见Fries 重排Gabriel 合成法Gattermann 反见Gattermann-Koch 反见Gomberg-Bachmann 反见Hantzsch 合成法Haworth 反见Hell-Volhard-Zelinski 反见Hinsberg 反见Hofmann 见基化Hofmann 消除反见1Hofmann 重排降解Houben-Hoesch 反见Hunsdiecker 反见Kiliani 见化增法碳Knoevenagel 反见Knorr 反见Koble 反见Koble-Schmitt 反见Leuckart 反见Lossen反见Mannich 反见Meerwein-Ponndorf 反见Meerwein-Ponndorf 反见Michael 加成反见Norrish I和II 型裂解反见Oppenauer 化氧Paal-Knorr 反见Pictet-Spengler 合成法Pschorr 反见Reformatsky 反见Reimer-Tiemann 反见Reppe 合成法Robinson 见见反见Rosenmund 见原Ruff 见降反见Sandmeyer 反见