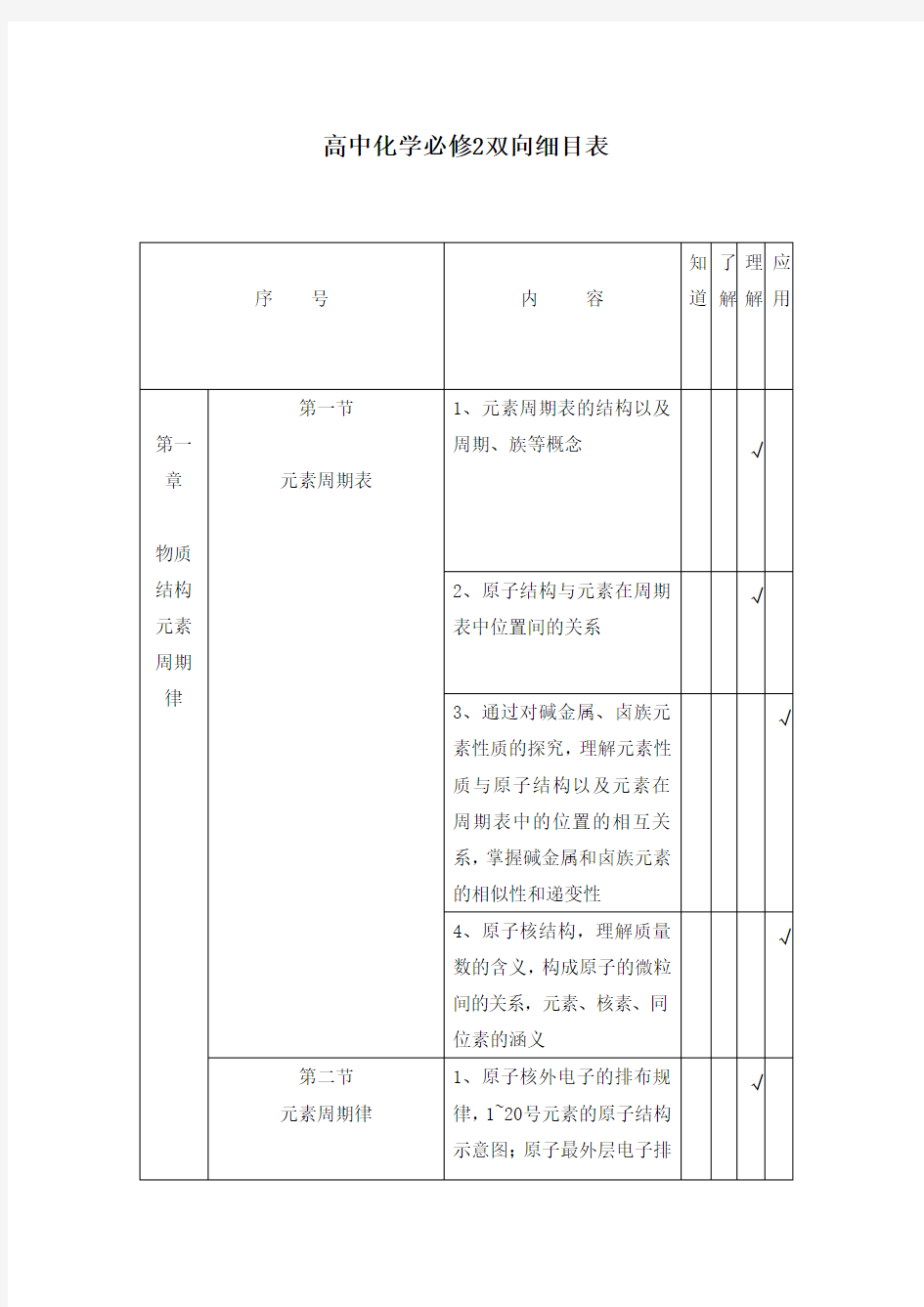
高中化学必修2双向细目表
序号内容知
道
了
解
理
解
应
用
第一章
物质结构元素周期律
第一节
元素周期表
1、元素周期表的结构以及
周期、族等概念√
2、原子结构与元素在周期
表中位置间的关系
√
3、通过对碱金属、卤族元
素性质的探究,理解元素性
质与原子结构以及元素在
周期表中的位置的相互关
系,掌握碱金属和卤族元素
的相似性和递变性
√
4、原子核结构,理解质量
数的含义,构成原子的微粒
间的关系,元素、核素、同
位素的涵义
√
第二节
元素周期律
1、原子核外电子的排布规
律,1~20号元素的原子结构
示意图;原子最外层电子排
√
布与元素的原子得失电子
能力和化合价的关系
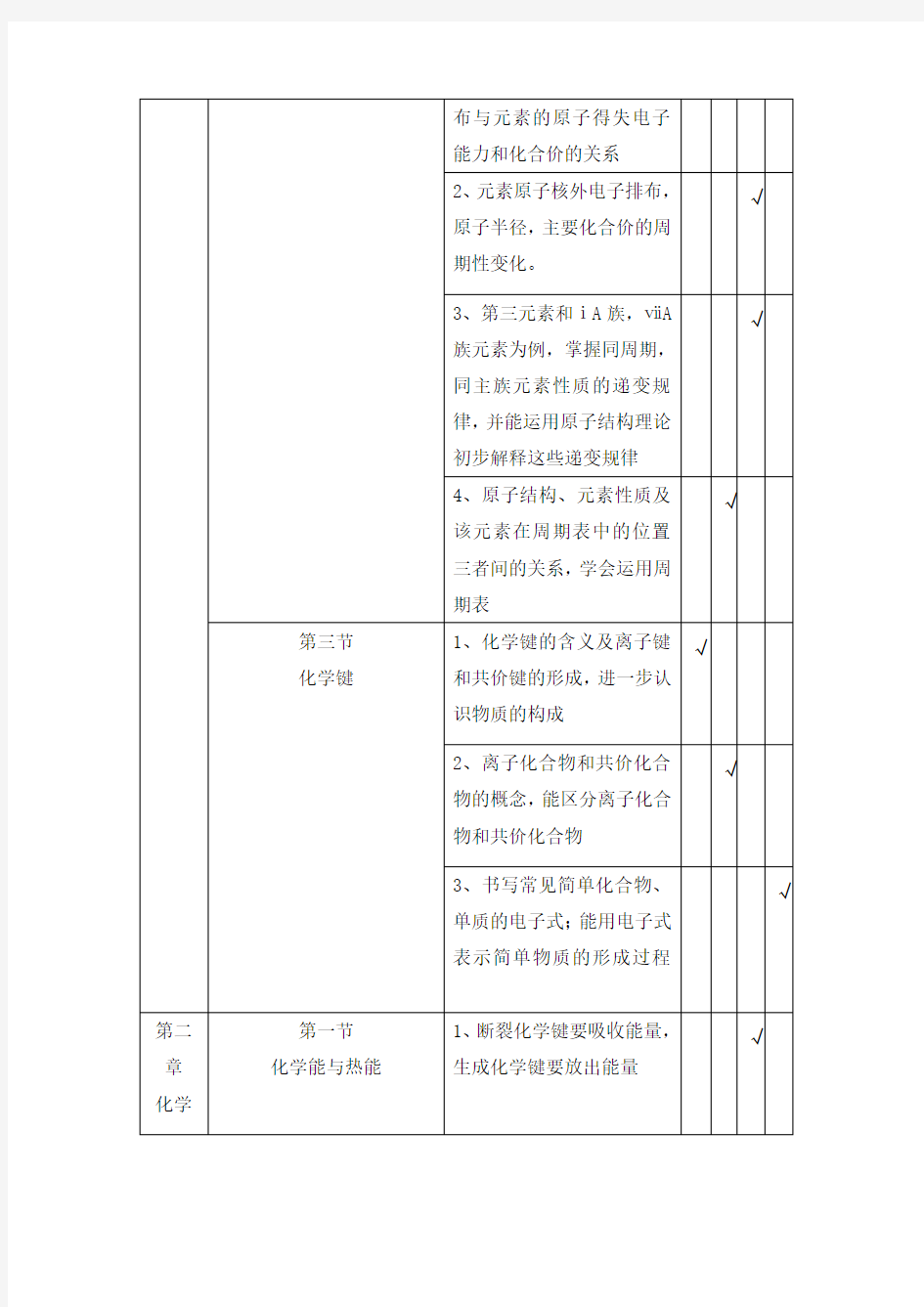
2、元素原子核外电子排布,
原子半径,主要化合价的周
期性变化。
√
3、第三元素和ⅰA族,ⅶA
族元素为例,掌握同周期,
同主族元素性质的递变规
律,并能运用原子结构理论
初步解释这些递变规律
√
4、原子结构、元素性质及
该元素在周期表中的位置
三者间的关系,学会运用周
期表
√
第三节化学键1、化学键的含义及离子键
和共价键的形成,进一步认
识物质的构成
√
2、离子化合物和共价化合
物的概念,能区分离子化合
物和共价化合物
√
3、书写常见简单化合物、
单质的电子式;能用电子式
表示简单物质的形成过程
√
第二章化学
第一节
化学能与热能
1、断裂化学键要吸收能量,
生成化学键要放出能量
√
反应与能量
2、化学能和热能是相互转
化的,并且符合能量守恒
√
3、什么是吸热反应和放热
反应,并通过实验亲身体验
放热反应和吸热反应,记住
常接触的化学反应中哪些
是放热反应,哪些是吸热反
应。
√
4、物质变化和能量变化是
普遍存在的,它们符合质量
守恒和能量守恒定律
√
第二节
化学能与电能
1、火力发电中的能量转化√
2、原电池的原理√
3、氧化还原反应是使化学
能转换为电能的关键
√
4、通过对原电池装置的分
析,掌握原电池正、负极判
断方法
√
5、通过原电池装置来判断
金属的活动性顺序
√
6、几种发展中的化学电源√
7、学会自己设计原电池√
第三节
化学反应的速率和限度1、化学反应速率的涵义及
表示方法,并能进行化学反
应速率的简单计算
√
2、浓度、温度、固体的表
面积、催化剂等条件对化学
反应速率的影响
√
3、建立化学平衡的观点√
4、理解化学平衡的特征√
5、几种化学反应进行限度
的因素
√
6、区分某条件对化学反应
速率和可逆反应的方向性。
√
第三章有
第一节
最简单的有机化合物——
1、明确什么是有机化合物,
理解有机化合物种类繁多、
√
机化合物
甲烷数量巨大的原因,体会到有
机物对人们的生产、生活的
影响
2、甲烷的组成和物理性质,
掌握甲烷的正四面体结构
和化学性质
√
3、烷烃的物理性质及其性
质的变化规律,烷烃的结
构、性质和烷烃的命名方法
√
4、取代反应,同分异构现
象和同分异构体
√
第二节
来自石油和煤的两种基本
化工原料
1、石油的分馏及其产品和
用途,石油的裂化和裂解
√
2、煤的干馏和综合利用√
3、煤、石油的组成和石油
产品、煤干馏产品的广泛用
途
√
4、乙烯、苯的组成和结构
特征,和它们的主要性质
√
5、乙烯的物理性质和主要
用途,和实验室制法
√
6、掌握苯的结构式及其重
要的化学性质,了解苯及其
同系物在组成、结构、性质
上的异同
√
7、初步学会烃的有关简单
计算
√
第三节
生活中两种常见的有机物1、乙醇的物理性质,乙酸
和乙酸乙脂的物理性质
√
2、乙醇的生理作用和工业
制法
√
3、理解乙醇的结构,通过
分析乙醇的结构式掌握乙
醇在发生化学反应时的断
键位置,从而推断乙醇所具
有的化学性质
√
4、乙酸的物理性质以及它
与人们生活的关系
√
5、通过分析乙醇和乙酸的
结构式,掌握它们发生脂化
反应的原理以及实验的操
作方法,分析实验现象,会
熟练地书写该化学方程式
√
6、了解乙酸的通性,并通
过设计实验来验证次氯酸、
碳酸和乙酸的酸性强弱顺
序
√
7、掌握乙酸的分子结构和
化学性质,了解乙酸的用
途、制法等
√
第四节
基本营养物质1、油脂的组成、结构、重
要性质和用途,酯和油脂的
联系和区别
√
2、油脂的应用,肥皂和硝
化甘油等日常生活中的知
识
√
3、掌握糖类的主要代表物
的组成和性质,了解淀粉、
纤维素的组成和性质
√
4、掌握蛋白质的基本性质,
认识蛋白质是生命现象最
基本的物质基础
√
第四章化学与可持续发展
第一节
开发利用金属矿物和海水
资源
1、了解金属冶炼的一般原
理,理解金属冶炼方法的选
择同金属活动性的关系,了
解常见金属的冶炼方法
√
2、了解金属回收的重要意
义,树立资源保护,环境保
护的意识
√
3、海水中微量元素的存在√
和应用,以及对工业生产和
高科技领域的潜在价值,认
识综合开发利用海水资源
的重要意义
4、掌握蒸馏法淡化海水的
原理及操作,通过对海水中
提取溴、碘等知识的学习,
进一步学习卤族单质和其
化合物的性质,同时学会应
用氧化还原原理设计实验
探究物质氧化性或还原相
对强弱的方法
√
第二节
化学与资源综合利用、环境
保护1、了解煤的组成及煤包含
的元素种类,了解煤的综合
利用的途径
√
2、了解煤干馏的原理和煤
干馏的产物极其主要用途
√
3、认识石油的成分,石油
分馏、裂化和裂解的基本原
理,石油分馏和裂解的产品
和用途,乙烯的加聚反应
√
4、理解加聚反应的概念和
原理,能够书写常见的加聚
反应方程式
√
5、造成环境污染的主要原
因,常见污染物及治理措
√
施。绿色化学的原理和意义,认识环境和人类生存发展的密切关系,增强环保意识,树立可持续发展意识
高中化学必修2双向细目表 序号内容知了理应 道解解用 第一章第一节 1、元素周期表的结构以及周期、族 ? 物质结构元素周期等概念 元素周期表 2、原子结构与元素在周期表中位置 ? 律间的关系 3、通过对碱金属、卤族元素性质的 ? 探究,理解元素性质与原子结构以及 元素在周期表中的位置的相互关系, 掌握碱金属和卤族元素的相似性和 递变性 4、原子核结构,理解质量数的含义, ? 构成原子的微粒间的关系,元素、核 素、同位素的涵义 第二节 1、原子核外电子的排布规律,1~20 ? 元素周期号元素的原子结构示意图;原子最外 律层电子排布与元素的原子得失电子 能力和化合价的关系 2、元素原子核外电子排布,原子半 ? 径,主要化合价的周期性变化。 3、第三元素和?A族,?A族元素为 ? 例,掌握同周期,同主族元素性质的 递变规律,并能运用原子结构理论初 步解释这些递变规律 4、原子结构、元素性质及该元素在 ? 周期表中的位置三者间的关系,学会 运用周期表
第三节 1、化学键的含义及离子键和共价键 ? 化学键的形成,进一步认识物质的构成 2、离子化合物和共价化合物的概念, ? 能区分离子化合物和共价化合物 3、书写常见简单化合物、单质的电 ? 子式;能用电子式表示简单物质的形 成过程 第二章第一节 1、断裂化学键要吸收能量,生成化 ? 化学反应化学能与学键要放出能量 与能量热能 2、化学能和热能是相互转化的,并 ? 且符合能量守恒 3、什么是吸热反应和放热反应,并 ? 通过实验亲身体验放热反应和吸热 反应,记住常接触的化学反应中哪些 是放热反应,哪些是吸热反应。 4、物质变化和能量变化是普遍存在 ? 的,它们符合质量守恒和能量守恒定 律 第二节 1、火力发电中的能量转化 ? 化学能与 电能 2、原电池的原理 ? 3、氧化还原反应是使化学能转换为 ? 电能的关键 4、通过对原电池装置的分析,掌握 ? 原电池正、负极判断方法 5、通过原电池装置来判断金属的活 ? 动性顺序 6、几种发展中的化学电源 ? 7、学会自己设计原电池 ? 第三节 1、化学反应速率的涵义及表示方法, ? 化学反应并能进行化学反应速率的简单计算的速率和2、浓度、温度、固体的表面积、催 ? 限度化剂等条件对化学反应速率的影响 3、建立化学平衡的观点 ?
初高中化学常见俗称及其物质总结 无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3 小苏打:NaHCO3 大苏打:Na2S2O3 生石灰:CaO 熟石灰消石灰:Ca(OH) 2 石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 漂白粉:Ca (ClO)2、CaCl2(混和物) 漂白液:NaCl NaClO 莹石:CaF2 重晶石:BaSO4 碳铵:NH4HCO3 石灰石、大理石:CaCO3 食盐:NaCl 熟石灰、消石灰:Ca(OH)2 水银:Hg 芒硝:Na2SO4·7H2O 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2 明矾:KAl (SO4)2·12H2O (十二水合硫酸铝钾)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2 皓矾:ZnSO4·7H2O 硅石、石英:SiO2 刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3 铁红、铁矿:Fe2O3 磁铁矿:Fe3O4 黄铁矿、硫铁矿:FeS2 铜绿、孔雀石:Cu2 (OH)2CO3 菱铁矿:FeCO3 赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4 石硫合剂:Ca (OH)2和S 天然气、沼气、坑气(主要成分):CH4 水煤气:CO和H2 硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2
光化学烟雾:NO2在光照下产生的一种有毒气体 王水:浓HNO3与浓HCl按体积比1:3混合而成。(混和物) 尿素:CO(NH2) 2 有机部分: 氯仿:CHCl3 电石:CaC2 电石气:C2H2 (乙炔) TNT:三硝基甲苯 酒精、乙醇:C2H5OH 冰醋酸、食醋CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。甘油、丙三醇:C3H8O3 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。 蚁醛:甲醛HCHO 福尔马林:35%—40%的甲醛水溶液 蚁酸:甲酸HCOOH 葡萄糖:C6H12O6 果糖:C6H12O6 蔗糖:C12H22O11 麦芽糖:C12H22O11 淀粉:(C6H10O5)n 硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH
高中化学必背知识点归纳与总结|高中化学必背知识点归纳与总结 【--高中生入党申请书】 一、俗名 无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3 小苏打:NaHCO3 大苏打:Na2S2O3 石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2 重晶石:BaSO4(无毒) 碳铵:NH4HCO3 石灰石、大理石:CaCO3 生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2 芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2 明矾:KAl (SO4)2·12H2O 漂:Ca (ClO)2 、CaCl2(混和物) 泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O
双氧水:H2O2 皓矾:ZnSO4·7H2O 硅石、石英:SiO2 刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3 铁红、铁矿:Fe2O3 磁铁矿:Fe3O4 黄铁矿、硫铁矿:FeS2 铜绿、孔雀石:Cu2 (OH)2CO3 菱铁矿:FeCO3 赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4 石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2 过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4 重过磷酸钙(主要成分):Ca (H2PO4)2 天然气、沼气、坑气(主要成分):CH4 水煤气:CO和H2 硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2 溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3:浓HCl按体积比1:3混合而成,高中化学必背知识点归纳与总结。 铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2)2 有机部分:
高中化学俗名大全 无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3、小苏打:NaHCO3、大苏打:Na2S2O3、石膏(生石膏):CaSO4.2H2O、熟石膏:2CaSO4·H2O 莹石:CaF2;重晶石:BaSO4(无毒);碳铵:NH4HCO3;石灰石、大理石:CaCO3;生石灰:CaO;食盐:NaCl;熟石灰、消石灰:Ca(OH)2;芒硝:Na2SO4·7H2O(缓泻剂);烧碱、火碱、苛性钠:NaOH;绿矾:FaSO4·7H2O;干冰:CO2;明矾:KAl(SO4)2·12H2O;漂白粉:Ca(ClO)2、CaCl2(混和物);泻盐:MgSO4·7H2O;胆矾、蓝矾:CuSO4·5H2O;双氧水:H2O2;皓矾:ZnSO4·7H2O;硅石、石英:SiO2;刚玉:Al2O3;水玻璃、泡花碱、矿物胶:Na2SiO3;铁红、铁矿:Fe2O3;磁铁矿:Fe3O4;黄铁矿、硫铁矿:FeS2;铜绿、孔雀石:Cu2(OH)2CO3;菱铁矿:FeCO3;赤铜矿:Cu2O;波尔多液:Ca(OH)2和CuSO4;石硫合剂:Ca(OH)2和S玻璃的主要成分:Na2SiO3、CaSiO3、SiO2;过磷酸钙(主要成分):Ca(H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca(H2PO4)2;天然气、沼气、坑气(主要成分):CH4;水煤气:CO和H2;硫酸亚铁铵(淡蓝绿色):Fe(NH4)2(SO4)2溶于水后呈淡绿色。 光化学烟雾:NO2在光照下产生的一种有毒气体。
铝热剂:Al+Fe2O3或其它氧化物。 尿素:CO(NH2)2 有机部分: 氯仿:CHCl3;电石:CaC2;电石气:C2H2;(乙炔)TNT:三硝基甲苯、酒精、乙醇:C2H5OH 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。醋酸:冰醋酸、食醋CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO 等。甘油、丙三醇:C3H8O3 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。石炭酸:苯酚蚁醛:甲醛HCHO 福尔马林:35%—40%的甲醛水溶液蚁酸:甲酸HCOOH 葡萄糖:C6H12O6;果糖:C6H12O6;蔗糖:C12H22O11;麦芽糖:C12H22O11;淀粉:(C6H10O5)n 硬脂酸:C17H35COOH;油酸:C17H33COOH;软脂酸:C15H31COOH 草酸:乙二酸:HOOC—COOH;使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。 文章来源网络整理,请自行参考编辑使用
初中毕业学业水平考试 试卷双向细目表 学科:化学命题时间: 单元难度 A B 考试水平 C D 难度分布 (%) 合计 a 身边的 化学物质 b c 10 4 6 2 16.7 10 10 22 a42315 物质构成 的奥秘 b2 1.611 c a54218.3 物质的 化学变化 b c 4 4 6.7 6.7 19 a22 6.7 化学与 社会发展 b4 6.78 c a 科学探究 b 4 2 7 2 19(渗透 在上述 c4 内容中)考试水平合计153******** 整卷难度分布(%):a(容易)68.3;b(中等难度)21.7;c(较难)10.
芜湖市初中毕业学业水平考试 试题情况分析 试卷名称:化学命题时间:2010年6月 题号题型知识点章/节 考试 水平 难度 估计 分值 1 2 3 4选择 选择 选择 选择 物质的变化 物质的分类 营养素 实验基本操作 2、3 2、3 12 1 B B B B 0.7 0.75 0.75 0.75 2 2 2 2 5 6选择化学式的意义 选择物质的微粒性 3 4-2 B A 0.7 0.75 2 2能根据原子序数在元素周期表 7选择 中找到指定元素 8选择与化学有关的安全知识 合成材料对人类、环境的影响;9选择 新材料对人类、社会发展的关系 4B0.72 8-1、8-3A0.752 12-3A0.72 10选择对溶解度(曲线)7-2B0.52 11填空物质的化学性质、化学变化的类1-1、1-1、B0.724 2 12填空 化学用语、混合物提纯与分离、5-2、12-1 实验分析A B C 0.65 0.8 0.6 3 2 3 7 化学用语、燃料的利用、生活中4-2、5-2A0.83 13填空6 B0.651常见的物质、分析评价6-3、7-3C0.652 14填空实验室制取气体9 3-2、5-2、A0.753
高中化学基础知识总结 一、俗名 无机部分: 纯碱、苏打Na2CO3、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生 石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2 芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉: Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、 硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷 酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、 沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2(SO4)2 溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3:浓HCl按体积比1:3混合 而成。 铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2) 2 有机部分: 氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔) TNT:三硝基甲苯 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。酒精、乙醇:C2H5OH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。醋酸:冰醋酸、食醋 CH3COOH 甘油、丙三醇:C3H8O3石炭酸:苯酚蚁醛:甲醛 HCHO 二、颜色 铁:铁粉是黑色的;一整块的固体铁是银白色的。 Fe2+——浅绿色 Fe3O4——黑色晶体 Fe(OH)2——白色沉淀 Fe3+——黄色 Fe (OH)3——红褐色沉淀 Fe (SCN)3——血红色溶液 FeO——黑色的粉末 Fe (NH4)2(SO4)2——淡蓝绿色 Fe2O3——红棕色粉末 铜:单质是紫红色 Cu2+——蓝色 CuO——黑色 Cu2O——红色 CuSO4(无水)—白色 CuSO4·5H2O——蓝色 Cu2 (OH)2CO3—绿色 Cu(OH)2——蓝色 [Cu(NH3)4]SO4——深蓝色溶液 FeS——黑色固体 BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl 、 Mg (OH)2、三溴苯酚均是白色沉淀 Al(OH)3白色絮状沉淀 H4SiO4(原硅酸)白色胶状沉淀 Cl2、氯水——黄绿色 F2——淡黄绿色气体 Br2——深红棕色液体 I2——紫黑色固体 HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾
高中化学必修1双向细目表 章节内容(知识点)知 道了 解 理 解 应 用 第一章认识化学科学1.研究物质性质的方法和程序√ 2、钠、氯气的物理性质√ 3、钠及其氧化物、氯气的化学性质。√ 4.物质的量、摩尔质量的概念既简单计算√ 5.物质的量浓度及其简单计算,溶液稀 释时有关的计算 √6.气体摩尔体积及其简单计算√7.配制一定物质的量浓度的溶液√8.物质的质量、摩尔质量、物质的量、 物质的粒子数、物质的量浓度之间的相互 关系及有关计算 √ 第二章元素与物质的分类1、物质分类 √ 2、分散系√ 3、丁达尔效应√ 4、胶体的渗析、胶体的吸附作用√
5. 电离方程式的书写√ 6、离子共存、离子的物质的量浓度√ 7、Cl-、SO42-、CO32-的检验方法√8.氧化还原反应、氧化、还原、氧化剂、 还原剂等概念 √9.简单的氧化还原反应方程式的配平、 标出电子转移的方向和数目 √ 第三章自然界中的元素1、同素异形体的概念, √ 2、碳酸钠和碳酸氢钠的主要性质。 √3、碳单质、一氧化碳、二氧化碳、碳酸 盐、碳酸氢盐之间的转化。 √ 4.自然界中的氮循环及人类活动对氮循 环的影响; √ 5、生物固氮和人工固氮形式,认识N2、 NO 、NO2的性质; √ 6、NH3性质及制取、铵盐的性质及铵态 氮肥的使用问题; √ 7、HNO3的性质。 √
8、硫的主要性质; √ 9、不同价态硫元素之间的相互转化 √ 10、二氧化硫和浓硫酸的主要性质。 √11、硫及其化合物在生产中的应用及酸雨 的危害 √ 12、镁单质的还原性和重要用途。 √13、氯、溴、碘单质的氧化性和氧化性递 变顺序及溴单质和溴的化合物的重要用 途。 √ 14、海水中微量元素的存在和应用及在工 业生产和高科技领域的潜在价值,认识到 综合开发利用海水化学资源的重要意义。 √ 第四章元素与材料世界1、硅的存在及用途。√ 2、二氧化硅的物理、化学性质及其用途。√ 3、硅酸的性质(弱酸性、水溶性、硅胶 的吸水性)及制备方法。 √ 4.硅酸钠(Na2SiO3)的性质、用途。√5.硅酸盐工业√6.铝及其重要化合物的化学性质;√
(化学)2018年初中毕业生毕业升学考试双向细目表 一级主题二 级 主 题 三 级 主 题 题型 能力 层次 难 度 分 值 选 择 题 填 空 题 简 答 题 实 验 题 计 算 题 A B C 科学探究 增进对科学探究的理解√7、2 发展 科学 探究 能力 能对一些实验进行探究 6 √2、1 6 学习 基本 的实 验技 能 药品的取用、仪器的连 接、加热 1 √ 7、2 1 选择实验仪器和药品√7 会配制溶液 1 √7、2 1 指示剂、PH试纸的使用√7、2 检验和区分常见物质0.25 √7、2 0.25 气体制取的装置和方法 4 √7 4 过滤、蒸发分离物质 1 2 √7 3 身边的化学物质地球 周围 的空 气 空气成分及作用 1 √√7 1 氧气和很多物质发生氧 化反应 1 √7 1 氧气、二氧化碳、一氧化 碳的性质、用途 0.5 1 √ √ 7、2、1 1.5 氧气、二氧化碳的实验室 制法 √7、2 水与 常见 的溶 液 水的组成,硬水和软水0.25 √7 0.25 常见水的净水方法 1 √7 1 溶解现象,溶液的组成0.25 √√7 0.25 饱和溶液、溶解度 5 √7、2 5 溶质质量分数的计算 1 √ 1 1 结晶现象√7 乳化√7 金属 与金 属矿 金属的物理特征,主要化 学性质,及防腐蚀方法 1 √√7、 2 1 常见的铁矿石炼铁√7 合金性能,生铁和钢√7
物金属材料作用√7 金属资源的保护√7、2 生活中常见的化合物酸碱的性质和用途,腐蚀 性 2.25 √√√2、1 2.25 常见酸碱的稀释方法√7 酸碱性对人体、农作物的 影响 √7 常见盐的用途 1 √7 1 常见化肥种类及作用 1 √7 1 常见有机物及有机物的 重要性 √√7、2 碳酸根、铵根的检验√7、2、1 常见物质的颜色及溶解 性 1.75√7 1.75 物质构成的奥秘化学 物质 的多 样性 物质的三态转化0.25√7、2 0.25 物质的分类 1 √√√7、2、1 1 微粒 构成 物质 构成物质的微粒 1.75√7 1.75 用微粒观点解释现象 4 √7 4 原子的构成 2 √7 2 微粒间的转化,核外电子 在化学反应中的作用 1 √√ 2 1 认识 化学 元素 常见元素名称及符号√7 元素的简单分类 1 √7 1 元素周期表的简单应用√7 物质 组成 的表 示 常见元素的化合价 1 √7 1 书写化学式 3 √7、2、1 3 化学式的简单计算 1 √7、2 1 商品标签的元素组成及 含量√7、2 物质的化学变化学 变化 的基 本特 征 化学变化的特征及本质0.75√7 0.75 化学变化中的能量变化 1 √7、2 1 催化剂的作用0.5 √7 0.5
高中化学知识点大全内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)
高中化学重要知识点详细总结 一、俗名 无机部分: 纯碱、苏打、天然碱 、口碱:Na 2CO 3 小苏打:NaHCO 3 大苏打:Na 2S 2O 3 石膏(生石膏): 熟石膏:2CaSO 4·.H 2O 莹石:CaF 2 重晶石:BaSO 4(无毒) 碳铵:NH 4HCO 3 石灰石、大理石:CaCO 3 生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2 芒硝:Na 2SO 4·7H 2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO 4·7H 2O 干冰:CO 2 明矾:KAl (SO4)2·12H 2O 漂白粉:Ca (ClO)2 、CaCl 2(混和物) 泻盐:MgSO 4·7H 2O 胆矾、蓝矾:CuSO 4·5H 2O 双氧水:H 2O 2 皓矾:ZnSO 4·7H 2O 硅石、石英:SiO 2 刚玉:Al 2O 3 水玻璃、泡花碱、矿物胶:Na 2SiO 3 铁红、铁矿:Fe 2O 3 磁铁矿:Fe 3O 4 黄铁矿、硫铁矿:FeS 2 铜绿、孔雀石:Cu 2 (OH)2CO 3 菱铁矿:FeCO 3 赤铜矿:Cu 2O 波尔多液:Ca (OH)2和CuSO 4 石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na 2SiO 3、CaSiO 3、SiO 2 过磷酸钙(主要成分):Ca (H 2PO 4)2和CaSO 4 重过磷酸钙(主要成分):Ca (H 2PO 4)2 天然气、沼气、坑气(主要成分):CH 4 水煤气:CO 和H 2 硫酸亚铁铵(淡蓝绿色):Fe (NH 4)2 (SO 4)2 溶于水后呈淡绿色 光化学烟雾:NO 2在光照下产生的一种有毒气体 王水:浓HNO 3与浓HCl 按体积比1:3混合而成。 铝热剂:Al + Fe 2O 3或其它氧化物。 尿素:CO (NH 2) 2 有机部分: 氯仿:CHCl 3 电石:CaC 2 电石气:C 2H 2 (乙炔) TNT :三硝基甲苯 酒精、乙醇:C 2H 5OH
高中化学物质的俗名 1.生石灰(主要成份是CaO); 消石灰、熟石灰[主要成份是Ca(OH)2]; 水垢[主要成份是CaCO3和Mg(OH)2]; 石灰石、大理石、白垩、蛋壳、贝壳、骨骼中的无机盐(主要成份是CaCO3); 波尔多液(石灰水与硫酸铜溶液的混合物);石硫合剂(石灰水与硫粉的悬浊液)。 碱石灰:NaOH和CaO的混合物]; 2.烧碱、火碱、苛性钠(NaOH);苛性钾(KOH) 3.苏打、纯碱、口碱(Na2CO3); 小苏打(NaHCO3); 大苏打、海波(Na2S2O3) 纯碱晶体(Na2CO3·10H2O);泡花碱、水玻璃、矿物胶(Na2SiO3的水溶液) 4.芒硝(Na2SO4·10H2O)重晶石(BaSO4) 石膏(CaSO4·2H2O)熟石膏(2CaSO4·H2O) 5.胆矾、蓝矾(CuSO4·5H2O);明矾[KAl(SO4)2·12H2O或K2 SO4·Al2(SO4)3·24H2O]; 绿矾(FeSO4·7H2O)皓矾(ZnSO4·7H2O) 6.菱镁矿(主要成份是MgCO3)菱铁矿(主要成份是FeCO3) 磁铁矿(主要成份是Fe3O4)赤铁矿、铁红(主要成份是Fe2O3) 黄铁矿、硫铁矿(主要成份是FeS2) 7.磷矿石[主要成份是Ca3(PO4)2] 重过磷酸钙、重钙[主要成份是Ca(H2PO4)2] 过磷酸钙、普钙[主要成份是Ca(H2PO4)2和CaSO4] 8.光卤石(KCl·MgCl2·6H2O)9.铜绿、孔雀石[Cu2(OH)2CO3 ] 10.萤石(CaF2);电石(CaC2);冰晶石(Na3AlF6)水晶(SiO2);玛瑙(主要成份是SiO2);石英(主要成份是SiO2); 硅藻土(无定形SiO2)宝石、刚玉(Al2O3);金刚砂(SiC)。 11.草酸HOOC—COOH 硬脂酸C17H35COOH 软脂酸C15H31COOH 油酸C17H33COOH 石炭酸C6H5OH 蚁酸HCOOH 蚁醛HCHO 福尔马林(HCHO的水溶液)木精CH3OH 酒精CH3CH2OH 醋酸、冰醋酸CH3COOH 甘油(CH2OHCHOHCH2OH)硝化甘油(三硝酸甘油酯) TNT(三硝基甲苯)肥皂(有效成份是C17H35COONa) 火棉——纤维素与硝酸完全酯化反应、含氮量高的纤维素硝酸酯。用于制造无烟火药和枪弹的发射药。 胶棉——纤维素与硝酸不完全酯化反应、含氮量低的纤维素硝酸酯。用于制造赛璐珞和油漆。 粘胶纤维——由植物的秸秆、棉绒等富含纤维素的物质经过NaOH和CS2等处理后,得到的一种纤维状物质。其中长纤维俗称人造丝,短纤维俗称人造棉。 12.尿素CO(NH2)2硫铵(NH4)2SO4碳铵NH4HCO3 13.硫酐SO3硝酐N2O5碳酐、干冰、碳酸气CO2 14.王水(浓硝酸和浓盐酸按体积比 ...1 : 3的混合物) 1
高考化学知识点双向细目表 (依据安徽 2011 年高考说明) 黄山市田家炳实验中学程培红2011年 8月 31日 理综 题型 分类序 知识点内容 了解合 号解掌应 填空题 选择题 握用 物质 1 分子、原子、离子、元素等概念的含义;√ 的组 2 原子团的定义√ 成、3 物理变化与化学变化的区别与联系。√√ 性质 4 混合物和纯净物、单质和化合物、金属和非金属的概念√√ 和分 类 5 同素异形体的概念。√ 6 酸、碱、盐、氧化物的概念及其相互联系。√√ 7 熟记并正确书写常见元素的名称、符号、离子符号。√√ 化 熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式), 8 √√ 或根据化学式判断化合价。 学 基9 原子结构示意图、分子式、结构式和结构简式的表示方法。√√√化学 本 用语概 及常念 用计化 量学 基 本 理 论 溶液 物 质 结 构10 质量守恒定律的含义。√ 11 正确书写化学方程式、离子方程式,并能进行有关计算。√√√ 12 相对原子质量、相对分子质量的定义,并能进行有关计算。√√ 13 物质的量的单位 -- 摩尔( mol ),摩尔质量、气体摩尔体积。√√√ 14 物质的量浓度( mol·L-1 )、阿伏加德罗常数的含义。√√√ 根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标 15 准状况下)之间的相互关系进行有关计算。 √√√ 16 溶液的含义。√ 17 溶解度、饱和溶液的概念。√ 18 溶液的组成。√ 19 溶液中溶质的质量分数的概念,并能进行有关计算。√√ 20 胶体是一种常见的分散系√√ 21 元素、核素和同位素的含义。√√ 原子构成。原子序数、核电荷数、质子数、中子数、核外电子数 √√√22 以及它们之间的相互关系 23 元素周期律的实质。√
高中化学必背基础知识总结 一、俗名 1.无机部分 纯碱、打、天然碱、口碱:Na2CO3小打:NaHCO3 大打:Na2S2O3石膏(生石膏):CaSO4·2H2O 熟石膏:2CaSO4·H2O 莹石:CaF2重晶石:BaSO4(无毒) 碳铵:NH4HCO3 石灰石、石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3 磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2(OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4 石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4 水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3:浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2) 2 2.有机部分 氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔) TNT:三硝基甲苯氟氯烃:是良好的制冷剂,有毒,但破坏O3层。酒精、乙醇:C2H5OH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。醋酸、冰醋酸、食醋:CH3COOH 甘油、丙三醇:C3H8O3 石炭酸:苯酚蚁醛、甲醛:HCHO 二、颜色 铁:铁粉是黑色的;一整块的固体铁是银白色的。 Fe2+浅绿色Fe3O4黑色晶体Fe(OH)2白色沉淀Fe3+:黄色Fe(OH)3红褐色沉淀Fe(SCN)3血红色溶液FeO黑色的粉末 Fe (NH4)2(SO4)2淡蓝绿色Fe2O3红棕色粉末铜单质是紫红色 Cu2+蓝色CuO黑色Cu2O红色CuSO4(无水)白色 CuSO4·5H2O蓝色Cu2(OH)2CO3绿色Cu(OH)2蓝色[Cu(NH3)4]SO4深蓝色溶液FeS黑色固体BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl 、Mg (OH)2、三溴苯酚均是白色沉淀 Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀 Cl2、氯水黄绿色F2淡黄绿色气体Br2深红棕色液体 I2紫黑色固体HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾CCl4无色的液体,密度大于水,与水不互溶 Na2O2淡黄色固体Ag3PO4黄色沉淀S黄色固体AgBr—浅黄色沉淀AgI黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、
高中化学全部知识点总结 一、俗名 无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2) 2 有机部分: 氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔) TNT:三硝基甲苯酒精、乙醇:C2H5OH 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。醋酸:冰醋酸、食醋CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。甘油、丙三醇:C3H8O3 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。石炭酸:苯酚蚁醛:甲醛HCHO 福尔马林:35%—40%的甲醛水溶液蚁酸:甲酸HCOOH 葡萄糖:C6H12O6果糖:C6H12O6蔗糖:C12H22O11麦芽糖:C12H22O11淀粉:(C6H10O5)n 硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH 草酸:乙二酸HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。 二、颜色 铁:铁粉是黑色的;一整块的固体铁是银白色的。Fe2+——浅绿色Fe3O4——黑色晶体Fe(OH)2——白色沉淀Fe3+——黄色Fe (OH)3——红褐色沉淀Fe (SCN)3——血红色溶液 FeO——黑色的粉末Fe (NH4)2(SO4)2——淡蓝绿色Fe2O3——红棕色粉末FeS——黑色固体铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4(无水)—白色CuSO4·5H2O——蓝色Cu2 (OH)2CO3—绿色Cu(OH)2——蓝色[Cu(NH3)4]SO4——深蓝色溶液BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl 、Mg (OH)2、三溴苯酚均是白色沉淀 Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀 Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体 HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾 CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色 Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀 AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、有毒的气体 SO3—无色固体(沸点44.8 0C)品红溶液——红色氢氟酸:HF——腐蚀玻璃 N2O4、NO——无色气体NO2——红棕色气体NH3——无色、有剌激性气味气体 三、现象:
高中化学重要知识点详细总结一、俗名 无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2) 2 有机部分: 氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔) TNT:三硝基甲苯酒精、乙醇:C2H5OH 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。醋酸:冰醋酸、食醋CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。甘油、丙三醇:C3H8O3 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。石炭酸:苯酚蚁醛:甲醛HCHO 福尔马林:35%—40%的甲醛水溶液蚁酸:甲酸HCOOH 葡萄糖:C6H12O6果糖:C6H12O6蔗糖:C12H22O11麦芽糖:C12H22O11淀粉:(C6H10O5)n 硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH 草酸:乙二酸HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。二、颜色 铁:铁粉是黑色的;一整块的固体铁是银白色的。Fe2+——浅绿色Fe3O4——黑色晶体 Fe(OH)2——白色沉淀Fe3+——黄色Fe (OH)3——红褐色沉淀Fe (SCN)3——血红色溶液FeO——黑色的粉末Fe (NH4)2(SO4)2——淡蓝绿色Fe2O3——红棕色粉末FeS——黑色固体 铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4(无水)—白色CuSO4·5H2O——蓝色Cu2(OH)2CO3—绿色Cu(OH)2——蓝色[Cu(NH3)4]SO4——深蓝色溶液 BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl 、Mg (OH)2、三溴苯酚均是白色沉淀 Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀 Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体 HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾 CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色 Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀 AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、有毒的气体 SO3—无色固体(沸点44.8 0C)品红溶液——红色氢氟酸:HF——腐蚀玻璃 N2O4、NO——无色气体NO2——红棕色气体NH3——无色、有剌激性气味气体 三、现象: 1、铝片与盐酸反应是放热的,Ba(OH)2与NH4Cl反应是吸热的; 2、Na与H2O(放有酚酞)反应,熔化、浮于水面、转动、有气体放出;(熔、浮、游、嘶、红) 3、焰色反应:Na 黄色、K紫色(透过蓝色的钴玻璃)、Cu 绿色、Ca砖红、Na+(黄色)、K+(紫色)。 4、Cu丝在Cl2中燃烧产生棕色的烟; 5、H2在Cl2中燃烧是苍白色的火焰; 6、Na在Cl2中燃烧产生大量的白烟; 7、P在Cl2中燃烧产生大量的白色烟雾; 8、SO2通入品红溶液先褪色,加热后恢复原色; 9、NH3与HCl相遇产生大量的白烟;10、铝箔在氧气中激烈燃烧产生刺眼的白光; 11、镁条在空气中燃烧产生刺眼白光,在CO2中燃烧
高中化学重要知识点详细总结 一、俗名 无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4〃.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4〃7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4〃7H2O 干冰:CO2明矾:KAl (SO4)2〃12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4〃7H2O 胆矾、蓝矾:CuSO4〃5H2O 双氧水:H2O2皓矾:ZnSO4〃7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤 铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻 璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2 和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑 气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3 与浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。尿素:CO(NH2) 2 有机部分: 氯仿:CHCl3电石:CaC2电石气:C2H2(乙炔) TNT:三 硝基甲苯酒精、乙醇:C2H5OH 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。醋酸:冰 醋酸、食醋 CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。
高中常见物质俗名及颜色汇总 一、俗名 无机部分 (1)各种苏打: 纯碱、苏打、天然碱:Na2CO3 小苏打:NaHCO3大苏打:Na2S2O3 (2)各种石膏 石膏(生石膏):CaSO4?2H2O 熟石膏:2CaSO4·H2O (3)各种石灰 石灰石、大理石:CaCO3生石灰:CaO 熟石灰、消石灰:Ca(OH)2 (4)铁相关: 绿矾:FeSO4·7H2O 磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2 菱铁矿:FeCO3 铁红、铁矿:Fe2O3 硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色 (5)各种矾 胆矾、蓝矾:CuSO4?5H2O 明矾:KAl (SO4)2·12H2O 绿矾:FeSO4·7H2O 皓矾:ZnSO4·7H2O (6)其他无机相关 莹石:CaF2重晶石:BaSO4(无毒) 水煤气:CO和H2 芒硝:Na2SO4·7H2O (缓泻剂) 漂白粉:Ca (ClO)2、CaCl2(混和物) 硅石、石英:SiO2刚玉:Al2O3铜绿、孔雀石:Cu2 (OH)2CO3 水玻璃、泡花碱、矿物胶:Na2SiO3赤铜矿:Cu2O 尿素:CO(NH2) 2
波尔多液:Ca (OH)2和CuSO4玻璃的主要成分:Na2SiO3、CaSiO3、SiO2 天然气、沼气、坑气(主要成分):CH4 光化学烟雾:NO2在光照下产生的一种有毒气体 王水:浓HNO3与浓HCl按体积比1∶3混合而成 铝热剂:Al + Fe2O3或其它氧化物 氢氟酸:HF——腐蚀玻璃 有机相关 (1)糖相关: 葡萄糖:C6H12O6果糖:C6H12O6蔗糖:C12H22O11麦芽糖:C12H22O11 淀粉:(C6H10O5)n (2)酸相关 硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH 醋酸、冰醋酸、食醋:CH3COOH 蚁酸、甲酸:HCOOH 石炭酸:苯酚 蚁醛、甲醛:HCHO 草酸、乙二酸:HOOC—COOH (呈强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色)。 (3)其他有机相关 氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔) 甘油、丙三醇:C3H8O3
高中化学俗名总结 ---陆文豪(带有“▲”的为重点和最常用 一、金属和非金属部分 ▲1、纯碱、苏打、天然碱、口碱:N a2CO3 ▲2、小苏打:NaHCO3 ▲3、大苏打:Na2S2O3 ▲4、烧碱、火碱、苛性钠:NaOH 5、芒硝:Na2SO4·7H2O(缓泻剂 ▲6、食盐:NaCl ▲7、明矾:KAl (SO42·12H2O ▲8、胃舒平:Al(OH 9、刚玉(蓝宝石.红宝石:Al2O3 10、盐卤:MgCl2.6H2O 11、铜绿、孔雀石:Cu2 (OH2CO3 12、赤铜矿:Cu2O 13、波尔多液:Ca (OH2和CuSO4 14、钡餐,重晶石:BaSO4 ▲15、胆矾、蓝矾:CuSO4·5H2O ▲16、绿矾:FeSO4·7H2O
▲17、铁红、铁锈、赤铁铁矿:Fe2O3 ▲18、磁铁矿:Fe3O4 19、黄铁矿、硫铁矿:FeS2 20、菱铁矿:FeCO3 21、白口铁:碳以FeC3形式存在 22、硫酸亚铁铵(淡蓝绿色:Fe (NH42 (SO42溶于水后呈淡绿色 23、石膏(生石膏:CaSO4.2H2O 24、熟石膏:2CaSO4·.H2O 25、过磷酸钙(主要成分:Ca (H2PO42和CaSO4 26、重过磷酸钙(主要成分:Ca (H2PO42 27、石硫合剂:Ca (OH2和S 28、金刚石、石墨:C 29、足球烯:C6 ▲30、硅石、水晶、石英:SiO2 ▲31、玻璃的主要成分:Na2SiO3、CaSiO3、SiO2 ▲32、金刚砂:SiC ▲33、水玻璃、泡花碱、矿物胶:Na2SiO3 34、正长石:KAlSi3O8 35、高岭石:Al2 (Si2O5(OH 4