一、 绪论
1. 研究对象是工业反应过程或工业反应器 研究目的是实现工业反应过程的优化
2. 决策变量:反应器结构、操作方式、工艺条件 3. 优化指标——技术指标:反应速率、选择性、能耗
掌握转化率、收率与选择性的概念
4. 工程思维方法
二、化学反应动力学
1. 反应类型:简单反应、自催化、可逆、平行、串联反应
基本特征、分析判断
2. 化学反应速率的工程表示
)
)((反应区反应时间反应量
反应速率=
3. 工业反应动力学规律可表示为:
)()(T f C f r T i C i ?=
a) 浓度效应——n 工程意义是:反应速率对浓度变化的敏感程度。 b) 温度效应——E 工程意义是:反应速率对温度变化的敏感程度。 已知两个温度下的反应速率常数k ,可以按下式计算活化能E :
E ——cal/mol ,j/mol T ——K
R = 1.987cal/mol.K = 8.314 j/mol.K
三、PFR 与CSTR 基本方程
1. 理想间歇:??-=--==Af A Af A x x A
A
A c c A A R r dx c r dc v V t 00)()(00
工程问题
2. 理想PFR : ??-=--==Af A Af A x x A A
A c c A A R p r dx c r dc v V 00)
()(00τ
3. CSTR : )
()(00A A
A A A A R p r x c r c c v V -=
--==
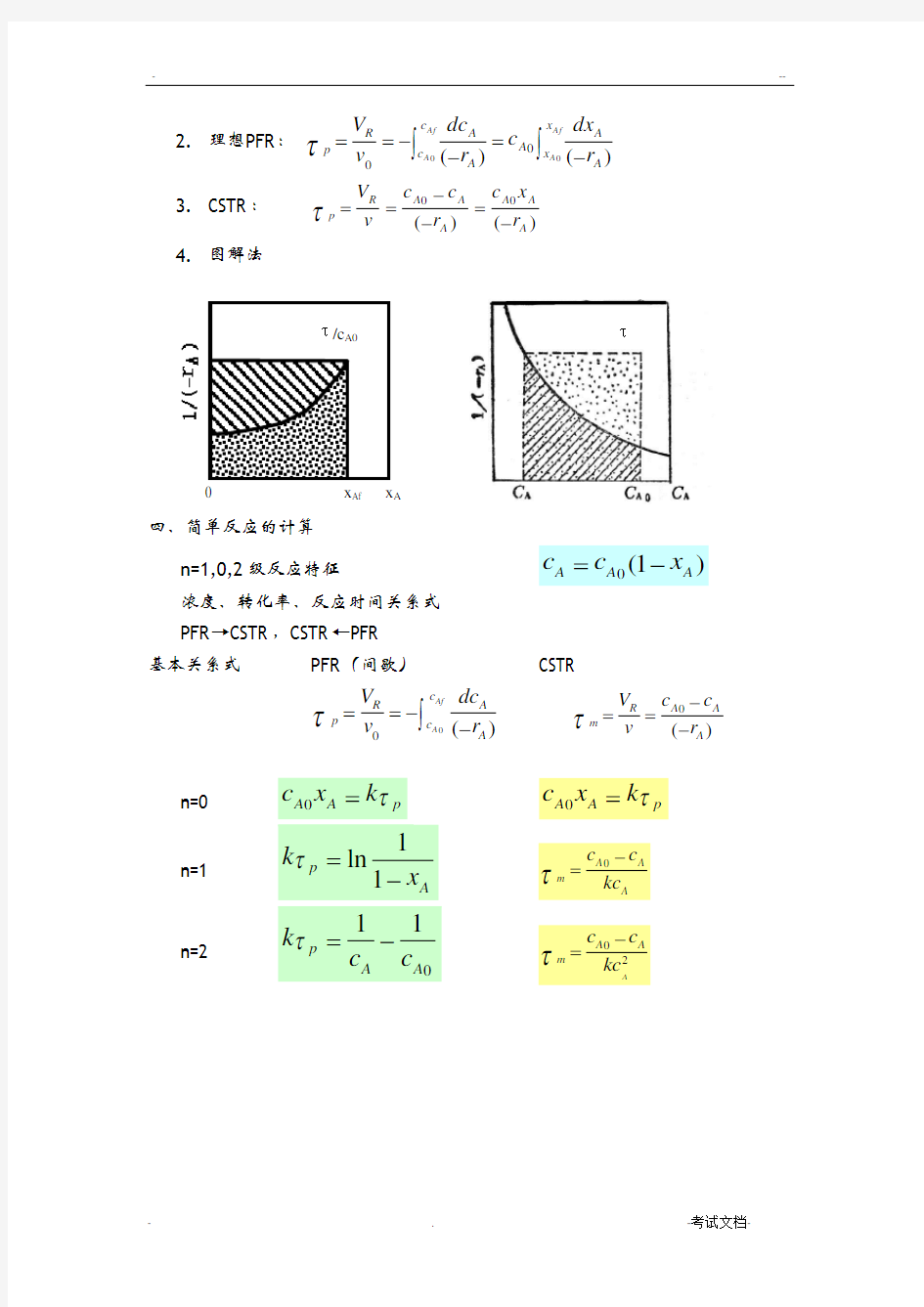
τ 4. 图解法
四、简单反应的计算 n=1,0,2级反应特征
0(1)A A A c c x =-
浓度、转化率、反应时间关系式
PFR →CSTR ,CSTR ←PFR
基本关系式
PFR (间歇)
CSTR 00
()Af A c R A p
c A V dc v r τ
==--?
0()
A A
R m A c c V v r τ-=
=-
n=0
0A A p c x k τ=
0A A p c x k τ=
n=1
1
ln
1p A k x τ=-
0A A
m A
c c kc τ-=
n=2 0
11p A A k c c τ=-
02
A
A A
m c c kc τ-=0 x Af x A
τ/c A0 τ
五、可逆反应 A
P
)()(02121A
A A P A A C C k C k C k C k r --=-=-
))((21Ae A C C k k -+=
)()(021A Ae A x x C
k k -+=
温度效应: 浓度效应:
?=-0)(A r ]
)
1(ln[10201
2A A
eq x x k k R E E T --= ])
x (x k k E E ln[R E E A A opt --=110201212
PFR 积分式
CSTR :由基本方程导出 六、平行反应
2
11
211n A
n A n A
S P P C k C k C k r r r +=+=β, k 1
k 2 P (主反应) S (副反应)
Af
A
C
C A
Af
A
pf
C
C
dC
C
C
C Af
A
-
-
=
-
=
?
β
β
()
A
A
C
p
P
pf A
C
A A
dC
r
C dC
r dC
ββ
==-=-
-
?温度效应:温度升高有利于活化能大的反应
浓度效应:浓度升高有利于级数大的反应
计算:由基本方程PFR、CSTR推出
①反应器选型与组合优化:
β~C A曲线——对应面积=C P
β~X曲线——对应面积=C P/C A0
②最优加料方式:p163-164
平行反应
P 1
1
1
m
B
n
A
p
C
C
k
r=
A+B
S 2
2
2
m
B
n
A
s
C
C
k
r=
七、串联反应
A P S
k1k2
A A C k r 1)(=-
P A P C k C k r 21-=
P S C k r 2=
温度效应:温度升高有利于活化能大的反应(同平行反应)
浓度效应:凡是使A P C C /增大的因素对串连反应选择率总是不利的。 ①串联反应的计算
PFR
CSTR t k A A e C C 10-=
物料衡算
)e e (C k k k C t k t k A P 2101
21
---=
- S P A A 0
②串联反应的最优反应时间、转化率与最大收率
PFR
CSTR
1
21
2ln
k k k k opt
-=τ
2
11k k opt =
τ
opt
k opt e
x τ11--=
opt opt opt k k x ττ111+=
1
22)(2
10
max ,max k k k A p k k c c -==
?
221
1
20
max ,max ]1)[(1+=
=
k k c c A p ?
八、自催化反应 A +P P +P
P A A C kC r =-)(
2
2
)
(0
0P
A
T
opt
A
C
C
C
C
+
=
=
0T
P
A
P
A
C
C
C
C
C=
+
=
+
P
P
A
A
T C
C
C
C
kt
C
/
/
ln
==
九、变分子反应
①空速SV的物理意义与因次
②膨胀率的定义
1
=
=
=
-
=
A
A
A
x
x
x
A V
V
V
ε
③膨胀因子的物理含义
a
b
a
s
p
A
)
(
)
(+
-
+
=
δ
④变分子反应中停留时间t与空时τ的大小关系十、循环反应器的计算
v
v
R R
=
反
应
器
组
合
优
化
R
RC C C Af
A A ++=
101
?-+-==τAf A C C A
A
r dC R v V 1)()1(0 十一、返混
1. 不同年龄的物料相互之间的混合——返混(CSTR )
相同年龄的物料相互之间的混合——混合(间歇反应器) 2. 返混的起因:①空间上的反向流动②不均匀的速度分布 3. 返混的结果:反应器的浓度变化(↑↓P A C C ) 4. 改善措施:分割——横向分割和纵向分割 5. )(t f 和)(t F 含义 6. 数学期望-
t 与方差2t
σ
无因次方差2
2
2
-=
t
t σσθ
7. CSTR
-
--=t
t
e
t
t f 1
)(
t t e t F --=1)( 12=θσ
PFR
)(t f 和)(t F
02=θσ
8. 固相反应的计算
dt t f c t c c c A A A A
)()(000?∞-
= ?∞
-
=0
)()(dt t f t x x A A
9. 微观混合对反应结果的影响
(1) 大于一级的反应,上凹曲线,不利
(2) 小于一级的反应,下凹曲线,有利
绝热温升,()A b
ad P
H c T c ρ-??=
3
121Re Sc A Sh =
十五、热量传递与反应器的热稳定性
1.定态条件r
g
Q
Q=热稳定条件g r
s s
dQ dQ
dT dT
<
2.放热曲线与移热曲线,影响因素。多态—A、B、C点的稳定性
3.最大允许温差
E
RT
T
T
T
c
2
max
)
(=
-
=
?
第二份:
优化的经济指标:1.技术上是可行的;2.经济上的合理的;3.生产的安全程度。生产成本中原料费用比例大小已成为现代工业生产过程先进性的重要标志。
三个决策变量:1.结构变量;2.操作方式。3.工艺条件。
反应器的操作方式按其操作连续性可以分为间歇操作,连续操作和半连续操作。工业反应过程开发就其核心问题而言,需要解决三方面的问题;1.反应器的合理选型;2.反应器操作的优选条件;3.反应器的工程放大。
均相反应应当满足的两个条件(P26):1.反应系统可以成为均相;2.预混合过程的时间远小于反应时间.
活化能的工程意义是反应速率对反应温度敏感程度的一种度量。活化能越大,表
明反应速率对温度变化愈敏感,即温度的变化会使反应反应速率发生较大的变化。(P31)
反应级数的工程意义是表示反应速率对于反应物浓度变化的敏感程度。反应级数的高低并不单独决定反应速率的大小,但反应了反应速率对浓度的敏感程度。级数越高,浓度变化对反应速率的影响越大。(P34)
反应器设计基本方程:反应器设计的基本方程包括反应动力学方程式。物料衡算方程式、热量衡算方程式和动量衡算方程式。反应动力学方程式是化学反应器设计的基础。P59
自催化反应指的是反应产物本身具有催化作用,能加速反应的进行。
自催化反应的特性是自催化反应必须加入微量产物才能启动。
平行反应选择率的温度效应是:提高温度有利于活化能高的反应;反之,降低温度则有利于活化能低的反应。
平行反应选择率与反应物浓度的关系:提高反应物浓度C A,有利于级数高的反应;反之,降低反应物浓度C A,则有利于级数低的反应。
空时、空速和停留时间:
空时又称空间时间,其定义为反应器体积V R与流体进反应器的体积流量v0的比值。
空速是空时的倒数,其物理意义是单位时间单位反应器体积所能处理进口物料的体积。
停留时间指的是反应物料从进入反应器时算起到离开反应器时为止所经历的时间。
表征反应前后分子数变化程度的方法有膨胀率法和膨胀因子法。
膨胀率的定义:是反应组分A全部转化后系统体积变化的分率。
膨胀因子:是原料A消耗1摩尔时,反应系统总物质的量的变化。
返混:停留时间不动的物料之间的混合,称为逆向混合或返混。
返混的原因:1.设备中存在不同尺度的环流;2.不均匀的速度分布。主要措施是分割。
1停留时间分布的表达有停留时间分布密度和停留时间分布函数。
2停留时间分布密度,以f(x)来表达。其定义为,在定常条件下的连续流动系统中,对于某一瞬间t=0时流入反应器的物料,在反应器出口流体物料中停留时间介于t与t+dt之间的物料所占的分率应为f(t)dt。
3停留时间分布函数,以F(t)表示。其定义为,在定常态下的连续流动系统中,相对于t=0瞬间流入反应器的物料,在反应器出口物料流中停留时间小于t的物料所占的分率。
4停留时间分布的实验测定:停留时间分布通常由实验测定,主要方法是应答技术,即用一定的方法将示踪物加入反应器进口,然后在反应器出口物料中检测示踪物的信号,以获得示踪物在反应器中停留时间分布规律的实验数据。
5示踪物的输入方法有阶跃注入法、脉冲注入法及周期输入法等。
6示踪物的基本要求:1.示踪物必须与进料具有相同或非常接近的流动性能,两者应具有尽可能相同的物理性质。2.示踪物要具有易于检测的特殊物质,而且这种物质的检测愈灵敏、愈简捷,试验结果就越精确。3.示踪物不能与反应物料发生化学反应或被吸附,否则就无法进行对示踪物的物料衡算。4.用于多相系统检测的示踪物不发生由一相转移到另一相的情况。
连续反应过程的考察方法:
在同一个连续釜式反应器中分别进行均相反应和固相反应采用的是完全不同的两种分析方法。两种方法的根本区别在于考察的对象不同;均相反应是以反应器作为考察对象,而固相反应则以反应物料为考察对象。
滴际混合:是指液滴合并、再分散过程起到了液滴之间的相互混合的作用,称为滴际混合。
扩散模型:
扩散模型是一种适合于返混程度较小的非理想流动的流动模型。所谓扩散模型即是仿照一般的分子扩散系数来表征反应器的质量传递,用一个轴向有效扩散系数D e来表征一维的返混。也就是把具有一定返混的流动简化为在一个平推流流动上叠加一个轴向的扩散。它是基于如下的基本假设:
1.沿着与流体流动方向垂直的每一个截面上具有均匀的径向浓度;
2.在每一个截面上和沿流体流动方向,流体速度和扩散系数均为一恒定值
3.物料浓度是流体流动距离的连续函数。
多级全混流模型
多级全混流模型是假设一个实际设备中的返混情况等效于若干级全混釜串联式的返混。
化学反应工程研究的目的是实现工业化学反应过程的优化。所谓优化,就是在一定的围,选择一组优惠的决策变量,使过程系统对于确定的目标达到最优状态。工业反应过程的经济收益是评价生产过程的主要优化目标。
1.自催化反应的优组合(CSTR+PFR)
答:最优反应器组合是先用一个全混流反应器,控制在最大速率点处操作,然后
接一个平推流反应器,达到高转化率以充分利用原料。 2.串联反应,应选择怎样的反应器?
答:返混对于串联反应工程的选择率是不利因素,因而平推流反应器或多级串联全混流反应器的选择率总是优于全混流反应器。(任何使反应器反应器C p 增大和原料C A 减小的措施者不利于串联过程选择率的提高。)(PFR 或间歇反应器)
1.气固催化反应步骤(在多孔性催化剂上进行的)P209 答:①反应物从气流主体扩散到催化剂颗粒外表面
②反应物从颗粒外表面经催化剂的孔扩散到颗粒的表面 ③反应物在颗粒表面上进行化学反应 ④反应产物从孔深处的孔口逆向扩散
⑤反应产物从催化剂外表面扩散打返回气流主体 2.三种温度和三种浓度。P210
答:三种温度:(1)流体主体的温度Tb ;(2)催化剂颗粒外表面上温度T es ;(3)催化剂颗粒表面上的温度Tis
三种浓度:(1)流体主体中的浓度Cb;(2)催化剂颗粒外表面上浓度Ces ;(3)催化剂颗粒表面上的浓度Cis
只有当外传递的阻力降低到很低以至可以忽略不计时,上述三个温度和浓度才会趋于一致,即Cb ≈Ces ≈Cis; Tb ≈T es ≈Tis. 3.极限反应速率和极限传质速率。
答:(1)n b kC r =-lim )( ()lim r -为极限反应速率。其物理意义是传质过程影响可以忽略不计时的反应速率,是气固催化反应是所能达到的最大的可能反应速
率。
(2)N lim =k g aC b N lim 为极限传质速率
颗粒外部传质速率:()es b g C C a k N -= 在气流主体浓度Cb 恒定条件下,当Ces 趋于0时,传质速率趋于它的极限值N lim 。
4.达姆克勒准数的物理意义:lim lim )(N r ac k kC Da b g b
n -=
=极限反应速率与极限传质速率之比。
5.准数(西勒准数)是表征扩散过程对化学反应影响的一个重要参数,其物理意义: 极限颗粒内扩散速率
极限反应速率
=
?
??? ?
?=
Φp b e p
n b r C D r kC 33
Φ值大,意味着极限反应速率大于极限颗粒扩散速率,扩散影响大。反之,扩散影响小。
1.热稳定性和参数灵敏性的概念。P266
答:(1)参数灵敏性指的是个有关参数如流量,进口温度和冷却介质温度等微小调整时,反应器温度或反应结果变化的多少。 (2)热稳定性:
两者区别:热稳定性是对微小的短暂扰动而言的,参数灵敏性则是对对微小的但是持久的调整而言的。
2.催化剂颗粒要维持定态操作就必须使颗粒表面上的反应放热速率等于颗粒向周围流体的传热速率,这就是催化剂颗粒温度的定态条件。
3. 定态稳定条件 dT
dQ dT dQ g
r > 即移热线的斜率大于放热线的斜率是定态稳
定的必要条件,称为斜率条件.