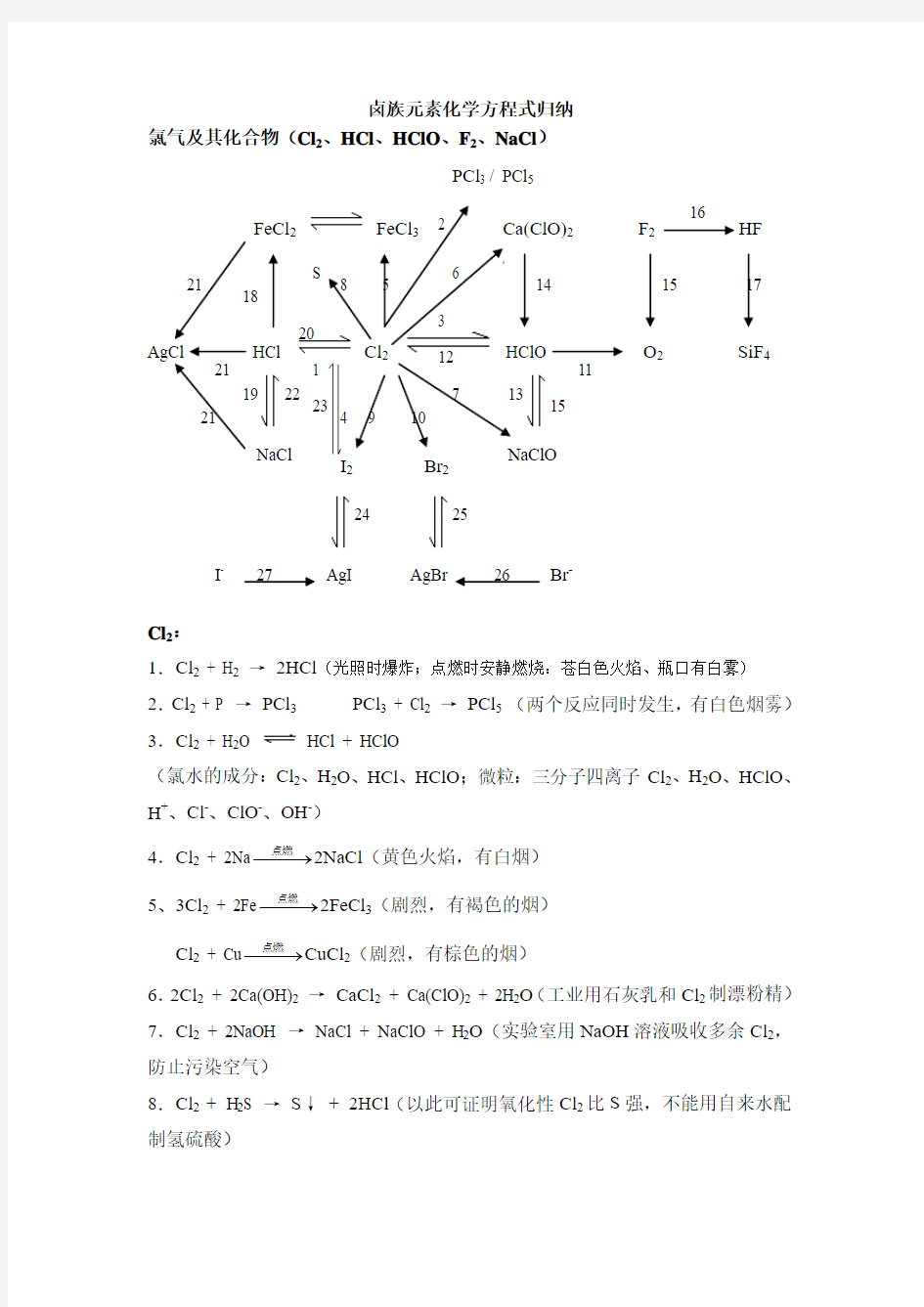

卤族元素化学方程式归纳
氯气及其化合物(Cl 2、HCl 、HClO 、F 2、NaCl )
FeCl 2 FeCl 3 Ca(ClO)2 F 2 HF
AgCl HCl Cl 2 HClO O 2 SiF 4
Cl 2:
1.Cl 2 + H 2 → 2HCl (光照时爆炸;点燃时安静燃烧:苍白色火焰、瓶口有白雾) 2.Cl 2 + P → PCl 3 PCl 3 + Cl 2 → PCl 5 (两个反应同时发生,有白色烟雾) 3.Cl 2 + H 2O
HCl + HClO
(氯水的成分:Cl 2、H 2O 、HCl 、HClO ;微粒:三分子四离子Cl 2、H 2O 、HClO 、H +、Cl -、ClO -、OH -)
4.Cl 2 + 2Na ??→?点燃
2NaCl (黄色火焰,有白烟) 5、3Cl 2 + 2Fe ??→?点燃
2FeCl 3(剧烈,有褐色的烟) Cl 2 + Cu ??→?点燃
CuCl 2(剧烈,有棕色的烟) 6.2Cl 2 + 2Ca(OH)2 → CaCl 2 + Ca(ClO)2 + 2H 2O (工业用石灰乳和Cl 2制漂粉精) 7.Cl 2 + 2NaOH → NaCl + NaClO + H 2O (实验室用NaOH 溶液吸收多余Cl 2,防止污染空气)
8.Cl 2 + H 2S → S ↓ + 2HCl (以此可证明氧化性Cl 2比S 强,不能用自来水配制氢硫酸)
NaCl NaClO
I 2 Br 2 S
AgI
AgBr
PCl 3 / PCl 5
1
3
4 2 6
8
5
11
12
9 10
7
13
14
15 15
20
18
21 19 23 21 21
24
25 I -
Br -
26
27 16
17
22
9.Cl 2 + 2KI → I 2 + 2KCl (用湿润的KI 淀粉试纸变蓝色检验Cl 2) 10.Cl 2 + 2KBr → Br 2 + 2KCl
HClO :强氧化性(漂白性)、不稳定性、弱酸性
11.2HClO ??→?光照
2HCl + O 2↑ 12.HClO + HCl → Cl 2↑ + H 2O 13.HClO + NaOH → NaClO + H 2O
14.Ca(ClO)2 + 2CO 2 + 2H 2O → Ca(HCO 3)2 + 2HClO (漂粉精的漂白原理)
F 2:最活泼的非金属单质 15.2F 2 + 2H 2O → 4HF + O 2↑
16.F 2 + H 2 → 2HF (黑暗条件下爆炸,放出大量的热)
17.4HF + SiO 2 → SiF 4↑+ 2H 2O (HF 酸用塑料瓶保存,HF 酸可用来刻画玻璃) HCl :
18.Fe + 2HCl → FeCl 2 + H 2↑(注意与3Cl 2 + 2Fe ??→?点燃2FeCl 3区别) 19.HCl + NaOH → NaCl + H 2O
20.4HCl (浓)+ MnO 2 ?→?
?
MnCl 2 + Cl 2↑+ 2H 2O (实验室制氯气,盐酸一半作酸、一半作还原剂) 21.Cl - + Ag + → AgCl ↓ NaCl :
22.NaCl + H 2SO 4(浓)??→?微热NaHSO 4 + HCl ↑(实验室制HCl ) 23.2NaCl + 2H 2O ??→?电解2NaOH + H 2↑+ Cl 2↑(氯碱工业)
24.2AgI ??→?光照
2Ag + I 2(AgI 作人工降雨剂)
25.2AgBr
2Ag + Br 2(变色镜的原理)
26.Ag + + Br - → AgBr ↓(浅黄色,遇硝酸不溶解) 27.Ag + + I - → AgI ↓(黄色,遇硝酸不溶解)
光照 CuO
硫和氮化学方程式归纳
硫及其化合物(S 、H 2S 、SO 2、H 2SO 4) CuS
H 2S S
SO 2
SO 3
H 2SO 4
S :
1.S + 2Cu ?→?
?
Cu 2S(黑色) 2.S + 2Na ?→?
? Na 2S 3.S + Fe ?→?
? FeS(黑色) 4.S + Hg → HgS (用硫粉处理散落的汞滴)
5.S + H 2 ?→?
? H 2S 6.S + O 2 ??→?点燃
SO 2(淡蓝色火焰)或S + 2H 2SO 4(浓)?→??
3SO 2↑ + 2H 2O (黑火药:S + 2KNO 3 + 3C ??→?点燃
K 2S + N 2↑+ 3CO 2↑) H 2S :
7.H 2S ?→?
?
S + H 2 (不稳定性) 2H 2S + O 2 → 2H 2O + 2S ↓(氢硫酸敞开放置变质) H 2S+H 2SO 4(浓) → 2H 2O + SO 2↑ + S ↓
2H 2S+O 2 ??→?点燃 2H 2O + 2S (不完全燃烧); 2H 2S+3O 2 ??→?点燃
2H 2O + 2SO 2(完全燃烧) 8.H 2S + 2NaOH → Na 2S + 2H 2O (氢硫酸的酸性) 9.H 2S + Pb(AC)2 → 2HAC+PbS ↓(硫化氢气体的检验) 10.H 2S + CuSO 4 → H 2SO 4+CuS ↓(硫化氢气体的吸收)
Na 2S
Cu 2S
FeS HgS H 2SO 3 HCl
FeSO 4 Na 2SO 4 BaSO 4
22Cu 、23C 、24S 14O 2
4 3 2 1
5 6
7
8 9 10⑨11⑨12⑨18
19 20 21
PbS
11.FeS + H 2SO 4(稀) → FeSO 4 + H 2S ↑(硫化氢气体的实验室制法) SO 2:
12.SO 2 + 2H 2S → 3S + 2H 2O (现象:瓶壁上有黄色粉末和小水珠生成)
13.SO 2 + H 2O H 2SO 3(酸雨的形成,pH<5.6)
14.2H 2SO 3 + O 2 → 2H 2SO 4(酸雨放置一段时间酸性增强,pH 减小)
15.2SO 2+O 2
2SO 3
16.SO 2 + Cl 2 + H 2O → H 2SO 4 + 2HCl (SO 2与Cl 2等体积混合不具有漂白性) 17.SO 2 + Br 2 + H 2O → H 2SO 4 + 2HBr (SO 2使溴水褪色) H 2SO 4:
18.H 2SO 4 + Fe → FeSO 4 + H 2↑ 19.H 2SO 4 + 2NaOH → Na 2SO 4 + 2H 2O 20.H 2SO 4 + BaCl 2 → BaSO 4↓+ 2HCl
(SO 42-的检验:取样,先加盐酸无现象,再加BaCl 2有白色沉淀,Ba 2++SO 42-→BaSO 4↓)
21.H 2SO 4(浓)+ NaCl ??→?微热NaHSO 4 + HCl ↑(浓硫酸的难挥发性,制易挥发性的酸)
22.2H 2SO 4(浓)+ Cu ?→?
?
CuSO 4 + SO 2↑ + 2H 2O (一半作酸,一半作氧化剂) 23.2H 2SO 4(浓)+ C ?→?
? CO 2↑ + 2SO 2↑ + 2H 2O (2mol 全部作酸用) 24.S + 2H 2SO 4(浓) ?→?
?2H 2O + 3SO 2↑(SO 2既是氧化产物、又是还原产物,1:2)
氮及其化合物(N 2、NH 3、NH 4+、NO )
N 2:
1.N 2 + 3Mg ??→?点燃 Mg 3N 2
2.N 2 + 3H 2
2NH 3
3.N 2 + O 2 ??→?放电 2NO NH 3:
4.NH 3 + H 2O
NH 3?H 2O
NH 4+
+ OH -
(显弱碱性,使酚酞变红色)
5.4NH 3 + 5O 2 ??→?32O Cr 4NO + 6H 2O (氨的催化氧化,现象是:催化剂继续保持红热,
有红棕色气体生成,有水生成)
6.NH 3 + HCl → NH 4Cl (白烟)
7.4NH 3 + 3O 2 → 2N 2 + 6H 2O(在纯氧中燃烧) 2NH 3(适量) + 3Cl 2 → N 2 + 6HCl
8NH 3(过量) + 3Cl 2 → N 2 + 6NH 4Cl (用浓氨水检验Cl 2管道是否有泄露) NH 4+:
8.2NH 4Cl + Ca(OH)2?→?
?
2NH 3↑ + CaCl 2 + 2H 2O (NH 3的实验室制法) NH 4Cl ?→?
?
NH 3↑ + HCl ↑(铵盐不稳定,受热易分解) NH 4+的检验:取样,加入NaOH 溶液,加热试管,用湿润的红色石蕊试纸放在试管口,若变蓝色,则含NH 4+。 9. 2NO+O 2 → 2NO 2(红棕色) 10.3NO 2 + H 2O → 2HNO 3 + NO
(雷雨促庄稼N 2+O 2??→?放电2NO 2NO+O 2→2NO 2 3NO 2+H 2O →2HNO 3+NO ) 4NO 2+O 2+2H 2O → 4HNO 3 4NO+3O 2+2H 2O → 4HNO 3
NH 4+ NO 2 HNO 3
NH 3?H 2O
Mg 3N 2 1
2
4
5
6
8 9
10
10
4
高温、高压
催化剂
铁及其化合物(Fe 、Fe 2+、Fe 3+)
Fe :(只有还原性,变价金属,氧化产物可显+2,+3价) 1.2Fe + 3Cl 2??→?点燃 2FeCl 3(剧烈,有褐色的烟) 2.2Fe + 3Br 2 → 2FeBr 3
3.S + Fe ?→?
?
FeS (黑褐色固体,难溶于水,可溶于强酸得H 2S 气体) 4.3Fe + 2O 2??→?点燃 Fe 3O 4(剧烈,火星四射,可写成FeO ?Fe 2O 3形式) 5.Fe + 2HCl → FeCl 2 + H 2↑(Fe + 2H + → Fe 2+ + H 2↑ ) 6.Fe + 4HNO 3(稀硝酸)→ Fe(NO 3)3 + NO ↑ + 2H 2O 7.Fe + CuSO 4 → Cu + FeSO 4
8.3Fe + 4H 2O (g)??→?高温 Fe 3O 4 + 4H 2
Fe 2+:(既有氧化性、又有还原性) 9.Zn + FeSO 4 → Fe + ZnSO 4 10.2FeCl 2 + Cl 2 → 2FeCl 3 11.2Fe 2+ + Br 2 → 2Fe 3+ + 2Br -
Fe 2+
Fe
5 HCl
Fe 3+
3S 10Cl 2 、11 Br 2 、12HNO 3
7Cu 2+
1Cl 2 2 Br 2
6 HNO 3
9 Zn
14Fe 、15Cu 、16 S 2-、17I -
24 O 2
19CO
18Al
Fe 3O 4
4 O 2 8 H 2O Fe(OH)3
Fe(OH)2 13OH -
20OH - 21 H + 22 H + 23 Δ
12.3Fe2+ + 4 H+ + NO3-→3Fe3+ + NO↑+ 2 H2O
(Fe2+、4 H+、NO3-三者不能共存,若为浓硝酸,则为NO2)13.Fe2+ + 2OH- →Fe(OH)2↓(白色沉淀)
(氨水也可,离子反应为:Fe2+ + 2 NH3?H2O→Fe(OH)2↓+ 2NH4+)
Fe3+:(只有氧化性)
14.Fe + 2 Fe3+→3Fe2+
15.Cu + 2 Fe3+→2Fe2+ + Cu2+(FeCl3用于电路板的腐蚀)
16.2Fe3+ + S2- →2Fe2+ + S(Fe3+有氧化性,不与S2-共存)
17.2Fe3+ + 2 I- →2Fe2+ + I2(Fe3+有氧化性,不与I-共存)
18.2Al + Fe2O3?
?高温2Fe + Al2O3(铝热反应)
?→
19.Fe2O3 + 3CO?
?高温2Fe + 3CO2(铁的冶炼,原料:赤铁矿、焦炭、空气、石灰石)
?→
20.Fe3+ + 3OH- →Fe(OH)3↓(红褐色沉淀)
(氨水也可,离子反应为:Fe3+ + 3 NH3?H2O→Fe(OH)3↓+ 3NH4+)
Fe(OH)2和Fe(OH)3:
21.Fe(OH)2 + 2 H+→Fe2++ 2 H2O
22.Fe(OH)3 + 3 H+→Fe3++ 3 H2O
??Fe2O3 + 3 H2O(制铁红颜料Fe2O3)
23.2Fe(OH)3 ?→
24.4Fe(OH)2 + O2 + 2 H2O →4Fe(OH)3(在FeSO4溶液中加入NaOH,先有白色沉淀,后灰绿色,最后变为红褐色)
Fe2+和Fe3+的检验:
25.Fe2+的检验:
法一:先加入KSCN溶液,无血红色,滴加氯水(Cl2)有血红色;(常用方法)法二:加入NaOH溶液,先有白色沉淀,后灰绿色,最后变为红褐色。
26.Fe3+的检验:
法一:先加入KSCN溶液,有血红色;(常用方法)
法二:加入NaOH溶液,有红褐色沉淀生成。
铝及其化合物(Al ,Al 2O 3,Al(OH)3)
Al :(两性金属:既可以和强酸反应,又可以和强碱溶液反应) 1.2Al + 3Cl 2??→?点燃 2AlCl 3
2.4Al + 3O 2→ 2Al 2O 3(常温下缓慢生成致密的氧化膜,与汞形成合金时“毛刷”现象) 3.2Al + 3S → 2Al 2S 3
(干燥环境制备,Al 2S 3极易水解, Al 2S 3 + 6H 2O → 2Al(OH)3↓+ 3H 2S ↑) 4.2Al + Hg(NO 3)2→ 2Hg + Al(NO 3)3 5.2Al + 6HCl → 2AlCl 3 + 3H 2↑
6.2Al + Fe 2O 3??→?高温2Fe + Al 2O 3 + Q (Al 和Fe 2O 3混合物为铝热剂,反应放出大量的热,主要用于冶炼难熔金属钒、铬、锰和野外焊接铁轨)
7.2Al + 6H 2O ?→?
?
2Al(OH)3 + 3H 2↑ 8.2Al + 2H 2O + 2NaOH → 2NaAlO 2 + 3H 2↑(Al 表面有大量气泡,反应后溶液
静置变澄清,Al 先和水反应;方程式可写成:
2O+ 2NaOH → 2NaAlO 2 + 4H 2O +3H 2↑,注意氧化剂、还原剂及电子转移的标注) Al 2O 3:(两性氧化物,难溶于水) 9.Al 2O 3 + 6HCl → 2AlCl 3 + 3 H 2O 10.Al 2O 3 + 2NaOH → 2NaAlO 2 + H 2O
Al 2O 3
13HCl
5 HCl
9 HCl
Al
Al(OH)3
AlCl 3
2 O 2, 6 Fe 2O
3 12 Δ 3 S,Δ
Al 2S 3
1 Cl
2 Hg
4 Hg(NO 3)2 1
5 NaOH
16 NH 3?H 2O
两性
11.2Al 2O 3 ??→?电解4Al +3O 2↑(工业冶炼Al 的反应)
12.2Al(OH)3 ?→?
?
Al 2O 3 + H 2O (Al 2O 3的制备) Al(OH)3:(两性,电离方程式为:H + + AlO 2- + H 2O Al(OH)3
Al 3+ +3OH -)
13.Al(OH)3 + 3HCl → AlCl 3 + 3 H 2O 14.Al(OH)3 + NaOH → NaAlO 2 + 2H 2O
15.AlCl 3 + 3 NaOH → Al(OH)3↓ + 3NaCl (适量NaOH )
16.AlCl 3 + 3 NH 3?H 2O → Al(OH)3↓ + 3NH 4Cl (Al(OH)3的实验室制备) 17.NaAlO 2 + HCl + H 2O → Al(OH)3↓ + NaCl (适量HCl ) 18.NaAlO 2 + CO 2 + 2H 2O → Al(OH)3↓ + NaHCO 3 (过量CO 2) 互滴讨论(过量与少量问题): 1.Al 3+ 与OH -的反应 1)OH -逐滴加入到Al 3+中 先:Al 3+ + 3 OH -→ Al(OH)3↓ 后:Al(OH)3 + OH - →AlO 2- + 2H 2O 2) Al 3+逐滴加入到OH -中 先:Al 3+ + 4OH -→AlO 2- + 2H 2O
后:Al 3+ + 3AlO 2- + 6H 2O → 4Al(OH)3↓ 3)Al 3+ 与NH 3?H 2O 反应
现象无区别,均产生沉淀,不消失。Al 3++ 3 NH 3?H 2O → Al(OH)3↓ + 3NH 4+ 2.AlO 2-与H +的反应 1)H +逐滴加入到AlO 2-中
先:AlO 2- + H + + H 2O → Al(OH)3↓ 后:Al(OH)3 + 3H + → Al 3+ + 3H 2O 2)AlO 2-逐滴加入到H +中 AlO 2- + 4 H + →Al 3+ + 2H 2O
Al 3+ + 3AlO 2- + 6H 2O → 4Al(OH)3↓ 3)AlO 2-与CO 2(过量或少量)的反应
现象无区别,均产生沉淀,不消失。AlO 2-+ CO 2 + 2H 2O → Al(OH)3↓ +HCO 3- Al 3+的检验:取样逐滴滴加NaOH ,先有白色沉淀,后沉淀减少或消失,则含Al 3+。
冰晶石
V(NaOH)
m(Al(OH)3
)
V(AlCl 3)
m(Al(OH)3
)
V(HCl)
m(Al(OH)3
)
V(NaAlO 2)
m(Al(OH)3
)
两性
有机化学反应方程式书写及反应类型
1.CaC 2 + 2H 2O → Ca(OH)2 + C 2H 2↑(水解反应)
2.
3.CH ≡CH + 2H 2
??→?Ni CH 3-CH 3
4. CH ≡CH + HCl ???→?催化剂
CH 2=CHCl (加成反应)
5. (加聚反应) 6 .
7.CH 2=CH 2 + H 2
???→?催化剂
CH 3-CH 3(加成反应)
8.
9. CH 2=CH 2 + HCl ???→?催化剂
CH 3-CH 2Cl 10. CH 2=CH 2 + H 2O ???→
?催化剂 CH 3-CH 2OH (加成)
11. (加聚反应) 12. CH 3-CH 3 + Cl 2
??→?光照
CH 3-CH 2Cl + HCl (取代反应)
13. CH 3CH 2OH CH 2=CH 2↑+ H 2O (消去反应) 14 .CH 3CH 2OH C 2H 5OC 2H 5 + H 2O (取代反应) 15 .CH 3CH 2OH + 2Na → 2C 2H 5ONa + H 2↑ (置换反应)
16.2 CH 3CH 2OH + O 2?→??
2CH 3CHO + 2H 2O (氧化反应) 17.2CH 3CHO + O 2??
→?催化剂
2CH 3COOH (氧化反应) 18.CH 3CHO + 2Cu(OH)2?→?
?
CH 3COOH + Cu 2O ↓+2H 2O (氧化反应) 19.CH 3CHO + H 2??
→?催化剂
CH 3CH 2OH (还原反应 / 加成反应) 20.CH 3COOH + CH 3CH 2OH ??
→?浓硫酸
+ H 2O (酯化反应 / 取代反应)
Cu
Δ
(加成反应)
硫及其化合物性质
氮及其化合物性质高温、高压
氯及其化合物性质
铁、铝化学方程式 一、铁 1.与O 2反应:3Fe+2O 2??→?点燃 Fe 3O 4 2.与Cl 2反应:2Fe+3Cl 2??→?点燃 2FeCl 3 3.与Br 2反应:2Fe+3Br 2??→?点燃 2FeBr 3 4.与I 2反应:Fe+I 2??→?点燃 FeI 2 5.与S 反应:Fe+S ?→?? FeS +Q 6.加热下与浓H 2SO 4反应:2Fe+6H 2SO 4(浓)?→?? 2Fe 2(SO 4)3+3SO 2↑+6H 2O 7.加热下与稀HNO 3反应:Fe+4HNO 3?→? ? Fe(NO 3)3+NO ↑+2H 2O 8.高温下与水蒸气反应:3Fe+4H 2O(g)??→?高温Fe 3O 4+4H 2↑ 二、铁的氢氧化物 (一)Fe(OH)2 8.被氧气氧化:4Fe(OH)2+O 2+2H 2O →4Fe(OH)3 9.制取:FeSO 4+2NaOH →Na 2SO 4+Fe(OH)2↓ (二)Fe(OH)3 10.受热分解:2Fe(OH)3?→? ? Fe 2O 3+3H 2O 11.制取:Fe 3++OH —→Fe(OH)3↓ 三、铁盐和亚铁盐 (一)Fe 2+ 12.和Cl 2反应:Fe 2++ Cl 2→2Fe 3++2Cl — 13.和H 2O 2反应:2H ++2Fe 2++H 2O 2→2Fe 3++2H 2O (二)Fe 3+ 14.和Fe 反应:2Fe 3++Fe →3Fe 2+ 15.和Cu 反应:Fe 3++Cu →Cu 2++Fe 2+ 16.和I —反应:2Fe 3++2I —→2Fe 2++I 2
17.和SCN—反应:Fe3++3SCN— Fe(SCN)3
第五章 评说硫、氮的功与过化学方程式总结 1. S +K 2S +3CO 2↑+N 2↑(黑火药爆炸) 2. 3. 2Cu 4. Hg +S HgS 5. H 2+S 2S 6. S +O 2 (在氧气中发出蓝紫色火焰) 7. 2H 2S +3O +2H 2O (发出淡蓝色火焰) 8. 2H 2S +O 2(不足)2S +2H 2O (H 2S 不完全燃烧) 9. 2H 2S +SO 2 3S +2H 2O 10. H 2S + CuSO 4 = CuS ↓(黑)+ H 2SO 4 (检验H 2S ) 11. H 2S + Pb(NO 3)2 = PbS ↓(黑)+ 2HNO 3 (检验H 2S ) 12. SO 2+H 2O H 2SO 3 (二元中强酸) 13. 2H 2SO 3+O 22H 2SO 4 14. 2SO 2 + O 2 催化剂 加热 2SO 3 (SO 2的催化氧化) 15. SO 3+H 2O H 2SO 4 16. SO 2 + Br 2 + 2H 4 + 2HBr (使溴水或高锰酸钾溶液褪色) 17. NaCl +H 2SO 4(浓) 4+HCl ↑ 18. NaNO 3 + H 2SO 4+HNO 3↑ 19. Cu +2H 2SO 4(浓) CuSO 4+SO 2↑+2H 2O 剧烈反应,铜片表面产生气泡,溶液变成绿色,品红溶液褪色 20. C + 2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O 21. BaCl 2 + H 2SO 4BaSO 4↓+2HCl 22. BaCl 2 + Na 2SO 4BaSO 4↓+2NaCl 23. BaCl 2 + Na 2CO 3BaCO 3↓+2NaCl 24. BaCO 3 +2HCl BaCl 2+H 2O +CO 2↑ 25. Ba 2+ + SO 42- BaSO 4↓ 在实验室里检验溶液中是否含有SO 42-时,常常先用盐酸把溶液酸化,以排除CO 32- 、SO 32-、Ag +等干扰,再加入BaCl 2溶液,如果有白色沉淀出现,则说明原溶液中肯定存在SO 42-。
高中有机化学方程式总结 一、烃 1.甲烷 烷烃通式:C n H 2n -2 (1)氧化反应 甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。 (2)取代反应 一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2.乙烯 乙烯的制取:CH 3CH 2OH H 2 烯烃通式:C n H 2n (1)氧化反应 乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2(2)加成反应 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH 点燃 光 光 光 光 浓硫酸 170℃ 高温 催化剂 △ 图1 乙烯的制取
乙烯加聚,生成聚乙烯:n H 2 3.乙炔 乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2 (1)氧化反应 乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。 (2)加成反应 与溴水加成:HC ≡CH+Br 2 HC=CH B r CHBr=CHBr+Br 2 CHBr 2—CHBr 2 与氢气加成:HC ≡CH+H 2 H 2C=CH 2 与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2 n CH n 4.苯 苯的同系物通式:C n H 2n-6 (1)氧化反应 苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。 CH 2-CH 2 点燃 图2 乙炔的制取 催化剂 △ Br CH 2—CH Cl CH=CH 点燃
铝及其化合物的化学方程式和离子方程式 欧阳学文 一、铝 1、铝在氧气中燃烧:4Al+3O22Al2O3 2、铝在氯气中燃烧:2Al+3Cl22AlCl3 3、铝和硫共热:2Al+3S Al2S3 4、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑ 2Al+6H+2Al3++3H2↑ 5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑ 2Al+2OH-+2H2O2AlO2-+3H2↑ 6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O 7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2O Al+6H++3NO3-Al3++3NO2↑+3H2O 8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2O Al+4H++NO3-Al3++NO ↑+2H2O 8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3Ag Al+3Ag+Al3++3Ag
9、铝与硫酸铜溶液反应:2Al +3CuSO4Al2(SO4)3+3Cu 2Al +3Cu2+2Al3++3Cu 10、铝和氧化铁高温下反应:2Al +Fe2O3Al2O3+2Fe 11、铝和四氧化三铁高温共热:8Al +3Fe3O4 4Al2O3+9Fe 12、铝和氧化铜高温共热:2Al +3CuO Al2O3+3Cu 13、铝和二氧化锰高温共热:4Al +3MnO22Al2O3+3Mn 二、氧化铝 1、氧化铝与稀硫酸反应:Al2O3+3H2SO4Al2(SO4)3+3H2O Al2O3+6H +2Al3++3H2O 2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH 2NaAlO2+H2O Al2O3+2OH -2AlO2-+H2O 3、电解氧化铝的熔融液:2Al2O34Al +3O2↑ 三、氢氧化铝 1、氢氧化铝与稀硫酸反应:2Al(OH)3+3H2SO4Al2(SO4)3+6H2O Al(OH)3+3H +Al3++3H2O 2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH NaAlO2+2H2O Al(OH)3+OH -AlO2-+2H2O 3、加热氢氧化铝:2Al(OH)3Al2O3+3H2O 冰晶石 电解
高中化学镁铝铁知识归纳【知识网络】 一、镁及其化合物 相关化学方程式 2Mg+O 2 =2MgO 3Mg+N 2Mg 3 N 2 Mg+Cl 2MgCl 2 Mg+2H+=Mg2++H 2 ↑ Mg+2H 2O Mg(OH) 2 +H 2 ↑ 2Mg+CO 2 2MgO+C MgO+H 2O=Mg(OH) 2 MgO+2HCl=MgCl 2+H 2 O MgCl 2(熔融) Mg+Cl 2 ↑
Mg2++CO 32-=MgCO 3 ↓ MgCO 3+2H+=Mg2++CO 2 ↑+H2O MgCO 3+CO 2 +H 2 O=Mg(HCO 3 ) 2 MgCO 3+H 2 O Mg(OH) 2 +CO 2 ↑ Mg(OH) 2+2H+=Mg2++H 2 O Mg(OH) 2MgO+H 2 O Mg 3N 2 +6H 2 O=3Mg(OH) 2 ↓+2NH3↑ 二、铝及其化合物 相关化学方程式 4Al+3O 2=2Al 2 O 3 3S+2Al Al 2S 3 2Al+3Cl 22AlCl 3 2Al+6HCl=2AlCl 3+3H 2 ↑
2Al+6H 2O 2Al(OH)3+3H 2↑ 2Al+Fe 2O 3 Al 2O 3+2Fe 2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑ Al 2O 3+6HCl =2AlCl 3+3H 2O Al 2O 3+2NaOH =2NaAlO 2+2H 2O 2Al 2O 3(熔融) 4Al+3O 2↑ Al 3++3H 2O=Al(OH)3+3H + Al 3++3NH 3·H 2O=Al(OH)3↓+3NH 4+ Al 3++3OH -=Al(OH)3↓ Al 3+ +4OH -=AlO 2- +2H 2O Al 2S 3+6H 2O=2Al(OH)3↓+3H 2S ↑ Al(OH)3+3H + =Al 3+ +3H 2O Al(OH)3+OH -=AlO 2-+2H 2O AlO 2-+CO 2+2H 2O=Al(OH)3↓+HCO 3- AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+4H +=Al 3++2H 2O 3AlO 2-+Al 3++6H 2O=4Al(OH)3↓ 三、铁及其化合物
硫和氮的化学方程式 一、硫 1.硫与金属的反应 (1)硫与铜反应:2Cu+S → Cu2S (硫化亚铜,难溶于水的黑色固体) (2)硫与铁反应:Fe + S →FeS (硫化亚铁, 难溶于水的黑色固体) (3)硫还可以与钠、镁、铝等金属反应: 2 Na + S 研磨 Na2S Zn + S △ZnS Mg + S △MgS Hg + S △HgS 2Al + 3S △ Al2S3 2.硫与非金属的反应 (1)硫与氢气反应:H2 + S △ H2S (硫的氧化性) (2)硫与氧气反应:S + O2→SO2(硫的还原性) 3.硫与化合物反应 S + 2H2SO4 (浓) △ 3SO2↑+ 2H2O S + 6HNO3 (浓) △ 6NO2↑+ H2SO4 + 2H2O 3S + 6 NaOH→ 2Na2S + Na2SO3 + 3H2O S + 2KNO3+ 3C → K2S + N2↑+3CO2↑(黑火药) 4.硫的性质 硫是淡黄色晶体,俗称硫磺,不溶于水,微溶于酒精,易溶于二硫化碳 (CS2);由于硫易溶于二硫化碳,所以粘在试管上的硫可用二硫化碳除 去。硫在火山口以游离态形式存在。 5.硫的用途 (1)用于制造硫酸。 (2)用于制造黑火药、焰火、火柴。 (3)用于制造农药(如石灰硫黄合剂) (4)医学上用于制硫黄软膏。
二、硫化氢 (一)、气体性质 1.可燃性 (1)不完全燃烧:2H2S + O2→ 2H2O + 2S↓ (2)完全燃烧:2H2S + 3O2→ 2H2O + 2SO2 2.不稳定性 H2S→H2 + S(把H2S加热到300℃左右,就会分解) 3.强还原性 (1) H2S+Cl2→ S↓+2HCl 现象:H2S能使氯水褪色,并有淡黄色沉淀生成 (2) H2S+Br2→ S↓+2HBr 现象:H2S能使溴水褪色,并有淡黄色沉淀生成 (3) H2S+I2→ S↓+2HI 现象:H2S能使碘水褪色,并有淡黄色沉淀生成 (4) 5H2S+2KMnO4+3H2SO4→ K2SO4+2MnSO4+5S↓+8H2O 现象:H2S能使酸性KMnO4溶液褪色,并有淡黄色沉淀生成 (5) H2S+H2SO4(浓) →S↓+SO2↑+2H2O 现象:有淡黄色沉淀生成 (6) H2S+8HNO3(浓) →H2SO4+8NO2↑+4H2O 现象:有棕色NO2气体产生 (7) 3H2S+2HNO3(稀) →3S↓+2NO↑+4H2O 现象:有淡黄色沉淀生成 (8) H2S+2FeCl3→FeCl2+S↓+2HC1 现象:通入H2S后,溶液由黄色变成浅绿色,有淡黄色沉淀生成 (9) 2H2S+SO2→3S↓+2H2O 现象:两种气体混合后,瓶壁有淡黄色沉淀生成 4.H2S气体与某些重金属盐溶液反应产生硫化物沉淀 (1) H2S+CuSO4 →CuS↓+H2SO4 现象:通入H2S后,生成黑色沉淀 (2) H2S+2AgNO3→ Ag2S↓+2HNO3 现象:通入H2S后,生成黑色沉淀 (3) H2S+Pb(NO3)2→PbS↓+2HNO3 现象:通入H2S后,生成黑色沉淀 (PbS为黑色沉淀,用湿润的醋酸铅试纸检验H2S气体)
天堂de 果冻专业贡献 光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压 催化剂 △ 催化剂 催化剂 △ 浓硫酸 170℃ 浓硫酸 140℃ △ 催化剂 催化剂 催化剂 催化剂 催化剂 △ 催化剂 加热、加压 + 高中有机化学方程式汇总 1. CH 4 + Cl 2 CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 2 6. C 16H 34 C 8H 18 + C 8H 16 7. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 22OH 10. CH 2 = CH 23—CH 2 Br 11. CH 2 = CH 2CH 3 12. nCH 2 = CH 2 ] n 13. nCH 22-CH=CH-CH 2] n 14. 2CH 23CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO 20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 + Br 222. + HO 2 +H 2O 23. + HO 3H+H 2O 24. + 3H 2O 26. 3CH ≡27. CH 3CH 228. CH 3CH 229. CH 3CH 22O 30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑ 31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 34. 2O 35. 2O -+H 3O + 23 37 38. CH 339. 2CH 340. CH 34 +2Ag ↓+3NH 3+H 2O 41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑ 44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑ 45. CH 3COOH + NaOH CH 3COONa + H 2O 46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O 47.CH 3COOH+CH 3CH 23COOCH 2CH 3 +H 2O 48. CH 3COOCH 2CH 3+NaOH CH 3COONa+ 2OH 49. nOHCH 2CH 22H 2O 50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l) 51. C 6H 12O 6 2CH 3CH 2OH + 2CO 2 52. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6 蔗糖 葡萄糖 果糖 53. C 12H 22O 11 + H 2O 2C 6H 12O 6 麦芽唐 葡萄糖 54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 淀粉 葡萄糖 55. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 纤维素 葡萄糖 56.C 17H 33COO-CH 2 C 17H 35COO-CH 2 C 17H 33COO-CH +3H 2 C 17H 35COO-CH C 17H 33COO-CH 2 C 17H 352 57. C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH COOH+ CH-OH C 17H 35COO-CH 2 58. CH 2OH COOH CH 2OH COOH
高中化学方程式钠,铝,铁全 部 钠及其化合物的化学方程式 一、钠 1、钠在氧气中燃烧:2Na+O2Na2O2...文档交流仅供参考... 2、钠在氯气中燃烧:2Na+Cl22NaCl...文档交流仅供参考... 3、钠常温条件下和氧气反应:4Na+O22Na2O...文档交流仅供参考... 4、钠和硫共热:2Na+SNa2S 5、钠和水反应:2Na+2H2O2NaOH+H2↑...文档交流仅供参考... 6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑...文档交流仅供参考... 7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2ONa2SO4+Cu(OH)2↓+H2↑...文档交流仅供参考... 8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑...文档交流仅供参考... 9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑...文档交流仅供参考... 10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti...文档交流仅供参考...
二、氧化钠 1、氧化钠和水反应:Na2O+H2O=2NaOH 2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO3...文档交流仅供参考... 3、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2O 4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2OCu(OH)2↓+Na2SO4...文档交流仅供参考... 5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl...文档交流仅供参考... 6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlC l3NaAlO2+3NaCl...文档交流仅供参考... 三、过氧化钠 1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑...文档交流仅供参考... 2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑...文档交流仅供参考... 3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaC l+2H2O+O2↑...文档交流仅供参考... 4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuS O4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑...文档交流仅供参考... 5、向氯化铝溶液中加入少量的过氧化钠: 6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12
碳、硅、氮、硫、氯及其化合物方程式和离子方程式锦集 一、碳及其化合物方程式和离子方程式 1、C (1)与氧气反应(不足):2C+O22CO (2)与氧气反应(充足): C+O2CO2 (3)与氧化铜反应: 2CuO+C2Cu+CO2↑ (4)与二氧化硅反应: SiO2+2C Si+2CO↑ (5)与水蒸气反应(高温): C+H2O CO+H2 (6)与浓硝酸反应: C+4HNO3CO2↑+4NO2↑+2H2O C+4H++4NO3-CO2↑+4NO2↑+2H2O (7)与浓硫酸反应: C+2H2SO4(浓)CO2↑+2SO2↑+2H2O (8)与二氧化碳反应: C+CO22CO 2、CO (1)与氧气反应: 2CO+O22CO2 (2)与氧化铜反应:CuO+CO Cu+CO2 (3)与氧化铁反应:Fe2O3+3CO2Fe+3CO2 (4)与水蒸气反应: CO+H2O CO2+H2 3、CO2 (1)与水反应:CO2+H2O H2CO3 (2)与碳单质反应:C+CO22CO (3)与镁单质反应:2Mg+CO22MgO+C (4)与氧化钙反应: CaO+CO2CaCO3 (5)与过氧化钠反应: 2Na2O2+2CO22Na2CO3+O2↑ (6)与少量氢氧化钠溶液反应: NaOH+CO2NaHCO3OH-+CO2HCO3- (7)与过量量氢氧化钠溶液反应:2NaOH+CO2Na2CO3+H2O 2OH-+CO2CO32-+H2O (8)与少量氢氧化钙溶液反应:Ca(OH)2+2CO2Ca(HCO3)2OH-+CO2HCO3- (9)与过量氢氧化钙溶液反应:Ca(OH)2+CO2CaCO3↓+H2O Ca2++2OH-+CO2CaCO3↓+H2O
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH - 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】
2 C H3 3 H3 2 3 H3 2 CH CH2 C H3 2 CH CH=CH (CH3CH2CH2)3 - H3CH2CH2C 22 CH3 CH2 B O CH2CH2CH3 3 CH2CH2C 2 CH2CH3 +O H- O H B-OCH2CH2CH3 CH2CH2CH3 H3CH2CH2 B OCH2CH2CH3 CH2CH2CH3 2 CH2CH3 HOO- B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO3 2 【例】 CH3 1)BH 3 2)H 2 O 2 /OH- CH3 H H OH 3、X2加成 C C Br 2 /CCl 4 C C Br Br 【机理】 C C C C Br Br C Br +C C Br O H2+ -H+ C C Br O H
铝及其化合物的化学方程式和离子方程式 一、铝 1、铝在氧气中燃烧:4Al +3O 22Al 2O 3 2、铝在氯气中燃烧:2Al +3Cl 22AlCl 3 3、铝和硫共热:2Al +3S Al 2S 3 4、铝与稀硫酸反应:2Al +3H 2SO 4 Al 2(SO 4)3 +3H 2 ↑ 2Al +6H + 2Al 3+ +3H 2 ↑ 5、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O 2NaAlO 2+3H 2 ↑ 2Al +2OH - +2H 2O 2AlO 2- +3H 2 ↑ 6、铝和浓硫酸共热:2Al +6H 2SO 4Al 2(SO 4)3 +3SO 2 ↑+6H 2O 7、铝和浓硝酸共热:Al +6HNO 3Al(NO 3)3 +3NO 2 ↑+3H 2O Al +6H + +3NO 3- Al 3+ +3NO 2 ↑+3H 2O 8、铝和稀硝酸反应:Al +4HNO 3 Al(NO 3)3 +NO ↑+2H 2O Al +4H ++NO 3- Al 3+ +NO ↑+2H 2O 8、铝和硝酸银溶液反应:Al +3AgNO 3 Al(NO 3)3 +3Ag Al +3Ag +Al 3+ +3Ag 9、铝与硫酸铜溶液反应:2Al +3CuSO 4Al 2(SO 4)3 +3Cu 2Al +3Cu 2 + 2Al 3+ +3Cu 10、铝和氧化铁高温下反应:2Al +Fe 2O 3Al 2O 3+2Fe 11、铝和四氧化三铁高温共热:8Al +3Fe 3O 44Al 2O 3+9Fe 12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu 13、铝和二氧化锰高温共热:4Al +3MnO 22Al 2O 3+3Mn 二、氧化铝 1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2(SO 4)3 +3H 2O Al 2O 3+6H + 2Al 3+ +3H 2O 2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH 2NaAlO 2+H 2O Al 2O 3+2OH - 2AlO 2- +H 2O 3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑ 三、氢氧化铝 1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H + Al 3++3H 2O 2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O Al(OH)3 +OH - AlO 2- +2H 2O 3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O 冰晶石 电解
高二化学铁铝化学方程式整理 一、铁 1.与O 2反应:3Fe+2O 2??→?点燃Fe 3O 4 2.与Cl 2反应:2Fe+3Cl 2??→?点燃2FeCl 3 3.与Br 2反应:2Fe+3Br 2??→?点燃2FeBr 3 4.与I 2反应:Fe+I 2??→?点燃FeI 2 5.与S 反应:Fe+S ?→??FeS +Q 6.加热下与浓H 2SO 4反应:2Fe+6H 2SO 4(浓)?→?? 2Fe 2(SO 4)3+3SO 2↑+6H 2O 7.加热下与稀HNO 3反应:Fe+4HNO 3?→?? Fe(NO 3)3+NO ↑+2H 2O 8.高温下与水蒸气反应:3Fe+4H 2O(g)??→?高温Fe 3O 4+4H 2↑ 二、铁的氢氧化物 (一)Fe(OH)2 8.被氧气氧化:4Fe(OH)2+O 2+2H 2O →4Fe(OH)3 9.制取:FeSO 4+2NaOH →Na 2SO 4+Fe(OH)2↓ (二)Fe(OH)3 10.受热分解:2Fe(OH)3?→?? Fe 2O 3+3H 2O 11.制取:Fe 3++OH —→Fe(OH)3↓ 三、铁盐和亚铁盐 (一)Fe 2+ 12.和Cl 2反应:Fe 2++ Cl 2→2Fe 3++2Cl — 13.和H 2O 2反应:2H ++2Fe 2++H 2O 2→2Fe 3++2H 2O (二)Fe 3+ 14.和Fe 反应:2Fe 3++Fe →3Fe 2+ 15.和Cu 反应:Fe 3++Cu →Cu 2++Fe 2+ 16.和I —反应:2Fe 3++2I —→2Fe 2++I 2 17.和SCN —反应:Fe 3++3SCN —?Fe(SCN)3
第三节《硫和氮的氧化物》练习题 一、选择题(可能有1-2个答案) 1.工业上制镁粉是将镁蒸气在某种冷却剂中冷却而制得的,下列物质:①空气;② CO2;③ Ar;④ H2;⑤N2;⑥ H2O 中,可做冷却剂的的是 A、①② B、③④ C、③⑥ D、③⑤ 2.下列现象的产生与人为排放大气污染物氮氧化物无关的是 A、闪电 B、光化学烟雾 C、酸雨 D、臭氧层空洞 3.除去混入NO中的少量NO2应将气体通过下列试剂中的 A、Na2CO3(aq) B、NaHCO3(aq) C、H2O D、浓H2SO4 4.氮的某种氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得氮气和二氧化碳的物质的量之比为1∶2,则这种氮的氧化物是 A、N2O B、NO C、NO2 D、N2O5 5.0.1mol某金属与足量的硫反应时,生成物的质量比原金属质量增加了1.6g,则此金属可能是 A.Na B.Cu C.Fe D.Al 6.30mL0.1mol·L-1的Na2SO3溶液恰好将2×10-3molXO4-还原,则在还原产物中,X元素的化合价是 A.+1 B.+2 C.+3 D.+4 7.对酸雨的pH描述中最准确是 A.小于7 B.小于5.6 C.在5.6~7之间 D.等于5.6 8.下列反应中,表现了二氧化硫氧化性的是 A.与水反应 B.与溴水反应 C.使高锰酸钾溶液褪色 D.与硫化氢反应 9.下列几种物质均能使品红褪色,其中有一种物质使品红褪色的原理与其他几种不同,该物质是 A.过氧化钠 B.臭氧 C.二氧化硫 D.过氧化氢 10.将SO2和SO3两种气体的混合物通入BaCl2溶液,其结果是 A. 两种气体都被吸收,并有BaSO4沉淀生成 B.只有BaSO4沉淀,SO2通入溶液中无沉淀生成 C. 生成BaSO3和BaSO4两种沉淀 D.只生成BaSO3沉淀,SO3从溶液中逸出 11.欲除去CO2气体中混有的SO2气体,不可以使用的试剂是 A.酸性高锰酸钾溶液 B.饱和碳酸氢钠溶液 C.溴水 D.饱和碳酸钠溶液 12.实验室里为了吸收多余的二氧化硫气体,最好选择的下列装置中的
常见有机化学方程式归纳 物质类别性质反应方程式 一、烷烃 1、燃烧 CH4 + 2O2CO2 + 2H2O 2、取代反应 CH4 + Cl2CH3Cl + HCl CH3Cl + Cl2CH2Cl2 + HCl(或CH4 + 2Cl2CH2Cl2 + 2HCl) CH2Cl2 + Cl2CHCl3 + HCl(或CH4 + 3Cl2CHCl3 + 3HCl) CHCl3 + Cl2CCl4 + HCl(或CH4 + 4Cl2CCl4 + 4HCl) CH3CH3 + Br2CH3CH2Br + HBr 3、高温分解CH4 C + 2H2↑ 二、烯烃 1、燃烧 C2H4 + 3O22CO2 + 2H2O 2、加成反应
3、加聚反应 4、氧化反应 三、炔烃 1、燃烧 2C2H2 + 5O24CO2 + 2H2O 2、加成反应 四、芳香烃 1、卤代 2、硝化
3、加成 4、氧化 五、醇 1、与活泼金属反应2CH3CH2OH +2 Na2CH3CH2ONa + H2↑ 2、消去反应 3、脱水成醚 4、取代反应 5、氧化
6、酯化反应 六、醛1、氧化 2C2H4O + 5O24CO2 + 4H2O
2、还原 七、酮1、加氢还原 八、羧酸 1、酸性 2CH3COOH + 2Na = 2CH3COONa + H2↑ CH3COOH + NaOH = CHCOONa + H2O 2CH3COOH + Na2CO3 = 2CH3COONa + H2O + CO2↑ CH3COOH + NaHCO3 = CH3COONa + H2O + CO2↑ 2、酯化反应参考醇的性质 九、酯1、水解 十一、卤代烃 1、水解反应 2、消去反应 十二、酚1、弱酸性
铁、铝化学方程式整理 一、铁 1.与O 2反应:3Fe+2O 2??→?点燃Fe 3O 4 2.与Cl 2反应:2Fe+3Cl 2??→?点燃2FeCl 3 3.与Br 2反应:2Fe+3Br 2??→?点燃2FeBr 3 4.与I 2反应:Fe+I 2??→?点燃FeI 2 5.与S 反应:Fe+S ?→??FeS +Q 6.加热下与浓H 2SO 4反应:2Fe+6H 2SO 4(浓)?→?? 2Fe 2(SO 4)3+3SO 2↑+6H 2O 7铁和过量的稀硝酸反应 Fe + 4HNO3(稀) ==Fe(NO3)3 + NO↑+ 2H2O 过量的铁和稀硝酸反应 3Fe + 8HNO3(稀) == 3Fe(NO3)2 + 2NO↑+ 4H2O 8.高温下与水蒸气反应:3Fe+4H2O(g)??→?高温Fe3O4+4H2↑ 二、铁的氢氧化物 (一)Fe(OH)2 8.被氧气氧化:4Fe(OH)2+O 2+2H 2O →4Fe(OH)3 9.制取:FeSO 4+2NaOH →Na 2SO 4+Fe(OH)2↓ (二)Fe(OH)3 10.受热分解:2Fe(OH)3?→?? Fe 2O 3+3H 2O 11.制取:Fe 3++OH —→Fe(OH)3↓ 三、铁盐和亚铁盐 (一)Fe 2+ 12.和Cl 2反应:Fe 2++ Cl 2→2Fe 3++2Cl — 13.和H 2O 2反应:2H ++2Fe 2++H 2O 2→2Fe 3++2H 2O (二)Fe 3+ 14.和Fe 反应:2Fe 3++Fe →3Fe 2+ 15.和Cu 反应:Fe 3++Cu →Cu 2++Fe 2+ 16.和I —反应:2Fe 3++2I —→2Fe 2++I 2
一. 硫的化学性质:Cu + S —— ; Fe + S —— ; S + O 2—— ; H 2 + S —— ; 3S +6NaOH=====△ 2Na 2S +Na 2SO 3+3H 2O 。 二. SO 2的化学性质: (2)弱氧化性(与H 2S 溶液或H 2S 气体反应): SO 2 + H 2S —— (3)强还原性:+4价的硫SO 2(SO 32-或HSO 3-)以强还原性为主,能被O 2、X 2(Cl 2、Br 2、I 2)水溶液、FeCl 3溶液、KMnO 4(H +)溶液、H 2O 2等氧化,其氧化产物为SO 3、H 2SO 4或SO 42- 。 ①SO 2 + O 2 —— ; ②SO 2可使氯水褪色,反应的化学方程式为 ; SO 2可使溴水褪色,反应的离子方程式为 ; ③将SO 2 通入FeCl 3溶液中,溶液由棕黄色变为浅绿色,反应的离子方程式为: ;④酸性KMnO 4溶液吸收SO 2,离子方程式为: ; ⑤ SO 2 + H 2O 2—— ; (4)漂白性:SO 2的漂白原理是:有色物质+ SO 2无色物质(不稳定) ①将SO 2通入品红溶液中,现象 ,再加热溶液现象 。 ②将Cl 2通入品红溶液中,现象 ,再加热溶液现象 。 ③将SO 2通入紫色石蕊试液中,现象 。 ④将Cl 2通入紫色石蕊试液中,现象 。 (5)SO 2的实验室制法(化学方程式): 三.SO 3的化学性质 SO 3 + NaOH —— ; SO 3 + CaO —— ; SO 3 + H 2O —— 。
四.氮气:(1)与H2反应:N2 + H2——; (2)与O2反应:N2 + O2——;(3)与Mg反应:N2 + Mg——;五.氮的氧化物化学性质: (1) N2 + O2——; (2) N2O5+ H2O——; (3) N2O5+ NaOH——; (4) NO + O2——; (5) NO2+ H2O——; (6) NO2 + O2+ H2O——; (7) NO + O2+ H2O——; (8) 2NO2 + 2NaOH == NaNO3+ NaNO2 + H2O 六.硫的氧化物、氮的氧化物的污染与治理 (1)某酸雨样品放置时pH减小的原因(离子方程式):。 某酸雨样品与自来水混合, pH减小的原因(化学方程式):。 (2)钙基“固硫”法 为防治酸雨,工业上常用生石灰和含硫的煤混合后燃烧,燃烧时硫、生石灰、O2共同反应生成CaSO4,从而使硫转移到煤渣中,反应原理(反应方程式2个)为 ;总反应方程式为。七.写出下列除杂所用的试剂以及所发生反应的方程式(属于离子反应的写离子方程式) (1) Fe(OH)3 [Al(OH)3] :、; (2) FeSO4溶液 [(Fe2(SO4)3]:、; (3) FeCl3溶液(FeCl2):、; (4) Fe2O3[Fe(OH)3]:、; (5)Fe2O3 (SiO2) :、; (6)SiO2 (Al2O3) :、; (7)SiO2 (H2SiO3) :、; (8)SiO2 (CaCO3) :、; (9) O2(Cl2):、; (10)N2(O2) :、; (11) CO2(CO):、; (12) O 2(SO2):、; (13) CO2(HCl):、; (14) Cl2(HCl):、; (15) SO2(HCl):、; (16) CO2(SO2):、; (17)NO2(NO):、;
光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压 催化剂 △ 催化剂 有机化学方程式汇总 1. CH 4 + Cl 2 CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 2 6. C 16H 34 C 8H 18 + C 8H 16 7. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 23 12. nCH 2 = CH 2 ] n 13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO 20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2O
NaOH H 2 O 醇 △ 催化剂 △ 浓硫酸 170℃ 浓硫酸 140℃ 催化剂 △ 24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr 28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr 29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O 30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑ 31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 3 37 38. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O 41CH 3O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑
钠及其化合物的化学方程式 一、钠 1、钠在氧气中燃烧:2Na+O2Na2O2 2、钠在氯气中燃烧:2Na+Cl22NaCl 3、钠常温条件下和氧气反应:4Na+O22Na2O 4、钠和硫共热:2Na+S Na2S 5、钠和水反应:2Na+2H2O2NaOH+H2↑ 6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑ 7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑ 8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑ 9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑ 10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti 二、氧化钠 1、氧化钠和水反应:Na2O+H2O=2NaOH 2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO3 3、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2O 4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4 5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl 6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl 三、过氧化钠 1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑ 2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑ 3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑ 4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑
氯的化学方程式 1、钠在氯气中燃烧________________________________________ 2、铁在氯气中燃烧________________________________________ 3、铜在氯气中燃烧________________________________________ 4、氢气在氯气燃烧________________________________________ 5、氯气与水反应________________________________________ 离子方程式________________________________________ 6、次氯酸见光分解________________________________________ 7、氯水加氯化亚铁________________________________________ 离子方程式________________________________________ 8、氯气与NaOH溶液______________________________________ 离子方程式________________________________________ 9、氯气与石灰水________________________________________ 离子方程式________________________________________ 10、漂白粉失效________________________________________ ________________________________________ 11、氯气与NaBr溶液_______________________________________ 离子方程式_______________________________________ 12、氯气与KI溶液________________________________________ 13、Br2与KI溶液________________________________________ 14、HCl溶液加AgNO3离子方程式_________________________ 15、实验室制氯气________________________________________ 离子方程式________________________________________ 硫和氮的化学方程式 1、硫与铁加热________________________________________ 2、硫在氧气燃烧_______________________________________ 3、SO2与NaOH溶液___________________________________ 离子方程式_______________________________________ 4、SO2使石灰水浑浊___________________________________ 离子方程式______________________________________ 5、SO2与Na2CO3溶液_________________________________ 6、Na2SO3与H2SO4溶液_______________________________ 离子方程式______________________________________ 7、SO2与氯水________________________________________ 离子方程式_______________________________________ 8、SO2与Br2水_______________________________________ 9、SO2与H2S气体____________________________________ 10、煤加生石灰减污染_________________________________ ______________________________________ 11、氮气与氧气放电___________________________________ 12、NO与氧气_______________________________________ 13、NO2与水________________________________________ 14、NO2与O2通入水_________________________________ 15、NO与O2通入水__________________________________