
Fluorine sites in glasses and transparent glass-ceramics of the system Na 2O/K 2O/Al 2O 3/SiO 2/BaF 2
Christian Bocker a ,n ,Francisco Mun
?oz b ,Alicia Dura ′n b ,Christian R ¨ussel a
a Otto-Schott-Institut,Jena University,Fraunhoferstr.6,07743Jena,Germany
b
Instituto de Cera
′mica y Vidrio (CSIC),Kelsen 5,28049Madrid,Spain a r t i c l e i n f o
Article history:
Received 2September 2010Received in revised form 17November 2010
Accepted 1December 2010
Available online 7December 2010Keywords:NMR
Crystal growth Crystallization Nano crystals Silicate glasses
a b s t r a c t
The transparent glass-ceramics obtained in the silicate system Na 2O/K 2O/SiO 2/BaF 2show homogeneously dispersed BaF 2nano crystals with a narrow size distribution.The X-ray diffraction and the nuclear magnetic resonance spectroscopy were applied to glasses and the respective glass-ceramics in order to clarify the crystallization mechanism and the role of ?uorine during crystallization.With an increasing annealing time,the concentration and also the number of crystals remain approximately constant.With an increasing annealing temperature,the crystalline fraction increases until a saturation limit is reached,while the number of crystals decreases and the size of the crystals increases.Fluoride in the glassy network occurs as Al–F–Ba,Al–F–Na and also as Ba–F structures.The latter are transformed into crystalline BaF 2and ?uoride is removed from the Al–F–Ba/Na bonds.However,some ?uorine is still present in the glassy phase after the crystallization.
&2010Elsevier Inc.All rights reserved.
1.Introduction
Glass-ceramics containing ?uoride crystallites are valuable materials for photonic applications.Especially,alkaline earth ?uoride crystals are known as good host materials for rare earth ions such as Er 3+or Eu 3+[1–3].These doped glass-ceramics are advantageous for some applications,because they can be easily processed by the viscous ?ow, e.g.drawn to a ?ber.After subsequent annealing and crystallization of the glasses,optical properties,e.g.?uorescence lifetimes and luminescence or up-conversion ef?ciencies [4–6].These materials might be used,for example,as optical ampli?ers or in ?ber lasers [7,8].In order to obtain transparent glass-ceramics i.e.to avoid light scattering,the size of the crystals must be much smaller than half of the wavelength of the used light.
The formation of nano crystals in a multi-component glass system containing BaF 2or CaF 2was recently explained by the formation of a diffusion barrier around the forming crystals [9–11].The nano crystals were homogeneously distributed within the glass matrix and possessed a narrow crystallite size distribution [12].When in multi-component glasses,a metal ?uoride compo-nent is crystallized,a layer around the crystal is depleted in the respective components.Since in the case of metal ?uorides,these compounds act as the network modifying component;this leads to an enrichment in network formers,and hence increases the
viscosity.This layer might act as a diffusion barrier and hinders further crystal growth [13,14].
The role of ?uorine in aluminosilicate glass networks was studied by several researchers [15–19].By means of solid-state nuclear magnetic resonance (NMR),it is possible to study the local environment of the involved atoms in the crystallization process.An NMR of ?uorine-containing aluminosilicate glasses has shown that ?uorine atoms are preferentially coordinated to aluminium instead of silicon,due to their tendency to bond with small and highly charged cations [19].Generally,the larger the ionic ?eld strength of the modi?er cations,the higher is their ability to form chemical bonds to ?uorine [20].
In this paper,a study on the BaF 2concentration and the incorporation of ?uorine during the course of BaF 2crystallization in glass-ceramics in the system Na 2O/K 2O/Al 2O 3/SiO 2/BaF 2through X-ray diffraction (XRD)and NMR is reported.
2.Experimental procedures
Glasses with the compositions (100àx )(2Na 2O á16K 2O á8Al 2O 3á74SiO 2)áx BaF 2(in mol%),with x ?0,1,2,3,4,5and 6,were melted from reagent grade Na 2CO 3,K 2CO 3,BaF 2,Al(OH)3and SiO 2(quartz)in batches of 200g.The covered platinum crucible was placed in a furnace at 15901C and kept for 1.5h.The melts were cast onto a copper block and were subsequently put into a furnace preheated to 4501C.Then the furnace was switched off and the glass was allowed to cool to room temperature.During melting,?uorine is
Contents lists available at ScienceDirect
journal homepage:https://www.doczj.com/doc/b6640213.html,/locate/jssc
Journal of Solid State Chemistry
0022-4596/$-see front matter &2010Elsevier Inc.All rights reserved.doi:10.1016/j.jssc.2010.12.001
n
Corresponding author.Fax:+493641948502.
E-mail address:christian.bocker@uni-jena.de (C.Bocker).
Journal of Solid State Chemistry 184(2011)405–410
lost due to an unavoidable evaporation.The ?uorine concentration was determined by a wet-chemical method [21],X-ray ?uores-cence and energy-dispersive X-ray spectrometry.On the average about (3473)%of ?uorine was lost during melting.Wet chemical analyses and energy-dispersive X-ray spectrometry were in good agreement (710%).
The glasses with 6mol%BaF 2were annealed at temperatures in the range 500–6001C,for 20h.For the samples annealed at 500and 5401C,the annealing time was varied in the range 5–160h.The X-ray diffraction (XRD)patterns were recorded from powdered samples,using a Siemens D5000diffractometer.To quantitatively determine the fraction of the crystalline BaF 2,the method of Rietveld-re?nement was applied to the obtained XRD-patterns.An internal standard (25wt%Al 2O 3)was added to the powdered samples [22].
19
F magic angle spinning (MAS)nuclear magnetic resonance (NMR)spectra were recorded with a Bruker ASX 400spectrometer operating at 376MHz (9.4T),using a 2.5mm probe.The pulse time was 1m s and 30s recycling time and 4.5m s death time were used.A total number of 300scans were accumulated with a spinning rate of 25kHz.The background signal from the probe was registered for an empty rotor under the same conditions and removed from the 19F spectra of all samples.Solid CaF 2was used as the secondary reference with a chemical shift of à0.108ppm with respect to CFCl 3reference.
27
Al MAS NMR spectra were recorded with a Bruker ASX 400spectrometer operating at 104.27MHz (9.4T),using a 4mm probe.The pulse time used was 2.7m s and the recycling time 2s with 6m s death time.A total number of 1024scans was accumulated with a spinning rate of 10kHz and as the chemical shift reference AlCl 3á6H 2O was used.3.Results
The obtained glasses and glass-ceramics were all colorless and transparent.Fig.1shows the XRD-patterns of the glass and glass-ceramic samples obtained after annealing at 500and 6001C for 20h,and at 5001C for 160h.The glass sample was amorphous while after annealing at 5001C for 20h broadened resonance peaks appeared.The mean crystallite sizes of the samples annealed at 5001C were approximately 7nm,as calculated by using Rietveld-re?nement.Although the peaks of the sample,annealed for 160h at 5001C,seem broader in Fig.1,the values are within an assumed accuracy of 70.5nm.For the sample annealed at 6001C for 20h,a mean crystallite size of 15nm was calculated.All peaks were attributable to the crystalline cubic BaF 2(JCPDS no.4-452).
Annealing at a temperature of 5001C for 160h did not lead to the formation of any additional crystalline phase.
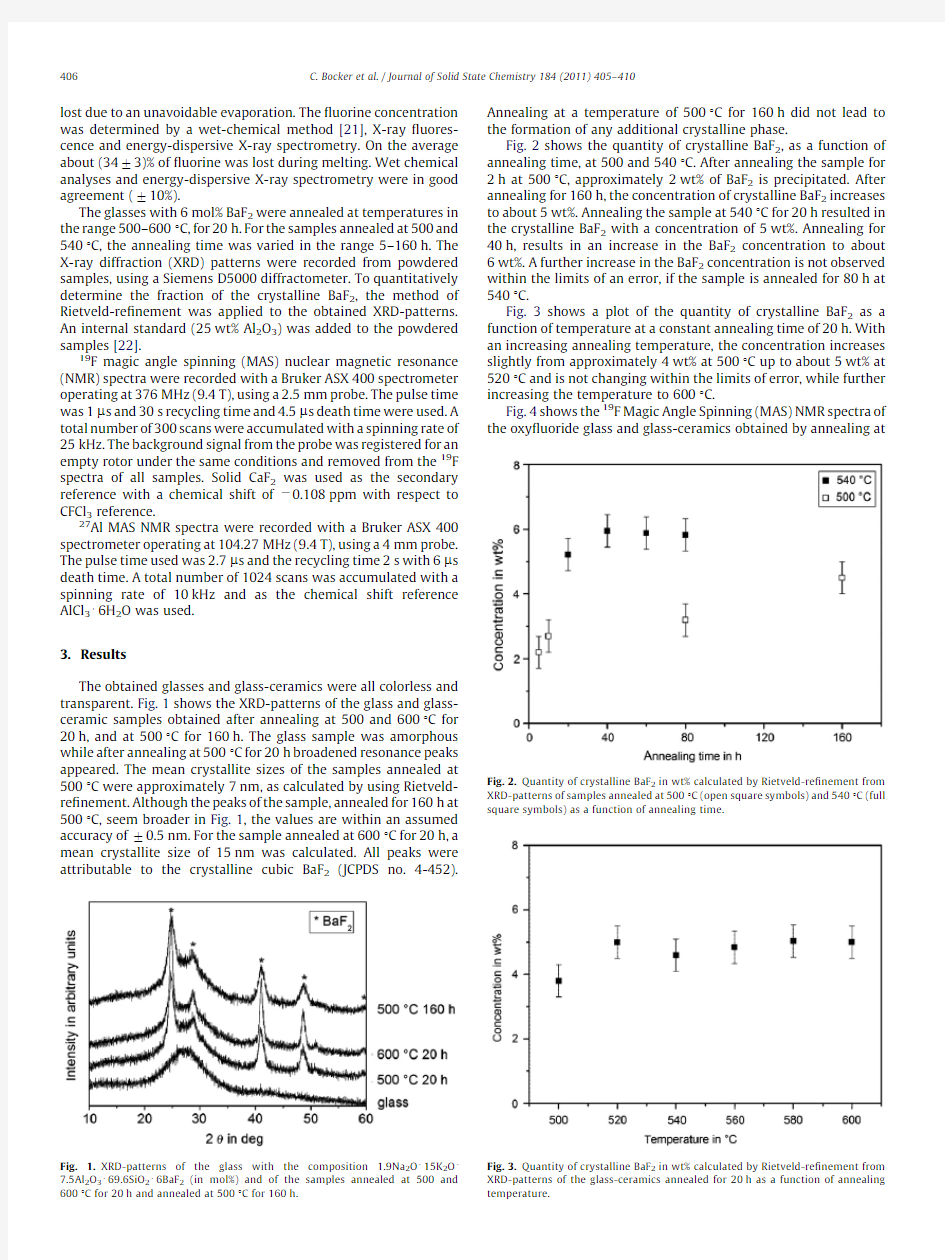
Fig.2shows the quantity of crystalline BaF 2,as a function of annealing time,at 500and 5401C.After annealing the sample for 2h at 5001C,approximately 2wt%of BaF 2is precipitated.After annealing for 160h,the concentration of crystalline BaF 2increases to about 5wt%.Annealing the sample at 5401C for 20h resulted in the crystalline BaF 2with a concentration of 5wt%.Annealing for 40h,results in an increase in the BaF 2concentration to about 6wt%.A further increase in the BaF 2concentration is not observed within the limits of an error,if the sample is annealed for 80h at 5401C.
Fig.3shows a plot of the quantity of crystalline BaF 2as a function of temperature at a constant annealing time of 20h.With an increasing annealing temperature,the concentration increases slightly from approximately 4wt%at 5001C up to about 5wt%at 5201C and is not changing within the limits of error,while further increasing the temperature to 6001C.
Fig.4shows the 19F Magic Angle Spinning (MAS)NMR spectra of the oxy?uoride glass and glass-ceramics obtained by annealing
at
Fig. 1.XRD-patterns of the glass with the composition 1.9Na 2O á15K 2O á7.5Al 2O 3á69.6SiO 2á6BaF 2(in mol%)and of the samples annealed at 500and 6001C for 20h and annealed at 5001C for 160
h.Fig.2.Quantity of crystalline BaF 2in wt%calculated by Rietveld-re?nement from XRD-patterns of samples annealed at 5001C (open square symbols)and 5401C (full square symbols)as a function of annealing
time.
Fig.3.Quantity of crystalline BaF 2in wt%calculated by Rietveld-re?nement from XRD-patterns of the glass-ceramics annealed for 20h as a function of annealing temperature.
C.Bocker et al./Journal of Solid State Chemistry 184(2011)405–410
406
temperatures in the range 500–6001C for 20h.The spectrum of the base glass presents a resonance band with a maximum in the range à174to à173ppm,and a second very broad band with a maximum centered at around à140ppm.Due to their width,it is not possible to deduce how many bands exactly contribute to these resonances.According to Kiczenski et al.[16],the resonances at a precise chemical shift of à173ppm should be attributed to ?uorine atoms within an Al–F–Al environment.However,it is not possible to exclude other possibilities such as Al–F–Al(Na +)structures reported to occur at à166ppm;Al–F–Al(Ba +)struc-tures which should appear at à155.6,à145.9or à150.1and à140ppm;and Al–F–K at à155ppm or Al–F–Na structures which should be observed between à190and à180ppm [16].The broad resonance found in all glass-ceramics in the range à160to à100ppm,with a maximum at approximately à140ppm,may be caused by different structures in which ?uorine atoms coordi-nated with aluminium and additionally with Ba 2+or Na +cations.Furthermore,a very small and also broad resonance is detected within the range à25to 50ppm which,according to the literature [20],should be attributed to ?uorine in Ba–F clusters within an amorphous structure.
The 19F MAS NMR spectra of the glass-ceramic samples again show the two previously mentioned resonances with the maxima centered at à180and à140ppm.Both are very broad and show much smaller intensities.Additionally,a very strong resonance centered at à16ppm appears,which is assigned to ?uorine in the crystalline BaF 2[16].A deconvolution of the resonance band centered at à16ppm,including spinning side bands,has been carried out by using DMFIT software [23].Table 1summarizes the results of the deconvolution procedure for the 19F signal related to ?uorine atoms in the crystalline BaF 2.It is seen that 35%of ?uorine in the glass is already incorporated into the crystalline phase after annealing the sample at 5001C for 20h.Annealing at higher
temperatures gives rise to a small increase in the concentration of ?uorine atoms incorporated into the crystals.All other ?uorine atoms seem to be incorporated in Al–F–Na or Al–F–Ba structures in the same manner as in the base glass.It is already shown in Fig.3that for a constant annealing time of 20h,the BaF 2concentration is smaller after annealing at 5001C and remains constant within the limits of an error for annealing temperatures in the range 520–6001C.
Finally,it is worth noting that other small resonances can be seen within the NMR spectra of the glass-ceramic samples,whose centers are at 7,à40and à67ppm,which unfortunately are not easy to attribute to any known phases.
Fig.5shows 27Al MAS NMR spectra of the glass before annealing and spectra of samples annealed for 20h at temperatures in
the
Fig.4.19FMAS NMR spectra of samples containing 6mol%BaF 2without annealing and annealed at temperatures from 500to 6001C for 20h.The asterisks refer to the spinning side bands.Table 1
Percentage of the total ?uorine incorporated in BaF 2as determined from 19
F NMR
spectra from the resonance at à16ppm (error 72%).Annealing temperature
in 1C Fluorine in the crystal
phase in wt%50035520475404958046600
44
Fig.5.27A l MAS NMR spectra of samples containing 6mol%BaF 2without annealing and annealed at temperatures from 500to 6001C for 20h.The asterisks refer to the spinning side bands.
C.Bocker et al./Journal of Solid State Chemistry 184(2011)405–410407
range 500–6001C.The spectrum of the glass sample shows a main resonance band at 60ppm and two other small ones at 30and à5ppm,which are assigned to aluminium in four-,?ve-and six-fold coordinations,respectively [24].However,the spectra of the glass-ceramic samples present the main resonance attributed to Al(IV)species with negligible contributions of Al(V)and Al(VI)species.
Fig.6depicts the 27Al MAS NMR spectra of glasses containing different BaF 2concentrations,from 0to 6mol%BaF 2.It can be seen that the concentrations of Al(V)and Al(VI)species increase with an increasing BaF 2concentration in glasses.4.Discussion
Annealed samples show notably broadened XRD-lines,all attributable to crystalline BaF 2(see Fig.1).The crystallite sizes of these samples,calculated from the XRD-line broadening using Rietveld-re?nement,are in the range 7–15nm.The fraction of the crystalline phase increases with the annealing time as well as with the temperature (see Figs.2and 3).Annealing the samples at 5001C for 160h led to the crystallization of approximately 4wt%BaF 2,while annealing at 5401C resulted in approximately 6wt%BaF 2already after 40h.Annealing at even higher temperatures and shorter times,i.e.at 6001C for 20h,led to the precipitation of about 5wt%BaF 2.Assuming a relative ?uorine loss of 34%during melting as reported from the previous studies [12],the ?uorine concentra-tion in the glass is still attributed to 9wt%BaF 2.Hence,if after
annealing,5wt%BaF 2are crystallized,approximately (5475)%of ?uorine atoms are incorporated in the crystalline phase.This estimation is in agreement to the calculations from NMR spectra (see Table 1).
The volume fraction j of crystalline BaF 2can be calculated using Eq.(1)
j ?
V C V C tV RG ?r RG
r RG tr C c C àr C
,e1T
with c C as the concentration of crystalline phase in wt%,V C and V RG
as the volume fraction and r C and r RG are the densities of the crystalline and the residual glassy phase,respectively.The density of the cubic BaF 2was reported to be r C ?4.89g cm à3[25]and for the residual glassy phase a density of r RG ?2.4g cm à3is assumed (measured from a glass with approximately the same composition,i.e.a smaller BaF 2concentration and additional BaO in agreement with the assumed ?uorine loss).Using the volume fraction and the mean size of the crystallites d (obtained from the line broadening in the XRD,using Rietveld-re?nement),the number of crystals N in a certain volume V can be calculated by Eq.(2)N ?
j V
V C
?
6j V
p d 3
,e2T
with V C as the volume of the crystal which is assumed to possess a spherical shape.
In Fig.7,the number of crystals (per volume)as a function of annealing time and temperature is shown.The error bars
were
Fig.6.
27
Al MAS NMR spectra of glasses with different BaF 2concentrations in the range 0–6mol%.The asterisks refer to the spinning side
bands.
Fig.7.Number of BaF 2crystallites as a function of (a)annealing time and (b)temperature in the sample with 6mol%BaF 2.
C.Bocker et al./Journal of Solid State Chemistry 184(2011)405–410
408
calculated according to Eq.(3)
D N?
@N
@j
D jt@N
@d
D de3T
The absolute error D j was calculated from Eq.(1),where error values are attributed to the crystalline fraction c C and the density of the residual glassy phase r RG.
There is no change in the number of crystals(within the limits of error)with an increasing annealing time as shown in Fig.7a.This indicates that no coarsening by Ostwald ripening or coalescence occurs.In Ref.[12],these?ndings are discussed by the very narrow crystallite size distributions in the glass-ceramics.It should be noted that annealing the samples at5001C for5and10h resulted in large error bars.This is due to the small crystallite sizes and the small crystallite fraction,which are close to the detection limit of an XRD.Both errors are included in the error calculation of Eq.(3). However,a notable decrease in the number of crystals is observed with an increasing annealing temperature from150?103m mà3at 5001C to14?103m mà3at6001C,as shown in Fig.7b.According to Tammann[26],a one step annealing process leads to different nucleation rates at different temperatures.During annealing at temperatures larger than that attributed to the maximum nuclea-tion rate,the number of crystals in the glass-ceramics should decrease(see Fig.7b).Simultaneously,the crystal growth velocity increases and hence the crystal size at constant annealing time and different temperatures should increase[11].Recent studies on the crystal growth using Monte Carlo simulation and taking into account the kinetics and development of stresses during crystal-lization led to the conclusion that the crystal growth rate is decelerated with an ongoing time in this type of glass systems[27].
The glassy network is described according to Zachariasen in Ref.[28]as a random distribution of network forming(NF)and network modifying(NM)components.It is assumed,that NFs,such as SiO2,B2O3or P2O5,form covalent bonds and NMs,such as Na2O, K2O,CaO or BaO,are incorporated into the network via ionic bonds. In the glass system under investigation,an SiO2is the main NF and K2O,Na2O represent the NMs.Since(([K2O]á[Na2O])/[Al2O3]41), Al2O3is mainly incorporated as an NF.The formed AlO4àtetrahedra are charge balanced by alkaline or alkaline earth cations.If a coordination number of eight is assumed for Ba2+,it should be surrounded by the two non-bridging oxygens and six bridging oxygens in order to maintain electroneutrality.Of course,this is only an average value,which might locally be different.Concerning the incorporation of Fàinto the silicate network,various possibi-lities are discussed in the literature.In Ref.[29],studies on the structure of?uorine containing soda-lime glasses as well as aluminium silicate glasses are reported.In the alkali glasses,it seems that?uorine prefers to coordinate Na+ions,while in calcium containing glasses it can be found close to Ca+ions.For glasses which additionally contain aluminium,the?uorine coordinates Al3+ions[16,17,20].
An19F NMR spectra(see Fig.5)show that?uorine in glass is mainly involved in Al–F–Ba or Al–F–Na bonds.Nevertheless,it cannot be excluded that a very small amount of Fàis coordinated with silicon,and hence forms SiO3F-tetrahedra.It can be seen from Fig.5that a very small concentration of?uorine is arranged in Ba–F bonds.The coordination of barium with?uorine in an amorphous state can be interpreted as an advantageous structural state to develop BaF2crystals during subsequent thermal annealing.As seen in Fig.4,remarkable difference between the19F NMR spectra of samples annealed using different annealing temperatures and times are not observed.By contrast,the27Al MAS NMR spectra are notably different.In the glass sample,small resonances of Al(V)and Al(VI)species are observed.However in the spectra of the glass-ceramics,these resonances are nearly vanished.The detection of these species is very hard due to their higher quadrupolar coupling constant combined with their low intensities.Therefore,nearly all aluminium is four-fold coordinated.Thus,it can be concluded that Al(V)and Al(VI)are mainly present in the glass if?uorine is bonded to aluminium atoms through Al–F–Na or Al–F–Ba bonds.If during thermal annealing,BaF2crystallizes,?uorine moves away from these bonds with aluminium and then aluminium turns to occur exclusively in the fourfold coordination in the glass-ceramics, coordinated with oxygen or the remaining?uorine.Hence,during crystallization,the coordination sphere of aluminium in the glassy phase is affected.The27Al MAS NMR spectra of glasses containing different BaF2concentration in Fig.6show the effect of?uorine concentration in glasses on the distribution of aluminium species. With an increasing BaF2concentration in the glass,the amount of Al(V)and Al(VI)species also increases.
These?ndings are in agreement to the results of Stamboulis et al.and Karpukhina et al.[18,30]in calcium–alumosilicate glasses.Also in this glass system,?uorine is preferably bonded to the alkaline-earth ion Ca2+as Ca–F or Al–F–Ca bonds,while Si–F–Ca bonds were not proved.In Ref.[20],it is reported that NMs such as M2+(M?Ba,Ca,Mg)are attracting more?uorine with an increasing?eld strength of the ion,i.e.are competing more effectively with Al3+in order to form metal?uorine bonds.The strong effect of the?uorine concentration on the glass properties such as viscosity or glass transformation temperature(T g)is discussed by Hill et al.[31].It is assumed that a complex of CaF+ is formed which acts in an analogy to alkali ions,and hence affects the depolymerisation of the glassy network stronger than Ca2+.It can be assumed that the latter builds up bridges between two non-bridging oxygen.Also in the case of the BaF2glass system,the viscosity decreases rapidly and non-linear with the addition of ?uorine[14].
5.Conclusion
During annealing glasses in the system Na2O/K2O/Al2O3/SiO2/ BaF2,crystallization of cubic BaF2is observed.The crystallites formed are smaller than20nm as shown by the X-ray diffraction. Furthermore,Rietveld-re?nement was used to quantify the crystal-line BaF2fraction in the glass-ceramics.With increasing annealing times,the concentration of crystalline BaF2increases until a saturation is reached at approximately5–6wt%.The higher the annealing temperature,the faster the limiting value is reached.The number of crystallites decreases with an annealing temperature, while it remains constant within the limits of error when the annealing time is varied.The latter proves that Ostwald ripening does not occur.
The role of?uorine in the glassy network is studied by an MAS NMR spectroscopy.Here,glasses with different?uorine concen-trations and crystallized samples were investigated.In the glassy network,the incorporation of?uorine in Al–F–Ba,Al–F–Na and Ba–F bonds and also the formation of BaF+complex is most probable.During annealing the glasses,Ba–F bonds transform into crystalline BaF2,which is proved by19F MAS NMR spectra. Aluminium with coordination numbers44(Al(V,VI)species) disappears after thermal annealing of the glass.This is due to the transformation of Al(V,VI)-F–Ba into BaF2,thus increasing the relative proportion of Al(IV)tetrahedra in the crystallized samples. Acknowledgment
This work was funded by the European community within the Strep project INTERCONY(NMP3-CT-2006-033200).
C.Bocker et al./Journal of Solid State Chemistry184(2011)405–410409
References
[1]X.Qiao,Q.Luo,X.Fan,M.Wang,J.Rare Earths26(2008)883–888.
[2]X.Qiao,X.Fan,M.Wang,Scr.Mater.55(2006)211–214.
[3]Y.Dwivedi,S.B.Rai,Opt.Mater.31(2008)87–93.
[4]Y.Yu,D.Chen,Y.Wang,F.Liu,E.Ma,J.Non-Cryst.Solids353(2007)405–409.
[5]D.Chen,Y.Wang,Y.Yu,E.Ma,Z.Hu,J.Phys.Condens.Matter17(2005)
6545.
[6]D.N.Patel,R.B.Reddy,S.K.Nash-Stevenson,Appl.Opt.37(1998)7805–7808.
[7]Y.Kawamoto,R.Kanno,J.Qiu,J.Mater.Sci.33(1998)63–67.
[8]S.Tanabe,H.Hayashi,T.Hanada,N.Onodera,Opt.Mater.19(2002)343–349.
[9]R.P.F.de Almeida,C.Bocker,C.R¨ussel,Chem.Mater.20(2008)5916–5921.
[10]C.R¨ussel,Chem.Mater.17(2005)5843–5847.
[11]C.Bocker,C.R¨ussel,J.Eur.Ceram.Soc.29(2009)1221–1225.
[12]C.Bocker,S.Bhattacharyya,T.H¨oche,C.R¨ussel,Acta Materialia57(2009)
5956–5963.
[13]S.Bhattacharyya,C.Bocker,T.Heil,J.R.Jinschek,T.H¨oche,C.R¨ussel,H.Kohl,
Nano Lett.9(2009)2493–2496.
[14]C.Bocker,I.Avramov,C.R¨ussel,Chem.Phys.369(2010)96–100.
[15]R.G.Hill,A.Stamboulis,https://www.doczj.com/doc/b6640213.html,w,J.Dent.34(2006)525–532.[16]T.J.Kiczenski,J.F.Stebbins,J.Non-Cryst.Solids306(2002)160–168.
[17]Q.Zeng,J.F.Stebbins,Am.Mineral.85(2000)863–867.
[18]A.Stamboulis,R.G.Hill,https://www.doczj.com/doc/b6640213.html,w,J.Non-Cryst.Solids333(2004)101–107.
[19]J.F.Stebbins,Q.Zeng,J.Non-Cryst.Solids262(2000)1–5.
[20]T.J.Kiczenski,L.-S.Du,J.F.Stebbins,J.Non-Cryst.Solids337(2004)142–149.
[21]G.Pietzka,P.Ehrlich,Angew.Chem.65(1953)131–135.
[22]L.S.Zevin,G.Kimmel,Quantitative X-ray Diffractometry,Springer,New York,
Berlin,1995.
[23]D.Massiot,F.Fayon,M.Capron,I.King,S.Le Calve′,B.Alonso,J.-O.Durand,
B.Bujoli,Z.Gan,G.Hoatson,Magn.Reson.Chem.40(2002)70–76.
[24]D.R.Neuville,L.Cormier,D.Massiot,Chem.Geol.229(2006)173–185.
[25]A.S.Radtke,G.E.Brown,Am.Mineral.59(1974)885–888.
[26]G.Tammann,Der Glaszustand,Voss,Leipzig,1933.
[27]N.Tsakiris,P.Argyrakis,I.Avramov,C.Bocker,C.R¨ussel,Europhys.Lett.89
(2010)18004.
[28]W.H.Zachariasen,J.Am.Chem.Soc.54(1932)3841–3851.
[29]J.F.Stebbins,S.Kroeker,S.Keun Lee,T.J.Kiczenski,J.Non-Cryst.Solids275
(2000)1–6.
[30]N.Karpukhina,https://www.doczj.com/doc/b6640213.html,w,R.G.Hill,Adv.Mater.Res.39–40(2008)25–30.
[31]R.G.Hill,N.D.Costa,https://www.doczj.com/doc/b6640213.html,w,J.Non-Cryst.Solids351(2005)69–74.
C.Bocker et al./Journal of Solid State Chemistry184(2011)405–410 410
左氧氟沙星片说明书 【篇一:盐酸左氧氟沙星片说明书】 快易捷药品网 【药品名称】 盐酸左氧氟沙星片 【英文或拉丁名】 levofloxacin hydrochloride tablets 【主要成分】 本品主要成分为盐酸左氧氟沙星 【化学名】 (s)-(-)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪基)-7-氧-7h-吡啶并[1,2,3-de]-[1,4] 苯并噁嗪-6-羧酸盐酸盐一水合物 【性状】 本品为类白色或淡黄色片。 【药理毒理】 本品为氧氟沙星的左旋体,其抗菌活性约为氧氟沙星的2倍,它的 主要作用机制为抑制细菌dna旋转酶活性,抑制细菌dna复制。本 品具有抗菌谱广、抗菌作用强的特点,对多数肠杆菌科细菌,如肺 炎克雷白菌、变形杆菌属、伤寒沙门菌属、志贺菌属、部分大肠杆 菌等有较强的抗菌活性,对部分葡萄球菌、肺炎链球菌、流感杆菌、绿脓杆菌、淋球菌、衣原体等也有良好的抗菌作用。 【吸收、分布、消除】 左氧氟沙星0.3g静注(n=8)和口服(n=12)后 药代动力学参数的平均值 给药 cmax auc(0~24) t(1/2) 肾清除率 静注 6.27 20.73 6.28 145.55 口服 4.04 22.62 6.48 162.80 [auc(0~48)] 左氧氟沙星在体内组织中分布广泛。主要以原型药由尿中排出,口 服给药后48小时内,尿中原型药排出量约占给药量的87%;72小 时内粪便中的排出药量少于给药量的4%;约5%的药物以无活性代 谢物的形式由尿中排出。
肾功能减退的患者左氧氟沙星清除率下降,消除半衰期延长,为避 免药物蓄积,应进行剂量调整。血液透析和连续腹膜透析(capd)不 影响左氧氟沙星从体内排除。 【适应症】 本品适用于敏感细菌引起的下列轻、中度感染: 呼吸系统感染:急性支气管炎、慢性支气管炎急性发作、弥漫性细 支气管炎、支气管扩张合并感染、肺炎、扁桃体炎(扁桃体周围脓肿); 泌尿系统感染:肾盂肾炎、复杂性尿路感染等; 生殖系统感染:急性前列腺炎、急性副睾炎、宫腔感染、子宫附件炎、盆腔炎(疑有厌氧菌感染时可合用甲硝唑); 皮肤软组织感染:传染性脓疱病、蜂窝组织炎、淋巴管(结)炎、 皮下脓肿、肛周脓肿等; 肠道感染:细菌性痢疾、感染性肠炎、沙门菌属肠炎、伤寒及副伤寒; 败血症、粒细胞减少及免疫功能低下患者的各种感染; 其他感染:乳腺炎、外伤、烧伤及手术后伤口感染、腹腔感染(必 要时合用甲硝唑)、胆囊炎、胆管炎、骨与关节感染以及五官科感 染等。 【用法与用量】 口服,成人每次0.1~0.2g,每日两次。病情偏重者可增为每日三次。【不良反应】 用药期间可能出现恶心、呕吐、腹部不适、腹泻、食欲不振、腹痛、腹胀等症状,失眠、头晕、头痛等神经系统症状和皮疹、搔痒等。 亦可出现一过性肝功能异常,如血清转氨酶增高、血清总胆红素增 加等。上述不良反应发生率在0.1~5%之间。偶见血中尿素氮上升、倦怠、发热、心悸、味觉异常等。一般均能耐受,疗程结束后迅速 消失。 【禁忌症】 对喹诺酮类药物过敏者、妊娠及哺乳期妇女、18岁以下患者禁用。【注意事项】 1.肾功能不全者应减量或延长给药间期,重度肾功能不全者慎用。 2.有中枢神经系统疾病及癫痫史患者应慎用。
一、目的与范围: 规定盐酸左氧氟沙星胶囊生产过程的各项技术要求,为其它涉及该过程的标准操作规程、原始记录等技术文件制订提供依据。 二、产品概述: 2.1产品名称: 2.1.1通用名:盐酸左氧氟沙星胶囊 2.1.2英文名:Levofloxacin Hydrochloride Capsules 2.1.3汉语拼音:Yansuan Zuoyangfushaxing Jiaonang 2.2剂型:胶囊剂 2.3性状:本品为硬胶囊。 2.4规格:0.1g/粒(以左氧氟沙星计)。 2.5包装:6粒/板×1板/盒×400盒/箱;8粒\板×1板\盒×400盒\箱;10粒\板×1板\盒×600盒\箱;10粒\板×2板\盒×500盒\箱;12粒\板×1板\盒×500盒\箱; 2.6批量:60万粒/批次;100万粒/批次;注:每批生产投料量应严格根据规定的批量投料。 2.7功能主治:本品为氧氟沙星的基旋体,抗菌活性是氧氟沙星的2倍。它的主要作用机理是通过抑制细菌DNA旋转酶的活性,阻碍细菌DNA的复制而达到抗菌作用。具有抗菌谱广,抗菌作用强的特点,对大多数肠杆菌科细菌以及多数革兰阴性细菌及部分革兰阳性细菌有较强的搞菌活性。 2.8用法用量: 成人每日200mg—300mg,分别2-3次口服。病情较重者每日剂量可增至600mg分3次口服。另外,可根据的种类及症状适当增减。 2.9 批准文号:国药准字H20066862。 2.10 贮藏:本品应遮光,密封保存; 2.11有效期:24个月。 三、处方和依据: 3.1 处方 盐酸左氧氟沙星 115.1g 干淀粉 40g
二氧化硅适量 制成 1000粒 注:本制剂用混合粉末直接充填,不需制粒。 3.2处方依据:《中华人民共和国药典》2020年版二部。 3.3生产工艺流程图: 质量控制1 检查是否按处方配料、细度、干淀粉水份。 质量控制2 混合时间、混合量、是否符合工艺。 质量控制3 胶囊装量差异、外观是否符合要求。 质量控制4 批号打印是否正确,热封是否严密,裁切是否符合要求,有无缺粒。 质量控制5 检查说明书、小盒、大箱是否与药物一致;有无缺粒,批号、文字、数量是否准确。 质量控制6 检查是否有成品合格证。 五、生产过程及工艺条件: 5.1生产准备: 5.1.1 文件准备 5.1.1.1批制剂指令明确了生产品种名称、规格、生产批号、生产批量、投料量等; 5.1.1.2生产品种应有执行标准、工艺规程、岗位标准操作程序。 5.1.1.3生产地点应有环境要求的文件规定和环境清洁标准操作程序。 5.1.1.4使用设备应有相应的设备操作、维护保养、清洁标准操作程序。 5.1.1.5容器具清洁应有相应的标准操作程序。 5.1.1.6应有岗位所需生产记录(含清场),房间使用卡、设备状态标识卡、生产物料领料单等空白表格。 5.1.1.7其他有关执行文件。 5.1.1.8上述文件均应为现行文件。
微晶玻璃的化学组成 微晶玻璃的化学组成包括基础玻璃成分和成核剂两部分.为了满足玻璃的形成和工艺要求,基础玻璃成分一般都含有一定量的SiO2、B2O3、P2O5和以【AlO4】形式存在的Al2O3等玻璃网络形成体,以【AlO6】形式存在的Al2O3和ZnO等玻璃网络中间体及包括碱金属与碱土金属氧化物在内的玻璃网络调整体。而为了获得无气泡的基础玻璃,通常在基础玻璃组分中引入一定量的澄清剂(如Na2SO4/C、Sb2O3、Na2SiF6等)。此外,为了诱导或促进基础玻璃在热处理过程中的晶核形成,促进玻璃的整体晶化,通常需要引入成核剂。根据基础玻璃成分,可将微晶玻璃分为硅酸盐、铝硅酸盐、硼硅酸盐、硼酸盐和磷酸五大系统。成核剂可以分成三大类:一类是Au、Ag、Cu、Pt、Ru等贵金属盐类物质,当这里物质与玻璃配合料一起熔融时,贵金属元素在高温时以离子状态存在,而在低温下则分解还原成贵金属原子,这些原子经过一定的热处理将在玻璃结构中形成高度分散的金属晶体颗粒,从而实现诱导析晶。另一类是阳离子电荷高、场强大、积聚作用强的氧化物,如ZrO2、TiO2、P2O5等,这三种物质对玻璃的成核作用有所不同。一般认为,ZrO2的成核作用是先从母体玻璃中析出富含锆氧的微不均匀区,进而诱导母体玻璃成核;TiO2的成核作用是先从母体玻璃中析出富含钛酸盐相(无定形态),在一定条件下,这种液相将转变成结晶相,进而使母体玻璃形成晶核;P2O5与前两种成核剂的作用机制不同,由于P5+的场强比Si4+大,有加速硅酸盐玻璃分相的作用,从而促使玻璃核化。ZrO2、TiO2与P2O5是制备微晶玻璃最常用的三种成核剂,除此之外,Cr2O3、Fe2O3等也可作为成核剂使用,但由于它们能使玻璃着色,故很少采用。还有一类成核剂是氟化钙(CaF2)、冰晶石(Na2AlF6)、氟硅酸钠(Na2SiF-6)和氟化镁(MgF2)等氧化物。一般认为氟的加入起减弱玻璃结构的作用,用F-取代O2-造成硅氧网络结构的断裂,这是氟化物诱导玻璃成核的主要原因。另外,当氟含量大于2%~4%时,氟化物就会在冷却(或热处理)过程中从熔体中分离出来,形成细结晶状的沉淀物而引起玻璃乳浊(分相),从而促使玻璃成核。
盐酸左氧氟沙星眼用凝胶说明书 【药品名称】 通用名称:盐酸左氧氟沙星眼用凝胶 商品名称:盐酸左氧氟沙星眼用凝胶(杰奇) 英文名称:Levofloxacin Hydrochloride Eye Gel 拼音全码:YanSuanZuoYangFuShaXingYanYongNingJiao(JieQi) 【主要成份】本品主要成份为盐酸左氧氟沙星,其化学名称为:(S)-(-)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪)-7-氧-7H-吡啶骈[1,2,3-de]-[1,4]苯骈噁嗪-6-羧酸盐酸盐的水合物。 【成份】 分子量:C18H20FN3O4·HCl·H2O 【性状】本品为淡黄色或淡黄绿色透明的凝胶。 【适应症/功能主治】本品适用于细菌性结膜炎、角膜炎、角膜溃疡、泪囊炎、术后感染等外眼感染。 【规格型号】5g 【用法用量】涂于眼下睑穹窿部,每日3次(早、中、晚各一次)。【不良反应】偶有一过性的刺激症状。 【禁忌】对本品成份氧氟沙星或喹诺酮类药物过敏者禁用。 【注意事项】1.不宜长期使用。 2.使用中出现过敏症状,应立即停止使用。 3.只限于眼用。请仔细阅读说明书并遵医嘱使用。 【儿童用药】未进行该项实验且无可靠参考文献。
【老年患者用药】未进行该项实验且无可靠参考文献。 【孕妇及哺乳期妇女用药】未进行该项实验且无可靠参考文献。【药物相互作用】如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。 【药物过量】未进行该项实验且无可靠参考文献。 【药理毒理】药理作用:本品属喹诺酮类抗菌药,为氧氟沙星的左旋体,其抗菌活性约为氧氟沙星的2倍,主要作用机制为抑制细菌DNA旋转酶的活性,抑制细菌DNA的复制。本品具有抗菌谱广、抗菌作用强的特点,对多数肠杆菌科细菌如肺炎克雷白菌、变形杆菌属、伤寒杆菌属、志贺菌属、部分大肠杆菌等有较强的抗菌活性,对部分葡萄球菌、肺炎链球苗、流感杆菌、绿脓杆菌、淋球菌、衣原体等也有良好的抗菌作用。毒理研究:未进行该项实验且无可靠参考文献。【药代动力学】未进行该项实验且无可靠参考文献。 【贮藏】遮光,凉暗处保存。 【包装】药用聚乙烯/铝/聚乙烯复合软膏管,5g/支,1支/盒。【有效期】24 月 【执行标准】WS-587(X-499)-2001 【批准文号】国药准字H20040234
二硅酸锂微晶玻璃材料综述 何志龙-3112007045 (金属材料强度国家重点实验室, 西安交通大学材料科学与工程学院,西安710049) 摘要:微晶玻璃以其优异的力学、化学、生物等性能,在国防、航空、建筑、电子、光学、化工、机械及医疗等领域作为结构材料、技术材料、光学材料、电绝缘材料等而获得广泛应用,吸引了许多研究者的关注。本文在参考学习了诸多相关文献的基础上,对微晶玻璃材料的制备、性能、应用及研究进展进行了论述,列举了人们在该领域取得的重要研究进展,以及微晶玻璃材料领域存在的研究难题。 关键词:晶化,微晶玻璃,综述,非均匀成核 1 研究背景与意义 自从1957年,美国康宁公司著名玻璃化学家S.D.Stookey研制出第一种微晶玻璃以来,微晶玻璃就凭借其组分广泛、性能优异、品种繁多而著称。由于析出的晶粒尺寸可控,与界面结合强度高,抗弯强度可以达到200MPa以上,大量微晶玻璃体系涌现出来,它们的形成机制也得到大量深入研究。 微晶玻璃又称玻璃陶瓷,它是将某些特定组成的基础玻璃,在一定温度下进行控制晶化,制得的一种同时含有微晶相和玻璃相的多晶固体材料。在热处理过程中,基础玻璃内部产生晶核及晶体长大,因为析出的晶体非常小,被称作微晶玻璃。 微晶玻璃既不同于陶瓷,也不同于玻璃。微晶玻璃与陶瓷的不同之处是:玻璃微晶化过程中的晶相是从单一均匀玻璃相或易产生相分离的区域,通过成核和晶体生长而产生的致密材料;而陶瓷材料中的晶相,除了通过固相反应出现的重结晶或新晶相以外,大部分是在制备陶瓷时通过组分直接引入的。微晶玻璃与玻璃的不同之处在于微晶玻璃是微晶体(尺寸为0.1-0.5μm)和残余玻璃组成的复相;而玻璃则是非晶态或无定形体。微晶玻璃可以是透明的或呈各种花纹和颜色的非透明体,而玻璃一般是各种颜色、透光率各异的透明体。 2 微晶玻璃分类 按照基础玻璃的组成,微晶玻璃主要有以下四大类: (1)硅酸盐类微晶玻璃 由碱金属、碱土金属的硅酸盐晶相组成,主晶相有:透辉石、顽辉石、硅灰石、二硅酸锂等,这些晶相的种类影响微晶玻璃的性能。其中,最早研究的矿渣微晶玻璃和光敏微晶玻璃属此类。
盐酸左氧氟沙星注射液说明书 【药品名称】 通用名:盐酸左氧氟沙星注射液 英文名:Levofloxacin Hydrochloride and Sodium Chloride Injection 汉语拼音:Yansuan Zuoyangfushaxing Lühuana Zhusheye 商品名:左克 【成份】 本品主要成份为盐酸左氧氟沙星;其化学名称为(S)-(-)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪基)-7-氧-7H-吡啶并[1,2,3-de]-[1,4]苯并噁嗪-6-羧酸盐酸盐-水合物。 化学结构式: 分子式:C18H20FN3O4·HCl·H2O 分子量:415.85 Cas No:177325-13-2 辅料为:注射用水 【性状】本品为淡黄绿色或黄绿色澄明液体。 【适应症】 本品适用于敏感细菌所引起的下列重度感染: 呼吸系统感染:急性支气管炎、慢性支气管炎急性发作、弥漫性细支气管炎、支气管扩张合并感染、肺炎、扁桃体炎(扁桃体周脓肿); 泌尿系统感染:肾盂肾炎、复杂性尿路感染等; 生殖系统感染:急性前列腺炎、急性副睾炎、宫腔感染、子宫附件炎、盆腔炎(疑有厌氧菌感染时可合用甲硝唑); 皮肤软组织感染:传染性脓疱病、蜂窝组织炎、淋巴管(结)炎、皮下脓肿、肛周脓肿等; 肠道感染:细菌性痢疾、感染性肠炎、沙门菌属肠炎、伤寒及副伤寒; 败血症、粒细胞减少及免疫功能低下患者的各种感染; 其他感染:乳腺炎、外伤、烧伤及手术后伤口感染、腹腔感染(必要时合用甲硝唑)、胆囊炎、胆管炎、骨与关节感染以及五官科感染等。 【规格】 2ml:盐酸左氧氟沙星0.1g(以左氧氟沙星计算) 【用法用量】 静脉滴注:成人一日400ml(0.4g),分2次静滴。重度感染患者及病原菌对本品敏感性较差者(如铜绿假单胞菌),每日最大剂量可增至600ml(0.6g),分2次静滴。 【不良反应】 用药期间可能出现恶心、呕吐、腹部不适、腹泻、食欲不振、腹痛、腹胀消化症状;失眠、头晕、头痛等神经系统症状;皮疹、瘙痒、红斑及注射部位发红、发痒或静脉炎等症状。亦
1 绪论 1.1 微晶玻璃的定义 1.1.1 定义及特性 微晶玻璃(glass-ceramic)又称玻璃陶瓷,是将特定组成的基础玻璃,在加热过程中通过控制晶化而制得的一类含有大量微晶相及玻璃相的多晶固体材料。 玻璃是一种非晶态固体,从热力学观点看,它是一种亚稳态,较之晶态具有较高的内能,在一定的条件下,可转变为结晶态。从动力学观点看,玻璃熔体在冷却过程中,黏度的快速增加抑制了晶核的形成和长大,使其难以转变为晶态。微晶玻璃就是人们充分利用玻璃在热力学上的有利条件而获得的新材料。 微晶玻璃既不同于陶瓷,也不同于玻璃。微晶玻璃与陶瓷的不同之处是:玻璃微晶化过程中的晶相是从单一均匀玻璃相或已产生相分离的区域,通过成核和晶体生长而产生的致密材料;而陶瓷材料中的晶相,除了通过固相反应出现的重结晶或新晶相以外,大部分是在制备陶瓷时通过组分直接引入的。微晶玻璃与玻璃的不同之处在于微晶玻璃是微晶体(尺寸为0.1~0.5μm)和残余玻璃组成的复相材料;而玻璃则是非晶态或无定形体。另外微晶玻璃可以是透明的或呈各种花纹和颜色的非透明体,而玻璃一般是各种颜色、透光率各异的透明体。 尽管微晶玻璃的结构、性能及生产方法与玻璃和陶瓷都有一定的区别,但是微晶玻璃既有玻璃的基本性能,又具有陶瓷的多相特征,集中了玻璃和陶瓷的特点,成为一类独特的新型材料。 微晶玻璃具有很多优异的性能,其性能指标往往优于同类玻璃和陶瓷。如热膨胀系数可在很大范围内调整(甚至可以制得零膨胀甚至是负膨胀的微晶玻璃);机械强度高;硬度大,耐磨性能好;具有良好的化学稳定性和热稳定性,能适应恶劣的使用环境;软化温度高,即使在高温环境下也能保持较高的机械强度;电绝缘性能优良,介电损耗小、介电常数稳定;与相同力学性能的金属材料相比,其密度小但质地致密,不透水、不透气等。并且微晶玻璃还可以通过组成的设计来获取特殊的光学、电学、磁学、热学和生物等功能,从而可作为各种技术材料、结构材料或其他特殊材料而获得广泛的应用。 微晶玻璃的性能主要决定于微晶相的种类、晶粒尺寸和数量、残余玻璃相的性质和数量。以上诸因素,又取决于原始玻璃的组成及热处理制度。热处理制度不但决定微晶体的尺寸和数量,而且在某些系统中导致主晶相的变化,从而使材料性能发生显著变化。另外,晶核剂的使用是否适当,对玻璃的微晶化也起着关键作用。微晶玻璃的原始组成不同,其主晶相的种类不同,如硅灰石、β-石英、β-锂辉石、氟金云母、尖晶石等。因此通过调整基础玻璃成分和工艺制度,就可以制得各种符合性能要求的微晶玻璃。 1.1.2 微晶玻璃的种类 目前,问世的微晶玻璃种类繁多,分类方法也有所不同。通常按微晶化原理分为光敏微晶玻璃和热敏微晶玻璃;按基础玻璃的组成分为硅酸盐系统、铝硅酸盐系统、硼硅酸盐系统、硼酸盐和磷酸盐系统;按所用原料分为技术微晶玻璃(用一般的玻璃原料)和矿渣微晶玻璃(用工矿业废渣等为原料);按外观分为透明微晶玻璃和不透明微晶玻璃;按性能又可分为耐高温、耐腐蚀、耐热冲击、高强度、低膨胀、零膨胀、低介电损耗、易机械加工以及易化学蚀刻等微晶玻璃以及压电微晶玻璃、生物微晶玻璃等。表1-1列出了常用微晶玻璃的基础组成、主晶相及其主要特性。 表1-1常用微晶玻璃的组成、主晶相及主要特性
盐酸左氧氟沙星片 人体相对生物利用度及生物等效性试验 临床研究方案 华中科技大学同济医学院临床药理研究所 华中科技大学同济医学院国家药品临床研究基地 2004年3月
前言 左氧氟沙星(Levofloxacin)又称可乐必妥、利复星、左氧沙星、Cravit、CVFX,由日本Daiichi(第一制药株式会社)公司开发研制;1993年1月在日本首次上市。国内首次注册时间是1995年,注册号为:X950251。 【药理作用】左氧氟沙星是消旋氧氟沙星的左旋体,其抗菌活性是氧氟沙星的2倍。本品作用于细菌的DNA旋转酶(拓扑异构酶II),通过抑制DNA旋转酶的活性来阻碍DNA复制,从而杀灭细菌;它还可以溶解细菌的部分结构。本品对包括厌氧菌在内的革兰氏阳性菌和阴性菌具有广谱抗菌作用,对葡萄球菌、肺炎球菌、淋球菌、化脓性链球菌、溶血性链球菌、肠球菌、大肠杆菌、克雷白氏杆菌、绿脓杆菌、变形杆菌等显示有较强的抗菌活性。另外,本品对衣原体、支原体也有抗菌作用。 【体内过程】左氧氟沙星口服吸收迅速、完全,生物利用度接近100%,同服食物不影响吸收。口服后能迅速有效地渗透到全身,在组织或体液中地药物浓度高于血浆浓度。健康成人单剂量口服本品50、100、200mg后,血浆药物浓度达峰时间为0.9~2.4h,峰浓度分别为0.6、1.2、2.0μg/ml,表观分布容积为1.09~1.26L/kg。本品在体内几乎不代谢,血浆半衰期为4.3~6.0h,在口服24h内,用药剂量的80%~85%以原形从尿液中排泄。 【用法用量】(1)口服:每次0.1~0.2g,每日2~3次,疗程为3~7天。用于淋病治疗时,可单剂量顿服0.4~0.6g。(2)静脉滴注:每次0.2~0.3g,每日2次。 【不良反应】本品的不良反应与氧氟沙星相同,但比较轻。主要
微晶玻璃 摘要:本文介绍了微晶玻璃与普通玻璃和陶瓷的区别,通过分析组成将其分类。 同时描述了微晶玻璃的制备,性质,应用,浅析其发展趋势。 关键词:微晶玻璃组成制备性能应用 Abstract:This paper introduces the difference between microcrystalline glass and common glass and ceramics. Through the analysis of composition classified microcrystalline glass. At the same time, also describe microcrystalline glass’s preparation, property and application. Analysisthe trend of its development. Keywords: Microcrystalline glass preparation property application trend 1 前言 微晶玻璃又称微晶玉石或陶瓷玻璃,是综合玻璃,是一种外国刚刚开发的新型的建筑材料,它的学名叫做玻璃水晶。微晶玻璃和我们常见的玻璃看起来大不相同。它具有玻璃和陶瓷的双重特性,普通玻璃内部的原子排列是没有规则的,这也是玻璃易碎的原因之一。而微晶玻璃象陶瓷一样,由晶体组成,也就是说,它的原子排列是有规律的。所以,微晶玻璃比陶瓷的亮度高,比玻璃韧性强。但晶玻璃既不同于陶瓷,也不同于玻璃。微晶玻璃与陶瓷的不同之处是:玻璃微晶化过程中的晶相是从单一均匀玻璃相或已产生相分离的区域,通过成核和晶体生长而产生的致密材料;而陶瓷材料中的晶相,除了通过固相反应出现的重结晶或新晶相以外,大部分是在制备陶瓷时通过组分直接引入的[1]。微晶玻璃与玻璃的不同之处在于微晶玻璃是微晶体(尺寸为0.1~0.5μm)和残余玻璃组成的复相材料;而玻璃则是非晶态或无定形体。另外微晶玻璃可以是透明的或呈各种花纹和颜色的非透明体,而玻璃一般是各种颜色、透光率各异的透明体。 2分类及其组成 目前,问世的微晶玻璃种类繁多,分类方法也有所不同。通常按微晶化原理分为光敏微晶玻璃和热敏微晶玻璃;按基础玻璃的组成分为硅酸盐系统、铝硅酸盐系统、硼硅酸盐系统、硼酸盐和磷酸盐系统;按所用原料分为技术微晶玻璃(用一般的玻璃原料)和矿渣微晶玻璃(用工矿业废渣等为原料);按外观分为透明微晶玻璃和不透明微晶玻璃;按性能又可分为耐高温、耐腐蚀、耐热冲击、高强度、低膨胀、零膨胀、低介电损耗、易机械加工以及易化学蚀刻等微晶玻璃以及压电微晶玻璃、生物微晶玻璃等 晶玻璃的组成在很大程度上决定其结构和性能。按照化学组成微晶玻璃主要分为四类:硅酸盐微晶玻璃,铝硅酸盐微晶玻璃,氟硅酸盐微晶玻璃,磷酸盐微晶玻璃。 2.1 硅酸盐微晶玻璃 简单硅酸盐微晶玻璃主要由碱金属和碱土金属的硅酸盐晶相组成,这些晶相的性能也决定了微晶玻璃的性能。研究最早的光敏微晶玻璃和矿渣微晶玻璃属于 这类微晶玻璃。光敏微晶玻璃中析出的主要晶相为二硅酸锂(Li 2Si 2 O 5 ),这种晶 体具有沿某些晶面或晶格方向生长而成的树枝状形貌,实质上是一种骨架结构。
LEV AQUIN?(左氧氟沙星)片剂 LEV AQUIN?(左氧氟沙星)口服液 LEV AQUIN?(左氧氟沙星)注射剂 LEV AQUIN?(含5%葡萄糖的左氧氟沙星)注射剂 处方信息 为减少耐药菌株的发生并维持LEV AQUIN?(左氧氟沙星)与其他抗菌药物的疗效, LEV AQUIN?(左氧氟沙星)只能用于治疗或预防已证实由细菌引起或高度疑似由细菌引起的感染。 描述 LEV AQUIN?(左氧氟沙星)是人工合成的口服或静脉滴注用广谱抗菌药。左氧氟沙星是消旋氧氟沙星的纯-(S)-异构体,化学上来讲它是一种手性氟羧基喹诺酮。化学名是(S)-(-)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪基)-7-氧代-7H-吡啶并[1,2,3-de]-[1,4]苯并噁嗪-6-羧酸半水合物。化学结构是: 分子式是C18H20FN3O4·1/2H2O,分子量370.38。左氧氟沙星是一种白色至淡黄色的晶体或晶状粉末。在小肠pH条件下呈两性离子。数据显示在pH0.6-5.8范围内,左氧氟沙星的溶解度恒定(大约为100mg/ml)。USP命名原则指出在这个pH范围内,左氧氟沙星溶解度是“可溶至易溶”。超过pH5.8,溶解度迅速增加并在pH6.7时的达最大值(272mg/ml),此范围内是“易溶”。超过pH6.7,溶解度下降并在pH约为6.9时达到最小值(约50mg/ml)。 左氧氟沙星能与许多金属离子生成稳定的配位化合物。在体外,金属离子与其螯合的能力顺序为:Al+3>Cu+2>Zn+2>Mg+2>Ca+2。 LEV AQUIN片剂是薄膜衣片剂,含有下列非活性成分: 250mg(以无水形式):羟丙甲纤维素,交联聚维酮,维晶纤维素,硬脂酸镁,聚乙二醇,钛白粉,聚山梨酯80和合成氧化铁红 500mg(以无水形式):羟丙甲纤维素,交联聚维酮,维晶纤维素,硬脂酸镁,聚乙二醇,钛白粉,聚山梨酯80和合成氧化铁红 750mg(以无水形式):羟丙甲纤维素,交联聚维酮,维晶纤维素,硬脂酸镁,聚乙二醇,钛白粉,聚山梨酯80 LEV AQUIN口服液(25mg/ml)是多用途,自我防腐的左氧氟沙星溶液,pH范围在5.0至6.0 LEV AQUIN口服液外观澄清,呈黄色至绿黄色。这种颜色不同不会对产品的功效产生不良影
盐酸左氧氟沙星片说明书 【药品名称】 通用名称:盐酸左氧氟沙星片 商品名称:盐酸左氧氟沙星片(彼迪) 英文名称:Levofloxacin Hydrochloride Tablets 拼音全码:YanSuanZuoYangFuShaXingPian(BiDi) 【主要成份】本品主要成份为盐酸左氧氟沙星。 【成份】 化学名:(S)-(-)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪)-7-氧-7H-吡啶骈[1,2,3-de]-[1,4]苯并噁嗪-6-羧酸盐酸盐的水合物分子量:C18H20FN3O4·HCl·H2O 【性状】本品薄膜衣片,除去薄膜衣后显白色。 【适应症/功能主治】适用于敏感菌引起的:1.泌尿生殖系统感染,包括单纯性、复杂性尿路感染、细菌性前列腺炎、淋病奈瑟菌尿道炎或宫颈炎(包括产酶株所致者)。2.呼吸道感染,包括敏感革兰阴性杆菌所致支气管感染急性发作及肺部感染。3.胃肠道感染,由志贺菌属、沙门菌属、产肠毒素大肠杆菌、亲水气单胞菌、副溶血弧菌等所致。4.伤寒。5.骨和关节感染。6.皮肤软组织感染。7.败血症等全身感染。 【规格型号】 0.2g*12s
【用法用量】盐酸左氧氟沙星口服制剂和注射剂用于上述感染性疾病(详见适应症)的治疗,通用的用法用量如下所示,但必须结合疾病严重程度由临床医生最终决定。1.剂量和给药方法(1)肾功能正常患者中剂量盐酸左氧氟沙星口服制剂的常用剂量为250mg或750mg,每24小时口服一次,根据感染情况按照下表所示服用。【详情请见说明书】 【不良反应】 1.胃肠道反应:腹部不适或疼痛、腹泻、恶心或呕吐。 2.中枢神经系统反应可有头昏、头痛、嗜睡或失眠。 3.过敏反应:皮疹、皮肤瘙痒,偶可发生渗出性多形性红斑及血管神经性水肿。光敏反应较少见。 4.偶可发生:①癫痫发作、精神异常、烦躁不安、意识模糊、幻觉、震颤。②血尿、发热、皮疹等间质性肾炎表现。③静脉炎。④结晶尿,多见于高剂量应用时。⑤关节疼痛。 5.少数患者可发生血清氨基转移酶升高、血尿素氮增高及周围血象白细胞降低,多属轻度,并呈一过性。 【禁忌】对本品及氟喹诺酮类药过敏的患者禁用。 【注意事项】 1.由于目前大肠埃希菌对氟喹诺酮类药物耐药者多见,应在给药前留取尿培养标本,参考细菌药敏结果调整用药。2.本品大剂量应用或尿pH值在7以上时可发生结晶尿。为避免结晶尿的发生,宜多饮水,保持24小时排尿量在1200ml以上。3.肾功能减退者,需根据肾功能调整给药剂量。4.应用本品时应避免过度暴露于阳光,如发生光敏反应或其他过敏症状需停药。5.肝功能减退时,如属重度(肝硬化腹水)可减少药物清除,血药浓度增高,肝、肾功
对主要研究结果的总结及评价xxxx制药有限责任公司
1、综述资料: 盐酸左氧氟沙星原料药、盐酸左氧氟沙星片收载于《中华人民共和国药典》(20xx年版)2004年增补本,故名称如下: 【药品名称】 通用名:盐酸左氧氟沙星片 英文名:Levofloxacin Hydrochloride Tablets 汉语拼音:Yansuan zuoYangfushaxing Pian 本品主要成分为盐酸左氟沙星。其化学名为(-)-(S)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪基)-7-氧-7H –吡啶并[1,2,3-de]-[1,4]苯并嗪-6-羧酸盐酸盐一水合物。其化学结构式为: 分子式:C18H20FN3O4·HCl·H2O 分子量:415.85 2、药学研究资料: 2. 1处方: 盐酸左氧氟沙星 115.0 g 预胶化淀粉 35.0 g 10%淀粉浆 10.0g(折淀粉) 羧甲基淀粉钠 2.0g 微晶纤维素 5.0g 制成 1000片
2.2工艺规程: 2.2.1 称取盐酸左氧氟沙星原料药、预胶化淀粉分别过80目筛网。 2.2.2 称取处方量盐酸左氧氟沙星原料药115g、预胶化淀粉35g,按等量递加法混合均匀。 2.2.3 称取淀粉20g,加纯化水(约20g)搅拌溶解。加沸纯化水至200g,搅拌,制成10%淀粉浆。 2.2.4 加入处方量的10%的淀粉浆搅拌5分钟,并高速制粒。 2.2.5 将颗粒在80℃以下烘干。 2.2.6 将烘干的颗粒,用旋涡振荡筛整粒,外加2 g羧甲基淀粉钠,5g微晶纤维素混合均匀,制得半成品。 2.2.7 半成品检验合格后,定片重,压片。 2.2.8 素片检验合格后,包薄膜衣。 2.2.9 铝塑罩泡包装即得。 2.3、三批小试技术数据: 2.2、质量研究: 盐酸左氧氟沙星片试制样品批号为:xx0216 xx0217 xx0218 和对照样品(浙江京新药业股份有限公司批号:xx01312 )按《中华人民共和国药典》(2010年版)进行实验,试验研究结果如下:
海南大学2012-2013学年度第2学期《功能材料学》论文 题目:微晶玻璃的光学应用 姓名: 学号: 20100607310014 学院:材料与化工学院 专业班级: 10理科实验班
微晶玻璃的光学应用 刘涛 20100607310014 摘要:微晶玻璃也叫做玻璃陶瓷,是玻璃经过晶化处理得到的部分结晶态的物质,它兼具玻璃和陶瓷的优良性质,比陶瓷的亮度高,比玻璃韧性强,因而广泛用于建筑、航天等各个领域。中国稀土资源丰富,由于稀土离子特殊的4f电子层结构使其具有许多优越的性能,目前稀土发光材料引起了全世界的广泛关注。微晶玻璃的高透过性和优越的机械性能使其能够做为稀土元素的良好基质,制成的稀土掺杂发光微晶玻璃广泛应用于荧光设备、激光、波导激光、上转换材料等领域,具有重要的现实意义。 关键词:微晶玻璃稀土元素光学应用 一、固体发光过程 发光是物体不经过热阶段而将其内部以某种方式吸收的能量直接转换为非平衡辐射的现象。当物质受到外界能量(如光照、外加电场或电子束轰击等)的激发后,吸收外界能量而处于激发态,它在跃迁返回基态的过程中,吸收的能量会通过光或热的形式释放出来,如果这部分能量以光的电磁波形式辐射出来,即为发光。图1所示即为发光的过程[1]: 图1:发光的过程示意图 激活剂A吸收激发光的能量被激发(EXC),由基态A变为激发态A*,然后又回到基态(R),并发出光(EM)[2]。 二、发光材料的应用及稀土掺杂微晶玻璃的优点
发光材料在人们日常生活中有着重要的应用,从照明、显像到医学、放射学等领域,无不存在着发光材料的身影。在发光材料的发展中,稀土掺杂的发光材料格外引人注目,由于稀土离子特殊的4f电子层结构,决定其具有许多优越的性能:物理化学性质稳定、耐高温、可承受大功率电子束、高能辐射和强紫外光的作用;荧光寿命宽泛,可以跨越纳秒到毫秒6个数量级;发光颜色度纯、转换效率高、发射波长分布区域宽等。这些优异的性能使得稀土发光材料广泛应用于荧光设备、激光、波导激光、上转换材料等领域[3]。 稀土掺杂的基质材料一般为晶体,也可以是非晶态玻璃材料,晶体和玻璃作为稀土掺杂发光材料的基质各有优缺点,发光玻璃保证了发光光材料的稳定性,但是与同组成的晶体材料相比,发光玻璃的发光强度弱,转换效率也比较低[4],而微晶玻璃作为一种晶态和非晶态共存的材料,兼具了晶体发光材料优异的发光性能及玻璃材料的优异特性,其内部晶相能够保持发光晶体材料原有的发光性能,其熔制时的液体状态亦能够保证其均匀性,微晶玻璃亦具有良好的稳定性及可加工性,具有重要的研究价值。 三、微晶玻璃的分类、制备及显微结构 1、微晶玻璃的分类 按照玻璃陶瓷的化学组成来讲,玻璃陶瓷分为四大类:硅酸盐玻璃陶瓷、铝硅酸盐玻璃陶瓷、氟硅酸盐玻璃陶瓷、磷酸盐玻璃陶瓷[12] 。 1.1 硅酸盐玻璃陶瓷 硅酸盐玻璃陶瓷主要是由碱金属和碱土金属两部分组成,主晶相为硅酸盐,晶相可以决定玻璃陶瓷的性能[13]。硅酸盐玻璃陶瓷可分为两种:光敏玻璃陶瓷和 矿渣玻璃陶瓷。光敏玻璃陶瓷是以二硅酸锂(Li 2Si 2 O 5 )为主晶相的,这种晶体是 一种骨架结构[14],形貌像树枝,因为它的晶体生长方向是沿某些晶面,或者晶格 方向。而矿渣玻璃陶瓷主晶相则为硅灰石(CaSiO 3)和透辉石[Ca Mg(SiO 3 ) 2 ]。透 辉石因为其结构的特殊性,比硅灰石更加耐磨,耐腐烛,强度也更高。 1.2 铝硅酸盐玻璃陶瓷 铝硅酸盐玻璃陶瓷包括Li 2O—Al 2 O 3 —SiO 2 系统、MgO—Al 2 O 3 —SiO 2 系统、Na 2 O
盐酸左氧氟沙星片 Levofloxacin Hydrochloride Tablets 一、参比试剂的选择 1、国内上市情况 目前国内盐酸左氧氟沙星片有93个文号,规格有为100mg、200mg、250mg、500mg。 山东华信制药集团股份有限公司规格:100mg。 盐酸左氧氟沙星片国内无进口。 2、国外上市情况 左氧氟沙星由赛诺菲-安万特公司开发,商品名为“Tavanic”,美国市场授权给强生公司,美国上市规格为250mg、500mg、750mg。1993年赛诺菲将欧洲、亚洲、非洲、中东和南美等地区的生产和销售权授予给第一三共株式会社。 盐酸左氧氟沙星片未在EMEA上市。 左氧氟沙星片在日本上市,规格为100mg、250mg、500mg。其中第一三共株式会社上市规格为250mg、500mg。 3、参比制剂 左氧氟沙星片原研厂家为JANSSEN PHARMS,其于1996年12月20日获得FDA批准在美国上市,规格为250mg、500mg、750mg。规格与华信制药集团差别大且需要一次性进口。 左氧氟沙星片由第一三共株式会社在国内生产,规格分别为0.1g和0.5g,分别于2000年和2004年获得生产批件,批准文号分别为国药准字H20000655和国药准字H20040091。 盐酸左氧氟沙星在国内无进口制剂,也无进口本地化制剂上市。氧氟沙星片由第一三共株式会社生产,规格为0.1g和0.5g。第一三共株式会社在亚洲的生产和销售权为原研公司赛诺菲授予,因此第一三共株式会社的左氧氟沙星片既是原研制剂,可作为国内一致性评价的参比制剂。 二、体外溶出曲线 1、左氧氟沙星片FDA溶出方法
微晶玻璃简要概述 刘帅聪 (无机非金属材料工程1301班,湖南工学院材料与化学工程学院 湖南衡阳 421002) 摘要 微晶玻璃是通过基础玻璃或其它材料在加热过程中进行控制晶化而得到的一种中含有大量微晶体和玻璃体的复合固体材料。由于其机械强度高、热膨胀性可调、抗热震性好、耐化学腐蚀、介电损耗低、电绝缘性好等优越的综合性能,已在许多领域得到广泛的应用。 关键词微晶玻璃特点制备工艺应用发展 Brief Introduction of Glass - Ceramics Shuai Cong Liu (Inorganic Nonmetallic Materials Engineering1301class,Hunan Institute of TechnologyDepartment of Material and Chemical Engineering Hunan Hengyang 421002) Abstract: Crystalline glass is a composite solid material containing a large amount of microcrystals and vitreous bodies obtained by controlling crystallization during the heating process by the base glass or other materials. Because of its high mechanical strength, adjustable thermal expansion, good thermal shock resistance, chemical resistance, low dielectric loss, good electrical insulation properties such as superior performance, has been widely used in many fields. Key words: glass - ceramics, characteristics, preparation technology, application development
H P L C法测定盐酸左氧氟 沙星片的含量 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
HPLC法测定盐酸左氧氟沙星片的含量 摘要:目的:对HPLC及UV测定盐酸左氧氟沙星片的含量进行比较。方法:高效液相色谱法选择色谱柱为AgilentC18(150 mm×4.6 mm,5μm),流动相为醋酸铵高氯酸钠溶液(pH=-乙腈(85:15),流速为·min-1,检测波长为294nm;紫外分光光度法选择294nm波长测定含量.结果:HPLC法中盐酸左氧氟沙星片在·mL-1~·mL-1范围内线性关系良好.回归方程Y=523247X-23331(r=),加样回收率平均值为%,%。结论:HPLC法及紫外分光光度法均准确性、重复性高、精密度好,可考虑将紫外分光光度法作为盐酸左氧氟沙星含量测定的替代方法使用。 关键词:高效液相法;紫外分光光度法;盐酸左氧氟沙星 左氧氟沙星是氧氟沙星的L-型光学活性异构体,因其抗菌谱广、抗菌作用强、不良反应率较低,而被广泛使用[1]。2015版药典推荐高效液相法来分析本品及其相关剂型,考虑到基层药物监测机构尚不能完全普及高效液相设备[2],本文对比分析高效液相法及紫外分光光度法测定盐酸左氧氟沙星含量。 1材料 仪器与试药 岛津LC-20A(改为LC-2010CHT)型高效液相色谱仪;岛津UV-2501(改为UV-2450)型紫外分光光度计;超声波清洗器;乙腈由国药集团化学试剂有限公司提供(改为霍尼韦尔贸易(上海)有限公司提供),为色谱醇;磷酸、醋酸铵、高氯酸钠均为分析纯;盐酸左氧氟沙星对照品(美国西格玛公司,批号:
盐酸左氧氟沙星片 【药品名称】 通用名称:盐酸左氧氟沙星片 英文名称:Levofloxacin Hydrochloride Tablets 商品名称:乐朗 【成份】 本品主要成份为盐酸左氧氟沙星。其化学名为(S)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪基)-7-氧代-7H–吡啶并[1,2,3-de]-[1,4]苯并嗪-6-羧酸盐酸盐的水合物。 结构式: 分子式:C18H20FN3O4 分子量:415.85 【性状】本品为白色薄膜衣片,除去薄膜后显类白色或淡黄色。 【适应症】 本品适用于敏感细菌所引起的下列轻、中度感染: 1.呼吸系统感染:急性支气管炎,慢性支气管炎急性发作、弥漫性细支气管炎、支气管扩张合并感染、肺炎、扁桃体炎(扁桃体周围脓肿); 2.泌尿系统感染:肾盂肾炎、复杂性尿路感染等; 3.生殖系统感染:急性前列腺炎、急性副睾炎、宫腔感染、子宫附件炎、盆腔炎(疑有厌氧菌感染时可合用甲硝唑); 4.皮肤软组织感染:传染性脓疱病、蜂窝组织炎、淋巴管(结)炎、皮下脓肿、肛周脓肿等; 5.肠道感染:细菌性痢疾、感染性肠炎、沙门菌属肠炎、伤寒及副伤寒; 败血症、粒细胞减少及免疫功能低下患者的各种感染; 6.其他感染:乳腺炎、外伤、烧伤及手术后伤口感染、腹腔感染(必要时合用甲硝唑)、胆囊炎、胆管炎、骨与关节感染以及五官科感染等。
【规格】:0.5g(以左氧氟沙星计) 【用法用量】 口服,成人每次0.5g(1片),一日1次。具体推荐剂量见下表(表1)。 表1 肾功能正常病人推荐用法用量 【不良反应】 本品为盐酸左氧氟沙星,其活性成分为左氧氟沙星,文献报道的左氧氟沙星的相关情况如下: 1.严重的和其他重要的不良反应 下述严重和其他重要的不良反应已在【注意事项】中详细说明:肌腱炎和肌腱断裂、重症肌无力恶化、超敏反应、其他严重和有时致命的反应、肝毒性、中枢性神经系统效应、难辨梭菌相关腹泻、周围神经病、QT间期延长、儿科患者中的肌肉骨骼疾病、血糖紊乱、光敏感性/光毒性和耐药细菌产生。 左氧氟沙星快速静脉滴注或者推注可能导致低血压。应根据剂量,静脉滴注不少于60-90分钟。据报告,使用喹诺酮类药物(包括左氧氟沙星)可能导致结晶尿和管型尿。因此,对于接受左氧氟沙星治疗的患者,应当维持适当的水化,以防止形成高度浓缩尿。 2.临床试验经验 由于临床试验在不同的条件下完成,在临床试验中观察到的一种药物的不良反应率不能直接和其他药物在临床试验中的不良反应率相比较,且未必反映在实际应用中的不良反应率。
微晶玻璃的制备 一、文献综述 1、微晶玻璃的概念 微晶玻璃又叫微晶玉石或瓷玻璃,是综合玻璃,学名叫做玻璃水晶。 微晶玻璃和我们常见的玻璃看起来大不相同。它具有玻璃和瓷的双重特性,普通玻璃部的原子排列是没有规则的,这也是玻璃易碎的原因之一。而微晶玻璃象瓷一样,由晶体组成,也就是说,它的原子排列是有规律的。 所以,微晶玻璃比瓷的亮度高,比玻璃韧性强。但微晶玻璃不同于瓷和玻璃。 微晶玻璃与瓷的不同之处是:玻璃微晶化过程中的晶相是从单一均匀玻璃相或已产生相分离的区域,通过成核和晶体生长而产生的致密材料; 而瓷材料中的晶相,除了通过固相反应出现的重结晶或新晶相以外,大部分是在制备瓷时通过组分直接引入的。微晶玻璃与玻璃的不同之处在于微晶玻璃是微晶体(尺寸为0.1~0.5μm)和残余玻璃组成的复相材料;而玻璃则是非晶态或无定形体。 另外微晶玻璃可以是透明的或呈各种花纹和颜色的非透明体,而玻璃一般是各种颜色、透光率各异的透明体。 2、微晶玻璃的分类 (1)通常按微晶化原理分为光敏微晶玻璃和热敏微晶玻璃; (2)按基础玻璃的组成分为硅酸盐系统、铝硅酸盐系统、硼硅酸盐系统、硼酸盐和磷酸盐系统; (3)按所用原料分为技术微晶玻璃(用一般的玻璃原料)和矿渣微晶玻璃(用工矿业废渣等为原料); (4)按外观分为透明微晶玻璃和不透明微晶玻璃; (5)按性能又可分为耐高温、耐腐蚀、耐热冲击、高强度、低膨胀、零膨胀、低介电损耗、易机械加工以及易化学蚀刻等微晶玻璃以及压电微晶玻璃、生物微晶玻璃等 (6)晶玻璃的组成在很大程度上决定其结构和性能。按照化学组成微晶玻璃主要分为四类:硅酸盐微晶玻璃,铝硅酸盐微晶玻璃,氟硅酸盐微晶玻璃,磷酸盐微晶玻璃。 3、微晶玻璃的制备方法 微晶玻璃的制备方法根据其所用原材料的种类、特性、对材料的性能要求而变化,主要的有熔融法、烧结法、溶胶—凝胶法、二次成型工艺、强韧化技术等。 3.1、熔融法(整体析晶法) 熔融后急冷,退火后在经一定的热处理制度进行成核和晶化以获得晶粒细小、含量多、结构均匀的微晶玻璃制品。热处理制度的确定是微晶玻璃生产的关