中学常见的缩聚反应
一、缩聚反应的定义
缩聚反应,是一类有机化学反应,是具有两个或两个以上官能团的单体,相互反应生成高分子化合物,同时产生有简单分子(如H2O、HX、醇等)的化学反应。兼有缩合出低分子和聚合成高分子的双重含义,反应产物称为缩聚物(是混合物)。缩聚反应本质可看作为取代。
二、缩聚反应特征和分类
1.特征
缩聚反应通常是官能团间的聚合反应
比如说氨基酸脱水缩合就是一个典型的缩聚反应,反应中有低分子副产物产生,如水、醇、氨等。缩聚物中往往留有官能团的结构特征, 如-OCO- -NHCO- ,故大部分缩聚物都是杂链聚合物。缩聚物的结构单元比其单体少若干原子,故分子量不再是单体分子量的整数倍。缩聚反应即缩合聚合反应,单体经多次缩合而聚合成大分子的反应。该反应常伴随着小分子的生成。具有两个或两个以上官能团的单体,相互反应生成高分子化合物,同时产生有简单分子(如H2O、HX、醇等)的化学反应。如:甲醛跟过量苯酚在酸性条件下生成酚醛树脂(线型),在碱性和甲醛过量条件下,则生成网状高分子。再如:由对苯二甲酸和乙二醇生成聚酯树脂。缩聚反应是合成高分子化合物的基本反应之一,在有机高分子化工领域有重要应用
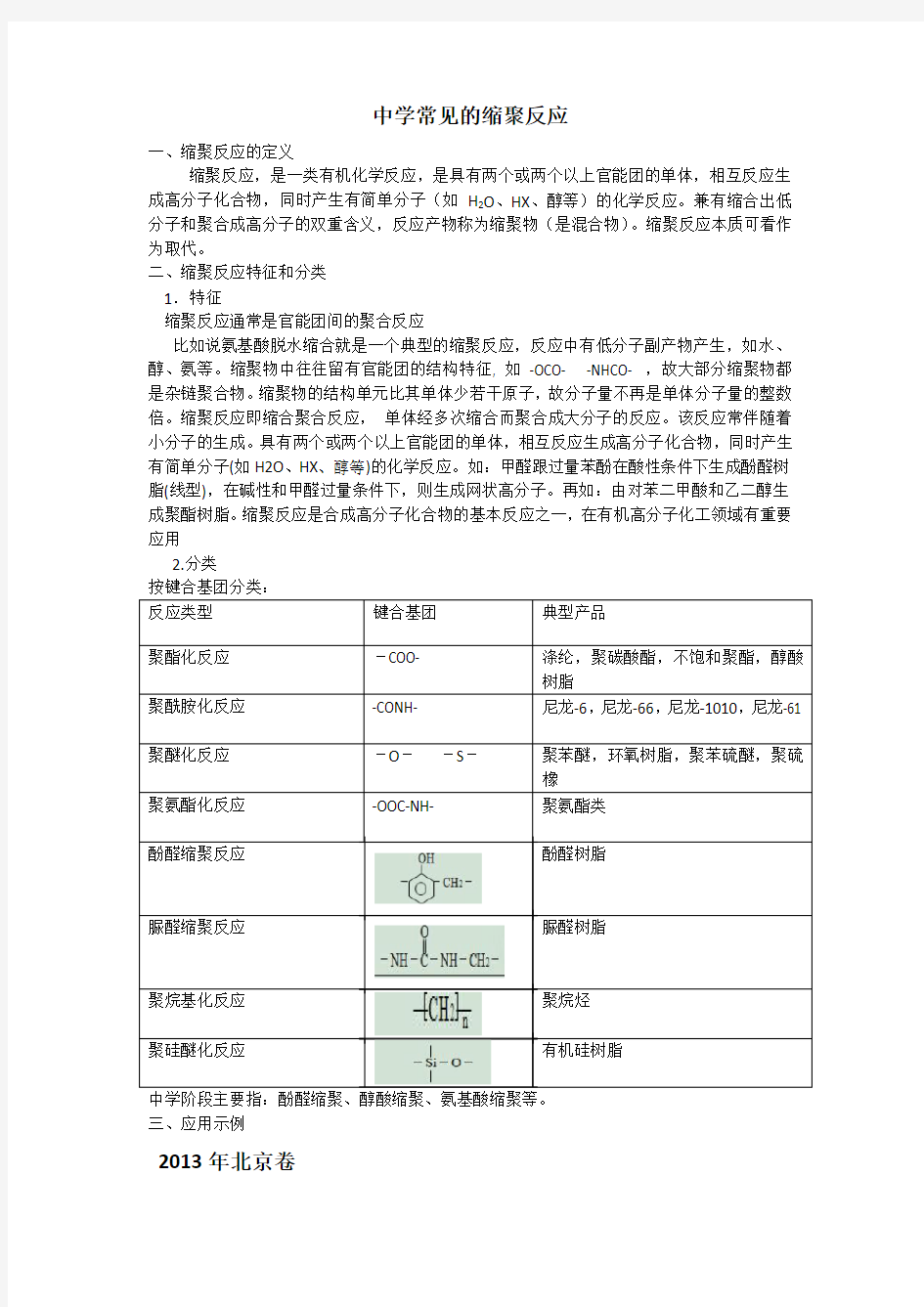
2.分类
按键合基团分类:
酚醛树脂
脲醛树脂
聚烷烃
有机硅树脂
三、应用示例
2013年北京卷
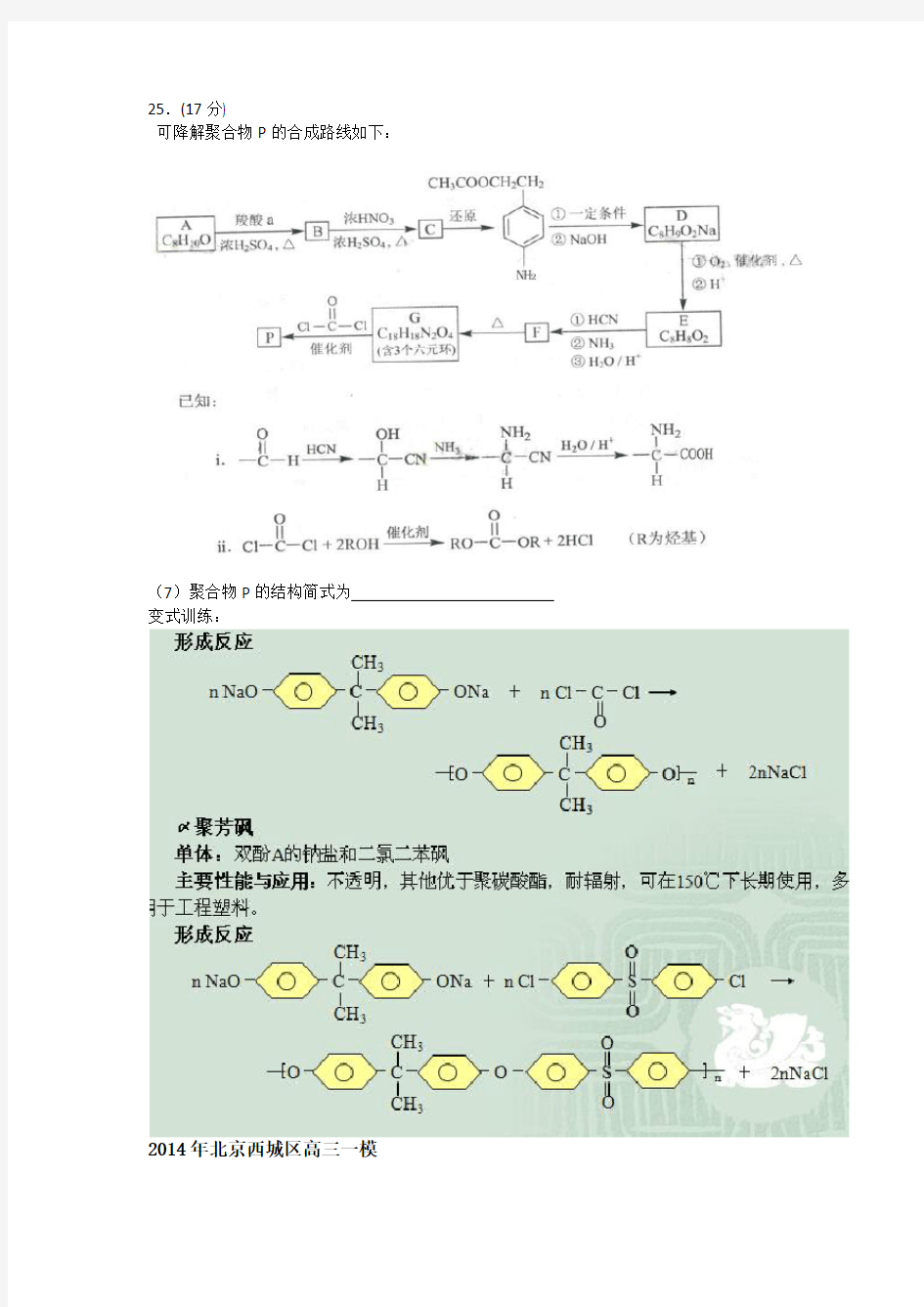
25.(17分)
可降解聚合物P的合成路线如下:
(7)聚合物P的结构简式为_________________________ 变式训练:
2014年北京西城区高三一模
25.(17分)以乙炔或苯为原料可合成有机酸H2MA ,并进一步合成高分子化合物PMLA 。
I .用乙炔等合成烃C 。
(1)A 分子中的官能团名称是 、____。
(2)A 的一种同分异构体属于乙酸酯,其结构简式是____。 (3)B 转化为C 的化学方程式是____,其反应类型是一 。 II .用烃C 或苯合成PMLA 的路线如下。
(4)1 mol 有机物H 与足量NaHC03溶液反应生成标准状况下的C02 44.8 L ,H
有顺反异构,其反式结构简式是____。 (5)E 的结构简式是____。
(6)G 与NaOH 溶液在加热条件下反应的化学方程式是 。
(7)聚酯PMLA 有多种结构,写出由H 2MA 制PMLA 的化学方程式(任写一种)____ 。
HOOCCH2CH(-OH)-COOH 的缩聚产物
2014年海淀区高三一模
25.(16分)高分子材料PET 聚酯树脂和PMMA 的合成路线如下:
2
C
CH 3
3
n (PMMA )
已知:
Ⅰ. RCOOR’+ R’’18OH
RCO 18OR’’+R’OH(R 、R’、R’’代表烃基)
Ⅱ.
-
2+
R C
O R
R C COOH
OH R
(R 、R ’代表烃基)
’
’
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d. 1 mol 烯
Br2 / CCl4
A NaOH溶液
B
COOCH3
3
催化剂,
D
PET单体
PET树脂
催化剂,
聚合
CH2C
CH3
COOCH3
①②
③
④
⑤⑥
⑦n
(PMMA)C12H14O6
E
H8O)
O2
Cu /
i. HCN / OH-
ii. H2O / H +
浓 H2SO4,
PMMA
单体⑧
F G I
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是
________。
(8)写出由PET单体制备PET聚酯并生成B的化学方程式________。
第(8)问答案:
变式训练:
2013年山东卷(4)
33、(8分)【化学-有机化学基础】
聚酰胺-66常用来生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线
进行合成,
C
HOCH2
CH2O
O
C
O
O CH2CH2O H + (n-1) CH2CH2
OH COOCH2CH2OH
COOCH2CH2OH
催化剂
n
n
(1)能与银氨溶液反应的B的同分异构体的结构简式为。(2)D的结构简式为;①的反应类型为。(3)为检验D中的官能团,所用试剂包括NaOH水溶液及。(4)由F和G生成H的反应方程式为。
33【答案】(1)CH
3CH
2
CH
2
CHO (CH
3
)CHCHO
(2)取代反应
(3)AgNO
3与HNO
3
(4)nHOOC(CH
2)
4
COOH + nH
2
N (CH
2
)
6
NH
2
+
(2n-1)H
2
O 变式训练:
其它如:
同学们下去多分析,多想办法就能将这类试题做好。
催化剂
初中化学反应方程式汇总 一、氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧:2Mg + O2点燃 2MgO 2. 铁在氧气中燃烧:3Fe + 2O点燃 Fe3O4 3. 铜在空气中受热:2Cu + O2加热 2CuO 4. 铝在空气中燃烧:4Al + 3O2点燃 2Al2O3 5. 氢气中空气中燃烧:2H2 + O2点燃 2H2O 6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2点燃 2P2O5 7. 硫粉在空气中燃烧: S + O2点燃 SO2 8. 碳在氧气中充分燃烧:C + O2点燃 CO2 9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO + O2点燃 2CO2 11. 甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O 12. 酒精在空气中燃烧:C2H5OH + 3O2点燃 2CO2 + 3H2O (3)氧气的来源: 13.玻义耳研究空气的成分实验 2HgO 加热 Hg+ O2↑ 14.加热高锰酸钾:2KMnO4加热 K2MnO4 + MnO2 + O2↑(实验室制氧气原理1) 15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO22H2O+ O2↑(实验室制氧气原理2) 二、自然界中的水: 16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑
17.生石灰溶于水:CaO + H2O == Ca(OH)2 18.二氧化碳可溶于水: H2O + CO2==H2CO3 三、质量守恒定律: 19.镁在空气中燃烧:2Mg + O2点燃 2MgO 20.铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu 21.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O 22. 镁还原氧化铜:Mg + CuO 加热 Cu + MgO 四、碳和碳的氧化物: (1)碳的化学性质 23. 碳在氧气中充分燃烧:C + O2点燃 CO2 24.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑ 25.焦炭还原氧化铁:3C+ 2Fe2O3高温 4Fe + 3CO2↑ (2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层:C + O2点燃 CO2 27.煤炉的中层:CO2 + C 高温 2CO 28.煤炉的上部蓝色火焰的产生:2CO + O2点燃 2CO2 (3)二氧化碳的制法与性质: 29.大理石与稀盐酸反应(实验室制二氧化碳): CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑ 31.二氧化碳可溶于水: H2O + CO2== H2CO3 32.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO + CO2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳): Ca(OH)2 + CO2 == CaCO3 ↓+ H2O (4)一氧化碳的性质:
三、氧化还原反应 1、准确理解氧化还原反应的概念 1.1 氧化还原反应各概念之间的关系 (1)反应类型: 氧化反应:物质所含元素化合价升高的反应。 还原反应:物质所含元素化合价降低的反应。 氧化还原反应:有元素化合价升高和降低的反应。 (2)反应物: 氧化剂:在反应中得到电子(化合价降低)的物质-----表现氧化性 还原剂:在反应中失去电子(化合价升高)的物质-----表现还原性 (3)产物: 氧化产物:失电子被氧化后得到的产物-----具有氧化性 还原产物:得电子被还原后得到的产物-----具有还原性 (4)物质性质: 氧化性:氧化剂所表现出得电子的性质 还原性:还原剂所表现出失电子的性质 注意:a.氧化剂还原剂可以是不同物质,也可以是同种物质 b氧化产物、还原产物可以是不同物质,也可以是同种物质 C.物质的氧化性(或还原性)是指物质得到(或失去)电子的能力,与物质得失电子数目的多少无关(5)各个概念之间的关系如下图 1.2 常见的氧化剂与还原剂 (1)物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。 ①元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S ②元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S ③元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S (2)重要的氧化剂 ①活泼非金属单质,如F2、Cl2、Br2、O2等。 ②元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓H2SO4,HNO3;
初中化学反应常见基本的化学方程式大全: (1)单质与氧气的反应:(化合反应) 1.镁在空气中燃烧:2Mg+O 2====点燃 2MgO (耀眼白光) 2.铁在氧气中燃烧:3Fe+2O 2====点燃Fe 3O 4 (火光四射,黑色固体) 3.铜在空气中受热:2Cu+O 2====加热2CuO 4.铝在空气中燃烧:4Al+3O 2====点燃2Al 2O 3 5.氢气中空气中燃烧:2H 2+O 2====点燃2H 2O (烧杯内壁有水珠生成) 6.红磷在空气中燃烧(研究空气组成的实验):4P+5O 2====点燃 2P 2O 5 (大量白烟,会溶于水) 7.硫粉在空气中燃烧:S+O 2====点燃 SO 2 (蓝紫色火焰,刺激性气味产生) 8.碳在氧气中充分燃烧:C+O 2====点燃CO 2 (发出白光,澄清石灰水变浑浊) 9.碳在氧气中不充分燃烧:2C+O 2====点燃2CO (无色无味,有毒) (2)化合物与氧气的反应: 10.一氧化碳在氧气中燃烧:2CO+O 2====点燃2CO 2 11.甲烷在空气中燃烧:CH 4+2O 2====点燃 CO 2+2H 2O 12.酒精在空气中燃烧:C 2H 5OH+3O 2====点燃2CO 2+3H 2O (3)氧气的来源 13、加热氯酸钾:2KClO 3 ﹦= 2KCl+ 3O 2(实验室制氧气原理1) 14.加热高锰酸钾:2KMnO 4====加热 K 2MnO 4+MnO 2+O 2↑(实验室制氧气原理2) 15.过氧化氢在二氧化锰作催化剂条件下分解反应:H 2O 2=====MnO2 2H 2O+O 2↑(实验室制氧气原理3) 二、自然界中的水: 16.水在直流电的作用下分解(研究水的组成实验):2H 2O ====通电 2H 2↑+O 2↑ 17.生石灰溶于水:CaO+H 2O==Ca(OH)2 18.二氧化碳可溶于水:H 2O+CO 2==H 2CO 3 三、质量守恒定律: 19.镁在空气中燃烧:2Mg+O 2====点燃 2MgO (最后固体的质量比原来镁条的质量轻了,为什么?) 20.铁和硫酸铜溶液反应:Fe+CuSO 4===F e SO 4+Cu (最后溶液的质量增加、减少、不变?) 21.氢气还原氧化铜:H 2+CuO ====加热 Cu+H 2O 四、碳和碳的氧化物: (1)碳的化学性质 23. 碳在氧气中充分燃烧:C+O 2====点燃 CO 2 24.木炭还原氧化铜:C+2CuO ====高温 2Cu+CO 2↑ 25.焦炭还原氧化铁:3C+2Fe 2O 3====高温 4Fe+3CO 2↑ (2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层:C+O 2====点燃 CO 2 27.煤炉的中层:CO 2+C ====高温 2CO 28.煤炉的上部蓝色火焰的产生:2CO+O 2====点燃 2CO 2
陕西国防工业职业技术学院 课时授课计划 课程名称:高聚物生产技术任课教师:杨博授课顺序:第讲 教研室主任签名年月日
陕西国防工业职业技术学院教案专用稿纸 第二节缩聚反应与逐步加聚反应的工业实施聚酯是制造聚酯纤维、涂料、薄膜及工程塑料的原料,是由饱和的二元酸和二元醇通过缩聚反应制得的一类线型高分子缩聚物。这类缩聚物大分子中各个链接都是以酯基(-COO-)相连的,所以称为聚酯。以聚酯为基础制得的纤维称为涤纶(的确良),是三大合成纤维之一,是最主要的纤维。 一、聚酯的生产 聚对苯二甲酸乙二醇酯(PET)的生产工艺 (一)主要原料 (二)聚酯的生产工艺 1.聚酯的合成工艺路线 2.聚对苯二甲酸乙二醇酯的生产工艺 3.聚酯的纺丝:熔融纺丝 (三)聚酯的结构、性能和用途 二、聚酰胺-66,聚酰胺-1010的生产 聚酰胺纤维是以聚酰胺为基础制得的纤维,商品名是锦纶、尼龙,简称PA。它是三大合成纤维之一,也是制造薄膜及工程塑料的原料,是由饱和的二元酸与二元胺通过缩聚反应制得的一类线性高分子缩聚物。常见的聚酰胺有PA-6、PA-11、PA-12、PA-66、PA-610、PA-612、PA-1010等,其中PA-6和PA-66的产量最大,约占聚酰胺产量的90%。 聚酰胺的共同特点:大分子中的各链节间都是以酰胺基相连。 (一)聚酰胺-66的生产 聚酰胺-66是己二酸与己二胺的缩聚物是最早实现工业化生产的聚酰胺品种,也是产量最大的聚酰胺。 1.主要原料 (1)己二酸(2)己二胺 2.生产原理 3.生产工艺 4.聚酰胺的纺丝 5.聚酰胺-66的结构、性能及用途
聚酰胺的纺丝采用直接熔融纺丝和间接熔融纺丝。 熔融纺丝主要包括纺丝和纤维的后加工两个基本操作过程 (二)聚酰胺-1010的生产 聚酰胺-1010学名聚癸二酰癸二胺,俗称尼龙1010,简称PA-1010,是我国利用蓖麻油为主要原料的独特尼龙品种。结构式:H-[-NH(CH2)10NHCO(CH2)8CO-]n-OH 1.主要原料 (1)癸二酸(2)癸二胺 2.生产原理 方程式? 3.生产工艺 4.聚酰胺-1010的结构、性能与用途 酚醛树脂是酚类化合物与醛类化合物在酸性或碱性条件下,经缩聚反应而制得的一类聚合物的统称。其中以苯酚和甲醛为单体缩聚的酚醛树脂最为常用,简称为PF,是第一个工业化生产的树脂品种。以酚醛树脂为主要成分并添加大量其他助剂而制得的制品称为酚醛塑料。 三、酚醛树脂的生产 1.主要原料 (1)苯酚俗称石炭酸(2)甲醛 2.酚醛树脂的生产原理 3.酚醛树脂生产工艺 4.酚醛树脂结构、性能和用途 四、聚氨酯的生产 聚氨酯为大分子链中含有氨酯型重复结构单元的一类聚合物,全称为聚氨基甲酸酯,简称PU或PUR。它是由多异氰酸酯与聚醚型或聚酯型多羟基化合物在一定比例下反应的产物。一般分为热塑性和热固性两大类;或分为弹性体和泡沫塑料两大类。 1.主要原料 (1)异氰酸酯 (2)多氰基化合物 2.聚氨酯泡沫塑料的生产工艺 3.聚氨酯的结构、性能及用途
高中化学氧化还原反应的练习题 1. 将木炭与氧化铜的粉未混合加热,可得到红色的铜。试写出其反应的化学方程式,指出其中的氧化反应与还原反应并考虑它们的关系。 思路解析:C+2CuO 2Cu+CO2↑,从反应过程来看,氧化铜失去氧原子被还原为铜,炭得到氧原子被氧化为二氧化碳,前者为还原反应,后者为氧化反应,两者在一个反应中同时进行,氧原子在两个反应中进行传递。 答案:氧化铜失去氧原子被还原为铜,炭得到氧原子被氧化为二氧化碳,前者为还原反应,后者为氧化反应,两者在一个反应中同时进行,氧原子在两个反应中进行传递 2. 生活中有很多氧化反应,如金属腐蚀、细胞老化。请你总结氧化反应的本质,然后再在你的生活中找一找,还有哪些是氧化反应。 思路解析:金属腐蚀是金属的化合价升高,细胞老化可能是得到了氧原子或失去了氢原子,其实质还是化合价升高。生活中最典型的莫过于燃烧反应,燃烧的物质总是得到氧原子化合价被氧化。 答案:实质是化合价升高。燃烧也是氧化反应。(其他合理答案亦可) 3. 根据以下几种常见元素原子的原子结构示意图,指出它们在化学反应中得失电子的趋势。 氢氧氖钠镁氯 思路解析:最外层电子数越多,电子层数越少,得电子能力越强。 答案:氧和氯主要得电子,钠和镁主要失电子,氢得失电子能力都不强;氖则既不易得电子,又不易失电子。 4. 比较氯化钠和氯化氢的形成过程,总结其区别与联系。 思路解析:分析氯化钠和氯化氢形成过程中电子的得失或转移、化合价的变化情况。
答案:氯元素的原子在氯化钠和氯化氢形成的过程中化合价都降低了,被还原,发生的是还原反应;钠元素的原子失去电子,化合价升高被氧化,发生的是氧化反应;氢元素虽然不能得到电子,但它与氯原子共用的电子对偏离氢原子,氢的化合价升高,被氧化,发生的是氧化反应 10分钟训练(强化类训练,可用于课中) 1. (2004 全国春季高考理综)在下图所表示的粒子中,氧化性的是( ) A. B. C. D. 思路解析:氧化性的本质是物质得电子的能力,从粒子结构示意图可以很清 楚地知道:最容易得电子的是 B 项中粒子。 答案:B 2. 下列叙述正确的是( ) A. 元素的单质可由氧化或还原含该元素的化合物来制得 B. 得电子越多的氧化剂,其氧化性就越强 C. 阳离子只能得到电子被还原,只能作氧化剂 D. 含有价元素的化合物不一定具有强的氧化性 思路解析: A 项正确,一般金属用还原其相应化合物的方法获得,非金属用氧化其相应化合物的方法获得;B 项将得电子能力与得电子多少混为一谈,实际上氧化性只与得电子能力有对应关系;C 项绝对化,也有阳离子如Fe2+可以继续被氧化,作还原剂;D 项正确,如H2O 中H 元素就是价,但它只有极弱的氧化性。 答案:AD 3. 下列有关氧化还原反应的叙述正确的是( )
⑴、⑼、(10) ⑵、⑶ ⑷、⑸、⑺ ⑶、⑸、⑹、(10⑵、⑷ ⑴ (13) (14) (16) (15) (18) (17) (19) (19) ⑺ ⑹ (20) 化学物质反应关系规律图 ⑴.金属单质+非金属单质→无氧酸盐 (化合反应) 2Na+Cl 2点燃2NaCl ⑵.金属氧化物+非金属氧化物→含氧酸盐 (化合反应) CaO+SiO 2高温CaSiO 3 (高炉炼铁除去铁矿石中的SiO 2) ⑶.酸+碱性氧化物→盐+水 (复分解反应) 6HCl+Fe 2O 3==2FeCl 3+3H 2O H 2SO 4+CuO ==CuSO 4+H 2O 2HCl+CaO ==CaCl 2+H 2O 3H 2SO 4+ Fe 2O 3==Fe 2(SO 4)3+3H 2O ⑷.碱+酸性氧化物→盐+水 (不属于复分解反应) Ca(OH)2+CO 2==CaCO 3↓+H 2O 2NaOH+SO 2==Na 2SO 3+H 2O 2NaOH+CO 2==Na 2CO 3+H 2O 2NaOH+SO 3==Na 2SO 4+H 2O ⑸.酸+碱→盐+水 (复分解反应) HCl+NaOH ==NaCl+H 2O H 2SO 4+Cu(OH)2==CuSO 4+2H 2O ⑹.酸+盐→新酸+新盐 (复分解反应) HCl +AgNO 3 ==AgCl ↓+HNO 3 2HCl+CaCO 3==CaCl 2+H 2O+CO 2↑ H 2SO 4+BaCl 2==BaSO 4↓+2HCl 2HCl+Na 2CO 3==2NaCl+H 2O+CO 2↑ HCl+NaHCO 3==NaCl+H 2O+CO 2↑ ⑺.碱+盐→新碱+新盐 (复分解反应) 反应物中的碱和盐必须都溶于水 2NaOH+ CuSO 4 ==CuCl 2 +Cu(OH)2↓ Ca(OH)2+ 2NH 4Cl == CaCl 2+2NH 3↑+2H 2O 3NaOH+ FeCl 3 ==3NaCl +Fe(OH)3↓ Ca(OH)2+ Na 2CO 3== CaCO 3↓+2NaOH
氧化还原反应 氧化还原反应与四大基本反应类型的关系①置换反应都是氧化还原反应; ③有单质生成的分解反应是氧化还原反 应; ④有单质参加的化合反应也是氧化还原反 应。 从数学集合角度考虑: 氧化还原反应的概念 1.基本概念 . 2.基本概念之间的关系:
氧化剂 有氧化性 化合价降低 得电子 被还原 发生还原反应生成还原产物 还原剂 有还原性 化合价升高 失电子 被氧化 发生氧化反应生成氧化产物 [例1]金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为: aTiO2+ bCl2+ cC aTiCl4+ c CO ……反应① TiCl4+2Mg Ti + 2MgCl2 ……反应② 关于反应①、②的分析不正确的是() ①TiCl4在反应①中是还原产物,在反应②中是氧化剂; ②C、Mg在反应中均为还原剂,被还原; ③在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4; ④a=1,b=c=2; ⑤每生成19.2 g Ti,反应①、②中共转移4.8 mol e-。 A.①②④B.②③④C.③④D.②⑤ 标电子转移的方向和数目(双线桥法、单线桥法) ①单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例: MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O ②双线桥法。得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。例: MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 两类特殊的化学反应 ①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。例: 3Cl2+6KOH KClO3+5KCl+3H2O ②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例: 得2e-—— 2e- 失2e-— — 失5e 得5×e
初中化学四大基本反应类型归纳 四大基本反应类型是:化合反应、分解反应、置换反应、复分解反应 一、化合反应:由两种或两种以上的物质生成另一种物质的反应,叫化合反应。 点燃 1、非金属单质与氧气生成非金属氧化物。如 2H 2+O 2 ===H 2 O 其它非金属如硫、磷、碳等都可以与氧气反应生成非金属氧化物。 点燃 2、金属与氧气反应生成金属氧化物。如 3Fe+2O 2====Fe 3 O 4 其它金属如铝、锌、铜也可以与氧气发生类似反应,生成相应的金属氧化物。 3、金属氧化物与水反应,生成相应的碱。如CaO+H 2O= Ca(OH) 2 其它金属氧化物Na 2O、K 2 O、BaO都可以与水反应生成相应的碱 4、非金属氧化物与水反应,生成相应的酸。如 CO 2+H 2 O= H 2 CO 3 其它非金属氧化物SO 2、 SO 3 也可以与水生成相应的酸。 点燃 5、其它如2CO+ O 2 =====2CO 2 等。 二、分解反应:由一种物质生成两种或两种以上其他物质的化学反应叫做分解反应。高温 1、不溶性碳酸盐高温分解如CaCO 3====CaO+CO 2 ↑ 加热 2、不溶性碱受热分解,如Cu(OH) 2 =====CuO + H 2 O 加热
3、某些酸式盐受热分解(了解)如B、2NaHCO 3 =====Na 2 CO 3 +CO 2 ↑+H 2 O 加热 4、某些碱式盐受热分解(了解)如 Cu 2(OH) 2 CO 3 =====2CuO+ CO 2 ↑+ H 2 O 其它如:水的电解、双氧水分解、高锰酸钾受热分解、氯酸钾受热分解 三、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应叫置换反应。 1、活泼金属与酸反应(金属为金属活动顺序中氢以前的金属,酸不包括浓硫酸 和硝酸)例如Fe+2HCl=FeCl 2+H 2 ↑ Mg+ 2HCl = MgCl 2+ H 2 ↑ H 2 SO 4 + Fe = FeSO 4 + H 2 ↑ 2HCl + Zn = ZnCl 2+ H 2 ↑H 2 SO 4 + Zn = ZnSO 4 + H 2 ↑ 2、金属与盐反应,生成新盐与新金属。盐(含较不活泼金属)+金属(较活泼)——金属(较不活泼)+盐(含较活泼金属)盐须溶于水,金属须比盐中金属活泼,钾、钙、钠三种金属不跟盐溶液发生置换反应。 如Fe+CuSO 4===FeSO 4 +Cu 2AgNO 3 + Cu= Cu(NO 3 ) 2 +2 Ag 加热 3、氢气还原金属氧化物,H 2+CuO =====Cu+H 2 O 高温 4、碳还原金属氧化物。3C+Fe 2O 3 =====2 Fe+ 3CO 2 ↑ 四、复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应,叫复分解反应。 1、酸+碱性氧化物——盐+水 如Fe 2O 3 + 6HCl= 2 FeCl 3 +3H 2 O 3H 2SO 4 + Fe 2 O 3 = Fe 2 (SO 4 ) 3 + 3H 2 O
怎样认识加聚反应和缩聚反应 加聚反应是加成聚合反应的简称,是指以不饱和烃或含不饱和键的物质为单体,通过不饱和键的加成,聚合成高聚物的反应。例如,乙烯加聚成聚乙烯,是在适当的温度、压强和催化剂存在的条件下,乙烯分子中的双键会断裂其中的一个键,发生加成反应,使乙烯分子里的碳原子结合成为很长的键。 CH2=CH2+CH2=CH2+CH2=CH2+……→ —CH2—CH2—CH2—CH2—CH2…… 这个反应可以用方程式表示为: 反应的产物是聚乙烯,它是一种相对分子质量很大的化合物,其分子组成可以表示为(C2H4)n。 加聚反应根据参加反应的单体种类,又分为均聚反应和共聚反应。仅由一种单体发生的加聚反应叫做均聚反应,合成聚乙烯的反应就是均聚反应。由两种以上单体共同参加的聚合反应叫共聚反应。例如,合成丁苯橡胶的反应即为共聚反应。这个反应可用下式表示: 加聚反应的特点是: (1)单体必须是含有双键等不饱和键的化合物。例如,氯乙烯、丙烯腈等含不饱和键的物质,在一定条件下,都可以发生加聚反应。 (2)加聚反应发生在不饱和键上。 (3)发生加聚反应的过程中,没有副产物产生,得高聚物的化学组成跟 (4)加聚反应生成的高聚物相对分子质量为单体整数倍。 缩聚反应是缩合聚合反应的简称,是指单体之间相互作用生成高分子,同时还生成小分子(如水、氨、卤化氢等)的聚合反应。例如合成酚醛树脂的反应就是缩聚反应。合成酚醛树脂通常是以苯酚和甲醛为原料,在催化剂作用下,经缩聚反应而得到。 缩聚反应根据参加反应的单体种数又分为共缩聚和均缩聚,由不同种单体参加的缩聚反应称为共缩聚。如酚醛树脂的合成反应就是共缩聚,它是由苯酚和甲醛两种物质为单体的。由同种单体进行的缩聚反应称为均缩聚。如氨基酸聚合成多肽的缩聚反应就属均缩聚。 缩聚反应的特点是:(1)单体不一定含有不饱和键,但必须含有两个或两个以上的反应基团(如—OH、—COOH、—NH2、—X等) (2)缩聚反应的结果,不仅生成高聚物,而且还有副产物分子生成。 (3)所得高分子化合物的化学组成跟单体的化学组成不同。由上可见,加聚反应和缩聚反应的单体结构、反应机理、产物的化学组成都是截然不同的。
中学常见的氧化还原反应 一.因氧化还原而不能共存的离子 1.不需要酸性条件的 MnO4-与S2-、Fe2+、I-、SO32-、HS-、HSO3-、S2O32-、Sn2+、H2O2; Fe3+与I-、S2-、HS-、SO32-、Sn2+、HSO3-; ClO-与S2-、I-、SO32-、HS-、HSO3-、Fe2+、Sn2+、S2O32- 2.酸性条件下才能进行的反应 S2-与SO32-、S2O32-;NO3-与Fe2+、I-;ClO3-、MnO4-与Cl- 有关反应如下: 2 MnO4-+ 3 S2-+4H2O=2MnO2↓+3S↓+8OH- 3MnO4-+9 Fe2++6H2O=3MnO2↓+5Fe3++4Fe(OH)3↓ 2MnO4-+ I-+H2O=2MnO2↓+IO3-+2OH- 2MnO4-+ SO32-+2OH-=2MnO42-+SO42-+ H2O 2Fe3+ +2I-=2Fe2++I2 2Fe3+ +S2-=2Fe2++S↓ 2Fe3+ +SO32-+ H2O=2Fe2++SO42-+2H+ 2Fe3+ +Sn2+=2Fe2++Sn4+ 2Fe3+ +3S2-=2FeS↓+S↓2Fe3++HS-=2Fe2++S↓+H+ ClO-+2I-+ H2O=Cl-+I2+2OH-ClO-+S2-+ H2O= Cl-+S↓+2OH- 3ClO-+6Fe2++ 3H2O= 3Cl-+ 4Fe3++2Fe(OH)3↓ 2S2-+SO32-+6H+=3S+3 H2O 2S2-+S2O32-+6H+=4S↓+3 H2O 3Fe2++NO3-+4H+=3 Fe3++NO↑+ 2H2O 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8 H2O 2NO3-+6I-+8H+=2NO↑+3I2+ 4H2O 2NO2-+2I-+4H+=2NO↑+I2+2 H2O 二.其它氧化还原反应 2Fe3++H2S=2Fe2++S↓+2H+ 2Fe3++SO2+ H2O=2Fe2++SO42-+2H+ 2Fe3+ +Cu=2Fe2++Cu2+ 2Fe3++Zn=2Fe2++Zn2+ 2Fe2++H2O2+2H+=2Fe3++2 H2O 4Fe2++O2+4H+=4Fe3++2H2O 2SO32-+O2=2SO42-SO32-+X2+H2O=SO42-+2X-+2H+ X2+SO2+ 2H2O=4H++SO42-+2X-(X2——Cl2、Br2、I2) H2SO4(浓)+2HBr=SO2↑+Br2↑+ 2H2O H2SO4(浓)+8HI=H2S↑+4I2+ 4H2O H2SO4(浓)+H2S=SO2↑+S↓+ 2H2O 2HNO3+3SO2+2H2O=3H2SO4+2NO↑2NH3+3CuO=N2+3Cu+3H2O MnO2+2NaCl+3H2SO4=MnSO4+2NaHSO4+Cl2+2H2O
怎样认识加聚反应和缩聚反应 加聚反应和缩聚反应是合成有机高分子的两种基本反应。这两种反应虽然都由单体(小分子)产生高聚物(大分子)的反应,但它们还是有着本质的区别。 加聚反应是加成聚合反应的简称,是指以不饱和烃或含不饱和键的物质为单体,通过不饱和键的加成,聚合成高聚物的反应。例如,乙烯加聚成聚乙烯,是在适当的温度、压强和催化剂存在的条件下,乙烯分子中的双键会断裂其中的一个键,发生加成反应,使乙烯分子里的碳原子结合成为很长的键。 CH2=CH2+CH2=CH2+CH2=CH2+……→ —CH2—CH2—CH2—CH2—CH2…… 这个反应可以用方程式表示为: 反应的产物是聚乙烯,它是一种相对分子质量很大的化合物,其分子组成可以表示为(C2H4)n。 加聚反应根据参加反应的单体种类,又分为均聚反应和共聚反应。仅由一种单体发生的加聚反应叫做均聚反应,合成聚乙烯的反应就是均聚反应。由两种以上单体共同参加的聚合反应叫共聚反应。例如,合成丁苯橡胶的反应即为共聚反应。这个反应可用下式表示: 加聚反应的特点是: (1)单体必须是含有双键等不饱和键的化合物。例如,氯乙烯、丙烯腈等含不饱和键的物质,在一定条件下,都可以发生加聚反应。 (2)加聚反应发生在不饱和键上。 (3)发生加聚反应的过程中,没有副产物产生,得高聚物的化学组成跟 (4)加聚反应生成的高聚物相对分子质量为单体整数倍。 缩聚反应是缩合聚合反应的简称,是指单体之间相互作用生成高分子,同时还生成小分子(如水、氨、卤化氢等)的聚合反应。例如合成酚醛树脂的反应就是缩聚反应。合成酚醛树脂通常是以苯酚和甲醛为原料,在催化剂作用下,经缩聚反应而得到。 缩聚反应根据参加反应的单体种数又分为共缩聚和均缩聚,由不同种单体参加的缩聚反应称为共缩聚。如酚醛树脂的合成反应就是共缩聚,它是由苯酚和甲醛两种物质为单体的。由同种单体进行的缩聚反应称为均缩聚。如氨基酸聚合成多肽的缩聚反应就属均缩聚。
氧化反应和还原反应 1、(1)氧化反应:物质与氧发生的反应叫氧化反应。 还原反应:含氧化合物中的氧被夺去的反应叫还原反应。 (2)反应中夺取氧的物质具有还原性,是还原剂,发生氧化反应。 反应中失氧的物质具有氧化性,是氧化剂,发生还原反应。 (3)常见还原剂:木炭、一氧化碳、氢气 (4)具有还原性的物质有:H 2、CO 、 C 。 2 、关系:化合反应不一定是氧化反应,氧化反应不一定是化合反应 3、 氧化反应分类 (1)剧烈氧化:如燃烧、自燃、爆炸。 (2)缓慢氧化:如食物的腐烂、酿酒、铁生锈、呼吸作用等。 注意: ①、物质与氧气发生的反应叫氧化反应。(错)物质与氧气发生的反应是氧化反应。(对) ②、氧气中含有氧,但含有氧的物质不一定是氧气。 ③、判断氧化反应的一般标准就是看反应物中是否有氧气。 1.列反应既属于氧化反应又属于化合反应的是( )。 A.氧化汞――→加热汞+氧气 B.红磷+氧气――→点燃五氧化二磷 C.氢氧化钙+二氧化碳―→碳酸钙+水 D.蜡烛+氧气――→点燃二氧化碳+水 2.氧气是化学性质比较活泼的气体,它跟其他物质发生的化学反应( ) A .都是氧化反应 B .都是化合反应 C .都有、发光、放热、火焰 3.下列说法正确的是 ( ) A.化合反应一定是氧化反应 B .物质与氧气的反应都是化合反应 C.物质跟氧气的反应才叫做氧化反应 D .物质跟氧气只生成一种物质的反应既是化合反应又是氧化反应 4.下列物质在氧气中燃烧的主要现象及所属反应类型正确的是 ( ) A .硫—黄色火焰—氧化反应 B .红磷—蓝色火焰—化合反应 C .镁—耀眼白光—氧化反应 D .蜡烛—黄色火焰—化合反应 5.氢气还原氧化铜过程中,谁做氧化剂?( ) A.氢气 B.氧化铜 C.铜 D.水 6.用氢气还原氧化铜过程中,得到铜8.0g ,那么需要氢气多少?( ) A.小于0.2g B.等于0.2g C.大于0.2g D.不确定
加聚反应和缩聚反应 马林 一、概念和区别 由小分子生成高分子化合物的反应叫做聚合反应。聚合反应包括两类:加成聚合反应和缩合聚合反应。单体或单体间反应只生成一种高分子化合物的反应叫做加成聚合反应,简称为加聚反应。单体间相互反应而成高分子化合物,同时还生成小分子(如水、氨等)的聚合反应叫做缩合聚合反应,简称缩聚反应。 加聚反应和缩聚反应的异同: 1.加聚反应是含“C=C”键的不饱和化合物的性质,而不能说成是烯烃,也不能说成广义的不饱和烃(如炔烃)或不饱和化合物的性质。但有例外的是,甲醛可以聚合为聚甲醛。 2.加聚反应是把“C=C”键碳上的原子或基团上下甩,打开双键中的一键连起来。加聚反应的实质是通过加成反应而生成高分子的聚合反应,故它只能生成一种物质,即高分子化合物。 3.除特种橡胶外,一般橡胶都是加聚反应的产物,且单体都是二烯烃,或两个含“C=C”键的化合物,故橡胶链节中有“C=C”,易氧化、老化。 4.加聚反应所生成的高分子的名称是在单体名称前加上一个“聚”字。 5.加聚反应所生成的高分子的链节与单体组成相同,结构不同,故其相对分子质量是单体的相对分子质量的整数倍:M=M(单体)×n(聚合度)。 6.缩聚反应是含有双官能团的物质或物质间可能发生的反应,如氨基酸,苯酚与甲醛,己二酸和己二胺等发生缩聚反应。 7.缩聚反应的实质是缩合反应而生成高分子的聚合反应,在生成高分子物质的同时,还会产生一种小分子,如H2O、NH3等。 8.缩聚反应所生成的高分子的链节与单体组成不相同,结构也不同,其相对分子质量一定小于单体的相对分子质量的整数倍:M<M(单体)×n(聚合度)。 二、有关的加聚反应 (聚甲基丙烯酸甲酯,有机玻璃) (聚丁二烯橡胶、人造橡胶)
118个化学方程式(初中)燃烧(高温) 1、镁在空气中燃烧:2Mg+O22MgO 2、铁在氧气中燃烧:3Fe+2O2Fe3O4 3、铝在空气中燃烧:4Al+3O22Al2O3 4、氢气在空气中燃烧:2H2+O22H2O 5、红磷在空气中燃烧:4P+5O22P2O5 6、硫粉在空气中燃烧: S+O2SO2 7、碳在氧气中充分燃烧:C+O2CO2 8、碳在氧气中不充分燃烧:2C+O22CO 9、二氧化碳通过灼热碳层: C+CO22CO 10、一氧化碳在氧气中燃烧:2CO+O22CO2 11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O==H2CO3 12、生石灰溶于水:CaO+H2O==Ca(OH)2 13、无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O 14、钠在氯气中燃烧:2Na+Cl22NaCl
分解反应 15、实验室用双氧水制氧气:2H2O22H2O+O2↑ 16、加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑ 17、水在直流电的作用下分解:2H2O2H2↑+O2↑ 18、碳酸不稳定而分解:H2CO3==H2O+CO2↑ 19、高温煅烧石灰石(二氧化碳工业制法):CaCO3CaO+CO2↑置换反应 20、铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu 21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑ 22、镁和稀盐酸反应:Mg+2HCl==MgCl2+H2↑ 23、氢气还原氧化铜:H2+CuO Cu+H2O 24、木炭还原氧化铜:C+2CuO2Cu+CO2↑ 25、水蒸气通过灼热碳层:H2O+C H2+CO 26、焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑ 其他 27.氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 28、甲烷在空气中燃烧:CH4+2O2CO2+2H2O 29、酒精在空气中燃烧:C2H5OH+3O22CO2+3H2O
加聚反应和缩聚反应集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]
加聚反应和缩聚反应 一、概念和区别 由小分子生成高分子化合物的反应叫做聚合反应。聚合反应包括两类:加成聚合反应和缩合聚合反应。单体或单体间反应只生成一种高分子化合物的反应叫做加成聚合反应,简称为加聚反应。单体间相互反应而成高分子化合物,同时还生成小分子如水、氨等的聚合反应叫做缩合聚合反应,简称缩聚反应。 加聚反应和缩聚反应的异同: 1.加聚反应是含“C =C ”键的不饱和化合物的性质,而不能说成是烯烃,也不能说成广义的不饱和烃如炔烃或不饱和化合物的性质。但有例外的是,甲醛可以聚合为聚甲醛。 2.加聚反应是把“C =C ”键碳上的原子或基团上下甩,打开双键中的一键连起来。加聚反应的实质是通过加成反应而生成高分子的聚合反应,故它只能生成一种物质,即高分子化合物。 3.除特种橡胶外,一般橡胶都是加聚反应的产物,且单体都是二烯烃,或两个含“C =C ”键的化合物,故橡胶链节中有“C =C ”,易氧化、老化。 4.加聚反应所生成的高分子的名称是在单体名称前加上一个“聚”字。 5.加聚反应所生成的高分子的链节与单体组成相同,结构不同,故其相对分子质量是单体的相对分子质量的整数倍:M =M 单体×n 聚合度。 6.缩聚反应是含有双官能团的物质或物质间可能发生的反应,如氨基酸,苯酚与甲醛,己二酸和己二胺等发生缩聚反应。 7.缩聚反应的实质是缩合反应而生成高分子的聚合反应,在生成高分子物质的同时,还会产生一种小分子,如H 2O 、NH 3等。 8.缩聚反应所生成的高分子的链节与单体组成不相同,结构也不同,其相对分子质量一定小于单体的相对分子质量的整数倍:M <M 单体×n 聚合度。 二、有关的加聚反应 聚甲基丙烯酸甲酯,有机玻璃 聚丁二烯橡胶、人造橡胶 丁苯橡胶 三、缩聚反应的类型 1.羟醇、酚醛缩合型 1酚醛树脂电木 2聚乙烯醇缩甲醛维尼纶 单体:CH 3COOCH =CH 2、CH 3OH 、HCHO 3糠醛树脂似电木 2.羟醇羧酸缩合型酯化型 1聚对苯二甲酸二乙醇酯涤纶 3.羧氨缩合型酰胺键、肽键 1聚己内酰胺绵纶、尼龙—6
合成高分子化合物的基本方法(一) 班级:____________,姓名:_________________。 1.导电薄膜属高分子材料,其结构片断为…CH=CH―CH=CH―CH=CH―CH=CH…由此判断合成导电薄膜的单体为(A ) A.乙炔 B.乙烷 C.乙烯 D.1,3-丁二烯 2.某同学在所收到的信封上发现有收藏价值的邮票,便将邮票剪下来浸入水中,以去掉邮票背面的黏合剂。根据“相似相溶”原理,该黏合剂的成分可能是() A.B.C.D. 【详解】 根据选项中物质的结构可以知道,四种物质中只有中含有亲水基团羟基(—OH),与 水相溶,故B符合题意。 综上所述,答案为B。 3.结构为的高分子化合物的单体是( A ) A.B. C.D. 4.某高分子化合物含有如下结构片断:,对其结构的 分析正确的是() A.它是缩聚反应的产物 B.合成它的小分子是CH3OH C.合成它的小分子是CH2=CH2和HCOOCH3 D.合成它的小分子是CH2=CHCOOCH3 【详解】 链节中主链上只有碳原子,为加聚反应生成的高聚物,而不是缩聚反应的产物;该高聚物的链节为,所以该高聚物的单体为CH2=CHCOOCH3,即合成它的小分子为CH2=CHCOOCH3, 故ABC从错误,D正确; 综上所述,本题选D。 5.以乙烯和丙烯的混合物为单体,发生加聚反应,不可能得到的是() A. B. C.
D. 【详解】 乙烯和丙烯中都含有双键,发生加聚反应时,可以是乙烯和乙烯之间发生加聚反应,可以是丙烯和丙烯之间发生加聚反应,也可以是乙烯和丙烯之间发生加聚反应;如果是乙烯和乙烯之间发生加聚反应生成聚乙烯,结构简式为,即为A结构,如果是丙烯和丙烯之间发生加 聚反应是聚丙烯,结构简式为,如果是乙烯和丙烯之间发生加聚反应,由于碳原子之间的连接顺序可以有和两种结构简式,分别为C,D结构;故答案为B。 6.某ABS合成树脂的结构为,则关于合成该树脂 的反应类型与单体种类的判断,正确的是() A.加聚反应,1种 B.缩聚反应,2种 C.加聚反应,3种 D.缩聚反应,3种 【详解】 根据高分子化合物的结构简式可知,该物质是加聚反应的产物。根据单键变双键、双键变单键可知,其单体是苯乙烯、1,3-丁二烯、CH2=CHCN,单体种类为3种。 答案选C。 7.由CH3CH2CH3制备聚合物过程中依次发生的化学反应是() ①取代反应②消去反应③加聚反应④醋化反应⑤还原反应⑥水解反应 A.②④⑤ B.①②③ C.②③⑥ D.①②④ 【详解】 由CH3CH2CH3制备聚合物过程为: CH3CH2CH3→CH3CH2CH2Cl→CH3CH=CH2→,故依次经历的反应类型为:取代 反应、消去反应和加聚反应。 答案为B。 8.关于下列三种常见高分子材料的说法正确的是() 酚醛树脂涤纶顺丁橡胶 A.顺丁橡胶、涤纶和酚醛树脂都属于天然高分子材料 B.顺丁橡胶的单体与2-丁烯互为同分异构体 C.涤纶是对苯二甲酸和乙二醇通过缩聚反应得到的
高二化学提高班第一讲 《加聚反应和缩聚反应》 1.基础知识回顾 (1)下列物质中属于加聚产物的是(填序号),属于缩聚产物的是(填序号)(2)请把各聚合物的单体写在空格里 ()5 (3)写出合成聚合物的化学方程式 ① ② ③ ④ [练习]下列化合物中 (1)可发生加聚反应的一种化合物是,加聚物的结构简式为。 (2)可发生缩聚反应的一种化合物是,缩聚物的结构简式为。 (3)可发生缩聚反应的两种化合物是和,缩聚物的结构简式为。 2.各区试题汇总 (1)[丰台一模] 有机物B还可以发生以下变化: 已知F的单体是由E和按1:1生成,请写出E→高分子化合物F的化学方程 a.b.c. d.e.
式 。 (2)[宣武一模 ] C 4H 4O 4中核磁共振氢谱中有两种峰,而且峰面积之比为1:1,写出G 的结构简式 。 (3)[东城一模] 已知: (R 、R ’表示烃基或官能团)其中D 的分子式为C 4H 6O 2,两分子F 反应可生成六元环状酯类化合物。 请回答:F 可发生多种类型的反应。 ①两分子F 反应生成的六元环状酯类化合物的结构简式是 ; ②F 可制得使Br 2的CCl 4溶液褪色的有机物H 。 F →H 的化学方程式是 ; ③F 在一定条件下发生缩聚反应的化学方程式是 。 (4)[崇文一模] 经质谱法分析得知,某单烯烃Q 的相对分子质量为56;其核磁共振氢谱与红外光谱表明,Q 分子中有两种化学环境不同的氢原子,氢谱峰面积显示两种氢的原子个数比为1:3(Q 分子中含有支链)。 (1)Q 的结构简式为 。 (2)D 在一定条件下能发生缩聚反应生成高聚物,请写出D 发生缩聚反应的化学方程式
加聚反应 写出下列反应的化学方程式 乙烯、丙烯、1.3- 丁二烯、甲醛、苯乙烯、丙烯酸甲酯、异戊二烯 、1,3-丁二烯与丙烯腈、乙烯和丙烯按1:1的加聚反应方程式 由许多小分子通过加成反应变成一个有机高分子化合物,既属于加成反应又属于聚合反应,叫做加成聚合反应,简称加聚反应。 乙烯这类能够进行聚合反应形成高分子化合物的低分子化合物称为单体;高分子 化合物中化学组成相同、可重复的最小结构单元称为链节,也称重复结构单元; 链节的数目称为聚合度,用n 表示; 1、单体必须是含有双键、参键等不饱和键的化合物。如:烯、二烯、炔、醛等含不饱和键的化合物。 2、发生加聚反应的过程中,没有副产物产生。 3、聚合物链节的化学组成跟单体的化学组成相同,聚合物相对分子质量为单体相对分子质量的整数倍。 分析上述的加聚反应,有几种情况? 加聚反应的分类: 1、均聚反应:仅由一种单体发生的加聚反应 (1)单C=C 加聚 (2)含共轭双键的加聚 2、共聚反应:由两种或两种以上单体发生的加聚反应 学 与 问:下面几种个聚合物由何种单体聚合而成 归纳出判断加聚产物的单体的方法吗? 判断加聚聚合物单体的方法 1、若链节中全是C —C ,则两个碳原子一节断开,C —C 变C=C 即可。 2、若链节中含C=C ,则四个碳原子一节断开,链节中的C —C 变C=C 、C=C 变C —C 即可。
如聚合物:的单体是: 。 练习 1、人造象牙中,主要成分的结构是,它是通过加聚反应制得的, 则合成人造象牙的单体是 A、(CH3)2O B、HCHO C、CH3CHO D、CH3OCH3 2、聚四氟乙烯可以作为不粘锅的内衬,其链节是 3、乙烯与丙烯按1:1(物质的量)聚合时,生成聚合物的结构可能是 4、人造羊毛在许多方面比天然羊毛更,其分子式中存在如下结构的有机物: 则合成它的单体是。 5、某种ABS工程树脂,由丙烯腈(CH2=CHCN,符号A)、1,3-丁二烯(CH2=CH-CH=CH2,符号B)和苯乙烯(C6H5-CH=CH2,符号S)按一定配比共聚而得。 (1)A、B和S三种单体中,碳氢比(C:H)值最小的单体是。 (2)经元素分析可知该ABS样品的组成为CaHbNc(a、b、c为正整数),则原料中A和B的物质的量之比是(用a、b、c表示)。
初中化学四大基本反应类型 一、化合反应 1、镁在空气中燃烧: 2Mg + O2 =点燃= 2MgO 现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末 2、铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O4 现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体 注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。 3、铜在空气中受热:2Cu + O2 =△= 2CuO 现象:铜丝变黑。 4、铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O3 现象:发出耀眼的白光,放热,有白色固体生成。 5、氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O 现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。 6、红(白)磷在空气中燃烧:4P + 5O2 =点燃= 2P2O5 现象:(1)发出白光(2)放出热量(3)生成大量白烟。 7、硫粉在空气中燃烧: S + O2 =点燃= SO2 现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。 B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。 8、碳在氧气中充分燃烧:C + O2 =点燃= CO2 现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊 9、碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO 10、二氧化碳通过灼热碳层: C + CO2 =高温= 2CO(是吸热的反应) 11、一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO2 现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。 12、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3 现象:石蕊试液由紫色变成红色。 注意:酸性氧化物+水→酸如:SO2 + H2O === H2SO3 SO3 + H2O === H2SO4 13、生石灰溶于水:CaO + H2O === Ca(OH)2(此反应放出热量) 注意:碱性氧化物+水→碱 氧化钠溶于水:Na2O + H2O =2NaOH 氧化钾溶于水:K2O + H2O=2KOH 氧化钡溶于水:BaO + H2O=Ba(OH)2 14、钠在氯气中燃烧:2Na + Cl2=点燃= 2NaCl 15、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O 二、分解反应: 1、水在直流电的作用下分解:2H2O= 通电= 2H2↑+ O2 ↑ 现象:(1)电极上有气泡产生。H2:O2=2:1 正极产生的气体能使带火星的木条复燃。