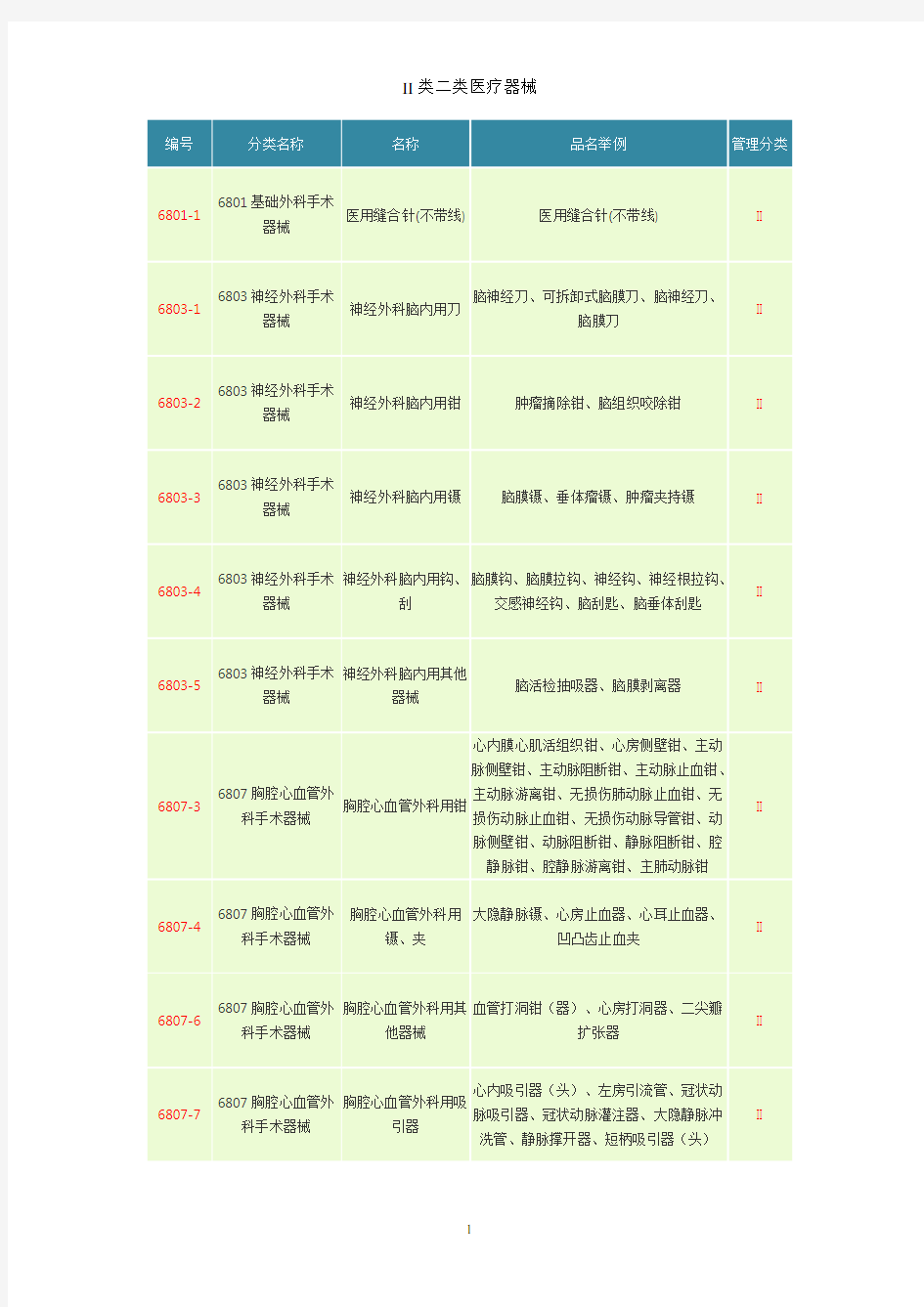
编号分类名称名称品名举例管理分类
6801-16801基础外科手术
器械
医用缝合针(不带线) 医用缝合针(不带线) II
6803-16803神经外科手术
器械
神经外科脑内用刀
脑神经刀、可拆卸式脑膜刀、脑神经刀、
脑膜刀
II
6803-26803神经外科手术
器械
神经外科脑内用钳肿瘤摘除钳、脑组织咬除钳II
6803-36803神经外科手术
器械
神经外科脑内用镊脑膜镊、垂体瘤镊、肿瘤夹持镊II
6803-46803神经外科手术
器械
神经外科脑内用钩、
刮
脑膜钩、脑膜拉钩、神经钩、神经根拉钩、
交感神经钩、脑刮匙、脑垂体刮匙
II
6803-56803神经外科手术
器械
神经外科脑内用其他
器械
脑活检抽吸器、脑膜剥离器II
6807-36807胸腔心血管外
科手术器械
胸腔心血管外科用钳
心内膜心肌活组织钳、心房侧壁钳、主动
脉侧壁钳、主动脉阻断钳、主动脉止血钳、
主动脉游离钳、无损伤肺动脉止血钳、无
损伤动脉止血钳、无损伤动脉导管钳、动
脉侧壁钳、动脉阻断钳、静脉阻断钳、腔
静脉钳、腔静脉游离钳、主肺动脉钳
II
6807-46807胸腔心血管外
科手术器械
胸腔心血管外科用
镊、夹
大隐静脉镊、心房止血器、心耳止血器、
凹凸齿止血夹
II
6807-66807胸腔心血管外
科手术器械
胸腔心血管外科用其
他器械
血管打洞钳(器)、心房打洞器、二尖瓣
扩张器
II
6807-76807胸腔心血管外
科手术器械
胸腔心血管外科用吸
引器
心内吸引器(头)、左房引流管、冠状动
脉吸引器、冠状动脉灌注器、大隐静脉冲
洗管、静脉撑开器、短柄吸引器(头)
II
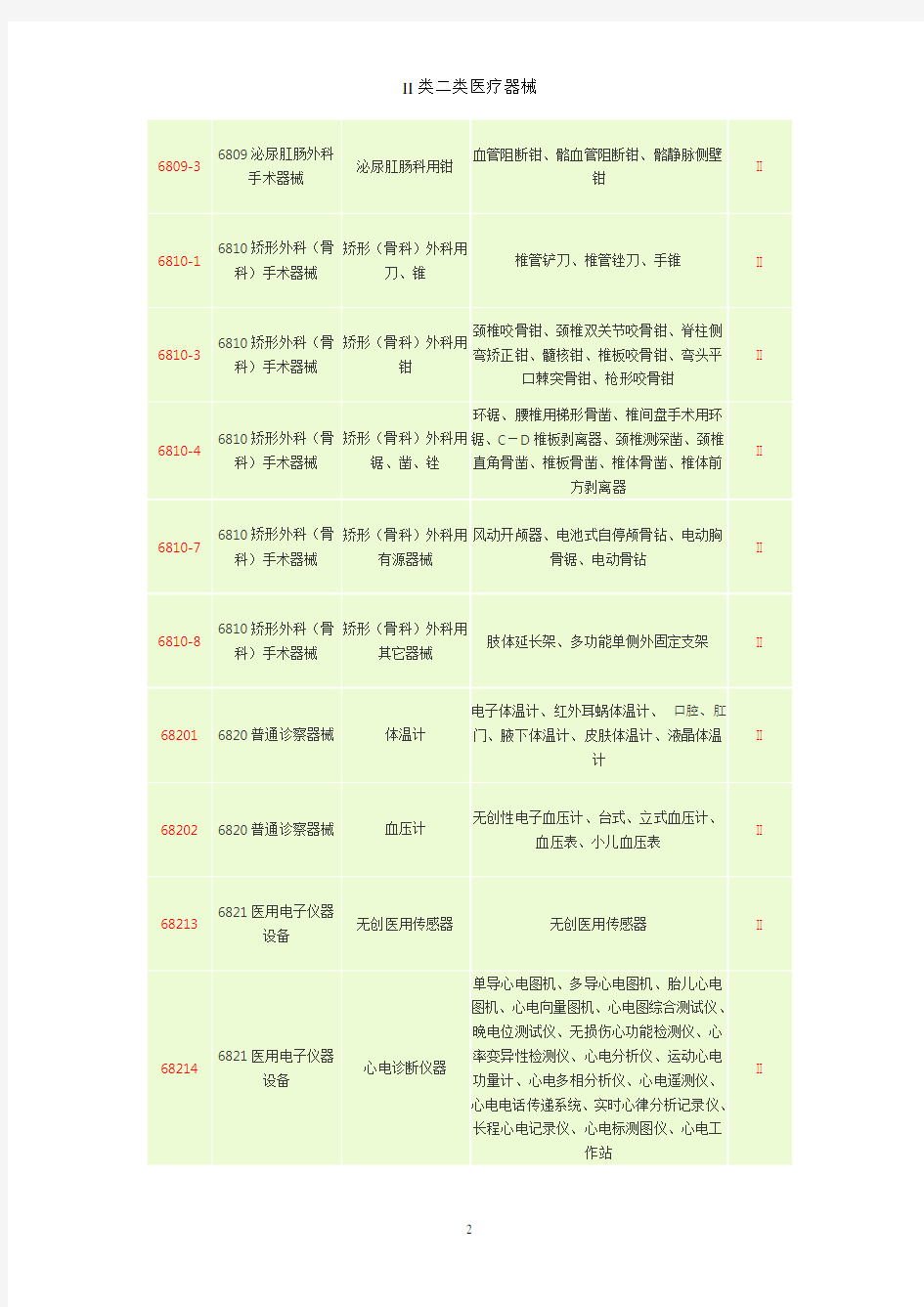
6809-36809泌尿肛肠外科
手术器械
泌尿肛肠科用钳
血管阻断钳、骼血管阻断钳、骼静脉侧壁
钳
II
6810-16810矫形外科(骨
科)手术器械
矫形(骨科)外科用
刀、锥
椎管铲刀、椎管锉刀、手锥II
6810-36810矫形外科(骨
科)手术器械
矫形(骨科)外科用
钳
颈椎咬骨钳、颈椎双关节咬骨钳、脊柱侧
弯矫正钳、髓核钳、椎板咬骨钳、弯头平
口棘突骨钳、枪形咬骨钳
II
6810-46810矫形外科(骨
科)手术器械
矫形(骨科)外科用
锯、凿、锉
环锯、腰椎用梯形骨凿、椎间盘手术用环
锯、C-D椎板剥离器、颈椎测深凿、颈椎
直角骨凿、椎板骨凿、椎体骨凿、椎体前
方剥离器
II
6810-76810矫形外科(骨
科)手术器械
矫形(骨科)外科用
有源器械
风动开颅器、电池式自停颅骨钻、电动胸
骨锯、电动骨钻
II
6810-86810矫形外科(骨
科)手术器械
矫形(骨科)外科用
其它器械
肢体延长架、多功能单侧外固定支架II
682016820普通诊察器械体温计电子体温计、红外耳蜗体温计、口腔、肛
门、腋下体温计、皮肤体温计、液晶体温
计
II
682026820普通诊察器械血压计无创性电子血压计、台式、立式血压计、
血压表、小儿血压表
II
682136821医用电子仪器
设备
无创医用传感器无创医用传感器II
682146821医用电子仪器
设备
心电诊断仪器
单导心电图机、多导心电图机、胎儿心电
图机、心电向量图机、心电图综合测试仪、
晚电位测试仪、无损伤心功能检测仪、心
率变异性检测仪、心电分析仪、运动心电
功量计、心电多相分析仪、心电遥测仪、
心电电话传递系统、实时心律分析记录仪、
长程心电记录仪、心电标测图仪、心电工
作站
II
682156821医用电子仪器
设备
脑电诊断仪器
脑电图机、脑电阻仪、脑电波分析仪、脑
地形图仪、脑电实时分析记录仪
II
682166821医用电子仪器
设备
肌电诊断仪器肌电图机II
682176821医用电子仪器
设备
其他生物电诊断仪器
眼动图仪、眼震电图仪、视网膜电图仪、
诱发电位检测系统(含视、听、体)
II
682186821医用电子仪器
设备
电声诊断仪器
听力计、小儿测听计、心音图仪、舌音图
仪、胃电图仪、胃肠电流图仪
II
682196821医用电子仪器
设备
无创监护仪器
病人监护仪(监护参数含心电、血氧饱和
度、无创血压、脉搏、体温、呼吸、呼吸
末二氧化碳)、麻醉气体监护仪、呼吸功
能监护仪、睡眠评价系统、分娩监护仪
II
6821106821医用电子仪器
设备
呼吸功能及气体分析
测定装置
综合肺功能测定仪、呼吸功能测试仪、氧
浓度测定仪、肺通气功能测试仪、CO2浓
度测定仪、肺内气体分布功能测试仪、弥
散功能测试仪、氮气计、微量气体分析器、
压力型容积描绘仪、肺量仪
II
6821116821医用电子仪器
设备
医用刺激器声、光、电、磁刺激器II
6821126821医用电子仪器
设备
血流量、容量测定装
置
脑血流图仪、阻抗血流图仪、电磁血流量
计、无创心输出量计、心脏血管功能综合
测试仪
II
6821136821医用电子仪器
设备
电子压力测定装置电子血压脉搏仪、动态血压监护仪II
6821146821医用电子仪器
设备
生理研究实验仪器
方波生理仪、生物电脉冲频率分析仪、生
物电脉冲分析仪、微电极控制器、微操纵
器、微电极监视器
II
6821156821医用电子仪器
设备
光谱诊断设备医用红外热象仪、红外线乳腺诊断仪II
6821176821医用电子仪器
设备
睡眠呼吸治疗系统睡眠呼吸治疗系统II
684016840临床检验分析
仪器
血液分析系统
全自动血细胞分析仪、全自动涂片机、半
自动血细胞分析仪、半自动血栓、血凝分
析仪、自动血库系统、血红蛋白测定仪、
血小板聚集仪、血糖分析仪、血流变仪、
血液粘度计、红细胞变形仪、血液流变参
数测试仪、血栓弹力仪、流式细胞分析仪、、
全自动血栓止血分析系统、全自动凝血纤
溶分析仪
II
684026840临床检验分析
仪器
生化分析系统
全自动生化分析仪、全自动快速(干式)
生化分析仪、全自动多项电解质分析仪、
半自动生化分析仪、半自动单/多项电解质
分析仪
II
684036840临床检验分析
仪器
免疫分析系统
酶免仪、半自动酶标仪、荧光显微检测系
统、特定蛋白分析仪、化学发光测定仪、
荧光免疫分析仪、
II
684046840临床检验分析
仪器
细菌分析系统
细菌测定系统、快速细菌培养仪、幽门螺
旋杆菌测定仪
II
684056840临床检验分析
仪器
尿液分析系统自动尿液分析仪及试纸II
684076840临床检验分析
仪器
血气分析系统
全自动血气分析仪、组织氧含量测定仪、
血气采血器、血氧饱和度测试仪、CO2红
外分析仪、经皮血氧分压监测仪、血气酸
碱分析仪、电化学测氧仪
II
684086840临床检验分析
仪器
基因和生命科学仪器
精子分析仪、生物芯片阅读仪、PCR扩增
仪
II
6840106840临床检验分析
仪器
临床医学检验辅助设
备
超净装置、血球记数板、自动加样系统、
自动进样系统、洗板机
II
684116841医用化验和基
础设备器具
医用培养箱
CO2培养箱、超净恒温培养箱、厌氧培养
装置
II
684146841医用化验和基
础设备器具
血液化验设备和器具真空采血管、采血针、激光采血机II
684536845体外循环及血
液处理设备
人工心肺设备辅助装
置
热交换器、水箱II
684566845体外循环及血
液处理设备
体液处理设备腹膜透析机、腹膜透析管II
684656846植入材料和人
工器官
器官辅助装置助听器、外挂式人工喉II
685456854手术室、急救
室、诊疗室设备及器
具
输液辅助装置输液泵、注射泵II
685466854手术室、急救
室、诊疗室设备及器
具
负压吸引装置流产吸引器、负压吸引器II
685476854手术室、急救
室、诊疗室设备及器
具
呼吸设备配件简易呼吸器II
685486854手术室、急救
室、诊疗室设备及器
具
医用制气设备医用制氧机、手提式氧气发生器II
685496854手术室、急救
室、诊疗室设备及器
具
电动貉故质
跆?/td>
电动综合手术台、治疗手术床、电动间隙
牵引床、
II
6854106854手术室、急救
室、诊疗室设备及器
具
冲洗、通气、减压器
具
各种胃肠减压器、电动洗胃机、自控洗胃
机、胃脏冲洗器、输卵管通气机、灌肠机、
洗肠机
II
6854116854手术室、急救
室、诊疗室设备及器
具
诊察治疗设备耳鼻喉科检查治疗台II
6854136854手术室、急救
室、诊疗室设备及器
具
手术灯无影灯接美涔庀宋脊馐质醯?/td> II
685516855口腔科设备及
器具
口腔综合治疗设备综合治疗台(机)II
685526855口腔科设备及
器具
牙钻机及配件电动牙钻机、涡轮牙钻机II
685536855口腔科设备及
器具
牙科椅液压牙科椅、电动牙科椅II
685546855口腔科设备及
器具
牙科手机电动手机、涡轮手机II
685556855口腔科设备及
器具
洁牙、补牙设备
医用洁牙机、牙髓活力测试仪、牙根管长
度测定仪、根管治疗仪、光固化机(器)
II
685566855口腔科设备及
器具
车针车针II
685576855口腔科设备及
器具
口腔综合治疗设备配
件
强力吸引器、三用喷枪、吸唾器II
685616856病房护理设备
及器具
供氧系统
医院集中供氧系统、吸排氧三通阀箱、吸
氧调节器、氧浓度监察仪、氧气减压装置、
排氧装置
II
685626856病房护理设备
及器具
病床电动多功能病床、电动防褥疮床垫II
685716857消毒和灭菌设
备及器具
辐射灭菌设备医用伽玛射线灭菌器II
685726857消毒和灭菌设
备及器具
压力蒸汽灭菌设备
预真空蒸汽灭菌器、高压蒸汽灭菌器、自
动高压蒸汽灭菌器、立式压力蒸汽灭菌器、
卧式圆形压力蒸汽灭菌器、卧式矩形压力
蒸汽灭菌器、脉动真空压力蒸汽灭菌器、
手提式压力蒸汽灭菌器
II
685736857消毒和灭菌设
备及器具
气体灭菌设备环氧乙烷灭菌器、轻便型自动气体灭菌器II
6821186821医用电子仪器
设备
心电电极心电电极II
682246822医用光学器具、
仪器及内窥镜设备
眼科光学仪器
裂隙灯显微镜、视野机、同视机、夜间视
觉检查仪、隐斜计、前房深度测定仪、角
膜曲率计、色盲镜、视网膜镜、眼压镜、
验光仪、直接和间接检眼镜、屈光度仪、
眼底照相机验光镜片组、验光组合台、角
膜地形图仪、激光视网膜传递函数测定仪、
瞳距测量仪、光学和光电弱视助视器、检
影镜、验光镜片
II
682256822医用光学器具、
仪器及内窥镜设备
光学内窥镜及冷光源
诊断用纤维内窥镜(上消化道镜、结肠镜、
大肠镜、支气管镜)、观察用硬管内窥镜
(喉镜、鼻镜、膀胱镜、子宫镜、直肠镜、
羊水镜)、内窥镜冷光源
II
682266822医用光学器具、
仪器及内窥镜设备
医用手术及诊断用显
微设备
各类手术显微镜(眼科、显微外科、儿鼻
喉科等)、阴道显微镜、直肠显微镜、微
循环显微镜、体表微循环显微镜、生物显
微镜、显微精子分析系统
II
682336823医用超声仪器
及有关设备
超声母婴监护设备
多功能超声监护仪、超声母亲/胎儿综合监
护仪、超声产科监护仪、胎儿监护仪
II
682346823医用超声仪器
及有关设备
超声换能器
心腔内超声导管换能器、穿刺超声换能器、
血管内超声换能器、电子线阵换能器、机
械扫描换能器、环阵换能器、凸阵扫描换
能器、食管超声换能器
II
682356823医用超声仪器
及有关设备
便携式超声诊断设备
B型电子线阵超声诊断仪、B型机械扇扫超
声诊断仪、B型伪彩色显示仪、超声听诊
器、超声骨密度仪、超声骨强度仪、超声
骨测量仪
II
682366823医用超声仪器
及有关设备
超声理疗设备
超声去脂仪、超声治疗机、超声雾化器、
超声穴位治疗机、超声按摩仪、超声骨折
治疗机、超声洁牙机、超声波妇科皮肤治
疗仪、
II
682426824医用激光仪器
设备
激光诊断仪器
激光肿瘤光谱诊断装置、激光荧光肿瘤诊
断仪、2类激光诊断仪、激光血液分析仪、
激光检测仪、激光多普勒血流计
II
682456824医用激光仪器
设备
弱激光体外治疗仪器
氦氖激光治疗机(包括具有扩束装置的照
射仪)、氦镉激光治疗机、3A类半导体激
光治疗机、激光针灸治疗仪
II
682516825医用高频仪器
设备
高频手术和电凝设备
高频腋臭治疗仪、高频痔疮治疗仪、高频
电灼器
II
682526825医用高频仪器
设备
高频电熨设备高频妇科电熨器、高频五官科电熨器II
682546825医用高频仪器
设备
射频治疗设备短波治疗机、超短波治疗机II
682556825医用高频仪器
设备
高频电极电凝钳、电凝镊、阴极板、手术电极II
682626826物理治疗及康
复设备
电疗仪器
音频电疗机、差频电疗机、高压低频脉冲
治疗机、场效应治疗仪(热垫式治疗仪)
II
682636826物理治疗及康
复设备
光谱辐射治疗仪器
光量子血液治疗机(紫外线照射)、紫外
线治疗机、红外线治疗机、远红外辐射治
疗机常规光源治疗机、光谱治疗仪、强光
辐射治疗仪
II
682656826物理治疗及康
复设备
理疗康复仪器
电动牵引装置、防打鼾器(正压呼吸治疗
机)
II
682666826物理治疗及康
复设备
生物反馈仪
肌电生物反馈仪、温度生物反馈仪、心率
反馈仪
II
682676826物理治疗及康
复设备
磁疗仪器
磁疗机、磁感应电疗机、低频电磁综合治
疗机、特定电磁波治疗机、磁疗器具
II
682686826物理治疗及康
复设备
眼科康复治疗仪器视力训练仪、弱视治疗仪II
682716827中医器械诊断仪器中医专家系统、脉象仪、舌相仪、痛阈测
量仪、经络分析仪
II
682726827中医器械治疗仪器电子穴位测定治疗仪、综合电针仪、电麻
仪、定量针麻仪、探穴针麻机穴位测试仪、
耳穴探测治疗机
II
682736827中医器械中医器具针灸针、小针刀、三棱针、梅花针II
683026830医用X射线设备X射线诊断设备及高
压发生装置
200mA以下(含200mA)X射线诊断设备II
683116831医用X射线附属
设备及部件
医用X射线管、管组
件或源组件
医用固定阳极X射线管、旋转阳极X射线
管、X射线CT管、栅极X射线管及管组件
或源组件、高压发生器
II
683126831医用X射线附属
设备及部件
医用X线影像系统及
成像器件
医用X射线电视系统、数字减影系统、X
射线影像增强系统、激光相机、X射线像
增强器、医用透视荧光屏、医用间接摄影
荧光屏、医用中,高速增感屏、牙用增感
屏
II
683136831医用X射线附属
设备及部件
X线机配套用患者或
部件支撑装置(电动)
X射线检查用电动胃肠床、电动摄影平床、
电动导管床、电动断层床、X射线管或监
视器用电动悬吊装置及电动立柱式支撑装
置
II
683146831医用X射线附属
设备及部件
X射线透视、摄影附
加装置
高压注射器、防散射滤线栅、荧光摄影装
置、胸片摄影装置
II
683156831医用X射线附属
设备及部件
X射线机用限速器X射线机用限速器II
683326833医用核素设备放射性核素诊断设备骨密度仪、伽玛照相机、肾功能仪、甲状
腺功能测定仪、核素听诊器、心功能仪、
闪烁分层摄影仪、放射性核素透视机、γ
射线探测仪
II
683336833医用核素设备核素标本测定装置放射免疫测定仪II 683346833医用核素设备核素设备用准直装置放射性同位素设备准直器II
685746857消毒和灭菌设
备及器具
干热灭菌设备干热灭菌器、微波灭菌柜II
685756857消毒和灭菌设
备及器具
高压电离灭菌设备
手术室用高压电离灭菌设备、病房用高压
电离灭菌设备
II
685766857消毒和灭菌设
备及器具
专用消毒设备超声消毒设备、口腔科消毒设备II
685816858医用冷疗、低
温、冷藏设备及器具
低温治疗仪器
宫腔冷冻治疗仪、冷冻低温治疗机、低温
变速降温仪旱淞苹⒀顾跏嚼涠持瘟
埔?/td>
II
685826858医用冷疗、低
温、冷藏设备及器具
医用低温设备
医用低温箱(-20℃、-40℃、-60℃、-80℃)、
低温生物降温仪
II
685836858医用冷疗、低
温、冷藏设备及器具
医用冷藏设备血液制品冷藏箱、脏器冷藏装置II
686356863口腔科材料永久性充填材料及有
关材料
牙釉质粘合剂、窝沟封闭剂II
686366863口腔科材料暂封性充填材料及有
关材料
暂封补牙条、氧化锌水门汀II
686376863口腔科材料金属、陶瓷类义齿材
料
齿科铸造合金、齿科锻造合金、烤瓷合金、
焊接合金、烤瓷粉、金属—烤瓷、瓷牙
II
686386863口腔科材料齿科预防保健材料氟防龋材料II 686396863口腔科材料充填辅助材料齿科酸蚀剂、预处理剂、遮色剂II
6863106863口腔科材料正畸材料正畸丝、矫治器、方丝弓矫治器、细丝弓
矫治器、带环、橡皮圈
II
6863116863口腔科材料印模材料印模膏、氧化锌印模糊剂、琼脂印模材料、
印模石膏、橡胶类印模材料、藻酸盐印模
材料
II
686426864医用卫生材料
及敷料
敷料、护创材料止血海绵接猛阎蕖II接猛阎床?/td> II
686526865医用缝合材料
及粘合剂
不可吸收缝合线(带
针/不带针)
各种锦纶、丙纶、涤纶缝合线、不锈钢缝
线、蚕丝线
II
686546865医用缝合材料
及粘合剂
表面缝合材料皮肤缝合钉接美II
686626866医用高分子材
料及制品
妇科检查器械一次性使用阴道扩张器及润滑液II
686636866医用高分子材
料及制品
避孕器械避孕套、避孕帽II
686646866医用高分子材
料及制品
导管鞴?/td>
一次性使用导尿管淮涡允褂玫デ坏寄蚬
堋⑺黄业寄蚬堋⒌ü芤鞴?/td>
II
686656866医用高分子材
料及制品
呼吸麻醉或通气用气
管插管
经口(鼻)气管插管、气管切开插管、支
气管插管、麻醉机用呼吸囊、麻醉呼吸机
管路及接头、
II
686666866医用高分子材
料及制品
肠道插管鼻饲管、胃管、十二指肠管、肛门管II
686676866医用高分子材
料及制品
手术手套无菌医用手套II
687026870软件诊断图象处理软件CR/DR II 687026870软件诊断图象处理软件病理图像分析系统II 687026870软件诊断图象处理软件显微分析系统II 687026870软件诊断图象处理软件红外热象处理II 687026870软件诊断图象处理软件数字化超声工作站、II 687026870软件诊断图象处理软件超声三维成像系统、II 687026870软件诊断图象处理软件舌象仪II 687036870软件诊断数据处理软件24小时全信息动态心电分析系统II
687036870软件诊断数据处理软件24小时全信息动态脑电记录分析系统II 687036870软件诊断数据处理软件脉象仪II 687036870软件诊断数据处理软件脑电(肌电)诊断分析系统II 687036870软件诊断数据处理软件睡眠监护系统、II 687036870软件诊断数据处理软件血流变数据处理软件II
687036870软件诊断数据处理软件激光(血液分析仪、激光全息检测仪)数据分
析软件
II
687046870软件影象档案传输、处理
系统软件
PACS、远程诊断II
687056870软件人体解剖学测量软件人体解剖学测量软件II
重庆XXX医疗器械有限公司 二类医疗器械经营管理制度 目录 1、医疗器械质量管理人员的职责; 2、医疗器械质量管理的规定; 3、医疗器械采购、收货、验收的规定; 4、医疗器械供货者资格审核的规定; 5、医疗器械贮存、养护的规定; 6、医疗器械销售和售后服务的规定; 7、不合格医疗器械管理的规定; 8、医疗器械退、换货的规定; 9、医疗器械不良事件监测和报告规定; 10、医疗器械召回规定; 11、设施设备维护及验证和校准的规定; 12、卫生和人员健康状况的规定; 13、质量管理培训及考核的规定; 14、医疗器械质量投诉、事故调查和处理报告的规定; 15、质量管理制度执行情况考核的规定
1.医疗器械质量管理人员的职责 本公司医疗器械质量管理负责人为xxx,负责医疗器械质量管理相关的所有工作。 质量管理负责人职责是: 1认真贯彻学习和遵守国家关于医疗器械质量管理政策、法律及有关规定。 2依据企业质量方针目标,制定并定期修改本店的质量管理制度,并领导、组织、实施。 3负责处理质量查询。对顾客反映的质量问题,应填写质量查询登记表,及时查出原因,迅速予以答复解决。 4负责质量信息管理工作。经常收集各种医疗器械信息和有关医疗器械质量的公告,组织传递反馈。 五、负责不合格产品报损前的审核及报废产品处理的监督工作。 六、收集、保管好本店的质量文件、档案资料,督促各岗位做好各种台帐、记录,保证本店各项质量活动记录的完整性、准确性和可追溯性。 七、及时上报本店发生的质量事故,及时填报医疗器械不良反应和其它各类信息报表。 八、负责经营过程中产品质量管理工作,指导、督促产品质量管理制度的执行,培训并指导验收员、养护员和保管员执行质量管理制度和各项管理规定。 九、负责质量管理制度在本店的贯彻、执行,定期检查制度执行情况,对存在的问题提出改进措施。 一、为明确本店经营质量管理的总体质量方针和目标,根据《医疗器械监督管理条例》和国家食品药品监督管理局《医疗器械经营许可证管理办法》等规定,结合企业实际,制定本制度。使得本企业能遵守《医疗器械监督管理条例》法规以及有关医疗器械管理规定,按国家药品监督管理部门制定的《医疗器械经营监督管理办法》规范企业经营行为,在经营许可核定的经营方式和范围内从事医疗器械营销活动。确保本店在医疗器械进、存、销各环节中的质量要求及管理措施的实施。 二、企业的质量方针为:质量是企业的生命线,诚信是企业发展的基石。 三、企业质量管理的目标:
质量管理制度目录 一、各部门、各类人员的岗位职责 二、员工法规及质量管理培训考核制度 三、供货企业的资质品种审核管理制度 四、进货验收制度 五、仓库保管制度 六、出库复核制度 七、效期产品管理制度 八、不合格产品的确认和处理制度 九、质量跟踪制度 十、不良事件报告制度 十一、质量事故和投诉处理的管理制度十二、产品售后服务的管理制度 十三、有关记录和凭证的管理制度
各部门、各类人员的岗位职责 一、经理职责 1、组织本经销部所有员工认真学习和执行有关《医疗器械监督管理条例》、《医疗器械经营企业许可证管理办法》,在“质量第一”的思想指导下进行经营管理。 2、组织有关岗位人员建立规章制度和完善质量体系,定期召开质量管理工作会议,研究、解决质量工作方面的问题,对本经销部所经营医疗器械质量负全面责任。 3、指导和监督员工严格按《医疗器械监督管理条例》来规范医疗器械经营行为。 4、组织有关人员定期对医疗器械进行检查,做到经营医疗器械帐物相符,严禁变质及过期失效、淘汰医疗器械出售现象发生。 5、检查各级质量责任制度的执行情况,表彰先进,处罚造成质量事故的有关人员。 6、负责组织制定和修订各项质量管理制度。 7、负责质量指导、质量计划的实施,对质量体系的工作质量负责。 8、主持质量问题的调查、分析和处理、落实质量奖惩工作。
二、质量管理负责人职责 1、负责贯彻执行国家有关医疗器械质量管理的法律、法规和行政规章。包括:①组织学习国家有关医疗器械质量管理的法律、法规和行政规章。②宣传、贯彻、执行国家有关医疗器械质量管理的法律、法规和行政规章。③指导企业在医疗器械的购进、验收、储存与养护中严格按有关法律、法规办事。 2、负责起草、编制企业医疗器械质量管理制度,并指导、督促制度的执行。 3、负责首营企业的质量审核。包括参与现场考察首营企业。 4、负责首营品种的质量审核。包括参与现场考察首营品种。 5、负责建立企业所经营品种包含质量标准等内容的质量档案。 6、负责医疗器械质量的查询和医疗器械质量事故或质量投诉的调查、处理及报告。 7、负责医疗器械的验收管理。 8、负责指导和监督医疗器械保管、养护和运输中的质量工作。 9、负责质量不合格医疗器械的审核,对不合格医疗器械的处理过程实施监督。包括对不合格医疗器械的确认、处理、报损和监督销毁。 10、负责收集和分析医疗器械质量信息。包括企业的外部信息和内
第一批不需申请《医疗器械经营企业许可证》的第二类医疗器械产品名录 1、普通诊断器械体温计、血压计 2、物理治疗设备磁疗器具 3、医用卫生材料及敷料医用脱脂棉、医用脱脂纱布、医用卫生口罩 4、临床检验分析仪器家用血糖仪、血糖试纸条、妊娠诊断试纸(早孕检测试纸) 5、医用高分子材料及制品避孕套、避孕帽 6、病房护理设备及器具轮椅 7、敷料医用无菌纱布 第二批不需申请《医疗器械经营企业许可证》的第二类医疗器械产品名录 电子血压脉搏仪 梅花针 三棱针 针灸针 排卵检测试纸 手提式氧气发生器 第一节工艺布局 第4.1.1条工艺布局应按生产流程要求,做到布置合理、紧凑,有利生产操作,并能保证对生产过程进行有效的管理。 第4.1.2条工艺布局要防止人流、物流之间的混杂和交叉污染,并符合下列基本要求: 一、分别设置人员和物炎进出生产区域的通道,极易造成污染的物料(如部分原辅料、生产中废弃物等)必要时可设置专用出入口。洁净厂房内的物传递路线尽量要短; 二、人员和物料进入洁净生产区应有各自的净化用室和设计。净化用室的设置要求与生产区的空气洁净度等级相适应; 三、生产操作区内应只设置必要的工艺设备和设计。用于生产、贮存的区域不得用作非本区域内工作人员的通道; 四、输送人中和物料的电梯宜分开。电梯不宜设在洁净区内。必需设置时,电梯前应设所闸室或其他确保洁净区空气洁净度的措施。 第4.1.3条在满足工艺条件的前提下,为提高净化效果,节约能源,有空气洁度要求的房间近下列要求布置: 一、空气洁净度高的房间或区域宜布置在人员最少到达的地方,并宜靠近空调机房; 二、不同空气洁净度等级的诚心诚意是或区域宜按空气洁净度等级的高低由里及外布置; 三、空气洁净度相同的房间或区域宜相对集中; 四、不同空气洁净度房间之间相互联系应有防止污染措施,如:气闸室或传递窗(柜)等。 第4.1.4条医药工业洁净厂房内应设置与生产规模相适应的原辅材料、半成品、成品存放区域,且尽可能靠近与其相联系的生产区域,减少运输过程中的混杂与污染。存放区域内应安排待验区、合格品区和不合格品区。 第4.1.5条下列生产辅助用室的布置要求: 一、称量室 宜靠近原辅料室,其空气洁净度等级宜同配料室; 二、设备及容器具清洗室
五、研究资料 根据所申报的产品,提供适用的研究资料。 (一)产品性能研究 应当提供产品性能研究资料以及产品技术要求的研究和编制说明,包括功能性、安全性指标(如电气安全与电磁兼容、辐射安全)以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。 (二)生物相容性评价研究 应对成品中与患者和使用者直接或间接接触的材料的生物相容性进行评价。 生物相容性评价研究资料应当包括: 1.生物相容性评价的依据和方法。 2.产品所用材料的描述及与人体接触的性质。 3.实施或豁免生物学试验的理由和论证。 4.对于现有数据或试验结果的评价。 (三)生物安全性研究 对于含有同种异体材料、动物源性材料或生物活性物质等具有生物安全风险类产品,应当提供相关材料及生物活性物质的生物安全性研究资料。包括说明组织、细胞和材料的获取、加工、
保存、测试和处理过程;阐述来源(包括捐献者筛选细节),并描述生产过程中对病毒、其他病原体及免疫源性物质去除或灭活方法的验证试验;工艺验证的简要总结。 (四)灭菌/消毒工艺研究 1.生产企业灭菌:应明确灭菌工艺(方法和参数)和无菌保证水平(SAL),并提供灭菌确认报告。 2.终端用户灭菌:应当明确推荐的灭菌工艺(方法和参数)及所推荐的灭菌方法确定的依据;对可耐受两次或多次灭菌的产品,应当提供产品相关推荐的灭菌方法耐受性的研究资料。 3.残留毒性:如灭菌使用的方法容易出现残留,应当明确残留物信息及采取的处理方法,并提供研究资料。 4.终端用户消毒:应当明确推荐的消毒工艺(方法和参数)以及所推荐消毒方法确定的依据。 (五)产品有效期和包装研究 1.有效期的确定:如适用,应当提供产品有效期的验证报告。 2.对于有限次重复使用的医疗器械,应当提供使用次数验证资料。 3.包装及包装完整性:在宣称的有效期内以及运输储存条件下,保持包装完整性的依据。 (六)临床前动物试验 如适用,应当包括动物试验研究的目的、结果及记录。
医疗器械管理制度及职责培训一医疗器械管理制度 1.医疗器械购进、销售管理制度 严格执行公司的规定,坚持“质量第一、按需进货,择优采购”的原则。 首营企业应按公司“医疗器械首营企业和品种质量审核管理制度”的规定办理有关审核手续。 凡经质量管理部门检查或接医疗器械监督管理部门通知的不合格、过期失效、变质的医疗器械,一律不得开票销售,已销售的应及时通知收回。需报损的医疗器械,应按公司的规定进行。 销售医疗器械应开具合法票据,并按规定建立销售记录,做到票、帐、货相符。销售票据和记录应按规定妥善保管。 定期或不定期上门征求或函询顾客意见,认真协助质量管理部门处理顾客投诉和质量问题,及时进行质量改进。 2.医疗器械首营企业和品种质量审核管理制度 ①“首营企业”指与本企业首次发生医疗器械供需关系的医疗器械生产企业或医疗器械经营企业;②首营品种是指公司向医疗器械生产企业首次购进的医疗器械。 审批首营企业和品种的必备资料:① 首营企业的审核要求必须提供加盖首营企业原印章的合法证照(《医疗器械生产企业许可证》或《医疗器械经营企业许可证》和营业执照)复印件;医疗器械销售人员须提供加盖企业原印章和企业法定代表人印章或签字
的授权委托书,并标明授权范围及授权时限;医疗器械销售人员身份证复印件;质量保证协议及售后服务书。 购进品种时,应提供医疗器械质量标准;医疗器械注册证;医疗器械产品登记表。 3.医疗器械质量验收管理制度 医疗器械质量验收由质量管理部的质量验收员负责。质量验收员应具有高中以上学历,并经岗位培训和湖南省食品药品监督管理局培训考试合格,取得岗位合格证书后方可上岗。 国家对医疗器械实行分类管理。 第一类是指,通过常规管理足以保证其安全性、有效性的医疗器械。 第二类是指,对其安全性、有效性应当加以控制的医疗器械。 第三类是指,植入人体;用于支持、维持生命;对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。 验收时应按照医疗器械的分类,对医疗器械的包装、标签、说明书以及有关要求的证明或文件进行逐一检查。 ① 验收医疗器械标签、包装标识应包括:生产企业的名称、地址,医疗器械的名称、型号、规格、医疗器械注册证书编号、产品标准编号、产品生产日期或者批(编)号,限期使用的产品,应当标明有效期限、依据产品特性应当标注的图形、符号以及其他相关内容等。
医疗器械监督管理条例具体内容 医疗器械监督管理条例具体内容 发布时间:2020-04-19 《医疗器械监督管理条例》已经20xx年2月12日国务院第39次常务会议修订通过,现将修订后的《医疗器械监督管理条例》公布,自20xx年6月1日起施行。下文是医疗器械监督管理条例,欢迎阅读! 医疗器械监督管理条例完整版全文第一章总则 第一条为了保证医疗器械的安全、有效,保障人体健康和生命安全,制定本条例。 第二条在中华人民共和国境内从事医疗器械的研制、生产、经营、使用活动及其监督管理,应当遵守本条例。 第三条国务院食品药品监督管理部门负责全国医疗器械监督管理工作。国务院有关部门在各自的职责范围内负责与医疗器械有关的监督管理工作。 县级以上地方人民政府食品药品监督管理部门负责本行政区域的医疗器械监督管理工作。县级以上地方人民政府有关部门在各自的职责范围内负责与医疗器械有关的监督管理工作。 国务院食品药品监督管理部门应当配合国务院有关部门,贯彻实施国家医疗器械产业规划和政策。 第四条国家对医疗器械按照风险程度实行分类管理。 第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。 第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。 第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。 评价医疗器械风险程度,应当考虑医疗器械的预期目的、结构特征、使用方法等因素。 国务院食品药品监督管理部门负责制定医疗器械的分类规则和分类目录,并根据医疗器械生产、经营、使用情况,及时对医疗器械的风险变化进行分析、评价,对分类目录进行调整。制定、调整分类目录,应当充分听取医疗器械生产经营企业以及使用单位、行业组织的意见,并参考国际医疗器械分类实践。医疗器械分类目录应当向社会公布。
公司质量管理制度(医疗器械) 执行日期:2014年10月1日 医疗器械质量管理制度目录
一、企业负责人职责 二、质量管理人职责 三、验收员岗位职责 四、维修养护售后人员职责 五、产品采购索证管理制度 六、进货验收管理制度 七、仓库保管养护管理制度 八、出库复核管理制度 九、效期产品管理制度 十、不合格品的确认和处理制度 十一、购销记录档案管理制度 十二、产品售后服务管理制度 十三、一次性使用无菌医疗器械管理制度 十四、质量查询、质量投诉及不良反应报告制度十五、质量信息管理制度 十六、有关质量记录的管理制度 十七、质量教育培训及考核管理制度 企业负责人职责
一、领导和动员全体员工认真贯彻执行《医疗器械监督管理条例》 《医疗器械经营监督管理办法》等国家有关医疗器械法律、法规和规章等,在“合法经营、质量为本”的思想指导下进行经营管理。对公司所经营医疗器械的质量负全面领导责任。 二、合理设置并领导质量组织机构,保证其独立、客观地行使职权 充分发挥其质量把关职能,支持其合理意见和要求,提供并保证其必要的质量活动经费。 三、表彰和奖励在质量管理工作中作出成绩的员工,批评和处罚造 成质量事故的人员。 四、正确处理质量与经营的关系。 五、重视客户意见和投诉处理,主持重大质量事故的处理和重大质 量问题的解决和质量改进。 六、创造必要的物质、技术条件,使之与经营的质量要求相适应。 七、签发质量管理体系文件。
质量管理人员职责 一、全面负责企业的质量管理工作,对本企业经营全过程的质量管理工作进行监督、指导、协调,有效实施质量否决权。确保单位贯彻执行国家有关医疗器械质量管理的法律、法规和行政规章。 二、负责对供货企业质量审核。 三、负责开展对单位职工产品品质量管理方面的教育培训工作。 四、负责指导和监督医疗器械验收、保管、养护中的质量工作。 五、对不合格医疗器械进行控制性管理,负责不合格医疗器械报损前的审核及报损、销毁医疗器械处理的监督工作,监督做好不合格医疗器械的相关记录。 六、负责种类质量记录、资料的收集存档工作,保证各项质量记录的完整性、准确性和可追溯性。 七、负责产品不良反应信息的处理及报告工作。 八、定期检查配送中心(门店)的环境及人员卫生情况,组织员工定期接受健康检查。
附件2: 第二类医疗器械注册申报资料要求及说明 (征求意见稿) 申报资料一级标题申报资料二级标题 1.申请表 2.证明性文件 3.医疗器械安全有效基本要求 清单 4.综述资料 4.1概述 4.2产品描述 4.3型号规格 4.4包装说明 4.5适用范围和禁忌症 4.6参考的同类产品或前代产品的情况(如有) 4.7其他需说明的内容 5.研究资料 5.1产品性能研究 5.2生物相容性评价研究 5.3生物安全性研究 5.4灭菌和消毒工艺研究 5.5有效期和包装研究 5.6动物研究 5.7软件研究 5.8其他 6.生产制造信息 6.1 无源产品/有源产品生产过程信息描述 6.2生产场地 7.临床评价资料 8.产品风险分析资料 9.产品技术要求 10.产品注册检验报告10.1注册检验报告 10.2预评价意见 11.说明书和标签样稿11.1说明书 11.2最小销售单元的标签样稿 12.符合性声明 注册申报资料应有所提交资料目录,包括申报资料的一级和二级标题。每项二级标题对应的资料应单独编制页码。 一、申请表(附表1)
二、证明性文件 1.企业营业执照副本复印件和组织机构代码证复印件。 2.按照《创新医疗器械特别审批程序审批》的境内医疗器械申请注册时,应当提交创新医疗器械特别审批申请审查通知单,样品委托其他企业生产的,应当提供受托企业生产许可证和委托协议。生产许可证生产范围应涵盖申报产品类别。 三、医疗器械安全有效基本要求清单 说明产品符合《医疗器械安全有效基本要求清单》(附表2)各项适用要求所采用的方法,以及证明其符合性的文件。对于《医疗器械安全有效基本要求清单》中不适用的各项要求,应当说明其理由。 对于包含在产品注册申报资料中的文件,应当说明其在申报资料中的具体位置;对于未包含在产品注册申报资料中的文件,应当注明该证据文件名称及其在质量管理体系文件中的编号备查。 四、综述资料 (一)概述 描述申报产品的管理类别、分类编码及名称的确定依据。 (二)产品描述 1.无源医疗器械 描述产品工作原理、作用机理(如适用)、结构组成(含配合使用的附件)、主要原材料,以及区别于其他同类产品的特征等内容;必要时提供图示说明。 2.有源医疗器械 描述产品工作原理、作用机理(如适用)、结构组成(含配合使用
(一)采购管理制度 ⑴采购员的资质:门店采购员必须具有相应的资质并经专业培训、考试合格后方可上岗。 ⑵采购的方式:门店根据销售情况,通过线上采购和线下采购两者方式进行采购。 ⑶记录的保存:2年 (二)收货、验收管理制度 ⑴验收员的资质:验收人员必须具有相应的资质并经专业或岗位培训,合格后方可上岗。 ⑵验收过程:验收员必须依据公司开具的随货同行单,对到货医疗器械的品名、规格、数量、效期、生产厂商、批号等逐一进行核对,检查医疗器械外观、质量是否符合规定,有无医疗器械破碎,短缺等问题,并在凭证上签字。(三)陈列管理制度 ⑴门店温湿度的监控:门店必须对营业场所温度进行监测和调控,以使营业场所的温度符合常温要求,定期(每月)进行卫生检查,保持环境整洁。存放、陈列医疗器械的设备应当保持清洁卫生,不得放置与销售活动无关的物品,并采取防虫、防鼠等措施,防止污染药品。 ⑵陈列的要求: 1)医疗器械按用途以及储存要求分类陈列,并设置醒目标志,类别标签字迹清晰、放置准确,物价标签必须与陈列医疗器械一一对应,字迹清晰。2)拆零销售的医疗器械集中存放于拆零专柜或专区,做好记录并保留原包装标签至该医疗器械销售完为止
⑶重点检查的品种:拆零医疗器械和易变质、近效期、摆放时间较长的医疗器械等,每月检查两次。 ⑷有疑问医疗器械的处理:凡是质量有疑问的医疗器械,一律不得上架陈列、销售。 (四)销售管理制度 ⑴经营的范围和方式:门店必须按照依法批准的经营方式和经营范围经营医疗器械。 ⑵人员上岗要求:凡从事医疗器械零售工作的营业员,上岗前必须经过业务培训,考核合格后取得上岗证,同时取得健康证明后方能上岗工作,非本企业在职人员不得在营业场所内从事医疗器械销售相关活动。 执业药师或药师等内容的胸卡。 ⑷销售医疗器械的要求:按照《医疗器械监督管理条例》执行。 ⑸广告的要求:店堂内的医疗器械广告宣传必须符合国家《广告法》的规定。未经药品监督管理部门审核批准的医疗器械宣传广告不准在店堂内、门口悬挂张贴、散发。 (五)供应单位和采购品种的审核制度 ⑴本门店为晋江市泉安医药连锁有限公司下属门店,供货单位只有一家为公司总部晋江市泉安医药连锁有限公司;采购的品种审核,也是由公司总部晋江市泉安医药连锁有限公司,统一委托福建泉安医药公司进行审核,门店不再对供应商和采购的品种进行审核。 (六)记录和凭证的管理 ⑴记录范围:指质量管理工作中涉及的各种质量记录。
二类医疗器械注册所需资料及详细步骤 所需资料: 1、医疗器械注册申请表 2、医疗器械生产企业资格证明 3、产品技术报告 4、安全风险分析报告 5、适用的产品标准及说明 6、产品性能自测报告 7、有承检资质的医疗器械检测机构出具的产品注册检测 报告 8、医疗器械临床试验资料 9、医疗器械说明书 10、产品生产质量体系考核(认证)的有效证明文件 11、所提交材料真实性的自我保证声明 注册步骤: a)产品技术报告(产品名称、产品型号/规格及其划分说明; 性能指标:能客观判定的成品的功能性、安全性指标及质量控制相关指标,符合国家标准/行业标准,但不包括产品设计开发的评价性内容;检验方法:具有可重现性和可操作性。) b)注册检测(要求检测公司具有相应的检测资质,我方提供
技术相关资料、注册检验的样品及产品技术;检测公测出检测报告和预评价报告) c)临床试验(临床试验;临床试验合同或协议、临床试验方 案、临床试验报告) d)产品生产质量体系考核(认证)的有效证明文件 e)安全风险分析报告、产品性能自测报告…….. 备注: 医疗器械注册申请表(包括电子版和纸质版,已有表格)、医疗器械生产企业资格证明(生产许可证和营业执照)、 安全风险分析报告(包括能量危害、生物学危害、环境危害、有关使用的危害和由功能失效、维护不周及老化引起的危害等方面的风险分析、风险控制与防范措施等,有相应的表格)、 适用的产品标准及说明(产品的标准可为国家标准、行业标准或注册产品标准文本;采用国家和行业标准的,要提交所采纳的国家标准或行业标准的有效文本及采标说明,采用注册产品标准作为产品标准的,提交注册产品标准正式文本及其编制说明) 产品性能自测报告(产品标准中要求的出厂检测,包括产品名称、规格型号、产品编号或批号、生产日期、样品数量、抽样基数;检测依据、检测项目、标准要求、检测结果、结
办理第二类医疗器械产品生产注册流程(38-8-02) 一、申请与受理 申请人登陆北京市药品监督管理局企业服务平台进行网上申报,根据受理范围的规定,需提交以下申请材料: 1.《中华人民共和国医疗器械注册申请表》; 申请企业填交的《中华人民共和国医疗器械注册申请表》应有法定代表人签字并加盖公章,所填写项目应齐全、准确。 2.《医疗器械注册登记表》; 3.医疗器械生产企业资格证明(包括《医疗器械生产企业许可证》副本复印件及《工商营业执照》副本复印件) 4.产品标准(可为国家标准、行业标准或注册产品标准)及有关说明 5.产品使用说明书 6.注册产品照片,申报企业应按注册产品的不同规格、型号提供5寸以上(含5寸)彩色照片。照片应清晰反映产品全貌。 7.注册软盘 (1)应包括注册申请表、注册登记表、说明书和注册产品标准等内容。 (2)软盘中的内容应与申请材料相一致。 (3)软盘上应注明申请企业名称和申请产品名称、型号。 (一)首次注册的还需提交: 1.产品技术报告 (1)产品特点、工作原理、结构组成、预期用途; (2)产品技术指标或主要性能要求确定的依据; (3)产品设计控制、开发、研制过程; (4)产品的主要工艺流程及说明; (5)产品检测及临床试验情况; (6)与国内外同类产品对比分析。 2.安全风险管理报告 安全风险分析报告应符合YY0316-2003《医疗器械风险管理对医疗器械的应用》,其内容至少应包括:能量危害、生物学危害、环境危害、有关使用的危害和由功能失效、维护不周及老化引起的危害等方面的风险分析、风险控制与防范措施等方面的内容。
3.产品性能自测报告 产品性能自测报告中的检测项目至少应包括产品标准中规定的出厂检测项目。产品性能自测报告至少应包括以下内容: (1)产品名称、规格型号、产品编号或批号、生产日期; (2)检测依据、检测项目、标准要求、检测结果、结果判定、检验人员签字或盖章、检验日期等; (3)如属于委托检测,应提供委托检验协议书及被委托检测机构出具的检测报告。 消毒/灭菌类医疗器械还应提交环境监测报告、消毒/灭菌协议及检菌协议。采用环氧乙烷消毒/灭菌的还需提交环氧乙烷残留量检测协议。同时还应提交保证每批产品消毒/灭菌效果符合产品标准的声明。 4.产品注册检测报告(原件) 5.临床试验资料 临床试验资料包括:临床试验合同(或协议)(原件)、临床试验方案(原件)、临床试验报告(原件),或者相关临床文献资料和已批准上市的同类产品的对比说明; (1)需要进行临床试验的医疗器械,临床试验资料应包括:临床试验合同(或协议)、临床试验方案、临床试验报告,并应符合以下要求: ——实施临床试验的医疗机构应在国家食品药品监督管理局公布的临床试验基地目录内; ——临床试验资料中填写的内容以及相关签字、盖章应齐全、规范; ——临床试验方案首页与临床试验报告首页内容应一致。 (2)提交同类产品临床试验资料的医疗器械,临床试验资料应包括:本企业或其他企业已批准上市的同类产品临床试验报告或相关临床文献资料,并与同类产品进行对比说明(包括基本原理、主要技术性能指标、预期用途等内容)。 注①:临床文献资料是指省级以上核心医学刊物公开发表的能够充分说明产品预期临床使用效果的学术论文、专著以及文献综述。 ②:在SFDA“同类产品目录”未发布前,可提交对比说明的产品仅为京药监发[2003]21号文中豁免目录内的产品。 (3)不需要提供临床试验资料的医疗器械,应符合《医疗器械注册管理办法》或其它规范性文件的相应要求。 6.企业质量体系考核(认证)的有效证明文件 企业质量体系考核(认证)的有效证明文件应为以下形式之一: (1)省、自治区、直辖市(食品)药品监督管理部门签章的、在有效期之内的体系考核报告,考核的产品范围应涵盖申请注册的产品; (2)医疗器械生产质量管理规范检查报告或者医疗器械质量体系认证证书,检查或认证的产品范围应涵盖申请注册的产品;
药店零售二类医疗器 械制度
******药业有限公司 医 疗 器 械 经 营 质 量 管 理 制 度
目录 1、医疗器械质量管理人员的职责; 2、医疗器械质量管理的规定; 3、医疗器械采购、收货、验收的规定; 4、医疗器械供货者资格审核的规定; 5、医疗器械贮存、养护的规定; 6、医疗器械销售和售后服务的规定; 7、不合格医疗器械管理的规定; 8、医疗器械退、换货的规定; 9、医疗器械不良事件监测和报告规定; 10、医疗器械召回规定; 11、设施设备维护及验证和校准的规定; 12、卫生和人员健康状况的规定; 13、质量管理培训及考核的规定;
14、医疗器械质量投诉、事故调查和处理报告的规定; 15、质量管理制度执行情况考核的规定。 医疗器械质量管理人员的职责 本店医疗器械质量管理负责人为罗通海,负责医疗器械质量管理相关的所有工作。质量管理负责人职责是: 一、认真贯彻学习和遵守国家关于医疗器械质量管理政策、法律及有关规定。 二、依据企业质量方针目标,制定并定期修改本店的质量管理制度,并领导、组织、实施。 三、负责处理质量查询。对顾客反映的质量问题,应填写质量查询登记表,及时查出原因,迅速予以答复解决。 四、负责质量信息管理工作。经常收集各种医疗器械信息和有关医疗器械质量的公告,组织传递反馈。 五、负责不合格产品报损前的审核及报废产品处理的监督工作。 六、收集、保管好本店的质量文件、档案资料,督促各岗位做好各种台帐、记录,保证本店各项质量活动记录的完整性、准确性和可追溯性。
七、及时上报本店发生的质量事故,及时填报医疗器械不良反应和其它各类信息报表。 八、负责经营过程中产品质量管理工作,指导、督促产品质量管理制度的执行,培训并指导验收员、养护员和保管员执行质量管理制度和各项管理规定。 九、负责质量管理制度在本店的贯彻、执行,定期检查制度执行情况,对存在的问题提出改进措施。 医疗器械质量管理的规定 一、为明确本店经营质量管理的总体质量方针和目标,根据《医疗器械监督管理条例》和国家食品药品监督管理局《医疗器械经营许可证管理办法》等规定,结合企业实际,制定本制度。使得本企业能遵守《医疗器械监督管理条例》法规以及有关医疗器械管理规定,按国家药品监督管理部门制定的《医疗器械经营监督管理办法》规范企业经营行为,在经营许可核定的经营方式和范围内从事医疗器械营销活动。确保本店在医疗器械进、存、销各环节中的质量要求及管理措施的实施。 二、企业的质量方针为:质量是企业的生命线,诚信是企业发展的基石。 三、企业质量管理的目标: 1、确保企业经营行为的规范、合法; 2、所经营的医疗器械产品安全有效; 3、使本店的质量管理体系,有效运行及持续改进提高; 4、使本店的质量信誉及经济效益不断提高。
《医疗器械监督管理条例》培训考试试卷 日期:姓名:岗位:评分: 一、填空题(每题 2 分, 2 分× 10,共 20 分) 1、(HCV)丙型肝炎病毒抗体检测试剂盒( 胶体金法 ) 国械注准 20143401951 属于第类医疗器械。 2、医用干式激光胶片 (SD-S 片)闽厦械备20150043属于第类医疗器械。 3、医疗器械产品应当符合医疗器械强制性标准;尚无强制性国家标准的,应当符合医疗器械强 制性标准。 4、第一类医疗器械实行产品管理,第二类、第三类医疗器械实行产品管理。 5、医疗器械注册证有效期为年。有效期届满需要延续注册的,应当在有效期届满前向原注册部 门提出延续注册的申请。 6、具有高风险的医疗器械不得委托生产,具体目录由国务院食品药品监督管理部门制定、调整 并公布。 7、提供虚假资料或者采取其他欺骗手段取得医疗器械注册证、医疗器械生产许可证、医疗器械经 营许可证、广告批准文件等许可证件的,由原发证部门已经取得的许可证件,并处罚款, 5 年内不 受理相关责任人及企业提出的医疗器械许可申请。 8、医疗器械经营许可证有效期为_______年。有效期届满需要延续的,依照有关行政许可的法律规 定办理延续手续。 9、从事医疗器械经营活动,应当有与经营规模和经营范围相适应的________和________,以及与 经营的医疗器械相适应的质量管理制度和质量管理机构或者人员。 10、国家对医疗器械按照风险程度实行。 二、判断题(每题 2 分, 2 分× 15,共 30 分) 1、第一类医疗器械产品备案,不需要进行临床试验() 2、任何单位以及个人不得伪造、变造、买卖、出租、出借《医疗器械经营许可证》和医疗器械经 营备案凭证() 3、经营第一类医疗器械和第二类医疗器械都需要许可和备案() 4、从事第三类医疗器械经营的,经营企业应当向省级食品药品监督管理部门提出申请许可证 () 5、医疗器械应当使用通用名称。通用名称应当符合国务院食品药品监督管理部门制定的医疗器械 命名规则() 6、委托生产医疗器械,由委托方对所委托生产的医疗器械质量负责() 7、进口医疗器械没有中文说明书、中文标签或者说明书、标签不符合本条规定的,不得进口。()
西安康乃大药房有限公司 医疗器械经营质量管理制度目录 1. 质量管理机构(质量管理人员)职责K N -001 2. 质量管理规定K N - 002 3. 采购、收货、验收管理制度K N -003 4. 首营企业和首营品种质量审核制度KN -004 5. 仓库贮存、养护、出入库管理制度KN-005 6. 销售和售后服务管理制度KN -006 7. 不合格医疗器械管理制度K N -007 8. 医疗器械退、换货管理制度KN -008 9.医疗器械不良事件监测和报告管理制度KN -009 10.医疗器械召回管理制度KN-010 11.设施设备维护及验证和校准管理制度KN-011 12.卫生和人员健康状况管理制度KN-012 13.质量管理培训及考核管理制度KN-013 14.医疗器械质量投诉、事故调查和处理报告管理制度KN -014 15.购货者资格审查管理制度KN-015 16.医疗器械追踪溯管理制度KN-016 17.质量管理制度执行情况考核管理制度KN-017 18.质量管理自查制度KN-018 19.医疗器械进货查验记录制度KN-019 20.医疗器械销售记录制度KN -020
西安康乃大药房有限公司 医疗器械经营质量工作程序目录 1. 质量管理文件管理程序 2. 质量管理记录工作程序 3. 医疗器械购进管理工作程序 4. 医疗器械验收管理工作程序 5. 医疗器械贮存及养护工作程序 6. 医疗器械出入库管理工作程序 7. 医疗器械运输管理工作程序 8. 医疗器械销售管理程序 9. 医疗器械售后服务管理程序 10. 不合格品管理工作程序 11. 购进退出及销后退回管理程序
质量管理制度目录 一、各部门、各类人员得岗位职责 二、员工法规及质量管理培训考核制度 三、供货企业得资质品种审核管理制度 四、进货验收制度 五、仓库保管制度 六、出库复核制度 七、效期产品管理制度 八、不合格产品得确认与处理制度 九、质量跟踪制度 十、不良事件报告制度 十一、质量事故与投诉处理得管理制度 十二、产品售后服务得管理制度 十三、有关记录与凭证得管理制度 各部门、各类人员得岗位职责 一、经理职责 1、组织本经销部所有员工认真学习与执行有关《医疗器械监督管理条例》、《医疗器械经营企业许可证管理办法》,在“质量第一”得思想指导下进行经营管理。
2、组织有关岗位人员建立规章制度与完善质量体系,定期召开质量管理工作会议,研究、解决质量工作方面得问题,对本经销部所经营医疗器械质量负全面责任. 3、指导与监督员工严格按《医疗器械监督管理条例》来规范医疗器械经营行为. 4、组织有关人员定期对医疗器械进行检查,做到经营医疗器械帐物相符,严禁变质及过期失效、淘汰医疗器械出售现象发生. 5、检查各级质量责任制度得执行情况,表彰先进,处罚造成质量事故得有关人员。 6、负责组织制定与修订各项质量管理制度。 7、负责质量指导、质量计划得实施,对质量体系得工作质量负责。 8、主持质量问题得调查、分析与处理、落实质量奖惩工作.
二、质量管理负责人职责 1、负责贯彻执行国家有关医疗器械质量管理得法律、法规与行政规章。包括:①组织学习国家有关医疗器械质量管理得法律、法规与行政规章。②宣传、贯彻、执行国家有关医疗器械质量管理得法律、法规与行政规章.③指导企业在医疗器械得购进、验收、储存与养护中严格按有关法律、法规办事。 2、负责起草、编制企业医疗器械质量管理制度,并指导、督促制度得执行. 3、负责首营企业得质量审核。包括参与现场考察首营企业. 4、负责首营品种得质量审核。包括参与现场考察首营品种。 5、负责建立企业所经营品种包含质量标准等内容得质量档案。6、负责医疗器械质量得查询与医疗器械质量事故或质量投诉得调查、处理及报告。 7、负责医疗器械得验收管理。 8、负责指导与监督医疗器械保管、养护与运输中得质量工作。9、负责质量不合格医疗器械得审核,对不合格医疗器械得处理过程实施监督。包括对不合格医疗器械得确认、处理、报损与监督销毁。 10、负责收集与分析医疗器械质量信息。包括企业得外部信息与
申请人提交材料目录: 资料编号1、《医疗器械生产企业许可证(开办)申请表》3份; 资料编号2、法定代表人、企业负责人的身份证明,学历证明或职称证明,任命文件的复印件和工作简历1份; 资料编号3、工商行政管理部门出具的《企业名称预先核准通知书》或《工商营业执照》副本原件和1份复印件; 资料编号4、生产场地证明文件,包括房产证明或租赁协议和出租方的房产证明的复印件1份;厂区总平面图,主要生产车间布置图 1 份,有洁净要求的车间,须标明功能间及人物流走向;《第二类、第三类医疗器械生产企业跨省设立生产场地登记表》4份(拟跨省设立生产场地的企业适用); 资料编号5、企业的生产、技术、质量部门负责人的简历、学历证明或职称证明的复印件1份;相关专业技术人员、技术工人登记表 1 份;相关人员登记一览表1份(在网上下载),并标明所在部门及岗位;高、中、初级技术人员的比例情况表1份;符合质量管理体系要求的内审员证书复印件 1 份; 资料编号6、拟生产产品范围、品种和相关产品简介各1份(产品简介至少包括对产品的结构组成、原理、预期用途的说明和产品标准);拟生产体外诊断试剂的,还需提供拟生产体外诊断试剂企业情况一览表1份,见附表1; 资料编号7、主要生产设备及检验仪器清单1份; 资料编号8、生产质量管理规范文件目录1份,包括采购、验收、生产过程、产品检验、入库、出库、质量跟踪、用户反馈、不良事件监测和质量事故报告制度等文件; 资料编号9、拟生产产品的工艺流程图1份,并注明主要控制项目和控制点,包括关键和特殊工序的设备、人员及工艺参数控制的说明; 资料编号10、生产过程有净化要求的应提供省级食品药品监督管理部门认可的检测机构出具的一年内环境检测报告复印件(包括:生产区净化车间检测报告一份、万级净化菌检室检测报告一份)。 如拟生产无菌医疗器械的环境,应达到YY0033《无菌医疗器具生产管理规范》要求; 如拟生产体外诊断试剂的环境,应达到《体外诊断试剂生产实施细则(试行)》附录A要求。 资料编号11、申请材料真实性的自我保证声明1份,包括申请材料目录和企业对材料作出如有虚假承担法律责任的承诺; 资料编号12、凡申请企业申报材料时,办理人员不是法定代表人或负责人本人,企业应当提交《授权委托书》1份。 资料编号13、如实填写的开办医疗器械生产企业自查确认书1份,申请检查确认书1份。 对申请材料的要求: 1、申请材料应完整、清晰、签字并逐份加盖企业公章,如无公章,则须有法定代表人签字或签章。使用A4 纸双面打印或复印,按照申请材料目录顺序装订成册;
综述 一、概述 1. 管理类别及分类编码 按照医疗器械分类目录(2002-08-28)本产品属于分类编号6854“手术室、急救室、诊疗室设备及器具”中“手术及急救装置”,以及按《医疗器械分类规则》(国家食品药品监督管理总局令第15号)及附件(2015-07-14)本产品属于“接触人体器械”中“无源医疗器械”中的“其它无源器械”,使用状态为“暂时使用”中的“创伤”接触,管理类别为Ⅱ类的动脉压迫止血器。 2. 名称确定 鉴于本产品的预期用途及适用范围,根据《医疗器械通用名称命名规则》,将本产品命名为桡动脉压迫止血器,其中止血器为核心词,桡动脉和压迫均为特征词。同时,本命名符合《医疗器械通用名称命名规则》的其他相关要求, 二、产品描述 本产品由XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX组成。无菌包装,灭菌方式XXXXXX灭菌。 1.工作原理:XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX。 结构组成:XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX。 2.主要原材料:XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX; 3.区别于其他同类产品的特征: XXXXXXXXXXXXXXXXXXXXXXXXXX。 4.相应图示说明: 见图 三、型号规格 桡动脉压迫止血器有XX和XX两种规格。 型号1:XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX。 型号2:XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX。 型号1与型号2两种型号XXXXX不同,在结构组成及性能指标等方面均无区别。
******药业有限公司 医 疗 器 械 经 营 质 量 管 理 制 度
目录 1、医疗器械质量管理人员的职责; 2、医疗器械质量管理的规定; 3、医疗器械采购、收货、验收的规定; 4、医疗器械供货者资格审核的规定; 5、医疗器械贮存、养护的规定; 6、医疗器械销售和售后服务的规定; 7、不合格医疗器械管理的规定; 8、医疗器械退、换货的规定; 9、医疗器械不良事件监测和报告规定; 10、医疗器械召回规定; 11、设施设备维护及验证和校准的规定; 12、卫生和人员健康状况的规定; 13、质量管理培训及考核的规定; 14、医疗器械质量投诉、事故调查和处理报告的规定; 15、质量管理制度执行情况考核的规定。
医疗器械质量管理人员的职责 本店医疗器械质量管理负责人为罗通海,负责医疗器械质量管理相关的所有工作。质量管理负责人职责是: 一、认真贯彻学习和遵守国家关于医疗器械质量管理政策、法律及有关规定。 二、依据企业质量方针目标,制定并定期修改本店的质量管理制度,并领导、组织、实施。 三、负责处理质量查询。对顾客反映的质量问题,应填写质量查询登记表,及时查出原因,迅速予以答复解决。 四、负责质量信息管理工作。经常收集各种医疗器械信息和有关医疗器械质量的公告,组织传递反馈。 五、负责不合格产品报损前的审核及报废产品处理的监督工作。 六、收集、保管好本店的质量文件、档案资料,督促各岗位做好各种台帐、记录,保证本店各项质量活动记录的完整性、准确性和可追溯性。 七、及时上报本店发生的质量事故,及时填报医疗器械不良反应和其它各类信息报表。 八、负责经营过程中产品质量管理工作,指导、督促产品质量管理制度的执行,培训并指导验收员、养护员和保管员执行质量管理制度和各项管理规定。 九、负责质量管理制度在本店的贯彻、执行,定期检查制度执行情况,对存在的问题提出改进措施。
1、格式要求:(1)申请材料的同一项目的填写应一致;(2)申请材料应使用A4规格纸张打印;(3)申请材料应清晰、整洁,每份申请材料均应装订并加盖企业公章,并按照申请材料目录的顺序装订成册;(4)在每项文件的第一页作一标签,或用带标签的隔页纸分隔,并标明项目编号;(5)用档案袋将报送的材料装好,档案袋需使用封面(格式见“档案袋封面格式.doc”),在袋面标明生产企业名称、地址、产品名称、联系人及电话,并加注申请材料审核的医疗器械注册申请事务人员姓名(需亲笔签名),联系方式,如是医疗器械注册专员请提供姓名(需亲笔签名)、联系方式及备案凭证号。 2、医疗器械注册申请表、产品标准一式两份,其他资料各一份。(附件1~附件5另附,无需与整套申请材料一起装订) 3、各项(上市批件、标准、检测报告、说明书)申报资料中的产品名称应与申请表中填写的产品名称实质性内容相对应。若有商品名,应标注商品名。申报资料应当使用中文,根据外文资料翻译的申报资料,应当同时提供原文。 4、申报资料受理后,企业不得自行补充申请,但属于《医疗器械注册管理办法》第三十八条规定情形的,可以补充申请。 5、生产企业在提交注册申报资料时,应同时提交医疗器械注册申请表、产品注册标准及备案说明书、标签和包装标识的电子文本(Word格式,具体要求见《关于调整医疗器械说明书备案内容的通知》(食药监办[2008]125号),其内容须与纸质文件的内容相一致。电子文本可通过移动存储设备(U盘或光盘)形式提交。 6、办理医疗器械注册申请事务的人员应当受生产企业委托,应提交生产企业负责人身份证明原件与复印件(生产企业负责人办理时);或者生产企业出具的本企业注册申请事务办理人员的授权书及该办 理人身份证明原件与复印件(非生产企业负责人办理时),身份证明原件经核对后退回。 7、如某项申请材料符合国家食品药品监督管理局《医疗器械注册管理办法》中相关豁免条款的规定,或符合国家局其他相关文件规定的,应提交相应的说明文件。 8、本指南已明确要求提交原件的,不得提交复印件。凡申请材料需提交复印件的,申请人(单位)须在复印件上注明“此复印件与原件相符”字样或者文字说明,注明日期,加盖单位公章。注1:企业应自行保存1份注册申报资料复印件以便注册核查用。(若注册申请未获批准,整套注册申报资料不予退还,申请人可凭复印件申请换回原件。) (二)申报资料的具体要求: 1、医疗器械注册申请表(1)应有法定代表人签字并加盖公章,所填写项目应齐全、准确; (2)“生产企业名称”、“注册地址”与《工商营业执照》相同; (3)“产品名称”、“规格型号”与所提交的产品标准、检测报告等申请材料中所用名称、规格型号一致。