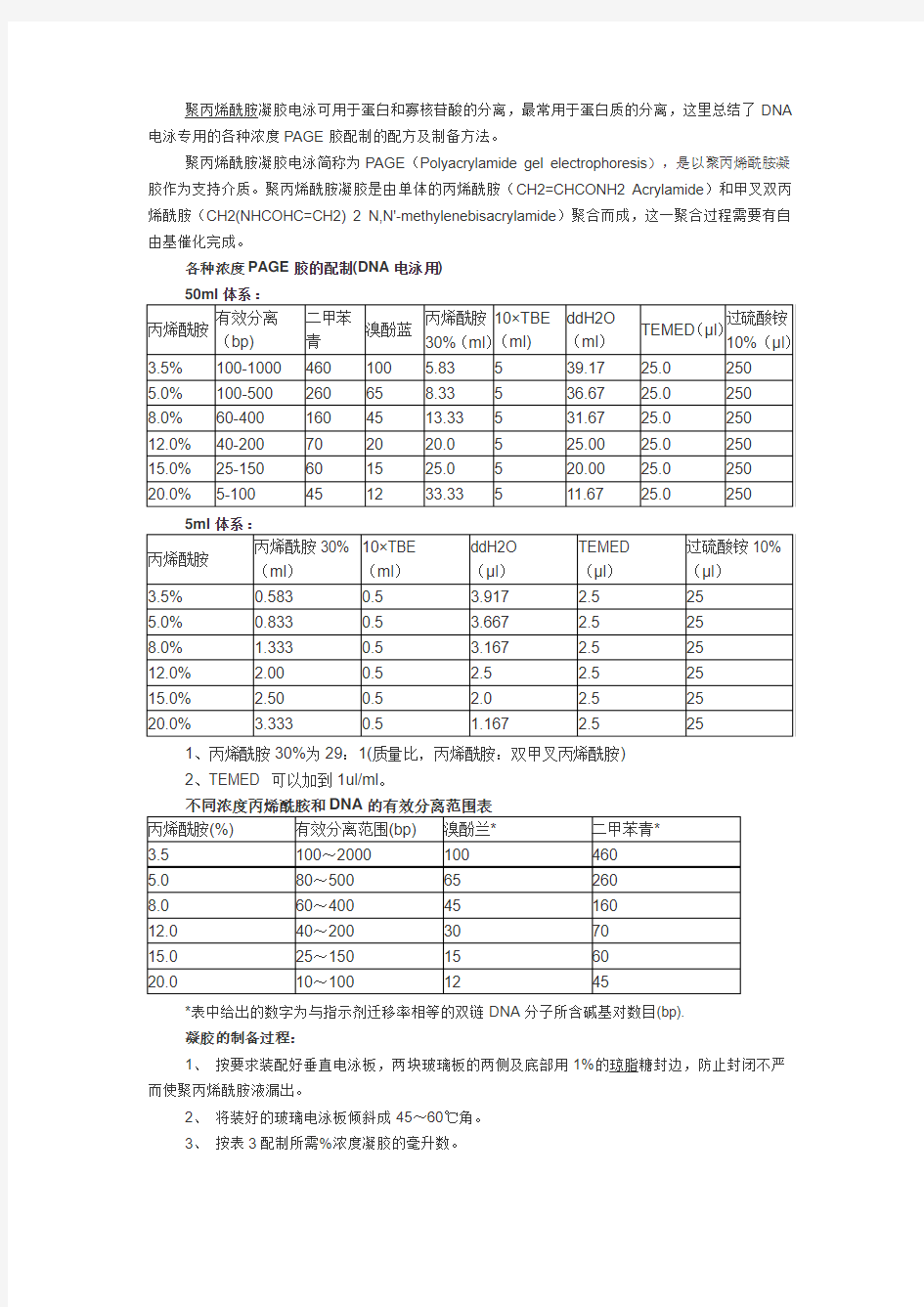

聚丙烯酰胺凝胶电泳可用于蛋白和寡核苷酸的分离,最常用于蛋白质的分离,这里总结了DNA 电泳专用的各种浓度PAGE胶配制的配方及制备方法。
聚丙烯酰胺凝胶电泳简称为PAGE(Polyacrylamide gel electrophoresis),是以聚丙烯酰胺凝胶作为支持介质。聚丙烯酰胺凝胶是由单体的丙烯酰胺(CH2=CHCONH2 Acrylamide)和甲叉双丙烯酰胺(CH2(NHCOHC=CH2) 2 N,N'-methylenebisacrylamide)聚合而成,这一聚合过程需要有自由基催化完成。
各种浓度PAGE胶的配制(DNA电泳用)
1、丙烯酰胺30%为29:1(质量比,丙烯酰胺:双甲叉丙烯酰胺)
2、TEMED 可以加到1ul/ml。
*表中给出的数字为与指示剂迁移率相等的双链DNA分子所含碱基对数目(bp).
凝胶的制备过程:
1、按要求装配好垂直电泳板,两块玻璃板的两侧及底部用1%的琼脂糖封边,防止封闭不严而使聚丙烯酰胺液漏出。
2、将装好的玻璃电泳板倾斜成45~60℃角。
3、按表3配制所需%浓度凝胶的毫升数。
4、加入TEMED后,立即混匀,缓缓倒入两玻璃板间的胶床中,直到液体接近溢出时为止。
5、立即插入适当的梳子,密切注意防止梳齿下产生气泡,用一有力的夹将梳子夹在一边的玻璃板上,然后将玻璃板斜靠在物体上,使成10°角,可减少液体泄漏的机会。
6、室温聚合一小时后,将玻璃板插入电泳槽中,上紧,倒入0.1XTBE缓冲液。
7、小心取出梳子,加样。
大家可以根据自己试验中DNA片段大小的不同选择配制合适浓度的丙烯酰胺胶。PAGE 胶配制过程中记得避免气泡的产生。
SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)实 验原理和操作步骤 实验原理: SDS-PAGE是对蛋白质进行量化,比较及特性鉴定的一种经济、快速、而且可重复的方法。该法是依据混合蛋白的分子量不同来进行分离的。 SDS是一种去垢剂,可与蛋白质的疏水部分相结合,破坏其折叠结构,并使其广泛存在于一个广泛均一的溶液中。SDS蛋白质复合物的长度与其分子量成正比。在样品介质和凝胶中加入强还原剂和去污剂后,电荷因素可被忽略。蛋白亚基的迁移率取决于亚基分子量。 试剂和器材: 试剂:1. 5x样品缓冲液(10ml):0.6ml 1mol/L的Tris-HCl(pH6.8),5ml 50%甘油,2ml 10%的SDS,0.5ml巯基乙醇,1ml 1%溴酚蓝,0.9ml蒸馏水。可在4℃保存数周,或在-20℃保存数月。 2. 凝胶贮液:在通风橱中,称取丙烯酰胺30g,甲叉双丙烯酰胺0.8g,加重蒸水溶解后,定容到100ml。过滤后置棕色瓶中,4℃保存,一般可放置1个月。 3. pH8.9分离胶缓冲液:Tris 36.3g ,加1mol/L HCl 48ml,
加重蒸水80ml使其溶解,调pH8.9,定容至100ml,4℃保存。 4. pH6.7浓缩胶缓冲液:Tris 5.98g ,加1mol/L HCl 48ml,加重蒸水80ml使其溶解,调pH 6.7,定容至100ml,4℃保存。 5. TEMED(四乙基乙二胺)原液 6.10%过硫酸铵(用重蒸水新鲜配制) 7. pH8.3 Tris-甘氨酸电极缓冲液:称取Tris 6.0g,甘氨酸28.8g,加蒸馏水约900ml,调pH8.3后,用蒸馏水定容至1000ml。置4℃保存,临用前稀释10倍。 8. 考马斯亮蓝G250染色液:称100mg考马斯亮蓝G250,溶于200ml蒸馏水中,慢慢加入7.5ml 70%的过氯酸,最后补足水到250ml,搅拌1小时,小孔滤纸过滤。 器材:电泳仪,电泳槽,水浴锅,摇床。 实验操作
垂直板聚丙烯酰胺凝胶电泳分离蛋白质 一、实验目的 学习SDS-聚丙烯酰胺凝胶电泳法(SDS—PAGE)测定蛋白质的分子量的原理和基本操作技术。 二、实验原理 蛋白质是两性电解质,在一定的pH条件下解离而带电荷。当溶液的pH大于蛋白质的等电点(pI)时,蛋白质本身带负电,在电场中将向正极移动;当溶液的pH小于蛋白质的等电点时,蛋白质带正电,在电场中将向负极移动;蛋白质在特定电场中移动的速度取决于其本身所带的净电荷的多少、蛋白质颗粒的大小和分子形状、电场强度等。 聚丙烯酰胺凝胶是由一定量的丙烯酰胺和双丙烯酰胺聚合而成的三维网状孔结构。本实验采用不连续凝胶系统,调整双丙烯酰胺用量的多少,可制成不同孔径的两层凝胶;这样,当含有不同分子量的蛋白质溶液通过这两层凝胶时,受阻滞的程度不同而表现出不同的迁移率。由于上层胶的孔径较大,不同大小的蛋白质分子在通过大孔胶时,受到的阻滞基本相同,因此以相同的速率移动;当进入小孔胶时,分子量大的蛋白质移动速度减慢,因而在两层凝胶的界面处,样品被压缩成很窄的区带。这就是常说的浓缩效应和分子筛效应。同时,在制备上层胶(浓缩胶)和下层胶(分离胶)时,采用两种缓冲体系;上层胶pH=6.7—6.8,下层胶pH=8.9;Tris —HCI缓冲液中的Tris用于维持溶液的电中性及pH,是缓冲配对离子;CI-是前导离子。在pH6.8时,缓冲液中的Gly-为尾随离子,而在pH=8.9时,Gly的解离度增加;这样浓缩胶和分离胶之间pH的不连续性,控制了慢离子的解离度,进而达到控制其有效迁移率之目的。不同蛋白质具有不同的等电点,在进入分离胶后,各种蛋白质由于所带的静电荷不同,而有不同的迁移率。由于在聚丙烯酰胺凝胶电泳中存在的浓缩效应,分子筛效应及电荷效应,使不同的蛋白质在同一电场中达到有效的分离。 如果在聚丙烯酰胺凝胶中加入一定浓度的十二烷基硫酸钠(SDS),由于SDS带有大量的负电荷,且这种阴离子表面活性剂能使蛋白质变性,特别是在强还原剂如巯基乙醇存在下,蛋白质分子内的二硫键被还原,肽链完全伸展,使蛋白质分子与SDS充分结合,形成带负电性的蛋白质—SDS复合物;此时,蛋白质分子上所带的负电荷量远远超过蛋白质分子原有的电荷量,掩盖了不同蛋白质间所带电荷上的差异。蛋白质分子量愈小,在电场中移动得愈快;反之,愈慢。蛋白质的分子量与电泳迁移率之间的关系是: M r =K(10-b·m) logM r =LogK—b·R m , 式中M r ——蛋白质的分子量; logK——截距; b——斜率; R m ——相对迁移率。 实验证明,蛋白质分子量在15,000—200,000的范围内,电泳迁移率与分子量
蛋白质亚基分子量测定SDS-PAGE凝胶电泳 一目的 掌握SDS-PAGE凝胶电泳测定蛋白质亚基分子量的基本原理和操作方法 二原理 SDS是一种阴离子去污剂,作为变性剂和助溶性试剂,能断裂分子内和分子间的氢键,使分子去折叠,破坏蛋白质分子的二级、三级结构;而强还原剂,如二硫苏糖醇、β-巯基乙醇能使半胱氨酸残基之间的二硫键断裂。 因此,在样品和凝胶中加入SDS和还原剂后,蛋白质分子被解聚为组成它们的多肽链,解聚后的氨基酸侧链与SDS结合后,形成带负电的蛋白质-SDS胶束,所带电荷远远超过了蛋白质原有的电荷量,消除了不同分子间的电荷差异;同时,蛋白质-SDS聚合体的形状也基本相同,这就消除了在电泳过程中分子形状对迁移率的影响。 基于上述SDS-PAGE的原理介绍,我们可以利用SDS-PAGE电泳进行未知蛋白质的分子量测定;以不同分子量的标准蛋白进行SDS-PAGE电泳得到不同标准蛋白的电泳迁移率,制作标准校正曲线,然后对未知蛋白在相同条件下进行SDS-PAGE电泳,测定迁移率,从标准曲线得到相应的分子量 三试剂和器材 试剂:1低分子量标准蛋白质 2 待测蛋白质样品(用上次测定的可溶性蛋白样液) 3 凝胶贮液:30g丙烯酰胺,0.8g甲叉双丙烯酰胺,溶于100ml蒸馏水中,过滤,于4°暗处贮存,一个月内使用 4 1mol/l,PH8.8 Tris-HCl 缓冲液,Tris121g溶于蒸馏水,用浓盐酸调至PH8.8,以蒸馏水定容至1000ml 5 10%(w/v)SDS 6 10%(w/v)过硫酸铵溶液(当天配) 7 四甲基乙二胺(TEMED) 8 电极缓冲液PH8.3:Tris30.3g,甘氨酸144.2g,SDS 10g,溶于蒸馏水并定容至1000ml,使用时稀释10倍。 9 2×样品稀释液:SDS 500mg,巯基乙醇1ml ,甘油3ml, 溴酚蓝4mg,1mol/L Tris-HCL (pH6.8),用蒸馏水溶解并定容至10ml,按每份1ml分装,可在4℃存放数周,或在-20℃保存数月。以此液制备样品时,样品若为液体,则加入与阳平等体积的原液混合即可。 10 固定液:500ml 乙醇,100ml冰醋酸,用蒸馏水定容至1000ml 11 脱色液:250ml乙醇,80ml冰醋酸,用蒸馏水定容至1000ml 12 染色液:0.29g考马斯亮蓝R-250溶解在250ml脱色液中 器材:微量进样针,电泳仪,电泳槽 四操作步骤 1分离胶制备: 凝胶浓度5% 7.5% 10% 12.5% 15% 凝胶贮液ml 5 7.5 10 12.5 15 1mol/LPH8.8 Tris-HClml 11.2 11.2 11.2 11.2 11.2 水ml 13.7 11.2 1.2 8.7 3.7 10% SDS ml 0.3 10% 过硫酸铵ml 0.1 TEMED (μL) 20 将上述胶液配好,混匀后,迅速加入两块玻璃板间隙中,使胶液面与矮玻璃和高玻璃之间形
SDS-PAGE 一. 实验原理 SDS 是一种阴离子表面活性剂,在蛋白质溶液里加入 SDS 和巯基乙醇后,巯基乙醇能使蛋白质分子中的二硫键还原, SDS 能使蛋白质的氢键、疏水键打开并结合到蛋白质分子上,形成蛋白质-SDS 复合物。在一定条件下,SDS 与大多数蛋白质的结合比例为 1.4:1。由于十二烷基磺酸根带负电,使各种蛋白质的SDS-复合物都带上相同密度的负电荷,它的量大大超过了蛋白质原有的电荷量,因而掩盖了不同种类蛋白质间原有的电荷差别。SDS与蛋白质结合后,还引起了蛋白质构象的改变。蛋白质-SDS复合物的流体力学和光学性质表明,它们在水溶液中的形状,近似于雪茄烟形的长椭圆棒,不同蛋白质的 SDS 复合物的短轴长度都一样,约为 1.8nm ,而长轴则随蛋白质的 Mr 成正比的变化。基于上述原因,蛋白质-SDS 复合物在凝胶电泳中的迁移率,不再受蛋白质原有电荷和形状的影响,而只与椭圆棒的长度有关,也就是蛋白质 Mr 的函数。 二. 试剂器材 30%凝胶贮液(100mL):称取试剂Acr 29.2g和Bis 0.8g置于100mL烧杯中,向烧杯中加入约60mL双蒸水,充分搅拌溶解后加双蒸水定容至100mL,置于棕色瓶内4℃贮存,每过1-2个月应重新配制; 注意:丙稀酰胺具有很强的神经毒性,并可通过皮肤吸收,其作用有积累性,配制时应戴手套和口罩等。 分离胶缓冲液(1.5 mol/L Tris-HCl,pH 8.8,100mL):称取Tris 18.2g 溶于约80mL 双蒸水,用6mol/L的HCl 调整pH值至8.8,加双蒸水定容到100mL,4℃ 贮存;堆积胶缓冲液(0.5 M Tris-HCl,pH 6.8,100mL):称取Tris 6.0g溶于约80mL双蒸水,用1mol/L的HCl 调整pH值至6.8,加双蒸水定容到100mL,4℃ 贮存;
SDS- 聚丙烯酰胺凝胶电泳(SDS-PAGE) 实验 原理和操作步骤 实验原理: SDS-PAGE 是对蛋白质进行量化,比较及特性鉴定的一种经济、 快速、而且可重复的方法。该法是依据混合蛋白的分子量不同来 进行分离的。 SDS 是一种去垢剂,可与蛋白质的疏水部分相结合,破坏其折 叠结构,并使其广泛存在于一个广泛均一的溶液中。 SDS 蛋白质复 合物的长度与其分子量成正比。在样品介质和凝胶中加入强还原剂 和去污剂后,电荷因素可被忽略。蛋白亚基的迁移率取决于亚基分 子量。 试剂和器材: 试剂: 1. 5x样品缓冲液(10ml):0.6ml1mol/L的Tris-HCl(pH6.8),5ml 50%甘油,2ml 10%的SDS,0.5ml巯基 乙醇, 1ml 1% 溴酚蓝, 0.9ml 蒸馏水。可在 4℃保存数周,或在 -20 ℃保存数月。 2.凝胶贮液:在通风橱中,称取丙烯酰胺 30g ,甲叉双丙烯酰胺 0.8g ,加重蒸水溶解后,定容到 100ml 。过滤后置棕色瓶中, 4℃ 保存,一般可放置 1个月。 3. pH8.9 分离胶缓冲液:Tris 36.3g,加1mol/L HCl 48ml,
加重蒸水 80ml 使其溶解,调 pH8.9 ,定容至 100ml , 4℃保存。 4. pH6.7 浓缩胶缓冲液: Tris 5.98g ,加 1mol/L HCl 48ml ,加重蒸水 80ml 使其溶解,调 pH 6.7 ,定容至 100ml , 4℃保存。 5.TEMED (四乙基乙二胺)原液 6.10% 过硫酸铵(用重蒸水新鲜配制) 7.pH8.3 Tris- 甘氨酸电极缓冲液:称取 Tris 6.0g ,甘氨酸 28.8g , 加蒸馏水约 900ml ,调 pH8.3 后,用蒸馏水定容至 1000ml 。置4℃保存,临用前稀释 10 倍。 8.考马斯亮蓝G250 染色液:称100mg 考马斯亮蓝G250 ,溶于200ml 蒸馏水中,慢慢加入7.5ml 70% 的过氯酸,最后补足水到250ml ,搅拌 1小时,小孔滤纸过滤。 器材:电泳仪,电泳槽,水浴锅,摇床。 实验操作
蛋白电泳手册 SDS-PAGE及Westernblot 蛋白电泳 蛋白质的电泳分离是重要的生物化学分离纯化技术之一,电泳是指带电粒子在电场作用下,向着与其电荷相反的电极移动的现象.根据所采用的支持物不同,有琼脂糖凝胶电泳,淀粉凝胶电泳,聚丙烯酰胺凝胶电泳等。其中,聚丙烯酰胺凝胶电泳(PAGE)由于无电渗作用,样品用量少(1-100μg),分辨率高,凝胶机械强度大,重复性好以及可以通过调节单体浓度或单体与交联剂的比例而得到孔径不同的凝胶等优点而受到广泛的应用。 PAGE原理 聚丙烯酰胺凝胶是由丙烯酰胺(简称Acr)和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。聚丙烯酰胺凝胶电泳(PAGE)可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带。 SDS-PAGE原理 SDS是一种阴离子表面活性剂,能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。因此,各种蛋白质-SDS复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。实验使用过程中,还加入DTT或者***,以打开蛋白间的二硫键,破坏蛋白质的四级结构。SDS—PAGE最常采用垂直板不连续系统(分离胶与浓缩胶)。
索引 蛋白电泳(SDS-PAGE)…………………… 电泳试剂总表……………………………………………………制胶……………………………… 上样及电泳…………………… 染色 蛋白提取 蛋白定量 Bradford蛋白浓度测定试剂盒使用说明 BCA蛋白浓度测定试剂盒使用说明 Lowry蛋白浓度测定试剂盒使用说明 蛋白分子量标准(图) 考马斯蛋白胶快速染色液 Westernblot WesternblottingDAB检测试剂盒 WesternblottingECL化学发光检测试剂盒
1 SDS-PAGE凝胶电泳操作 2 一、常规试剂的配制 3 1. 30% 聚丙烯酰胺贮液:丙烯酰胺 150g,甲叉双丙烯酰胺4g,双蒸水4 500ml,滤纸过滤后,棕色瓶避光4℃保存; 2. 1.5mol/L,pH 8.8 Tris-HCl分离胶缓冲液:18.15g Tris,用1mol/L HCl 5 6 定容至100ml,棕色瓶避光4℃保存; 7 3. 1.0mol/L,pH 6.8 Tris-HCl分离胶缓冲液:12g Tris,用1mol/L 调 pH至100ml,棕色瓶避光4℃保存; 8 9 4. 10% SDS溶液:10g SDS加水定容至100ml,完全溶解室温保存; 10 5. 10% AP溶液:0.1g AP(过硫酸铵)加水定容至1ml,用前新鲜配制; 11 6. 1×SDS-PAGE电泳缓冲液:25mM Tris(3.0285g/L),192mM甘氨酸12 (14.41g/L),0.1%SDS(1g/L),pH 8.30; 13 7. 染色液:0.25g 考马斯亮蓝R-250溶解于45ml甲醇,45ml水,10ml冰 醋酸,过滤除去杂质; 14 15 8. 脱色液:45ml甲醇,45ml水,10ml冰醋酸; 16 9. 固定液:50ml甲醇,40ml水,10ml冰醋酸; 10. 2×SDS-PAGE上样缓冲液:10% SDS 0.4ml,0.375M Tris-HCl(pH 6.8) 17 18 0.333ml,甘油0.2ml,1% 溴酚兰10μL,β-疏基乙醇100μL,加水定容至1ml,19 分装后-20℃保存。 20 二、样品的处理 21 1. 蛋白含量较低的酶制剂或原料样品 22 (1)粉剂(或颗粒)样品 23 称取样品1g,加入3-5ml蒸馏水进行搅拌溶解1h(搅拌时间可根据实际情24 况进行增减),4000rpm离心10min,取离心上清液等体积加入20%的三氯乙酸聚25 沉30min,离心,弃去离心上清液,用70%的丙酮溶液洗涤沉淀,4000rpm离心
SDS-PAGE电泳试剂 1) 30%储备胶溶液:丙烯酰胺(Acr)29.0g,亚甲基双丙烯酰(Bis)1.0g,混匀后加ddH2O,37O C溶解,定容至100 mL,棕色瓶存于4O C; 2) 1.5M Tris-HCl(pH :Tris 18.17g加ddH2O溶解,浓盐酸调pH至,定容至100mL; 3) 1M Tris-HCl(pH :Tris 12.11g加ddH2O溶解,浓盐酸调pH至,定容至100 mL; 4) 4′分离胶缓冲液:溶于1.5M Tris-HCl(pH ,定容至100mL; 5) 4′浓缩胶缓冲液:溶于1M Tris-HCl(pH ,定容至100mL; 6) 10′电泳缓冲液(pH :Tris 3.029g,甘氨酸14.415g,SDS 1g加ddH2O溶解,定容至100mL; 7) 10%过硫酸铵(Aps,现配):1g AP加ddH2O至10mL; 8) 2′SDS电泳上样缓冲液:1M Tris-HCl(pH ,b-巯基乙醇,SDS 0.6g,甘油 mL,%溴酚兰 mL,ddH2O ; 9) 考马斯亮兰染色液:考马斯亮兰R2501.25g,甲醇225 mL,冰醋酸50 mL,ddH2O 225mL; 10) 脱色液: 甲醇、冰醋酸、ddH2O以2∶1∶7配制而成; 11) 分离胶%): ddH2O 4mL,30%储备胶5 mL, 4′分离胶缓冲液3mL, 10% Aps (现配),TEMED(N,N,N’,N’-四甲基乙二胺)10μL; 12) 浓缩胶(5%):ddH2O ,30%储备胶,4′浓缩胶缓冲液, 10%Aps 50μL,TEMED 5μL。 Tricine(三羟甲基氨基甘氨酸)- SDS - PAGE蛋白质电泳
SDS-聚丙烯酰胺凝胶电泳 该技术首先在1967年由Shapiro建立,1969年由Weber和Osborn进一步完善。 一、原理 聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。本实验采用垂直板状不连续系统。所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。 1.样品的浓缩效应 在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,、浓缩胶缓冲液(Tris—HCl,、分离胶缓冲液(Tris—HCl,,两种凝胶的浓度(即孔径)也不相同。在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=,pK a=只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。这些离子在电泳时都向正极移动。C1—速度最快(先导离子),其次为蛋白质,Gly 负离子最慢(尾随离子)。由于C1—很快超过蛋白离子,因此在其后面形成一个电导较低、电位梯度较陡的区域,该区电位梯度最高,这是在电泳过程中形成的电位梯度的不连续性,导致蛋白质和Gly 离子加快移动,结果使蛋白质在进入分
SDS-PAGE凝胶电泳操作 一、常规试剂的配制 1. 30% 聚丙烯酰胺贮液:丙烯酰胺150g,甲叉双丙烯酰胺4g,双蒸水500ml,滤纸过滤后,棕色瓶避光4℃保存; 2. 1.5mol/L,pH 8.8 Tris-HCl分离胶缓冲液:18.15g Tris,用1mol/L HCl定容至100ml,棕色瓶避光4℃保存; 3. 1.0mol/L,pH 6.8 Tris-HCl分离胶缓冲液:12g Tris,用1mol/L 调pH至100ml,棕色瓶避光4℃保存; 4. 10% SDS溶液:10g SDS加水定容至100ml,完全溶解室温保存; 5. 10% AP溶液:0.1g AP(过硫酸铵)加水定容至1ml,用前新鲜配制; 6. 1×SDS-PAGE电泳缓冲液:25mM Tris(3.0285g/L),192mM甘氨酸(14.41g/L),0.1%SDS (1g/L),pH 8.30; 7. 染色液:0.25g 考马斯亮蓝R-250溶解于45ml甲醇,45ml水,10ml冰醋酸,过滤除去杂质; 8. 脱色液:45ml甲醇,45ml水,10ml冰醋酸; 9. 固定液:50ml甲醇,40ml水,10ml冰醋酸; 10. 2×SDS-PAGE上样缓冲液:10% SDS 0.4ml,0.375M Tris-HCl(pH 6.8)0.333ml,甘油 0.2ml,1% 溴酚兰10μL,β-疏基乙醇100μL,加水定容至1ml,分装后-20℃保存。 二、样品的处理 1. 蛋白含量较低的酶制剂或原料样品 (1)粉剂(或颗粒)样品 称取样品1g,加入3-5ml蒸馏水进行搅拌溶解1h(搅拌时间可根据实际情况进行增减),4000rpm离心10min,取离心上清液等体积加入20%的三氯乙酸聚沉30min,离心,弃去离心上清液,用70%的丙酮溶液洗涤沉淀,4000rpm离心10min,重复洗涤3-5次,将丙酮洗涤液吹干,加入适量(1-3ml)PBS溶解沉淀,溶解液即可用于电泳实验。 (2)液体样品 液体样品经离心后,取离心上清液等体积加入20%的三氯乙酸聚沉30min,离心,弃去离心上清液,用70%的丙酮溶液洗涤沉淀,4000rpm离心10min,重复洗涤3-5次,将丙酮洗涤液吹干,加入适量(1-3ml)PBS溶解沉淀,溶解液即可用于电泳实验。 2. 蛋白含量相对较高的酶制剂或原料样品 (1)粉剂(或颗粒)样品
SDS-PAGE蛋白质凝胶电泳 第一部知识准备 一、双向凝胶电泳 蛋白质组分析的先决条件是蛋白质的分离。分离过程一般可以分为2步,首先将蛋白质消化成肽段,通常由蛋白水解酶完成,然后将复杂的混合物分离成简单地形式。这2步没有明确的先后关系,也可先将蛋白质混合体分离成单个的蛋白质或肽段,然后消化分析。双向凝胶电泳是采取的先分离后消化的方法,是目前唯一可以在一块凝胶上同时分离数千乃至数万个蛋白质的方法,是当今蛋白质组学方法的主流。刚刚兴起的非胶系统蛋白质组学是先消化然后直接质谱分析,充分应用生物信息学方法,是蛋白质组学分离方法的一个发展方向。 (一)双向电泳简介 双向电泳技术建立于20世纪70年代,它的基本原理是首先根据蛋白质等电点的不同在pH梯度介质中等电聚焦(isoelectrofocusing,IEF)将其分离,然后按照其分子量大小在垂直或水平方向进行十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-APGE)进行分离。 目前,根据第一向等电聚焦条件和方式的不同,可将双向凝胶电泳分为三种系统:载体两性电解质pH梯度-SDS电泳技术(ISO-DALT)、不平衡的pH梯度凝胶电泳(NEPHGE)、固相pH梯度-SDS电泳技术(IPG-DALT)。在ISO-DALT系统中,等电聚焦在聚丙烯酰胺管胶中进行,载体两性电解质在外加电场作用下形成pH梯度。其主要缺点是在碱性区域不稳定(阴极漂移)、重复性不易掌握和上样量低,并且一般不能分离等电点大于8.0的碱性蛋白质;优点是电泳设备要求不高,电泳溶液容易配制,易于展开工作。各种电泳条件经优化后,可达到非常高的分辨率,也可获得好的重复性,利用这一系统可以分辨10000个蛋白质斑点。NEPHGE为非平衡pH梯度电泳,是IPG胶发明之前用于分离碱性蛋白质的一种方法,蛋白质在等电点等电聚焦场中大道平衡前结束电泳,第一向的pH也是依靠载体两性电解质和电场来建立。在IPG-DALT是现在主要和常用的方法,它的优势表现在:pH梯度稳定、梯度分辨率高;无阴极漂移及碱性蛋白质丢失现象;蛋白质上样量大,可以提高低丰度蛋白质成分的分辨效果;样品中盐的干扰少,无边缘效应;pH梯度和分离效果的重复性好。
SDS-PAGE电泳的基础原理和实验步骤 1.名称: SDS-PAGE(sodium dodecyl sulfate polyacrylamide gel electrophoresis) 十二烷基硫酸钠聚丙烯酰胺凝胶电泳 2.原理: 此项技术的原理,是根据样品中蛋白质分子量大小的不同,使其在电泳胶中分离。 不同的蛋白质在不同的pH值下表现出不同的电荷,同时蛋白质具有不同的大小和形状。为了使蛋白在电泳中的迁移率只与分子量有关,我们在上样前,通常会进行一些处理。 上样缓冲液由Tris-HCl(pH6.8)、甘油,10%SDS、β-巯基乙醇、0.1%溴酚蓝以及蒸馏水组成。其各自的作用如下述: SDS 即十二烷基硫酸钠,是一种阴离子表面活性剂,它可以断开分子内和分子间的氢键,破坏蛋白质分子的二级和三级结构;β-巯基乙醇是强还原剂,它可以断开半胱氨酸残基之间的二硫键。由于SDS和巯基乙醇的作用,蛋白质完全变性和解聚,解离成亚基或者单个肽链,因此测定结果只是亚基或者单个肽链的分子量。同时,SDS与蛋白质结合引起蛋白质的构象改变,形成长椭圆棒状,不同蛋白质短轴长度都一样,长轴随蛋白分子量不同而不同,这样就消除了性状的影响。另外,解聚后的氨基酸侧链和SDS结合成蛋白- SDS胶束,所带的负电荷大大超过了蛋白原有的电荷量,这样就消除了不同分子间的电荷差异和结构差异。 甘油用以增大样品液密度,使加样时样品溶液可以快速沉入样品凹槽底部。
样品处理液中通常还加入溴酚蓝染料,用于监控整个电泳过程。 SDS-PAGE一般采用的是不连续缓冲系统,与连续缓冲系统相比,能够有较高的分辨率。 浓缩胶的作用是有堆积作用,凝胶浓度较小,孔径较大,把较稀的样品加在浓缩胶上,经过大孔径凝胶的迁移作用而被浓缩至一个狭窄的区带。样品液和浓缩胶中Tris-HCl均为pH6.8,上下槽缓冲液含Tris-甘氨酸(pH8.3),分离胶含Tris-HCl(Ph8.8). 电泳启动时,蛋白样品处于pH6.8 的上层,pH8.8 的分离胶层在下层,上槽为负极,下槽为正极。出现了pH 不连续和胶孔径大小不连续:启动时Clˉ解离度大,Proˉ解离度居中,甘aaCOOˉ解离度小,迁移顺序为(pH6.8)Clˉ> Proˉ >—COOˉ。在Clˉ与Proˉ之间和Proˉ与—COOˉ之间都将出现低离子区,同时也出现高电势,高电势迫使Proˉ向C lˉ迁移,—COOˉ向Proˉ迁移。如:一个Clˉ领路,—COOˉ推动,蛋白在中间,这样就起到浓缩的作用了。在浓缩胶运动中,由于胶联度小,孔径大,Proˉ受阻小,因此不同的蛋白质就浓缩到分离胶之上成层,起浓缩效应,使全部蛋白质处于同一起跑线上。当蛋白质进入分离胶时,此时Proˉ,Clˉ,甘aa 离子在pH8.8 的溶液中,Clˉ完全电离而很快到达正极,甘aa 电离度加大很快跃过蛋白质,而到达正极,只有蛋白质分子在分离胶中较为缓慢的移动,并被筛分而依各自的大小分离。 SDS-PAGE的有效分离范围取决于用于灌胶的聚丙烯酰胺的浓度和交联度。甲叉双丙烯酰胺和丙烯酰胺在过硫酸胺的作用下聚合形成胶。过硫酸铵(AP)在隔氧的状态下,最好现配现用,使用新鲜的。TEMED即四甲基乙二胺,为加速催化剂。
一、常规试剂的配制 1.30%聚丙烯酰胺贮液:丙烯酰胺150g ,甲叉双丙烯酰胺4g,双蒸水500ml,滤纸过滤后,棕色瓶避光4 C保存; 2.L,pH Tris-HCI 分离胶缓冲液:Tris,用1mol/L HCl定容至100ml,棕色瓶避光4 C 保存; 3.L, pH Tris-HCl 分离胶缓冲液:12g Tris,用1mol/L 调pH至100ml,棕色瓶避光4 C 保存; 4.10% SDS溶液:10g SDS加水定容至100ml,完全溶解室温保存; 5.10% AP溶液:AP (过硫酸铵)加水定容至1ml,用前新鲜配制; 6.1X SDS-PAGE电泳缓冲液:25mM Tris (L),192mM甘氨酸(L ),%SDS( 1g/L ),pH ; 7.染色液:考马斯亮蓝R-250 溶解于45ml 甲醇,45ml 水,10ml 冰醋酸,过滤除去杂质; 8.脱色液:45ml 甲醇,45ml 水,10ml 冰醋酸; 9.固定液:50ml 甲醇,40ml 水,10ml 冰醋酸; 10.2X SDS-PAGEh样缓冲液:10%SDS,Tris-HCl (pH ),甘油,1% 溴酚兰10 卩L,3 - 疏基乙醇100卩L,加水定容至1ml,分装后-20 C保存。 二、样品的处理 1.蛋白含量较低的酶制剂或原料样品 (1 )粉剂(或颗粒)样品 称取样品1g,加入3-5ml蒸馏水进行搅拌溶解仆(搅拌时间可根据实际情况进行增减),4000rpm离心10min,取离心上清液等体积加入20%的三氯乙酸聚沉30min,离心,弃去离心 上清液,用70%的丙酮溶液洗涤沉淀,4000rpm离心10min,重复洗涤3-5次,将丙酮洗涤 液吹干,加入适量(1-3ml )PBS溶解沉淀,溶解液即可用于电泳实验。 (2)液体样品 液体样品经离心后,取离心上清液等体积加入20%的三氯乙酸聚沉30min,离心,弃去 离心上清液,用70%勺丙酮溶液洗涤沉淀,4000rpm离心10min,重复洗涤3-5次,将丙酮洗涤液吹干,加入适量(1-3ml )PBS溶解沉淀,溶解液即可用于电泳实验。 2.蛋白含量相对较高勺酶制剂或原料样品 (1 )粉剂(或颗粒)样品 称取样品1g,加入3-5ml蒸馏水进行搅拌溶解仆(搅拌时间可根据实际情况进行增减),4000rpm离心10min,取离心上清液用于电泳实验。 (2)液体样品 液体样品经离心后,取离心上清液用于电泳实验。