二氧化碳的溶解性
- 格式:doc
- 大小:41.51 KB
- 文档页数:2

二氧化碳的物理化学性质二氧化碳,化学式为CO2,是一种无色、无味、无臭的气体。
二氧化碳具有许多重要的物理化学性质,包括其基本性质、结构和热力学性质、碳循环和气候变化、二氧化碳的化学性质等。
在这篇文章中,我们将探讨这些性质及其重要性。
一、基本性质1.1 结构二氧化碳分子由一个碳原子和两个氧原子组成,化学式为CO2。
该分子具有线性结构,碳原子与两个氧原子之间的键角为180度,分子具有一个互相作用的极性中心,共轭三重键。
1.2 密度二氧化碳密度视温度和压力而变化。
在常温常压下,它的密度约为1.98克/升(0.072737磅/立方英尺)。
如将二氧化碳压力提高,则其密度会增加。
例如,当压力为5兆帕时,二氧化碳的密度可达到629克/立方米。
1.3 溶解性二氧化碳是一种易溶于水、液态或固态溶液中的气体。
在常温常压下,水中的二氧化碳溶解度为1.45克/升。
当温度升高时,水中的溶解度会降低。
此外,在高压下,二氧化碳也有很强的溶解度,可用于压力容器或饮料容器中。
1.4 凝固点和沸点二氧化碳在常压下是一种无色气体,但它可以在某些温度和压力下变为固态。
在常温下,二氧化碳不会凝固,但当气体压缩到超过5.2大气压及低于-56.6摄氏度时,二氧化碳会凝固,成为固态二氧化碳,通常被称为干冰。
其沸点为-57℃(-70.6℉)。
二、结构和热力学性质2.1 极性二氧化碳的分子没有净电荷,因此它是一种非极性分子。
分子内部的分子键角度非常大,这意味着分子内部相互作用非常小;这又意味着二氧化碳液体或固体的化学性质不同于极性分子,如水。
2.2 热力学性质二氧化碳的热力学性质研究意义重大,因为它是地球大气层最重要的气体之一。
它的热力学性质包括其内能、焓和熵。
在工业和科学方面,了解二氧化碳的热力学性质是至关重要的,因为这些性质可以用于动力学和热力学分析。
2.3 蒸汽压蒸汽压是物质的汽化时所产生的蒸汽分子对外界压强的描述。
二氧化碳在不同温度和压力下的蒸汽压差异较大。

5℃时二氧化碳在水中的溶解度二氧化碳是一种常见的气体,在大气中的含量很高。
当二氧化碳与水接触时,会发生溶解反应,形成碳酸。
溶解度是指在一定温度和压力下,溶质在溶剂中溶解的最大量,通常用单位质量的溶剂中溶质的质量表示。
本文将探讨在5℃时二氧化碳在水中的溶解度。
我们需要了解溶解度与温度的关系。
一般来说,溶解度随着温度的升高而增加。
这是因为温度升高会增加溶质分子的动能,使其与溶剂分子更加活跃,从而更易于溶解。
但是,对于二氧化碳在水中的溶解度来说,情况却有所不同。
二氧化碳在水中的溶解度受到温度和压力的共同影响。
在常温常压下,二氧化碳是一种无色无味的气体,不易溶解于水中。
然而,当温度降低到5℃时,二氧化碳的溶解度会显著增加。
这是因为低温会降低溶剂分子的热运动能力,使其活性降低,从而减少了溶解过程中的竞争。
因此,在5℃时,二氧化碳在水中的溶解度较高。
根据实验数据,我们可以得出5℃时二氧化碳在水中的溶解度约为0.9g/100g水。
这意味着在100克水中最多可以溶解0.9克的二氧化碳。
需要注意的是,这只是一个近似值,实际的溶解度会受到其他因素的影响,例如水的纯度、溶解过程中的搅拌等。
二氧化碳在水中的溶解度对于生物体来说具有重要意义。
一方面,二氧化碳是植物进行光合作用的重要原料,植物通过叶片中的气孔吸收二氧化碳,并将其转化为有机物质。
另一方面,二氧化碳的溶解度也影响着水体中的酸碱度。
当二氧化碳溶解于水中形成碳酸时,会增加水的酸度,导致水体的酸化。
这对于水生生物来说可能会带来一系列的影响,例如对鱼类和其他水生生物的生存和繁殖能力造成负面影响。
在实际应用中,二氧化碳的溶解度也具有一定的重要性。
例如,在饮料工业中,二氧化碳被用作饮料的起泡剂,其溶解度的大小直接影响着饮料的口感和质量。
此外,在一些化学工艺中,也常常需要控制二氧化碳的溶解度,以达到特定的反应条件。
在5℃时,二氧化碳在水中的溶解度较高。
这一特性与一般情况下气体溶解度随温度升高而增加的规律有所不同。
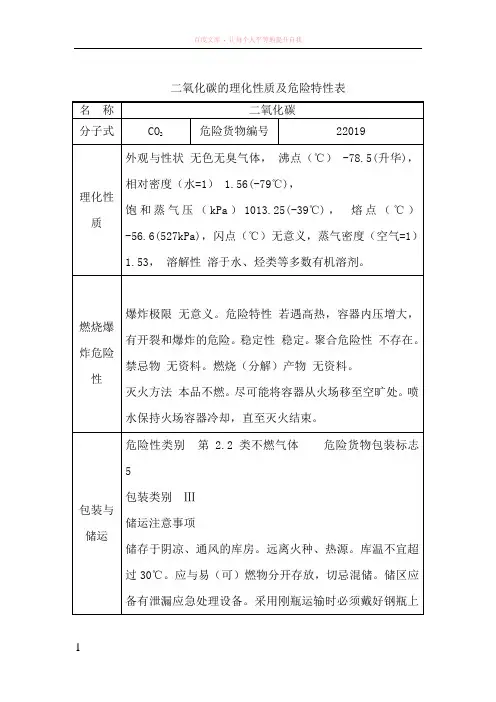
二氧化碳的理化性质及危险特性表名称二氧化碳分子式CO2危险货物编号22019理化性质外观与性状无色无臭气体,沸点(℃) -78.5(升华),相对密度(水=1) 1.56(-79℃),饱和蒸气压(kPa)1013.25(-39℃),熔点(℃)-56.6(527kPa),闪点(℃)无意义,蒸气密度(空气=1)1.53,溶解性溶于水、烃类等多数有机溶剂。
燃烧爆炸危险性爆炸极限无意义。
危险特性若遇高热,容器内压增大,有开裂和爆炸的危险。
稳定性稳定。
聚合危险性不存在。
禁忌物无资料。
燃烧(分解)产物无资料。
灭火方法本品不燃。
尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
包装与储运危险性类别第 2.2类不燃气体危险货物包装标志5包装类别Ⅲ储运注意事项储存于阴凉、通风的库房。
远离火种、热源。
库温不宜超过30℃。
应与易(可)燃物分开存放,切忌混储。
储区应备有泄漏应急处理设备。
采用刚瓶运输时必须戴好钢瓶上的安全帽。
钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。
严禁与易燃物或可燃物等混装混运。
夏季应早晚运输,防止日光曝晒。
铁路运输时要禁止溜放。
毒性及健康危害职业接触限值:未制订侵入途径:吸入健康危害:在低浓度时,对呼吸中枢呈兴奋;高浓度时则引起抑制作用,更高浓度时还有麻醉作用。
中毒机制中还兼有缺氧的因素。
急性中毒:人进入高浓度二氧化碳环境,在几秒钟内迅速昏迷倒下,反射消失、瞳孔扩大或缩小、大小便失禁?呕吐等,更严重者出现呼吸停止及休克,甚至死亡。
慢性中毒,在生产中是否存在,目前无定论。
固态(干冰)和液态二氧化碳在常压下迅速汽化,造成局部低温,可引起皮肤和眼腈严重的低温灼伤。
急救皮肤接触:若有皮肤冻伤,先用温水洗浴,再涂抹冻伤软膏,用消毒沙布包扎。
就医。
冻结在皮肤上的衣服,要在解冻后才可脱去。
接触液化气体,接触部位用温水浸泡复温。
注意患者保暖并且保持安静。

二氧化碳在深海中溶解度大的原因
二氧化碳是一种广泛存在于地球大气中的气体,它对地球的气候和生态系统起着重要的影响。
在深海中,二氧化碳的溶解度远远大于在陆地和浅海中的溶解度。
这主要是由于深海环境的特殊性和深海水体的物理化学性质所致。
深海的温度和压力对二氧化碳的溶解度有重要影响。
深海水温较低,一般在0-4摄氏度之间,而温度越低,二氧化碳分子的运动越缓慢,溶解度也就越大。
此外,深海水压远远高于陆地和浅海,达到几百至几千个大气压,高压环境也有助于二氧化碳的溶解。
因此,深海中的低温和高压条件为二氧化碳的溶解提供了有利条件。
深海水体的盐度也是影响二氧化碳溶解度的重要因素之一。
深海水盐度较高,平均盐度约为35‰,高盐度使得深海水体具有较强的溶解性。
二氧化碳分子在高盐度的水体中更容易与水分子发生作用,从而增加了溶解度。
深海中的生物活动也会影响二氧化碳的溶解度。
深海生物通过呼吸和新陈代谢过程产生大量的二氧化碳,这些二氧化碳会溶解在周围的海水中。
深海中二氧化碳的溶解度较大的原因主要包括低温、高压、高盐度以及深海生物的作用。
这种高溶解度使得深海成为了地球上最大的碳汇之一,吸收并储存了大量的二氧化碳,对地球的气候和环境起
到了重要的调节作用。
然而,随着人类活动导致二氧化碳排放的增加,深海中的二氧化碳溶解度可能会发生变化,进而对深海生态系统产生重要影响,这也需要引起我们的关注和重视。

二氧化碳的溶解性探究【探究目的】1.、通过探究认识二氧化碳在水中的溶解性2、初步学会运用多种途径进行探究的方法【探究活动】1、问题的提出汽水、可乐开启后会有大量气泡冒出,它们通常被称为碳酸饮料。
二氧化碳能溶解在水中吗?2、实验探究结合已有经验和所学知识,根据二氧化碳在水中溶解前后和溶解过程中发生的一系列变化,设计方案探究二氧化碳在水中的溶解性。
请你认真研究方案,从中选择方案探究。
也可以自己设计方案探究。
方案Ⅰ:根据“二氧化碳溶解在水中,可与水反应生成碳酸,碳酸遇紫色石蕊试液变红”探究二氧化碳在水中的溶解性。
1.取两支同样大小的试管,加入1/3体积的水,滴加几滴紫色石蕊。
分别通入二氧化碳和空气。
观察实验现象。
2.把上述两支试管分别在酒精灯上加热。
观察实验现象。
3.问题思考:碳酸能使紫色石蕊试液变红,为什么在水中通入二氧化碳也能使紫色石蕊变红?加热后的现象表明温度对于二氧化碳在水中的溶解度有何影响?方案Ⅱ根据“二氧化碳被水吸收而引起的气体压强变化”探究二氧化碳的在水中的溶取两只干燥的大小相等的矿泉水瓶,其中一只收集满二氧化碳气体,另一只收集满空气,分别向其中倒入等体积的水。
拧紧瓶塞,观察矿泉水瓶的变化。
1.问题思考:两只矿泉水瓶中,哪只矿泉水瓶发生干瘪现象?导致瓶内外气体压强差异的原因是什么?方案Ⅲ定量探究常温下二氧化碳在水中溶解的量。
1.取两支一次性注射器(25ml),分别吸入10ml水,其中一支吸入5ml二氧化碳气体,另一支吸入5ml空气。
2.用小橡皮封住注射器针孔,慢慢推进注射器活塞,轻轻振荡注射器,放开注射器活塞,记录气体被水溶解的量。
3.在两支注射器中分别吸入10ml水,重复上述实验。
4.问题思考:如何表示常温下二氧化碳在水中溶解的量?为什么在表示二氧化碳在水中溶解的量时要注明温度?活动探究记录探究主题姓名合作者班级时间【交流与反思】把你小组的探究方案、探究活动、探究结果及体会与同学交流讨论。

二氧化碳具有的物理性质
二氧化碳是一种普遍存在于大气层中的气体,它的化学结构是由一个氧原子和两个碳原子组成的,它的化学式为CO2。
二氧化碳具有多种物理性质,这种物理性质对我们的环境有重要的影响。
首先,二氧化碳是一种稳定的无机物。
它具有较高的溶解度,能够溶解在水中,是一种极其不活泼的物质。
它在空气中也极其不活泼,但是在温度较高时,它可以极其不活跃地向上升。
其次,二氧化碳具有较强的吸附性。
它能够与水,金属,硅,木头等物质紧密结合,在气体中的浓度由大气的温度、湿度、压力等因素决定。
此外,二氧化碳具有比较强的酸性,其pH值在4.2-4.4之间,波长范围为4.4-4.6 microns,反射率在50-60%之间。
这一属性比较强烈,具有一定的全球变暖作用。
由于全球变暖,海洋水位也将上涨,对陆地造成巨大破坏。
最后,二氧化碳具有优异的热传导性。
它能够有效地将热量传递给附近的环境,这一特性可用于大气系统中的能量传输。
这一物理性质也可以用于热开关,即可以控制二氧化碳浓度以调节大气温度。
总之,二氧化碳具有多种物理性质,它们对我们的环境有重要的影响。
了解这些物理性质,我们可以更有效地利用它们,减少全球变暖的影响,减少地球受到破坏的可能性。
- 1 -。

二氧化碳溶解度有机溶剂
二氧化碳是一种广泛存在于自然界中的气体,它对于地球的温度和气候变化有着重要的影响。
而二氧化碳的溶解度则是指在一定温度和压力下,二氧化碳能够溶解在水或有机溶剂中的程度。
本文将主要探讨二氧化碳在有机溶剂中的溶解度问题。
有机溶剂是指在化学结构中含有碳元素的溶剂,如醇、醚、酮、酯等。
与水相比,有机溶剂的极性较小,因此在溶解二氧化碳时会表现出不同的特性。
一般来说,有机溶剂的二氧化碳溶解度要比水低得多。
二氧化碳在有机溶剂中的溶解度与温度、压力、溶剂种类、溶剂极性等因素密切相关。
以温度为例,随着温度的升高,二氧化碳在有机溶剂中的溶解度会降低。
这是因为温度升高会导致分子热运动加剧,使分子间距离增大,从而减小了二氧化碳分子与溶剂分子之间的相互作用力,导致其溶解度下降。
除了温度外,压力也是影响二氧化碳在有机溶剂中溶解度的因素之一。
随着压力的升高,二氧化碳分子与有机溶剂分子之间的相互作用力增强,从而促进了其溶解度。
但是,在一定范围内,压力对二氧化碳在有机溶剂中的溶解度影响并不明显。
此外,不同种类的有机溶剂对于二氧化碳的溶解度也存在差异。
一般来说,极性较大的有机溶剂如醇类对二氧化碳的溶解度较高,而极性较小的有机溶剂如烷烃类对其溶解度较低。
总之,二氧化碳在有机溶剂中的溶解度受到多种因素的影响,其中温度、压力、溶剂种类和极性等因素都是重要的影响因素。
对于工业生产和环境保护等领域来说,了解和掌握二氧化碳在有机溶剂中的溶解度规律具有重要的实际意义。

氧和二氧化碳在水中的溶解度氧和二氧化碳是生命中必不可少的气体,在水中溶解度也是非常重要的。
本文将探讨氧和二氧化碳在水中的溶解度,以及溶解度的影响因素和作用。
一、氧在水中的溶解度氧在自然界中广泛存在,并且是人和动物生存的基本要素之一。
在水中,氧也是生存必需的物质,因为大部分水生生物需要从水中摄取氧气来进行呼吸。
氧气在水中的溶解度取决于水的温度和压力。
一般情况下,在常温下(25℃)和常压下(1 atm)下,氧气在水中的溶解度为8.26毫克/升。
但是,氧气的溶解度并不是完全稳定的,它会受到一些因素的影响。
例如,当水的温度升高时,氧气的溶解度会降低,因为气体分子在水中的运动速度会加快,从而导致氧气分子从水中释放出来。
此外,当水的压力下降时,氧气的溶解度也会下降。
这是因为压力越低,氧气分子在水中容易形成气泡,并从水中释放出来。
二、二氧化碳在水中的溶解度二氧化碳是另一种重要的气体,在人体和动物呼吸中也扮演着重要的角色。
在水中,二氧化碳的溶解度也受到一些因素的影响,如温度、压力和水的pH值等。
二氧化碳在水中的溶解度随着水温的升高而降低。
这是因为,当水温升高时,水分子的热运动速度加快,从而使得二氧化碳分子从水中释放出来。
与氧气不同的是,水温越低,二氧化碳在水中的溶解度就越高。
压力也对二氧化碳在水中的溶解度产生影响。
一般情况下,随着水压的增加,二氧化碳在水中的溶解度也会增加。
这是因为,当水被压缩时,其中的空气和有机体会被压缩成小空间,从而使二氧化碳分子更容易溶解到水中。
水的pH值还可以影响二氧化碳在水中的溶解度。
在酸性环境中,二氧化碳的溶解度会提高,而在碱性环境中则会下降。
三、氧和二氧化碳的作用氧和二氧化碳在水中的溶解度对生物体的生存与发展起着重要作用。
其中,氧在水中的溶解度越高,意味着水体中的氧含量越高,从而使得水中生物的呼吸更加顺畅。
高氧水可以促进鱼类和其他水生生物的生长,提高抗病能力,增加其能量消耗,以及促进繁殖和生殖发育。

二氧化碳的性质二氧化碳,化学式为CO2,是一种无色无味的气体,在常温下为稳定的分子。
它是地球上最常见的温室气体之一,对地球的气候变化起着重要的作用。
除了在大气中存在,二氧化碳也可以通过燃烧、呼吸和其他生物活动产生,同时也可以通过植物的光合作用和一些化学反应进行吸收。
二氧化碳的化学性质1. 稳定性:二氧化碳是一种很稳定的分子,可以在大气中长时间存在而不会分解。
这是因为它的化学键很强,需要高能量才能断裂。
2. 非可燃性:二氧化碳是一种不可燃的气体,不支持燃烧过程。
然而,高浓度的二氧化碳可以对火源形成窒息作用,因为它会将氧气从空气中排除。
3. 可溶性:二氧化碳是一种极易溶于水的气体,能与水分子发生反应形成碳酸。
这也是为什么二氧化碳溶解在水中会形成碳酸饮料的原因。
4. 酸性:二氧化碳可以与水反应形成碳酸,会使水呈现酸性。
因此,高浓度的二氧化碳能够腐蚀金属和其他材料。
5. 冷凝性:当二氧化碳气体的温度降低时,可以通过压缩和冷却使其变成液体或固体。
液体二氧化碳可以用作工业冷冻剂和气体灭火剂。
二氧化碳在大气中的作用1. 温室效应:二氧化碳是地球大气的主要温室气体之一,它能够吸收和重新辐射地球表面向上辐射的长波辐射,使得地球保持温暖。
然而,当二氧化碳浓度过高时,会导致过强的温室效应,导致全球气候变暖。
2. pH影响:二氧化碳通过与水反应形成碳酸,影响水的酸碱度。
大气中的二氧化碳增加会导致海洋中碳酸的浓度增加,使得海水变酸,并对海洋生态系统造成影响。
3. 有机物的来源:二氧化碳是植物进行光合作用的重要原料,植物通过光合作用将二氧化碳转化为有机物,进而提供能量和生命所需的碳源。
4. 空气污染:二氧化碳的大量排放是工业和交通活动的副产品,也是燃煤和燃油等化石燃料的燃烧产物。
高浓度的二氧化碳排放被视为一种空气污染物,对人类和生态环境造成负面影响。
二氧化碳的应用1. 饮料产业:二氧化碳被广泛应用于碳酸饮料的制造过程中,用于增加饮料的起泡效果,并给予饮料一种清爽的口感。


5℃时二氧化碳在水中的溶解度二氧化碳是一种常见的气体,在大气中广泛存在。
而在水中,二氧化碳也能够溶解,形成碳酸。
本文将探讨在5℃时二氧化碳在水中的溶解度,并解释其原因。
二氧化碳的溶解度是指在一定温度和压力下,单位体积的水中能够溶解的二氧化碳的质量。
在5℃时,二氧化碳在水中的溶解度较高,这是因为低温能够增加二氧化碳分子在水中的溶解度。
二氧化碳分子在水中溶解的过程涉及到物质的相互作用力。
在水中,二氧化碳分子与水分子之间会发生相互作用,形成碳酸。
这种相互作用力主要是静电相互作用力和氢键相互作用力。
静电相互作用力是指带正电荷的二氧化碳分子与带负电荷的水分子之间的相互作用。
在水中,水分子会发生电离,形成氢离子和羟基离子。
而二氧化碳分子在水中也会部分电离,形成碳酸离子和氢离子。
这些离子之间的电荷相互吸引,使得二氧化碳分子能够在水中溶解。
氢键相互作用力是指水分子中的氢原子与二氧化碳分子中的氧原子之间的相互作用。
在水中,水分子中的氢原子带有正电荷,而二氧化碳分子中的氧原子带有负电荷。
这种电荷之间的相互作用力使得二氧化碳分子能够与水分子形成氢键,增强它们在水中的溶解度。
温度也对二氧化碳在水中的溶解度产生影响。
一般来说,温度越低,二氧化碳在水中的溶解度越高。
这是因为低温能够降低水分子的热运动速度,减少水分子与二氧化碳分子之间的相互作用力被破坏的可能性,从而增加二氧化碳分子在水中的溶解度。
在实际应用中,二氧化碳的溶解度在工业生产和环境保护等方面具有重要意义。
例如,在饮料生产中,二氧化碳被用于制造汽水和啤酒等饮料,其溶解度的高低直接影响着饮料的味道和口感。
此外,二氧化碳的溶解度还与海洋生态系统的稳定性有关。
海洋中的二氧化碳溶解度的变化会影响海洋中的生物体的生存和繁衍,对海洋生态环境产生重要影响。
在5℃时二氧化碳在水中的溶解度较高。
这是由于低温能够增加二氧化碳分子在水中的溶解度。
二氧化碳分子在水中的溶解主要是通过静电相互作用力和氢键相互作用力实现的。
探究活动溶解度曲线二氧化碳在水中的溶解性二氧化碳在水中的溶解性一、探究目的1.通过探究认识二氧化碳在水中的溶解性2.学会运用多种途径进行探究的方法3.初步学习设计实验探宪方案二、探究活动1.问题情景和问题的提出通常汽水瓶开启后,我们都会看到有大量的气泡冒出,有时甚至夹带着大量的汽水往外冲。
汽水瓶和啤酒瓶受热或受到猛烈碰撞时都可能发生爆炸,所以,装有汽水和啤酒的箱子都标有“轻拿轻放、避光保存”的安全标志。
汽水和啤酒通常被称为碳酸饮料。
为什么汽水和啤酒中含有二氧化碳呢?二氧化碳能溶解在水中吗?如果二氧化碳能溶于水,那它在水中的溶解程度如何?2.实验探究二氧化碳是无色、无味的气体,这给我们的探究带来了一定的困难。
但我们可以结合所学知识和已有经验,根据二氧化碳在水中溶解前后和溶解过程中发生的一系列变化,设计方案探究二氧化碳在水中的溶解情况。
下面给出了探究二氧化碳在水中溶解情况的实验方案,请你认真研究此方案,从中选择一些方案进行探究。
你也可以自己设计方案探究二氧化碳在水中的溶解情况。
探究方案(Ⅰ)根据“二氧化碳溶解在水中,可与水反应生成碳酸,碳酸遇紫色石蕊试液会变红”探究二氧化碳在水中的溶解情况二氧化碳+水=碳酸()()()1.下图,取两支试管,加入约1/3体积的滴有紫色石蕊试液的水,分别通入足量的二氧化碳(可用嘴吹)和空气,观察实验现象。
探究方案(Ⅰ)实验示意图2.把上述两支试管分别放在酒精灯火焰上加热。
观察实验现象。
3.回答下列问题:(1)分别通入二氧化碳和空气后,A试管呈________色;B试管呈________色。
(2)加热后,A试管呈________色;B试管呈________色。
(3)碳酸能使紫色石蕊试液变红,为什么在水中通入二氧化碳也能使紫色石蕊试液变红?(4)加热后的现象表明温度对于二氧化碳在水中的溶解度有何影响?探究方案(Ⅱ)根据“二氧化碳和空气在不同温度下在水中溶解量的不同”探究二氧化碳在水中的溶解情况。
二氧化碳溶解度1. 引言二氧化碳(CO2)是一种常见的气体,它在自然界中广泛存在,同时也是人类活动的产物。
二氧化碳的溶解度是指在特定温度和压力下,溶解在液体中的二氧化碳的量。
了解二氧化碳的溶解度对于理解二氧化碳在环境和工业过程中的行为非常重要。
本文将介绍二氧化碳溶解度的影响因素、测量方法以及应用领域。
2. 影响因素二氧化碳溶解度受多种因素影响,包括温度、压力、溶剂性质等。
2.1 温度温度是影响二氧化碳溶解度最重要的因素之一。
一般来说,温度升高会导致溶解度下降。
这是因为温度升高会增加液体分子的热运动能量,使得分子间相互作用减弱,从而降低了二氧化碳分子与液体分子之间的吸引力。
因此,在相同压力下,冷水比热水能溶解更多的二氧化碳。
2.2 压力压力是另一个影响二氧化碳溶解度的重要因素。
一般来说,压力升高会导致溶解度增加。
这是因为增加压力会使得二氧化碳分子与液体分子之间的相互作用增强,从而促进了二氧化碳的溶解。
因此,在相同温度下,高压下的液体能够溶解更多的二氧化碳。
2.3 溶剂性质不同溶剂对二氧化碳的溶解度有不同影响。
一般来说,极性溶剂(如水)比非极性溶剂(如石油醚)更容易溶解二氧化碳。
这是因为极性溶剂中存在较强的分子间相互作用,可以与二氧化碳分子形成较强的吸引力,从而提高了其溶解度。
3. 测量方法测量二氧化碳溶解度的常用方法包括体积法和重量法。
3.1 体积法体积法是通过测量液体中所含二氧化碳的体积来确定其溶解度的方法。
首先,将一定量的液体置于密封容器中,并通入一定压力的二氧化碳气体。
然后,测量容器中液体和气体的体积变化,计算出二氧化碳的溶解度。
3.2 重量法重量法是通过测量液体中所含二氧化碳的质量来确定其溶解度的方法。
首先,将一定量的液体置于天平上,并使其与一定压力的二氧化碳接触。
然后,测量液体质量的变化,计算出二氧化碳的溶解度。
4. 应用领域二氧化碳溶解度在许多领域都有着广泛应用。
4.1 环境科学在环境科学中,了解二氧化碳在水中的溶解度对于研究水体中二氧化碳循环和酸碱平衡非常重要。
二氧化碳溶解度和温度的关系
二氧化碳溶解度和温度之间存在着密切的关系。
一般来说,随
着温度的升高,溶解度会降低,而温度的降低则会导致溶解度的增加。
这种关系可以通过理解气体溶解的基本原理来解释。
根据亨利
定律,在一定温度下,气体溶解在液体中的溶解度与该气体的分压
成正比。
因此,当温度升高时,气体分子的动能增加,分压也会增加,导致溶解度降低。
相反,当温度降低时,气体分子的动能减小,分压也会减小,从而导致溶解度增加。
具体到二氧化碳溶解度和温度的关系,可以以饮料中的气泡现
象为例。
在常温下,开启汽水瓶时会听到“嘶嘶”声,这是因为二
氧化碳从饮料中释放出来。
而当饮料被冷藏后,气泡会减少,因为
在低温下二氧化碳的溶解度增加,更多的气体会溶解在液体中而不
释放出来。
此外,二氧化碳的溶解度还受到压力的影响。
在一定温度下,
增加压力会增加气体的溶解度,而减小压力则会减少溶解度。
总之,二氧化碳的溶解度和温度之间存在着明显的关系,温度升高会导致溶解度降低,而温度降低则会导致溶解度增加。
这一关系对于许多工业和生活中的应用具有重要意义。
水溶解二氧化碳最大浓度水溶解二氧化碳是一个重要的气体溶解物,其浓度对于环境和人类健康都有很大的影响。
因此,了解水溶解二氧化碳的最大浓度是非常重要的。
一、什么是二氧化碳溶解度?二氧化碳是一种在水中溶解度非常高的气体。
二氧化碳分子借助分子间作用力吸附在水分子表面形成二氧化碳水溶液。
溶解二氧化碳的能力可以用溶解度来描述,通常采用质量浓度来进行度量。
单位是克/升,通常也可以使用毫摩尔/升来描述。
二、影响二氧化碳溶解度的因素1. 水温:水的温度越高,其溶解度就越低,因为高温会导致水分子的扰动变得更剧烈,离子以及分子之间的相互作用力变得更弱。
2. 水压:在相同的温度下,溶解度随水压的升高而增加,因为增加的压力可以在水分子中会产生更多的水分子之间的作用力,进而吸附更多的二氧化碳分子到溶液中去。
3. 溶质的浓度: 当二氧化碳浓度较高时,其溶解度也会随之降低。
三、水溶解二氧化碳最大浓度水溶解二氧化碳的最大浓度取决于环境条件,例如温度和压力等因素。
而不同的水体中二氧化碳溶解度不同,这也导致不同类型的水体允许的最大二氧化碳浓度不同。
例如,对于某些淡水或者咸水,在恒定压力下,最大二氧化碳浓度通常为20至30毫升/升。
对此,美国环保署建议全国公共水源量不能超过6至8毫升/升。
同样,对于溶氧水体,如池塘和湖泊,最大二氧化碳浓度通常为70至150毫升/升。
最后,如果是海水,最大二氧化碳浓度可达于至250至350毫升/升。
四、具体的应用了解水溶解二氧化碳最大浓度是非常重要的,例如,我们需要知道二氧化碳浓度对于水体生态系统影响是巨大的。
因此,我们需要保证水体中的二氧化碳浓度不超过最大允许浓度。
同时,这也提示我们在工业生产中,对气体的排放和净化的控制也非常重要。
通过使用高效的净化设备,可以有效地减少二氧化碳的排放并保证环境的持续健康。
综上所述,了解二氧化碳在水中的最大溶解浓度至关重要,根据温度、压力等环境因素的不同,不同类型的水体中的最大允许浓度也存在差异。
二氧化碳溶解度与温度的关系引言:二氧化碳是一种常见的气体,在自然界和人类活动中广泛存在。
了解二氧化碳的溶解度与温度的关系对于很多领域都具有重要的意义,如环境科学、化学工程、气候变化等。
本文将探讨二氧化碳在不同温度下的溶解度变化规律,并分析其影响因素和应用价值。
一、二氧化碳的溶解度与温度的基本关系二氧化碳的溶解度通常用单位质量溶剂中溶解的二氧化碳质量来表示,单位可以是克/升或克/千克。
实验研究表明,二氧化碳的溶解度随温度的升高而降低。
这是因为在常温下,二氧化碳溶解度较高,随着温度升高分子的运动速度增加,溶解度减小。
二、二氧化碳溶解度与温度的数值关系根据实验数据和理论计算,可以得到二氧化碳溶解度与温度之间的大致关系。
在常温下,二氧化碳在水中的溶解度大约为0.9克/升。
随着温度的升高,二氧化碳的溶解度逐渐减小,温度每升高10摄氏度,溶解度大约减少10%。
三、二氧化碳溶解度与压力的关系除了温度,压力也是影响二氧化碳溶解度的重要因素。
一般情况下,二氧化碳的溶解度随着压力的增加而增加。
这是因为增加压力会增加溶剂中分子之间的相互作用力,从而增加二氧化碳分子在溶液中的溶解度。
四、二氧化碳溶解度的应用价值1. 环境科学:了解二氧化碳的溶解度与温度的关系,有助于研究二氧化碳在海洋和淡水中的溶解和释放过程,从而进一步了解二氧化碳的生物地球化学循环和影响。
2. 化学工程:二氧化碳的溶解度与温度的关系对于二氧化碳的分离和提纯具有重要意义。
通过控制温度可以实现二氧化碳的溶解和析出,从而实现对二氧化碳的分离和回收。
3. 气候变化:二氧化碳是主要的温室气体之一,了解二氧化碳的溶解度与温度的关系有助于研究气候变化的机理和预测模型,从而更好地应对气候变化的挑战。
结论:二氧化碳的溶解度与温度呈负相关关系,随着温度的升高,二氧化碳的溶解度减小。
此外,压力也是影响二氧化碳溶解度的重要因素。
了解二氧化碳溶解度与温度的关系对于环境科学、化学工程和气候变化等领域具有重要的应用价值。
关于二氧化碳的溶解性实验的研究
河南省固始县胡族第一中学 465245 符正金
义务教育课程标准实验教科书《化学》(上册)(2001年6月第1版)[实验6-5]是二氧化碳的溶解性实验。
实验时,向一个收集满二氧化碳的质地较软的塑料瓶中加入约1/2 容积的水,振荡后,塑料瓶子变瘪,但(可)总有不少的二氧化碳气体未溶解。
这说明二氧化碳能溶于水,但与教材关于二氧化碳溶于水的描述“在通常状况下,1体积的水约能溶解1体积的二氧化碳”不相吻合。
笔者使用容积为340ml的塑料瓶,在室温下分别加入不同体积的水进行实验。
充分振荡后,在水面以下再次充满水,用量筒测出水的体积,算出被溶解的气体的体积见表1。
表1
实验的次别加入水的体
积(ml)
约占总容积
的比例
后测得水的
体积(ml )
被溶解的气体
体积(ml)
第1次170 1
2
248 78
第2次110 1
3
159 49
第3次85 1
4
125 40
第4次226 2
3
325 99 每次瓶子都明显变瘪,尤其第4次实验,瓶中的气体几乎被溶解尽了,实验的效果更显著,趣味性大大增强。
1体积的水中溶解的气体的体积数接近0.5,这与教材相差很远。
查阅《中学化学教师手册》(上海教育出版社1986年5月第一版),初中化学教材中的几种常见的气体,在气体压强为 1.01*105Pa (1大气压)(没有水蒸气)时,1体积水中溶解的气体,还原到0℃和1.01*105Pa (1大气压)时的体积数见表2。
表2
H2O2N2CO2
0℃0.02148 0.04889 0.02354 1.713
20℃0.01819 0.03102 0.01545 0.878 可见,除二氧化碳以外,其它气体的溶解度与教材或教师用书中列举的数据一致。
中学实验室中,肯定要受到水蒸气分压的影响,使二氧化碳的压强达不到1.01*105Pa (1大气压);加上一般使用自来水代替蒸馏水(自来水中已经溶解了一些二氧化碳)的原因,所以,实验测得的被溶解的二氧化碳的体积数一定会小于理论值。
因此建议如下:
1、将实验中“加入约1/2体积的水”改为“加入约2/3体积的水”,以增强实验的效果。
2、将上述二氧化碳溶于水的描述改为“在20℃,二氧化碳的压强为1.01*105Pa(1大气压)时,1体积的水约能溶解0.88体积的二氧化碳”。