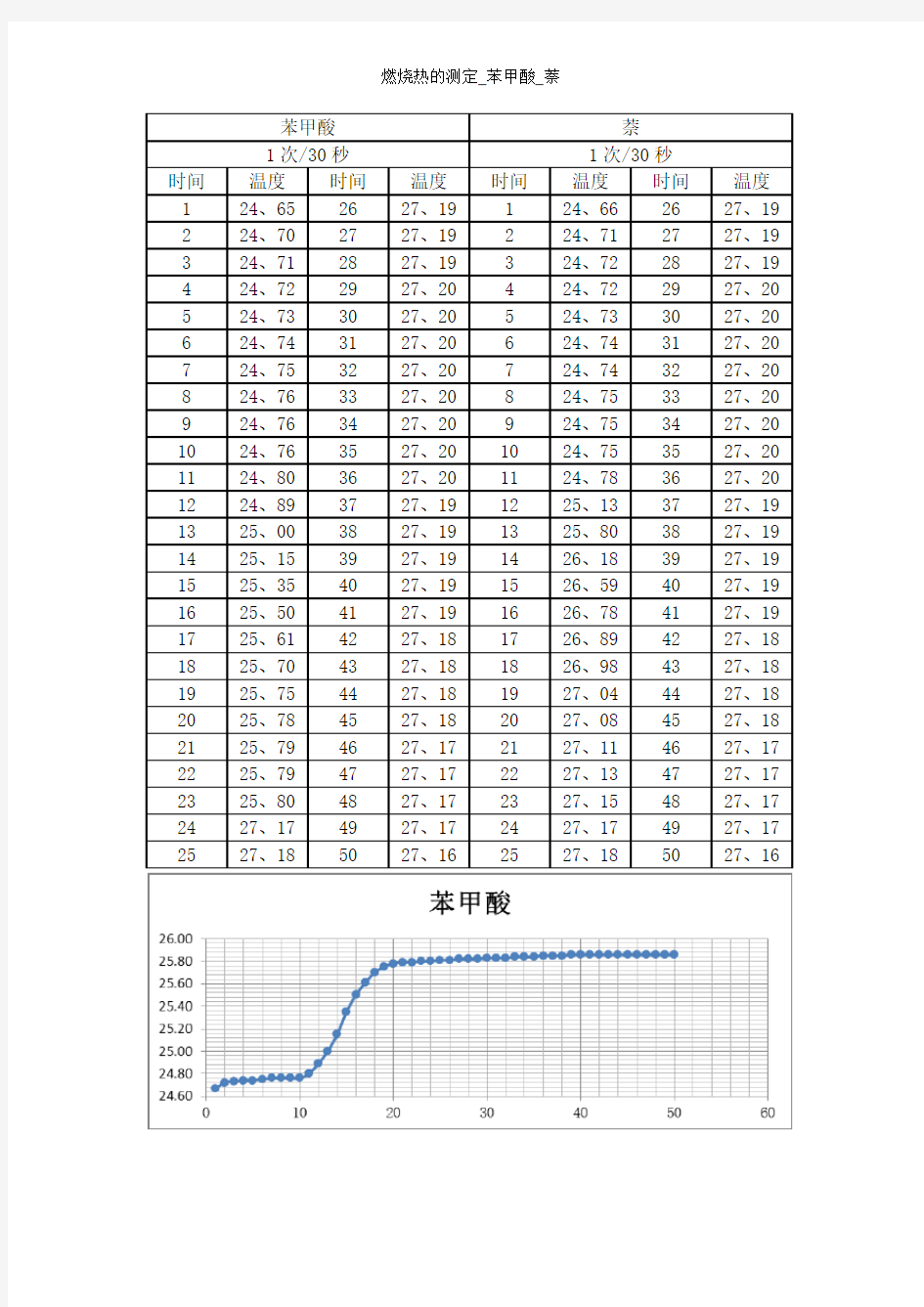
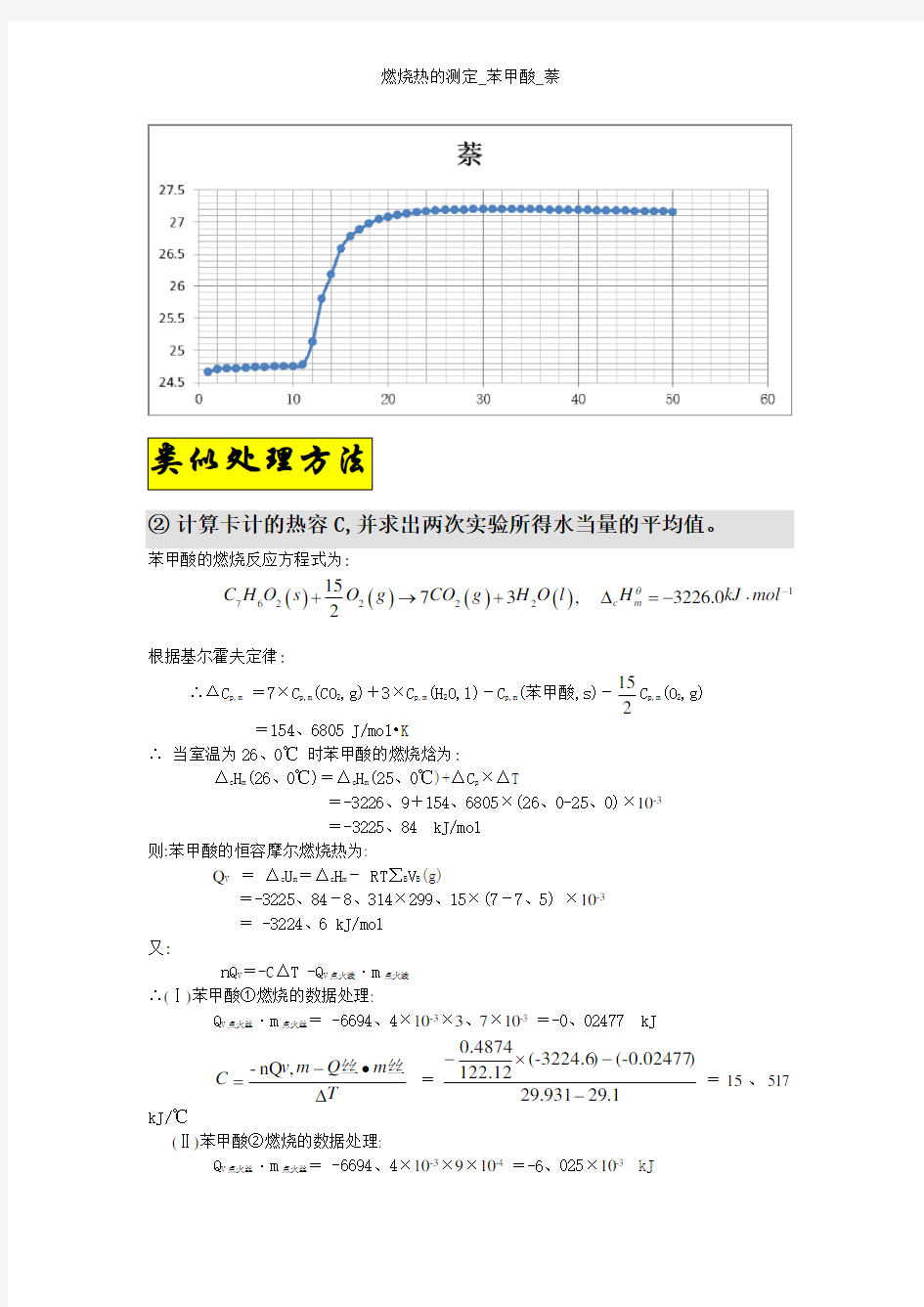
苯甲酸萘
1次/30秒1次/30秒
时间温度时间温度时间温度时间温度
1 24、65 26 27、19 1 24、66 26 27、19
2 24、70 27 27、19 2 24、71 27 27、19
3 24、71 28 27、19 3 24、72 28 27、19
4 24、72 29 27、20 4 24、72 29 27、20
5 24、73 30 27、20 5 24、73 30 27、20
6 24、74 31 27、20 6 24、74 31 27、20
7 24、75 32 27、20 7 24、74 32 27、20
8 24、76 33 27、20 8 24、75 33 27、20
9 24、76 34 27、20 9 24、75 34 27、20
10 24、76 35 27、20 10 24、75 35 27、20
11 24、80 36 27、20 11 24、78 36 27、20
12 24、89 37 27、19 12 25、13 37 27、19
13 25、00 38 27、19 13 25、80 38 27、19
14 25、15 39 27、19 14 26、18 39 27、19
15 25、35 40 27、19 15 26、59 40 27、19
16 25、50 41 27、19 16 26、78 41 27、19
17 25、61 42 27、18 17 26、89 42 27、18
18 25、70 43 27、18 18 26、98 43 27、18
19 25、75 44 27、18 19 27、04 44 27、18
20 25、78 45 27、18 20 27、08 45 27、18
21 25、79 46 27、17 21 27、11 46 27、17
22 25、79 47 27、17 22 27、13 47 27、17
23 25、80 48 27、17 23 27、15 48 27、17
24 27、17 49 27、17 24 27、17 49 27、17
25 27、18 50 27、16 25 27、18 50 27、16
类似处理方法
② 计算卡计的热容C,并求出两次实验所得水当量的平均值。
苯甲酸的燃烧反应方程式为:
()()()()176********, 3226.02
c m C H O s O g CO g H O l H kJ mol θ
-+
→+?=-?
根据基尔霍夫定律:
∴ΔC p,m =7×C p,m (CO 2,g)+3×C p,m (H 2O,l)-C p,m (苯甲酸,s)-
2
15
C p,m (O 2,g) =154、6805 J/mol ?K
∴ 当室温为26、0℃ 时苯甲酸的燃烧焓为:
△c H m (26、0℃)=△c H m (25、0℃)+△C p ×△T
=-3226、9+154、6805×(26、0-25、0)×10-3 =-3225、84 kJ/mol 则:苯甲酸的恒容摩尔燃烧热为:
Q V = △c U m =△c H m - RT ∑B V B (g)
=-3225、84-8、314×299、15×(7-7、5) ×10-3
= -3224、6 kJ/mol 又:
nQ V =-C △T -Q V 点火线·m 点火线
∴(Ⅰ)苯甲酸①燃烧的数据处理:
Q V 点火丝·m 点火丝= -6694、4×10-3×3、7×10-3 =-0、02477 kJ
,nQ -T
m Q m v C ??-=
丝
丝=
1
.29931.29)
-0.02477()-3224.6(122.120.4874
--?-
=15、517
kJ/℃
(Ⅱ)苯甲酸②燃烧的数据处理:
Q V 点火丝·m 点火丝= -6694、4×10-3×9×10-4 =-6、025×10-3 kJ
,nQ -T
m Q m v C ??-=
丝
丝=
648
.30373.31)
-0.006025()-3224.6(122.120.4354
--?-
=15、866
kJ/℃
(Ⅲ)两次实验所得水当量的平均值为:
C =(15、517+15、866)÷2=15、692 kJ/℃
③计算萘的恒容摩尔燃烧热Q V ,m
根据公式:
nQ V =-C △T -Q V 点火线·m 点火线
则:(Ⅰ)萘①燃烧的数据处理:
Q V 点火丝·m 点火丝= -6694、4×10-3×5、4×10-3 =-0、03615 kJ Q V ,m =(-C △T -Q V 点火线·m 点火线)/n
=
()128.18
0.47310.03615
47.28695.2915.692---?=-5217、9 kJ/mol
(Ⅱ)萘②燃烧的数据处理:
Q V 点火丝·m 点火丝= -6694、4×10-3×1、7×10-3 =-0、01138 kJ Q V ,m =(-C △T -Q V 点火线·m 点火线)/n
=
()128.18
0.48190.01138
627.27867.2815.692---?=-5178 kJ/mol
(Ⅲ)萘的恒容摩尔燃烧热平均值为
m v,Q =(-5217、9-5178) ÷2=-5197、5 kJ/mol
④求萘的恒压摩尔燃烧热Q p,m (即△c H m )
萘燃烧的化学方程式为:
()()()()
10822212104C H s O g CO g H O l +→+
()2B
B
g ν
=-∑,
根据基尔霍夫定律:
∴ΔC p,m =10×C p,m (CO 2,g)+4×C p,m (H 2O,l)-C p,m (萘,s)-12C p,m (O 2,g) =154、304 J/mol ?K
∴26、0℃ 时萘的燃烧焓为:
△c H m (26、0℃)=△c U m + RT ∑B V B (g)
=-5206、63+8、314×299、15×(-2)×10-3 =-5211、604 kJ/mol
⑤由基尔霍夫定律将△c H m (T)换成△c H m (298、15K),并与文献比较
△c H m (25、0℃)=△c H m (26、0℃)+△C p ×△T
华南师范大学实验报告 一、实验目的 1、明确燃烧热的定义,了解定压燃烧热与定容燃烧热的差别。 2、掌握量热技术的基本原理;学会测定萘的燃烧热 3、了解氧弹量热计的主要组成及作用,掌握氧弹量热计的操作技术。 4、学会雷诺图解法校正温度改变值。 二、 实验原理 通常测定物质的燃烧热,是用氧弹量热计,测量的基本原理是能量守恒定律。一定量被测物质样品在氧弹中完全燃烧时,所释放的热量使氧弹本身及其周围的介质和量热计有关附件的温度升高,测量介质在燃烧前后温度的变化值T ?,就能计算出该样品的燃烧热。 ()p V Q Q RT n g =+? (1) ()V W W Q Q C W C M +=+样品21总铁丝铁丝水水(T -T ) (2) 用已知燃烧热的物质(本实验用苯甲酸)放在量热计中燃烧,测其始末温度,求出T ?。 便可据上式求出K ,再用求得的K 值作为已知数求出待测物(萘)的燃烧热。 三、仪器和试剂 1.仪器 SHR-15氧弹量热计1台;贝克曼温度计;压片机 2台;充氧器1台;氧气钢瓶1个;1/10℃温度计;万能电表一个;天平 2.试剂 铁丝;苯甲酸(AR);萘(AR );氧气 四、实验步骤 1、测定氧氮卡计和水的总热容量 (1)样品压片:压片前先检查压片用钢模,若发现钢模有铁锈油污或尘土等,必须擦净后,才能进行压片,用天平称取约0.8g 苯甲酸,再用分析天平准确称取一根铁丝质量,从模具的上面倒入己称好的苯甲酸样品,徐徐旋紧 压片机的螺杆,直到将样品压成片状为止。抽出模底的托板,再继续向下压,使模底和样品一起脱落,然后在分析天平上准确称重。 分别准确称量记录好数据,即可供燃烧热测定用。 (2)装置氧弹、充氧气:拧开氧弹盖,将氧弹内壁擦净,特别是电极下端的不锈钢接线柱更应擦十净,将点火丝的两端分别绑紧在氧弹中的两根电极上,选紧氧弹盖,用万用表欧姆档检查两电极是否通路,使用高压钢瓶时必须严格遵守操作规则。将氧弹放在充氧仪台架上,拉动板乎充入氧气。 (3)燃烧温度的测定:将充好氧气后,再用万用表检查两电极间是否通路,若通路将氧弹放入量热计内简。用量筒称3L 自来水,倒入水桶内,装好搅拌轴,盖好盖子,将贝克曼温度计探头插入水中,此时用普通温度计读出水外筒水温和水桶内的水温。接好电极,盖上盖了,打开搅拌开关。待温度温度稳定上升后,每个半分钟读取贝克曼温度计一次,连续记
华南师范大学实验报告 课程名称 物理化学实验 实验项目 燃烧热的测定 【实验目的】 ①明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。 ②掌握量热技术的基本原理,学会测定奈的燃烧热。 ③了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。 ④学会雷诺图解法校正温度改变值。 【实验原理】 燃烧热是指1摩尔物质完全燃烧时所放出的热量。在恒容条件下测得的燃烧热称为恒容燃烧热(O v ),恒容燃烧热这个过程的内能变化(ΔU )。在恒压条件下测得的燃烧热称为恒压燃烧热(Q p ),恒压燃烧热等于这个过程的热焓变化(ΔH )。若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式: ?c H m = Q p =Q v +Δn RT (1) 本实验采用氧弹式量热计测量蔗糖的燃烧热。测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。 氧弹是一个特制的不锈钢容器(如图)为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。 但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。因此燃烧前后温度的变化值不能直接准确测量,而必须经过作图法进行校正。 放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计) 量热原理—能量守恒定律 在盛有定水的容器中,样品物质的量为n 摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C (通常称为仪器的水当量,即量热计及水每升高1K 所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T 1、T 2,则此样品的恒容摩尔燃烧热为: n T T C Q m V ) (12,-- = (2) 式中,Qvm 为样品的恒容摩尔燃烧热(J·mol -1);n 为样品的摩尔数(mol);C 为仪器的总热容(J·K -1或J / oC)。上述公式是最理想、最简单的情况。
1、在氧弹里加10ml蒸馏水起什么作用? 在燃烧过程中,当氧弹内存在微量空气时,N2的氧化会产生热效应。生成NO、NO2等,NO+NO2+H2O=HNO2,而后利用NaOH溶液对其滴定,以扣除N2燃烧引起的放热,若不加入蒸馏水,灰烬落在氧弹内较难清洗,加入水后灰烬落入水中,也便于氧弹清洗。2、在实验中,哪些为体系?哪些为环境?实验过程中有无热损耗,如何降低热损耗? 在本实验装置中,氧弹的内部是被测物质的燃烧空间,也就是燃烧反应体系。氧弹壳及环境恒温式量热计及内外筒内的水为环境。盛水桶、3000ml水(刚好可以淹没氧弹)和氧弹三部分组成了测量体系,测量体系与环境之间有热量的交换,因为理想的绝热条件是不可能达到的,同时影响热量的交换量大小的因素也比较多,与体系、环境的材质有关;与体系、环境的接触界面积大小有关;与体系、环境的温差有关。所以要定量准确地测量出体系与环境交换的热量是比较困难的。如果有净的热量交换的话,将会增大实验的测量误差。在本实验过程中,样品点火燃烧以后体系的温度肯定将高于环境的温度,体系将热传递给环境,因此就必须在样品点火燃烧以前使体系的温度低于环境的温度,使体系从环境处获得热量,并使体系获得的热量与传出的热量尽量抵消,这样测量的效果就相当于绝热体系的结果。 3、在环境恒温式量热计中,为什么内筒温度要比外筒温度低?低多少合适? 无法避免体系与环境之间有热量的交换,就希望体系与环境之间交换的热量为零或尽可能的小。在本实验过程中,样品点火燃烧以后体系的温度肯定将高于环境的温度,体系将热传递给环境,因此就必须在样品点火燃烧以前使体系的温度低于环境的温度,使体系从环境处获得热量,并使体系获得的热量与传出的热量尽量抵消,这样测量的效果就相当于绝热体系的结果。根据称样量范围,升温变化应在1.5~2度之间,所以选择起始水温低于环境1度左右,以减少因未采用绝热式热量计而引起的热辐射误差。 4、欲测定液体样品的燃烧热,你能想出测定方法吗? 采用药用胶囊装取液体试样装入氧弹进行测量。(计算时扣除胶囊的燃烧热)。 采用脱脂棉吸附液体试样方法。(计算时扣除脱脂棉的燃烧热)。 思考题; 1.加入内筒中水的温度为什么要选择比外筒水温低?低多少合适?为什么? 2.在燃烧热测定实验中,哪些是体系?哪些是环境?有无热交换?这些热交换对实验结果有何影响? 3.在燃烧热测定的实验中,哪些因素容易造成实验误差?如何提高实验的准确度? ①检验多功能控制器数显读数是否稳定。熟习压片和氧弹装样操作,量热计安装注意探头不得碰弯,温度与温差的切换功能键钮,报时及灯闪烁提示功能等。
设计实验食品燃烧热的测定 一,实验目的 1,复习恒温式微机热量计的构造和主要部件的作用,进一步掌握氢弹热量计的实验技术。2,用恒温式微机热量计测定食品的燃烧热。 3,了解恒压燃烧热与恒容燃烧热的差别及相互关系。 4,了解消化代谢实验的知识,通过本实验就可以求出食品的总能,消化能和代谢能。 二,实验基本原理 1)燃烧与热量 在适当的条件下,许多有机物都能迅速而全面地进行氧化反应,这就为准确测定它们的燃烧热创造了有利条件。 燃烧热的定义:1摩尔物质完全燃烧时的反应热效应。所谓“完全燃烧”,是指对燃烧的产物有明确规定。如有机化合物中的C氧化成CO2(g),而不是CO(g) 。 量热法是热力学的基本实验方法之一。在恒容或恒压条件下,可分别测得恒容燃烧热Qv和恒压燃烧热Qp。当反应中有气体参加,并将气体视为理想气体时,则它们之间存在下列关系: QP=QV+△nRT 注意式中△n、T温度的取值。 热量计的种类主要包括两种,一种为恒温式的热量计,一种为绝热式热量计。 本实验所用的氧弹热量计是一种环境恒温式的热量计,恒温式的热量计设备较简单,但一般需温度校正,准确度较高,而绝热式热量计可免除温度校正,但仪器比较贵。 2)氧弹热量计 将样品置于密封氧弹内,通电点火,使样品完全燃烧,放出的热量被介质水(内筒水)氧弹本身及有关附件吸收,则测得介质在燃烧前后温度的变化值,就可求算该样品的恒容燃烧热。 1. 标定热量计热容量 采用已知燃烧热量的标准苯甲酸标定。将其置入氧弹内密封充氧,点燃使之完全燃烧,根据校正后内筒水的温升,可标定热量计的热容量: E=(GB·QB+∑q)/ △t 2.燃烧热的测定 热容量标定好后,取试样按上述标定热容量的方法进行同样的操作,可测得试样的燃烧热: QS=(E·△t-∑q)/ Gs 三,实验仪器 氧弹热量计 1套数字式精密温差测量仪 1支 案秤(10kg)1台氧气钢瓶 1只温度计(0~50℃)1支
内容提要:本实验利用氧弹式热量计,以苯甲酸为标准 物,测量物质燃烧时系统温度随时间的变化曲线,经过雷 诺校正和相关计算,得到16.3℃,102.20 kPa下,热量计 的水当量为(1.87±0.07)×103 J?K?1,进而得到蔗糖的 燃烧热为(?16.4±0.1) kJ?g?1,与文献值比较误差为- 0.6 %。对实验的讨论给出了可能引起误差的原因,并说明 了雷诺校正的原理及意义。 1 引言(略) 2 实验部分 2.1 仪器和药品 GR 3500Ⅱ型氧弹式热量计,氧气钢瓶,压片机,SWC-Ⅱ D型温差测量仪,RF-K1型控制箱,数字万用表,秒表,分析天平(万分之一),电子天平(百分之一),研钵,容量瓶(1000 mL,2000 mL)。 镍丝,棉线,苯甲酸(分析纯),蔗糖(分析纯)。 2.2实验步骤 2.2.1 水当量的测量 取一段镍丝,称量其质量m1,紧缠于氧弹两电极上。取一段棉线,称量其质量m2。称取约1.0 g研磨过的苯甲酸,用专用压片机压片。用棉线绑住压片,称量总质量m3后置于燃烧皿中,棉线两端缠绕在镍丝上。 旋紧氧弹盖,充入约1 MPa氧气,随即放气。重复三次,最后充入1.0 MPa氧气。用数字万用表测得两电极间的电阻为12~15 Ω,符合要求。将氧弹放入热量器中。 从实验室中的水箱内取3000.0 mL水加入热量器内筒,关上热量器盖,插入温差测量仪探头,启动控制箱开始搅拌。待水温稳定上升后,将温差测量仪采零,开始计时,每隔30 s记录一次温差。10 min后点火,每15 s记录一次温差。待温差基本保持不变后停止计时。 停止搅拌,取出温差测量仪探头,打开盖子,取出氧弹,泄去废气,打开氧弹,取出剩余镍丝并称量其质量m4。 2.2.2 蔗糖燃烧热的测量 擦干氧弹内外壁和热量器内筒,清理燃烧皿中的残渣。用 2.2.1所述方法测量蔗糖的温差-时间变化曲线,进而计算燃烧热。
浙江万里学院生物与环境学院化学工程实验技术实验报告 实验名称:燃烧热的测定
一、 实验预习(30分) 1. 实验装置预习(10分)_____年____月____日 指导教师______(签字)成绩 2. 实验仿真预习(10分)_____年____月____日 指导教师______(签字)成绩 3. 预习报告(10分) 指导教师______(签字)成绩 (1) 实验目的 1.用氧弹量热计测定蔗糖的燃烧热。 2.掌握恒压燃烧热与恒容燃烧热的概念及两者关系。 3.了解氧弹量热计的主要结构功能与作用;掌握氧弹量热计的实验操作技术。 4.学会用雷诺图解法校正温度变化。 (2) 实验原理 标准燃烧热的定义是:在温度T 、参加反应各物质均处标准态下,一摩尔β相的物质B 在纯氧中完全燃烧时所放出的热量。所谓完全燃烧,即组成反应物的各元素,在经过燃烧反应后,必须呈显本元素的最高化合价。如C 经燃烧反应后,变成CO 不能认为是完全燃烧。只有在变成CO 2时,方可认为是完全燃烧。同时还必须指出,反应物和生成物在指定的温度下都属于标准态。如苯甲酸在298.15K 时的燃烧反应过程为: (液)(气)(气)(固)O H CO O COOH H C 22 256372 15 +?+ 由热力学第一定律,恒容过程的热效应Q v ,即ΔU 。恒压过程的热效应Q p ,即ΔH 。它们之间的相互关系如下: nRT Q Q V P ?+= (1) 或nRT U H ?+?=? (2) 其中Δn 为反前后气态物质的物质的量之差。R 为气体常数。T 为反应的绝对温度。本实验通过测定蔗糖完全燃烧时的恒容燃烧热,然后再计算出蔗糖的恒压燃烧ΔH 。在计算蔗糖的恒压
燃烧热计算公式 已知:Qv 苯甲酸=—26581 J/g ,Q 点火丝=—1400 J/g , M 苯甲酸=mol, M 萘=mol —m 苯甲酸 ·Q v 苯甲酸—m 点火丝·Q 点火丝=(m 水C 水+C 计)·⊿T 苯甲酸 —m 苯甲酸 ·Q v 苯甲酸—m 点火丝·Q 点火丝= C 总·⊿T 苯甲酸 苯甲酸 萘 点火丝 点火丝 T 苯甲酸 T 萘 (3)计算 ①通过标准样品苯甲酸的数据求总的热容C 总(J/K ) —m 苯甲酸 ·Q v 苯甲酸—m 点火丝·Q 点火丝 = C 总·⊿T 苯甲酸 — × (—26581J/g) — × (—1400J/g) = C 总× C 总= K 303.2 (-1400J/g) 0.004g -)(-26581J/g 0.9945g -?? =K J 303.24045.26440 =K ②通过总的热容C 总(J/K )求萘的恒容燃烧热Q v 萘 —m 萘 ·Q v 萘—m 点火丝·Q 点火丝 = C 总·⊿T 萘 — ×Q v 萘 — × (—1400J/g) = K × — ×Q v 萘+ =
Q v 萘 = g 1213.1 .72J 6-0871.83J 4- = —g J/g × g/mol = J/mol = —g× mol = — KJ/mol ③求萘的恒压燃烧热 )(4)(10)(12222810g O H g CO g O H C +=+ n= 2 Q P = Q V + nRT = KJ/mol + (2)mol/K 298K/1000 = mol 1 ④误差估算 %3.95154 5154 4674-=-=?P P Q Q (4)另一种计算方式。所有燃烧热的值都取正值! ①通过标准样品苯甲酸的数据求总的热容C 总(J/K ) m 苯甲酸·Q v 苯甲酸 + m 点火丝·Q 点火丝 = C 总·⊿T 苯甲酸 × 26581J/g + × 1400J/g = C 总× C 总= K 303.2 1400J/g 0.004g 26581J/g 0.9945g ?+? =K J 303.24045.26440 =K
. 燃烧热的测定 姓名:憨家豪学号:2012012026 班级:材23 同组人:赵晓慧 实验日期:2014年4月19日提交报告日期:2014年4月20日 实验老师姓名:郭勋 1 引言 1.1实验目的 (1)熟悉弹式量热计的原理、构造及使用方法; (2)明确恒压燃烧热与恒容燃烧热的差别及相互关系; (3)掌握温差测量的实验原理和技术; (4)学会用雷诺图解法校正温度改变值; 1.2实验原理 在指定温度及一定压力下,1 mol物质完全燃烧时的定压反应热,称为该物质在此温度下的摩尔燃烧热,记作△H。通常,完全燃烧是指C→CO(g),H→HO(l),S→SO(g),22m22c而N、卤素、银等元素变为游离状态。由于在上述条件下△H=Q,因此△H也就是该物质mpc燃烧反应的等压热效应Q。p在实际测量中,燃烧反应在恒容条件下进行(如在弹式量热计中进行),这样直接测得的是反应的恒容热效应Q(即燃烧反应的△U)。若反应系统中的气体均为理想气体,根据mcv 热力学推导,Q和Q的关系为vp (1) T式中:——反应温度,K;——反应前后产物与反应物中气体的物质的量之差; R——摩尔气体常数。 值,根据上式就可计算出,即燃烧热的值。通过实验测得 1 / 8 .
测量热效应的仪器称作量热计。量热计的种类很多。一般测量燃烧热用弹式量热计。内所示。2-2-2实验过程中外水套保持恒温,本实验所用量热计和氧弹结构如图2-2-1和图内水桶连这样,同时,还对内水桶的外表面进行了电抛光。水桶与外水套之间以空气隔热。同其中的氧弹、测温器件、搅拌器和水便近似构成一个绝热体系。弹式量热计的基本原理是能量守恒定律。样品完全燃烧所释放的能量使得氧弹本身及就可求算该样品测量介质在燃烧前后的变化值,周围的介质和量热计有关附件的温度升高。的恒容燃烧热。2 / 8 . (2) m——为待测物的质量,kg ;式中:
实验二 燃烧热的测定 一、目的要求 1.用氧弹量热计测定萘的燃烧热。 2.了解氧弹量热计的原理、构造及使用方法。 二、实验原理 1摩尔物质完全氧化时的反应热称为燃烧热。所谓完全氧化是指C 变为CO 2(气),H 变为H 2O(液),S 变为SO 2(气),N 变为N 2(气),如银等金属都变成为游离状态。 例如:在25℃、1.01325×105Pa 下苯甲酸的燃烧热为-3226.9kJ/mol ,反应方程式为: 1.01325105165222225C H COOH()+7O ()7CO H O Pa s g g l ??????→℃ ()+3() 3226.9kJ/mol c m H O ?=- 对于有机化合物,通常利用燃烧热的基本数据求算反应热。燃烧热可在恒容或恒压条件下测定,由热力学第一定律可知:在不做非膨胀功的情况下,恒容燃烧热V Q U =?,恒压燃烧热p Q H =?。在体积恒定的氧弹式量热计中测得的燃烧热为Q V ,而通常从手册上查得的数据为Q p ,这两者可按下列公式进行换算 ()p V Q Q RT n g =+? (2-1) 式中,Δn(g)——反应前后生成物和反应物中气体的物质的量之差; R ——气体常数; T ——反应温度,用绝对温度表示。 通常测定物质的燃烧热,是用氧弹量热计,测量的基本原理是能量守恒定律。一定量被测物质样品在氧弹中完全燃烧时,所释放的热
量使氧弹本身及其周围的介质和量热计有关附件的温度升高,测量介质在燃烧前后温度的变化值T ?,就能计算出该样品的燃烧热。 ()V W W Q Q C W C M + =+样品 21总铁丝铁丝水水(T -T ) (2-2) 式中,W 样品,M ——分别为样品的质量和摩尔质量; Q V ——为样品的恒容燃烧热; W 铁丝,铁丝Q ——引燃用的铁丝的质量和单位质量的燃烧热 (-16.69kJ g Q =?铁丝); C W 水水,——分别为水的比热容和水的质量; C 总——是量热计的总热容(氧弹、水桶每升高1K ,所需的总 热量); 21T T -——即T ?,为样品燃烧前后水温的变化值。 若每次实验时水量相等,对同一台仪器C 总不变,则(C W C +总水水)可视为定值K ,称为量热计的水当量。 水当量K 的求法是:用已知燃烧热的物质(本实验用苯甲酸)放在量热计中燃烧,测其始末温度,求出T ?,便可据式2-2求出K 。 三、仪器和药品 1.仪器 SHR-15氧弹量热计1台;SWC-ⅡD 精密温度温差仪1台;压片机 1台;充氧器1台;氧气钢瓶1个。部分实验仪器如图2.1和图2.2所示。
题目:燃烧热的测定学院名称:化学与环境工程学院专业:化学工程与工艺班级:14化工2 学号:2014333222 姓名:刘磊 指导老师:陈旭红 二〇一六年十一月
目录 一目的要求、实验原理·········3~4页二仪器试剂、实验步骤·········5~6页三数据处理、结果讨论·········6~9页四其他·········9~10页
燃烧热的测定 关键词:燃烧热、雷诺温度校正图 一目的要求 1、掌握燃烧热的定义,了解恒压燃烧热与恒容燃烧热的差别及相互关系; 2、熟悉热量计中主要部件的原理和作用,掌握氧弹热量计的实验技术; 3、用氧弹热量计测定苯甲酸和蔗糖的燃烧热; 4、学会雷诺图解法校正温度改变值。 二基本原理 1、燃烧与量热 根据热化学的定义,1mol物质完全氧化时的反应热称为燃烧热。所谓完全氧化,对燃烧产物有明确规定。如有机化合物中的碳氧化成一氧化碳不能认为是完全氧化,只有氧化成二氧化碳才是完全氧化。 燃烧热的测定,除了有其实际应用价值外,还可以用于求算化合物的生成热、键能等。 量热法是热力学的一种基本实验方法。在恒容或恒压条件下可以分别测得恒容燃烧热Qv和恒压燃烧热Qp。由热力学第一定律可知,Qv等于体积内能变化ΔU;Qp等于其焓变ΔH。若参加反应的气体和反应生成的气体都作为理想气体处理,则它们之间存在以下关系: ΔH=ΔU+Δ(PV) Qp=Qv+ΔnRT 式中Δn为反应前后反应物和生成物中气体的物质的量之差;R为摩尔气体常数;T为反应时的热力学温度。 热量计的种类很多,本实验所用的氧弹热量计是一种环境恒温式的热量计。氧弹热量计测量装置如图1所示,图2是氧弹的剖面图。
燃烧热的测定 一、实验目的 ●使用氧弹式量热计测定固体有机物质(萘)的恒容燃烧热,并 由此求算其摩尔燃烧热。 ●了解氧弹式量热计的结构及各部分作用,掌握氧弹式量热计的 使用方法,熟悉贝克曼温度计的调节和使用方法 ●掌握恒容燃烧热和恒压燃烧热的差异和相互换算 二、实验原理 摩尔燃烧焓?c H m 恒容燃烧热Q V ?r H m = Q p ?r U m = Q V 对于单位燃烧反应,气相视为理想气体 ?c H m = Q V +∑νB RT=Q V +△n(g)RT 氧弹中 放热(样品、点火丝)=吸热(水、氧弹、量热计、温度计) 待测物质 QV-摩尔恒容燃烧热Mx-摩尔质量 ε-点火丝热值bx-所耗点火丝质量q-助燃棉线热值cx-所耗棉线质量 K-氧弹量热计常数?Tx-体系温度改变值
三、仪器及设备 标准物质:苯甲酸待测物质:萘 氧弹式量热计 1-恒热夹套2-氧弹3-量热容器4-绝热垫片5-隔热盖盖板6-马达7,10-搅拌器8-伯克曼温度计9-读数放大镜11-振动器12-温度计
四、实验步骤 1.量热计常数K的测定 (1) 苯甲酸约1.0g,压片,中部系一已知质量棉线,称取洁净坩埚放置样片前后质量W1和W2 (2)把盛有苯甲酸片的坩埚放于氧弹内的坩埚架上,连接好点火丝和助燃棉线 (3) 盖好氧弹,与减压阀相连,充气到弹内压力为1.2MPa为止 (4)把氧弹放入量热容器中,加入3000ml水 (5) 调节贝克曼温度计,水银球应在氧弹高度约1/2处 (6) 接好电路,计时开关指向“1分”,点火开关到向“振动”,开启电源。约10min后,若温度变化均匀,开始读取温度。读数前5s振动器自动振动,两次振动间隔1min,每次振动结束读数。 (7)在第10min读数后按下“点火”开关,同时将计时开关倒向“半分”,点火指示灯亮。加大点火电流使点火指示灯熄灭,样品燃烧。灯灭时读取温度。 (8)温度变化率降为0.05°C·min-1后,改为1min计时,在记录温度读数至少10min,关闭电源。先取出贝克曼温度计,再取氧弹,旋松放气口排除废气。 (9)称量剩余点火丝质量。清洗氧弹内部及坩埚。 实验步骤 2. 萘的恒容燃烧热的测定 取萘0.6g压片,重复上述步骤进行实验,记录燃烧过程中温度
物化实验报告燃烧热的 测定苯甲酸萘 TPMK standardization office【 TPMK5AB- TPMK08- TPMK2C- TPMK18】
华南师范大学实验报告课程名称物理化学实验实验项目燃烧热的测定 【实验目的】 ①明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。 ②掌握量热技术的基本原理,学会测定奈的燃烧热。 ③了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。 ④学会雷诺图解法校正温度改变值。 【实验原理】 燃烧热是指1摩尔物质完全燃烧时所放出的热量。在恒容条件下测得的燃烧热称为恒容燃烧热(O v),恒容燃烧热这个过程的内能变化(ΔU)。在恒压条件下测得的燃烧热称为恒压燃烧热(Q p),恒压燃烧热等于这个过程的热焓变化(ΔH)。若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式: c H m = Q p=Q v +Δn RT(1) 本实验采用氧弹式量热计测量蔗糖的燃烧热。测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。 氧弹是一个特制的不锈钢容器(如图)为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。 但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。因此燃烧前后温度的变化值不能直接准确测量,而必须经过作图法进行校正。
放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计) 量热原理—能量守恒定律 在盛有定水的容器中,样品物质的量为n 摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C (通常称为仪器的水当量,即量热计及水每升高1K 所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T 1、T 2,则此样品的恒容摩尔燃烧热为: n T T C Q m V ) (12,-- = (2) 式中,Qvm 为样品的恒容摩尔燃烧热(J·mol -1);n 为样品的摩尔数(mol);C 为仪器的总热容(J·K -1或J / oC)。上述公式是最理想、最简单的情况。 图 1 氧弹量热计构造示意图图 2 氧弹构造示意图 1、氧弹 1-厚壁圆筒;2-弹盖 2、内水桶(量热容器) 3-螺帽; 4-进气孔 3、电极 4、温度计 5-排气孔;6-电极 5、搅拌器 6、恒温外套 8-电极(也是进气管) 但是,由于(1):氧弹量热计不可能完全绝热,热漏在所难免。因此,燃烧前后温度的变化不能直接用测到的燃烧前后的温度差来计算,必须经过合理的雷诺校正才能得到准确的温差变化。(2)多数物质不能自燃,如本实验所用萘,必须借助电流引燃点火丝,再引起萘的燃烧,因此,等式(2)左边必须把点火丝燃烧所放热量考虑进去就如等式(3): ΔT 点火丝,C Q m nQ m V =--点火丝 (3) 式中:m 点火丝为点火丝的质量,Q 点火丝为点火丝的燃烧热,为-6694.4 J / g ,?T 为校正后的温度升高值。
燃烧热的测定 预习题: 1. 什么是燃烧热?其终极产物是什么? 2. 实验测仪器常数采用什么样的办法?水当量是什么含义? 3. 氧弹式热量计测燃烧热的简单原理?主要测量误差是什么?如何求Q p ? 4. 为什么说高精度的燃烧热数据较之生成热数据更显得必要? 一、实验目的 1.明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的相互关系。 2. 熟悉氧弹量热计的构造、工作原理及测量方法。 3.学会应用雷诺图解法校正温度改变值。 二、实验原理 燃烧热是指1摩尔物质在等温、等压下与氧气进行完全氧化时的焓变。“完全氧化”的意思是指化合物中的元素生成较稳定的氧化物,如碳被氧化成CO 2(气),氢被氧化成H 2O(液)等。燃烧焓是热化学中重要的基本数据,因为许多有机化合物的标准摩尔生成焓都可通过盖斯定律由它的标准摩尔燃烧焓及二氧化碳和水的标准摩尔生成焓求得。通过燃烧焓的测定,还可以判断工业用燃料的质量等。 在非体积功为 零的情况下,物质的燃烧焓以物质燃烧时的热效应(燃烧热)来表示:即△C H m =Q P ,m ,因此,测定物质的燃烧焓实际就是测定物质在等温、等压下的燃烧热。 量热法是热力学实验的一个基本方法。测定燃烧热可以在等容条件下,亦可以在等压条件下进行。等压燃烧热(Q P )与等容燃烧热(Q V )之间的关系为: RT V n Q Q g g V p ∑??+=ξ (2-1)
式中∑νg 为气体物质化学计量数的代数和;Δξ为反应进度增量,Q P 或Q V 为反应物质的量为Δξ时的反应热,Δn(g)为该反应前后气体物质的物质的量变化,T 为反应的绝对温度。 测量原理是能量守恒定律,样品完全燃烧放出的能量使量热计本身及周围介质温度升高,测量出介质燃烧前后温度的变化,就可以求算该样品的恒容燃烧热。 其关系如下: T C Q V V ?-= (2-2) 式中负号是指系统放出热量,放热时系统内能降低,C V 、T 均为正值。 系统除样品燃烧放出热量引起系统温度升高以外,其他因素:燃烧丝的燃烧,氧弹内N 2和O 2化合并溶于水中形成硝酸等都会引起系统温度变化,因此在计算水当量及发热量时,这些因素必须进行校正,校正值如下: (1) 燃烧丝的校正:Cu-Ni 合金丝:-3.138J·cm -1 (2) 酸形成的校正:(本实验此因素忽略) 校正后的关系式为:Q V -W-3.138L= -K △T (2-3) Q V :样品恒容燃烧热(J·g -1) W :样品的质量(g ) L :燃烧丝的长度(cm ) K :量热计的水当量 量热计的水当量K 一般用纯净苯甲酸的燃烧热来标定,苯甲酸的燃烧热Q V =-26460 J·g -1 为了保证样品燃烧完全,氧弹中必须充足高压氧气。因此要求氧弹密封、耐高压、耐腐蚀。同时,粉末样品必须压成片状,以免冲气时冲散样品使燃烧不完全,而引起实验误差,完全燃烧是实验成功的第一步,第二步还必须使燃烧后放出的的热量不散失,不与周围环境发生热交换,全部传递给量热计本身和其中的盛水,使量热计和水的温度升高,为了减少量热计与环境的热交换,量热计放在一恒温的套壳中,故称环境恒温或外壳恒温量热计。量热计须高度抛光,也是为了减少热辐射,量热计和套壳中间有一层挡屏,以减少空气的对流。虽然如此,热漏还是无法避免,因此燃烧前后温度变化的测量值必须经过雷诺作图法校正。其校正方法如下: 称适量待测物质,使燃烧后水温升高1.5-2.0℃,预先调节水温低于环境温度0.5-1.0℃,然后将燃烧前后历次观察的水温对时间作图,连成FHID 折线,见图10-3, J 温度 J 温度 时间 图10-3 图10-4 图中H 相当于开始燃烧之点,D 为观察到的最高温度读数点,作一平行线JI 交折线于I ,过I 点作垂线ab ,然后将FH 线和GD 线外延交ab 于A 、C 两点。A 点与C 点所表示的温度差即为欲求温度的升高△T 。图中AA′为开始燃烧到温度上升至室温这一段时间△t 1内,由环境辐射和搅拌引进的能量而造成量热计温度的升高,必须扣除。CC′为温度由室温升高到最高点D 这一段时间△t 2内量热计向环境辐射出能量而造成量热计温度的降低,因此需要添加上。由此可见,AC 两点的温度差较客观地表示了由于样品燃烧促使温度计升高的数值,有时量热计的绝热情况良好,热漏小,而搅拌器功率大,不断稍微引进能量使的燃烧后的最高点不出现,这种情况下△T 仍然可以按照同法校正,见图10-4。
燃烧热实验报告 一、实验目的 1、明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。 2、掌握量热技术的基本原理,学会测定奈的燃烧热。 3、了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。 4、学会雷诺图解法校正温度改变值。 二、实验原理 燃烧热是指1摩尔物质完全燃烧时所放出的热量。在恒容条件下测得的燃烧 热称为恒容燃烧热(Q v,m ),恒容燃烧热这个过程的内能变化(Δ r U m )。在恒压条 件下测得的燃烧热称为恒压燃烧热(Q p,m ),恒压燃烧热等于这个过程的热焓变化 (Δ r H m )。若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列 关系式: c H m = Q p,m =Q v,m +ΔnRT (1) 本实验采用氧弹式量热计测量萘的燃烧热。测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。 氧弹是一个特制的不锈钢容器。为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。 但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。因此燃烧前后温度的变化值不能直接准确测量,而必须经过雷诺矫正作图法进行校正。 放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计) 量热原理—能量守恒定律 在盛有定水的容器中,样品物质的量为n摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C(通常称为仪器的水当量,
华南师范大学实验报告课程名称物理化学实验实验项目燃烧热的测定 【实验目的】 ①明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。 ②掌握量热技术的基本原理,学会测定奈的燃烧热。 ③了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。 ④学会雷诺图解法校正温度改变值。 【实验原理】 燃烧热是指1摩尔物质完全燃烧时所放出的热量。在恒容条件下测得的燃烧热称为恒容燃烧热(O v),恒容燃烧热这个过程的内能变化(ΔU)。在恒压条件下测得的燃烧热称为恒压燃烧热(Q p),恒压燃烧热等于这个过程的热焓变化(ΔH)。若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式: c H m = Q p=Q v +Δn RT(1) 本实验采用氧弹式量热计测量蔗糖的燃烧热。测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。 氧弹是一个特制的不锈钢容器(如图)为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。 但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。因此燃烧前后温度的变化值不能直接准确测量,而必须经过作图法进行校正。
放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计) 量热原理—能量守恒定律 在盛有定水的容器中,样品物质的量为n 摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C (通常称为仪器的水当量,即量热计及水每升高1K 所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T 1、T 2,则此样品的恒容摩尔燃烧热为: n T T C Q m V ) (12,-- = (2) 式中,Qvm 为样品的恒容摩尔燃烧热(J·mol -1);n 为样品的摩尔数(mol); C 为仪器的总热容(J·K -1或J / oC)。上述公式是最理想、最简单的情况。 图 1 氧弹量热计构造示意图图 2 氧弹构造示意图 1、氧弹 1-厚壁圆筒;2 -弹盖 2、内水桶(量热容器) 3-螺帽; 4- 进气孔 3、电极 4、温度计 5-排气孔;6- 电极 5、搅拌器 6、恒温外套 8-电极(也是 进气管) 但是,由于(1):氧弹量热计不可能完全绝热,热漏在所难免。因此,燃烧前后温度的变化不能直接用测到的燃烧前后的温度差来计算,必须经过合理的雷
燃烧热数据处理 外界压力:97.58kpa 温度:19.8℃ 湿度:96% 1)苯甲酸测定 外筒温度:21.18℃ 内筒温度:20.44℃ 相差在0.5~1.2℃之间。 2)萘的测定 外筒温度:21.18℃ 内筒温度:20.08℃ 相差在0.5~1.2℃之间。 表1.实验药品及燃烧丝记录 表2.0.1mol/L 的NaOH 滴定用量 一、量热计常数的计算 图1.苯甲酸燃烧数据绘图 药品质量 燃烧丝质量 剩余燃烧丝质量 苯甲酸的测定/g 0.9113 0.0156 0.0016 萘的测定/g 0.5908 0.0160 0.0037 燃烧后滴定用NaOH 量 苯甲酸 萘 5.70mL 7.23mL
由图可测知: 表3.ΔT 数据记录表 则可知△T=1.68K 由反应方程式可知 △n = 7 – 15/2 = -0.5 mol 所以Q V = Q P -△nRT = △H-△nRT = -3226.9*103 +0.5*8.314*(20+273.15) = -3.2257×106 J?mol -1 K=(-26430J?g -1 X m 1-3242.6J?g -1 X m 2 -5980J?mol -1X n)/△T= --1.4336712005*104J?K -1 式中m 1 m 2 n 分别为苯甲酸,已燃镍丝的质量及生成硝酸的物质的量。 △T 为量热系统温度的升高。 可知道量热计常数为K= --1.4336712005*104J?K -1 二、萘的定容和定压燃烧热计算 图2.萘燃烧数据绘图 T 1 T 2 T 3 -0.358 0.381 1.325403 ΔT 1.683403
华南师范大学实验报告 学生姓名学号 专业年级、班级 课程名称物理化学实验实验项目燃烧焓的测定 实验类型□验证□设计□综合试验时间2019 年 4 月23 日 实验指导老师实验评分 一、实验目的 (1)明确燃烧热的定义,了解恒压燃烧热与恒容燃烧烧热的差别与联系。(2)掌握量热技术基本原理,测定萘的燃烧热。 (3)了解氧弹卡计的基本原理,掌握氧弹卡计的基本实验技术。 (4)利用雷诺校正法对温度进行校正。 二、实验原理 2.1基本概念 物质的标准摩尔燃烧焓是指1mol物质在标准压力下完全燃烧所放出的热量。若在恒容条件下测得的1mol物质的燃烧热称为恒容摩尔燃烧热Q V ,m 数值上等于这个燃烧反应过程的热力学能变Δr U m;恒压条件下测得的1mol物质的燃 烧热成为恒压摩尔燃烧热Q p ,m ,数值上等于这个燃烧反应过程的摩尔焓变Δr H m。化学反应的热效应通常用恒压热效应Δr H m来表示。若参加燃烧反应的是标准压力下的1mol物质,则恒压热效应即为该有机物的标准摩尔燃烧热。 把燃烧反应中涉及的气体看做是理想气体,遵循以下关系式: Q p,m=Q V,m+(ΣV B)RT ① ΣV B 为生成物中气体物质的计量系数减去反应物中气体物质的计量系数;R 为气体常数;T为反应的绝对温度;Q p ,m 、Q V ,m 的量纲为J/mol。 2.2氧弹量热计 本实验采用外槽恒温式量热计为高度抛光刚性容器,耐高压,密封性好。量热计的内筒,包括其内部的水、氧弹及其搅拌棒等近似构成一个绝热体系。为了尽可能将热量全部传递给体系,而不与内筒以外的部分发生热交换,量热计在设计上采取了一系列措施。为了减少热传导,在量热计外面设置一个套壳。内筒与外筒空气层绝热,并且设置了挡板以减少空气对流。量热计壁高度抛光,以减少热辐射。为了保证样品在氧弹内燃烧完全,必须往氧弹中充入高压氧气,这就要求要把粉末状样品压成片状,以免充气时或燃烧时冲散样品。 2.3量热反应测量的基本原理 量热反应测量的基本原理是能量守恒定律。热是一个很难测定的物理量,热量的传递往往表现为温度的改变。而温度却很容易测量。在盛有定量水的容器中,样品的物质的量为nmol,放入密闭氢弹,充氧,使样品完全燃烧,放出的热量
华南师范大学实验报告 课程名称 物理化学实验 实验项目 燃烧热的测定 ________ 【实验目的】 ① 明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别。 ② 掌握量热技术的基本原理,学会测定奈的燃烧热。 ③ 了解氧弹卡计主要部件的作用,掌握氧弹量热计的实验技术。 ④ 学会雷诺图解法校正温度改变值。 【实验原理】 燃烧热是指1摩尔物质完全燃烧时所放出的热量。在恒容条件下测得的燃烧热称为恒容燃烧热( O v ), 恒容燃烧热这个过程的内能变化( △ U )。在恒压条件下测得的燃烧热称为恒压燃烧热( Q p ),恒压燃烧热 等于这个过程的热焓变化( △ H )。若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关 系式: -c H m = Q p = Q + A n RT (1) 本实验采用氧弹式量热计测量蔗糖的燃烧热。测量的基本原理是将一定量待测物质样品在氧弹 中完全燃烧,燃烧 时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。 氧弹是一个特制的不锈钢容器(如图)为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者 其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周 围环境发生热交换。 但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高, 也可以是由于量热计 向环境辐射出热量而使量热计的温度降低。因此燃烧前后温度的变化值不能直接准确 测量,而必须经过作图法进行校正。 放出热(样品+点火丝)=吸收热(水、氧弹、量热计、温度计 ) 量热原理一能量守恒定律 在盛有定水的容器中,样品物质的量为 n 摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传 给水及仪器各部件,引起温度上升。设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容 为C (通常称为仪器的水当量,即量热计及水每升高 1K 所需吸收的热量),假设系统与环境之间没有热交 换,燃烧前、后的温度分别为 T 1、T 2,则此样品的恒容摩尔燃烧热为 : (2) 1) ; n 为样品的摩尔数(mol ) ; C 为仪器的总热容J ?K -1 C(T 2-T 1 ) n 式中,Qvn 为样品的恒容摩尔燃烧热J ? mol 或J / oC )。上述公式是最理想、最简单的情况。
实验四 燃烧热(焓)的测定 【实验目的】 1. 通过萘的燃烧热测定,了解氧弹量热计各主要部件的作用,掌握燃烧热的测定技术。 2. 明确燃烧焓的定义,了解恒压燃烧热与恒容燃烧热的差别及相互关系。 3. 学会雷诺图解法,校正温度改变值 【实验原理】 燃烧焓是指1mol 物质在等温、等压下与氧进行完全氧化反应时的焓变。“完全氧化”的意思是化合物中的元素生成较高级的稳定氧化物,如碳被氧化成CO 2(气),氢被氧化成H 2O(液),硫被氧化成SO 2(气)等。燃烧焓是热化学中重要的基本数据,因为许多有机化合物的标准摩尔生成焓都可通过盖斯定律由它的标准摩尔燃烧焓及二氧化碳和水的标准摩尔生成焓求得。通过燃烧焓的测定,还可以判断工业用燃料的质量等。 由上述燃烧焓的定义可知,在非体积功为零的情况下,物质的燃烧焓常以物质燃烧时的热效应(燃烧热)来表示,即p Q H =?因此,测定物质的燃烧焓实际就是测定物质在等温、等压下的燃烧热。 量热法是热力学实验的一个基本方法。测定燃烧热可以在等容条件下,亦可以在等压条件下进行。等压燃烧热(Q P )与等容燃烧热(Q V )之间的关系为: nRT Q Q V P ?+= 式中,△n 为产物与反应物中气体物质的量之差,R 为气体常数,T 为反应的绝对温度。 例如:对萘: )(4)(10)(12)(222810l O H g CO g O s H C +→+ RT Q RT Q RT Q Q m V m V B g B m V m P 2)1210(,,)(,,-=-+=+=∑ν 2. 测量 氧弹量热计是一种环境恒温式的量热计 。 氧弹量热计的基本原理是能量守恒定律。样品完全燃烧所释放的能量使得氧弹本身及其周围的介质(本实验中为水)以及和量热计有关附件的温度升高。测量介质在燃烧前后温度的变化值,就可求算该样品的恒容燃烧热。 V r m Q W T Q m M =?-点火丝点火丝卡 W 卡称为量热计的水当量,即除水之外,量热计升高1℃所需的热量;?T 为样品燃烧前后水温的变化值。量热计和周围环境之间的热交换是无法完全避免的,它对温差测量值的影响可用雷诺温