痰标本细菌学检验
细菌室
一、项目申请:
1、普通细菌培养:对于病房患者选择项目名称为“病房痰培养”,对于门急诊患者选择“门诊痰培养”。如果临床怀疑奴卡菌等特殊病原体,需要在打印出的条码上注明目的病原菌,以便实验室延长培养时间和选择适当培养方法。
2、真菌培养:选择项目名称为“真菌培养”,标本种类选择“痰”。
3、不适于培养的病原菌:厌氧菌、军团菌、衣原体、支原体等,如果有疑问请与细菌室联系询问(电话2485)。分枝杆菌培养为我院外送检验项目。
二、标本采集:
1、采集时间:尽量在抗生素使用前,以清晨留取的标本为更佳。
2、容器要求:螺旋口无菌塑料瓶。
3、采集方法:标本采集前应充分清洁患者口腔,如:漱口、刷牙等,有假牙的病人应取下假牙。嘱附病人深咳,将痰液直接留到无菌瓶内。容器瓶口旋紧勿泄漏。
4、将条码贴于标本瓶上,扫描记录采集时间。
三、送检要求:
1、标本采集后应及时(2小时内)送检。标本若冷藏保存可能会影响对温度敏感细菌的检出。
2一天送检一次即可,不需同一天内连续送检多次,多余的送检标本视为不合格。如遇特殊情况需多次送检时,请事先与细菌室联系。
3、常规送检时间为每周一至周五8点至16点30分,节假日顺延。在常规时间以外如有送检要求,请事先与细菌室联系说明送检原因,经确认后再送检。
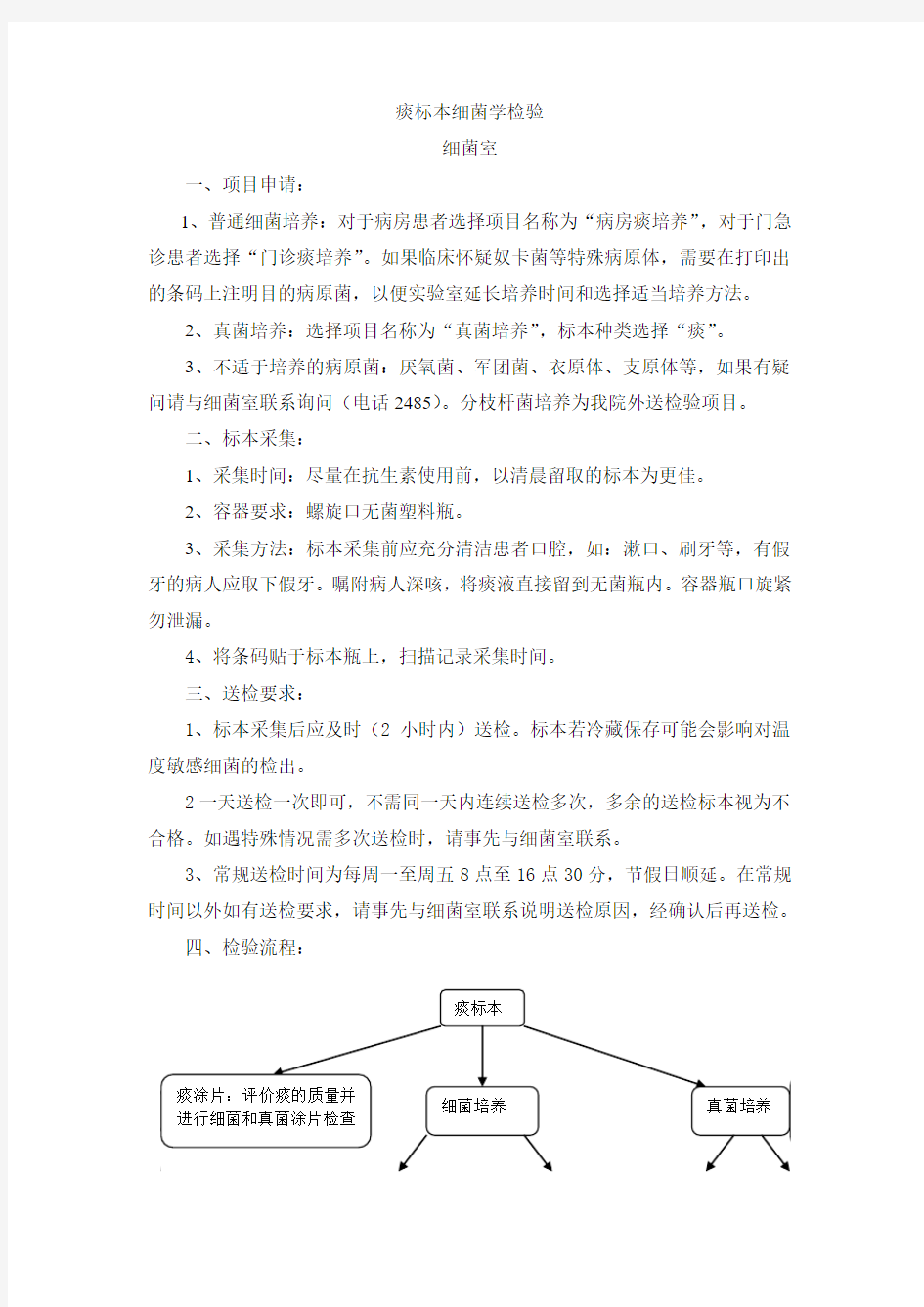
四、检验流程:
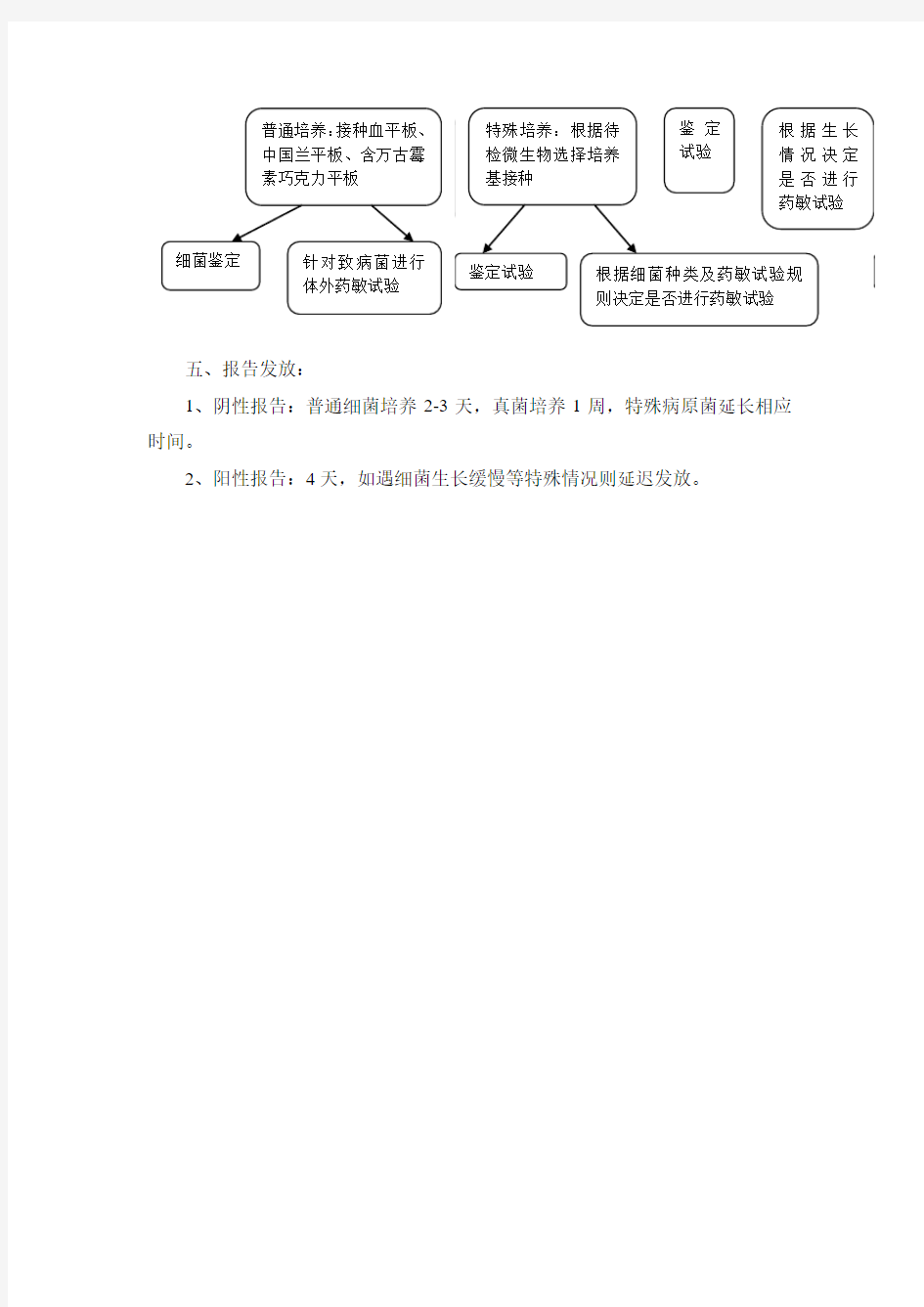
五、报告发放:
1、阴性报告:普通细菌培养2-3天,真菌培养1周,特殊病原菌延长相应时间。
2、阳性报告:4天,如遇细菌生长缓慢等特殊情况则延迟发放。
临床细菌学检验的质量控制流程 1、质量的概念和质量保证 影响检验结果质量的因素很多,实验过程中,仪器、试剂和操作等均会引起试验结果的误差,衡量检验结果的质量常用准确度和精确度,或特异性和灵敏度。具体采用哪一种指标应根据实验的性质决定,目前临床细菌学检验的工作内容大致有3类,衡量起质量的技术指标不完全相同。 第一类是检出细菌的实验,包括标本直接涂片检查和细菌分离培养。现代的细菌感染,混合菌较常见,一份标本中,会有2种以上细菌存在。无论标本直接涂片还是分离培养,检验结果必须如实反映感染病灶中细菌的真实情况。这类实验的质量,应该用细菌检出率或细菌分离率来衡量。 第二类是鉴定细菌的实验。通过一系列生理生化及形态学、血清学的手段来鉴定病原菌。对分离到的病原菌都做出准确的鉴定,是反映细菌事工作质量的一个重要方面。 第三类是药敏实验。有稀释法和纸片法,前者是半定量的实验,可以用准确度和精密度来衡量,后者以敏感或耐药的形
式报告,属于定性的实验,但实验过程中测量抑菌环是定量的指标。也应以准确度和精确度衡量。 所以实验室人员必须清楚认识到以上这一点,在实验室的设计和管理方面就应该主动设置误差检测系统,实验中一旦出现误差及时发出警报,查明原因及时纠正。 2、室内质量控制 2.1在职人员 2.1.1须受过细菌学检验的专门基础教育以及相关的生物交全防护知识,并以细菌检验为专业,及时终结并积累工作经验。 2.1.2作人员必须具有严谨的工作态度,技术操作须完全遵守操作规程,并直接参与质量控制工作。 2.1.3工作人员应不断加强自身的业务学习,及时了解本领域的新进展,将所掌握的新知识应用到实际工作中。 2.1.4实验室管理人员应注意利用一切机会培养技术人员,积极参加国际、国内学术会议、专业培训班,获取新信息。因为细菌学检验,投资人员培训远比投资与仪器设备更重要。 2.2操作手册及参考书
术后标本的病理学检查管理制度及流程
术后标本的病理学检查管理制度及流程 避免各类差错事故的发生,保证准确及时发出病理报告,根据我院实际情况特制定以下规定。 一、手术中取下的标本,都必须送做病理检查,不得随意丢弃。 二、凡需手术病员,由管床医生术前填写“病理申请单”,与手术当天与病历一起送人手术室。手术中切下的标本由巡回护士放入容器内,按规定将标本浸入固定液内,并贴好标码(姓名、住院号),送交手术室专职人员登记签收。 三、送检的病理标本连同病理申请单由手术室专职人员送到病理科,负责送检标本人员必须带上“病理标本签收簿”,由病理科工作人员核对无误签收后,方能留下标本。 四、凡送检冰冻病理标本,手术医师必须按要求填写冰冻病理申请单,并由手术主刀或一助(特殊情况下可由手术室专职人员),将手术标本给病人家属或委托人确认。然后由手术室专职人员将冰冻标本,病理申请单一同送到病理科。凡需送冰冻检查,临床医师应提前一天通知病理科。 五、病理科收到标本后应及时操作检查。病理报告签发时限:(具体时间要核实) 1、冰冻报告一般在收到标本后半小时左右发出临时冰冻报告。如遇特殊情况应及时通知手术室,三天后发出正式冰冻报告。 2、石蜡切片报告在实际收到标本后五个工作日内发出,如遇特殊情况(需做酶标、特染、脱钙等)应及时发出临时报告。 3、细胞学检查:穿刺涂片一般在穿刺后一小时发出报告,如有特殊情况需和病人约定发出报告日期,脱落细胞检查在收到标本后两个工作日内发出报告。 六、病理标本检查后至少保留一个月、、、、、、、、、、、、、、、、、、、。 七、凡违反上述规定者,按性质、后果,责任到人。
脑脊液标本细菌学检验标准操作规程 1.目的 规范脑脊液标本细菌学检验标准操作规程,确保检验结果准确可靠。 2.适用范围 脑脊液培养。 3.标本 3.1标本类型脑脊液。 3.2 标本采集由临床医师以无菌要求做腰椎穿刺,抽取脑脊液2-3ml,盛于无菌容器中送检。脑膜炎奈瑟菌离体后能产生自溶酶,迅速自溶,肺炎链球菌及流感嗜血杆菌离体后也易于死亡。因此,脑脊液无论涂片或培养,必须于采集后立即送检。 3.3 标本拒收标准 3.3.1 标本标识与化验申请单不符。 3.3.2 标本未用无菌试管留取。 3.4 标本保存采集标本后立即送到实验室,不能及时送检可置于室温,放置时间不应超过2小时,切勿放冰箱,否则影响检出率。 4. 试剂、仪器 4.1 革兰染液、氧化酶试剂、3%触酶、血琼脂平板、巧克
力平板、麦克凯平板、相关生化试剂等。. 4.2 VITEK鉴定系统;革兰阴性菌鉴定卡(GNI+)、革兰阴性菌药敏卡(GNS)、革兰阳性菌鉴定卡(GPI)、革兰阳性菌药敏卡(GPS)、药敏纸片、TBA板条等,有效期及储存条件参见试剂说明书。 4.3 接种针、接种环、电热灼烧器、显微镜、孵育箱、CO2培养箱等。 5. 细菌鉴定和药敏质控 参见《质量管理程序》 6. 检验步骤 接收标本后,立即对标本进行编号、登记。 6.1 涂片检查 6.1.1 一般细菌涂片检查外观浑浊或脓性脑脊液可直接涂片,无色、透明的脑脊液,应3000r/min离心10-15分钟后取沉淀物涂片、革兰染色、就、镜检。根据染色及形态特征,常可初步提示细菌的种类。 6.1.2 结核分枝杆菌涂片检查参见《分支杆菌属检验标准操作规程》 6.1.3 新生隐球菌涂片检查取脑脊液的沉淀物作墨汁负染色,或取脑脊液的离心沉淀物接种于沙氏培养基,置于35摄氏度培养2~5日,根据菌落特性,涂片染色镜检作出报告。必要时可作生化反应进一步鉴定。
血液及骨髓液标本细菌学检验标准操作程序 1.检验目的 规范血液及骨髓标本细菌学检验,确保检验结果准确可靠。 2.适用范围 血液及骨髓液培养 3. 标本采集与运送 3.1 标本采集 3.1.1 无菌操作采集静脉血标本无需更换针头直接注入血培养瓶中。 3.1.2 釆血时间 3.1.2.1 发热初期或高峰期时抽血; 3.1.2.2 使用抗生素之前。已使用抗生素者,下一次使用之前。 3.1.3 采血频率 3.1.3.1 急性脓毒症:10min内从不同部位采集2-3套。 3.1.3.2 急性心内膜炎:1-2h内从3个不同体位采集3套。 3.1.3.2 亚急性心内膜炎:从3个分离部位采3套,间隔≥15min,如24h为阴性,要再采3套。 3.1.3.3 原因不明发热:从不同体位采2-3套,间隔≥60min,如24h为阴性,要再采3套。3. 1.4 采血量以培养基的1/10-1/5为宜,新生儿一次采血0.5m1,儿童1-5ml,成人8-10m1。 3.1.5 骨髓标本严格无菌操作,对穿刺一侧部位准备同外科切口,用骨髓穿刺针从髂骨采集。采集量一般为1-2ml。 3.2 标本运送 3.2.1 采集标本后立即送到细菌室,不能及时送检可置室温,切勿放于冰箱。 3.2.2 冬季血培养瓶送检过程应采取一定的保温措施。 3.2.3 在细菌室下班时间,标本应送急诊化验室进行标本保温。 4. 检验步骤 4.1 培养:扫描血培养瓶的条码,将血培养瓶置BACT/Alert 3D全自动血培养系统中培养。
4.2 阳性血培养瓶转种:当有菌生长时,仪器发出阳性报警,立即在生物安全柜中用无菌注射器抽取瓶内培养液直接涂片革兰染色,镜检,以电话方式告知临床医生镜检结果并登记危急值登记本。同时转种血平板。 4.3 培养:血平板置于35℃培养箱培养18一48h。 4.4 培养结果观察:正常人的血液是无菌的,有菌落形成即为可疑致病菌,从琼脂平板上挑取可疑致病菌落进行涂片染色镜检。除极少引起感染的微球菌和需氧芽孢杆菌外,均需要进行细菌鉴定和药敏。 5. 临床意义 血液标本的培养是诊断菌血症的基本而重要的方法,若从患者血液中检出细菌,一般视为病原菌感染,提示有菌血症。
痰液细菌学检验 痰涂片镜检: 选择痰标本中脓细胞成团块状分布,集中而不稠密,且周围无鳞状上皮细胞或无大量成团状分布的细菌球的区域为读片区,认真收寻视野中脓细胞聚集处的脓细胞胞浆中有无吞噬的细菌及细菌的染色排列特征. 接种培养:血平板、巧克力平板、麦康凯/沙氏平板 培养观察: 一、G+菌:BA生长、Choc不生长、MecK不生长 1、G+c菌: ①葡萄球菌:淡黄色/白色,中等大小,较凸,规则圆形,β/γ溶血,较湿润,除金黄色葡萄球菌外,一般不具有临床意义; ②微球菌:黄色/白色/橙色,中等大小,较凸,规则圆形,不溶血,较干燥,不易乳化较葡萄球菌生长缓慢,该菌一般无临床意义; ③链球菌:白色/灰白色、凸起小菌落,β溶血为溶血型链球菌; 灰白隆起中心扁平或凹陷,1.0-1.5mm大小的宽大а溶血为肺炎链球菌,该菌是最常见的肺部感染病原菌,在社区获得性感染中有重要的地位; 细如针尖,白色凸起а溶血的为草绿色链球菌,自然咯痰标本中的草绿色链球菌一般不具有临床意义; ④肠球菌:灰白,低凸,2.0mm左右之а溶血菌落,较湿润,但一般不具有临床意义;
⑤口腔球菌:白色凸起较大菌落,不溶血,黏着,接种针挑之则整个菌落挑起,琼脂上不留痕迹。该菌偶尔可引起肺部的严重感染,一般好发生于COPD病人和肺气肿病人; ⑥孪生球菌:白色、凸起细小菌落,β溶血,生长慢48h仅0.2~0.4mm,在含羊血的MH琼脂上不生长。该菌是上呼吸道的正常菌群组成之一,一般不导致肺部感染; 2、G+ b—依靠溶血特征,菌落形态、菌落大小、菌体形态区分: ①棒状杆菌:白色1.0-1.5mm左右大小,较干燥,不溶血/狭窄β溶血的为白喉或一般棒状杆菌;小而湿润,灰白/无色,半透明的为J-K棒状杆菌;灰白细小,β溶血的可能为假结核、化脓放线菌、溶血分泌杆菌;除白喉杆菌外,假结核、化脓放线菌、溶血分泌杆菌是罕见的咽喉部病源菌,棒状杆菌一般不导致肺部感染; ②乳杆菌:细小,白色凸起а溶血菌落,有特殊的酸臭味,口腔正常菌群,无临床意义; ③芽孢杆菌:灰白大菌落,表面粗糙如毛玻璃状、蜡状、边缘不规则,不同种类菌落形态差异巨大,宽大β溶血。延长培养时间,菌落从湿润变得干燥,边缘呈放射状扩散,形成叶状、掌状、雪花状、齿轮状等,常常为痰培养的污染菌; 根据形态分为G- b(革兰阴性杆菌、G-co(革兰阴性球菌、以及根据对特殊营养的需求对苛养性G- b进一步分类,常见的如嗜血杆菌,军团菌等: BA生长、Choc生长、MecK生长,——Gram染色:G- b—氧化酶、分科琼脂颜色 肠杆菌:氧化酶(-,分科琼脂上黄色湿润大菌落; 弧菌:氧化酶(+,分科琼脂上淡黄色扁平大菌落; 非发酵菌:氧化酶(+/-,分科琼脂上蓝色/无色透明小菌落—鲍曼不动杆菌为中等大小,菌落聚集处产不扩散黄色色素,分离菌落为兰色;
临床标本的细菌学检验 临床标本的细菌学检验,从各种标本中查找病原菌及其对抗生素的敏感性,在明确诊断、指 导用药、预防和流行病学调查等方面具有重要意义。对各种标本,应根据实际要求和标本特 点选择适当的检验步骤及方法,准确、快速地检测病原菌,分析检验结果并报告,同时应注 意低耗和安全防护。分离细菌的目的是查找与疾病相关的病原体及其对抗生素的敏感性,对 临床诊断、治疗、预后和流行病学调查很有价值。 1临床标本的采集与送检 临床标本的质量对于细菌学检验的结果至关重要,严格按操作规程的要求进行标本采集、运送、保存和处理,才能保证检验结果准确、可靠。 1.1临床标本的采集 1.1.1细菌学检验申请单的检查与登记:应仔细检查检验申请单上的内容,如标本类型、来源、送检目的、患者姓名、性别、年龄、临床诊断(如未明确,应注明主要症状)及是否已用 抗生素等,并及时登记。 1.1.2标本盛放容器:采集的标本,尤其是采自无正常菌群寄居部位的标本如血液、脑脊液、穿刺液等,必须盛放于无菌容器内[1]。容器灭菌应采用干热、湿热等物理方法灭菌。容器上 应贴上标签,注明待检患者姓名、床号等信息。 1.1.3无菌操作:在采集血液、脑脊液、穿刺液、骨髓时,应严格进行无菌操作,避免杂菌 污染标本。采集粪便、痰液、咽拭子、肛拭子等标本,虽无需严格无菌操作,但也应尽量避 免杂菌污染。 1.1.4采集时间和部位:选择合适的采集时间是很重要的,一般情况下,标本应尽量在疾病 早期或在症状、体征明显时,在抗生素治疗之前采集,一些特殊检验的标本应按规定的时间 采集。根据感染的具体情况,选择适当的部位采集标本。 1.1.5安全防护:采集的标本可能含有病原菌,因而采集、运送、保存和处理过程中必须注 意安全,防止标本中的病原菌溢出导致污染甚至传播;同时还需防止自身感染。 1.2标本的送检与保存 采集标本后,在盛装标本的容器上应贴好标签,并在标签上写明相关信息,立即将标本送至 检验室。标本收集时间应加以准确记录,使检验人员接种时能判断标本是否延误。如不能及 时送检,应根据病原菌的生物学特性,采用冷藏或保温等措施,以及将标本放入相应的保存 液或培养基中保存运送。常规细菌学检验的标本在采集后,应于1 h内送交实验室,否则可 能影响病原菌检出。若需保存于4℃,也不能超过24 h,否则会影响病原菌的检出率。包括 厌氧菌培养的临床细菌检验标本,运送时间与原始标本的量有关,标本的量少应加快运送, 可在15~30 min内送达,否则必须于厌氧环境中25℃存放,不超过20~24 h。不得冷藏及 冷冻。如怀疑淋病奈瑟菌、脑膜炎奈瑟菌、流感嗜血杆菌感染标本应立即处理。脑脊液、生 殖道、眼睛、内耳标本绝对不可以冷藏[2]。任何临床标本,包括拭子、体屑、体液或组织块,已知或可能含有被分离的致病菌,都应视为生物危险材料。运送时,无论距离远近都必须严 格执行有关病原微生物标本的运送管理规定,注意安全防护,且标识清楚、包装完整且符合 要求,然后安排专人运送。 2 临床标本的细菌学鉴定与报告 对标本进行直接涂片镜检、快速检测病原体成分或特异性抗原、直接药敏试验,同时进行病 原菌的分离培养、菌种鉴定和纯菌药物敏感试验,最后报告检验结果。
惠东县中医院 手术后病理标本检查规定与流程管理制度为了规范病理标本管理,避免各类差错事故的发生,保证准确及时发出病理报告,根据我院实际情况特制定以下规定。 一、手术中取下的标本(不论组织大小),都必须送做病理检查,不得随意丢弃。 二、凡需手术的病人,由主管医师术前填写“病理申请单”,于手术当天与病历一起送入手术室。手术中切下的标本由巡回护士或手术医师给家属或委托人确认后放入标本袋内,并贴好标码(姓名﹑住院号、科室、主要诊断等),送交手术室专职人员登记签收。 三、送检的病理标本连同病理申请单由手术室专职人员送到病理科,负责送检标本人员必须带上“病理标本签收簿”,由病理科工作人员核对无误签收后,方能留下标本。 四、凡送检冰冻病理标本,手术医师必须按要求填写冰冻病理申请单,并由手术主刀或一助(特殊情况下可由手术室专职人员)将手术标本给病人家属或委托人确认。然后由手术室专职人员将冰冻标本﹑病理申请单一同送到病理科。凡需送冰冻检查,临床医师应提前一天通知病理科。 五、病理科收到标本后应及时操作检查。病理报告签发时限: 1、冰冻报告一般在收到标本后半小时左右通过电话通知手术室临时冰冻报告结果。手术室及病理室应按照我院有关规定在快速冰冻病理登记表上登记。如遇特殊情况应及时通知手术室,三天后发出正式冰冻报告。 2、石蜡切片报告在实际收到标本后五个工作日内发出,如遇特殊情况(需做酶标﹑特染﹑脱钙等)应及时发出临时报告。 3、细胞学检查:穿刺涂片一般在穿刺后一小时发出报告,如有特殊情况需和病人约定发出报告日期,脱落细胞检查在收到标本后二个工作日内发出报告。
六、病理标本检查后至少保留一个月。 手术后标本病理学检查流程
血液标本的细菌学检验 发表时间:2013-05-21T10:52:18.263Z 来源:《中外健康文摘》2013年第12期供稿作者:袁颖何小芹徐建利[导读] 血及骨髓常规培养的三级报告方式如下。 袁颖何小芹徐建利 (山东省威海市立医院264200) 【中图分类号】R446.11 【文献标识码】A【文章编号】1672-5085(2013)12-0160-02 1 标本采集 1.1 采血部位与方法:实验室应按照CLSI的有关文件制定用不同采血管采集血液标本的规范(如:H3-静脉穿刺血液标本采集程序,H4-外周血液标本采集装置和程序,H11-动脉血液标本采集程序,H21-凝血检验血液标本的采集、运输和处理及各种抗凝方法的性能特点)。采血部位通常为肘静脉,以无菌操作方法抽取血液后,直接注入血培养瓶中,轻轻颠倒混匀,以防血液凝固。疑为细菌性心内膜炎时,以在肘动脉或股动脉处采血为宜。疑为细菌性骨髓炎或伤寒时,在病灶或髂前(后)上棘处严格消毒后抽取骨髓1~2 mL注入培养瓶内。要事先规定好是何种血液标本,是动脉血、静脉血还是毛细血管血;如果需要抗凝血,应选择何种抗凝剂。还应考虑到样品是否应该维持在真空状态(例如钙离子的检测)。分离血清或血浆的真空采血管和硅化注射器能干扰某些测试,甚至可能导致错误的结果[1]。血液采集后应尽快分离红细胞和其他细胞碎片。当采样条件偏离标准状态时,实验室工作人员应考虑其对检验结果的影响,并从已报道的文献中寻找解决方法。 1.2 采血量:一般要求血液量与培养基量之比应为1:5~1:10。采血量每人每份1瓶,成人每瓶8~10mL,儿童每瓶l~5 mL。骨髓采血量每瓶1~2mL。 1.3 采血时间及采集份数:采集血液标本应尽量在使用抗菌药物之前进行,于24h内采集2~3份血液标本(抽取1次血做多个培养应视为1份),最好分别于不同部位采集(如左、右肘静脉,颈静脉)。对间歇性寒战或发热的患者,应在寒战或体温高峰到来之前0.5~1h采集血液,或于寒战、发热后1h进行。不宜在发热高峰时采血,因为在高热时血液中可能已没有细菌[2]。特殊感染患者采血培养时应遵循以下原则:①可疑细菌性心内膜炎患者,在1~2 h内采集3份血液标本,如果24h后阴性,再采集2份。②不明原因发热的患者,先采集2~3份血液标本,24~36h后在体温升高之前再采血2份或以上。③可疑菌血症但血培养持续阴性时,应改变血培养方法,以获得罕见或苛养的微生物。 1.4 标本运送与保存:含血样的培养瓶应立即送往实验室;不能及时送检的标本,应将其放在室温,切忌冰箱存放。 2 血液标本中常见的病原体 正常人的血液和骨髓中是无菌的,当细菌侵入血液或骨髓引起菌血症或败血症时,血液标本可检出相应病原菌,这可为临床提供病原学诊断依据。革兰阳性菌包括金黄色葡萄球菌、凝固酶阴性葡萄球菌、肠球菌、A群链球菌、B群链球菌、草绿色链球菌、肺炎链球菌、产单核李斯特菌、分枝杆菌、炭疽芽胞杆菌;革兰阴性菌包括脑膜炎奈瑟菌、卡他莫拉菌、沙门菌、大肠埃希菌、肺炎克雷伯菌、肠杆菌、沙雷菌、铜绿假单胞菌、不动杆菌、流感嗜血杆菌;真菌包括念珠菌、隐球菌、曲霉菌、毛霉菌;厌氧菌包括拟杆菌属、具核梭杆菌、丙酸杆菌、消化球菌、韦荣球。 3 检验方法 一般血液或骨髓培养推荐同时作需氧血液培养及厌氧血液培养,因为厌氧菌血液感染占菌血症病原菌的5%~15%。 3.1增菌培养:血液及骨髓标本首先经过增菌培养。若使用全自动血液培养仪,有细菌生长时会自动报警。若人工增菌培养,35℃孵育18~24h后在血平板或巧克力平板上盲传1次。培养瓶继续孵育,每天早晨取出观察[3]。若出现均匀浑浊、沉淀、菌膜、产生气泡、培养液颜色变化、培养液呈胶冻状凝固、血液变色或溶血等现象,提示有细菌生长;若增菌培养至第7天仍无细菌生长现象,其间盲传2次亦无菌生长,则报告该次试验为阴性。 3.2 涂片镜检:血液培养仪报警或肉眼观察有细菌生长时,取培养物涂片做革兰染色镜检。若发现为单一种类的细菌,则可直接取培养液进行药敏试验,并尽快将镜检和药敏试验结果告知临床,为疾病的诊断和治疗提供参考;同时取培养液进行生化鉴定及分离培养。若发现有两种甚至多种细菌,则必须进行分离,获得纯菌后再做菌种鉴定。 3.3 分离培养与鉴定:对于增菌培养阳性的标本,根据涂片染色镜检结果,选择合适的培养基(如血平板、巧克力平板、SS平板、麦康凯平板、中国蓝平板、伊红美蓝平板,或厌氧平板)进行微生物的分离培养,获得纯种后进一步做生化试验、血清学试验进行鉴定,同时做抗菌药物敏感试验。 3.4 结果报告 血及骨髓常规培养的三级报告方式如下。一级报告:增菌培养有细菌生长时,取培养液进行涂片革兰染色镜检,将所见细菌形态、染色性等特征报告临床医生,以供初步选择抗菌药物。二级报告:获初步鉴定和药物敏感试验结果后,应立即将结果通知临床医生,此为二级报告。三级报告:将分离菌最终鉴定和药敏试验结果与初级报告对比,做出最终正式报告,通知临床以检查用药正确与否或更改治疗方案。 参考文献 [1]王勇,李忠波.细菌学检验的质量控制.中国公共卫生,2002,18卷(10):1167~1168. [2]徐英春,等.临床细菌学血培养操作规范.中华检验医学杂志,2004,27:124~126. [3]张卓然.临床细菌学和细菌检验[M].北京:人民卫生出版社, 2003,468.
穿刺液标本细菌学检验标准操作规程 1.目的 规范穿刺液标本细菌学检验标准操作规程,确保检验结果准确可靠。 2.适用范围 穿刺液标本培养。 3.标本 3.1 标本类型胸水、腹水、心包液、关节液、鞘膜液等。 3.2 标本采集采用无菌方法采集体内可疑感染部位的液体约2ml,注入无菌试管,或抽取穿刺液1-2ml注入多功能液体培养瓶,或抽取穿刺液2-5ml注入血培养瓶,混匀,立即送检。如怀疑厌氧菌感染,应做床边接种或接种运送培养基。 3.3 标本拒收标准 3.3.1 标本标识与化验申请单不符。 3.3.2 标本不是无菌留取,容器不符合要求。 3.4 标本保存采集标本后立即送到实验室,不能及时送检可置于室温,放置时间不超过2小时。 4.试剂、仪器 4.1 革兰染液、氧化酶试剂、3%触酶、血琼脂平板、
巧克力平板、麦克凯平板、相关生化试剂等。 4.2 VITEK鉴定系统;革兰阴性菌鉴定卡(GNI+)、革兰阴性菌药敏卡(GNS)、革兰阳性菌鉴定卡(GPI)、革兰阳性菌药敏卡(GPS)、真菌鉴定卡(YBC)、药敏纸片、TBA板条等,有效期及储存条件参见试剂说明书。 4.3 接种针、接种环、电热灼烧器、显微镜、孵育箱、CO2培养箱等。 5. 细菌鉴定和药敏质控 参见《质量管理程序》 6. 检验步骤 接收标本后,立即对标本进行编号、登记。 6.1 涂片检查脓性标本直接涂片。浆液性标本先离心(3000r/min)15分钟,取沉淀物涂片作革兰染色,观察有无细菌,以及细菌的形态。 6.2 分离培养 6.2.1 一般细菌培养接种于接种于血琼脂平板、巧克力琼脂平板和麦康凯(或EMB、中国蓝)琼脂平板,置于5%-10%CO2环境中,35°C培养18-24小时,根据菌落及染色形态特点,作出初步判断。 6.2.2 增菌-分离培养法将多功能体液培养瓶颠倒混匀使液体覆盖整个固体面,然后置35°C孵育培养箱(固体面在
痰液标本细菌学检验(一) 关键词:细胞库菌株培养中心 atcc 北京标准物质网 一、检验程序 痰及呼吸道标本的细菌学检验程序见图34—1。 二、检验方法 (一)显微镜检查 1.一般细菌涂片检查挑取标本中脓性或带血部分涂片进行革兰染色镜检,描述观察到的细菌的染色性、形态及排列等特征,可发出初步报告。 2.结核分枝杆菌涂片检查挑取标本干酪样或脓性部分做抗酸染色和金胺“O”荧光染色,前者用油镜,后者用荧光显微镜检查。具体操作详见第十五章分枝杆菌属检验。
3.放线菌及诺卡菌涂片检查将痰液用生理盐水反复洗涤数次,挑取黄色颗粒(硫黄颗粒)或不透明着色斑点,置玻片上并覆以盖玻片,轻压后置高倍镜下观察。如见中央为交织的菌丝,其末端粗杆呈放线状排列时揭去盖玻片,待干后做革兰染色及抗酸染色镜检。 4.下呼吸道其他标本检查支气管肺泡灌洗液等直接取自下呼吸道的标本,不易受上呼吸道杂菌的污染,涂片检菌的意义较大。可取离心沉淀物进行革兰染色与抗酸染色检查。 (二)培养和鉴定 1.痰培养标本的前处理于痰标本中加入一定量无菌生理盐水,剧烈振荡5~10秒后,将沉淀于管底的脓痰小片取出,置于另一试管中,同法再处理2次,可洗去痰中的正常菌群。然后向洗涤过的痰液中加入等量pH 7. 6的1%胰酶溶液,放置35℃环境90分钟,使痰液均质化后备用。 2.培养基与培养环境 (1)血琼脂平板:适用于分离多种细菌,需氧环境,可分离β-溶血性链球菌,葡萄球菌;置于5%CO 环境培养,分离肺炎链球菌和β-溶血性链球菌。根 2 据血琼脂平板生长的菌落特征及镜检形态,得出初步结果,再按各类细菌特性做进一步鉴定。 (2)巧克力色琼脂平板:置于5%CO 环境培养,常用于分离嗜血杆菌和脑膜 2 炎奈瑟菌等有特殊营养需求的细菌。 (3)中国蓝琼脂平板/麦康凯平板:需氧环境培养,常用于分离肠杆菌科细菌。 (4)TTC-沙保弱培养基:需氧环境培养,用于分离白假丝酵母菌及其他酵母菌、诺卡菌、放线菌以及烟曲霉菌等。 (5)厌氧血平板:厌氧环境培养,用于培养厌氧菌。 (6)结核分枝杆菌培养基:需氧或5%~10%CO 环境培养,改良罗氏培养基、 2 米氏7H10培养基或其他合适的培养基,用于培养结核分枝杆菌。 环境培养,药用炭酵母琼 (7)军团菌专用培养基:置于2.5%~5. 0%CO 2 脂(CYE)培养基、F-G琼脂,用于培养军团菌。 3.标本的培养
术后标本的病理学检查管理制度及流程为避免各类差错事故的发生,保证准确及时发出病理报告,根据我院实际情况特制定以下规定。 一、手术中取下的标本,都必须送做病理检查,不得随意丢弃。 二、凡需手术病员,由管床医生术前填写“病理申请单”,与手术当天与病历一起送人手术室。手术中切下的标本由巡回护士放入容器内,按规定将标本浸入固定液内,并贴好标码(姓名、住院号),送交手术室专职人员登记签收。 三、送检的病理标本连同病理申请单由手术室专职人员送到病理科,负责送检标本人员必须带上“病理标本签收簿”,由病理科工作人员核对无误签收后,方能留下标本。 四、凡送检冰冻病理标本,手术医师必须按要求填写冰冻病理申请单,并由手术主刀或一助(特殊情况下可由手术室专职人员),将手术标本给病人家属或委托人确认。然后由手术室专职人员将冰冻标本,病理申请单一同送到病理科。凡需送冰冻检查,临床医师应提前一天通知病理科。 五、病理科收到标本后应及时操作检查。病理报告签发时限:(具体时间要核实) 1、冰冻报告一般在收到标本后半小时左右发出临时冰冻报告。如遇特殊情况应及时通知手术室,三天后发出正式冰冻报告。 2、石蜡切片报告在实际收到标本后五个工作日内发出,如遇特殊情况(需做酶标、特染、脱钙等)应及时发出临时报告。 3、细胞学检查:穿刺涂片一般在穿刺后一小时发出报告,如有特殊情况需和病人约定发出报告日期,脱落细胞检查在收到标本后两个工作日内发出报告。 六、病理标本检查后至少保留一个月。 七、凡违反上述规定者,按性质、后果,责任到人。
手术室病理标本管理制度流程
利辛县中医院2011年4月8日
微生物学检验题库及答案
《微生物学与检验》题库及答案 一.名词解释 1.医院感染 2.肥达反应 3.内基小体 4. 噬菌体: 5.血浆凝固酶 6.败血症 7.灭菌 8.药物敏感试验 9.外 - 斐氏试验 10.L 型细菌 11.菌群失调: 12.微生物 13.细菌 14.最小抑菌浓度 15.菌落 16.汹涌发酵 17.无菌操作 18.流感杆菌“卫星现象” 19.培养基 20.包涵体 21.正常菌群 22. 内毒素 23. 干扰现象: 24.菌血症 25菌丝: 二.填空题 1 L 型细菌是指()。 2 杀灭物体上所有微生物的方法称为()。 3 细菌 H-O 变异是指()。 4 药敏试验所用标准培养基是,所用菌液相当于()个细菌/ ml ,细菌接种采用()划线接种法。 5 细菌致病因素包括()、()和()。 6 细菌引起的全身感染包括()、()、()和()四种类型。 7 不染色标本检查主要用于观察细菌的()。 8 影响革兰染色结果的关键步骤是()。 9 有动力细菌在半固体培养基中的生长现象是穿刺接种线(),无动力细菌穿刺接种线()。 10 糖发酵试验用于观察细菌分解糖是否产()和()。 11 靛基质试验的原理为,细菌产生的色氨酸酶分解蛋白胨中的色氨酸而生成(),此代谢产物与加入的试剂反应,生成()。 12 链球菌根据溶血现象分为()、()和()三种类型。 13 葡萄球菌触酶试验结果为()性,链球菌触酶试验结果为()性。 14 呈现脐窝状菌落的球菌是()。 15 抗 O 试验是测定病人血清中()抗体效价的试验,用于风湿热等疾病的辅助诊断。 16 血平板上呈现草绿色溶血环的病原性球菌是()和()。 17 IMViC 试验包括()、()、()和()四项试验。 18 分解乳糖的细菌在肠道选择平板上呈现()菌落,不分解乳糖则为()菌落。 19 KIA 斜面红色表明,底层黄色、有气泡表明()、(),有黑色沉淀表明()试验阳性 20 霍乱弧菌生物型包括()和()。 21 AIDS 的传染源是()和(),传播途径主要有(),()和()。 22 真菌菌落有()、()和()三种。 23 病毒培养方法有()、()和()。 24 病毒的基本结构由()和()组成,有些病毒还具有()。 25 流感病毒根据抗原结构不同分()、()、()三型,其中容易引起流感大流行的是其中的()型。
血液标本的微生物学检验程序 1.血液中可能出现的微生物、化脓性球菌: 革兰阳性球菌、革兰阳性杆菌、革兰阴性球菌、革兰阴性杆菌、真菌、厌氧菌、支原体、螺旋体、病毒等 金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、化脓性链球菌、肺炎链球菌等 2.基本思路: 在血液琼脂培养基上分区划线对未知细菌进行分离培养,根据其菌落特征以及不同的溶血现象,挑出单个菌落,进行下一步鉴定。 不同的细菌具有不同的生理特性,通过多种实验操作的阴性阳性对照,可以较为准确地辨别未知菌属。 3.实验内容: ⑴过氧化氢酶实验有些细菌含过氧化氢酶能催化过氧化氢生成水和新生态氧 ⑵凝固酶试验金葡菌能产生血浆凝固酶,使血液凝固 ⑶甘露醇发酵实验致病性葡萄球菌能发酵甘露醇产酸 ⑷新生霉素敏感实验表皮葡萄球菌对其敏感 ⑸胆汁溶菌实验胆汁可溶解肺炎链球菌 ⑹菊糖发酵实验肺炎链球菌能发酵菊糖产酸 ⑺奥普托辛实验肺炎链球菌对Optochin敏感 ⑻杆菌肽敏感实验A群溶血性链球菌对杆菌肽敏感 ⑼透明质酸酶实验A群溶血性链球菌可产生透明质酸酶 ⑽药敏实验:纸片扩散法 该法是将含有定量抗菌药物的滤纸片贴在已接种了测试菌的琼脂表面上,纸片中的药物在琼脂中扩散,随着扩散距离的增加,抗菌药物的浓度呈对数减少,从而在纸片的周围形成浓度梯度。同时,纸片周围抑菌浓度范围内的菌株不能生长,而抑菌范围外的菌株则可以生长,从而在纸片的周围形成透明的抑菌圈,不同的抑菌药物的抑菌圈直径因受药物在琼脂中扩散速度的影响而可能不同,抑菌圈的大小可以反映测试菌对药物的敏感程度,并与该药物对测试菌的MIC呈负相关。 粗略结果表: 试验项目结果 XXXX 阴性阳性++++ XXXX
痰液细菌学检验的标准化操作程序 1前言 众所周知,传统习惯程序的痰标本细菌学检验其临床符合率并不高,其原因是多方面的。除了痰标本采集不规范导致的不合格标本带来的培养结果与病人感染不相符外,还因为微生物和人体的相关性本身就具有复杂性:源自细菌的致病与条件致病的辨证性,如致病菌可能为正常携带,而细菌在肺通气功能异常病人的下呼吸道的可以发生单纯定植或感染,要证明培养结果与感染的相关性是医学微生物学所面临的难题,这也使得一直以来在对于痰培养的标准化进展十分缓慢,以至在各版《全国临床检验操作规程》上也未提出相应详细可行的令全国同行公认的统一规范的标准化操作程序(SOP)和完整的痰液培养的质量控制办法。习惯程序的痰标本细菌学检验的缓慢也很不适应临床诊断治疗的迫切性。故而,建立规范而快速的痰液细菌学检验的SOP对于提高呼吸系统感染病的诊治水平和控制抗生素的滥用等问题均有重要的作用 痰培养阳性率普遍教低,临床符合率差的关键因素是痰标本采集不规范,不合格痰标本将直接导致病原菌被分离的机会降低,大量正常菌群也会抑制病原菌的生长或干扰病原菌的检出,降低了临床符合率;再有就是操作程序的不规范,不重视直接涂片,检验过程控制的不严密也是导致临床符合率低的重要原因。我们通过SOP的临床应用情况的分析,痰培养阳性率和临床符合率均可能被提高,并且细菌分布统计结果显示本文与国外文献所报道的情况基本一致。 对于直接涂片的意义,在于判断标本中微生物有无、类型、染色特性、形态特征,标本的污染情况,还可对痰标本中可能的病原菌初步诊断(依据人体被病原菌感染后的炎性渗出包裹和白细胞吞噬反应),判断是否存在复数菌感染,动态观察处于治疗过程中不同时期所送检的标本中病原菌情况的变化(如同种病原菌数量的增减,机体的免疫反应,菌群的交替)。甚至可以推断临床治疗疗效和病人病情的变化和转归,医院内感染的发生等,具有重要意义。 为了满足高质量需求,对首代分离培养基应该进行严格的质量控制。另外,对首代分离培养基的选用和搭配的合理化也需要进行探讨。
手术后标本病理学检查规定与流程 为规范病例标本管理,避免各类差错事故的发生,保证准确及时发出病理报告,根据我院实际情况特制订以下规定。 一、手术中取下的标本(不论组织大小),都必须送做病理检查, 不得随意丢弃。 二、凡需手术的患者,由主管医生术前填写《病理申请单》,于 手术当天与病历一起送入手术室。手术中切下的标本由巡 回护士放入容器内,按规定将标本完全浸入10%中性福尔马 林溶液或95%乙醇溶液内,并贴好标码(患者姓名、住院号),送交手术室专职人员登记签收。 三、送检的病理标本连同病理申请单由手术室专职人员送到病 理科,负责送检标本人员必须带上“病理标本签收簿”,由 病理科工作人员核对无误签收后方能留下标本。 四、凡送检冰冻病理标本,手术医师必须按要求填写冰冻病理 申请单,并由手术主刀或一助(特殊情况下可由手术室专 职人员)将手术标本给病人家属或委托人确认。然后由手 术室专职人员将冰冻标本、病理申请单一同送到病理科。 凡有需送冰冻检查的情况,临床医师应提前一天通知病理 科。 五、病理科收到标本后应及时操作检查,病理报告签发时限。 1、冰冻报告一般在收到标本后半小时左右发出临时冰冻报 告。如遇特殊情况应及时通知手术室,三天后发出正式冰
冻报告。
2、石蜡切片报告在实际收到标本后五个工作日内发出,如遇 特殊情况(需做酶标、特染、脱钙等)应及时发出临时报 告。 3、细胞学检查:穿刺涂片一般在穿刺后一小时发出报告,如 有特殊情况需和病人约定发出报告日期,脱落细胞检查在 收到标本后两个工作日内发出报告。 六、病理标本检查后至少保留一个月。 七、凡违反上述规定者按事件性质、后果责任到人。 八、 九、 十、 十一、 十二、 (注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资 料部分来自网络,供参考。可复制、编制,期待你的好评与关注) 十三、 十四、
临床微生物学标本采取和处理的规范化要求 正确的采取、处理与运送用于细菌培养的标本是临床细菌检验成功的关键。标本采取与处理的规范化是准确、及时地向临床提供重要的临床感染信息的基础;而标本采取与处理不当将严重影响检验结果,给临床以误导,延误对患者的正确治疗。为此,我们提出初步的参考意见,并希望在实践中不断完善。 一、血液细菌培养标本的采集和处理 临床上疑为败血症、脓毒血症或其他血液感染的患者,需做血液细菌培养以明确病原。 1.采集方法:静脉采血,以无菌操作方法抽取血液后,直接注入血培养瓶中,轻轻颠倒混匀,以防血液凝固。如果同时作需氧和厌氧培养,应先将标本接种到厌氧瓶中,再注入需氧瓶,严格防止将空气注入厌氧瓶中。 2.采血时间以及血培养份数:在患者发热期间越早越好,最好在抗菌治疗前,用药前24小时内采集2~3次血液标本,可使细菌检出率高达99%。对间歇性寒战或发热的患者,应在寒战或体温高峰到来之前0.5~1小时采血,亦可在寒战或发热后1小时采集血液标本。特殊感染患者采血培养时应遵循以下原则: (1)可疑急性发热性菌血症、败血症患者:应在使用抗菌药物之前,在24小时内从不同部位采集2~3份血液标本培养。 (2)可疑细菌性心内膜炎患者、感染性心内膜炎患者:在1~2小时内采集3份血标本培养,如果24小时后阴性,再采集两份血标本培养。 (3)不明原因发热患者:先采集2~3份血标本,抽血间隔60 min,24~36小时后体温升高之前,再采集2份血标本进行培养。因为1次血培养不足以说明问题,可能会遗漏阳性结果。
(4)可疑菌血症但血培养持续阴性时;应改变血培养方法,以获得罕见或苛养的微生物。 (5)在急性发热性疾病如脑膜炎、细菌性肺炎,需马上做抗菌治疗;或急性骨髓炎、化脓性关节炎等要紧急手术的患者,应立即从两臂分别取2份标本。 3.采血部位:采血部位通常为肘静脉。疑为亚急性心内膜炎的患者,以肘动脉或股动脉采血为宜。疑为细菌性骨髓炎或伤寒患者,在病灶或髂前(后)上棘处严格消毒后抽取骨髓。多次采血应在不同部位的血管穿刺以排除皮肤菌丛污染的可能。要避免从血管插管内取血,因插管常被污染,其培养结果不能反映真实情况。在不同部位取血,2次分离出同样菌种才是确定病原菌的有力证据。采血时要求严格无菌操作,防止皮肤正常菌群污染。 4.采血量:采血量与血培养的检出率相关,所以采血量一定要足够。成人一般为8~10ml/瓶,新生儿与婴幼儿为1~5 ml/瓶,骨髓采血量为1~2ml/瓶。 5.标本运送与保存:含血样的培养瓶应立即送往实验室;不能及时送检的标本,应将其放在室温,切忌冰箱存放,因为某些苛养菌可在低温环境中死亡,而使培养阳性率下降。 二、下呼吸道分泌物(痰培养)的标本采取和处理 下呼吸道分泌物(痰)的细菌学检查对病原学诊断起着重要作用,但痰标本的质量往往难以保证,造成病原学诊断和实际引起感染的病原菌脱节,直接影响抗菌药物的应用、甚至耐药菌的出现或流行。痰标本的细菌学检验地带网检查应注意如下几个问题。 1.标本的采集:痰液标本最好在应用抗菌药物之前采集,以深咳晨痰最好,主 要有自然咳痰法、支气管镜采集法、胃内采痰法、小儿采痰法和气管穿刺法等。
关于痰液细菌学检验的标准化操作程序 1前言 众所周知,传统习惯程序的痰标本细菌学检验其临床符合率并不高,其原因是多方面的。除了痰标本采集不规范导致的不合格标本带来的培养结果与病人感染不相符外,还因为微生物和人体的相关性本身就具有复杂性:源自细菌的致病与条件致病的辨证性,如致病菌可能为正常携带,而细菌在肺通气功能异常病人的下呼吸道的可以发生单纯定植或感染,要证明培养结果与感染的相关性是医学微生物学所面临的难题,这也使得一直以来在对于痰培养的标准化进展十分缓慢,以至在各版《全国临床检验操作规程》上也未提出相应详细可行的令全国同行公认的统一规范的标准化操作程序(SOP)和完整的痰液培养的质量控制办法。习惯程序的痰标本细菌学检验的缓慢也很不适应临床诊断治疗的迫切性[1]。故而,建立规范而快速的痰液细菌学检验的SOP对于提高呼吸系统感染病的诊治水平和控制抗生素的滥用等问题均有重要的作用 痰培养阳性率普遍教低,临床符合率差的关键因素是痰标本采集不规范,不合格痰标本将直接导致病原菌被分离的机会降低,大量正常菌群也会抑制病原菌的生长或干扰病原菌的检出,降低了临床符合率;再有就是操作程序的不规范,不重视直接涂片,检验过程控制的不严密也是导致临床符合率低的重要原因。我们通过SOP的临床应用情况的分析,痰培养阳性率和临床符合率均可能被提高,并且细菌分布统计结果显示本文与国外文献所报道的情况基本一致[2]。 对于直接涂片的意义,在于判断标本中微生物有无、类型、染色特性、形态特征,标本的污染情况,还可对痰标本中可能的病原菌初步诊断(依据人体被病原菌感染后的炎性渗出包裹和白细胞吞噬反应),判断是否存在复数菌感染,动态观察处于治疗过程中不同时期所送检的标本中病原菌情况的变化(如同种病原菌数量的增减,机体的免疫反应,菌群的交替)。甚至可以推断临床治疗疗效和病人病情的变化和转归,医院内感染的发生等,具有重要意义[3]。 为了满足高质量需求,对首代分离培养基应该进行严格的质量控制[4]。另外,对首代分离培养基的选用和搭配的合理化也需要进行探讨。 为了缩短鉴定时间,在细菌鉴定中可采用酶法鉴定:所谓酶法鉴定:国外八十年代中一些微生物学家在研究中发现由于细菌在生长分裂过程中细胞内集聚了大量的与物质代谢相关的各种酶类,可在短时间内释放到胞外(称胞外酶)可迅速分解相应底物。故而,当在高灵敏微量生化反应培养基中加入大量浓厚的菌液时,则无须细菌繁殖就能在短时间内产生反应。根据这一理论采用高灵敏微量生化反应单元与数值分类法相结合而成的酶法生化编码鉴定系统可对细菌进行快速鉴定(如API rapid 20E/NH 11n、Sensititre AP80、Mi
液细 标准化操作程序 痰液细菌学检验的标准化操作程序 卢先雷 1 前言 众所周知, 传统习惯程序的痰标本细菌学检验其临床符合率并不高,其原因是多方面的。除了痰标本采集不规范导致的不合格标本带来的培养结果与病人感染不相符外, 还因为微生物和人体的相关性本身就具有复杂性: 源自细菌的致病与条件致病的辨证性, 如致病菌可能为正常携带,
而细菌在肺通气功能异常病人的下呼吸道的能够发生单纯定植或感染, 要证明培养结果与感染的相关性是医学微生物学所面临的难题, 这也使得一直以来在对于痰培养的标准化进展十分缓慢, 以至在各版《全国临床检验操作规程》上也未提出相应详细可行的令全国同行公认的统一规范的标准化操作程序( SOP) 和完整的痰液培养的质量控制办法。习惯程序的痰标本细菌学检验的缓慢也很不适应临床诊断治疗的迫切性[1]。故而, 建立规范而快速的痰液细菌学检验的SOP 对于提高呼吸系统感染病的诊治水平和控制抗生素的滥用等问题均有重要的作用 痰培养阳性率普遍教低, 临床符合率差的关键因素是痰标本采集不规范, 不合格痰标本将直接导致病原菌被分离的机会降低, 大 量正常菌群也会抑制病原菌的生长或干扰病原菌的检出, 降低了临床符合率; 再有就是操作程序的不规范, 不重视直接涂片, 检验过程 SOP 控制的不严密也是导致临床符合率低的重要原因。我们经过的临 床应用情况的分析, 痰培养阳性率和临床符合率均可能被提高而且细菌分布统计结果显示本文与国外文献所报道的情况基本一致[2]。 对于直接涂片的意义, 在于判断标本中微生物有无、类型、染色特性、形态特征, 标本的污染情况, 还可对痰标本中可能的病原菌初步诊断(依据人体被病原菌感染后的炎性渗出包裹和白细胞吞噬反应), 判断是否存在复数菌感染, 动态观察处于治疗过程中不同时期所送检的标本中病原菌情况的变化(如同种病原菌数量的增减机体的免疫反应, 菌群的交替)。甚至能够推断临床治疗疗效和病人病情的变化和转归, 医院内感染的发生等, 具有重要意义[3]。 为了满足高质量需求, 对首代分离培养基应该进行严格的质量控制