
LabVIEW程序开发注意事项说明
1、关于LabVIEW调用的最大内存
LabVIEW程序所占最大内存为电脑总内存有关(成线性关系),即LabVIEW 程序所占内存不能超过电脑总内存与该比例系数的乘积。即使电脑的内存足够,LabVIEW程序也可能报内存满,因为此时可能达到了LabVIEW的最大内存限制。
其与Matlab程序不一样,Matlab占用内存可以无限增加,直至占满电脑的整个内存。
2、LabVIEW程序如何节省内存
LabVIEW程序为顺序执行模式,即数据流为从左向右执行。正常情况下,执行完后的变量会被从其所占用的内存中释放出来,以为后面的变量保留足够的内存。
但当涉及到强制转换时,例如不同数据类型之间的运算,不同数据类型转换。LabVIEW程序会出现红色点,此时将会强制备份数据,即该数据不会随着数据的顺序执行而释放,当备份数组时,LabVIEW程序所占内存迅速增大。
Matlab程序执行的每一个变量都会保留,其不是顺序执行数据流模式。
3、如何查看LabVIEW程序是否存在内存泄漏
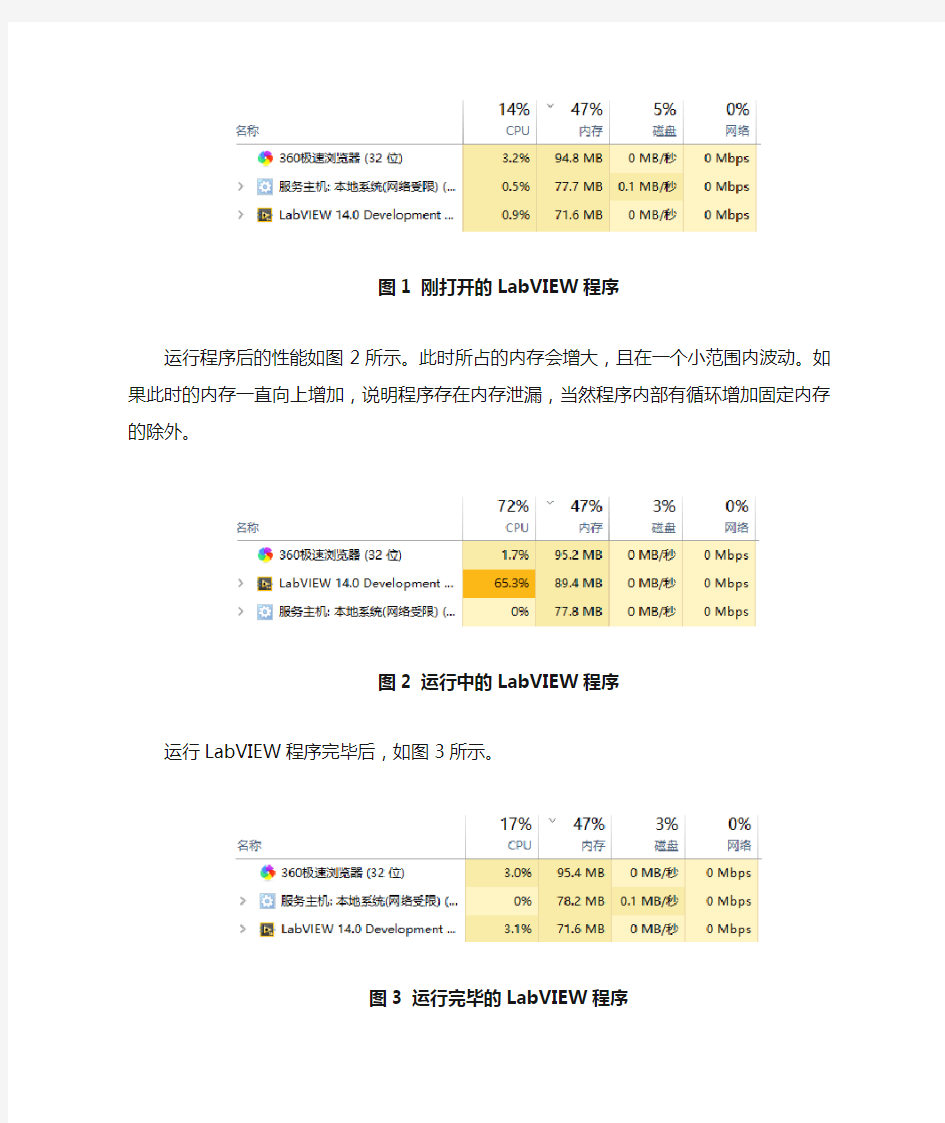
其他编程语言的内存泄漏与LabVIEW一致。打开所编写的LabVIEW程序,然后打开任务管理器->性能。打开程序后的性能如图1所示。
图1 刚打开的LabVIEW程序
运行程序后的性能如图2所示。此时所占的内存会增大,且在一个小范围内波动。如果此时的内存一直向上增加,说明程序存在内存泄漏,当然程序内部有循环增加固定内存的除外。
图2 运行中的LabVIEW程序运行LabVIEW程序完毕后,如图3所示。
图3 运行完毕的LabVIEW程序
1、Build a VI that generate a random number between zero and ten,and then divides it by an input number and diaplays the result on the front panel.If the input number is zero,the VI lights an LED to flag a “divide by zero”error 2、3-1,P43 3、Try create a VI to compute n! 4、求500个随机数中的最大值和最小值。 5、3-3,P44 6、3-4,P46 7、3-5,P49 If implement this equation using regular G arithmetic functions,the block diagram looks like the one in the following illustration.Please imolement the same equation using a Formula Node,and add event to control when the VI executes.
8、设计一个简单信号源,能选择正弦波、三角波和方波并用Waveform Graphe显示。 9、4-1,P68 10、4-5,P72 11、(1)显示一个二维数组的行数和列数(2)查找一个二维数组中最大值,以及最大值在数组中的位置。
12、5-2,P89 13、6-1,P100 14、6-3,P103 15、7-4,P120 16、7-5,P121 17、双边傅里叶
报批细节 1、技术档案: 技术人员简历表、培训档案、要求有实质性文件如每人的学历证书、上岗证、科研成果(课题)、技术文章、获奖证书等的复印件 2、仪器档案: 实验室所有仪器的购买、使用、校正、放置地点、出厂编号、说明书复印件等 实验室所有仪器维护校正记录如:加样器、温度计、温湿度计需出具计量局校正报告文件(可每种只校正一套作为标准)。 扩增仪需有仪器厂家专业技术人员维护校正报告,和校正后的参数。 加样器的出厂编号、使用时间、校正记录。 5700维护后验证记录—用同一公司或校准试剂或用自制质控血清并记录数值 3、其他细节: 垃圾处理:按生物污染性制品,交医院统一处理。 仪器简单操作流程 标记笔、枪头盒等一些小物品都要标明分区。 仪器的申请、采购、使用、验证程序 样本采集(针对临床医护人员)、运输、收集程序 样品的唯一编号原则—应区分开不同天、不同种类的标本 标本的保存程序—包括处理前、刚处理后、报告发放后的原始标本(原则上至少保留一周)应有专人负责。 检测结果的保存、备份记录、质控记录保存,除电脑记录外应有相应的手抄记录(类似于基因日检测统计表类型的)。 抱怨记录—应有时间、事件(项目)、接待人、处理方法、处理结果、处理人签字确认
注意事项 1、回答任何问题都应与自己写的SOP文件相一致."写你所做的,做你所写的". 2、SOP文件不能写的太虚,无法做到的东西不要写,比如公司版的SOP文件里的加样器的校准一般实验室就做不到.模棱两可也不要写,比如"消毒时间一到两小时"不能这样写,多少就是多少. 3、处理标本要在生物安全柜内,而加样则在柜外. 4、各区门口要贴有各区的工作制度,限入标志.还要准备两个登记本,一个来记录紫外消毒,一个来记录工作人员出入.区内还要有一个工作记录本,用来记录各区每天的工作内容,便于监测每天的工作全过程. 5、每把枪的用途要清楚,不能弄乱.比如稀释阳模的枪和处理标本的枪不可混用. 6、普通离心机处理分泌物标本时应在离心后静置20分钟才能开盖.(许斌这样认为) 7、所有仪器、设备都要有档案卡. 8、所有的清洁消毒要在实验结束后马上进行,尤其是仪器、设备.像扩增仪,每天都要清洁,做完的反应管决对不能留在样品槽内。 9、各区的拖把、抹布不得混用,标记清楚. 10、生物防护意识要强,手套要随时更换.生物防护安全的保证要从三个方面:制 度、硬件、意识。 11、爆管如何处理:立即停止实验,水浴里的水要倒掉,冲洗.所有可能污染的地方 要用消毒液擦洗,紫外照射,通风排风. 12、各区应有日常工作核查表,做为每天工作记录的补充. 13、各区要有泡有消毒液的生物污物桶,用来处理生物垃圾. 14、验收组带来的标本要按平时对待临床标本一样处理,要有接收记录,结果登记 等. 15、拒绝电话或代领等非正常方式发放报告单. 16、存放标本的冰箱要上锁,钥匙及电脑资料的密码要由本科室人员专人保管. 17、报告单上要注明试剂的检测下限,不能写成参考范围.除了有操作者,还要有 核校者,且两者姓名除了电子打印还要用手签.定量结果不能有阴阳性提示,
PCR疑难解答 当PCR结果不甚满意时,首先检查以下几方面并遵照执行: 将PCR反应的试管与反应板紧贴。 当酶反应混合物以70℃“热启动”开始循环时,切记在加入酶后稍微振荡一下,因为在0.2-ml 的PCR管中不能均匀传热。 不要随意减少dNTP的用量,它是一个系统的因素,必须与其它成份保持平衡。 对于有问题的PCR反应,例如模板的量少,模板不纯和环状模板等,先尝试加Taq酶前的体系进行预变性,后加模板进行正常PCR扩增。 没有扩增产物: 在提供MgCl2缓冲液中,以0.25mmol/L为梯度增加MgCl2浓度;无MgCl2的缓冲液以0.5 mmol/L为梯度增加MgCl2浓度。 泳道中出现模糊条带,如果DNA模板中存在RNA,则按上述提示浓度补加MgCl2,因为在PCR反应中可能缺少游离的Mg2+。 检查退火温度和变性条件,如果有需要的话,可降低退火温度。 检查模板和引物的用量。 增加循环次数和/或模板DNA的用量。 泳道中出现模糊条带: 减少循环次数或模板DNA的用量。 提高退火温度,但不要超过68℃。 重新设计引物或设计更长的引物。 其他值得注意的条件: 建议使用0.2-ml薄壁管。厚壁管在92℃时不能有效地使模板变性。 最佳反应体积为50ml,推荐用30ml矿物油覆盖(对盖子加热的PCR仪可以不加)。 大多数反应中,0.75ml(0.5~1ml)的酶量在大多数情况下可以得到满意的结果。 建议使用1.75mmol/L MgCl2∶350mmol/L dNTP或2.25mmol/L MgCl2∶500mmol/L dNTP 组合的混合物。然而要得到最佳结果,优化Mg2+的浓度是必需的。 基因组DNA模板的质量显著影响PCR反应。因此推荐使用琼脂糖凝胶电泳来检测DNA的长度。DNA片段长度可以超过50kb,传统的基因组DNA能扩增片段至10kb。 要扩增更长的片段应使用超纯或高分子量的DNA。请查阅高分子量DNA提取操作过程相关文献。 降低二级结构和引物二聚物形成的可能性。进行长片段PCR扩增时,引物长度一般为24~34个核苷酸,溶点在60~68℃间。使用这类引物可提高PCR反应的退火温度来增加反应的特异性。这点非常重要,长片段扩增的效果往往受到非特异性短片段优先扩增的影响。 变性:第一步变性在94℃下进行2分钟。在循环过程中尽可能缩短变性时间(94℃下进行20--30秒),除非模板中富含GC,则95℃下变性30秒。这可以防止DNA脱嘌啉和链断裂,对于所需扩增的基因组DNA片段终长度超过12 kb时,应该尽可能的降低变性温度。 延伸:68--72℃下进行延伸操作。 循环延伸:尽量采用循环延伸的条件,若PCR仪无此功能,则必须增加延伸的时间,例如在扩增10kb片断时,延伸时间用10分钟替代原来的8分钟。 长片断PCR系统扩增的片断其3’-末端带有一个突出的A,因此建议采用T/A克隆。若要进行平端可隆,可用Klenow酶和T4 DNA多聚酶将PCR产物补平后再进行。 测序时因酶的混合物带有3’→5’外切酶活性,用Sanger方法进行测序不能产生均一的(染色体)带型。
串口通信的基本概念 串口通信的基本概念 1,什么是串口? 2,什么是RS-232? 3,什么是RS-422? 4,什么是RS-485? 5,什么是握手? 1,什么是串口? 串口是计算机上一种非常通用设备通信的协议(不要与通用串行总线Universal Serial Bus或者USB混淆)。大多数计算机包含两个基于RS232的串口。串口同时也是仪器仪表设备通用的通信协议;很多GPIB兼容的设备也带有RS-232口。同时,串口通信协议也可以用于获取远程采集设备的数据。 串口通信的概念非常简单,串口按位(bit)发送和接收字节。尽管比按字节(byte)的并行通信慢,但是串口可以在使用一根线发送数据的同时用另一根线接收数据。它很简单并且能够实现远距离通信。比如IEEE488定义并行通行状态时,规定设备线总常不得超过20米,并且任意两个设备间的长度不得超过2米; 而对于串口而言,长度可达1200米。
典型地,串口用于ASCII码字符的传输。通信使用3根线完成:(1)地线,(2)发送,(3)接收。由于串口通信是异步的,端口能够在一根线上发送数据同时在另一根线上接收数据。其他线用于握手,但是不是必须的。串口通信最重要的参数是波特率、数据位、停止位和奇偶校验。对于两个进行通行的端口,这些参 数必须匹配: a,波特率:这是一个衡量通信速度的参数。它表示每秒钟传送的bit的个数。例如300波特表示每秒钟发送300个bit。当我们提到时钟周期时,我们就是指波特率例如如果协议需要4800波特率,那么时钟是4800Hz。这意味着串口通信在数据线上的采样率为4800Hz。通常电话线的波特率为14400,28800和36600。波特率可以远远大于这些值,但是波特率和距离成反比。高波特率常常用于放置的很近的仪器间的通信,典型的例子就是GPIB 设备的通信。 b,数据位:这是衡量通信中实际数据位的参数。当计算机发送一个信息包,实际的数据不会是8位的,标准的值是5、7和8位。如何设置取决于你想传送的信息。比如,标准的ASCII码是0~127(7位)。扩展的ASCII码是0~255(8位)。如果数据使用简单的文本(标准 ASCII码),那么每个数据包使用7位数据。每个包是指一个字节,包括开始/停止位,数据位和奇偶校验位。由于实际数据位取决于通信协议的选取,术语“包”指任何通信 的情况。 c,停止位:用于表示单个包的最后一位。典型的值为1,1.5和
LabVIEW的基本控件与基本函数 LabVIEW基本控件:数值、布尔、字符串与路径、数组与簇、图形、枚举1、数值:数值输入控件与数值显示控件(数值输入控件有增量/减量按钮;输入为白色背 景,输出为灰色背景) 默认数据类型为:双精度,橙色。 2、布尔:值默认为False,图标为绿色。 布尔控件的机械动作属性 单击时转换:按下按钮时改变状态,再次单击后恢复原状态。与VI是否读取控件无关。(可赋值恢复)类似开关按钮 释放时转换:按下按钮时保持当前状态,直到释放按钮,再次单击后恢复原状态。与VI是否读取控件无关。(可赋值恢复)类似开关按钮 保持转换直到释放:按下按钮时改变状态,直到释放按钮,,再次单击后恢复原状态。与VI 是否读取控件无关。(可赋值恢复)。类似开关按钮 单击时触发:按下按钮时改变状态,LabVIEW再次读取控件值后返回原状态。 释放时触发::按下按钮时保持当前状态,释放时改变状态,LabVIEW再次读取控件值后返回原状态。 保持触发直到释放:按下按钮时改变状态,直到释放按钮,LabVIEW再次读取控件值后返回原状态。
3、字符串与路径:(字符串输入控件与字符串显示控件),粉色。 4种显示方式(正常显示、’\’代码显示、密码显示、十六进制显示) 4、数组:依据加入的控件类型同样分为输入控件与显示控件 LabVIEW的数组以索引号0表示数组的首个数据。 增加数组维度的方法:(1)索引框的快捷菜单中->增加维度 (2)直接向下拖动索引框 (3)属性对话框->外观选项卡->维 数组中的元素为同类型的控件,可以是各种类型的控件,但不能是数组的数组。数组的多态性: 5、簇:依据加入的控件类型同样分为输入控件与显示控件 簇本身的属性:重新排序簇中控件、自动调整大小(无、调整为匹配大小、水平排列、垂直排列) 使用簇结构时,尽可能的使用:严格自定义类型。 错误簇:状态(布尔)、代码(数值输入)、源(字符串输入)
labview教程——如何判断字符串包含的是数字 字符串编程是Labview 编程的难点之一,有的时候,用一整天的时间做一个 字符串处理的VI 是常有的事,尤其是对各类专用设备特殊的通讯协议和祯结构. 从最简单的无符号10 进制整数谈起1.无符号DEC 整数 比如字符串”1234”,显然它包括的全部是数字,而不是字符(如A,B,C 等),问题是如何在程序中判定.无符号10 进制整数只包含0,1..9,因此可以借助C 语言的方法,用ASCII 值来判定.0 的ASCII 是0X30,1..9 分别是0X31..0X39,通过把字符串转换成U8 数组,U8 数组里保存的是字符的ASCII 值.LABVIEW 中提供了判 断10 进制字符的节点,IS DEC DIGIT?,用它可以简化程序,同时它是个多态的VI,LABVIEW 专门有一个例子程序说明它的使用方法,需要说明的是对于一个字符串,它只判断第一个字符.看看它接受的输入类型.因此,更简单地判断10 进制 无符号整数的方法如下图所示:同理,LABIVEW 同时提供了判断16 进制,8 禁止 的节点,因此可以方便地利用上面的方法判断是否是16 进制和8 进制的数字字 符串.LABVIEW 没有提供判断二进制字符串的方法,不过只需要把上面的0X39 改成0X31 就可以判断是否是二进制字符串.2.无符号浮点数的判定无符号的浮 点数,比如1.234 与无符号整数比较,只需要判定是否包含小数点就可以了,另外 有的整数用逗号表示千位分割符号,也可以采用类似的方法判定https://www.doczj.com/doc/a614758027.html,BVIEW 特 殊类型表示方法LABVIEW 有几种数值表示方法这样判断起来就非常复杂,需要包括+ - E K M 等的判断.下面提供一种通用的判断方法,虽然通用,相应效率也比较低,如果知道确切格式,用上面的方法比较合适可以直接判断+,-,科学记数法,不支持SI,逗号等 tips:感谢大家的阅读,本文由我司收集整编。仅供参阅!
PCR操作时应注意的事项 PCR检测微量感染因子时,容易因为污染的而导致各种问题,因此,进行PCR操作时,操作人员应该严格遵守一些操作规程,最大程度地降低可能出现的PCR污染或杜绝污染的出现。 (1)划分操作区:目前,普通PCR尚不能做到单人单管,实现完全闭管操作,但无论是否能够达到单人单管,均要求实验操作在三个不同的区域内进行,PCR的前处理和后处理要在不同的隔离区内进行: ①标本处理区,包括扩增摸板的制备; ②PCR扩增区,包括反应液的配制和PCR扩增; ③产物分析区,凝胶电泳分析,产物拍照及重组克隆的制备。 各工作区要有一定的隔离,操作器材专用,要有一定的方向性。如:标本制备→PCR 扩增→产物分析→产物处理。 切记:产物分析区的产物及器材不要拿到其他两个工作区。 (2)分装试剂:PCR扩增所需要的试剂均应在装有紫外灯的超净工作台或负压工作台配制和分装。所有的加样器和吸头需固定放于其中,不能用来吸取扩增后的DNA和其他来源的DNA: ①PCR用水应为高压的双蒸水; ②引物和dNTP用高压的双蒸水在无PCR扩增产物区配制; ③引物和dNTP应分装储存,分装时应标明时间,以备发生污染时查找原因。 (3) 实验操作注意事项尽管扩增序列的残留污染大部分是假阳性反应的原因,样品间的交叉污染也是原因之一。因此,不仅要在进行扩增反应是谨慎认真,在样品的收集、抽提和扩增的所有环节都应该注意: ①戴一次性手套,若不小心溅上反应液,立即更换手套; ②使用一次性吸头,严禁与PCR产物分析室的吸头混用,吸头不要长时间暴露于空气中,避免气溶胶的污染; ③避免反应液飞溅,打开反应管时为避免此种情况,开盖前稍离心收集液体于管底。若不小心溅到手套或桌面上,应立刻更换手套并用稀酸擦拭桌面; ④操作多份样品时,制备反应混合液,先将dNTP、缓冲液、引物和酶混合好,然后分装,这样即可以减少操作,避免污染,又可以增加反应的精确度; ⑤最后加入反应模板,加入后盖紧反应管; ⑥操作时设立阴阳性对照和空白对照,即可验证PCR反应的可靠性,又可以协助判断扩增系统的可信性; ⑦尽可能用可替换或可高压处理的加样器,由于加样器最容易受产物气溶胶或标本DNA的污染,最好使用可替换或高压处理的加样器。如没有这种特殊的加样器,至少PCR 操作过程中加样器应该专用,不能交叉使用,尤其是PCR产物分析所用加样器不能拿到其它两个区; ⑧重复实验,验证结果,慎下结论。 威斯腾生物400 675 6758
图象处理方法在车灯配光检测系统中的应用研究 Image Processing T echnique’s Application and Research in the Automobile Lamp Quality Measurement System 作者:金晅宏 戴曙光 穆平安 单位:上海理工大学光电学院 应用领域:汽车工业 使用的产品:LabVIEW ; NI-IMAQ ;NI-DAQ ; 挑战:将成熟的计算机视觉技术 引入车灯配光检测系统中,应用多种图象处理方法同时实现汽车车灯光轴交点检测和车灯零件检测。 应用方案:使用National Instruments 公司的IMAQ 可视化软件、LabVIEW 图片控制工具包、执行程序生成器和LabVIEW 来开发一个经济、灵活的基于PC 的车灯配光检测系统。 介绍: 车灯配光检测系统原为两套系统:车灯光轴交点检测系统和车灯零件检测系统,其通过人工目测检测车灯光轴交点,应用物位传感器精确定位来检测零件的缺损。本车灯配光检测系统将两系统二合为一,根据测量对象的特征,应用图象卷积、边缘特征提取、图象模式匹配等多种图象处理的方法,实现对不同型号的车灯进行车灯零件缺损检测和车灯光轴交点的自动检测。 系统组成: 整个系统包括硬件部分和软件部分。其系统组成简图如图1所示: 图1:系统组成简图 硬件部分主要运用黑白的CCD 摄取图象,图象通过美国NI 公司的1407图象采集卡传送入PC 机进行处理及数据显示,应用NI_DAQ6023卡控制摄像头间的切换及系统的启动和停止。本系统采用NI 公司的LabVIEW5.1及其图象处理软件包IMAQ Vision5.0作为软件操作平台。其系统的主界面如下图(图2)所示: 图2:系统主界面 系统运行中的一个检测报错界面如下图(图3)所示: 图3:检测报错界面 运用NI (美国国家仪器公司)的这套虚拟开发平台软件,是因为其使用图形化编程语言编写,并提供丰富的库函数和功能模块,具有功能强大及运用灵活等特点,极大的节约了程序开发时间。 光轴交点检测中的图象预处 理方法 (1) 光轴特征分析 本车灯配光检测系统实现计 算机自动检测车灯前照灯光路所成的交点。若为一右侧行驶前照灯, 则其光路图如图4所示: 图4:前照灯光路图 h-h :通过前照灯焦点的水平面; H-H2:道路中心线; v-v :通过前照灯的垂直面; 根据前照灯光路标准H —H2与h —h 的夹角为15°,且ZONE1 为暗区,而ZONE2为亮区,两个区域分界明显,有较大的亮度对比度。H-H2与h-h 的交点位置是车灯光轴检测的一个重要参数。 (2) 图象的原始LUT 变 换 LUT (Look_up Table )变换是一种 很基本的图象处理技术,其对图象象素的灰度值进行特定计算及转换,可以达到突出图象的有用信息,增加图象的光对比度,对要进行边缘检测的图象尤佳,可以使边缘明显。本系统的车灯光轴原始图如图5所示: 图5:光轴原始图
LabVIEW课程设计 报告书 班级 学号 姓名 一、基础题
1、用labview的基本运算函数编写以下算式的程序代码: 首先在前面板创建一个数值输出控件,然后在程序框图中按照上图连接线路,点击运行,程序结果。 2、利用摄氏温度与华氏温度的关系C = 5(F ?32) / 9编写一个程序,求华氏温度 (F)为32, 64, 4, 98.6 , 104, 212时的摄氏温度。
在程序前面板创建一个数值输入控件和一个数值显示控件,在程序框图中添加一个公式节点,添加一个输出和一个输入分别输入和显示控件项链,在公式节点框图中输入温度转换公式,然后在面前扮输入相应的温度点击运行,得到相应的结果。 3、创建一个2行3列的二维数组控制件,为数组成员赋值如下: 00 .600.500.400.300.200.1 在前面板创建一个数组显示控件,然后将1、2、3创建成数组第一行,4、5、6创建成数组第二行,再将两行创建成一个两行三列的二位数组,点击运行显示输 出结果。 4、用数组创建函数创建一个二维数组显示件,成员为:
1 2 3 4 5 6 2 3 4 5 6 1 3 4 5 6 1 2 4 5 6 1 2 3 编程将上述创建的数组转置为: 1 2 3 4 2 3 4 5 3 4 5 6 4 5 6 1 5 6 1 2 6 1 2 3 先在面前板上创建一个上图这样的数组。再创建两个显示数组(一个为显示数组,另一个为转换后数组),在程序框图上面按照下图连线,在原数组和转换后数组之间接一个“二维数组转制”, 点击运行后显示为:
5、创建一个簇控制件,成员分别为字符型控制件姓名,数值型控制件学号,布 尔型控制件注册。从这个簇控制件中提取出簇成员注册,显示在前面板上。 在面板上添加一个簇,在族里分别添加一字符显示控件,数值显示控件,布尔型 显示控件,程序框图连接如图: 先解除捆绑然后再捆绑,输入姓名、学号点击运行在输出簇里显示。 6、创建一个字符串显示件,程序运行后显示当前系统日期、时间和自己的班级、姓名。
逆转录RT-PCR操作注意事项 RT-PCR操作有三步: 第一,RNA提纯; 第二,RT逆转录; 第三,PCR聚合酶反应 1.做RT前必需测RNA浓度,逆转录体系对RNA量还是有一些要求,常用500ng或1ug。 2.RT按要求做,一般不会出太大问题。 3.PCR,按常规。但如需扩长片段,则对前两步要求较高,需要有完整的cDNA存在,不是单改变Mg2+浓度、退火温度能解决的。 1)RT和PCR时的引物设计有3种方法: a:Random 9mers; b:OligodT-Adaptor Primer; c:特异的下游引物。 如果用a和b方法,是扩增的所有的cDNA(理论上),还要用此产物做PCR 的模板继续扩增。如果用c方法,那么要去那里查它的序列呢?https://www.doczj.com/doc/a614758027.html, 1.RT-PCR有两种做法: 条件具备的话可用kit进行一步法进行;若条件不太好的话可分两步进行逆转录再PCR。但后来发现两步法的结果更加理想,条带特异性强且无拖尾现象,我推测是体系更加单一比较利于PCR的进行,当然也可能是我买的kit不太好。(promega)。 2.RT-PCR应具备的条件 高质量的RNA(保留后可做5',3'RACE);引物的(最好产物短点);若涉及粗略定量的话还应考虑RNA的浓度或是cDNA的浓度(如果由内标分子更好,但我发现其实很不容易将RNA的浓度以及内标分子的表达量调整的完全一样);体系的均一性等。 3.RACE 我做过RACE(3'RACE是宝生物的Kit;5'RACE是Gibico),但现在再进行另一个同源基因的3'RACE时却怎么也P不出来,这两个基因是由同一对引物扩增出来的,其中一个已经获得了全序列(RACE的方法),而另一个基因的3'UTR却怎么也扩不出来,我推测是不是该基因的3'UTR太长的缘故,我都快绿了,有无RT-PCR的常用内标b-actin 和GAPDH的使用有选择性吗?比如不同的细胞,不同的刺激。 有关内参的几点建议: 一定要做内参的,每一次,我想。不作内参的结果是不可信的。 (1)半定量和定量RT-PCR做的都是基因相对表达量,不是绝对表达量;
相对定量方法实际操作 (常用方法) 1. Comparative Delta-delta Ct法定量流程(RG6000软件设置) 1).先对样品中的目的基因与看家基因分别做标准曲线,通过标准曲线确定两个 基因的扩增效率是否一致或接近;将扩增效率优化为一致。 2).同一样品分别进行看家基因和目的基因的扩增,分列在两页中 公式: P1 P2 F=2— 待检样品看 家基因平均 Ct值 对照组目的 基因平均Ct 值 对照组看家 基因平均Ct 值 — 待检样品目 的基因平均 Ct值 ——
Comparative Delta-delta Ct法的特点、注意事项及实际应用 1). Comparative Delta-delta Ct法是很常用的一种相对定量方法,其最大特点 是,当优化的体系已经建立后,在每次实验中无需再对看家基因和目的基因做标准曲线,而只需对待测样品分别进行PCR扩增即可。 2). 其缺点是,每次实验都默认目的基因和看家基因的扩增效率一致,而并非真 实扩增情况的反映,这里势必存在一定的误差。 3). Comparative Delta-delta Ct法展开定量实验前,在预实验中,必需对目的基 因和看家基因做两组标准曲线。Rotor-Gene 的软件会自动给出两组标准曲线的R值、扩增效率等信息,如果两组标准曲线的斜率,即M值的差小于,那么后续实验中就可以用Comparative Delta-delta Ct法进行相对定量分析。 反之,如果M差值大于,就无法用该方法进行相对定量分析。此时的解决方法有两种,一是优化实验,使两组标准曲线的斜率差值小于,二是换用其它的相对定量方法。 应用实例: 如上图,将标准品进行梯度稀释后,分别对目的基因(Gene of Interest)和看家基因(Housekeeper Gene)做标准曲线。软件自动绘制标准曲线,并给出相应的参数。从上图可知,两组标准曲线的M值分别为和,两者的差值<,因此,
PCR 一、PCR的原理 PCR,Polymerase Chain Reaction,聚合酶链式反应,由Kary Mullis博士在1985年于美国的PE-Cetus公司工作期间发明。该技术基本原理如下: 在模板DNA、primers和4种dNTPs存在下,依赖于DNA polymerase的酶促合成反应。DNA polymerase以单链DNA为模板,借助一小段双链DNA来启动合成,通过一个或两个人工合成的寡核苷酸引物与单链DNA模板中的一段互补序列结合,形成部分双链。在适宜的温度和环境下,DNA聚合酶将脱氧单核苷酸加到引物3′-OH末端(退火),并以此为起始点,沿模板5′→3′方向延伸,合成一条新的DNA互补链的过程并依次循环。 1.PCR反应的基本成分 包括:Templates DNA(待扩增DNA)、Primers、4种脱氧核苷酸(dNTPs)、DNA聚合酶和适宜的Buffer(对于高GC含量的模板有时加入3% DMSO)。类似于DNA的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。 2.PCR由变性--退火--延伸三个基本反应步骤构成: ①.模板DNA的变性:模板DNA经加热至94℃左右一定时间后,使模板DNA双链或经PCR扩增形成的双链DNA解离,成为单链,以便它与引物结合,为下轮反应做准备; ②.模板DNA与引物的退火(复性):模板DNA经加热变性成单链后,温度降至55℃或60℃左右,引物与模板DNA单链的互补序列配对结合; ③.引物的延伸:DNA模板--引物结合物在Taq DNA聚合酶或Phusion DNA聚合酶或Pfu DNA聚合酶的作用下,以dNTPs为原料,靶序列为模板,按碱基互补配对半保留复制原理,合成一条新的与模板DNA 链互补的半保留复制链,新链又可成为下次循环的模板。 3.PCR的反应动力学 PCR的三个反应步骤反复进行,使DNA扩增量呈指数上升。反应最终的DNA 扩增量可用Y=(1+X)n计算。Y代表DNA片段扩增后的拷贝数,X表示实际扩增效率,平均约为75%,n代表循环次数。平均扩增效率的理论值为100%,但在实际反应中平均效率达不到理论值。如果进行30个Cycles,实际扩增倍数往往为106-107(理论上以Y=2n计算,为109)。反应初期,靶序列DNA片段的增加呈指数形式,随着PCR产物的逐渐积累,被扩增的DNA 片段不再呈指数增加,而进入线性增长期或静止期,即出现“停滞效应”,这种效应称平台期。PCR 扩增效率及DNA聚合酶、PCR的种类和活性及非特异性产物的竟争等因素与之都有
实验名称:LabVIEWIO输出实验 组号:62 同组者:日期: 4.28 【一】实验目的 学习和掌握LabVIEW串口通信的工作原理、功能和使用方法; 使用示波器测量电信号的各种参数; 【二】实验主要仪器设备 一台安装LabVIEW 、Proteus、IN_VISA串口通讯协议驱动和虚拟串口软件VSPD 的PC 机; 单片机实验板。 【三】实验原理 在串口通信中,由于实际上传输的是ASCII码,但是一般字符串控件显示出来的并不是其对应的ASCII码,关于字符串正常显示和十六进制显示,LabVIEW帮助文档里面是这么写的: 正常显示------可打印字符以控件字体显示。不可显示字符通常显示为一个小方框。 十六进制显示------每个字符显示为其十六进制的ASCII值,字符本身并不显示。 比方说对于01这个字符串,如果是正常显示情况下输入01,下位机接收的是其对应的ASCII码而不是01本身;如果是十六进制显示情况下输入01,下位机接收的是十六进制的01。上位机接收下位机发送的字符串同样是ASCII码,一般情况下如果不加转换,在正常显示情况下是乱码,在使用LabVIEW在编程处理直接处理这些字符串的时候,就会出现问题了。于是很多时候需要对字符串正常显示和十六进制显示做一个强制转换,以方便处理。 正常显示至十六进制显示强制转换,一般用于VISA Write:
需要注意的是,在输入端Normal Display String输入的时候要确保字符是以两位的格式输入,比如需要输入1,格式要为01,否则会出错。 十六进制显示至正常显示强制转换,一般用于VISA Read: 【四】实验内容 a. 实验步骤
影响PCR的主要因素 PCR技术必须有人工合成的合理引物和提取的样品DNA,然后才进行自动热循环,最后进行产物鉴定与分析。引物设计与合成目前只能在少数技术力量较强的研究院、所进行,临床应用只需购买PCR 检测试剂盒就可开展工作,PCR自动热循环中影响因素很多,对不同的DNA样品,PCR反应中各种成份加入量和温度循环参数均不一致。现将几种主要影响因素介绍如下。 一、温度循环参数 在PCR自动热循环中,最关键的因素是变性与退火的温度。如操作范例所示,其变性、退火、延伸的条件是:94℃60s, 37℃60s, 72℃120s,共25~30个循环,扩增片段500bp。在这里,每一步的时间应从反应混合液达到所要求的温度后开始计算。在自动热循环仪内由混合液原温度变至所要求温度的时间需要30~60s,这一迟滞时间的长短取决于几个因素,包括反应管类型、壁厚、反应混合液体积、热源(水浴或加热块)以及两步骤间的温度差,在设置热循环时应充分给以重视和考虑,对每一仪器均应进行实测。 关于热循环时间的另一个重要考虑是两条引物之间的距离;距离越远,合成靶序列全长所需的时间也越长,前文给出的反应时间是按最适于合成长度500bp的靶序列拟定的。下面就各种温度的选择作一介绍。 1.模板变性温度变性温度是决定PCR反应中双链DNA解链的温度,达不到变性温度就不会产生单链DNA模板,PCR也就不会启动。变性温度低则变性不完全,DNA双链会很快复性,因而减少产量。一般取90~95℃。样品一旦到达此温度宜迅速冷却到退火温度。DNA变性只需要几秒种,时间过久没有必要;反之,在高温时间应尽量缩短,以保持Taq DNA聚合酶的活力,加入Taq DNA聚合酶后最高变性温度不宜超过95℃。 2.引物退火温度退火温度决定PCR特异性与产量;温度高特异性强,但过高则引物不能与模板牢固结合,DNA扩增效率下降;温度低产量高,但过低可造成引物与模板错配,非特异性产物增加。一般先由37℃反应条件开始,设置一系列对照反应,以确定某一特定反应的最适退火温度。也可根据引物的(G+C)%含量进行推测,把握试验的起始点,一般试验中退火温度Ta(annealing temperature)比扩增引物的融解温度TTm(melting temperature)低5℃,可按公式进行计算: Ta = Tm - 5℃= 4(G+C)+ 2(A+T) -5℃ 其中A,T,G,C分别表示相应碱基的个数。例如,20个碱基的引物,如果(G+C)%含量为50%时,则Ta的起点可设在55℃。在典型的引物浓度时(如0.2μmol/L),退火反应数秒即可完成,长时间退火没有必要。 3.引物延伸温度温度的选择取决于Taq DNA聚合酶的最适温度。一般取70~75℃,在72℃时酶催化核苷酸的标准速率可达35~100个核苷酸/秒。每分钟可延伸1kb的长度,其速度取决于缓冲溶液的组成、pH值、盐浓度与DNA模板的性质。扩增片段如短于150bp,则可省略延伸这一步,而成为双温循环,因Taq DNA聚合酶在退火温度下足以完成短序列的合成。对于100~300bp之间的短序列片段,采用快速、简便的双温循环是行之有效的。此时,引物延伸温度与退火温度相同。对于1kb以上的DNA 片段,可根据片段长度将延伸时间控制在1~7min,与此同时,在PCR缓冲液中需加入明胶或BSA试剂,使Taq DNA聚合酶在长时间内保持良好的活性与稳定性;15%~20%的甘油有助于扩增2.5kb左右或较长DNA片段。 4.循环次数常规PCR一般为25~40个周期。一般的错误是循环次数过多,非特异性背景严重,复杂度增加。当然循环反应的次数太少,则产率偏低。所以,在保证产物得率前提下,应尽量减少循环次数。 扩增结束后,样品冷却并置4℃保存。 二、引物引物设计 要扩增模板DNA,首先要设计两条寡核苷酸引物,所谓引物,实际上就是两段与待扩增靶DNA序列互补的寡核苷酸片段,两引物间距离决定扩增片段的长度,两引物的5’端决定扩增产物的两个5’末端位置。由此可见,引物是决定PCR扩增片段长度、位置和结果的关键,引物设计也就更为重要。
完成PCR实验注意事项 聚合酶链式反应(Polymerase Chain Reaction,PCR)是一种体外核酸扩增系统,其原理类似DNA分子的天然复制过程,是将在待扩增的DNA片段和与其两侧互补的两个寡聚核苷酸引物,经变性、退火和延伸若干个循环后,DNA扩增2n 倍。该技术已成为分子生物学中一种有助于DNA克隆及基因分析的必需工具。 PCR操作时应注意事项 PCR检测微量感染因子时,容易因为污染而导致各种问题,因此,进行PCR操作时,操作人员应该严格遵守一些操作规程,最大程度地降低可能出现的PCR污染或杜绝污染出现。 (1)划分操作区 目前,普通PCR尚不能做到单人单管,实现完全闭管操作,但无论是否能够达到单人单管,均要求实验操作在三个不同的区域内进行,PCR的前处理和后处理要在不同的隔离区内进行: ①标本处理区,包括:扩增摸板制备; ② PCR扩增区,包括:反应液的配制和PCR扩增; ③产物分析区,凝胶电泳分析,产物拍照及重组克隆制备。 ※各工作区要具有一定隔离,操作器材专用,要有一定方向性,如,标本制备→PCR扩 增→产物分析→产物处理。 切记:产物分析区的产物及器材不要拿到其他两个工作区。 (2)分装试剂 PCR扩增所需要的试剂均应在装有紫外灯的超净工作台或负压工作台配制和分装,所有的加样器和吸头需固定放于其中,不能用来吸取扩增后的DNA和其他来源DNA: ①PCR用水应为高压的双蒸水; ②引物和d-NTP用高压的双蒸水在无PCR扩增产物区配制; ③引物和d-NTP应分装储存,分装时应标明时间,以备发生污染时查找原因。 (3)实验操作注意事项 尽管扩增序列的残留污染大部分是假阳性反应的原因,样品间的交叉污染也是原因之一。因此,不仅要在进行扩增反应是谨慎认真,在样品的收集、抽提和扩增的所有环节都应该注意。 ②一次性手套,若不小心溅上反应液,立即更换手套; ②使用一次性吸头,严禁与PCR产物分析室的吸头混用,吸头不要长时间暴露于空气中,避免气溶胶的污染; ③避免反应液飞溅,打开反应管时为避免此种情况,开盖前稍离心收集液体于管底。若不小心溅到手套或桌面上,应立刻更换手套并用稀酸擦拭桌面; ④操作多份样品时,制备反应混合液,先将dNTP、缓冲液、引物和酶混合好,然后分装,这样即可以减少操作,避免污染,又可以增加反应的精确度; ⑤最后加入反应模板,加入后盖紧反应管; ⑥操作时设立阴阳性对照和空白对照,即可验证PCR反应的可靠性,又可以协助判断扩增
Labview中的图像处理案例介绍 发布时间:2016-01-07 之前我们介绍了MV-EM130M工业相机的实时图像获取方法,本文再结合labview的图像处理函数给出一种简单的图像处理VI。此处的图像处理包括对图像进行采样,找出与采样点相同的图像。为了找出各种角度放置的采样点,在查找的同时对图像进行了360°的翻转,这样可以找出图像上所有相同点。 由于软件的运行比较复杂,数据的采集又是实时的,要求处理速度比较快,所以要对其进行整体设计,合理安排控件的调用和执行顺序。本程序中采用了一个大循环,保持程序的持续运行。在内部再调用一个顺序结构来控制程序的执行顺序,这样可以保证程序按编程者的思路进行。 图像采集&整个程序流程图 读取了图像数据后,还要设置查找的像素。这里通过一个光标选择函数来实现。先用函数IMAQ Setup Learn Pattern 2来设置需要记录的各项,然后再用IMAQ Extract函数进行光标设置。这样就记录了此光标区域的图像数据。
设置查找像素 这里用一个条件结构来控制是否进入记录像素的程序,也就是当选择了要记录的像素后,才进入此分支程序。在这一分支程序中,又利用了一个顺序结构,这样提高了程序运行的效率。 复位记录按钮 当设置完以上要查找的像素后,就可以在需要的图片中查找此像素。为了查找有用的像素,在选择了“开始查找”后,要先读取上面标记的像素,再进行查找。此处程序的设计中,也是先运行一个条件结构,再运行顺序结构,按顺序执行程序。 读取选择的像素 当读取像素后,利用顺序结构在第二帧的图像中继续查找。在这一帧中放置了一个循环,并限制循环次数为4。此时先用一个IMAQ Rotate对图像进行翻转,每次翻转90°。这样就可以在循环4次时翻转一周,对图像上各个角度的像素进行查找。再把图像送到IMAQ Match Pattern 2函数,对其进行查找。通过此函数直接输出找到的像素信息的数组。为了对找到的信息进行处理,又用一个For循环对此数据和簇进行拆分。 程序编写完成后,要对系统进行软硬件的联机调试。这里把维视图像的MV-EM130M工业相机用网线和计算机连接,并在计算机上安装驱动程序。具体操作如下:
核酸实验室使用注意事项 1. 核酸实验室包括PCR前区(314试剂准备间、样本处理间、极低病毒载量处理间)和PCR后区(321病毒载量检测间、测序间;212 PCR扩增间、电泳间)。核酸实验室单向流程,即从PCR前区流向PCR后区,严禁任何物品返回。 2. 核酸实验室所有耗材和试剂由专人负责订购和领取,其中一次性耗材由胡园园负责领取,常规试剂及耗材由马鹏飞负责订购和领取,请在实验前做好计划。 3. 各室冰箱由房间负责人按照需求分配,实验过程中出现的仪器设备使用故障或疑问,请咨询相关房间负责人。 4. 所有核酸实验室的门把手严禁带手套接触。所有房间的自感应水龙头、洗眼器为洁净区,禁止戴手套操作。 5. 生物安全柜使用:先打开外排风机,然后接通安全柜电源,打开安全柜内风机电源,然后等待下降气流及排风量稳定后方可使用,使用安全柜前后请务必清理台面,结束后先关闭安全柜电源,然后在关闭外排风机。(安全柜内污物使用后及时清理)。 6. 污物处理:液体、固体分开处理,液体:废物放入提前加入指定量次氯酸钠的专用容器,固体:放入预先准备好的污物袋中。实验完毕后,将固体废物扎紧,液体废物盖好盖子,然后送至-1层高压间。 7. 实验室的工作服严禁穿出该实验室。 8. 试剂准备间(负责人李喆):用于PCR体系配置及PCR试剂存放,严禁任何样本和核酸(如PCR模板或产物)带入该室。 9. 样本处理间(负责人苏俊琪),用于核酸提取及样本处理,处理血样样本时需要带双层乳胶手套,并做好相应防护措施。 10. 极低病毒载量处理间(负责人马鹏飞),严禁与实验无关人员进入该实验室。 11. 病毒载量检测间(负责人马鹏飞):用于病毒载量检测。
L a b V I E W程序设计步 骤
LabVIEW程序设计步骤 下面通过一个设计实例来详细介绍虚拟仪器软件LabVIEW的程序设计步骤。 设计目标:假设有一台仪器,需要调整其输入电压,当调整电压超过某一设定电压值时,需通过指示灯颜色变化发出警告。 1 建立新VI 启动LabVIEW程序,单击VI按钮,建立一个新VI程序。 这时将同时打开LabVIEW的前面板和后面板(框图程序面板)。在前面板中显示控件选板,在后面板中显示函数选板。在两个面板中都显示工具选板。 如果选板没有被显示出来,可以通过菜单查看(View)/工具选板(Tools Palette)来显示工具选板,通过查看(View)/控件选板(Controls Palette)显示控件选板,通过查看(View)/函数选板(Functions Palette)显示函数选板。 也可以在前面板的空白处,单击鼠标右键,以弹出控件选板。 2 前面板设计 输入控制和输出显示可以从控件选板的各个子选板中选取。 本例中,程序前面板中应有1个调压旋钮,1个仪表,1个指示灯,1个关闭按钮共4个控件。 1)往前面板添加1个旋钮控件:控件(Controls)→新式(Modern)→ 数值(Numeric)→旋钮(Knob),如图2-14所示,标签改为“调压旋钮”; 2)往前面板添加1个仪表控件:控件(Controls)→新式(Modern)→数值(Numeric)→仪表(Meter),如图2-14所示,标签改为“电压表”。 3)往前面板添加1个指示灯控件:控件(Controls)→新式(Modern)→布尔(Boolean)→圆形指示灯(Round LED),如图2-15所示,将标签改为“上限灯”。 图2-14 添加旋钮、仪表控件 图2-15 添加指示灯、按钮控件