
过氧化氢的催化分解
一、实验原理
过氧化氢水溶液在室温下,没有催化剂存在时,分解反应进行得很慢,但在含有催化剂I –的中性溶液中,其分解速率大大加快,反应式为:2H 2O 2 == 2H 2O + O 2(g)
反应机理为: H 2O 2 + I – → H 2O + IO – k 1 (慢) (1) H 2O 2 + IO – → H 2O + O 2(g) + I – k 2 (快) (2) 整个分解反应的速率由慢反应(1)决定,速率方程为: 22
-22H O 1H O I dc k c c dt
-
=
因反应(2)进行得很快且很完全,I –的浓度始终保持不变,故上式可写成: 22
22H O H O dc kc dt
-
=
式中,-1I k k c =,k 为表观反应速率常数。将上式积分得 0
ln
c kt c
= 此式表明,反应速率与H 2O 2浓度的一次方成正比,故称为一级反应。将上式积分得:
01ln ln c t k c t +-=
式中c 0、c t 分别为反应物过氧化氢在起始时刻和t 时刻的浓度。 反应半衰期为: 1
12/1693
.02ln k k t =
=
设H 2O 2完全分解时放出O 2的体积为V ∞,反应t 时放出O 2的体积为V , 则c 0∝V ∞,c ∝(V ∞ – V ),故 ln
V kt V V ∞
∞=-
ln
-V V
kt V ∞∞
-= ln -+ln V V kt V ∞∞-=()
以ln(V ∞ – V )对t 作图应得一直线,从直线斜率(– k )即可求得H 2O 2分解反应的速率常数。故实验需测定反应不同时刻O 2的体积V 及H 2O 2完全分解时O 2的体积V ∞。V ∞可用下法之一求出。
(a) 加热法 在测定若干个V 数据后,将H 2O 2溶液加热至50~60 ℃ 约15 min ,可以认为H 2O 2已分解完全,待冷却至室温后,记下量气管的读数,即为V ∞。
(b) 浓度标定法 用KMnO 4标准溶液对H 2O 2原始浓度进行标定,O 2近似按理想气体处理,则有
222
2
222
H O H O O O O 2c V RT RT V n p p ∞?=?=? 式中,2O p 为O 2的分压,是外界大气压与实验温度下水的饱和蒸气压之差。
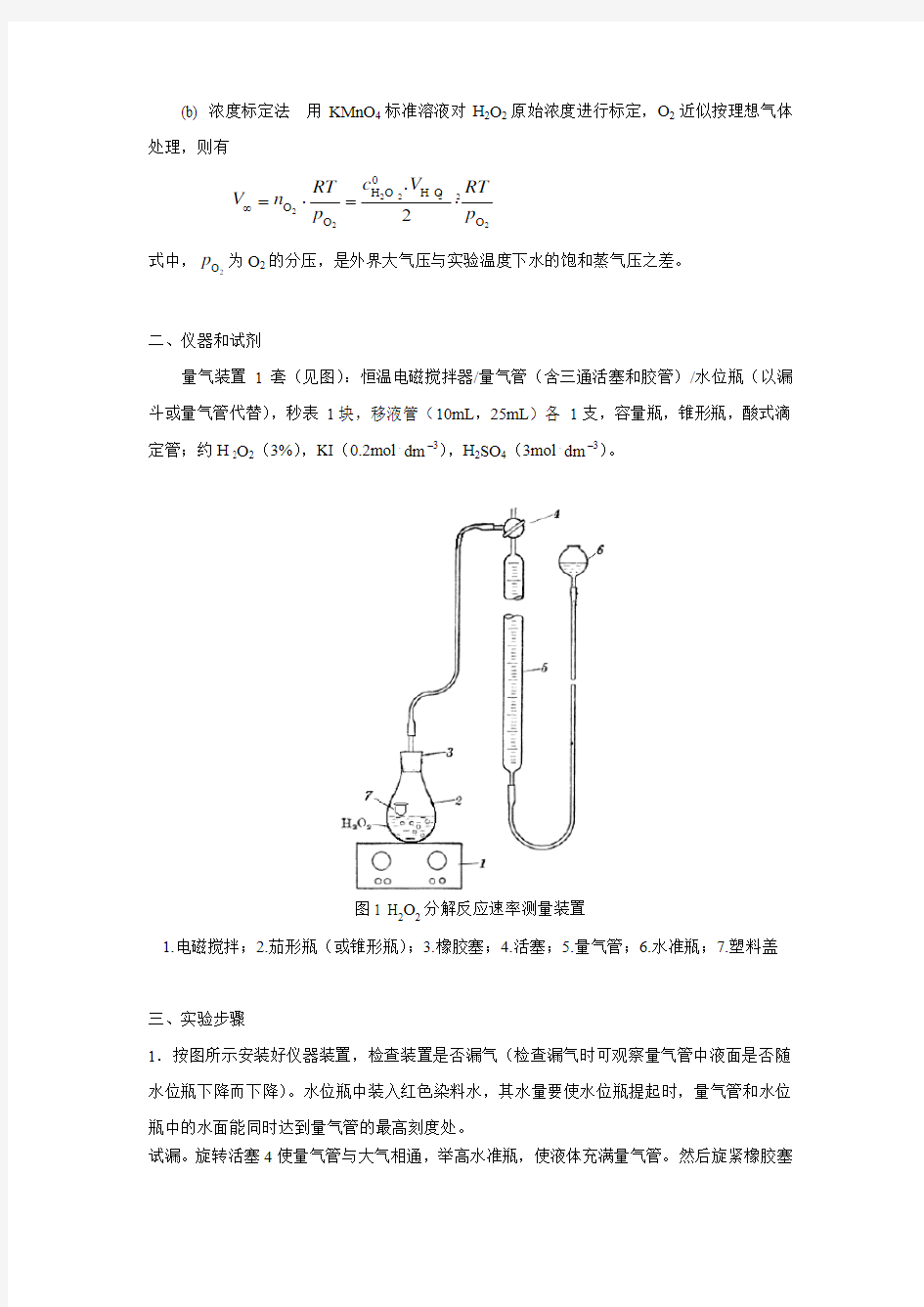
二、仪器和试剂
量气装置 1套(见图):恒温电磁搅拌器/量气管(含三通活塞和胶管)/水位瓶(以漏斗或量气管代替),秒表 1块,移液管(10mL ,25mL )各 1支,容量瓶,锥形瓶,酸式滴定管;约H 2O 2(3%),KI (0.2mol . dm –3),H 2SO 4(3mol . dm –3)。
图1 H 2O 2分解反应速率测量装置
1.电磁搅拌;
2.茄形瓶(或锥形瓶);
3.橡胶塞;
4.活塞;
5.量气管;
6.水准瓶;
7.塑料盖 三、实验步骤
1.按图所示安装好仪器装置,检查装置是否漏气(检查漏气时可观察量气管中液面是否随水位瓶下降而下降)。水位瓶中装入红色染料水,其水量要使水位瓶提起时,量气管和水位瓶中的水面能同时达到量气管的最高刻度处。
试漏。旋转活塞4使量气管与大气相通,举高水准瓶,使液体充满量气管。然后旋紧橡胶塞
3,通过反复调整水准瓶和活塞到合适的位置,让反应体系和量气管相通而与大气隔绝的情况下,量气管内液面的位置在刻度1.00附近。读取量气管液面对应的读数。然后把水准瓶放在较低的位置,若量气管中的液面仅在初始有下降,而在随后2 min 内保持不变,表示系统不漏气;否则应找出系统漏气的原因,并设法排除之。
注意:读取量气管读数时务必使水准瓶内液面和量气管内液面处于同一水平。 提示:系统漏气多发生在茄形瓶磨口塞处,可涂抹凡士林或真空脂。
3.用移液管(或滴定管)移取25 mL 浓度约为3 %的H 2O 2溶液放入锥形瓶中,另外移入25 mL 蒸馏水,加入磁搅拌子,用吸量管移取5mL 0.2 mol . dm –3 KI 放入到小塑料盖内,再用镊子将其小心放入到盛有H 2O 2溶液的茄形瓶中,让盖子漂浮在液面上,不能让H 2O 2接触到K 。
3.用手摇动茄形瓶,使塑料盖中的KI(s)与H 2O 2充分混合,记录反应起始时间,同时开启电磁搅拌开关,调节搅拌速度至中档。反应过程中不断调节水位瓶高低,保持水位瓶与量气管中水平面一致。量气管读数与零时刻读数之差即为等压下H 2O 2分解所放出O 2的体积。量气管内O 2体积以等时间间隔读取一次,若温度高,反应速率快,读取时间间隔宜以0.5 min ;若温度低,反应慢,宜以1 min 为准。最后都要测至量气管中O 2的体积增加到50 mL 为止。 4.改变KI 或H 2O 2的浓度(也可改变反应温度),重复上述步骤,测定H 2O 2分解速率。
表1 浓度对反应速率的影响 室温_________
注:由于含有强电解质KI 的水溶液的离子强度对反应速率的影响,若用不同的c KI 作实验时,应外加第三组分(如KCl )以调节溶液的离子强度,使它们相同。 5.过氧化氢的准确浓度的标定。
(1)移取实验用约1mol . dm –3 H 2O 2 10 mL 放入250 mL 容量瓶中,用水稀释至刻度并摇匀。(2)移取25 mL 稀释后的H 2O 2溶液放入锥形瓶中,加3 mol . dm –3 H 2SO 4 5 mL ,用0.02mol . dm –3 KMnO 4标准溶液滴定至淡红色为止,读取消耗KMnO 4标准溶液的体积。重复三次,取平均值。
反应式为:5 H 2O 2 + 2 MnO 4– + 6 H + == 2 Mn 2+ + 5 O 2 + 8 H 2O
根据滴定所用去的KMnO 4标准溶液的体积即可求得H 2O 2的原始浓度,继而可求得V ∞。
四、数据记录和处理
1.记录反应不同时刻t 放出氧气的体积V t ,用浓度标定法求得V ∞。 数据处理示例
T= K ;气压 pa ;c (H 2O 2)=3%;c (KI) =0.2mol·L -1;V ∞ = mL
2.以ln(V ∞ – V )对t 作图,从直线斜率(– k )求得H 2O 2分解反应的速率常数k 。 3.动力学方程式的建立有微分法和积分法两种方法。
积分法:如本实验所示,ln -+ln V V kt V ∞∞-=(),若ln(V ∞ – V )对t 作图为直线即证明这是一级反应,由斜率求得k 。
微分法:r = -dc /dt = k c α,这里r 为反应速率,c 为反应物H 2O 2的浓度,t 为时间,α为反应级数。由此,ln r = ln k +αln c ,以ln r 对ln c 作图为直线,斜率为反应级数α,截距为ln k ,即可求得反应速率系数k 。
本实验令-1I k k c =,即设催化剂KI 反应级数为一级。如要验证反应对c KI 确为一级反应,并求得该反应的速率系数 ,还必须以ln k 对ln c I -作图。若得直线的斜率接近1,即证明此反应对c KI 确为一级,并可求得k’值。
4.由不同浓度H 2O 2、KI 所得的速率常数,讨论反应物、催化剂浓度(或温度)对反应速率的影响。 五、注意事项
1.除KI 可作催化剂以外,其它的如Ag 、MnO 2、FeCl 3、Fe 2(SO 4)3等也都是该分解反应的
很好的催化剂。 2.系统不能漏气。
3.反应开始前,先开启搅拌器,再加入催化剂,注意顺序!加入催化剂要一次完成! 4.秒表读数必须连续,切不可中途停表。
5.搅拌速度要适中,每次实验的搅拌速度尽量保持一致;开始反应后,不能随意调节搅拌速度!
6.水位瓶移动不要太快,以免液面波动剧烈。
7.实验中V ∞可用化学分析法测定。先在酸性溶液中用KMnO 4标准溶液滴定求出过氧化氢的起始浓度,滴定反应为:
2MnO 4-6H +++5H 2O 2
2Mn 2++5O 2+8H 2O
再求所用过氧化氢按式(C2-1)完全分解时产生O 2的摩尔数,根据理想气体状态方程就可以计算出V ∞,即
*O
H O 22p
p RT n V -=
∞大气 (C2-8)
式中:p 大气为大气压,*
O
H 2p 为实验温度下水的饱和蒸汽压;T 为实验温度;R 为气体常数。
严格地讲,用含水量气管测量气体体积时,都包含着水蒸气的分体积。若在某温度时,水蒸气已达饱和,则V t 应按下式计算:
)1(*
,2大气
测量p p V V O
H
t t -
=
水的饱和蒸气压 (×102Pa ,273.2~313.2K)
温度/K 0.0 0.2 0.4 0.6 0.8 273 - 6.105 6.195 6.286 6.379 274 6.473 6.567 6.663 6.759 6.858 275 6.958 7.058 7.159 7.262 7.366 276 7.473 7.579 7.687 7.797 7.907 277 8.019 8.134 8.249 8.365 8.483 278 8.603 8.723 8.846 8.970 9.095 279 9.222 9.350 9.481 9.611 9.745 280 9.881 10.017 10.155 10.295 10.436 281 10.580 10.726 10.872 11.022 11.172 282
11.324
11.478
11.635
11.792
11.952
283 12.114 12.278 12.443 12.610 12.779 284 12.951 13.124 13.300 13.478 13.658 285 13.839 14.023 14.210 14.397 14.587 286 14.779 14.973 15.171 15.369 15.572 287 15.776 15.981 16.191 16.401 16.615 288 16.831 17.049 17.260 17.493 17.719 289 17.947 18.177 18.410 18.648 18.886 290 19.128 19.372 19.618 19.869 20.121 291 20.377 20.634 20.896 21.160 21.426 292 21.694 21.968 22.245 22.523 22.805 293 23.090 23.378 23.669 23.963 24.261 294 24.561 24.865 25.171 25.482 25.797 295 26.114 26.434 26.758 27.086 27.418 296 27.751 28.088 28.430 28.775 29.124 297 29.478 29.834 30.195 30.560 30.928 298 31.299 31.672 32.049 32.432 32.820 299 33.213 33.609 34.009 34.413 34.820 300 35.232 35.649 36.070 36.496 36.925 301 37.358 37.796 38.237 38.683 39.135 302 39.593 40.054 40.519 40.990 41.466 303 41.945 42.429 42.918 43.411 43.908 304 44.412 44.923 45.439 45.958 46.482 305 47.011 47.547 48.087 48.632 49.184 306 49.740 50.301 50.869 51.441 52.020 307 52.605 53.193 53.788 54.390 54.997 308 55.609 56.229 56.854 57.485 58.122 309 58.766 59.412 60.067 60.727 61.395 310 62.070 62.751 63.437 64.131 64.831 311 65.537 66.251 66.969 67.693 68.425 312 69.166 69.917 70.673 71.434 72.202 313 72.977 73.759 ---
过氧化氢分解氧气 成员:罗玉洁、何瑾、徐丽、胡艳、骆磊、申林 一、 实验目的 1、掌握实验室用双氧水制备氧气的原理、装置和操作。 2、了解影响双氧水制备氧气反应速率的因素。 3、能认识催化剂在化学反应中的作用及化学反应前后质量的变化。 二、 实验原理 过氧化氢不稳定,在常温下就能缓慢分解放出氧气。但速度较慢,不易察觉。在过氧化氢溶液中加入适量二氧化锰后,能立即有氧气迅速放出。在此反应中,二氧化锰是催化剂,能加速该反应的发生。 过氧化氢 水+氧气→ 二氧化锰 ↑+??→?2222O O H O H 2MnO 三、 实验药品与仪器 实验药品:5%、30%的双氧水、二氧化锰、氧化铜。 仪 器:注射器(20ml )、锥形瓶、导管、软木塞、恒温水浴锅、 集气瓶、橡皮管、钥匙。 四、 实验步骤 1、实验室制备氧气 ①连接仪器,检查装置的气密性; ②在锥形瓶中加入少量二氧化锰粉末,旋紧软木塞,用注射器在双氧水瓶里吸取10ml 5%双氧水,将注水器里的双氧水按需要的量缓慢注入加入装有少量二氧化锰粉末的锥形瓶中; ③等气泡连续均匀冒出时,开始收集; ④等集气瓶中液面下降至瓶口,瓶外有气泡产生时,实验结束。并用带火星的木条进行检验。实验装置如下:
改进装置原因: (1)因锥形瓶中的二氧化锰不易收集。所以将锥形瓶换成试管,便于收集二氧化锰,好做称量,证明二氧化锰作为一种催化 剂时,在反应前后质量不变。 (2)用分液漏斗来控制反应的速率,收集装置采用向下排水法。 (3)通过改变浓度、温度、催化剂来探究对双氧水催化分解氧气速率的影响。 2、探究影响双氧水分解速率的因素 (1)浓度对反应的影响 分别将10ml 5%双氧水溶液与10ml 30%双氧水溶液与等量的MnO2混合于试管中,分别观察实验现象。 (2)温度对反应的影响 分别观察:室温下10ml 30%双氧水溶液,发生装置浸入80℃的水浴加热的10ml 30%双氧水的现象。 (3)催化剂对反应的影响 10mL5%双氧水溶液加入少许氧化铜作为催化剂,10 ml 5%双氧水溶液加入少许二氧化锰作为催化剂。且氧化铜与二氧化锰等量,分别观察实验现象。 五、注意事项 1、在做实验之前,必须检查装置的气密性。气密性检查:用止水夹 关闭,打开分液漏斗活塞,向漏斗中加入水,水面不持续下降,就说明气密性良好。 2、双氧水的浓度不能过大,并且不适宜加多过氧化锰,容易造成反 应太剧烈。 3、刚开始出现气泡时,混有空气,此时不易收集氧气,待气泡增多 时,再进行收集。 六、思考题 1、实验中分液漏斗的作用? 2、二氧化锰在实验中的作用? 3、与高锰酸钾相比,双氧水分解制取氧气有哪些优点? 答:1、分液漏斗可以控制反应物的量,从而控制反应的速率。 2、二氧化锰在该反应中做催化剂,能改变反应的速率,而本身 在反应前后质量和化学性质不变,对于生成物的量是没有影响 的。 3、双氧水分解不需要加热,操作简单方便,且可以通过分液漏 斗控制反应物的量,从而控制反应的速率。
过氧化氢分解制氧气不同催化剂的探究 过氧化氢通常被保存在棕色瓶中以避开光照,原因是过氧化氢会自发地(缓慢地)分解成氧气和水。当有二氧化锰催化剂存在时,该分解过程大大加快。除二氧化锰外哪些物质还可以催化分解过氧化氢? 【思考与设计】请你设计实验方案探究 1. 不同催化剂对过氧化氢分解反应速率的影响 2. 同一催化剂存在下,过氧化氢的浓度对分解速率的影响。写出实验的各个步骤和应 注意的安全事项,写一份详细的实验计划。 请老师批准你的实验方案,按计划完成实验并记录实验现象和数据。 【实验材料】锥型瓶、分液漏斗、带刻度的玻璃量气管(或碱式滴定管)、玻璃三通、乳胶 头、导管、秒表、30%的过氧化氢、二氧化锰、0.2mol ·L -1 CuSO 4溶液、0.2mol ·L -1FeSO 4溶液、碘水、肥皂水(或洗发香波) 【实验案例】 1.不同催化剂对过氧化氢分解反应速率的影响 ● 把30%过氧化氢稀释成2%、4%、6%过 氧化氢溶液。 ● 按图综2-2连接装置来测量氧气生成 的体积。 ● 把肥皂水装满玻璃三通,在锥型瓶中加 入催化剂,从分液漏斗向锥型瓶中加入20mL 过氧化氢溶液。 ● 用乳胶头来制造肥皂泡,用秒表测量生 成固定体积(例如20mL )氧气所需要的时间,平均反应速率可以用单位时间内所产生的氧气体积来表示。认真观察实验现象并记录数据。 不同催化剂对同一浓度过氧化氢分解实验的对比表 编号 实 验 实验现象 时间 反应速率 1 20ml 4% 的双氧水+0.1克二氧化锰 2 20ml 4% 的双氧水+1mL 0.2mol ·L -1 CuSO 4溶液 3 20ml 4% 的双氧水+1mL 0.2mol ·L -1 FeSO 4溶液 4 20ml 4% 的双氧水+1mL 碘水 结论 图综2-2过氧化氢分解制氧气不同催化剂的探究
过氧化氢的催化分解 一、实验目的 1、了解不同催化剂对过氧化氢(H2O2)催化分解速率的影响。 2、认知能催化分解H2O2的不同催化剂。 二、实验原理 过氧化氢催化分解是一级反应:H2O2→H2O+1/2O2.。(凡是反应速度只与反应浓度的一次方成正比的反应称为一级反应。)实验证明,过氧化氢的反应机理为一级反应.化学反应速度取决于反应物的浓度、温度、反应压力、催化剂、搅拌速度等许多因素。许多催化剂如Pt、Ag、Cr、MnO2、FeCl3、CuO、血液、铁丝、炭粉、土豆丝等都能加速H2O2分解。用土豆丝来催化分解H2O2溶液,说明生物体内不断产生的过氧化氢酶,可促使H2O2迅速分解,这种酶广泛存在于动植物组织中。 三、实验仪器与药品 仪器:试管(2个)、具支试管(1个)、锈铁丝、气球、土豆丝、 药品:H2O2溶液, 四、实验步骤 1,过氧化氢溶液的制备 用移液管吸取30℅H2O2溶液5ml,置于50ml容量瓶中,稀释至刻度线,摇匀定容,即得实验用的H2O2溶液。 2,酶催化作用的验证实验 取两只试管,在一支试管中放入切成细条状的土豆丝。分别向两支试管中注入3%的H2O2 5ml,注意观察现象(放入土豆丝的试管中迅速产生大量的气泡,泡沫很快充满试管;用玻璃棒桶开泡沫,)插入带火星的木条,则木条立即复燃,而另一支试管中无明显现象。 3,用抽动法做“催化剂对H2O2分解速度的影响”的实验 ①取一支具支试管,在具支试管中加入10ml浓度30%H2O2溶液,在支管上装上小气球,通过橡皮塞插入一根已生锈的绕成螺旋状的粗铁丝。 ②将螺旋状的锈铁丝向下插入H2O2溶液中是,注意观察现象的变化。(H2O2迅速分解,锈铁丝表面上,有大量气泡产生。气球鼓起;把铁丝向上拉,离开H2O2溶液,则反应不明显。) ③取下塞子,用带火星木条放在试管口,注意观察现象变化。(则木条立即复燃,说明有O2生成。) 五、注意事项 1、实验过程中注意安全 2、玻璃仪器轻拿轻放 六、思考题 1,催化剂对反应速度有何影响? 2,常用催化剂有哪些?
过氧化氢的催化分解 一、实验原理 过氧化氢水溶液在室温下,没有催化剂存在时,分解反应进行得很慢,但在含有催化剂I –的中性溶液中,其分解速率大大加快,反应式为:2H 2O 2 == 2H 2O + O 2(g) 反应机理为: H 2O 2 + I – → H 2O + IO – k 1 (慢) (1) H 2O 2 + IO – → H 2O + O 2(g) + I – k 2 (快) (2) 整个分解反应的速率由慢反应(1)决定,速率方程为: 22 -22H O 1H O I dc k c c dt -= 因反应(2)进行得很快且很完全,I –的浓度始终保持不变,故上式可写成: 22 22H O H O dc kc dt -= 式中,-1I k k c =,k 为表观反应速率常数。将上式积分得 0ln c kt c = 此式表明,反应速率与H 2O 2浓度的一次方成正比,故称为一级反应。将上式积分得: 01ln ln c t k c t +-= 式中c 0、c t 分别为反应物过氧化氢在起始时刻和t 时刻的浓度。 反应半衰期为: 1 12/1693.02ln k k t == 设H 2O 2完全分解时放出O 2的体积为V ∞,反应t 时放出O 2的体积为V , 则c 0∝V ∞,c ∝(V ∞ – V ),故 ln V kt V V ∞∞=- ln -V V kt V ∞∞-= ln -+ln V V kt V ∞∞-=() 以ln(V ∞ – V )对t 作图应得一直线,从直线斜率(– k )即可求得H 2O 2分解反应的速率常数。故实验需测定反应不同时刻O 2的体积V 及H 2O 2完全分解时O 2的体积V ∞。V ∞可用下法之一求出。 (a) 加热法 在测定若干个V 数据后,将H 2O 2溶液加热至50~60 ℃ 约15 min ,可以认为H 2O 2已分解完全,待冷却至室温后,记下量气管的读数,即为V ∞。
过氧化氢催化分解反应速率常数的测定 分类:药学资料 标签: 化学 实验报告 过氧化氢 反应速率常数 教育 一、实验目的 (1)了解过氧化氢催化分解反应速率常数的测定方法。 (2)熟悉一级反应的特点,了解催化剂对反映速率的影响。 (3)掌握用图解计算法求反应速率常数。 二、实验用品 1、仪器 玻璃反应容器1个、水准瓶1个、50mL量气管1个、超级恒温槽1套、三通活塞1个、秒表1块、10mL量筒1个、5mL吸量管2支、胶管3m。 2、药品 质量分数为2%的H2O2溶液(新鲜配制)、0.1mol·L-1KI溶液。 三、实验原理与技术
过氧化氢很不稳定,在常温下的分解反应式为: H2O2→H2O+1/2O2(Ⅰ) 在KI作用下的分解反应机理为: H2O2+KI→KIO+ H2O (慢)(Ⅱ) KIO→KI+1/2O2 (快)(Ⅲ) (Ⅱ)式是H2O2分解的速控步骤,H2O2分解反应的反应速率方程为: -dc H2O2/d t=k′c H2O2·c KI (Ⅳ) 因为c KI近似不变,(Ⅳ)式可简化为: -dc H2O2/d t=k c H2O2 (Ⅴ) (其中k=k′c KI)。 H2O2的催化分解反应为一级反应,对(Ⅴ)式积分可得:ln(c/ c0)=-kt (Ⅵ) (其中c0为H2O2的初始浓度;c为反应至t时刻H2O2的浓度;k为H2O2的催化分解反应的速率常数)。 反应的半衰期为: t1/2= ln2/k=0.693/k (Ⅶ) 在等温等压条件下,在H2O2的分解反应中,氧气体积增长速率反映了H2O2的分解速率,本实验就是通过测定不同时刻放出的氧气的体积,间接地求出H2O2在相应时刻的浓度,这种方法称为物理法。 令ⅴ∞表示H2O2全部分解放出的O2的体积;ⅴt表示反应至t时刻放出的O2的体积;则由(Ⅰ)式可看出:
实验 过氧化氢的分解 一、 实验目的 1.测定H 2O 2分解反应的速率系数和半衰期。 2.熟悉一级反应的特点,了解温度和催化剂等因素对一级反应的影响。 3.学会用图解法求一级反应的速率系数。 二、 实验原理 过氧化氢是很不稳定的化合物,在没有催化剂作用时也能分解,但分解速度很慢。但加入催化剂时能促使H 2O 2较快分解,分解反应按下式进行: H 2O 2→H 2O+ 2 1O 2 (1) 在催化剂KI 作用下,H 2O 2分解反应的机理为: H 2O 2+KI →KIO+ H 2O (慢) (2) KIO →KI+ 2 1O 2 (快) (3) KI 与H 2O 2生成了中间产物KIO ,改变了反应的机理,使反应的活化能降低,反应加快。反应(2)较(3)慢得多,成为H 2O 2分解的控制步骤。 H 2O 2分解反应速率表示为: r = dt dc ) O H (22 反应速率方程为: dt dc ) O H (22=k ’c(H 2O 2)c(KI) (4) KI 在反应中不断再生,其浓度近似不变,这样(4)式可简化为: dt dc ) O H (22=kc(H 2O 2) (5) 其中,k=k ’c (KI),k 与催化剂浓度成正比。 由(5)式看出H 2O 2催化分解为一级反应,积分(5)式得:ln 0 c c = - kt (6) 式中:c 0——H 2O 2的初始浓度;c ——t 时刻H 2O 2的浓度。 一级反应半衰期t 2 1为: t 2 1= k 2ln = k 693.0 (7) 可见一级反应的半衰期与起始浓度无关,与反应速率系数成反比。本实验通过测定H 2O 2 分解时放出O 2的体积来求反应速率系数k 。从H 2O 2=== H 2O+ 2 1O 2中可看出在一定温度、一定 压力下反应所产生O 2的体积V 与消耗掉的H 2O 2浓度成正比,完全分解时放出O 2的体积V ∞与H 2O 2溶液初始浓度c 0成正比,其比例常数为定值,则c 0∝V ∞、c 0∝(V ∞-V)
课题2催化剂对过氧化氢分解反应速率的影响 1.完成下列各题空格 ⑴分子或离子间的是发生化学反应的先决条件,但不是每次碰撞都会引发反应。能够引起反应的分子(或离子)间的相互碰撞叫做,能够发生有效碰撞的分子叫做。活化分子具有的能量,因此活化分子所占分数的大小决定的快慢。活化分子的平均能量与所有分子的平均能量的差称为。 ⑵催化剂能使反应的活化能(如图Ea、Ea’分别代表有、无催化剂时正反应的活化能),使得具有平均能量的反应物分子只要吸收较少的能量就能变成,活化分子所占分数增大,可以成千上万倍地加快反应速率。催化剂能增大化学反应速率,但是它改变反应进行的方向,也使那些不可能发生的化学反应得以发生。 ⑶影响过氧化氢分解的因素有溶液的、光、热及遇到大多数。 ⑷分解反应的化学方程式为。 ⑸催化剂对化学反应速率的影响 一般选用MnO2作催化剂,其以及均会影响H2O2分解的速率。通过观察比较H2O2溶液中的快慢程度,或测定H2O2分解放出的O2的体积判断H2O2分解速率的大小。 ⑹保存H2O2溶液时要注意:从安全角度考虑,易分解产生气体的试剂不宜放在密封的中,双氧水通常盛放在干净的中。 2.下列关于催化剂的说法,正确的是() A.催化剂能使不起反应的物质发生反应 B.催化剂在化学反应前后,化学性质和质量都不变 C.催化剂不能改变化学反应速率 D.任何化学反应都需要催化剂 3.能够增加反应物分子中活化分子百分数的是() A.升高温度 B.减小压强 C.增大压强 D.增大浓度 4.亚氯酸盐(如NaClO2)可用作漂白剂,在常温下不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O。分解时,刚加入硫酸,反应缓慢,随后突然反应释放出大量ClO,这是因为()
过氧化氢催化分解反应速率常数的测定 一、实验目的 (1)了解过氧化氢催化分解反应速率常数的测定方法。 (2)熟悉一级反应的特点,了解催化剂对反映速率的影响。 (3)掌握用图解计算法求反应速率常数。 二、实验用品 1、仪器 玻璃反应容器1个、水准瓶1个、50mL量气管1个、超级恒温槽1套、三通活塞1个、秒表1块、10mL量筒1个、5mL吸量管2支、胶管3m。 2、药品 质量分数为2%的H2O2溶液(新鲜配制)、0.1mol·L-1KI溶液。 三、实验原理与技术 过氧化氢很不稳定,在常温下的分解反应式为: H2O2→H2O+1/2O2(Ⅰ) 在KI作用下的分解反应机理为: H2O2+KI→KIO+ H2O (慢)(Ⅱ) KIO→KI+1/2O2(快)(Ⅲ) (Ⅱ)式是H2O2分解的速控步骤,H2O2分解反应的反应速率方程为: -dcH2O2/d t=k′cH2O2·cKI(Ⅳ) 因为cKI近似不变,(Ⅳ)式可简化为: -dcH2O2/d t=k cH2O2 (Ⅴ) (其中k=k′cKI)。
H2O2的催化分解反应为一级反应,对(Ⅴ)式积分可得:ln(c/ c0)=-kt (Ⅵ) (其中c0为H2O2的初始浓度;c为反应至t时刻H2O2的浓度;k为H2O2的催化分解反应的速率常数)。 反应的半衰期为: t1/2= ln2/k=0.693/k (Ⅶ) 在等温等压条件下,在H2O2的分解反应中,氧气体积增长速率反映了H2O2的分解速率,本实验就是通过测定不同时刻放出的氧气的体积,间接地求出H2O2在相应时刻的浓度,这种方法称为物理法。 令ⅴ∞表示H2O2全部分解放出的O2的体积;ⅴt表示反应至t时刻放出的O2的体积;则由(Ⅰ)式可看出: 定温定压下反应产生的O2的体积ⅴt与被消耗的H2O2的浓度成正比,而 ⅴ∞则与H2O2的初始浓度成正比,且两者比例系数为定值,则:c。∝ⅴ∞;c∝(ⅴ∞-ⅴt)。 代入(Ⅵ)式可得:ln[(ⅴ∞-ⅴt)/ⅴ∞]=-kt (Ⅷ) →ln(ⅴ∞-ⅴt)=-kt+lnⅴ∞(Ⅸ) (其中ⅴ∞可以通过外推法或加热法求得)。 四、实验步骤 (1)组装仪器(实验室工作人员已经装好)。 (2)先用量筒量10mL蒸馏水和用吸量管吸取5mL 0.1mol·L-1KI溶液注入反应器的一室;再用另一支吸量管吸取5mL质量分数为2%的H2O2溶液于另一室。(注:此过程中各室的溶液都不能滴漏于另一边)。接着,盖好瓶塞,查漏。方法如下: 水准瓶装入一定量蒸馏水,旋转三同活塞,使体系与外界相通;高举水准瓶,使量气管的水平面达到0.00mL(即ⅴ0)刻度处,然后再旋转三通活塞,使体系与外界隔绝,水准瓶放回实验台面。2min内保持不变,则表示不漏气;否则,要找出原因,排除它。 (3)倾斜反应器,使KI溶液流入H2O2溶液中,立即开启秒表,混合溶液两室中反复转移3-4次,最后全部停留在一室,平稳且力度适中地摇匀。(注:反应器必须与量气管相通)
实验二 过氧化氢分解反应动力学 一、实验目的: 1.熟悉一级反应特点,了解反应物浓度、温度、催化剂等因素对一级反应速度的影响。 2.用静态法测定H 2O 2分解反应的速度常数和半衰期。 3.掌握量气技术,学会用图解计算法求出一级反应的速度常数。 二、实验原理: 凡是反应速度只与反应浓度的一次方成正比的反应称为一级反应。实验证明,过氧化氢的反应机理为一级反应。 化学反应速度取决于反应物的浓度、温度、反应压力、催化剂、搅拌速度等许多因素。 过氧化氢在没有催化剂存在时,分解反应进行的很慢。许多催化剂如Pt 、Ag 、MnO 2、FeCl 3、碘化物等都能加速H 2O 2分解。 过氧化氢分解反应的化学计量式如下: H 2O 2(l) = H 2O(l) + 1/2O 2(g) 若以KI 为催化剂,在KI 作用下催化分解步骤为: KI(l) + H 2O 2(l) = KIO + H 2O(l) (慢) KIO = KI(l) + 1/2O 2(g) 由于第一步的速率比第二步慢得多,所以,第一步为反应的控制步骤。因而可以假定其反应的速率方程式为: -dc A /dt =k ’c KI c A 式中,c A 为反应系统中反应到t 时刻H 2O 2浓度,因KI 在反应过程中浓度不变,故上式可简化为 - dc A /dt = kc A (2.1) 式中k=k ’c KI , 将上式分离变量积分: 当 t=0 时, C A =C 0 ; t=t 时, C A =C t ; 定积分式为: ? ?=-t C C t A A k d t c dc 00 (2.2)
积分结果: 0ln ln c kt c t +-= (2.3) 式是t c t ~ln 的直线方程。反应进行过程中,测定不同时刻 t 时反应系统中H 2O 2的浓度c t ,取得若干组c t 、t 的数据后,以lnc t 对t 作图,得一直线,表明该反应为一级反应(准一级反应),直线斜率为-k 。 在H 2O 2催化分解过程中t 时刻H 2O 2的浓度可通过测量相应的时间内分解放出的氧气的体积得出。放出的氧气的体积与分解了的H 2O 2的量成正比,其比例系数为定值。令V f 表示H 2O 2全部分解放出的氧气的体积,V t 表示H 2O 2在t 时刻分解放出的氧气体积,则: f O H O O H V RTV P V n c ?= = 2 2 002222 ; ()t f O H O O H t t t V V RTV P V n n c c c -?=-= -=2 2' 0'02222 c o ∝V f , c t ∝ (V f -V t ) 将上述关系代入(14.3)式,得: ln (V f -V t )= - kt + ln V f (2.4) 如果以ln (V f -V t )对t 作图得一直线,即验证是一级反应;由直线斜率m 可求出速率常数k ,m = - k 。 (2.4)为ln (V f -V t )~ t 的直线方程,式中V f 为H 2O 2全部分解放出的氧气体积,反应温度及KI 浓度一定时,它不随时间改变。实验过程中只需要测定反应进行的不同时刻t 时H 2O 2分解放出的氧气体积V t (若干个数据)和反应终了时H 2O 2全部分解放出的氧气体积V f (一个数据),以ln (V f -V t )对t 作图得一直线,直线斜率为-k ,用作图法可求出反应速率常数k 。 V f 可采用下面两种方法来求得: (a )外推法:以1/t 为横坐标,对V t 作图,将直线外推至1/t =0,其截距即V f 。 (b )加热法:在测定若干个V t 数据后,将H 2O 2加热至50—60℃约15分钟,可认为H 2O 2已基本分解完毕,待溶液冷却到实验温度时,读出量气管读数即为V f ,同学们可自择二者之一,与滴定结果作对照。 当02 1 c c t =时,t 可用t 1/2表示,即为反应的半衰期. 由(2.3)式变换得:
第次课 4 学时
实验14 过氧化氢催化分解反应速率常数的测定 一、实验目的 1. 测定过氧化氢催化分解反应速率常数; 2. 掌握通过测量反应系统的体积跟踪反应系统浓度从而研究反应速率的方法。 二、实验原理 过氧化氢在没有催化剂存在时,分解反应进行的很慢。加入催化剂能够提高分解速率。过氧化氢分解反应的化学计量式如下: H 2O 2(l) = H 2O(l) + 1/2O 2(g) 若以KI 为催化剂,在KI 作用下催化分解步骤为: KI(l) + H 2O 2(l) = KIO + H 2O(l) (慢) KIO = KI(l) + 1/2O 2(g) 由于第一步的速率比第二步慢得多,所以,第一步为反应的控制步骤。因而可以假定其反应的速率方程式为: -dc A /dt =k ’c KI c A 式中,c A 为反应系统中反应到t 时刻H 2O 2浓度,因KI 在反应过程中浓度不变,故上式可简化为 - d I c A /dt = k I c A (14.1) 式中k=k ’c KI , 将上式分离变量积分: 当 t=0 时, C A =C 0 ; t=t 时, C A =C t; 定积分式为: ??=-A A C C t A A kdt c dc 0 0 (14.2) 积分结果: 0ln ln c kt c t +-= (14.3) 式是t c t ~ln 的直线方程。反应进行过程中,测定不同时刻 t 时反应系统中氧气的浓度c t ,取得若干组c t 、t 的数据后,以lnc t 对t 作图,得一直线,表明该反应为一级反应(准一级反应),直线斜率为-k 。 物理化学的研究方法是采用物理的方法测定反应系统某组分的浓度,所谓物理的方法是利用反应系统某组分或各组分的某些物理性质(如体积、压力、电动势、折光率、
实验 量气法测定过氧化氢催化分解反应速率常数 一、实验目的 1. 学习使用量气法研究过氧化氢的分解反应 2. 了解一级反应的特点,掌握用图解计算法求反应速率常数。 二、实验原理 H 2O 2在室温下,没有催化剂存在时,分解反应进行得很慢,但加入催化剂(如Pt 、Ag 、MnO 2、碘化物)时能促使其较快分解,分解反应按下式进行: H 2O 2H 2O + 1 2O 2→ (C2-1) 在催化剂KI 作用下,H 2O 2分解反应的机理为: H 2O 2H 2O ++KI KIO (慢)→ (C2-2) K IO K I + 1 2 O 2(快)→ (C2-3) 整个分解反应的速度由慢反应(C2-2)决定: 22222 2O H KI O H O H c c k dt dc =- (C2-4) 式中c 表示各物质的浓度(mol ?L -1),t 为反应时间(s ),2 2O H k 为反应速率常数,它的大小仅决定 于温度。 在反应中作为催化剂的KI 的浓度保持不变,令KI O H 12 2c k k ?=,则 222 2O H 1O H c k dt dc =- (C2-5) 式中k 1为表观反应速率常数。此式表明,反应速率与H 2O 2浓度的一次方成正比,故称为一级反应。将上式积分得: 1ln ln c t k c t +-= (C2-5) 式中c 0、c t 分别为反应物过氧化氢在起始时刻和t 时刻的浓度。反应半衰期为: 1 1 2/1693.02ln k k t == (C2-6) 由反应方程式可知,在常温下,H 2O 2分解的反应速度与氧气析出的速度成正比。析出的氧气体积可由量气管测量。令V ∞表示H 2O 2全部分解所放出的O 2体积,V t 表示H 2O 2在t 时刻放出的O 2体积,则)(t t V V c -∝∞。将该关系式带入(C2-5),得到 ∞ ∞+-=-V t k V V t ln )ln(1 (C2-7)
过氧化氢的催化分解 一实验目的 1. 熟悉一级反应特点,了解反应浓度、温度和催化剂等因素对一级反应速度的影响; 2. 用静态法测H2O2分解反应的反应速度常数和半衰期.并求反应活化能; 3. 学会用图解法求出一级反应的反应速度常数. 二实验原理 凡是反应速度只与反应浓度的一次方成正比的反应称为一级反应。实验证明,过氧化氢的反应机理为一级反应.化学反应速度取决于反应物的浓度、温度、反应压力、催化剂、搅拌速度等许多因素。许多催化剂如Pt、Ag、MnO2、FeCl3碘化物等都能加速H2O2分解。在催化剂KI作用下的分解反应,反应历程如下: H2O2+Iˉ→IOˉ+H2O H2O2+ IOˉ→H2O+O2+Iˉ 按此历程,可推导出总反应的速度公式: -=Kˊ[H2O2][ Iˉ] 当溶液体积不变时,[ Iˉ]是个常数,即: -=K[H2O2] 为一级反应。 一级反应的速度公式为: -=KCA (14一1) 式中:K为反应速度常数:CA为时间t时的反应物浓度.将(14一1)式积分得: lnCA=-kt+lnCA0 (14一2) 式中CA0为反应开始时(t=0)反应物的初始浓度。 从(14一2)式可见,一级反应的速度常数K与反应物的初始浓度无关。 由(14一2)式变换得: ln=-kt (14一3) 当CA=CA0时,t可用t1/2表示,即为反应的半衰期. t1/2== (14一4) 从式(14一4)可见,在温度一定时,一级反应的半衰期应与反应的速度常数成反比,而与反应物的初始浓度无关。 由反应方程式可知,在常温常压下,H2O2分解的反应速度与氧气的析出速度成正比。析出的氧气体积可由量气管测量。 若以Vt和CA表示时间t时量气管的读数和H2O2的浓度,Vf表示H2O2完全分解时量气管的读数,则CA∝(Vf-Vt). Vf值可由如下两种方法求取: (1) 外推法:以1/t为横坐标对Vt作图,将直线段外推至1/t=0,其截距即为Vf ; (2) 加热法:在测定若干个Vt的数据之后,将H2O2溶液加热至50~60℃约15分钟,可认为H2O2己基本分解。待完全冷却后,记下量气管的读数.即为Vt。 化学反应速度随温度的提高而加快。对一般反应及某些复杂反应,温度与反应速度的定量关系由阿仑尼乌斯经验公式表达: K=Ae 式中 E—反应的活化能,常以KJ/mol表示; T—绝对温度,K。
第 次课 4 学时
实验14 过氧化氢催化分解反应速率常数的测定 一、实验目的 1. 测定过氧化氢催化分解反应速率常数; 2. 掌握通过测量反应系统的体积跟踪反应系统浓度从而研究反应速率的方法。 二、实验原理 过氧化氢在没有催化剂存在时,分解反应进行的很慢。加入催化剂能够提高分解速率。过氧化氢分解反应的化学计量式如下: H 2O 2(l) = H 2O(l) + 1/2O 2(g) 若以KI 为催化剂,在KI 作用下催化分解步骤为: KI(l) + H 2O 2(l) = KIO + H 2O(l) (慢) KIO = KI(l) + 1/2O 2(g) 由于第一步的速率比第二步慢得多,所以,第一步为反应的控制步骤。因而可以假定其反应的速率方程式为: -dc A /dt =k ’c KI c A 式中,c A 为反应系统中反应到t 时刻H 2O 2浓度,因KI 在反应过程中浓度不变,故上式可简化为 - d I c A /dt = k I c A () 式中k=k ’c KI , 将上式分离变量积分: 当 t=0 时, C A =C 0 ; t=t 时, C A =C t; 定积分式为: ??=-A A C C t A A kdt c dc 0 0 () 积分结果: 0ln ln c kt c t +-= () 式是t c t ~ln 的直线方程。反应进行过程中,测定不同时刻 t 时反应系统中氧气的浓度c t ,取得若干组c t 、t 的数据后,以lnc t 对t 作图,得一直线,表明该反应为一级反应(准一级反应),直线斜率为-k 。 物理化学的研究方法是采用物理的方法测定反应系统某组分的浓度,所谓物理的方法是利用反应系统某组分或各组分的某些物理性质(如体积、压力、电动势、折光率、旋光度等)与其有确定的单值函数关系的特征,通过测量系统中该物理性质的变化,间接测量浓度变化。此种物理化学的实验方法最大的优点是可以跟踪系统某组分或各组分的物理性质的变化,从而,不需要终止反应,便可以随时测定某一时刻反应系统某组分
实验量气法测定过氧化氢催化分解反应速率常数 一、实验目的 1. 学习使用量气法研究过氧化氢的分解反应 2. 了解一级反应的特点,掌握用图解计算法求反应速率常数。 二、实验原理 H 2O 2在室温下,没有催化剂存在时,分解反应进行得很慢,但加入催化剂(如Pt 、Ag 、MnO 2、碘化物)时能促使其较快分解,分解反应按下式进行: H 2O 2H 2O + 12O 2→ (C2-1) 在催化剂KI 作用下,H 2O 2分解反应的机理为: H 2O 2H 2O ++KI KIO (慢)→ (C2-2) KIO KI +1 2O 2(快)→ (C2-3) 整个分解反应的速度由慢反应(C2-2)决定: 22222 2O H KI O H O H c c k dt dc =- (C2-4) 式中c 表示各物质的浓度(mol?L -1),t 为反应时间(s ),22O H k 为反应速率常数,它的大小仅决定于温度。 在反应中作为催化剂的KI 的浓度保持不变,令KI O H 122c k k ?=,则 222 2O H 1O H c k dt dc =- (C2-5) 式中k 1为表观反应速率常数。此式表明,反应速率与H 2O 2浓度的一次方成正比,故称为一级反应。将上式积分得: 01ln ln c t k c t +-=(C2-5) 式中c 0、c t 分别为反应物过氧化氢在起始时刻和t 时刻的浓度。反应半衰期为: 1 12/1693 .02ln k k t == (C2-6) 由反应方程式可知,在常温下,H 2O 2分解的反应速度与氧气析出的速度成正比。析出的氧气体积可由量气管测量。令V ∞表示H 2O 2全部分解所放出的O 2体积,V t 表示H 2O 2在t 时刻放出的O 2体积,则)(t t V V c -∝∞。将该关系式带入(C2-5),得到 ∞∞+-=-V t k V V t ln )ln(1(C2-7)
过氧化氢的催化分解
过氧化氢分解氧气 成员:罗玉洁、何瑾、徐丽、胡艳、骆磊、申林 一、实验目的 1、掌握实验室用双氧水制备氧气的原理、装置和操作。 2、了解影响双氧水制备氧气反应速率的因素。 3、能认识催化剂在化学反应中的作用及化学反应前后质量的变化。 二、实验原理 过氧化氢不稳定,在常温下就能缓慢分解放出氧气。但速度较慢,不易察觉。在过氧化氢溶液中加入适量二氧化锰后,能立即有氧气迅速放出。在此反应中,二氧化锰是催化剂,能加速该反应的发生。 二氧化锰 过氧化氢T 水+氧气 出。2 MnO 2 H2O O2 三、实验药品与仪器 实验药品:5% 30%勺双氧水、二氧化锰、氧化铜。 仪器:注射器(20ml)、锥形瓶、导管、软木塞、恒温水浴锅、集气瓶、橡皮管、钥匙。 四、实验步骤 1、实验室制备氧气 ①连接仪器,检查装置的气密性; ②在锥形瓶中加入少量二氧化锰粉末,旋紧软木塞,用注射器在双氧水瓶 里吸取10ml 5%双氧水,将注水器里的双氧水按需要的量缓慢注入加入装有少量二氧化锰粉末的锥形瓶中; ③等气泡连续均匀冒出时,开始收集; ④等集气瓶中液面下降至瓶口,瓶外有气泡产生时,实验结束。并用带火 星的木条进行检验。实验装置如下:
改进装置原因: (1)因锥形瓶中的二氧化锰不易收集。所以将锥形瓶换成试管,便于收集二氧化锰,好做称量,证明二氧化锰作为一种催化剂时, 在反应前后质量不变。 (2)用分液漏斗来控制反应的速率,收集装置采用向下排水法。 (3)通过改变浓度、温度、催化剂来探究对双氧水催化分解氧气速率的影响。 2、探究影响双氧水分解速率的因素 (1)浓度对反应的影响 分别将10ml 5%双氧水溶液与10ml 30%双氧水溶液与等量的MnO 混合于试管中,分别观察实验现象。 (2)温度对反应的影响 分别观察:室温下10ml 30%双氧水溶液,发生装置浸入80C 的水 浴加热的10ml 30%双氧水的现象。 (3)催化剂对反应的影响 10mL5%双氧水溶液加入少许氧化铜作为催化剂,10 ml 5%双氧水溶液加入少许二氧化锰作为催化剂。且氧化铜与二氧化锰等量,分别观察实验现象。 五、注意事项 1、在做实验之前,必须检查装置的气密性。气密性检查:用止水夹关 闭,打开分液漏斗活塞,向漏斗中加入水,水面不持续下 降, 就说明气密性良好。 2、双氧水的浓度不能过大,并且不适宜加多过氧化锰,容易造成反应太剧 烈。
【实验6】比较过氧化氢在不同条件下的分解活动目标 1.进行比较过氧化氢在不同条件下分解的实验。 2.说出过氧化氢在不同条件下分解的快慢,了解过氧化氢酶的作用和意义。 背景资料 1.相关知识 化学反应活化能在一个化学反应体系中,任何一个分子要发生化学反应,都必须先被活化,即增加能量。分子从常态跃迁到容易发生化学反应的活跃状态所需要的能量,称为化学反应的活化能。 酶在化学反应中的作用本质酶是一种有机催化剂,与无机催化剂相比较,其主要作用是高效性,即在常温常压下能显著地降低化学反应所需要的活化能,从而促进化学反应高效地进行。 2.实验原理 新鲜的肝脏中含有较多的过氧化氢酶,过氧化氢酶可以催化过氧化氢分解为水和氧气。过氧化氢酶在不同的温度下催化效率不同。FeCl3溶液中的Fe3+也对过氧化氢具有催化作用,但催化效率要低很多。 3.实验设计和意义 基于以上事实,本实验共设置了4组小实验(见下表)。 编 号 处理情况图示组别现象1 号常温对照组 过氧化氢的分解速率十分缓 慢(难以观察到气泡的产 生)
2号高温(90 ℃) 水浴 实验组 过氧化氢分解速率加快,有大 量小气泡产生 3号常温,加入 FeCl3溶液 实验组 与2号试管相比,有更多的 气泡产生 4号常温,加入过 氧化氢酶溶 液 实验组 3号试管相比,气泡大并且 产生的速率快 说明:2号和1号的对照实验说明,温度升高有助于过氧化氢的分解,但细胞内不可能存在高温条件;3号、4号未经加热也有大量气泡产生,说明催化剂能降低化学反应的活化能,能加快化学反应的速率;4号和3号的实验现象相对比说明,在相同的常温条件下,酶的催化效率远远高于无机催化剂的催化效率 由以上分析可知,酶在常温下催化效率很高。酶催化所需的条件和所产生的效果正是人体细胞所能提供的条件和所需要的效果,同时也说明了酶的高效性,这是本实验要达到的目标。 本实验设置的4组小实验有助于培养学生设置对照实验和控制实验变量的能力。 操作指南 1.材料新鲜的质量分数为20%的肝脏(如猪肝、鸡肝)研磨液。 2.用具量筒,试管,滴管,试管架,卫生香,火柴,酒精灯,试管夹,大烧杯,三脚架,石棉网,温度计。 3.试剂新配制的体积分数为3%的过氧化氢溶液,质量分数为3.5%的FeCl3溶液。
过氧化氢的催化分解 一、实验目的: 1.用静态法测定H 2O 2分解反应的速度常数和半衰期。 2.熟悉一级反应特点,了解反应物浓度、温度、催化剂等因素对一级反应速度的影响。 3.掌握量气技术和体积校正,学会用图解计算法求出一级反应的速度常数。 二、实验原理: 1. 凡反应速度只与反应物浓度的一次方成正比的反应,称为一级反应,实验证明H 2O 2的分解反应如下: 2 H 2O 2 → 2 H 2O + O 2 (1) 2. 若该反应属于一级反应,则其速度方程应是: 式中:C H2O2—时间t 时的H 2O 2浓度; k —反应速度常数。 3. 化学反应速度取决于许多因素,如反应物浓度、搅拌速度、反应压力、温度、催化剂等等。某些催化剂可以明显的加速H 2O 2 的分解,它们有Pt 、Ag 、MnO 2、FeCl 3、碘化物。本实验用I -(具体用KI )作为催化剂。由于反应在均匀相(溶 液)中进行,故称为均相催化反应。 设该反应为一级反应,且按下列式进行: H 2O 2 + I - → H 2O + IO - (A ) H 2O 2 + IO - → H 2O + O 2 (B ) 则因 及 其总反应速度为上两式之和,即: 则 k A C I - = k B C IO- [][]dt C d dt C d B O H A O H 2 22 2-=-222 2O H O H kC dt dC =-)2(()2 22 2O H IO B I A O H C C k C k dt dC --+=-2222·H O A A H O I d C k C C dt -????-=2222·H O B B H O IO d C k C C dt -????-=
50 过氧化氢(H 2O 2,又名双氧水)是一种“绿色”化工产品,广泛应用于化工、医药、环保、军工等行业[1] 。过氧化氢自身分解非常缓慢,但在杂质及外界条件的诱发下会发生分解反应,放出大量的热。当放出的热量足够高时,反应不可控会导致爆炸。自2004年以来,国内已发生十余起过氧化氢爆炸事故。事故原因主要是高温或混入杂质等因素导致过氧化氢快速分解爆炸。近年来,国内外学者对过氧化氢催化分解进行了大量实验及理论研究。本文对国内外研究成果进行归纳整理,以期为今后过氧化氢生产、使用及储运提供理论指导。 1?金属催化剂 金属催化剂具有较高的活性及选择性、容易重复利用、耐腐蚀及稳定性好的特点,自60年代末出现以来,便不断有学者对金属催化剂催化H 2O 2分解性能进行研究。 1.1?贵金属催化剂 贵金属中,除了对钌、铑、铱没有研究之外,金、银、钯、锇、铂都对过氧化氢分解反应具有催化作用。银与锇在碱性条件下是很活泼的催化剂[2] 。金是H 2O 2非均相分解典型催化剂,金的溶胶也具有催化活性。 Pt与Pd的催化活性非常相似。在Pd基催化体系中加入无机酸可抑制过氧化氢分解。这主要是因为质子的存在会使体系pH值降低,改变Pd基催化剂表面电荷分布,抑制H 2O 2在载体及活性位上的吸附,从而抑制过氧化氢分解。Br -与Cl -的存在会抑制Pd基催化剂催化活性,F -的加入会提高催化剂对分解反应的催化活性,I -的加入会造成催化剂失活。此外,在卤素离子与酸同时存在时的抑制作用明显大于单独使用的抑制作用,且金属Pd负载于亲水性载体时会促进过氧化氢分解反应的进行。在双氧水生产过程中为避免H 2O 2分解,酸化及卤素离子的使用是非常必要的。 1.2?主族金属催化剂 碱金属及碱土金属(Mg、Ca、Sr、Ba)都对H 2O 2分解具有催化活性。碱金属对过氧化氢的催化活性非常高。铅也是高性能非均相催化分解H 2O 2的物质之一。卤素中除氟 外,都对H 2O 2分解具有催化作用。 碳材料由于广泛用作Pd基与Pt基催化剂载体材料而获得广泛研究与关注。Voitko等[3]研究了水溶液中碳材料的物理及化学结构对过氧化氢催化分解的影响,发现不同形态的碳材料由于化学及物理结构不同,表面吸附活性与反应性均不同,对H 2O 2分解反应的催化活性及催化反应机理不同。活性炭对过氧化氢分解催化活性要比纳米级碳材料强。同时一些学者研究发现用酸对载体碳材料进行预处理后会在活性炭表面形成不同的酸性含氧官能团。形成的酸性官能团带负电荷,会降低载体材料的疏水性,抑制反应物到催化剂表面的吸附,从而抑制过氧化氢分解。含氧官能团酸性越强,H 2O 2分解速率越慢。 1.3?双金属催化剂 在钯基催化剂中添加第二活性金属,特别是Pb-Pt双金属催化剂,对过氧化氢分解的影响获得学者们广泛关注与研究。Li等[4]通过对Pt-Pd双金属催化剂的TEM图像进行分析发现:Pd与Pt在载体表面不是单纯的物理混合,可能是以合金的形式存在。Hasnat等研究了几种双金属催化剂、金属氧化物催化剂及金属催化剂对H 2O 2分解的催化活性。实验结果表明各种催化剂的催化活性为:Pt-Pd双金属催化剂> MnO 2 > K 2Cr 2O 7 > Au-Pc > Pt 基催化剂。 鉴于双金属催化剂的高效催化活性,许多学者不断对双金属催化剂高效催化性能成因进行探究。Li等提出:在双金属催化剂表面,Pd颗粒带正电荷。在Pd催化剂中添加带负电荷的第二活性金属(如Pt)会增加整个催化剂表面的负电荷区域,有利于过氧化氢分解反应进行。 1.4?其它金属催化剂 金属锰的催化活性非常高。不同价态的锰离子对过氧化氢分解的催化作用是不同的,Mn 2+不具有催化活性,可起助催化作用。但Mn 3+对过氧化氢分解具有强烈的催化作用。金属铬对H 2O 2分解反应的催化活性较弱,六价态的铬离子催化活性最高,可与H 2O 2发生氧化还原反应。铁与铁的各种络合物都对过氧化氢分解具有催化作用,铁对H 2O 2的催化分解与铁的氧化同时进行,不同价态的铁离子对过 过氧化氢催化分解研究进展 信云霞1?张帆2?贾学五2?吕志果1 1.青岛科技大学化工学院 山东 青岛 266042 2.中国石油化工股份有限公司青岛安全工程研究院 山东 青岛 266071 摘要:本文介绍了用于过氧化氢分解催化剂的研究进展情况。目前过氧化氢分解催化剂主要有负载型金属催化剂、过渡金属氧化物催化剂以及非金属催化剂。本文简要概括总结了各种催化剂对双氧水分解反应的催化效果及催化影响因素,为过氧化氢生产及应用提供理论指导。 关键词:过氧化氢?分解?催化 Research?progress?of?catalysts?used?for?hydrogen?peroxide?decomposition Xin?Yunxia 1,Zhang?Fan 2,Jia?Xuewu 2,Lü?Zhiguo 1 Qingdao University of Science & Technology ,Qingdao 266042,China Abstract:This?paper?introduces?the?research?progress?of?the?catalysts?used?for?hydrogen?peroxide?decomposition,which?include?supported?metal?catalysts,transition?metal?oxide?catalysts?and?non-metal?catalysts.?In?this?paper,the?catalytic?effect?and?influential?factors?of?various?catalysts?on?the?decomposition?reaction?of?hydrogen?peroxide?are?summarized,which?provide?theoretical?guidance?for?the?production?and?application?of?hydrogen?peroxide. Keywords:hydrogen?peroxide;?decomposition;?catalysis