
对硝基苯胺的制备与纯化
杨丽 2011301040057 化学基地班(三)
摘要:本实验用乙酰苯胺作为起始原料,首先经过硝化获得了邻硝基乙酰苯胺和对硝基乙酰苯胺的混合物。接着采取了两种分离纯化的途径:一种是先将制得的混合物经过重结晶后获得纯的对硝基乙酰苯胺,通过测定固体的熔点来验证所得对硝基乙酰苯胺的纯度。再将重结晶后的产品用氢氧化钠的醇溶液水解,取水解后的产品作薄层析和熔点测定来确定水解后的产物。
另一种方法是直接将硝化后的混合物水解,制得邻硝基苯胺和对硝基苯胺的混合物。通过薄层分析和熔点的测定来证实两者的存在。再分别用重结晶和水蒸气蒸馏的办法分离纯化所获得的产品。并通过薄层析和测熔点的方法来验证产品的组成和纯度。
最后,根据实验结果分析比较两种分离纯化途径的优劣。
绪言:对硝基苯胺常温下是淡黄色针状结晶,易于升华。熔点 148.5℃,沸点 331.7℃,相对密度1.424(20/4℃)。闪点199°,水中溶解度为0.0008g。微溶于冷水,溶于沸水、乙醇、乙醚、苯和酸溶液,有毒,空气中容许浓度为5mg/m3。吸入、口服和皮肤接触有害。所以在实验过程中要尽量避免与之接触。对硝基苯胺是染料工业极为重要的中间体,可直接用于合成:对苯二胺,邻氯对硝基苯胺, 2.6-二氯-4硝基苯胺,5-硝基-2-氯苯酚等,同时还是防老剂,光稳定剂,显影剂等的原料。可作黑色盐 K,供棉麻织物染色、印花之用。并且可作农药和兽药的中间体,在医药工业中可用于生产氯硝胺、卡巴肿、硝基安定、喹啉脲硫酸盐等。还可用于生产对苯二胺;抗氧化剂和防腐剂等。因此对硝基苯胺的合成具有很大的应用价值。工业上生产对硝基苯胺的方法有乙酰苯胺的硝化水解和对硝基氯苯氨解两种方法。
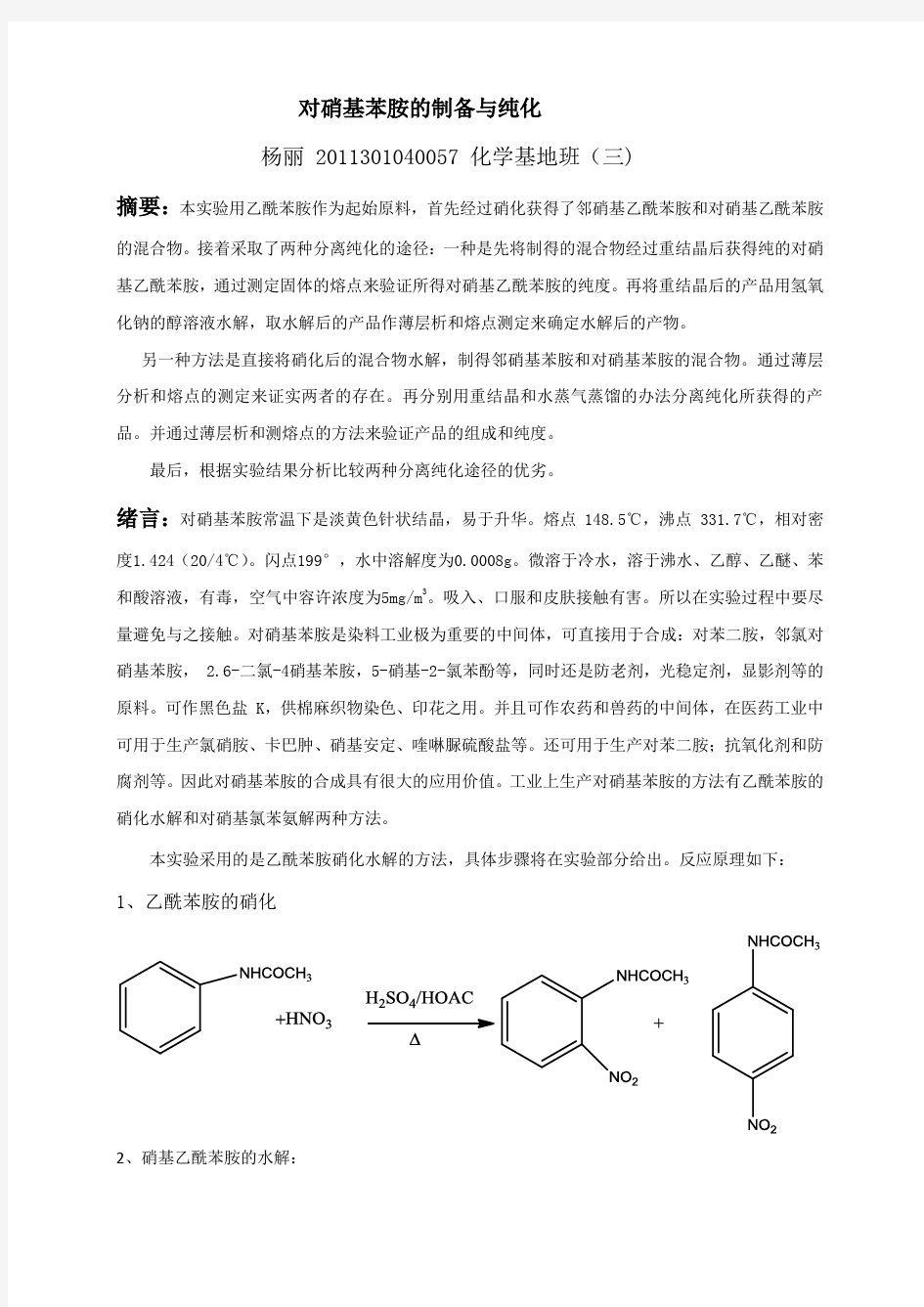
本实验采用的是乙酰苯胺硝化水解的方法,具体步骤将在实验部分给出。反应原理如下:1、乙酰苯胺的硝化
2、硝基乙酰苯胺的水解:
而纯化和分离的办法主要采取了薄层析、重结晶、水蒸气蒸馏三种办法。三者的分离原理如下。
薄层析:薄层色谱(TLC)是用来鉴别产物成分与辨别产物纯度的有效方法。不同物质的极性不同因此与展开剂的作用力不同,当物质随展开剂攀援而上时会由于攀援速度不同而分离开来。
溶剂前沿
溶剂前沿与起始线间距离品
点与起始线距离
样样品点与起始线间距离品
点与起始线距离
起始线
重结晶:重结晶是纯化静态物质的普适的、最常用的方法之一。用适当的溶剂把
含有杂质的晶体溶解,配成接近沸腾的浓溶液,趁热滤去不溶性杂质,使滤液冷却析出结晶,以达到纯化晶体的目的。
水蒸气蒸馏:有机物与水一起共热,当体系总的蒸气压等于大气压力时,体系沸腾,此时,有机物在低于100 o C的温度下随蒸气一起蒸出来,这样的操作叫做水蒸气蒸馏。
?水蒸气蒸馏的用途及适用场合:
水蒸气蒸馏是用来分离和提纯液态或固态有机化合物的一种方法,常用于下列场合:
(1)某些沸点高的有机化合物,在常压蒸馏虽可与副产品分离,但易将其破坏。
(2)混合物中含有大量树枝状杂质或不挥发性杂质,采用蒸馏、萃取等方法都难于分离;(3)从较多固体反应物中分离出被吸附的液体。
?被提纯物质必须具备以下几个条件:
(1)不溶或难溶于水;
(2)共沸腾下与水不发生化学反应;
(3)在100 o C左右时,必须具有一定的蒸气压[至少666.5 ~ 1333 Pa(5 ~ 10 mmHg)]
实验参数表格:
名称分子量性状折光率比重熔点
(o C)沸点
(o C)
溶解度(/100g)
水醇醚
乙酰苯胺135.17 白色有
光泽片
状结晶
1.5860 1.219 114.3 304 0.46
(20o
C)
36.9
(20o
C)
溶
临硝基乙酰苯胺180.16 淡黄色
片状或
棱状晶
体
1.4149 94 100
(0.133
KPa)
溶于
沸水
微溶
于冷
水
溶于
乙醇
溶于
乙醚
对硝基乙酰苯胺180.16 无色晶
体
1.41 215.6 100
(1.06x
10-3KPa)
溶于
热水
溶溶
邻硝基苯胺138.13 橙黄色
针状晶
体
1.44 69.7 284.5 微溶
于冷
水溶
于沸
水
溶于
乙醇
易溶
于乙
醚
对硝基苯胺138.13 淡黄色
针状晶
体,易升
华
1.424 148.5 331.7 0.00
08g
(冷
水)
溶于
沸水
溶溶
实验内容:
实验流程图乙酰苯胺
硝
化
邻、对硝基乙酰苯胺
测熔点 测熔点 薄层析
测熔点 薄层析
实验步骤 1、乙酰苯胺的硝化:
在100 mL 三口烧瓶中放入5.00g 制得的乙酰苯胺,加入10.0mL 冰醋酸。安装上电磁搅拌装置。在三颈瓶口分别装上温度计、回流冷凝管、恒压滴液漏斗。在恒压漏斗中加入4.0 mL 浓硝酸(比重为1.14 g/mL , 0.03 mol )和8 .0mL 浓硫酸(比重为1.84 g/mL )配成混酸。三颈瓶外用电热煲控温在50±5 o C ,边搅拌边缓慢加入混酸(约需20 min ),加完后60 o C 左右继续反应1小时。然后将反应液倒入20 g 碎冰中,即有黄色沉淀析出,过滤、水洗至中性。
实验装置图(一)硝化装置
2、硝基乙酰苯胺的水解:
重结晶
对硝基乙酰苯胺
水解
邻、对硝基苯胺
水
解
对硝基苯胺 重结晶
水蒸汽蒸馏
对硝基苯胺
邻硝基苯胺
对硝基苯胺
测熔点
薄层析
测熔点
薄层析
将得到的固体均分为两份,一份进行重结晶,粗产品转移到50ml烧瓶中,加入约10mL乙醇,在搅拌下加热至沸腾。观察有未溶解的固体,再补加乙醇约8mL后固体全部溶解,最后补加了5mL 乙醇。稍冷后,加入0.5g活性炭,并煮沸10min。在保温漏斗中趁热过滤除去活性炭。滤液倒入热的烧杯中。然后自然冷却至室温,冰水冷却,待结晶完全析出后,进行抽滤。用少量冷水洗涤滤饼两次,压紧抽干。将结晶转移至表面皿中,烘干后测定重结晶后固体的熔点,再将重结晶后的固体用自配的氢氧化钠醇溶液在加热沸腾的情况下回流水解半小时,再加入3.0mL水加热沸腾的情况下回流水解20min。再将溶液稍冷后倒入20 g冰水中,过滤,用水洗至弱碱性,烘干得水解产物。取水解后的产物做薄层分析和熔点测定。
水解装置 + 重结晶装置实验装置(二)
2.2 取另一份直接水解,水解方法与2.1中一样,水解之后仍将固体均分为两分,一份进行重结晶,重结晶的方法与2.1类似,只是乙醇的用量减半。再将重结晶的样品烘干测定熔点,并做薄层分析。将另一半固体进行水蒸气蒸馏,将蒸馏后收集到的馏分每次用10mL氯仿分两次萃取。将萃取所得液体再次蒸馏,直至烧瓶内溶剂仅剩3mL自然冷却至室温,将所得样品进行薄层分析。
蒸馏装置 萃取装置 实验装置(三)
实验结果与讨论: 1.实验结果: 1.1熔点测定结果
1.2薄层析结果:
物质 T 初(o
C ) T 全(o
C ) 熔距ΔT (o
C ) 标准熔点T
(o
C )
对硝基乙酰苯胺
(初产品重结晶)
165.0 193.0 28.0 168.0
190.0
22.0 215.6
对硝基苯胺 (重结晶加水解)
144.0 149.0 5.0 143.0 152.0 9.0 148.5 直接水解的初产 品
60.0
63.0 3.0 61.0
63.0
2.0
69.7
水解+重结晶后 的产品 59.0 65.0 6.0 61.0
66.0
5.0
69.7
对硝基苯胺 (水解+水蒸气蒸馏)
145.0 149.0 4.0 148.5 146.0
150.0
4.0
物质
Rf 值 样点黄色深浅
样点性状 重结晶再水解产品
样点1
0.59 颜色很浅, 椭球状 纯邻硝基苯胺 0.63 颜色深 椭球状 样点2
0.28 颜色极深 长条楔形 纯对硝基苯胺 0.28 颜色深 椭球状 直接水解的初产品 样点1
0.59 颜色深 椭球状 纯邻硝基苯胺 0.61 颜色深 椭球状 样点2
0.28 颜色浅 椭球状 纯对硝基苯胺 0.28 颜色深 椭球状 水解+重结
样点1
0.56 颜色深
椭球状
2、实验讨论
(1)熔点测定分析
由硝化产物直接重结晶得到的对硝基乙酰苯胺的熔点测定结果来看,熔程长,熔点相较于标准的对硝基乙酰苯胺的熔点-215.6o
C 来说偏低了许多。造成该实验结果的主要原因有:① 从得到的产品的晶型来看,产品呈土黄色泥状,基本看不出晶态。而晶体的晶型对晶体的熔点有很大的影响,我所得到的产品更偏向于是多晶或非晶,所以熔程较长。② 熔点低说明所含的杂质多,重结晶的效果欠佳,包含的杂质初步判断为临硝基乙酰苯胺。判断的理由是硝化过程中,在酸的作用下会有少量的乙酰苯胺被水解生成苯胺,但由于量少,在重结晶的过程中会全部溶解于溶剂中,不会给实验结果带来很大影响,而含量较多的邻硝基乙酰苯胺则会因为重结晶的的效果不佳而使得实验结果偏低。③ 熔点仪的温度计测温不准,造成所得数值偏低,这在其他的几个熔点测定实验中也可以看出。④ 晶体不够干燥。
①、② 两个解释最本质的原因是重结晶的过程中所加的溶剂量不够,溶剂用量不足会使得邻硝基乙酰苯胺在低温时并不能完全溶解在溶剂中,而随着对硝基乙酰苯胺一起析出,再加上晶体析出过程中,由于溶剂量过少,溶质析出过快,成核密度太大,微粒不能形成晶体而是以沉淀形式存在,且相对表面积增大,吸附现象严重,总的结果就是熔程长、熔点偏低。
(2)薄层析结果分析
①从薄层析结果来看,邻硝基苯胺的样点随溶剂移动的速度更快,比移值更大,
是由于邻硝基苯胺的极性比对硝基苯胺小,因此与吸附剂的结合力更弱,在吸附与脱吸的交替过程中脱吸占上风,因此与溶剂一起攀爬的速度快于对硝基苯胺。
②薄层析中,硝化后重结晶再水解的样品的样点拉得很长,并不是清晰的一点,说明产品纯度不高。除了有邻硝基苯胺和对硝基苯胺外还有其他有色杂质,这可能是硝化过程中由于温度控制不当,有多硝基化合物生成。多硝基化合物的生成会使得产品颜色加深,而我所得到的产品颜色确实很深。由此观之确实有少量多硝基化合物存在。
(3)综合分析
1、为什么要用氢氧化钠醇溶液作为水解试剂:
晶后的产品
纯邻硝基苯胺 0.56 颜色深 椭球状 样点2 0.28 颜色很浅 椭球状 纯对硝基苯胺
0.28 颜色深 椭球状 对硝基苯胺(水解+水蒸气蒸馏) 样点1 无 无 无 纯邻硝基苯胺 0.61 颜色深 椭球状 样点2
0.27 颜色深 椭球状 纯对硝基苯胺
0.27 颜色深 椭球状 邻硝基苯胺(水解+水蒸气蒸馏) 样点1 0.54 颜色深 椭球状 纯邻硝基苯胺 0.54 颜色深 椭球状 样点2
无 无 无 纯对硝基苯胺
0.26
颜色深
椭球状
胺基具有给电子性会使酰基碳钝化,因此水解所需的条件要剧烈一些,氢氧化钠醇溶液碱性强,水解效果好,以乙醇作溶剂提供了一个均相体系使反应更容易发生。
2、水解产品分析
重结晶后水解的产品中对硝基苯胺占绝大部分,但仍有少量的邻硝基苯胺,这从薄层析和熔点测定的结果中都可以看出。薄层析结果显示样品存在两个样点,一个与纯的邻硝基苯胺样点移动的速度一致,但颜色很浅;一个与纯的对硝基苯胺样点移动的速度一致,但颜色深。熔点测定时,熔点与对硝基苯胺的熔点十分接近。这两个实验结果都表明产物主要是对硝基苯胺。造成最终的产品中仍有邻硝基苯胺的原因很大一部分在于重结晶时的效果不好,有邻硝基乙酰苯胺,所以在水解之后产品不纯。
直接水解后的样品熔程短,熔点为62o C,十分接近邻硝基苯胺的熔点,而薄层色谱中样品仍有两个样点,一个与纯的邻硝基苯胺样点移动的速度一致,颜色很深;一个与纯的对硝基苯胺样点移动的速度一致,但颜色很浅。由熔点测定结果和薄层色谱结果可以得出,直接水解的产物中邻硝基苯胺居多。将初产品重结晶后,测得的熔点为63o C,相比于未重结晶的产品更接近纯的邻硝基乙酰苯胺的熔点,但改善不大。除了熔点改善不大之外,薄层色谱也十分相近。另外还有明显的熔程变长。而理论上重结晶后应该会使得熔程变短,熔点更接近真实值,所以实验结果与理论之间出现了悖论。这其中的原因是我在直接水解之后,将水解后的产品自然放置了一周,因此晶体的析出极其缓慢,成核密度低,形成的晶体大,晶型单一,所以直接得到的粗产品的熔程较短。而相较于重结晶时,晶体的及时其析出,晶型肯定比初产品差,这从外观也可以得到验证:粗产品为暗红色棱状晶体,而重结晶后是暗红色粉末状固体。而熔点改善小也是由于粗产品结晶过程长晶粒大,吸附包夹极少,纯度高,所以重结晶所能做的改善很小。
在水蒸气蒸馏试验中,我得到了0.13g对硝基苯胺,通过熔点的测定结果和薄层析的结果证实了它是比较纯的对硝基苯胺。而邻硝基苯胺几乎没有,在蒸发掉溶剂之后只在瓶壁上析出了少量固体,通过薄层分析证实了它是邻硝基苯胺,而且纯度很高。由水蒸气蒸馏实验可以得出一个与粗产品分析完全相反的结论:直接水解之后的产品中主要是对硝基苯胺。将粗产品分析与水蒸气蒸馏实验结果相比较不难看出他们之间存在明显的悖论:前者说明水解产物主要是邻硝基苯胺,而后者又证实主要是对硝基苯胺。
为什么会出现如此背道而驰的实验现象呢?首先,我们来看为什么邻硝基苯胺量会如此之多,这与温度控制有莫大关系。首先,在硝化的过程中我控温在63o C左右,但有时不慎温度会飙升到70o C以上,由于温度越高越有利于邻硝基乙酰苯胺的生成,所以在硝化之后邻硝基乙酰苯胺含量较高。但由直接重结晶的结果来看邻位虽然含量较高,但仍不至于完全盖过对硝基乙酰苯胺。所以除了邻硝基乙酰苯胺本身量多之外,更重要的原因在于我的水解过程。由直接重结晶再水解的结果来看可以排除水解试剂氢氧化钠醇溶液的影响,那么唯一可能带来该实验现象的就是我在析出晶体时实际上分了两步,第一步是水解之后我放至室温时有固体析出,但量很少,所以我将溶液抽滤后,并未直接弃去滤液,而是将他收集在250mL烧杯中,放置了一周,第二周发现烧杯中析出了大量暗
红色晶体,我将其抽滤后,用该晶体作了薄层析和熔点测定。以及重结晶。而将一周前析出的样品作了水蒸气蒸馏实验。
由我的实验过程,就不难看出问题的关键在于我做粗产品分析以及重结晶的样品与做水蒸气蒸馏的样品不同。前者是放置一周后析出的固体,后者是水解后直接洗出的固体。究其本质原因就在于邻硝基苯胺的水溶性比对硝基苯胺的水溶性高,这与两者的极性所导致的效果恰好相反:邻硝基苯胺的极性小,对硝基苯胺的极性大,根据相似相容原理,邻硝基苯胺更易溶于水。所以在溶剂量大,温度高的情况下邻硝基苯胺首先析出,而对硝基苯胺不析出。因此我提出了另一种解释,对硝基苯胺中,对硝基苯胺分子间的氢键相对来说比较强,与对硝基苯胺与水分子间的氢键相比不可忽略。而邻硝基苯胺没有自身分子间的氢键而只与水分子间形成氢键,所以临硝基乙酰苯胺在水中的溶解度大。同时将溶液放置很长时间后,溶剂挥发掉了,温度又进一步降低,自然地邻硝基苯胺就析出了,这也是为什么会造成水蒸气蒸馏结果和粗产品分析结果与重结晶结果之间存在悖谬的原因。
其实在实验之初,就出现过类似现象。也就是在硝化之后,抽滤时,首先析出的固体是浅黄色的,但是将滤液放置一段时间后,再将其抽滤,析出的固体就是橙黄色甚至是暗红色的了。很显然,浅黄色说明对硝基乙酰苯胺的量较多,而暗红色说明邻硝基乙酰苯胺的量多,也就是说总是存在邻硝基乙酰苯胺后析出,对硝基乙酰苯胺先析出的现象,造成该现象的原因与邻硝基苯胺和对硝基苯胺谁先析出的原因是一样的。
该实验之所以可以通过水蒸气蒸馏来分离邻硝基苯胺与对硝基苯胺,是由于在一个大气压下,邻硝基苯胺的饱和蒸汽压大于对硝基苯胺,因此在温度低于一百摄氏度时邻硝基苯胺先随水蒸气一起蒸出,如此便将邻硝基苯胺与对硝基苯胺分离开来。
水-对硝基苯
水-邻硝基苯胺
水
邻硝基苯
对硝基苯
胺
一个大气压
100oc
饱和蒸汽压
温度
比较两种合成和纯化路线的实验结果,从熔点值和薄层分析来看,先纯化后水解的办法比先水解后纯化的方法实验结果差,所得产品纯度低。这是因为先纯化得到的对硝基乙酰苯胺在水解的过程中会再一次引入杂质,导致先前的纯化所起的作用不大,要想得到纯的对硝基苯胺仍然需要进一步纯化。对比水蒸气蒸馏和重结晶的结果,水蒸气蒸馏所得产品的薄层析结果更纯,说明水蒸气蒸馏纯化比重结晶纯化效果要好。但是重结晶的实验操作比水蒸气蒸馏更简单。
综合上述实验结果,对硝基乙酰苯胺最好的合成及纯化路线是先硝化再水解,再进行水蒸气蒸馏。
附录:
实验仪器:50ml、100mL圆底烧瓶、100mL、50mL三口烧瓶、10ml量筒、玻璃棒、磁子、回流冷凝管、直型冷凝管、尾接管、温度计、电磁加热搅拌器、布氏漏斗、抽滤瓶、50mL、100mL、250ml 烧杯各一个、滤纸、表面皿、10ml及25ml及50ml锥形瓶、滴管、熔点仪、pH试纸、层析板、毛细管、熔点管、层析缸、棉花、水蒸汽发生装置
实验试剂:5.00g乙酰苯胺,浓硫酸,浓硝酸,冰醋酸,氢氧化钠固体,乙醇,石油醚,乙酸乙酯,氯仿
所用层析液是:体积比石油醚:乙酸乙酯 = 5 : 2
实验现象:熔点及性状
物质性状T初(o C)T全(o C)熔距ΔT(o C)
对硝基乙酰苯胺
(初产品重结晶)土黄色固体165.0193.0 28.0
168.0 190.0 22.0
对硝基苯胺
(重结晶加水解)土黄色泥状固
体
144.0 149.0 5.0
143.0 152.0 9.0
直接水解的初产
品暗红色晶状固
体
143.0 152.0 9.0
60.0 63.0 3.0
水解+重结晶
后
暗红色固体59.0 65.0 6.0
薄层分析:
注:在薄层析板前端的点叫做样点1,邻硝基苯胺。在薄层析板后端的点叫样点2,对硝基苯胺
的产品 61.0 66.0 5.0 对硝基苯胺
(水解+水蒸气蒸馏) 暗红色针状晶体
145.0 149.0 4.0 146.0
150.0
4.0
物质 Rf 值 样点黄色深浅
样点性状 重结晶再水解产品
样点1
0.59 颜色很浅, 椭球状 纯邻硝基苯胺 0.63 颜色深 椭球状 样点2
0.28 颜色极深 长条楔形 纯对硝基苯胺 0.28 颜色深 椭球状 直接水解的初产品
样点1
0.59 颜色深 椭球状 纯邻硝基苯胺 0.61 颜色深 椭球状 样点2
0.28 颜色浅 椭球状 纯对硝基苯胺 0.28 颜色深 椭球状 水解+重结晶后的产品
样点1 0.56 颜色深 椭球状 纯邻硝基苯胺 0.56 颜色深 椭球状 样点2 0.28 颜色很浅 椭球状 纯对硝基苯胺
0.28 颜色深 椭球状 对硝基苯胺(水解+水蒸气蒸馏) 样点1 无 无 无 纯邻硝基苯胺 0.61 颜色深 椭球状 样点2
0.27 颜色深 椭球状 纯对硝基苯胺
0.27 颜色深 椭球状 邻硝基苯胺(水解+水蒸气蒸馏) 样点1 0.54 颜色深 椭球状 纯邻硝基苯胺 0.54 颜色深 椭球状 样点2
无 无 无 纯对硝基苯胺
0.26
颜色深
椭球状
对硝基苯胺的制备 段东斑 (武汉大学化学与分子科学学院湖北武汉430072)
目录 一、实验目的-------------------------------------------------------3 二、实验原理-------------------------------------------------------3 2.1合成-----------------------------------------------------------3 2.2产品的分离与纯化-------------------------------------------4 三、主要试剂及产物的物理常数--------------------------------5 四、主要试剂规格、用量-----------------------------------------6 五、实验装置图-----------------------------------------------------6 六、实验步骤与现象-----------------------------------------------6 6.1苯胺的乙酰化--------------------------------------------------7 6.2乙酰苯胺的硝化---------------------------------------------7 6.3硝基乙酰苯胺的水解-----------------------------------------7 6.4柱层析与薄层层析------------------------------------------8 6.5蒸馏-----------------------------------------------------------8 七、产品的表征与纯度分析-------------------------------------9 7.1熔点的测定--------------------------------------------------9 7.2薄层色谱(TLC)---------------------------------------------10 7.3核磁共振氢谱1HNMR -------------------------------------10 八、产率计算及分析---------------------------------------------11 九、讨论------------------------------------------------------------12 十、其他合成方法------------------------------------------------13
乙酰苯胺的制备实验 一、实验原理 酰胺可以用酰氯、酸酐或酯同浓氨水、碳酸铵或(伯或仲)胺等作用制得。同冰醋酸共热来制备。这个反应是可逆的。在实际操作中,一般加入过量的冰醋酸,同时,用分馏柱把反应中生成的水(含少量的冰醋酸)蒸出,以提高乙酰苯胺的产率。 主反应: 二、反应试剂、产物、副产物的物理常数 三、药品 四、流程图
五、实验装置图 (1)分馏装置(2)抽滤装置(3)干燥装置 六、实验内容 在60ml锥形瓶上装一个分馏柱,柱顶插一支200℃温度计,用一个小锥形瓶收集稀醋酸溶液。 在锥形瓶中放入5.0ml(0.055mol)新蒸馏过的苯胺、7.4ml(0.13mol)冰醋酸和0.1g锌粉,缓慢加热至沸腾,保持反应混合物微沸约10min,然后逐渐升温,控制温度,保持温度计读数在105℃左右。经过40~60min,反应所生成的水(含少量醋酸)可完全蒸出。当温度计的读数发生上下波动或自行下降时(有时反应容器中出现白雾),表明反应达到终点。停止加热。这时,蒸出的水和醋酸大约有4ml。
在不断搅拌下把反应混合物趁热以细流慢慢倒入盛100ml冷水的烧杯中。继续剧烈搅拌,并冷却烧杯,使粗乙酰苯胺成细粒状完全析出。用布氏漏斗抽滤析出的固体,用玻璃瓶塞把固体压碎,再用5~10ml冷水洗涤以除去残留的酸液。把粗乙酰苯胺放入150ml热水中,加热至沸腾。如果仍有未溶解的油珠,需补加热水,直到油珠完全溶解为止。稍冷后加入约0.5g粉末状活性炭,用玻璃棒搅动并煮沸5-10min。趁热用保温漏斗过滤或用预先加热好的布氏漏斗减压过滤。冷却滤液,乙酰苯胺呈无色片状晶体析出。减压过滤,尽量挤压以除去晶体中的水分。产品放在表面皿上晾干后测定其熔点。产量:约5.0g。 纯乙酰苯胺为无色片状晶体。熔点mp=114.3℃。 (一)制备阶段 1.安装分馏装置:如图(1)所示,在100ml锥形瓶上装一个分馏柱,柱顶插一支200℃温度计,用一个100ml锥形瓶收集稀醋酸溶液。 2.加药品:在100ml锥形瓶中放入5ml新蒸馏过的苯胺、7.4ml冰醋酸和0.1g锌粉。 3.加热反应:用电热套缓慢加热至沸腾,保持反应混合物微沸约10min (注:为了让苯胺的酰化反应一段时间,暂时不要有馏分蒸出状态),然后逐渐升温,控制温度,保持温度计读数在105℃左右。经过40-60min,反应所生成的水(含少量醋酸)可完全蒸出。当温度计的读数发生上下波动或自行下降时(有时,反应容器中出现白雾),表明反应达到终点。停止加热。这时,蒸出的水和醋酸大约有4ml。 (二)后处理阶段 1.倒入冷水中析出产品:在不断搅拌下把反应混合物趁热以细流慢慢倒入盛100ml冷水的烧杯中。继续剧烈搅拌,并冷却烧杯,使粗乙酰苯胺成细粒状完全析出。 2.抽滤:用布氏漏斗抽滤析出的固体,用玻璃瓶塞把固体压碎。 3.洗涤:用5~10ml冷水洗涤以除去残留的酸液。
对氨基苯甲酸乙酯的制备方法 【【实验目的】 1. 通过苯佐卡因的合成,了解药物合成的基本过程。 2. 掌握氧化、酯化和还原反应的原理及基本操作。 3.学习以对甲苯胺为原料,经乙酰化、氧化、酸性水解和酯化,制取对氨基苯甲酸乙酯的原理和方法。 【实验原理】 苯佐卡因的合成涉及四个反应: (1)将对甲苯胺用乙酸酐处理转变为相应的酰胺,其目的是在第二步高锰酸钾氧化反应中保护氨基,避免氨基被氧化,形成的酰胺在 所用氧化条件下是稳定的。 (2)对甲基乙酰苯胺中的甲基被高锰酸钾氧化为相应的羧基。氧化过程中,紫色的高锰酸盐被还原成棕色的二氧化锰沉淀。鉴于溶液 中有氢氧根离子生成故要加入少量的硫酸镁作为缓冲剂,使溶液 碱性不致变得太强而使酰胺基发生水解。反应产物是羧酸盐,经 酸化后可使生成的羧酸从溶液中析出。 (3)使酰胺水解,除去起保护作用的乙酰基,此反应在稀酸溶液中很容易进行。 (4)用对氨基苯甲酸和乙醇,在浓硫酸的催化下,制备对氨基苯甲酸乙酯。 反应式如下: 【实验试剂】 对甲苯胺、高锰酸钾、无水乙醇、95%乙醇溶液、乙醚、锌粉、无水硫酸镁、七水硫酸镁、浓盐酸、18%盐酸溶液、浓硫酸、冰醋酸、10%氨水溶液、10%碳酸钠溶液 【实验器械】 数字显示熔点仪、电子台秤、电磁炉、磁力搅拌器、烘箱、球形冷凝管、直形冷凝管、空气冷凝管、刺型分馏柱、接收器、蒸馏头、圆底烧瓶(100mL、50mL)、烧杯(500mL、250mL、100mL)、量筒(50mL、10mL)、锥形瓶、抽滤瓶、布氏漏斗、分液漏斗、玻璃棒、药匙、pH试纸、表面皿【实验装置】
图1 图2 图3 【实验步骤】 (一)对甲基乙酰苯胺 在100mL圆底烧瓶中,加入10.7g(0.1mol)对甲苯胺、14.4mL(0. 25mol)冰醋酸、0.1g锌粉(<=0.1g),搭建装置(图1)作为反应装置,加热,使反应温度保持在100~110℃,当反应温度自动降低时,表示反应结束。取下圆底烧瓶,将其中的药品倒入放有冰水的500mL烧杯中,冷却结晶,然后抽滤,取滤渣即对甲基乙酰苯胺。取2g对甲基乙酰苯胺(其它的放入烘箱中烘干)放入50mL圆底烧瓶中,再加入10mL2:1的乙醇—水溶液和适量活性炭,搭建回流装置(图2)进行重结晶,加热15分钟后趁热抽滤除去活性炭,再冷却结晶,抽滤得成品,用滤纸干燥后,取部分测熔点,并记录数据。将烘干后的对甲基乙酰苯胺与重结晶后的对甲基乙酰苯胺一起称重,记录数据。 (二)对乙酰氨基苯甲酸 在100mL烧杯A中加入7.5g(0.05mol)对甲基乙酰苯胺、20g七水硫酸镁,混合均匀。在500mL烧杯B中加入19g高锰酸钾(不可过量)和42 0mL冷水,充分溶解。从B中移出20mL溶液于100mL烧杯C中,再将A中的混合物倒入B中,加热至85℃,同时不停搅拌,直至溶液用滤纸检验时无紫环出现,再边搅拌边逐滴加入C中溶液,至用滤纸检验紫环消褪很慢时停止滴加。趁热抽滤,在滤液中加入盐酸至生成大量沉淀,抽滤,收好产品。 (三)对氨基苯甲酸 称量上一步产物,并测熔点,记录数据。在100mL圆底烧瓶中加入5. 39g对乙酰氨基苯甲酸和40.0mL18%盐酸溶液,小火回流(图2)30分钟。然后,冷却,加入50mL水,用10%氨水溶液调节pH至有大量沉淀生成(此时pH≈5),抽滤,干燥产品,称重,测熔点,记录数据。 (四)对氨基苯甲酸乙酯 在100mL圆底烧瓶中加入1.09g对氨基苯甲酸、15.0mL95%乙醇溶液,旋摇圆底烧瓶,使尽早溶解,之后在冰水冷却下,加入1.00mL浓硫酸,生成沉淀,加热回流(图2)30分钟。然后将反应混合物转入250mL烧杯中,
乙酰苯胺的制备 一.实验目的 1.学习实验室制备芳香族酰胺的原理和方法。 2.训练固体有机物的热过滤、脱色、洗涤、重结晶、干燥等纯化技术。 二.实验原理 NH 2+CH 3COOH 3+H 2O 芳香族酰胺通常用伯或仲芳胺与酸酐或羧酸反应制备,因为酸酐的价格较贵,所以一般选羧酸。本反应是可逆的,为提高平衡转化率,加入了过量的冰醋酸,同时不断地把生成的水移出反应体系,可以使反应接近完成。为了让生成的水蒸出,而又仅可能地让沸点接近的醋酸少蒸出来,本实验采用较长的分馏柱进行分馏。实验加入少量的锌粉,是为了防止反应过程中苯胺被氧化。 三.试剂及物理常数 四、实验流程 5ml 苯胺 7.4ml 冰醋酸0.1g 锌粉 称重计算产率
抽滤装置 干燥装置 布氏漏斗 抽滤瓶 反应装置 六、操作要点和说明 1.合成 (1).反应物量的确定: 本实验反应是可逆的,采用乙酸过量和从反应体系中分出水的方法来提高乙酰苯胺的产率,但随之会增加副产物二乙酰基苯胺的生成量。二乙酰苯胺很容易水解成乙酰苯胺和乙酸,在产物精制过程中通过水洗、重结晶等操作,二乙酰基苯胺水解成乙酰苯胺和乙酸,经过滤可除去乙酸,不影响乙酰苯胺的产率和纯度。 苯胺极易氧化,在空气中放置会变成红色,使用时必须重新蒸馏除去其中的杂质。反应过程中加入少许锌粉。锌粉在酸性介质中可使苯胺中有色物质还原,防止苯胺继续氧化。在实验中可以看到,锌粉加得适量,反应混合物呈淡黄色或接近无色。但锌粉不能加得太多,一方面消耗乙酸,另一方面在精制过程中乙酸锌水解成氢氧化锌,很难从乙酰苯胺中分离出来。 (2).合成反应装置的设计: 水沸点为100℃,乙酸沸点为117℃,两者仅差17℃,若要分离出水而不夹带更多的乙酸,必须使用分馏反应装置,而不能用蒸馏的反应装置。本实验用分馏柱。 一般有机反应用耐压、耐液体沸腾冲出的圆形瓶作反应器。由于乙酰苯胺的熔点为114℃,稍冷即固化,不易从圆形瓶中倒出,因此用锥形瓶作反应器更方便。 分出的水量很少,分馏柱可以不连接冷凝管,在分馏柱支口上直接连尾接管,兼作空气冷凝管即可,使装置更简单。 为控制反应温度,在分馏柱顶口插温度计。 (3).操作条件的控制 保持分馏柱顶温度低于105℃的稳定操作,开始缓慢加热,使反应进行一段时间,有水生成
告验报实对氨基苯甲酸的制备合成化学实验名称课程名称 2 实验次数姓名汪建红化学化工学院二级学院专业化学 18 日实验日期: 3 月 mmHg % 大气压验条件:室温℃相对湿度 一、实验目的、熟悉制备对氨基苯甲酸的原理和方法;1 、熟练掌握回流装置的安装和使用; 2 、熟练掌握真空泵的使用方法。3二、实验原理、对氨基苯甲酸的用途1PABA,磺胺药具有抑制细菌把的组成部分(PABA)对氨基苯甲酸是维生素B(叶酸)10作为组分之一合成叶酸的反应的作用。、对氨基苯甲酸合成涉及的三个反应2)将对甲苯胺用乙酸酐处理变为相应酰胺,此酰胺比较稳定,这样可以在高锰酸钾1(氧化反应中保护氨基,避免氨基被氧化;)高锰酸钾将对甲基乙酰苯胺中的甲基氧化成相应的羧基;由于反应中会产生氢氧2(反应产物羧酸盐避免碱性太强而使酰基发生水解;根离子,故要加入少量硫酸镁作缓冲剂,经酸化后得到羧酸,能从溶液中析出。)水解除去保护的乙酰基,稀酸溶液中很容易进行。( 3 、合成对氨基苯甲酸的反应式3O(CHCO)23NHCOCHCHp-CHCHNHp-CHHCHCO+ 3266443323NaCHCO 232KMnONHCOCHHp-CHC2MnO+HCO+Kp-CHCONHCOH+KOH+ 44363246232+KCOHp-CHCONHCH+HHCOp-CHCONHC26432634 HCOCp-NHHHHCOCONHCp-CHHCH++COOH 26422463232三、仪器与试剂,直型水冷凝管,烧杯,锥形瓶,酒精灯,铁架台,℃)(100仪器:圆底烧瓶,温度计布什漏斗,真空泵,抽滤瓶。供参考. 试样:对甲苯胺(A.R),醋酸酐(A.R),结晶醋酸钠(CHCOONa·3HO)或无水醋酸钠23(A.R),高锰酸钾(A.R),硫酸镁晶体(MgSO·7HO)(A.R),乙醇(A.R),盐酸(A.R),硫酸(A.R),24氨水(A.R)。 四、实验装置图
乙酰苯胺的的最佳制备 姓名:xx 单位:xxx 摘要:对乙酰苯胺制备的微型实验条件进行探讨,确定乙酰苯胺制备微型实验的最佳条件。利用加热回流和重结晶法进行制备和提纯。获得较高产率的乙酰苯胺。乙酰苯胺制备的微型实验,利用较少量的试剂和较短的时间获得了满意的实验效果。(Preparation of Acetanilide micro experimental conditions to explore, determine acetanilide best conditions for preparation of micro-experiment. The use of heating and re-crystallization method return preparation and purification. A higher yield of acetanilide. Acetanilide preparation of micro-experiments, the use of smaller amounts of reagents and shorter time to obtain a satisfactory experimental results.) 关键词:乙酰苯胺重结晶(Acetanilide, recrystallization )冰醋酸(acetic acid)热过滤(hot filtration)提高产量(increase production) 前言:2011年10月18日,吉林农业大学2010级生命科学学院生物工程专业3班同学于有机化学实验室探讨了乙酰苯胺制备微型实验的最佳条件。主要是想通过对实验的分析和研究得知影响实验结果的因素,
实验报告 课程名称合成化学实验b 实验名称乙酰苯胺的制备 二级学院化学化工学院专业化学姓名汪建红实验次数 3 实验日期: 3 月 18 日 验条件:室温℃ 相对湿度 % 大气压 mmHg 一、实验目的 1、掌握苯胺乙酰化的原理和方法, 2、进一步熟悉固体有机化合物的提纯方法——重结晶 二、实验原理 1、乙酰苯胺的用途: 乙酰苯胺,白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂(俗称“退热冰”)、防腐剂和染料中间体。 2、苯胺乙酰化的必要性: (1)作为一种保护措施,将一级和二级芳胺(就是伯胺和仲胺)在合成中转化为其乙酰衍生物,降低芳胺对氧化性试剂的敏感性,使其不被反应试剂破坏, (2)氨基经酰化后,降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使其由很强的第I类定位基变成中等强度的第I类定位,使反应由多元取代变为有用的一元取代。 (3)由于乙酰基的空间效应,往往选择性地生成对位取代产物。 (4)在某些情况下,酰化可以避免氨基与其它功能基或试剂(如RCOCl,-SO2Cl,HNO2等)之间发生不必要的反应。 作为氨基保护基的酰基基团可在酸或碱的催化下脱除。 3、芳胺的乙酰化试剂选择: 芳胺可用酰氯、酸酐或冰醋酸加热来进行酰化,使用冰醋酸试剂易得,价格便宜,但需要较长的反应时间,适合于规模较大的制备。 酸酐一般来说是比酰氯更好的酰化试剂,用游离苯胺与纯乙酸酐进行酰化时,常伴有二乙酰胺[ArN(COCH3)2]副产物的生成,如果在醋酸——醋酸钠缓冲溶液中酰化,由于酸酐水解速度比酰化速度慢得多,可得到高纯度产物,但此方法不适用于硝基苯胺和其它碱性很弱的芳胺的酰化。
一.实验目的 1.学习实验室制备芳香族酰胺的原理和方法。 2.训练固体有机物的热过滤、脱色、洗涤、重结晶、干燥等纯化技术。 二.实验原理 NH 2+CH 3COOH 3+H 2O 芳香族酰胺通常用伯或仲芳胺与酸酐或羧酸反应制备,因为酸酐的价格较贵,所以一般选羧酸。本反应是可逆的,为提高平衡转化率,加入了过量的冰醋酸,同时不断地把生成的水移出反应体系,可以使反应接近完成。为了让生成的水蒸出,而又仅可能地让沸点接近的醋酸少蒸出来,本实验采用较长的分馏柱进行分馏。实验加入少量的锌粉,是为了防止反应过程中苯胺被氧化。 三.试剂及物理常数 四、实验流程 5ml 苯胺 7.4ml 冰醋酸0.1g 锌粉 称重计算产率 五、仪器装置
抽滤装置 干燥装置 布氏漏斗 抽滤瓶 反应装置 六、操作要点和说明 1.合成 (1).反应物量的确定: 本实验反应是可逆的,采用乙酸过量和从反应体系中分出水的方法来提高乙酰苯胺的产率,但随之会增加副产物二乙酰基苯胺的生成量。二乙酰苯胺很容易水解成乙酰苯胺和乙酸,在产物精制过程中通过水洗、重结晶等操作,二乙酰基苯胺水解成乙酰苯胺和乙酸,经过滤可除去乙酸,不影响乙酰苯胺的产率和纯度。 苯胺极易氧化,在空气中放置会变成红色,使用时必须重新蒸馏除去其中的杂质。反应过程中加入少许锌粉。锌粉在酸性介质中可使苯胺中有色物质还原,防止苯胺继续氧化。在实验中可以看到,锌粉加得适量,反应混合物呈淡黄色或接近无色。但锌粉不能加得太多,一方面消耗乙酸,另一方面在精制过程中乙酸锌水解成氢氧化锌,很难从乙酰苯胺中分离出来。 (2).合成反应装置的设计: 水沸点为100℃,乙酸沸点为117℃,两者仅差17℃,若要分离出水而不夹带更多的乙酸,必须使用分馏反应装置,而不能用蒸馏的反应装置。本实验用分馏柱。 一般有机反应用耐压、耐液体沸腾冲出的圆形瓶作反应器。由于乙酰苯胺的熔点为114℃,稍冷即固化,不易从圆形瓶中倒出,因此用锥形瓶作反应器更方便。 分出的水量很少,分馏柱可以不连接冷凝管,在分馏柱支口上直接连尾接管,兼作空气冷凝管即可,使装置更简单。 为控制反应温度,在分馏柱顶口插温度计。 (3).操作条件的控制 保持分馏柱顶温度低于105℃的稳定操作,开始缓慢加热,使反应进行一段时间,有水生成后,再调节反应温度使蒸汽缓慢进入分馏柱,只要生成水的速度大于或等于分出水的速度,即
专题一:有机物合成与推断 1.【2016新课标1卷】秸秆(含多糖类物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线: 回答下列问题: (1)下列关于糖类的说法正确的是______________。(填标号) a.糖类都有甜味,具有C n H2m O m的通式 b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖 c.用银镜反应不能判断淀粉水解是否完全 d.淀粉和纤维素都属于多糖类天然高分子化合物 (2)B生成C的反应类型为______。 (3)D中官能团名称为______,D生成E的反应类型为______。 (4)F的化学名称是______,由F生成G的化学方程式为______。 (5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5mol W与足量碳酸氢钠溶液反应生成44g CO2,W共有______种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为_________。(6)参照上述合成路线,以(反,反)-2,4-己二烯和C2H4为原料(无机试剂任选),设计制备对二苯二甲酸的合成路线_______________________。
2.【2016新课标2卷】氰基丙烯酸酯在碱性条件下能快速聚合为,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下: 已知:①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰 ② 回答下列问题: (1)A的化学名称为_______。 (2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。 (3)由C生成D的反应类型为________。 (4)由D生成E的化学方程式为___________。 (5)G中的官能团有_____、 _____ 、_____。(填官能团名称) (6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
对-硝基苯胺的制备MSDS 化合物名称 分子 量 性状 比重 (d ) 熔点 (℃) 沸点 (℃) 折光率 (n) 溶解度 水乙醇乙醚 苯胺93.12 液体 1.022 -6.1 184.4 1.586 3.618∞∞冰醋酸60.05 液体 1.049 16.5 118.1 1.371 ∞∞∞ 乙酰苯胺135 .1 斜方晶 体 1.214 133.4 305 - 0.53 3.580 21.20 46.60 7.25 对硝基苯胺138 .1 淡黄色 针状结 晶 1.424 148.5 331.7 0.000 8 邻硝基苯胺138. 12 橙黄色 针状结 晶 1.44 69.7 284.5 一、实验目的 1利用乙酰苯胺制备对-硝基苯胺; 2掌握连续合成的方法,复习抽滤、重结晶等实验基础操作。 二、实验原理 由于氨基对于苯环是强活化基团(亲电试剂主要进攻其邻对位),故可生成对硝基苯胺及邻硝基苯胺,降低了对-硝基苯胺的产率,因此我们用乙酰基对氨基进行保护。而且,加入乙酰基后,由于其空间结构较大并且降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使氨基由很强的第1类定位基变成中等强度的第1类定位基,使反应由多元取代变为有用的一元取代,这些均有利于后来的硝基在对位进行取代。在某些情况下,酰化可以避免氨基与其它功能基或试剂(如RCOCl,-SO2Cl,HNO2等)之间发生不必要的反应。 综合以上考虑,本实验中采用“乙酰苯胺→对-硝基乙酰苯胺→对-硝基苯胺”步骤进行合成。 以乙酰苯胺为反应物制备对-硝基乙酰苯胺,进而脱保护制备对-硝基苯胺,反应方程式如下:
NHCOCH3 +HNO3H2SO4 HOAc NHCOCH3NHCOCH3 + NO2 NO2 NHCOCH3NHCOCH3 + NO2 NO2NH2NH2 + NO2 NO2 +H2O KOH EtOH +CH3COOK 在制备对-硝基乙酰苯胺时,用醋酸做溶剂同时可以防止乙酰苯胺或对-硝基乙酰苯胺水解。对于产物来说,酸或碱都能够促使其水解,为了将粗产物中残留的酸中和掉而又不过量,实验中使用磷酸二氢钠,其中和结果是一种pH接近中性的缓冲溶液。由于邻-硝基苯胺形成分子内氢键,沸点低,对-硝基苯胺形成分子间氢键,沸点高,所以二者可以用水蒸气蒸馏的方法进行分离。 三、实验试剂 苯胺、浓盐酸、活性炭、乙酸酐、乙酸钠、冰醋酸、浓硫酸、浓硝酸、冰块、15%磷酸氢二钠溶液、95%乙醇、1:1硫酸、20%氢氧化钠溶液、石油醚、丙酮 四、实验步骤 乙酰苯胺→对-硝基乙酰苯胺→对-硝基苯胺 1..对-硝基乙酰苯胺的制备 在干燥的50ml锥形瓶中放入5克乙酰苯胺(0.037mol),加入7.9ml冰醋酸,加热至溶解。稍冷后相继用冷水浴和冰水浴冷却到10℃,滴入7.9ml浓硫酸,再在冰水浴中冷到10℃左右,溶液变得浓稠。 在干燥的25ml锥形瓶中混合3ml浓硝酸(含硝酸约0.044mol)和2.1ml浓硫酸,塞住瓶口,用冷水浴冷却到10℃到15℃,然后用滴管慢慢滴加到已制备的乙酰苯胺溶液中,边滴加边摇匀,控制反应温度在15℃到20℃之间,10到15分钟滴完。之后再室温下放置半小时以上,并注意监视温度变化。若发现温度上升超过室温,应以冰水浴冷却到15℃,然后重新在室温下放置并观察温度变化,直至在室温下连续放置半小时而温度不超过室温为止。 在100ml烧杯中放置42.5ml水和10克碎冰,将反应混合物倾注其中,搅拌,抽滤,尽量压干。 将固体转移到100ml烧杯中,加入15%磷酸氢二钠水溶液42.5到45ml,使液体呈中性,搅拌成糊状,抽滤。用约15ml水荡洗烧杯,一并转入抽滤漏斗,抽干后再用约25ml冷水洗涤滤饼,重新抽滤,用玻璃塞挤压滤饼,尽量抽干。将固体转移到表玻璃上晾干。分出一半产物,用95%乙醇重结晶纯化,另外一半不作处理,分别编号为A和B。 2.对-硝基乙酰苯胺的纯度测定 取少许A和B的晶体做熔点测定,记录三次熔点测定数值。 以石油醚与丙酮的等体积混合液作为展开剂进行薄层层析,计算比移值与样点数。
乙酰苯胺的制备 一、实验目的 1.掌握苯胺乙酰化的原理和方法, 2.掌握重结晶提纯固体有机化合物的原理和方法。 二、实验原理 乙酰苯胺的用途: 乙酰苯胺,白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂(俗称“退热冰”)、防腐剂和染料中间体。稳定性:在空气中稳定,遇酸或碱性水溶液易分解成苯胺及乙酸。 苯胺乙酰化的必要性: (1)作为一种保护措施,将一级和二级芳胺(就是伯胺和仲胺)在合成中转化为其乙酰衍生物,降低芳胺对氧化性试剂的敏感性,使其不被反应试剂破坏,(2)氨基经酰化后,降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使其由很强的第I类定位基变成中等强度的第I类定位,使反应由多元取代变为有用的一元取代。 (3)由于乙酰基的空间效应,往往选择性地生成对位取代产物。 (4)在某些情况下,酰化可以避免氨基与其它功能基或试剂(如RCOCl,-SO2Cl,HNO2等)之间发生不必要的反应。 作为氨基保护基的酰基基团可在酸或碱的催化下脱除。 芳胺的乙酰化试剂选择: 芳胺可用酰氯、酸酐或冰醋酸加热来进行酰化,使用冰醋酸试剂易得,价格便宜,但需要较长的反应时间,适合于规模较大的制备。 酸酐一般来说是比酰氯更好的酰化试剂,用游离苯胺与纯乙酸酐进行酰化时,常伴有二乙酰胺[ArN(COCH3)2]副产物的生成,如果在醋酸——醋酸钠缓冲溶液中酰化,由于酸酐水解速度比酰化速度慢得多,可得到高纯度产物,但此方法不适用于硝基苯胺和其它碱性很弱的芳胺的酰化。 乙酰苯胺的制备反应式: C6H5NH HCl C 6 H5NH3Cl 32C6H5NHCOCH3+CH3CO2H NaCl + 2 盐酸的作用:生成胺基正离子,降低了苯胺的亲核能力,减少副产物的生成,
邻硝基乙酰苯胺的制备实验报告 篇一:化学实验报告--乙酰苯胺的制备 化学实验报告--乙酰苯胺的制备乙酰苯胺的制备 1 1 、掌握苯胺乙酰化反应的原理和实验操作;2、学习固体样品的制备;3、学习分馏柱的原理及使用方法;4、掌握重结晶方法及操作; 5、熟悉固体样品熔点的测定方法; 2 N-苯乙酰胺 ,别名乙酰苯胺,具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰” 之称。乙酰苯胺可由苯胺与乙酰化试剂如醋酸、醋酸酐或乙酰氯等直接作用来制备。其特点比较如下:试剂反应活性价格来源副产物冰醋酸较慢便宜易得H 2 O 醋酸酐较快较贵受限CH 3 COOH 乙酰氯激烈较贵易得HCl 综合以上各因素考
虑,本实验选用乙酸作为乙酰化试剂。反应如下:乙酸与苯胺的反应速率较慢,且反应是可逆的,为了提高乙酰苯胺的产率,一般采用冰乙酸过量的方法,同时利用分馏柱将反应中生成的水从平衡中移去。由于苯胺易氧化,加入少量锌粉,防止苯胺在反应过程中氧化。乙酰苯胺不仅本身是重要的药物,而且是磺胺类药物合成中重要的中间体。本实验进行的反应是胺的酰化,在有机合成中有着重要的作用。作为一种保护措施,一级和二级芳胺在合成中通常被转化为它们的乙酰基衍生物以降低胺对氧化降解的敏感性,使其不被反应试剂破坏,然后再在芳环上接上所需基团,再利用酰胺能水解成胺的性质,恢复氨基;同时氨基酰化后降低了氨基在亲电取代反 应(特别是卤化)中的活化能力,使其由很强的第Ⅰ类定位基变为中等强度的第Ⅰ类定位基,使反应由多元取代变为有用的一元取代,由于乙酰
基的空间位阻,往往选择性的生成对位取代物。将固体物质加热到固态转变为液态时的温度即为该物质的熔点。纯净的固体化合物通常有固定的熔点,且熔程(固体开始熔化到全部熔化的温度范围)不超过 1 ℃。如果含有杂质,则熔点通常会比纯净物质降低,熔程也会加长。所以,可以通过测定熔点来鉴定有机物,并通过熔程来检验其纯度。测定混合物熔点可以鉴定两物质是否为同一物质。未知物A与已知物B 等量混合,若混合物熔点与A和 B 相同,则为同一物质。若比A或B 的熔点低得多且熔程加长,则为不同物质。物质在固态和液态时蒸汽压都随温度升高而升高。在交叉点处,固液态并存,此时温度为该物质熔点。根据拉乌尔定律,在一定温度、压力下,溶质的加入将降低溶剂的蒸汽分压,因此,杂质的存在将使得混合物熔点比纯净物低。但是,当混合物生成新的物质或者形成固溶体时,混合物熔点有
对甲氧基乙酰苯胺安全技术说明 中文名称:对甲氧基乙酰苯胺 CAS:51-66-1 英文名称:N-(4-Methoxyphenyl)acetamide EINECS:200-114-2 分子式:C9H11NO2 分子量:165.18914 基本信息 中文别名:4-甲氧基-N-乙酰苯胺;4-乙酰氨基苯甲醚;N-乙酰对甲氧基苯胺;N-乙酰基对甲苯胺;对甲氧基-N-乙酰苯胺;对乙酰氨基苯甲醚;4`-甲氧基乙酰苯胺;N-乙酰基-对-茴香胺;N-乙酰基对甲氧基苯胺;对异酰氨基甲氧基苯;甲氧基乙酰苯胺;N-乙醯對甲氧苯胺对甲氧基乙酰苯胺物理化学性质 性状灰白色晶体 熔点 130~132℃ 溶解性溶于热水、苯、乙醇和氯仿 对甲氧基乙酰苯胺用途 【用途一】用于制造分散染料 【用途二】用于制造分散藏青2GL、枣红GP色基,也是染料分散深蓝HGL及医药的中间体。 【用途三】用于制造分散藏青2GL、枣红GP色基,也是燃料分散深蓝HGL及医药中间体。 应用领域 用于制造分散染料 急救措施 【食入】如果受害人是清醒和警觉,给2-4 cupfuls,牛奶或水。不要给吃任何东西,处于昏迷状态的人。立即就医。 【吸入】立即从现场至空气新鲜。如果没有呼吸,进行人工呼吸。如呼吸困难,给输氧。 获得医疗救助。 【皮肤】获得医疗救助。至少15分钟,而用大量的肥皂和水冲洗皮肤,脱去被污染的衣服和鞋子。衣物重新使用前应清洗。 【眼睛】用大量的水冲洗至少15分钟,冲洗眼睛,并不时提起上下眼睑。立即就医。 处理 【处理】操作后彻底清洗。脱去被污染的衣服,清洗后方可重新使用。有足够的通风条件下使用。避免与眼睛,皮肤和衣物接触。保持容器密闭。避免食入和吸入。 危害辨识 【食入】可能引起胃肠道刺激症状,恶心,呕吐和腹泻。这种物质的毒理学性质没有得到充分的调查。 【吸入】可能引起呼吸道刺激症状。这种物质的毒理学性质没有得到充分的调查。 【皮肤】可能引起皮肤过敏。这种材料的毒理性质没有得到充分的调查。 【眼睛】可能会刺激眼睛。这种材料的毒理性质没有得到充分的调查。
班级 学号 有机实验报告 乙酰苯胺的制备 (微量实验) 院(系、部): 姓名: 年级: 专业: 指导教师: 教师职称: 2012年3月19日·北京 摘要 乙酰苯胺是磺胺类药物的原料,可用作止痛剂、退热剂和防腐剂。用来制造染
料中间体对硝基乙酰苯胺、对硝基苯胺和对苯二胺。在工业上可作橡胶硫化促进剂、纤维脂涂料的稳定剂、过氧化氢的稳定剂,以及用于合成樟脑等。 用冰醋酸做乙酰化试剂与苯胺制备乙酰苯胺,三组取不同量的试剂分别制备乙酰苯胺。用热水进行重结晶,精制乙酰苯胺,称重计算产率。分析乙酸苯胺制备过程中应注意的事项,以及影响产率的因素。 关键词:乙酰苯胺制备重结晶 Abstract Abstract: sulfa drugs acetanilide is the raw material, can be used as analgesics, antipyretic agents and preservatives. Used to make dyes intermediates of nitro acetanilide, p-nitroaniline and p-phenylenediamine.In the industrial rubber vulcanization accelerator can be used for fiber coating resin stabilizer, hydrogen peroxide stabilizer, as well as for synthetic camphor and so on. To do with glacial acetic acid and aniline acetylation reagent preparation acetanilide, three take different amounts of reagents were prepared acetanilide. Recrystallized with hot water, refined acetanilide, weighing calculate yield. During the preparation of acetic acid Aniline precautions, as well as the factors that affect yield. Key words:sulfa drugs acetanilide, preparation ,recrystallization
乙酰苯胺的合成与精制 一、实验目的和要求 1、熟悉氨基酰化反应的原理及意义。 2、掌握乙酰苯胺的制备方法。 3、学习重结晶的方法。 二、实验原理 乙酰苯胺又称退热冰,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。化学式为C6H5-NHCOCH3. 乙酰苯胺为白色有光泽片状结晶或白色结晶粉末,无臭或略有苯胺及乙酸气味,微溶于冷水,溶于热水、甲醇、乙醇、氯仿、丙酮等,不溶于石油醚。熔点113℃~114℃。合成路线如下: C6H5-NH2+(CH3CO)2O ────→CH3COOH+C6H5-NHCOCH3 三、实验药品与器材 苯胺、乙酸酐、滴液漏斗、三口烧瓶、温度计、真空泵等等 四、实验方法 (一)乙酰苯胺的制备 在250ml的三口烧瓶上配置温度计、冷凝管及滴液漏斗,将10ml 苯胺及30ml蒸馏水加入三口烧瓶中,反应在磁力加热搅拌器上进行,在磁子的搅拌下滴加14ml乙酸酐,控制滴加速度以保证反应温度不超过40℃,随着乙酸酐的加入,析出白色固体,滴加完毕于室温继
续搅拌30min,停止搅拌。室温下放置10min,析晶完全,得到白色晶体,抽滤,以冷水洗涤滤饼2次,抽干,得乙酰苯胺粗品。计算收率。 (二)乙酰苯胺的重结晶 取250ml单口烧瓶,加入2g乙酰苯胺粗品和90ml蒸馏水,加进1粒沸石,在电热套上加热至全溶后,稍冷,加入活性炭0.2g,继续加热回流10min。进行热过滤,将滤液转移至烧杯中,冷却,待析晶完全后抽滤,干燥,称重,计算收率。 五、注意事项 1、此次用到的是两种液体反应原料,尤其是醋酐的刺激性较强,应建议在通风橱内量取,并且远离眼睛。 2、切不可在沸腾的溶液中加入活性炭,以免引起暴沸。 3、热过滤时,也可采用抽滤装置。但布氏漏斗和吸滤瓶一定要预热。滤纸大小要合适,抽滤过程要快,避免产品在布氏漏斗中结晶。 六、实验结果 1、乙酰苯胺粗品的收率 2、重结晶的收率 七、思考题 1、为何要控制乙酸酐的滴加速度?
(实验报告)乙酰苯胺的制备 【目的要求】 ⑴熟悉氨基酰化反应的原理及意义,掌握乙酰苯胺的制备方法; ⑵进一步掌握分馏装置的安装与操作; ⑶熟练掌握重结晶、趁热过滤和减压过滤等操作技术。 【预习指导】 ⑴预习实验原理,了解乙酰化试剂的反应活性及用乙酸作乙酰化剂制备乙酰苯胺的方法。 ⑵认真阅读重结晶的原理和意义,复习趁热过滤和减压过滤操作技术。 ⑶通过查阅资料填写下表: 【实验原理】 乙酰苯胺为无色晶体,具有退热镇痛作用,是较早使用的解热镇痛药,因此俗称“退热冰”。乙酰苯胺也是磺胺类药物合成中重要的中间体。由于芳环上的氨基易氧化,在有机合成中为了保护氨基,往往先将其乙酰化转化为乙酰苯胺,然后再进行其他反应,最后水解除去乙酰基。 乙酰苯胺可由苯胺与乙酰化试剂如:乙酰氯、乙酐或乙酸等直接作用来制备。反应活性是乙酰氯>乙酐>乙酸。由于乙酰氯和乙酐的价格较贵,本实验
选用纯的乙酸(俗称冰醋酸)作为乙酰化试剂。反应式如下: 苯胺 乙酸 乙酰苯胺 冰醋酸与苯胺的反应速率较慢,且反应是可逆的,为了提高乙酰苯胺的产率,一般采用冰醋酸过量的方法,同时利用分馏柱将反应中生成的水从平衡中移去。由于苯胺易氧化,加入少量锌粉,防止苯胺在反应过程中氧化。 乙酰苯胺在水中的溶解度随温度的变化差异较大(20℃,0.46g ;100℃,5.5g ),因此生成的乙酰苯胺粗品可以用水重结晶进行纯化。其操作流程如下: 【仪器药品】 圆底烧瓶(100mL) 刺形分馏柱 直形冷凝管 接液管 量筒(10mL ) 温度计(200℃) 烧杯(250mL ) 吸滤瓶 布氏漏斗 小水泵 保温漏斗 电热套 苯胺 冰醋酸 锌粉 活性炭 【实验步骤】 馏出液 水乙酸固相 水水溶性杂质有色杂质 活性炭固相水水溶性杂质 乙酰苯胺 H 2O + NHCOCH 3 CH 3COOH + NH 2
乙酰苯胺的制备论文 吉林农业大学生命科学学院生物技术3班 作者:张洋摘要:本文通过实验研究了酰基化试剂和反应装置对乙酰苯胺合成产率的影响。研究实验结果表明乙酸酐为酰基化试剂制备乙酰苯胺的产率是最高的。但结合实验产率,产品纯度以及经济效益最终得出以冰醋酸为乙酰化试剂是实验室制备乙酰苯胺的最合适方案。 Abstract:In this paper, experimental study of the acylation reagent and experimental installation on Acetanilide yield. Research results show that acetic anhydride was the best acylation reagent. Above all, the experimental program for preparation of acetanilide on the teaching textbook was the best. 关键词:乙酰苯胺制备重结晶 实验部分 一.实验目的 1、掌握制备乙酰苯胺的原理和方法。 2、进一步学习重结晶和纯化固体的操作方法。 二、实验原理 制备乙酰苯胺时,常用的乙酰化试剂有冰醋酸、醋酸酐或乙酰氯等,当采用乙酰化试剂时反应最剧烈,醋酸次之,冰醋酸与苯胺反应最慢,但反应平稳、易于控制,且冰醋酸价格较便宜,故本实验采用冰醋酸作乙酰化试剂。 NH2+CH3COOH3+H2O 该反应是可逆反应,产率较低,为减少逆反应的发生,得到较高的收率,可增加乙酸的用量,另外还采取分馏法,控制温度在105到110度之间,不断除去生成的水,有效地使平衡向正反应方向移动。 纯乙酰苯胺为白色片状结晶,熔点为114度,稍溶于热水、乙醇、乙醚、氯仿、丙酮等溶剂,而难溶于冷水,故可用热水进行重结晶。 三、实验用品 1、仪器圆底烧瓶、温度计、分馏柱、锥形瓶、烧杯、抽滤装置、热浴漏斗
乙酰苯胺的制备 Preparation of acetyl aniline 实验课时:5学时 实验类型:综合实验 教学对象:应化、制药、化工、冶金、材料、医学等专业本科生 一、目的与要求 1.了解以冰醋酸为酰基化试剂制备乙酰苯胺的基本原理和方法。 2.掌握分馏操作和巩固重结晶和熔点测定等操作。 二、方法与原理 C6H5NH2 +CH3COOH → C6H5NHCOCH3 +H2O 以过量的乙酸和苯胺反应,并将产生的水脱离反应体系提高转化率。 乙酐和乙酰氯作酰化剂,反应速度较快,但价格较贵。选用乙酸作酰化剂,能更多地进行基本操作和实验方法的综合训练。 三、内容提要 苯胺用乙酸酰基化,用分馏装置使反应产生的水脱离反应体系,重结晶提纯粗品,干燥,测熔点以确定纯度。计算产率。 四、物理常数 五、教学要点 1.实验之关健: 1.分馏装置的安装; 2.控温蒸出反应生成的水使反应向右移动 3.反应终点的确定; 4.重结晶提纯。 2.教学安排 1.讲解实验原理及注意事项,乙酰化反应的方法与应用。 2.演示分馏装置操作。 3.复习和强调重结晶操作的关键步骤。(可结合上次重结晶实验中存在的问题,有针对性地指名演示操作,请同学们纠错,教师点评) 六、注意事项 1.制备时,所用仪器必须干燥(为什么) 2.应加入少许锌粒(什么作用?) 3.蒸出反应生成的水之前,必须保证乙酸与苯胺反应一段时间(为什么) 4.分馏时,必须控温105℃以下(为什么) 七、思考题及解答
1.为什么用分馏装置比蒸馏装置效果好? 答:分馏装置便于蒸馏出沸点差别不大的组分) 2.分馏时实际上收集的液体比理论上应产生的少要多,为什么? 答:因除水外,还有乙酸 3.苯胺是碱而乙酰苯胺不是,解释这种差异。 答:后者因氮原子与羰基的p-π,电子云向羰基氧偏移) 4.如果10g苯胺与过量乙酐作用,计算乙酰苯胺理论产量。(14.5g) 5.当苯胺用乙酸乙酰化时,为什么用过量酸,并将反应生成的水蒸出? 答;乙酸溶于水,易除去;利用沸点的差别,蒸去水,促使平衡右移 6.制备对硝基苯胺,硝化前为什么将苯胺转化为乙酰苯胺? 答:苯胺易氧化,转化为乙酰苯胺以保护氨基 7.苯胺和下列化合物反应,将得到什么产物? (1)琥珀酸酐,加热(2)二甲基乙烯酮 反应(2)中,先苯胺对烯酮进行亲核加成,然后重排并接受质子 八、参考书 1.黄涛主编.有机化学实验(第二版).北京:高等教育出版社. 2、兰州大学,复旦大学合编.有机化学实验(第二版).北京:高等教育出版社.