
基金项目:公益性行业(农业)科研专项资助项目(编号:nyhyzx07-011-06)
作者简介:傅力(1964-),女,新疆农业大学食品科学学院副教授。E 2m ai:l fl 1990@163.co m
收稿日期:2009-02-16
第25卷第3期2009年5
月Vol .25,No .3M ay.2009
里氏木霉高产纤维素酶菌株的选育及产酶培养基的优化
St udy on breedi ng and medi u m optim izati on of Trichoderma reese w ith hi gh cell u l ase acti vity 傅 力
1
FU Li
1
涂正东
2
TU Zhe ng 2dong 2
叶 凯
2
Y E Ka i
2
丁友昉
3
D ING Y ou 2fang
3
(1.新疆农业大学食品科学学院,新疆乌鲁木齐 830052;2.新疆农业科学研究院,新疆乌鲁木齐 830091;
3.天津科技大学生物工程学院,天津 300222)
(1.College o f F oo d Science ,X i njiang Agricult ura l Uni ver sity ,Uru m qi ,X i njiang 830052,Ch i na;
2.Xinjiang Acade my o f Agricult ura l S cience ,Uru m qi ,X i njiang 830091,China;
3.College of B iotec hnolo gy ,T ianjin Universit y o f S cience and Technolo gy ,Tianjin ,300222,China )
摘要:通过对里氏木霉D WC 原生质体紫外线诱变,筛选产纤
维素酶活力高的突变株并对该菌株的产酶培养基进行优化。研究原生质体最佳诱变时间以筛选高产纤维素酶的突变株,同时分别对产酶培养基中不同种类碳源和氮源、Vogel .s 母液、表面活性剂对CMC 酶活(C MCA)、FP 酶活(FPA)的影响进行了研究。结果表明:原生质体经过90s 诱变,得到产纤维素酶活力高的突变株D WC5,其C MCA 、FPA 分别达到410.2mg /mL #0.5h 和23.2m g/mL #h 分别为原菌株的1.5倍和1.2倍。D WC5突变株的C MCA 、FPA 达到最高水平的培养基条件是:氮源N H 4C l0.2%、碳源微晶纤维素1%、Vo ge l .s 母液4.0%、吐温800.1%~0.15%、微量元素母液0.01%。关键词:里氏木霉;纤维素酶;培养基;FP 酶活;CMC 酶活
A bs tract :The protop l asts of Tric hoder m a reeseiD WC was treated by UV rad i ati on f or ob t a i ning them utan tw i th h i gh cell u l ase activit y .Th e opti m al m ed i u m was st ud ied .The res u lts were as f oll o ws :The mu tantT ri chod er m a rees ei D WC5was obtai n ed f or 90s UV treat m ent .Th e e n z y m e acti vities of bot h C MC and FP of t h e mu tant D WC5reached 410.2m g /mL #0.5h 、123.2m g/mL #h respectivel y and t hey were 1.5ti m es and 1.2ti m es re 2spectivel y co mpari ng t o D WC ,res pecti vel y .The op ti m alm ed i um co m pos i 2ti on was n itroge n source NH 4Cl 0.2%,carbon s ource av i cel 1%,Vogel p s m ed i u m 4.0%,Tween 800.1%~0.15%,trace ele m entm i xt u re 0.01%.K eyword s :Trichoder m a reese ;Cell u l ase ;M ed i u m;C MCase acti vit y ;FPase acti v i ty
纤维素是地球上数量最大的可再生能源物质,每年全球光合作用的产物高达1.5@1011~2.0@1011t [1],中国每年仅农业生产中形成的农作物残渣(稻草、秸秆等)就约有20亿t [2]。但由于其木质纤维素含量高,生物降解缓慢,目前对其利用率不高。近年来对纤维素降解方面的研究最经济、环保的方法就是生物降解[3~5]。利用微生物或其产生的纤维素酶可将纤维素酶解为低分子量的己糖或戊糖,用于生产新型饲料、单细胞蛋白等,将缓解人类面临的粮食、能源及环境危机[6]。
纤维素酶在食品工业中也有着重要而广泛的用途,广泛用于果蔬加工、油料作物加工、茶叶生产、酒精生产、啤酒生产、食醋酿造、活性物质提取等方面。目前研究发现的能降解纤维素的微生物多为木霉、青霉、曲霉等真菌,它们普遍存在酶活力较低的问题[2]。筛选高效纤维素分解菌是降解纤维素的关键之一,其中利用诱变手段进行筛选优良菌株是提高纤维素酶活的有效途径之一[7,8]。
本试验对里氏木霉(T richoderma reese i)D WC 进行紫外线诱变,选育产纤维素酶活力高的突变株,并对其高产纤维素酶培养基进行优化,为实际生产中利用纤维素酶提高纤维素的利用率提供依据。
1 材料与方法
1.1 材料与仪器
菌种:里氏木霉(Trichode r ma reese i)D W C :新疆农业大学微生物与发酵实验室保藏,其C M CA 、FPA 分别为273.5mg /mL #0.5h 和102.7m g/mL #h ;
10
培养基:纤维素斜面培养基[9]:Vo gel.s母液4%,微晶纤维素1%,微量元素母液0.01%[10],琼脂2%,吐温800.1%, p H5.1;
纤维素液体培养:纤维素斜面培养基中不加琼脂,另加0.1%消泡剂;
基本培养基:葡萄糖30g,NaN O
32g,K
2
HPO
4
1g,
FeS O
40.01g,KC l0.5g,M g SO
4
#7H
2
O0.5g,H
2
O1000mL,
p H6.6;
再生完全培养基:用0.6M蔗糖溶液代替H
2
O配制基本培养基;
溶液:醋酸缓冲液:NaAC#3H
2
O15.80g和HAC 4.92mL,用去离子水2000mL定容,调p H值至4.80?
0.05,最长贮存时间4周;
0.6M NaC l溶液:将35.1g NaC l溶解于0.2M Na
2HPO
4
溶液中,用0.2M Na H
2PO
4
调到p H5.8,定容至1L;
超净工作台:W-C J-ICU型,苏州净化有限公司;
恒温振荡箱:T H Z-98A型,上海)恒科技有限公司;
恒温培养箱:D H P)9162型,上海)恒科技有限公司;
台式低速离心机:TD5A)WS型,长沙湘仪离心仪器有限公司;
恒温水浴锅:HW S26型,上海)恒科技有限公司;
p H计:DEL TA320型,梅特勒)托利多仪器上海有限公司;
立式电热压力蒸汽灭菌器:LDZX-50KB,上海中安医疗器械厂;
光栅分光光度计:722型,上海精密科学仪器有限公司。
1.2方法
1.2.1D WC原生质体制备[11]制备方法见参考文献[11]。
1.2.2D WC原生质体紫外线(UV)诱变[12]用0.6M N aC l 溶液稀释原生质体至105个/mL,将原生质体5mL移入9c m 的无菌培养皿中,置于20W紫外灯下30c m处,边搅拌边照射,照射时间分别为30,60,90,120s。照射后在红灯下分别将不同照射时间诱变处理的菌悬液稀释适当倍数,每个稀释倍数取0.1mL涂布于再生完全平板,用黑布包好。同时用无菌水对原生质体稀释,取10-2,10-3,10-4稀释液各0.1mL,涂布于基本培养基平板,在30e下培养70h。统计菌落数,计算原生质体经紫外线诱变后的再生率。
1.2.3高产菌株的筛选挑取完全再生平板上的单个菌落,接种于纤维素斜面培养基上,30e下培养7d,按1.2.4方法测酶活。
1.2.4纤维素酶活力测定方法[13]以羧甲基纤维素钠酶活(C MCase acti vity,简称C MCA)和滤纸酶活(FP ase acti vity 简称FPA)为测定指标,2种酶活力测定均采用3.5)二硝基水杨酸显色法。
(1)CMCA:在测定条件下1mL酶液30m i n酶解羧甲基纤维素钠产生1m g葡萄糖为一个单位。用mg/mL#0.5h 表示。
(2)FPA:在测定条件下1mL酶液1h酶解滤纸产生1m g葡萄糖为一个单位。用m g/mL#h表示。
1.2.5纤维素酶的发酵方法和酶液的制备将1环里氏木霉接种在纤维素固体斜面上,30e培养5~7d形成孢子后,用1mL无菌水将孢子洗下,得到菌悬液。250mL三角瓶装纤维素液体培养基40mL,接入菌悬液1mL,30e,转速150r/m in摇床培养4d。然后将2mL上述培养液再接入40mL纤维素液体培养基中,30e、150r/m in摇床培养7d。发酵液经2000r/m i n,10m i n离心除去菌体及培养基残渣,上清液用醋酸缓冲液作适当稀释,测定C MCA和FPA。
1.2.6产酶培养基优化
(1)不同种类碳源对酶活力的影响:按照1.2.5方法,但在纤维素液体培养基中碳源分别采用微晶纤维素、纤维二糖、小麦杆、稻草杆和C MC,每种碳源用量均为1%。
(2)不同种类氮源试验:按照1.2.5方法,但在纤维素液体培养基中采用最佳碳源,氮源分别采用氯化铵、硝酸铵、硫酸铵、硝酸钾、硝酸钠、乙酸铵、草酸铵、磷酸氢二铵、柠檬酸铵、尿素为氮源,用量均为0.2%。
(3)Voge l.s母液加量试验:按照1.2.5方法,但在纤维素液体培养基中采用最佳碳源,氮源,Vo gel.s母液加量分别选择3.0%、3.5%、4.0%、4.5%、5.0%。
(4)表面活性剂种类和添加量试验:按照1.2.5方法,但在纤维素液体培养中采用最佳碳源,氮源,Vo ge l.s母液,表面活性剂分别采用0.1%吐温80、0.1%Triton-100和0.1%SDS。
2结果与分析
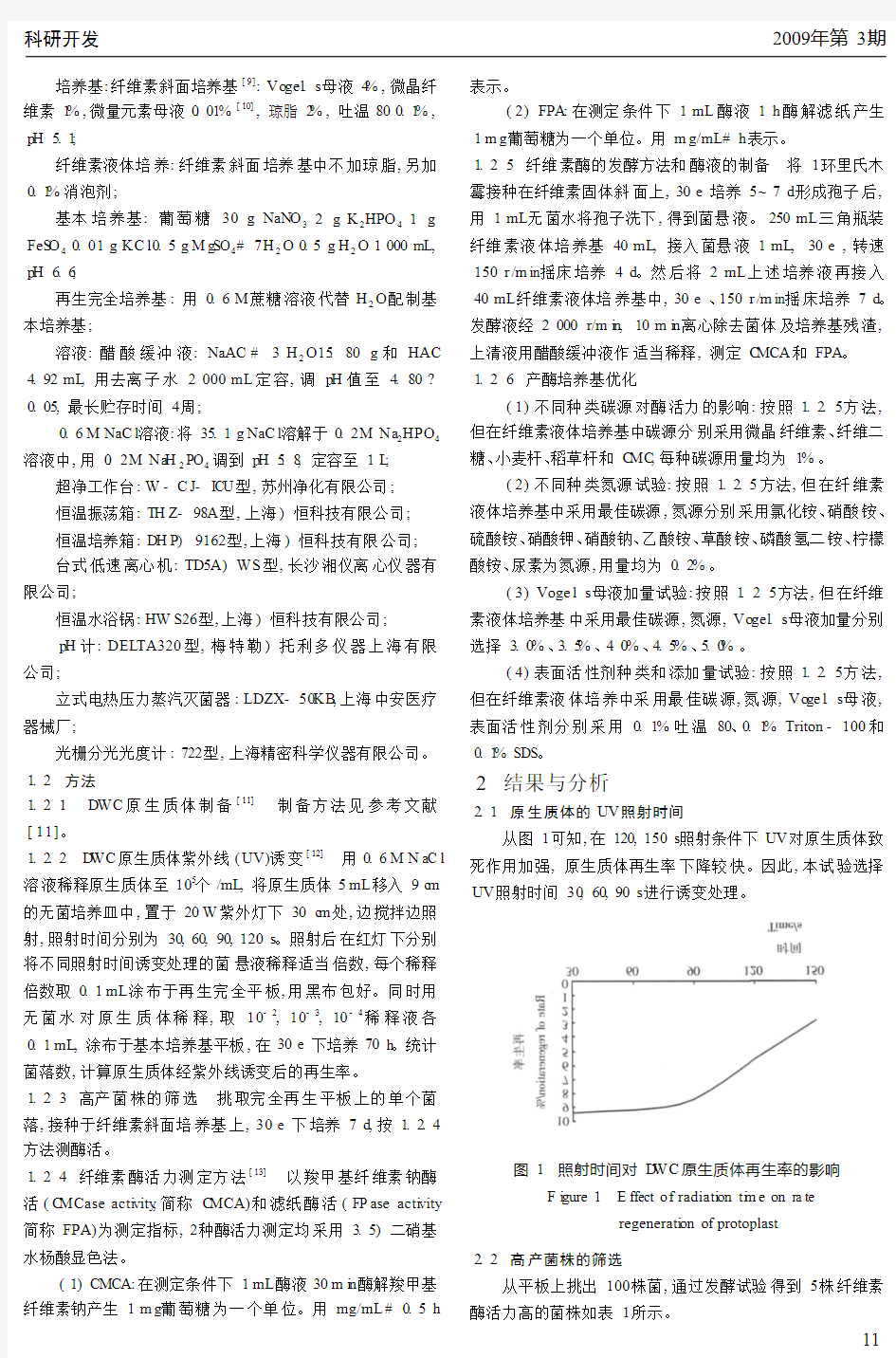
2.1原生质体的UV照射时间
从图1可知,在120,150s照射条件下UV对原生质体致死作用加强,原生质体再生率下降较快。因此,本试验选择UV照射时间30,60,90s
进行诱变处理。
图1照射时间对D WC原生质体再生率的影响
F i gure1E ffect of radiati on ti m e on ra te
regenerati on of protoplast
2.2高产菌株的筛选
从平板上挑出100株菌,通过发酵试验得到5株纤维素酶活力高的菌株如表1所示。
11
科研开发2009年第3期
表1 诱变后高产菌株的酶活Table 1 The enzy me acti viti es of mutants
菌株照射时间/s C MCA /
(mg #mL -1#0.5h -1)
FP A /(m g #mL -1#h -1)
D WC590410.2123.2D WC1490402.5107.1D WC3960397.797.3D WC4260393.996.9D WC21
30
376.0
106.1
UV 处理90s 筛选得到的D WC5活力最高,其C MCA 、
FPA 分别达到410.2m g/mL #0.5h 和123.2mg /mL #h ,分别分为原菌株的1.5倍和1.2倍。故90s 为最佳照射时间,选定D W C5做为以下试验菌株。2.3 产酶培养基的优化
由图2可知,以微晶纤维素为碳源,C MCA 最高为414.1mg /mL #0.5h ,其次是以C M C 为碳源,C M C A 为312.1mg /mL #0.5h ,再次以纤维二糖、小麦杆、稻草杆,C MCA 分别为221.7,221.4,220.3mg/mL #0.5h ,以乳糖、麦芽糖、葡萄糖、蔗糖为碳源,C MCA 最低。由于纤维素酶是诱导酶
[14]
,以纤维素原料为碳源其酶活较高,纤维素原料是
纤维素酶良好的诱导剂,以其它糖类为碳源虽能促进菌体的生长,但却抑制了酶的产生,必须在这些物质被耗尽后才有
纤维素酶产生。
图2 不同种类碳源对C MCA 及FPA 的影响F i gure 2 Effect of d ifferen t carban substrate
on C MCA and FPA
以微晶纤维素为碳源,FPA 最高为120m g/mL #h ,其次是以CMC 和麦芽糖为碳源,FPA 分别为68,54mg /mL #h ,再次为纤维二糖、小麦杆粉、稻草杆粉为碳源,FPA 分别为18,17,19mg /mL #h ,以乳糖、蔗糖葡萄糖为碳源,FPA 最低,所以1%微晶纤维素为最佳碳源。2.4 不同种类氮源对酶活力的影响
由图3可知,氮源的种类对C MC A 和FPA 的影响相似,以氯化铵为氮源其C MC A 、FPA 最高,分别达425m g/mL #0.5h 和119m g/mL #h ,其次是硝酸铵,酶活分别达到171.6mg /mL #0.5h 和67m g/mL #h ,再次为硫酸铵,C M 2C A 、FPA 分别达到146.9mg /mL #0.5h 和65m g/mL #h 。其余氮源2种酶活均较低。所以0.2%氯化铵为最佳氮源。
图3 不同种类氮源对C MCA 及FPA 的影响F i gure 3 E ffec t of different n itro gen substrates
on C MCA and FPA
2.5 Voge l .s 母液浓度对酶活力的影响
由图4可知,Voge l .s 母液加量为4.0%时,C MCA 和FPA 均为最高,分别为410.7mg /mL #0.5h 和203m g/mL #h ;当Voge l .s 母液加量4.5%时,酶活分别达到328m g/mL #0.5h 和188mg /mL #h ;低于4.0%或高于4.5%时,菌体生长速度慢,导致产酶过低。由此可以确定Vogel .s 母液最佳加量为4.0%
。
图4 Voge l .s 母液添加量对C MCA 及FPA 的影响F ig u re 4 Effect ofVoge ls 'soluti on on C MCA and FPA 2.6 表面活性剂对酶活力的影响
试验发现在0.1%吐温80、0.1%T riton-100和0.1%SDS 中,只有吐温80对D WC5产酶有促进作用,而另外两个因素对产酶无明显作用。这与孔显良[15]、庄桂[16]研究结果相似。吐温80的作用在于增加了细胞壁的通透性和增加细胞内诱导物的含量使纤维素酶的释放增加[17]
。
图5 吐温80添加量对C MCA 及FPA 的影响F i gure 5 E ffect of T ween 80on C MCA and FPA 12
第25卷第3期
傅 力等:里氏木霉高产纤维素酶菌株的选育及产酶培养基的优化
选择吐温80的添加量为:0.05%,0.1%,0.15%,0.2%。
由图5可知:吐温80添加量为0.15%时效果最好,其C MCA和FPA分别达到451.6mg/mL#0.5h和253mg/mL#h;低于或高于0.15%时,酶活均有所下降。所以选择吐温80添加量为0.15%
3结论
(1)对D W C原生质体诱变时间采取90s,得到产纤维素酶活力高的突变株D WC5,其C MCA、FPA分别达到410.2mg/mL#0.5h、123.2m g/mL#1h,分为原菌株的1.5倍、1.2倍。
(2)D WC5突变株C MCA、FPA达到最高水平的培养基组成是:氮源NH
4
C l0.2%、碳源微晶纤维素1%、Vogel.s母液4.0%、微量元素母液0.01%、吐温800.15%。
参考文献
1曲小爽,顿宝庆,郭明鸣,等.一株嗜热纤维素分解菌的分离及其酶学性质的初探[J].中国农业科技导报,2009,11(1):124~ 128.
Qu X i aoshu ang,Dun Baoqi ng,Guo M i ng m i ng,et a.l In iti al st ud ies on i solati on of a t h er m oph ilic cell u l ose2degrad i ng bacteria and its enzy2 mo l ogy characteri s tics[J].J ournal ofAgricu l tural Science and T ech2 nol ogy,2009,11(1):124~128.
2邓毛程,王瑶,阳元娥.一株绿色木霉液体深层发酵产纤维素酶工艺研究[J].食品与机械,2004,20(03):6~8.
Deng M aocheng,W ang Yao,Yang Yuan e.St udy on t he technics of deep liqu i d f er m entation of cell u lose2en z y m e w i th a Trichoder ma green [J].Food&Mach i nery,2004,20(03):6~8.
3Masoh i ro N,Masah i roG,H irof um iO,et a.l L2s orbose i nduces cell u2 lase gene transcri pti on i n t he cell u l o l ytic f ungus T ri chod er m a reesei [J].Cu rr Gen et,2001(38):329~334.
4R iz zattiA C S,Jorge J A,TerenziH F,et a.l Purificationand p roper2 ti es of a ther mostab l e extracell u l ar B2d2xy l osi d ase produced by a t her2 motolerantA s p erg ill us phoen i cis[J].Jorunal of IndustrialM i crob i olo2 gy and Bi otec hno l ogy,2001(26):156~160.
5黄继,彭智平,于俊红,等.降解玉米秸秆纤维素的真菌筛选及其产酶条件研究[J].广东农业科学,2009(1):89~91.
Huang J,i Peng Zh iping,Yu Junhong,et a.l Screen i ng of a m aize stra w cell u lose2deco m pos iti on f ung i strai n and it's cell u l as e2p roduci ng conditi on[J].Guangdong Agri cu lt u ral Sciences,2009(1):89~91. 6吴丹,邓泽元,范亚苇,等.粗壮脉纹孢菌液体发酵产纤维素酶的条件优化[J].食品与机械,2007,23(3):25~27.
W u Dan,Deng Zeyu an,Fan Y a we,i et a.l The op ti m al liqu i d f er2 m entati on cond itions of cell u lase produ cti on by neurospora crassa[J].
Food&M ach i nery,2007,23(3):25~27.
7冯培勇,张婷,王艳杰.复合诱变选育高产纤维素酶黑曲霉菌株[J].安徽农业科学,2008,36(36):15774~15775.
Feng Pe i yong,Zh ang T i ng,WangY an ji e.Selecti on of t he h i gh2yiel d2
i ng cell u l ose2n i ger strai n[J].Journal of Anhu iAgricultural Sci ences,
2008,36(36):15774~15775.
8马旭光,张宗舟,刘星斌.航天诱变黑曲霉菌株Z M28产纤维素酶的固态发酵条件研究[J].中国酿造,2008(23):37~40.
M a Xuguang,Zhang Zongzhou,L i u X i ngb in.Study on s oli d2state f er2 m entati on cond itions of spacem u t ated Aspergill u s n i ger Z M28f or cel2 l u l ase p roduction[J].Ch i na Bre w i ng,2008(23):37~40.
9崔腾蛟.里氏木霉D WC5育种及其发酵性能的研究[D].天津:天津科技大学,1997.
Cui Tengji ao.St ud i es on breed i ng ofT ri choder m a reeseiD WC and i ts
f er m entation[D].T ian ji n:T i an ji n U n i vers it y of Science and Techno l2
ogy,1997.
10傅力,丁友昉,古丽娜孜,等.微量元素对里氏木霉D WC5产纤维素酶的影响[J].新疆农业大学学报,2000,23(2):49~51.
Fu L,i D i ng You fang,Guli naz,i et a.l E ffect of trace ele m ents on cell u l as e acti vity fro m T ric h oder m a rees eiD WC5[J].J ournal ofX i n2 ji ang A gricu lt u ralUn i versity,2000,23(2):49~51.
11傅力,王德培,丁友昉.里氏木霉D WC原生质体制备条件的研究[J].新疆农业大学学报,2003,26(2):52~55.
Fu L,i W ang Depe,i D i ng Youfang.Studies on the prep arati on and regen erati on conditi on s of protop l asts of T ri chod er m a reesei D WC [J].J ournal ofX i n ji ang Agricu l turalUn i vers i ty,2003,26(2):52~
55.
12杜连祥.工业微生物学实验技术[M].天津:天津科学技术出版社,1992,183,230.
13傅力.里氏木霉高产纤维素酶菌株的选育及发酵条件的研究
[D].北京:中国农业大学,2000.
Fu L.i St ud ies on t he sel ecti on ofT ric h oder m a reesei for h i gh2yiel d cell u l as e p roduci ng strain and i ts f er m entati on cond iti ons[D].Bei2 ji ng:Ch i na Agri cu lt u ralUn ivers i ty,2000.
14Ghos e T K.M eas u re m ent of cell u l as e acti vit y[J].Pu re and App.l Ch e m.,1987,59(2):257.
15孔显良,陈必成,王俊英,等.黑曲酶变异株UV211248的选育及产糖化酶条件的研究[J].微生物学通报,1984,14(2):51~54.
Kong X ian li ang,Chen Bic h eng,W ang J unyi ng,et a.l St udy on se2 lecti on ofA.n i ger UV211248m utan t and its'enzy m e p roduci ng con2 diti on[J].M icrob i ology,1984,14(2):51~54.
16庄桂.黑曲霉H S-16纤维素糖化菌的选育及在酒精发酵中的应用[J].工业微生物,1996,26(4):21~27.
Zhuang Gu.i Selecti on ofA.n iger HS216Strai n and i ts app lication to alcoho l fer m entati on[J].Indu stri alM icrob iol ogy,1996,26(4): 21~27.
17张启先.纤维素和纤维素酶[J].微生物学通报,1976(2):31~
34.
Zhang Q i x i an.Cell u lose and cell u l ase[J].M icrob i ol ogy,1976(2): 31~34.
13
科研开发2009年第3期
本科开放项目 题目:产纤维素酶菌株的筛选及其酶活的测定 学生姓名: 指导教师: 学院: 专业班级: 2016年3月
产纤维素酶菌株的筛选及其酶活的测定 摘要 纤维素作为植物光合作用的主要多糖类产物,是高等植物细胞壁的主要成分,是公认的自然界数量最丰富、最廉价的可再生有机物质资源。据估计,纤维素生成量每年高达1000亿吨。我国每年农作物秸秆总产量为7亿吨左右,仅农业生产中形成的农作物残渣(如稻草、玉米秸、麦秸等),每年就有5亿吨之多。纤维素的降解是自然界碳素循环的中心环节。但由于纤维素的结构特点,对纤维素的利用仍然非常有限。目前仅有20%的纤维素物质被开发利用,大量的纤维素物质因无法分解利用而废弃,不仅造成资源浪费,而且污染环境。随着人口数量的不断增长和人民生活水平的不断提高,能源危机、食物短缺、环境污染等问题日益严重,寻找利用可再生资源、节省粮食、减少环境污染的有效途径显得日趋重要。采用微生物技术处理秸秆是当前研究最多的一种秸秆处理方法,纤维素酶能将天然纤维素降解,生成纤维素分子链、纤维二糖和葡萄糖,然而目前制约纤维素材料转化为乙醇并实现产业化的关键因素之一是纤维素酶效率低下,从而造成生产成本过高。因此,筛选具有高活性纤维素酶的秸秆降解微生物菌株以及相关研究是当前研究的热点和难点。 关键词:纤维素降解高活性纤维素酶微生物菌株
目录 第1章绪论 (1) 1.1 实验原理 (1) 1.2 实验仪器及试剂 (1) 1.2.1 实验材料 (1) 1.2.2 实验仪器 (1) 1.2.3 培养基 (2) 第2章实验步骤 (3) 2.1 采样培养 (3) 2.2 初筛 (3) 2.3 复筛 (3) 2.4 酶活的测定 (3) 2.4.1原理 (3) 2.4.2溶液配制 (3) 2.4.3实验步骤 (4) 第3章实验结果 (6) 3.1 标准曲线的绘制 (6) 3.2 菌株复筛结果 (6) 3.3 测定纤维素酶活力结果 (7) 结束语 (8) 参考文献 (9)
从土壤中分离产几丁质酶的真菌 作者:王春学号:11101680 摘要:几丁质是自然界中储量仅次于纤维素的生物多聚体,它广泛存在于真菌、硅藻、节肢动物和原生动物等生物体中,是绝大多数真菌细胞壁的结构物质,同时还是昆虫中肠围食膜的主要成分[1].几丁质酶(Chitinase,EC3.4.1.14)[2]可催化水解几丁质的β21,4糖苷键生成N2乙酰2D2氨基葡萄糖(NAG),它在植物病虫害,尤其是对真菌病的防治方面,以及在几丁质废物的转化和利用等方面都具有重要作用,其研究受到人们的广泛重视.通过几丁质作为碳源,从土壤中筛选产几丁质酶菌株. 1 材料与方法 1.1 培养基 1.1.1 平板培养基 (1)细菌几丁质培养基(分离用):蛋白胨10g,K2HPO40.7g,MgSO40.5g,KH2PO40.3g,胶体几丁质5.0g,琼脂15~20g,蒸馏水1L,pH值为7. 2.(2)纯几丁质培养基:胶体 几丁质 5.0g,KNO31.0g,NaCl0.5g,K2HPO40.5g,MgSO40.5g,FeSO40.01g,琼脂20g,蒸馏水1L,pH值为7.2.1.1.2 摇瓶培养基 (1)种子培养基(LB培养基):蛋白胨10g,酵母膏5g,NaCl10g,蒸馏水1L,pH值为7.0.(2)发酵培养基:用细菌几丁质培养基(分离用),但不加琼脂 1.2 菌株的分离 1.2.1 菌株初步分离从生产几丁质的工厂排污沟附近土壤采集土样,经过烘干及风化干燥,置于60目分样筛过筛,备用.称取1g土样放入加有9mL无菌水的离心管,分别稀释制成10-1,10-2,10-3,10-4,10-5,10-6不同稀释倍数的土壤溶液.从10-3,10-4,10-5,10-6不同稀度倍数的4管土壤稀释液中各吸取0.1mL,接种在纯几丁质培养基和细菌几丁质培养基的平板上,用涂布棒涂布均匀,在30℃下培养72h. 1.2.2 菌种的二次筛选从第1次稀释涂布的平板中挑取可以产生透明圈的菌落,再一次通过稀释涂布的方法,将其接种于纯几丁质平板和细菌几丁质平板上,培养72h,以取得纯菌落平板.从第2次筛选的纯菌平板上选取水解圈直径与菌落直径比最大的菌种,将其接种于50mL的LB种子培养基上,12h后以2%的接种量接于100mL的细菌几丁质发酵培养基中,在30℃下进行扩大培养. 1.3 菌种的鉴定 1.3.1 细菌染色体DNA提取从新培养产几个质酶活性高的革兰氏阴性细菌平板上,挑取一环菌落至加有500μLTE缓冲液的1.5mL微量离心管中,混匀后沸水浴1.5min,迅速低温离心(12000r?min-1)10min,取上层清液分装后,置4℃下保存备用. 1.3.2 16SrDNA引物根据16SrDNA的结构,应用B2/B3做引物,该引物扩增片段包含V8和V9两个高变区,扩增产物大小为1050bp(basepair,碱基对)左右.这两个引物序列为B2:5’2ACGGGCGGTGTGTAC23’;B3:5’2CCTACGGGAGGCAGCAG23’. 1.3.3 聚合酶链反应(PCR)检测 PCR反应体系为20μL,二次蒸馏水1 2.6μL,10倍扩增缓冲液2.0μL,25mmol?L-1Mg2+1.6μL,各2.5mmol?L-1的脱氧核苷三磷酸(dNTP)0.4μL,20μmol?L-1引物各1.0μL,DNA模板1.0μL,5GU?L-1Taq酶0.4μL.PCR循环:94℃预变性5min,94℃变性60s,50℃退火60s,72℃延伸90s,循环30次,并在72℃后延伸15min. 1.3.4 扩增产物的电泳分析用1倍的TAE缓冲液配制质量分数为1%琼脂糖凝胶.取PCR 扩增产物10μL,加2μL溴酚蓝指示剂,混匀后加样,于100V下电泳1.5h,紫外灯下观察电泳结果. 1.3.5 序列测定与分析将观察到的PCR产物切胶,用胶回收试剂盒回收后,连接到
高效产纤维素酶菌株ZJW-6发酵条件优化 摘要:在筛选出纤维素酶高产菌株的基础上,对纤维素酶高产菌株ZJW-6采用单因素试验进行不同条件下的液体发酵培养,使用DNS法对发酵后的菌悬液进行酶活力测定从而获得其最优发酵条件?结果表明,菌株ZJW-6产纤维素酶的最优发酵条件是以蛋白胨+(NH4)2SO4为氮源培养基,在30 ℃?pH 6下振荡培养48 h? 关键词:纤维素分解菌;发酵条件;纤维素酶;酶活力 Research on the Optimum Fermentation Conditions of High-Yield Cellulolytic Enzymes Strain ZJW-6 Abstract: The optimum fermentation conditions of high-yield cellulolytic enzymes strain ZJW-6 were studied in this paper. The strain was cultured under different liquid fermentation conditions and enzymes activity of bacteria suspension was determined using DNS method. The results showed that the optimum fermentation conditions of ZJW-6 was as follows: peptone and (NH4)2SO4 as nitrogen source, shaking for 48h at 30℃ and pH 6. Key words: cellulose-decomposing microorganisms; fermentation conditions; cellulose; enzyme activity 纤维素酶是指能降解纤维素生成纤维素二糖和葡萄糖等小分子物质的一组酶的总称?随着人们对纤维素酶研究的深入,纤维素酶在食品?饲料?环境保护?能源和资源开发等各个领域中发挥着越来越大的作用,因而引起了全世界的关注,其研究也取得了很大进展?但是纤维素酶的生产仍然存在着酶活力低?生产周期长等问题,大大限制了其大规模工业化生产[1]?对高产纤维素酶菌株ZJW-6采用单因素试验法进行不同条件下的液体发酵培养,使用DNS法对发酵后的菌悬液进行酶活力测定从而获得最优发酵条件,旨在为其工业化发酵生产打下基础? 1 材料与方法 1.1 材料 1.1.1 菌种菌种为邢台学院生物化学系微生物实验室筛选并保存的产纤维素酶菌株? 1.1.2 培养基液体培养基:羧甲基纤维素钠10.0 g/L,蛋白胨10.0 g/L,磷酸二氢钾1.0 g/L,硫酸铵0.2 g/L,氯化钠10.0 g/L,去离子水1 000 mL,pH 7.0[2]?
一、研究的目的及其意义 1.意义:能源危机这个时代沉重不可避免的话题以及同样重要的环境污染问题需要更加重视。纤维素乙醇作为新的清洁能源的一支,正在备受瞩目的开发研究之中。当前获得的纤维素酶的活性偏低,满足不了工业化生产的要求。虽然微生物可以直接降解天然的纤维素原料,但是,已知的纤维素酶却不能直接高效的降解结晶纤维素。如何快速有效地获得高活性的纤维素酶及产酶菌株成为了研究的热点之一。本实验利用刚果红脱色圈法,从多种含降解纤维素的自然环境中,得到高纤维素酶的细菌,进一步进行紫外诱变处理,获得酶活显著提高且具有遗传稳定性的菌株,最后通过单因素优化实验,初步确定较优的培养条件。这对利用木质纤维素原料的发酵制备燃料乙醇,解决当今世界所面临的环境污染、资源和能源危机等问题具有一定的现实意义。 2.目的 ①了解产纤维素酶微生物分离的基本原理和方法; ②掌握筛选原则与操作方法; ③掌握纤维素酶活力检测原理与方法; ④掌握诱变育种原理与紫外诱变的操作方法; ⑤掌握优化方法; ⑥掌握发酵罐的基本操作; ⑦了解正交分析方法。 二、国内外的研究现状和发展趋势 据估计,通过植物的光合作用,地球上每年合成的植物量约达1.8*1011t,其中有一半是纤维素物质[1,3],我国每年农作物稻秆?产量达6xl08t之多,利用微生物产生的纤维素酶,将这些闲置的纤维素资源水解转化,则可以在能源、词料、食品、纺织、造纸等方面得以有效利用[4,6],不仅可以减少因堆弃和焚烧对环境带来的污染,还将带来的巨大的经济效益和社会价值。 能源危机和环境污染的凸显,使得可再生清洁能源之一的生物质乙醇的进一步研发迫在眉睫。虽然国内外对于发酵工艺和代谢工程的研究较为广泛,但是目前取得的进展仍然存在较大的不足。一方面,人类获得的纤维素酶酶活力偏低,且不能直接高效降解天然结晶的木质纤维素。另一方面,自然界的大量微生物却可以直接快速的利用天然的木质纤维素来迅速繁衍。筛选并获得高活性的纤维素酶及其菌种,对于纤维素乙醇的研究具有重要意义。 三、研究的主要任务 1.调查并充分查阅资料; 2.设计实验方案; 3.样品的采集与处理; 4.实验操作的准备; 5.详细的实验流程;
从土壤中分离产几丁质酶的真菌 摘要:几丁质是自然界中储量仅次于纤维素的生物多聚体,它广泛存在于真菌、硅藻、节肢动物和原生动物等生物体中,是绝大多数真菌细胞壁的结构物质,同时还是昆虫中肠围食膜的主要成分[1].几丁质酶(Chitinase,EC3.4.1.14)[2]可催化水解几丁质的β21,4糖苷键生成N2乙酰2D2氨基葡萄糖(NAG),它在植物病虫害,尤其是对真菌病的防治方面,以及在几丁质废物的转化和利用等方面都具有重要作用,其研究受到人们的广泛重视.通过几丁质作为碳源,从土壤中筛选产几丁质酶菌株. 1材料与方法 1.1培养基 1.1.1平板培养基(1)细菌几丁质培养基(分离用):蛋白胨10g,K2HPO40.7g,MgSO40.5g,KH2PO40.3g,胶体几丁质5.0g,琼脂15~20g,蒸馏水1L,pH值为7. 2.(2)纯几丁质培养基:胶体 几丁质5.0g,KNO31.0g,NaCl0.5g,K2HPO40.5g,MgSO40.5g,FeSO40.01g,琼脂20g,蒸馏水1L,pH值为7.2.1.1.2摇瓶培养基(1)种子培养基(LB培养基):蛋白胨10g,酵母膏5g,NaCl10g,蒸馏水1L,pH值为7.0.(2)发酵培养基:用细菌几丁质培养基(分离用),但不加琼脂 1.2菌株的分离 1.2.1菌株初步分离从生产几丁质的工厂排污沟附近土壤采集土样,经过烘干及风化干燥,置于60目分样筛过筛,备用.称取1g土样放入加有9mL无菌水的离心管,分别稀释制成10-1,10-2,10-3,10-4,10-5,10-6不同稀释倍数的土壤溶液.从10-3,10-4,10-5,10-6不同稀度倍数的4管土壤稀释液中各吸取0.1mL,接种在纯几丁质培养基和细菌几丁质培养基的平板上,用涂布棒涂布均匀,在30℃下培养72h. 1.2.2菌种的二次筛选从第1次稀释涂布的平板中挑取可以产生透明圈的菌落,再一次通过稀释涂布的方法,将其接种于纯几丁质平板和细菌几丁质平板上,培养72h,以取得纯菌落平板.从第2次筛选的纯菌平板上选取水解圈直径与菌落直径比最大的菌种,将其接种于50mL的LB种子培养基上,12h后以2%的接种量接于100mL的细菌几丁质发酵培养基中,在30℃下进行扩大培养. 1.3菌种的鉴定 1.3.1细菌染色体DNA提取从新培养产几个质酶活性高的革兰氏阴性细菌平板上,挑取一环菌落至加有500μLTE缓冲液的1.5mL微量离心管中,混匀后沸水浴1.5min,迅速低温离心(12000r?min-1)10min,取上层清液分装后,置4℃下保存备用. 1.3.216SrDNA引物根据16SrDNA的结构,应用B2/B3做引物,该引物扩增片段包含V8和V9两个高变区,扩增产物大小为1050bp(basepair,碱基对)左右.这两个引物序列为B2:5’2ACGGGCGGTGTGTAC23’;B3:5’2CCTACGGGAGGCAGCAG23’. 1.3.3聚合酶链反应(PCR)检测PCR反应体系为20μL,二次蒸馏水1 2.6μL,10倍扩增缓冲液2.0μL,25mmol?L-1Mg2+1.6μL,各2.5mmol?L-1的脱氧核苷三磷酸(dNTP)0.4μL,20μmol?L-1引物各1.0μL,DNA模板1.0μL,5GU?L-1Taq酶0.4μL.PCR循环:94℃预变性5min,94℃变性60s,50℃退火60s,72℃延伸90s,循环30次,并在72℃后延伸15min. 1.3.4扩增产物的电泳分析用1倍的TAE缓冲液配制质量分数为1%琼脂糖凝胶.取PCR扩增产物10μL,加2μL溴酚蓝指示剂,混匀后加样,于100V下电泳1.5h,紫外灯下观察电泳结果. 1.3.5序列测定与分析将观察到的PCR产物切胶,用胶回收试剂盒回收后,连接到
综述与专论 生物技术通报 BI OTEC HNOLOG Y BULLETI N 2011年第5期 里氏木霉及其纤维素酶高产菌株的研究进展 覃玲灵 何钢 陈介南 (中南林业科技大学生物环境科学与技术研究所,长沙410004) 摘 要: 随着纤维素在能源、材料及化工等领域的广泛开发和应用,里氏木霉作为一种重要的产纤维素酶工业用菌种,越来越受到人们的广泛关注。为了提高其酶活,人们做了大量的工作,获得了一些相当好的突变株。对里氏木霉及其突变株的基因组进行研究,有助于人们理解其高效产酶的机制,同时也有利于构建其基因工程菌。介绍里氏木霉T r ichoderma reesei 的背景及其部分高产纤维素酶突变株,并阐述近些年来对其突变株的基因组的研究进展。 关键词: 里氏木霉 纤维素酶 突变株 基因组 SNV Research Develop m ent of Trichoder ma reesei and Its Cell ulase Hyperproduction Strai ns Q in L i ng ling H e G ang Chen Jienan (Instit ute of B i o l og ic al an d Environ ment al Science&T echnology,Ce ntral South University of Forest ry and Tec hnology,Changsha 410004) Abstrac:t A s w i de l y deve lop m ent and utilization of ce llulose i n the fi e l d of energy ,m ate rials and chem istry i ndustry,T r ichoderma reesei has been caught m ore and m ore attenti on for its be i ng a k i nd of i m portant ce ll u l ase stra i n for i ndustry .Fo r enhanc i ng i ts cell u l ase product ,peop l e hav e done a lot of work on it ,and ob tained seve ra l cons i derably good mutant strai ns .T o learn the genom e o f T r ichoderma reesei and its mu tant strains is he l p f u l to us understand its syste m o f ce llulase hype rproduction ,also he l p f u l to people construct its g enet ic eng i neering stra i n i n the f uture .T h i s article i ntroduced t he background o f T richoderma reesei and part of its hyperce llulase product stra i ns ,a l so elabo rated the research deve l op m ent of its m utan t strains geno m e i n t he recent yea rs . K ey words : T richoderma reesei Cell u l ase M u tant stra i n G enom e SNV 收稿日期:2010 11 24 基金项目:国家林业局 948 项目(2006 4 123) 作者简介:覃玲灵,女,硕士研究生,研究方向:生物质能源;E m ai:l canaceili ng @163.co m 通讯作者:何钢,男,教授,从事生物技术教学和科研;E m a i :l hegong262@yahoo .co https://www.doczj.com/doc/a55349854.html, 1 背景 随着人口不断增长,以及现有的煤、天然气和石 油存储量的减少,发展新能源成为实现经济社会可持续发展的必经之路。以纤维素、半纤维素和木质素形式存在的生物质收集并且存储了大量太阳能,是一种重要的能源和物质资源[1] 。地球上最主要的生物质来自绿色植物,每年光合作用的生物质净产量约为1800亿t [2] 。生物质中含量最多的是纤维素,其由成百上千个葡萄糖分子聚合而成,是地球上存在最丰富的有机大分子,储量约为850亿t [3] ;其次是半纤维素,储量约为500亿;t 第三类是木质素,由结构复杂的含芳香环的有机分子聚合而成,约 占20%,即350亿t [4] 。这些生物质大多以农业和林业废弃物的形式存在,并且每年都在大量积累,这不仅会导致环境的恶化,而且会导致这种可利用资源的流失[1] 。因此如何充分利用这些资源成为迫 在眉睫的问题,在对生物质的开发利用中,一个重要瓶颈就是如何高效利用微生物进行酶催化水解将生物质降解为单糖[5] 。 自然界中能降解和利用纤维素的微生物种类很多,许多细菌可分解纤维素,而且产生的纤维素酶具有高度专一性,但是它们生长速度慢,需要厌氧的生长条件[6],这些都限制了其应用。真菌所产生的纤维素酶多是胞外酶,便于分离和提取,且
湖南农业大学课程论文 学院:生物科学技术学院班级: 姓名:学号: 课程论文题目:纤维素酶高产菌株的诱变育种 课程名称:工业微生物育种学 评阅成绩: 评阅意见: 成绩评定教师签名: 日期:年月日
纤维素酶高产菌株的诱变育种 ( ) 【摘要】纤维素酶是一种重要的工业酶制剂,是一种复合酶,它将纤维素及类似物水解成葡萄糖。近年来,对产纤维素酶菌株的鉴定、诱变育种、筛选等方面取得了长足的进展。本文对这些研究进展进行了归纳和总结. 【关键词】产纤维素酶菌株;纤维素酶;筛选;诱变育种 Mutation Breeding of Cellulase High-yield Strain TAO Mi-lin (College of Biological Science and Technology, Hunan Agriculture University, Hunan 410128) 【Abstract】Cellulase is a kind of complex enzyme. Due to the ability of hydrolyzing cellulose or the similarity of cellulose into glucose. A great effort has been made until now on the research such as identification, mutation breeding and filter of cellulose-producing strain. This paper focused a brief induction and summary on advancing about these aspects. 【Key words】cellulose-producing strain ; cellulase ; filter ; mutation breeding 随着石化燃料由短缺变枯竭,能源是人类面临的共同问题。寻找新的能量来源关系到经济的可持续发展乃至人类的生存问题。纤维素与石化燃料不同,它是一种可再生的资源。地球上每年光合作用可产生大于100亿吨的植物干物质,其中一半以上是纤维素和半纤维素。另外,人类活动产生的废弃物中也含有大量的纤维素,如农业废物( 稻草、稻壳、麦杆、花生壳、玉米芯、棉籽壳、甘蔗渣等)、食品加工废物(果皮、果渣等)、木材废物(木屑、树皮)以及城市废弃物(40%~60% 固体废物是垃圾和废纸)等。如果能有效地利用生物转化技术将这些纤维素转化成简单糖,再发酵产生乙醇等能源物质,不仅可以变废为宝,而且还可以避免由于化石燃料燃烧所带来的环境污染,更重要的是可以缓解或解决石化能源短缺乃至枯竭所带来世界性能源危机。纤维素酶的特异性高,反应条件比较温和,可避免化学转化所导致的环境污染等,是将这些纤维素物质转化成简单糖的关键。因此,在再生能源利用方面具有很广阔的应用前景。另外,自然界中细菌、真菌、某些无脊椎动物,直至高等植物中都有纤维素酶的存在,因此,纤维素酶的研究还具有普遍的生态意义。 1、纤维素酶 纤维素酶最早由Seilliere于1906年研究发现,我国约从20世纪70年代开始纤维素酶的研究,且已被正式批准为饲料添加剂在动物生产中应用。 1.1 纤维素酶的结构 不同来源的纤维素酶理化性质不相同,纤维素酶分子一般由球状的催化结构域(CD)、连接桥(Linker)和纤维素结合结构域(CBD)3部分组成。纤维素酶是由葡聚糖内切酶(endo-1,4-β-D-glucanases,EC3.2.1.4,简称EG)、葡聚糖外切酶
湖北农业科学2009年(责任编辑郑威) mineral forming elements [C ].Amsterdam :Elsevier ,1979. 253-292.[6] NEALSON K H.The microbial manganese cycle [A ]. KRUMBEIN W E.Microbial geochemistry [C ].Oxford :Blackwell Scientific Publications ,1983.191-221.[7] TEBO B M ,BARGAR J R ,CLEMENT B G ,et al.Bio-genic manganese oxides :properties and mechanisms of forma-tion [J ].Annu.Rev.Eath.Planet Sci ,2004,32:287-328. [8]田美娟,邵宗泽.深海抗锰细菌的分离鉴定[J ].厦门大学学报 (自然科学版),2006,45(2):272-276. [9] SOLOMON E I ,SUNDARAM U M ,MACHONKIN T E.Multicopper oxidases and oxygenases [J ]. Chem Rev , 1996,96:2563-2605. [10] TONER B ,FAKRA S ,VILLALOBOS M ,et al.Spatially Resolved Characterization of Biogenic Manganese Oxide Pro-duction within a Bacterial Biofilm [J ].Appl Environ Micro-biol ,2005,71(3):1300-1310. 第48卷第1期 2009年1月 湖北农业科学 H ubei A gricultural S ciences Vol.48No.1 Jan .,2009 收稿日期:2008-10-18 基金项目:鲁东大学基金项目(20053305) 作者简介:冯培勇(1977-),男,山东日照人,硕士,主要从事微生物产酶的研究工作,(电话)132********(电子信箱)fengpeiyong2004@yahoo.com.cn 。 纤维素是广泛存在于自然界中的一种由许多葡萄糖基组成的大分子物质,可被存在于微生物中的纤维素酶所降解。纤维素酶指的是降解纤维素酶生成葡萄糖的一组酶的总称。目前认为,完全降解纤维素至少需要3种功能不同且互补的纤维素酶组分,即内切葡聚糖酶(C1酶或EG )、外切葡聚糖酶(Cx 酶或CBH )、β-葡萄糖苷酶(简称βG )[1]。纤维素酶的应用随着工业的发展而日趋广泛,不仅能用于生产葡萄糖、酿酒、饲料工业、纺织行业、环卫污物的处理、农产品加工及生物工程等方面[2],而且可用于服装加工行业[3]。由于野生型菌种的纤维素酶 活力不高,因此,利用各种诱变手段选育高产纤维素酶生产菌一直是国内外研究的热点。本研究通过化学诱变剂NTG 、硫酸二乙酯和LiCl 对一株黑曲霉菌株进诱变,获得了纤维素酶活性显著提高且遗传性状稳定的突变株。 1 材料与方法 1.1材料 1.1.1出发菌株黑曲霉(Aspergillus niger F1), 本实验室分离保存。 1.1.2 培养基 ①斜面培养基(PDA 培养基):马铃 高产纤维素酶黑曲霉菌株的化学诱变选育 冯培勇,宿红艳,张 丽,王艳华 (鲁东大学生命科学学院,山东烟台 264025) 摘要:以1株黑曲霉(Aspergillus niger F1)为出发菌株,经过亚硝基胍、硫酸二乙酯和氯化锂诱变处理,选育出1株纤维素酶高产菌株L1。在适宜条件下,其产CMCase 活力为出发菌株的150.2%。关键词:纤维素酶;化学诱变;黑曲霉中图分类号:Q933 文献标识码:A 文章编号:0439-8114(2009)01-0088-03 Breeding of High-Yield Cellulase Aspergillus niger Mutated by Chemicals FENG Pei-yong ,SU Hong-yan ,ZHANG li ,WANG Yan-hua (College of Life Science ,Ludong University Yantai 264025,Shandong ,China ) Abstract :A strain ,Aspergillus niger F1,was used as starting strain and mutated by NTG ,DES and LiCl.The strain named L1was bred which could produce high-yield cellulase.Under suitable conditions ,its CMCase activity was 150.2%of the starting strain. Key words :cellulase ;chemical mutatation ;Aspergillus niger !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
产纤维素酶细菌的筛选及培养 一、筛选步骤 1、菌种的采集 采集山上距湿润的表层10cm处的土壤样本40g左右,用研钵研成粉末称取1g样本加入灭菌的250mL锥形瓶中,加入99mL无菌水摇匀静置。 2、菌种初筛 (1)按照配方配制200mL CMC培养基,取1 X 250mL空锥形瓶和6 X 15mL试管,塞上棉塞并用报纸、棉线包扎,用报纸、棉线将试管包扎成一捆;取12套培养皿码齐包扎。将上述器材与培养基、无菌水121℃高压蒸汽灭菌20min。 (2)于无菌台上倒9个CMC培养基备用。 (3)另取6支15mL经灭菌的试管,用移液枪吸取土壤溶液(上清液)加入1号试管,加无菌水。混匀后吸取加入2号试管,重复上述操作,进行6次梯度稀释。 (4)待CMC培养基冷却后,在超净工作台分别吸取104、105、106倍稀释液于CMC 培养基上稀释涂布,每种稀释液涂布三份。 (5)将上述培养基置于37℃培养箱中培养24小时,标记菌落并记录各菌落形态(菌落高度、质地、颜色、气味、着生状态、边缘及表面纹理等)。 (6)配制200mL刚果红家别培养基,与三套培养皿一起121℃灭菌20min。 (7)在无菌操作台上倒3个鉴别培养基备用。 (8)将各菌落用牙签接种到冷却了的刚果红鉴别培养基上,37℃培养24h,挑选5株透明圈直径与菌落直径比最大的菌株进行摇瓶复筛。 3、菌种复筛 (1)配制500mL基础发酵培养基,分装到5只250mL的锥形瓶中,121℃高压蒸汽灭菌20min。
(2)将初筛得到的菌株用接种环接种于液体培养基上(2环),37℃、150r/min 下培养2—3天,转入4℃冰箱保藏。 二、培养方法 1清洗实验器具 2灭菌 3配培养基(纤维素作唯一能量源的培养基) 4倒平板 +选择培养原菌(可能会用摇床) 5稀释菌样 6涂布平板或平板划线 7放入恒温箱(调制均适宜的温度)12-24h ,之后就可以收获细菌了 8观察记录(数量、分布等) 三、培养基种类及其组成 1、初筛 CMC培养基:CMC 5g、蛋白胨 1 g、FeSO4·7H2O 0.005 g、NaCl 0.25 g、琼脂粉10g 于1000mL锥形瓶中加蒸馏水至500mL、调节pH 7.2~7.6,加棉塞121℃灭菌20min。 刚果红培养基: (NH4)2S04 2 g,MgS04·7H20 0.5 g,K2HP04 1 g,NaCl 0.5 g,微晶纤维素2 g,刚果红0.4 g,琼脂20 g,加水至1000 mL。 无菌水:取1只1000mL的锥形瓶,各加水1000mL,加棉塞与CMC培养基一起灭菌20 min。另取1只250mL空锥形瓶、6支15mL试管和12套培养皿灭菌备用。 2、复筛 基础发酵培养基:羧甲基纤维素钠10g,蛋白胨10g,KH2PO419,MgSO4 0.29,Nacl 10g水1000mL,pH调至7,121℃灭菌20min
高产纤维素酶菌株的分离与酶活性检测 一班3组 摘要:本组实验通过从土壤中取样并经过选择培养和梯度稀释,将所得样品进行纯化培养 后染色鉴别,之后挑取菌落进行涂布培养,即可分离出高产纤维素酶菌株。为确定分离得到 的是纤维素分解菌,还需要进行发酵产纤维素酶实验,我组采用液体发酵法。我组培养基在 培养过程中有菌落生长,后来观察到产生透明圈的菌落,经过分离纯化,进一步筛选出了单 菌落,然后又进行了镜检,最后通过液体发酵,检验了纤维素酶的活性。 关键词:高产纤维素酶菌株、分离、酶活性检测 1.研究方法: 1.1实验材料及用具 土壤、滤纸、刚果红染料、试管、培养皿、玻璃棒、烧杯、酒精灯、称量纸、天平、揺瓶、 摇床、胶头滴管、接种环、接种针、酒精棉球、无菌操作台、离心管、高速离心机、牛津杯 培养基、鉴别培养基、液体发酵法所需培养基 1.2实验方法 1.2.1高产纤维素酶菌株的分离 (1)土壤取样:在富含纤维素的环境中土壤取样,比如取树林中多年落叶形成的腐殖土。 (2)制备选择培养基: 纤维素钠 5g NaNO3 1g KCl 0.5g Na2HPO4·7H2O 1.2g KH2PO4 0.9g MgSO4 ·7H2O 0.5g酵母膏 1.0g 溶解后, 蒸馏水定容至1000mL (3)制备鉴别培养基: 纤维素钠 5g NaNO3 1g KCl 0.5g Na2HPO4·7H2O 1.2g KH2PO4 0.9g MgSO4 ·7H2O 0.5g酵母膏 1.0g 琼脂 20g 刚果红 0.2g 溶解后,蒸馏水定容至1000mL (4)选择培养:称取土样20 g,在无菌条件下加入装有30 mL培养基的摇瓶中。将摇瓶置于 摇床上,在30 ℃下振荡培养1~2 d,至培养基变混浊。吸取一定的培养液(约5 mL),转 移至另一瓶新鲜的选择培养基中,以同样的方法培养到培养液变浑浊。 (5)梯度稀释:按照前面的稀释操作方法,将选择培养后的培养基进行等比稀释10~1000000 倍。 (6)将样品涂布到鉴别纤维素分解菌的培养基上:制备鉴别培养基后涂布平板,将稀释度为 104~106的菌悬液各取0.1ml涂布到平板培养基上,30℃倒置培养。 (7)纯化培养:在产生明显的透明圈的菌落,挑取并接种到纤维素分解菌的选择培养基上, 在300C- 370C培养,可获得纯化培养。 1.2.2纤维素酶活力鉴定 (1)发酵培养:取上鉴别培养基长出的单菌落,在无菌环境中将菌株接种到液体培养基中, 然后摇床发酵培养24h。 (2)纤维素酶液获取:取发酵液2ml加入离心管,共加4支,高速离心5min后取出,上清液 即为欲获取的酶液。 (3)酶活性检测:将所取酶液加入到插有牛津杯的鉴别培养基中的牛津杯中,然后30度左右, 放置24h,观察透明圈大小,透明圈越大,说明酶活力越高。
实验一产纤维素酶菌种的分离与初筛 实验二产纤维素酶菌种的复筛与保藏 实验三酶活测定与传代保藏 实验四产纤维素酶菌种的紫外诱变育种 实验五产纤维素酶菌种的产酶条件优化 实验六产纤维素酶菌种的产酶条件优化的结果分析
实验一产纤维素酶菌种的分离与初步鉴定 一、实验目的 1.了解产纤维素酶微生物分离的基本原理;2.掌握产纤维素酶微生物分离的操作方法。 二、实验原理自然界中存在大量的纤维素类物质,同时存在着很多能分解纤维素类物质的生物,小到细菌、放线菌、真菌,大到一些食草类昆虫与动物。这些生物与绿色植物一起构成了这个世 界的碳循环。在发酵堆肥中,存在着大量的,耐高温的纤维素分解菌株,但多半都为混合分解,菌种需要: 1. 内切型葡萄糖苷酶(endo-1,4- ^D-glucanase,EC3.3.1.4,简称EBG),也称Cx 酶、CMC 酶、EG。这类酶作用于纤维素分子内部的非结晶区,随机识别并水解3-1,4-糖苷键,将长链纤维素分子截短,产生大量非还原性末端的小分子纤维素; 2. 外切型葡萄糖苷酶(exo-1,4- 3D-glucanase,EC 3.2.1.91 ),也称C1酶、微晶纤维素酶、 纤维二糖水解酶(Cellobiohydrolase, 简称CBH),这类酶从纤维素长链的非还原性末端水解3-1,4-糖苷键,每次切下纤维二糖分子; 3. B-葡萄糖苷酶(^glucosidase, EC3.2.21,简称BG)又称纤维二糖酶,它能水解纤维二 糖以及短链的纤维寡糖生产葡萄糖,对纤维二糖和纤维三糖的水解很快。随着葡萄糖聚合酶的增加水解速度下降,这种酶的专一性比较差。 只有三种酶的协同作用,才能较好的分解纤维素。就单菌落而言,霉菌如木霉、曲霉和青霉的总体酶活性较高,产量大,故在畜牧业和饲料工业中的应用的纤维素酶主要是真菌纤维素酶。 本实验以羟甲基纤维素钠为唯一碳源的培养基作为筛选培养基, 只有能够水解纤维素成单糖并加以利用的微生物才能在筛选培养基上生长, 利用筛选培养基分离产纤维素酶的微生物。 以羧甲基纤维素钠(CMC-Na )为唯一碳源,通过微生物分解利用CMC-Na ,分离出能产纤维素酶的菌种; 刚果红是一种酸性染料,可与纤维素反应形成红色复合物。 三、实验仪器及试剂 1. 材料土样取自学校校门口小树林5—20cm深处; 2 .仪器试管、烧杯、移液管、平板、锥形瓶、玻璃珠、电磁炉、电子称、量筒、培养皿、酒精灯、移液枪、接种环、高压灭菌锅等; 3 .培养基(1)筛选培养基(500ml) CMC-Na 10g 、(NH4)2SO4 1.4 g 、MgSO4 0.3g KH 2PO4 2g 、MnSO4 1.6mg 、FeSO4 5mg ZnSO 4 2.5mg 、CoCl2 2.0mg 琼脂20g PH7.0 (2)保藏培养基(500ml) CMC-Na 15g 、MgSO4 0.5g 、K2HPO4 1.5g 、酵母粉10g NaCl 5g 、蛋白胨15g、琼脂20g、刚果红PH7.0 四、实验步骤 1. 土样采集取自学校校门口小树林5—20cm深处; 2. 实验器材灭菌:平板、移液管的包扎及灭菌; 3. 无菌水的制备:
纤维素酶的应用现状与前景 【摘要】:本文阐述了纤维素酶的理化性质及其作用机理, 在此基础上重点讨论纤维素酶在食品业、农牧业、纺织业、造纸业等领域的应用, 对纤维素酶的来源及潜在应用价值作了展望。 【关键词】:纤维素酶; 固体发酵; 液体发酵;应用 The Application And Prospects of Cellulase [Abstract]: The physical and chemical properties of cellulase are elaborated in this thesis. On this basis, focusing on the Application of cellulose in the food industry, agriculture, textiles, paper, and other fields .In the same time looking in the future of The source and potential value of cellulase. [Keywords]: cellulase, Solid fermentation, Fermentation, Applications 纤维素类物质是地球上产量巨大而又未得到充分利用的可再生资源。纤维素酶是一组能够降解纤维素生成葡萄糖的酶的总称, 在食品、饲料、医药、纺织、洗涤剂和造纸等众多的工业领域有广泛的应用价值。从酶的作用特性出发可分成两大类: 碱性纤维素酶和酸性纤维素酶。纤维素酶的组成比较复杂,通常所说的碱性纤维素酶是具有3~10 种或更多组分构成的多组分酶。根据其作用方式一般又可将纤维素酶分为3 类: 外切β- 1, 4-葡聚糖苷酶( 简称CBH) 、内切β- 1, 4- 葡聚糖苷酶( 简称EG)和β- 1, 4- 葡萄糖苷酶( 简称BG) 。在这3 种酶的协同作用下,纤维素最终被分解成葡萄糖。到目前为止, 还没有能够在碱性条件下分解天然纤维素的纤维素酶。碱性纤维素酶是一种单组分或多组分的酶,
目录 实验一产纤维素酶菌种的分离与初筛 实验二产纤维素酶菌种的复筛与保藏 实验三酶活测定与传代保藏 实验四产纤维素酶菌种的紫外诱变育种 实验五产纤维素酶菌种的产酶条件优化 实验六产纤维素酶菌种的产酶条件优化的结果分析
实验一产纤维素酶菌种的分离与初步鉴定 一、实验目的 1.了解产纤维素酶微生物分离的基本原理; 2.掌握产纤维素酶微生物分离的操作方法。 二、实验原理 自然界中存在大量的纤维素类物质,同时存在着很多能分解纤维素类物质的生物,小到细菌、放线菌、真菌,大到一些食草类昆虫与动物。这些生物与绿色植物一起构成了这个世界的碳循环。在发酵堆肥中,存在着大量的,耐高温的纤维素分解菌株,但多半都为混合分解,菌种需要: 1.内切型葡萄糖苷酶(endo-1,4-β-D-glucanase,EC3.3.1.4,简称EBG),也称Cx酶、CMC 酶、EG。这类酶作用于纤维素分子内部的非结晶区,随机识别并水解β-1,4-糖苷键,将长链纤维素分子截短,产生大量非还原性末端的小分子纤维素; 2.外切型葡萄糖苷酶(exo-1,4-β-D-glucanase,EC 3.2.1.91),也称C1酶、微晶纤维素酶、 纤维二糖水解酶(Cellobiohydrolase,简称CBH),这类酶从纤维素长链的非还原性末端水解β-1,4-糖苷键,每次切下纤维二糖分子; 3.Β-葡萄糖苷酶(β-glucosidase,EC3.2.21,简称BG)又称纤维二糖酶,它能水解纤维二 糖以及短链的纤维寡糖生产葡萄糖,对纤维二糖和纤维三糖的水解很快。随着葡萄糖聚合酶的增加水解速度下降,这种酶的专一性比较差。 只有三种酶的协同作用,才能较好的分解纤维素。就单菌落而言,霉菌如木霉、曲霉和青霉的总体酶活性较高,产量大,故在畜牧业和饲料工业中的应用的纤维素酶主要是真菌纤维素酶。 本实验以羟甲基纤维素钠为唯一碳源的培养基作为筛选培养基,只有能够水解纤维素成单糖并加以利用的微生物才能在筛选培养基上生长,利用筛选培养基分离产纤维素酶的微生物。 以羧甲基纤维素钠(CMC-Na)为唯一碳源,通过微生物分解利用CMC-Na,分离出能产纤维素酶的菌种; 刚果红是一种酸性染料,可与纤维素反应形成红色复合物。 三、实验仪器及试剂 1.材料土样取自学校校门口小树林5—20cm深处; 2.仪器试管、烧杯、移液管、平板、锥形瓶、玻璃珠、电磁炉、电子称、量筒、培养皿、酒精灯、移液枪、接种环、高压灭菌锅等; 3.培养基(1)筛选培养基(500ml) CMC-Na 10g、(NH4)2SO4 1.4 g、MgSO4 0.3g KH2PO4 2g、MnSO4 1.6mg、FeSO4 5mg ZnSO4 2.5mg、CoCl2 2.0mg 琼脂20g PH7.0 (2)保藏培养基(500ml) CMC-Na 15g、MgSO4 0.5g、K2HPO4 1.5g、酵母粉10g NaCl 5g、蛋白胨15g、琼脂20g、刚果红 PH7.0 四、实验步骤 1.土样采集取自学校校门口小树林5—20cm深处; 2.实验器材灭菌:平板、移液管的包扎及灭菌;