
高中化学选修四第一章
第一节《化学反应与能量的变化》
[教学目标]:
1、使学生了解化学反应中能量转化的原因和常见的能量转化形式;
2、认识化学反应过程中同时存在着物质和能量的变化,而且能量的释放或吸收
是以发生的物质为基础的,能量的多少决定于反应物和生成物的质量;
3、了解反应热和焓变的含义;
4、认识热化学方程式的意义并能正确书写热化学方程式。
[重点、难点]:1、化学反应中的能量变化,热化学方程式的书写;
2、△H的“+”与“-”。
[教学过程]:
[引入]能量是推动人类进步的“杠杆”!能量使人类脱离了“茹毛饮血”的野蛮,进入繁华多姿的文明。化学反应所释放的能量是现代能量的主要来源
之一(一般以热和功的形式与外界环境进行能量交换)。所以,研究化
学反应中的能量变化,就显得极为重要。
引言:我们知道:一个化学反应过程中,除了生成了新物质外,还有
思考:
(1)你所知道的化学反应中有哪些是放热反应?能作一个简单的总结吗?
活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应
反应物具有的总能量 > 生成物具有的总能量
(2)你所知道的化学反应中有哪些是吸热反应?能作一个简单的总结吗?
多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧碳生成一氧化碳反应物具有的总能量 < 生成物具有的总能量
[讲述]我们不仅要知道化学反应是吸热还是放热,还要会表示它。
[提问]
1、如何表示化学反应热?
2、△H(焓变)所表示的意义?
3、用△H(焓变)如何表示放热还是吸热呢?
【查阅资料和课本讨论后口述】
△H(焓变)即化学反应过程中所吸收或放出的热量
△H(焓变)=反应物的总键能-生成物的总键能=生成物的总能量-应物的总能量单位:kJ/mol
△ H(焓变)〉0表示吸热反应
H(焓变)〈0表示放热
【引导】现在大家看到的都是直观和表面的信息,有没有更深层次的信息?或者我们将得到的信息稍稍处理一下,能否得到更有价值的信息呢?
[板书]一、反应热焓变
1、概念:化学反应过程中所释放或吸收的能量,都可以热量(或转换成相应的
热量)来表述,叫做反应热,又称为“焓变”。符号:ΔH,单位:kJ/mol 或kJ?mol-1
2、反应热的表示方法:
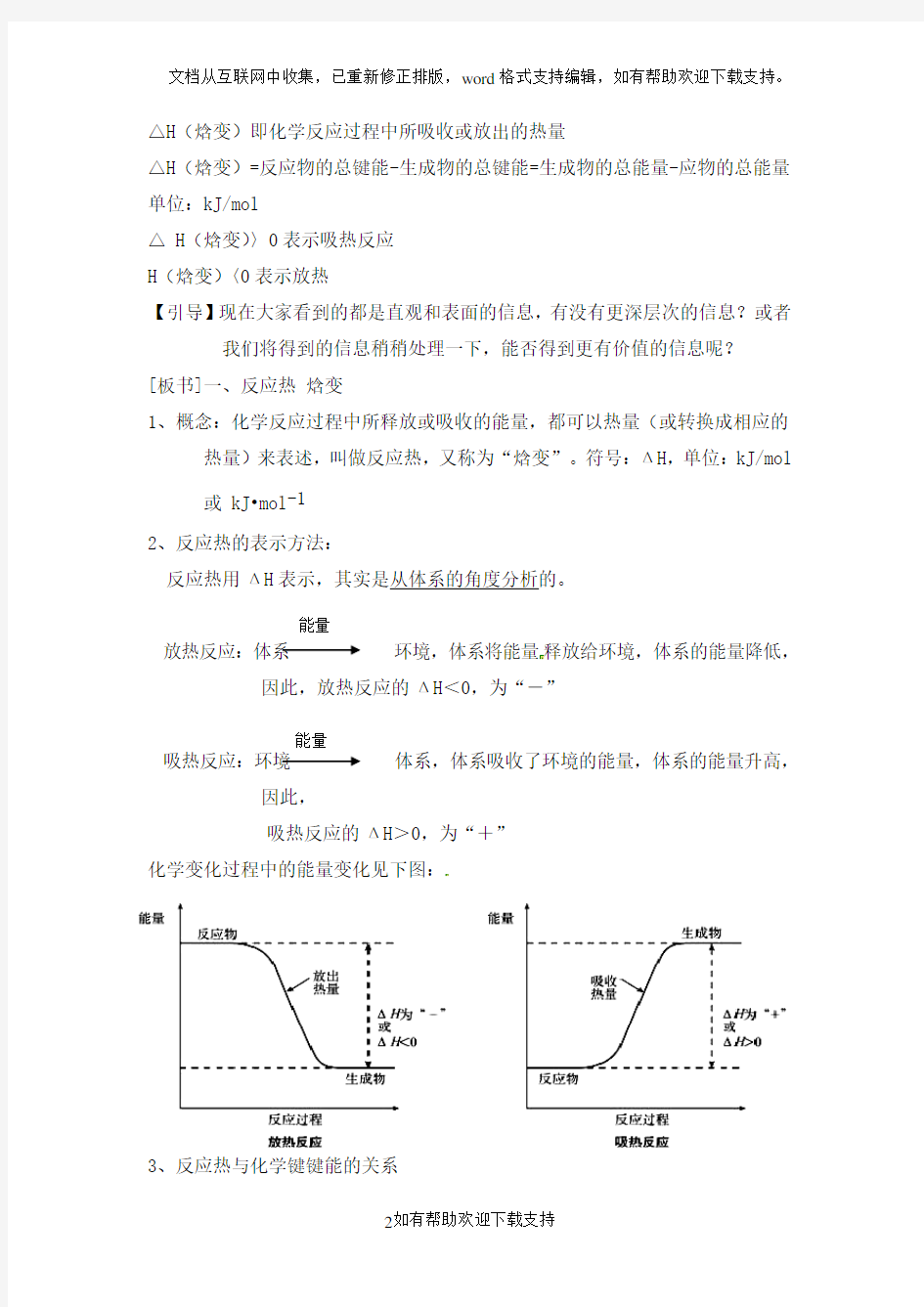
反应热用ΔH表示,其实是从体系的角度分析的。
放热反应:体系环境,体系将能量释放给环境,体系的能量降低,因此,放热反应的ΔH<0,为“-”
吸热反应:环境体系,体系吸收了环境的能量,体系的能量升高,因此,
吸热反应的ΔH>0,为“+”
化学变化过程中的能量变化见下图:
3、反应热与化学键键能的关系
能量
能量