
一、实验目得
1、用静态法测定氨基甲酸铵在不同温度下分解反应系统得平衡总压力;
2、求氨基甲酸铵分解反应得热力学函数[变];
3、了解等压计得构造及压力得测量。
二、实验原理
对于化学反应 a A +b B = y Y +z Z ,其标准平衡常数随温度得变化规律符合范特荷夫(van ’t Hof f)方程:
(3-11) 当温度变化范围不大时,Δr H m (T)可视为常量,积分式(3-11)得: (3-12) B 为积分常量、由式(3—12)可以瞧出,以 ln K (T )对1/T 作图应为直线,斜率为,由此可
求出反应得标准摩尔焓[变]Δr H m (T )。 由标准平衡常数得定义得:
Δr G m (T )= —RT l nK (T )
(3-13)
由 Δr Gm(T )=ΔrHm(T)- T Δr Sm (T )
得 Δr S m (T)= (3—14)
氨基甲酸铵得分解反应为:
N H2CO 2NH4(s) 2NH 3(g)+CO2(g) (3—15)
当反应系统建立平衡时,标准平衡常数为:
(3-16) 式中p(N H3)与p (C O2)分别为NH 3(g)与CO 2(g)得平衡压力,p =100kP a、设分解反应系统得总压力为P 总,由氨基甲酸铵得分解反应式(3-15)知: p (N H3)= p 总 , p (CO 2)= p 总 代入式(3—16)得:
(3—17)
实验时,将固体氨基甲酸铵放入一个抽成一定真空得容器里,在一定得温度下使其发生分解
并达平衡,测出系统总压力p总,就可以按式(3—17)计算氨基甲酸铵分解反应得标准平衡常数K ,从而计算其它热力学函数[变]。文献值:25℃时△Hm=159。32kJ /mol,
三、实验仪器及药品
真空装置一套;等压计;恒温槽;调压器一台;放大镜一只;数字式大气压力计; 氨基甲酸铵;硅油或石蜡油。
四、实验步骤
1、将氨基甲酸铵放入瓶3中并按图3-13连接好等压计2,开启恒温槽使槽温恒定在30℃;
2.将三通活塞a 置于位置A、打开抽气阀b 、关闭压力调节阀c ,开动真空泵抽真空,使压差仪得压差在500k Pa,观察等压计内通过油封有气泡冒出,持续抽空15min 以上;
3.关闭抽气阀b,将三通活塞a 置于B位,停止抽气,切断真空泵电源。此时氨基甲酸铵将在298K 温度下分解。 4、微微开启压力调节阀c,将空气放入系统中,直至等压计
U -型管得两臂油封液面保持在同一水平且在10min 内不变。读取压差仪得压差、大气压力计压力及恒温槽温度,计算
分解压。
图3-13 静态法测定氨基甲酸铵分解压装置简图
1 数字式低真空压差仪;
2 等压计;
3 氨基甲酸铵瓶;
4 油封;
5 恒温槽;
6 稳 压管
7 搅拌器;8温度计;9调节温度计;10 加热器;11 真空泵;12 真空泵 电机;13 电机开关;14 加热用调压器;a 三通活塞;b 抽气阀;c 压力调节阀
1 6
2
3 4 5
9
8
7 c a 10
11 12 13
14
b 三通活塞a 得 A 、B 位置
A B
5.检查氨基甲酸铵瓶内得空气就是否排净:关闭二通阀b与c,三通活塞a置于A位,抽空2min,然后开启抽气阀b继续排气5min,关闭阀b,停泵。重新测量298K下氨基甲酸铵得分解压并与4中测得相比较,若两次测量结果相差小于260~270Pa,可以进行下一温度下分解压得测量、
6、依次将恒温槽温度升至32、34、36、38、40、42与44℃,测量每一温度下得分解压。在升温过程中应该注意通过压力调节阀c十分缓慢得向系统中放入适量空气,保持等压计得两臂油封液面水平,既不要使氨基甲酸铵瓶3里得气体通过油封冒出,更不要让放入得空气通过油封进入氨基甲酸铵瓶。
7.结束实验:关闭恒温槽搅拌电机及继电器得电源;缓慢地从压力调节阀c向系统中放入空气,使空气以不连续鼓泡得速度通过等压计得油封进入氨基甲酸铵瓶中、
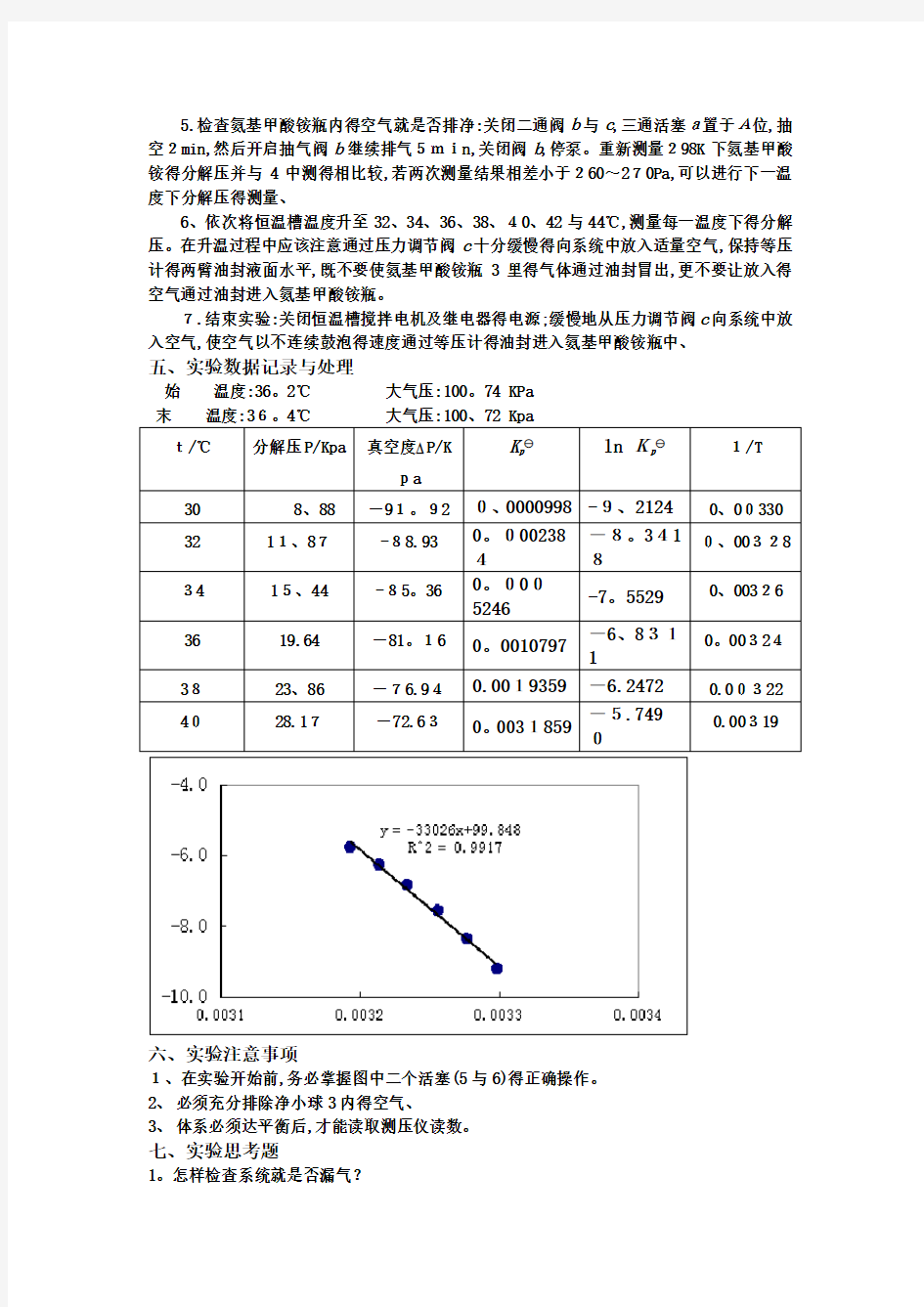
五、实验数据记录与处理
始温度:36。2℃大气压:100。74 KPa
t/℃分解压P/Kpa 真空度 P/K
pa
K
p
lnKp 1/T
30 8、88 -91。92 0、0000998 -9、2124 0、00330
32 11、87-88.93 0。000238
4
-8。341
8
0、00328
34 15、44 -85。36 0。000
5246
-7。5529 0、00326
36 19.64 -81。16 0。0010797 -6、831
1
0。003243823、86 -76.940.0019359 -6.2472 0.00322
4028.17-72.630。0031859 -5.749
0
0.00319
六、实验注意事项
1、在实验开始前,务必掌握图中二个活塞(5与6)得正确操作。
2、必须充分排除净小球3内得空气、
3、体系必须达平衡后,才能读取测压仪读数。
七、实验思考题
1。怎样检查系统就是否漏气?
答:关闭真空泵,关闭阀门,观察平衡常数测定仪得示数就是否变化,若变化则说明系统漏气,若变化过快,则需要检查装置重新抽气。
2、为什么要抽干净氨基甲酸铵小瓶中得空气?抽不干净对测量数据有什么影响?
答:因为我们在实验过程中主要测定得只就是得反应产生得气体得压力,即氨气与二氧化碳得总压,所以空气排除得越干净,得到得数据结果就越准确。如果系统中有少量空气,得到得蒸气压数据就会偏大,平衡常数就会偏大、
3、怎样判断氨基甲酸铵分解反应就是否已达到平衡?
答:U型等压计两臂得液面无论就是否等高,在1min内,液面不再变化即可认为反应体系已达平衡。
4、等压计中得油封液体为什么要用高沸点、低蒸气压得硅油或石蜡油?将硅油或石蜡油改为乙醇等低沸点得液体可以么?不用油封可以么?除了硅油、石蜡油之外您认为还可以使用什么液体作为等压计得油封液体?
答:因为高沸点防止油封液体挥发,而造成等压计液位得不稳定,低蒸汽压防止对被测液体得蒸汽压产生过高干扰。将硅油或石蜡油改为乙醇等低沸点得液体不可以,因为低沸点得乙醇较易挥发,使在测量过程中液面不稳定。不用油封不可以,因为不用油封一个内部液位挥发会造成测量误差,第二不易调整两侧液位。只要蒸气压很小且不与系统中物质发生化学作用得液体就可以作为等压计得油封液体。
八、实验结论
化学热力学化学平衡 一、选择题 ()1. 下列过程中,△G=0的是 (A) 氨在水中解离达平衡(B) 理想气体向真空膨胀(C) 乙醇溶于水(D) 炸药爆炸()2. 一定条件下,合成氨反应呈平衡状态,3H2+N2=2NH3-------K1, 3 2H2+ 1 2 N2=NH3-----K2,则K1与K2的关系为 (A) K1=K2(B) K12 = K2(C) K22=K1(D) 无法确定 ()3. 下列反应中哪个是表示△r H m=△f H m(AgBr,s)的反应 (A) Ag+(aq)+Br―(aq)=AgBr(s) (B) Ag(s)+1/2 Br2(l)=AgBr(s) (C) 2Ag(s)+Br2(g)=2AgBr(s) (D) Ag(s)+1/2 Br2(g)=AgBr(s) ()4.已知:A+B?→ ?M+N,Δr H1=35 kJ·mol-1;2M+2N?→ ?2D,Δr H2=-80 kJ·mol-1;则 A+B?→ ?D的Δr H3是 (A) -5kJ·mol-1(B) -10kJ·mol-1(C) -45kJ·mol-1(D) 45kJ·mol-1 ()5. H2 O(l,100℃,101.3 kPa) ?→ ?H2 O(g,100℃,101.3 kPa), 设H2 O(g)为理想气体,则由始态到终态体系所吸收的热量Q为 (A) >ΔH(B) <ΔH(C) =ΔH(D) =ΔU ()6. 下列单质的Δf H m不等于零的是 (A) Fe(s) (B) C(石墨) (C) Ne(g) (D) Cl2 (l) ()7. 合成氨反应3H2(g)+N2(g) 2NH3(g)在恒压下进行时,若向体系中引入氩气,则氨的产率 (A) 减小;(B) 增大;(C) 不变;(D) 无法判断。 ()8. 下列反应中,△r H m与产物的△f H m相同的是 (A)2H2 (g)+O2 (g) →2H2O(l)(B)NO(g)+?O2(g)→NO2(g) (C)C(金刚石)→C(石墨)(D)H2 (g)+?O2 (g) →H2O(g) ()9. 在标准压力和373 K下,水蒸气凝聚为液态水时体系中应是 (A) ΔH= 0 (B) ΔS= 0 (C) ΔG= 0 (D) ΔU = 0 ()10. 某体系在失去15kJ热给环境后,体系的内能增加了5kJ,则体系对环境所作的功是 (A) -20 kJ(B) -10 kJ(C) 10 kJ(D) 20 kJ ()11. 已知Zn(s) + 1/2O2 (g) =ZnO(s) Δr H m 1 = -351.5 kJ·mol-1 Hg(l) + 1/2O2 (g) =HgO(s,红) Δr H m 2 = -90.8 kJ·mol-1 则Zn(s) + HgO(s,红) =ZnO(s) + Hg(l) 的Δr H m为(kJ·mol-1) (A) 442.3 (B) -260.7 (C) 260.7 (D) -442.3 ()12.下列物理量中,属于状态函数的是 (A) ΔH(B) ΔU(C) Q(D) H ()13. 稳定纯态单质在298 K,100 kPa下,下述正确的是
第二部分工质的热力性质 六热力学函数的一般关系式 由热力学基本定律引出的一些基本热力学状态函数(如内能U、熵S)及其为某一研究方便而设的组合函数(如焓H、自由能F、自由焓G等)许多都是不可测量,必须将它们与可测量(如压力p、体积V、温度T等)联系起来,否则我们将得不到实际的结果,解决不了诸如上一章讲的最大功计算等一些具体的问题。 这就需要发展热力学的数学理论以将热力学基本定律应用到各种具体问题中去。 热力学函数一般关系式 全微分性质+基本热力学关系式6.1 状态函数的数学特性 对于状态参数,当我们强调它们与独立变量的函数关系时,常称它们为状态函数。从数学上说,状态函数必定具有全微分性质。这一数学特性十分重要,利用它可导出一系列很有实用价值的热力学关系式。下面我们扼要介绍全微分的一些基本定理。
设函数),(y x f z =具有全微分性质 dy y z dx x z dz x y ? ??? ????+??? ????= (6-1) 则必然有 (1) 互易关系 令式(6-1)中 ),(y x M x z y =???? ????, ),(y x N y z x =???? ???? 则 y x x N y M ???? ????=? ??? ???? (6-2) 互易关系与 ?=0 dz 等价。它不仅是全微分的必要条件 ,而且是充分条件。因此,可反过来检验某一物理量是否具有全微分。 (2) 循环关系 当保持z 不变,即0=dz 时,由式(6-1),得 0=???? ????+??? ????z x z y dy y z dx x z
则 x y z y z x z x y ???? ???????? ????- =???? ???? 故有 1-=???? ???????? ???????? ????y z x z x x y y z (6-3) 此式的功能是:若能直接求得两个偏导数,便可确定第三个偏导数。结果也很容易记忆,只需将三个变量依上、下、外次序,即))()((xzy yxz zyx 循环就行了。 (3) 变换关系 将式(6-1)用于某第四个变量ω不变的情况,可有 ωωωdy y z dx x z dz x y ? ??? ????+??? ????= 两边同除以ωdx ,得 ω ω??? ????? ??? ????+??? ????=??? ????x y y z x z x z x y (6-4) 式中:y x z ??? ????是函数),(y x z 对x 的偏导数;ω??? ????x z 是以),(ωx 为 独立变量时,函数),(ωx z 对x 的偏导数。上面的关系可用于它们之间的变换。这一关系式对于热力学公式的推导十分重要。
第一章 化学反应的方向和限度 第二节 化学反应的程度和化学平衡 一 可逆反应和化学平衡 1、可逆反应 在同一条件下,既能向一个方向进行,又能向相反方向进行的反应,称为可逆反应。 插入视频文件:可逆反应与化学平衡.swf 严格地说,可以认为所有的化学反应都具有一定的可逆性,从微观的角度来看,反应物分子可以发生有效碰撞,结合成产物分子;同时,产物分子也可以发生碰撞,再结合成反应物分子:反应物?产物。 当反应进行到某一程度,恰好逆正υυ=,反应物和产物的浓度都不再随时间而改变。那么,可逆反应的这种状态,就称为化学平衡。 2、化学平衡 正逆反应速率相等时,反应体系所处的状态,称为化学平衡状态。 特点:(1)逆正υυ= (2)动态平衡; (3)有条件的、相对的平衡(——条件改变,平衡改变)。 大量的实验表明:在一定条件下,处于化学平衡状态的体系,各物质浓度之间遵守一定的定量关系。这就是平衡常数关系式。 二 平衡常数 1、平衡常数 可逆反应在一定温度下达到平衡时,产物浓度的系数次方的乘积与反应物浓度的系数次方的乘积之比是一个常数,这个常数就叫做平衡常数。 :平衡浓度) 浓度平衡常数—c K c c c c K b a d g c ( (B)(A)(D)(G)dD gG bB aA c ??=+=+ 如果是气体反应,可以用平衡时各组分气体的分压来代替浓度,这时,平衡常数叫做压力平衡常数: (B) (A)(D)(G)p b a d g p p p p K ??= (p :平衡分压) ★ 注意:K c 、K p 一般都有单位,但习惯上不写;K c 一般不等于K p 。
为了统一和计算方便,规定在平衡常数的表达式中,凡是溶液中的浓度都除以标准态浓度:3θdm mol 1-?=c ,θc c ——相对浓度;若是气体分压,都除以标准态压力:Pa 101325θ=p , θp p ——相对分压,这样用相对浓度或相对分压表示的平衡常数,叫 标准平衡常数。 2、标准平衡常数 一般如果不作说明,我们提到的平衡常数都是指标准平衡常数。 ★ 注意:(1)平衡浓度、平衡分压 (2)对有纯固体或纯液体参加的反应,纯固体或纯液体的浓度视为常数1,不 出现在平衡常数的表达式中 (3)溶液中的组分一定用相对浓度θc c 表示;气相一定要用相对分压θp p 表 示 (4)平衡常数的表达式必须与反应方程式一一对应 3、平衡常数的意义 (1)平衡常数是反应进行程度的标志 (2)平衡常数是温度的单值函数,是反应的特征常数 (3)平衡常数指明了在一定温度下可逆反应建立平衡的条件 对于任一可逆反应:dD gG bB aA +=+,平衡时,各物质浓度符合: b a d g c c c c c c c c K ]/(B )[]/(A )[]/(D )[]/(G )[θθθθθ = 其中:c 一定是平衡浓度 若c 为任意状态浓度:b a d g c c c c c c c c Q ] /(B)[]/(A)[]/(D)[]/(G)[θθθθ=——反应商 则:?? ???=>><<—平衡建立的条件—反应处于化学平衡状态平衡浓度) 产物浓度反应向逆方向进行,(平衡浓度)产物浓度反应向正方向进行,(...θθθK Q K Q K Q 与自由能判据的关系: 根据热力学的推导,G ?与Q 之间存在下列关系: Q RT G G lg 303.2θ+?=? ——热力学等温方程。 当反应达平衡时:θ ,0K Q G ==? 则:0lg 303.2lg 303.2θθθ=+?=+?=?K RT G Q RT G G
第三章 化学反应系统热力学 习题及答案 § 标准热化学数据(P126) 1. 所有单质的 O m f G ? (T )皆为零为什么试举例说明 答:所有处于标准态的稳定单质的O m f G ? (T ) 皆为零,因为由稳定单质生成稳定单质 的状态未发生改变。如:单质碳有石墨和金刚石两种,O m f G ? ,石墨)=0,而O m f G ? ,金 刚石)= kJ·mol -1 (课本522页),从石墨到金刚石状态要发生改变,即要发生相变, 所以O m f G ? ,金刚石)不等于零。 2. 化合物的标准生成热(焓)定义成:“由稳定单质在和100KPa 下反应生成1mol 化合物的反应热”是否准确为什么 答:标准生成热(焓)的定义应为:单独处于各自标准态下,温度为T 的稳定单质生成单独处于标准态下、温度为T 的1mol 化合物B 过程的焓变。此定义中(1)强调压力为一个标准大气压,而不强调温度;(2)变化前后都单独处于标准态。 3. 一定温度、压力下,发生单位化学反应过程中系统与环境交换的热Q p 与化学反应摩尔焓变r m H ?是否相同为什么 答: 等压不作其他功时(W’=0),数值上Q p =n r H ?。但Q p 是过程量,与具体的过程有关;而r m H ?是状态函数,与过程无关,对一定的化学反应有固定的数值。如将一个化学反应至于一个绝热系统中,Q p 为零,但r m H ?有确定的数值。 § 化学反应热力学函数改变值的计算(P131) 1. O m r G ?(T )、m r G ?(T )、O m f G ?(B,相态,T )各自的含义是什么 答:O m r G ?(T ): 温度为T ,压力为P θ,发生单位反应的ΔG; m r G ?(T ):温度为T ,压力为P ,发生单位反应的ΔG;
第二讲化学热力学与化学平衡 一、基础知识点 1. 焓与焓变 (1)热力学第一定律: (2)焓: 热力学把定义为焓 焓变: 例1 1g火箭燃料肼在氧气中完全燃烧(等容),放热20.7kJ(273.15K),求1mol肼在该温度下完全燃烧的内能变化和等压反应热 2. 生成焓,熵,自由能 标态(100kPa)和T(K)下,由稳定单质生成1mol化合物(或不稳定态单质或其他形式)的焓变称为该物质在T(K)时的标准生成焓(kJ/mol) 标态下,1mol某物质的熵值叫做标准熵()(J/mol) 标态(100kPa)和T(K)下,由稳定单质生成1mol化合物(或不稳定态单质或其他形式)的自由能变化值称为该物质在T(K)时的标准生成自由能(kJ/mol)G:吉布斯自由能G = H - TS ?G m < 0 反应右向自发进行; ?G m = 0 反应达平衡; ?G m > 0 反应左向自发进行 3. 化学平衡 可逆反应:在同一条件下,既能向正反应方向又能向逆反应方向进行的反应。
化学平衡:正逆反应速度相等时,体系所处的状态称为化学平衡。 (1)建立平衡的前提:封闭体系、恒温、可逆反应; (2)建立平衡的条件:正逆反应速度相等(动态平衡,体系并非处于静止状态); (3)建立平衡的标志:各物质浓度不再随时间改变。平衡状态是封闭体系中可逆反应进行的最大限度; (4)化学平衡是有条件的平衡。外界因素:温度、压力、浓度、添加剂等。 4. 化学平衡常数 (1)一切可逆反应: (2)对于含气体的可逆反应: where mol/L→K C : (mol/L) ?n ; Pa , atm →K p : (Pa) ?n, (atm) ?n ?n = 0时,K C ,K p 无量纲 (1)如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。 (2)稀溶液中进行的反应,如有水参加,水的浓度也不必写在平衡关系式中 (3)同一化学反应,可以用不同的化学反应方程式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。进行化学平衡的计算时必须写出反应方程式和相应的平衡常数。 (4)对于气体反应,写平衡常数关系式时,除可以用平衡时的(物质的量)浓度表示外,也可以用平衡时气体的分压来表示 5. 平衡常数意义 (1)平衡常数的大小可以判断反应进行的程度、估计反应的可逆性。因为平衡状态是
热力学、动力学、化学平衡练习题 一.选择题: 1.下列参数中,哪个不属于状态函数? (A)温度T (B)压强P (C)热Q (D)焓H 2.已知反应)(2 1)()(2222g O l O H l O H + =的198-O ?-=?mol kJ H m r 反应)()(22g O H l O H =的1 0.44-O ?=?mol kJ H m r 则反应)()(2)(22222g O g O H l O H +=的为O ?m r H (A) -54 1 -?mol kJ (B) -1081 -?mol kJ (C) -1421 -?mol kJ (D)1421 -?mol kJ 3.在恒温条件下,若化学平衡发生移动,则其平衡常数 (A)不变 (B)减小 (C)增大 (D)难以判断 4.反应)()(2 1)()(22g CO g N g CO g NO += +的10.373-O ?-=?mol kJ H m r ,若要提高 )(g NO 和)(g CO 的转化率,可采取的方法是 (A)高温低压 (B)高温高压 (C)低温高压 (D)低温低压 5.已知某反应的速率常数为1 min 35.0-=k ,则此反应是 (A)零级反应 (B)一级反应 (C)二级反应 (D)三级反应 6.一个复杂反应的速度是 (A)由最慢的一步基元反应决定 (B)由最快的一步基元反应决定 (C)各步基元反应速度之和 (D)无法确定的 7.相同温度下,下列哪个反应的熵增量最大? (A))()(2)(2223g O g SO g SO += (B))(),()(22g O s C g CO +=石墨 (C))()(3)(2223g N g H g NH += (D))(2)()(22424l O H s CaSO s O H CaSO +=? 8.某反应在298K 及×105 Pa 时正反应能自发进行,高温时,逆反应能自发 进行,说明该反应正向属于下列哪种类型? (A)0,0>??S H (C)0,0?>?S H
第一章 绪论 1. 化学反应工程是一门研究______________的科学。(化学反应的工程问题) 2. 化学反应工程是一门研究化学反应的工程问题的科学,既以_______作为研究对象,又以_______为研究对象的学科体系。(化学反应、工程问题) 3. _______是化学反应工程的基础。( 三传一反) 4. 化学反应过程按操作方法分为_______、_______、_______操作。(分批式操作、连续式操作、半分批式) 5. 化学反应工程中的“三传一反”中的三传是指_______、_______、_______。(传质、传热、动量传递) 6. 不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来表达个参数间的关系,简称_______。(数学模型) 7. 在建立数学模型时,根据基础资料建立物料、热量和动量衡算式的一般式为_______。(累积量=输入量-输出量) 8.“三传一反”是化学反应工程的基础,其中所谓的一反是指_______。(D ) A .化学反应 B. 反应工程 C. 反应热力学 D. 反应动力学 9.“三传一反”是化学反应工程的基础,下列不属于三传的是_______。(A ) A. 能量传递 B. 质量传递 C. 热量传递 D. 动量传递 第二章 均相反应动力学 1. aA + bB pP + sS 对于反应,则=P r _______)(A r -。( a p ) 2.着眼反应组分K 的转化率的定义式为_______。( 00K K K K n n n -= χ) 3. 化学反应速率式为β αB A C A C C K r =-,用浓度表示的速率常数为C K ,假定符合理想气体状态方程,如用压力表示的速率常数P K ,则C K =_______P K 。() ()(βα+RT ) 4. 活化能的大小直接反映了______________对温度的敏感程度。(反应速率) 5. 一个可逆的均相化学反应,如果正、逆两向反应级数为未知时,采用______________法来求反应级数。(初始速率法) 6. 平行反应A P(主) S(副)均为一级不可逆反应,若主E >副E ,选择性S p 与_______无关,仅是_______的函数。(浓度、温度) 7. 如果平行反应 A P(主) S(副)均为一级不可逆反应,若主E >副E ,提高选择性P S 应 _______。(提高温度) 8. 一级连串反应A S K 1 K 2 P 在平推流反应器中,为提高目的产物P 的收率,应 ______12/k k 。(降低) 9.化学反应O H CH H CO 2423+?+,其中化学反应计量系数为-1的是哪种物质______。(A ) A. CO B. 2H C. 4CH D. O H 2 10.对于一非恒容均相化学反应αA A αB B ,反应组分A 的化学反应速率 =-A r _______。(A ) A. Vdt dn r A A -=- B. Vdt dn r B A -=- C. dt dC r A A -=- D. dt dC r B A -=-
第五讲热力学函数法 讲授内容:教科书§1.9-10 学时:6 教学方法:结合课件中的文字、画图、公式进行讲授;通过习题课使学生熟悉用热力学函数解决问题的方法 教学目的:1使学生熟悉热力学基本方程和基本不等式的应用,掌握热力学函数法的基本精神,会在典型热效应之间建立联系,会用热力学方法计算简单系统的热力学函数。 教学重点:热力学函数法的基本精神 教学难点:应用导数变换方法建立不同热效应之间的联系。本讲吸取国内对此内容的教学经验,将问题归纳为几种典型,通过较多的练习和习题课,使难点得以突破。 教学过程: 一热力学函数与典型过程(70分钟)(字幕) 引言:通过前面的讨论,我们在热力学定律和统计规律的基础上引进了两个基本的态函数——内能和熵。从原则上讲,利用这两个热力学函数再加上物态方程可以解决宏观热现象的一般问题。然而在实际操作上并不都很方便。例如在绝热过程中(字幕),外界对系统作的功等于系统内能的U A-U B=W (字幕)通过末态B与初态A内能之差可以直接得到功。根据熵增原理dS≥0(字幕)可以判断不可逆绝热过程的进行方向(字幕)。可是很多过程并不是绝热的,对于经常遇到的等温过程或等温等压过程就无法直接运用内能和熵解决上述问题。本节将引入几个新的热力学函数使问题得到简洁地处理。 1焓与等压过程:(字幕)
1.1等压过程中的功: (字幕)如果系统只有V 作为外参量,在等压过程中外界对系统的功W=-P 0(V B -V A )=-P 0ΔV (字幕) 1.2焓与等压过程中的热量: (字幕)ΔU=U B -U A =Q-P 0ΔV (字幕)移项得Δ(U+P 0V)=Q (字幕)不管等压过程是否可逆,只要初末态是平衡态,系统在初末态的压强P =P 0,引入新的热力学函数——焓H=U+PV (字幕)则ΔH=Q (字幕) 对于初末态为平衡态的无穷小过程则有dH=δQ (字幕)焓是广延量,具有和内能相同的量纲。焓具有明显的物理意义:在没有非体变功的等压过程中系统吸收的热量等于系统焓的增加,系统放出的热量等于系统焓的减少。(字幕)通过末态与初态焓的差就可以算得系统在等压过程中吸收的热量。 1.3焓的全微分式: (字幕)在热力学基本方程两端加d(PV),即 d U P V T d S P d V d P V ()()+=-+ 于是有 d H T d S Vd P =+ (字幕) 上式是以熵S 和压强P 为独立变量时焓的全微分表达式。有时,使用它讨论等压过程的问题比使用基本方程更为方便。通常,H(S,P)的全微分为 dH H S dS H P dP P S =+(/)(/)???? 两式对照即有(/)??H S T P =, (/)??H P V S = 。(字幕) 1.4定压热容:(字幕)系统的定压热容 C li m H T )H T )P T P ==→???0(/(/?? 对于等压过程, dH T dS Q C dT P ===δ 定压热容又可以由下式算得C H T T S T P P P ==(/)(/)???? (字幕) 2自由能与等温过程:(字幕) 2.1自由能与等温过程的功:(字幕)对于等温过程,将热力学基本不等式移项可得
1、对反应CO(g)+H2O(g)=H2(g)+CO2(g) ( B ) (A)=1 (B)=K c (C)>K c (D)<K c 2、化学反应体系在等温等压下发生Δξ= 1 mol 反应,所引起体系吉布斯自由能的改变值Δr G m的数值正好等于体系化学反应吉布斯自由能(G/ξ)T,p,的条件是:(D) (A) 体系发生单位反应 (B) 反应达到平衡 (C) 反应物处于标准状态 (D) 无穷大体系中所发生的单位反应 3、饱和溶液中溶剂的化学势与纯溶剂的化学势的关系式为: ( C ) (A)(B)(C)(D)不能确定 4、饱和溶液中溶质的化学势与纯溶质的化学势的关系式为: ( A ) (A)(B)(C)(D)不能确定 5、不饱和溶液中溶剂的化学势与纯溶剂的化学势的关系式为: ( C ) (A)(B)(C)(D)不能确定 6、不饱和溶液中溶质的化学势与纯溶质的化学势的关系式为: ( C ) (A)(B)(C)(D)不能确定 7、化学反应等温式Δr G m=+ RT ln Q a,当选取不同标准态时,反应的将改变,该反应的 Δr G m和Q a将: ( C ) (A) 都随之改变 (B) 都不改变 (C) Q a变,Δr G m不变 (D) Q a不变,Δr G m改变 8、在等温等压下,当反应的= 5 kJmol-1时,该反应能否进行? ( C ) (A) 能正向自发进行 (B) 能逆向自发进行 (C) 不能判断 (D) 不能进行 9、已知反应2NH3= N2+ 3H2在等温条件下,标准平衡常数为0.25,那
么,在此条件下,氨的合成反应(1/2) N2+(3/2) H2= NH3的标准平衡常 数为: ( C ) (A) 4 (B) 0.5 (C) 2 (D) 1 10、某化学反应在298 K时的标准吉布斯自由能变化为负值,则该温度时 反应的K将是: ( C ) (A) K= 0 (B) K< 0 (C) K> 1 (D) 0 < K< 1 11、25℃时水的饱和蒸气压为3.168 kPa,此时液态水的标准生成吉布斯 自由能为- 237.19 kJ·mol-1,则水蒸气的标准生成吉布斯自由能为: ( D ) (A) -245.76 kJmol-1 (B) -229.34 kJmol-1 (C) -245.04 kJmol-1 (D) -228.60 kJmol-1 12、理想气体反应的与温度的关系为: 若在标准状态下的反应向右进行,则应控制反应的温度: (B) (A)须高于409.3 K (B)须低于409.3 K (C)须等于409.3 K (D)须低于409.3 C 13、对理想气体反应 CO(g) + H2O(g) = H2(g) + CO2(g) ,下述哪种关系是 正确的? ( B ) (A) K x< K p (B) K p= K x (C) K x= K c (D) K p< K c 14、理想气体反应平衡常数K x与K c的关系是∶ ( D ) (A) K x= K c(RT) (B) K x= K c p (C) K x= K c(RT/p (D) K x= K c(V/n B) 15、在1100℃时,发生下列反应: (1) C(s) + 2S(s) = CS2(g) K1= 0.258 (2) Cu2S(s) + H2(g) = 2Cu(s) + H2S(g) K2= 3.9×10-3 (3) 2H2S(g) = 2H2(g) + 2S(s) K3= 2.29×10-2 则1100℃时反应 C(s) + 2Cu2S(s) = 4Cu(s) + CS2(g) 的K为: (A ) (A) 8.99×10-8 (B) 8.99×10-5 (C) 3.69×10-5 (D)3.69×10-8 16、气相反应 A+B = 2L+M ,在 25℃下和恒定容器内进行,最初 A 和
§2.1内能、焓、自由能和吉布斯函数的全微分 热力学函数中的物态方程、内能和熵是基本热力学函数,不仅因为它们对应热力学状态描述第零定律、第一定律和第二定律,而且其它热力学函数也可以由这三个基本热力学函数导出。焓:自由能: 吉布斯函数: 下面我们由热力学的基本方程(1) 即内能的全微分表达式推导焓、自由能和吉布斯函数的全微分 ?焓、自由能和吉布斯函数的全微分 o焓的全微分 由焓的定义式,求微分,得, 将(1)式代入上式得(2) o自由能的全微分 由得 (3) o吉布斯函数的全微分
(4) 从方程(1)(2)(3)(4)我们容易写出内能、焓、自由能和吉布斯函数的全微分dU,dH,dF,和dG独立变量分别是S,V;S,P;T,V和T,P 所以函数U(S,V),H(S,P),F(T,V),G(T,P)就是我们在§2.5将要讲到的特性函数。下面从这几个函数和它们的全微分方程来推出麦氏关系。 二、热力学(Maxwell)关系(麦克斯韦或麦氏) (1)U(S,V) 利用全微分性质(5) 用(1)式相比得(6) 再利用求偏导数的次序可以交换的性质,即 (6)式得(7) (2)H(S,P)
同(2)式相比有 由得(8) (3)F(T,V) 同(3)式相比 (9) (4)G(T,P) 同(4)式相比有 (10) (7),(8),(9),(10)式给出了热力学量的偏导数之间的关系,称为麦克斯韦(J.C.Maxwell)关系,简称麦氏关系。它是热力学参量偏导数之间的关系,利用麦氏关系,可以从以知的热力学量推导出系统的全部热力学量,可以将不能直接测量的物理量表示出来。例如,只要知道物态方程,就可以利用(9),(10)式求出熵的变化,即可求出熵函数。
一、热力学函数: 1、热力学能(U): 意义:反映了处于一定状态下的系统内部的能量总和。 应用:其本身无实际应用意义,但是热力学能变,即△U,可以反映系统变化前后的能量变化,其变化只与系统始终状态有关而与过程的具体途径无关。即△U等于系统与环境之间的能量传递。△U=W+Q。△U>0表明系统吸收了能量, △U<0表明系统放出了能量。 2、焓(H): 意义:热力学中将(U+pV)定义为焓,其本身并无明确的物理意义。 应用:H= U+pV,因而,焓就和热力学能一样,无实际意义,但是焓变△H却很有应用意义,Q p =H2-H1 =△H反映了在恒温恒压只做体积功的封闭系统中,系统吸收的能量全部用于增加系统的焓。△H>0表明系统吸热,△H<0则表明系统放热。即可以用其表示恒压条件下系统放出的或吸收的热量多少,实践证明,即使有气体参加的反应,p△V也很小,即△H≈△U,因而,在没有△U数据时,可以暂时用△H代替。 3、熵(S): 意义:熵反映了在一定状态下系统混乱度的大小。 应用:熵变△S却反映了系统变化前后混乱度的变化,0 K时,纯物质完美晶体的微观粒子熵为0,即S m* (B,0 K)=0,因而可以以此为基准,确定其他温度下物质的熵,△r S m(B)= S m(B,T)- S m* (B,0 K)= S m(B,T)。 4、吉布斯函数(G): 意义:吉布斯函数和焓一样,本身没有明确的物理意义,热力学中将H-TS规定为吉布斯函数。 应用:其本身无实际用途,但是其变化,即△G=△H-T△S,反映了在恒温恒压非体积功等于零的自发过程中,其焓变、熵变和温度三者的关系。△G的大小可作为判断反应能否自发进行的判据。即: △G<0 自发进行 △G=0 平衡状态 △G>0 不能自发进行(其逆过程是自发的)即根据△H,T,△S可以计算出△G,用于判断反应的可行性。 二、解离常数(K): 意义:反映了物质在溶液中电解能力的大小。 应用:常用的是电解质在水中的解离常数,如果是酸,跟据其解离常数可以计 算出溶液的解离常数大小,进而可以判断其酸碱性强弱或者直接换成pH的大小,碱也是如此。另外,只要知道弱电解质的解离度大小,根据其浓度,就能计算出其溶液中离子的浓度。跟据加入的电解子的离子,还可以计算出溶解平衡的移动方向,即同离子效应。 三、溶度积(K sp): 意义:反映了难容电解质的饱和溶液中,个离子活度幂次方的乘积大小,从而反映出该物质溶解能力的大小。 应用:1、根据溶度积原理,可以判断沉淀平衡移动的方向。 Q i >K sp 溶液为过饱和溶液,平衡向生成沉淀的方向移动。
电动势法测定化学反应的热力学函数 实验预习题 1. 能否用伏特计测化学反应的电动势?为什么?实验怎么用对消法测电动势? 2. 了解电位差计、标准电池和检流计的使用及注意事项。 3. 对消法测定电池电动势的装置中,电位差计,工作电池,标准电池及检流计 各起什么作用?标准电池的重要特点是什么?正负极各是什么?写出正负极及总反应方程式。 4. 在测量电池电动势的过程中,若检流计指针或光点总向一个方向偏转,可能 是什么原因? 5. 用电池电动势法测定化学反应热力学函数的原理和方法。 一、仪器及试剂 电势差计及附件:1套,超级恒温槽:1台,银—氯化银电极:1只, U型电极管:1只,饱和甘汞电极:1支,饱和氯化钾溶液 二、基本原理 原电池由正、负两极和电解质组成。电池在放电过程中,正极上发生还原反应,负极则发生氧化反应,电池反应是电池中所有反应的总和。 电池除可用作电源外,还可用它来研究构成此电池的化学反应的热力学性质,从化学热力学得知,在恒温、恒压、可逆条件下,电池反应有以下关系: (Δr G m)T,P= -nFE (1) (2) (3) 式中,F为法拉弟(Farady)常数;n为电极反应式中电子的计量系数;E为电池的电动势。 电池反应的Δr G m、Δr S m、Δr H m、Δr G m 分别测定“1”中电池在各个温度下的电动势, 作E—T图,从曲线斜率可求得任一温度下的,利用公式(1),(2),(3),(5),即 可求得该电池反应的Δr G m、Δr S m、Δr H mΔr G m 三、操作步骤 1、电池的组合 将Ag—AgCl电极、饱和甘汞电极插入装有饱和氯化钾溶液的电极管中,即得下列电池。
第6章化学平衡热力学原理 1. 1000 K,101.325kPa时,反应2SO3(g) ==== 2SO2(g)+O2(g)的Kc=3.54 mol·m-3。 (1)求此反应的 Kp和Ky;(2)求反应SO3(g)==== SO2(g)+1/2O2(g)的Kp和Kc。 (答案:①K p= 29.43 kPa,K Y= 0.29,②K p= 171.6 kPa,K c= 1.88 mol1/2·m-3/2) 解:(1) 2SO3(g)==== 2SO2(g)+O2(g) K p=Kc(RT)∑νβ=3.54×8.314×1000=29.43×103 Pa=29.43kPa K y= K p·P-∑νβ=29430×(101325)-1=0.29 (2) SO3(g)==== SO2(g)+1/2O2(g) = = 2.在温度T容积V的容器中,充入1mol H2和3mol I2,设平衡后有x mol HI生成。若再加入2mol H2,则平衡后HI的物质的量为2x mol。试计算Kp值。 (答案:4) 解:已知平衡时生成HI摩尔数为x H2(g) + I2(g) ==== 2HI 反应前摩尔数 1 3 0 平衡时摩尔数 1-0.5x3-0.5x x 总摩尔数∑n=1- 0.5x +3- 0.5x + x = 4mol ∵∑νB = 0 若在上述平衡体系中再加入2摩尔H2
H2(g) + I2(g) ==== 2HI 重新平衡时摩尔数3-x 3-x 2x 总摩尔数=3-x+3-x+2x = 6 在同一温度T,, ∴,解此方程得:x =1.5,故 3.将含有50% CO、25% CO2、25% H2(均为摩尔分数)的混合气体通入1 173 K的炉子中,总压为202.65 kPa。试计算平衡气相的组成。已知反应 CO2(g)+H2(g)===H2O(g)+CO(g)在1 173 K时,Kp=1.22。 (答案:CO2:18.03%,H2:18.03%,H2O:6.97%;CO:56.97%) 解:CO2(g)+H2(g) === H2O(g)+CO(g) 反应前物质的量0.25 0.25 0 0.5 mol 平衡时0.25-x0.25-x x0.5+x ∑n1= 0.25-x + 0.25-x + x + 0.5+x =1 0.22x2-1.11x + 0.07625 = 0 ,x = 0.0697 所以H2O%=6.97% CO% = (0.5+0.0697)×100% = 56.97% CO2% = H2% = (0.25-0.0697)×100% = 18.03%
第2章. 化学热力学与化学平衡 2.1 化学热力学基本知识 1. 研究内容:化学热力学研究的对象是宏观系统。 化学反应的能量变化;化学反应的方向;化学的反应限度。 2. 一些相关的重要的基本概念 (1)系统、环境和相: 热力学中研究的对象为系统;称系统以外的其他密切相关部分为环境。 相是系统中物理性质和化学性质完全相同的均匀部分,相与相之间存在明显的界面。通常把只含有一个相的系统称为均相系统;含两个或两个以上相的系统称为多相系统。(2)系统的分类: 按系统与环境之间能量和物质交换有无交换分三类: 重点讨论的是封闭系统。 (3)状态和状态函数: 状态:系统的宏观性质的综合表现。
状态函数:描述系统性质的物理量(如:n、p、V、T、U、H、G、S ……) 广度性质:具有加和性的系统性质,如体积、质量等。 强度性质:不具有加和性的系统性质, 如温度。 状态函数的特点:其量值只取决系统所处的状态;其变化值仅取决于系统的始态和终态,而与变化的途径无关。(4)过程和途径: 系统状态所发生的任何变化称为过程。系统经历一个过程,由始态变化到终态,可以采用多种不同的方式,通常把完成某一过程的具体方式称为途径。 根据过程发生时的条件不同,可分为以下几类: (1)等温过程:系统的始态温度与终态温度相同。 (2)等压过程:系统始态的压力与终态的压力相同。 (3)等容过程:系统的体积无变化的过程称为等容过程。 (4)循环过程:如果系统由某一状态出发,经过一系列变化又回到原来的状态,这种过程就称为循环过程。 无机化学重点讨论等温等压等压过程。 3. 标准状态、标准状况 热力学标准状态:
第七章统计热力学基础 教学目的与要求: 通过本章的教学使学生初步了解统计热力学的基本研究方法,各种独立子系统的微观状态数的求法,不同系统的统计规律,系统的各热力学函数的表示式,配分函数的计算,固体的热容理论导出的基本思路。 重点与难点: 统计热力学的基本研究方法,不同系统的微观状态数的计算,玻尔兹曼分布律的含义,系统的热力学函数的表示式,配分函数的计算,不同的固体热容理论的基本方法。 §7.1 概论 统计热力学的研究任务和目的 统计力学的研究对象是大量微观粒子所构成的宏观系统。从这一点来说,统计热力学和热力学的研究对象都是一样的。但热力学是根据从经验归纳得到的四条基本定律,通过演绎推理的方法,确定系统变化的方向和达到平衡时的状态。由于热力学不管物质的微观结构和微观运动形态,因此只能得到联系各种宏观性质的一般规律,而不能给出微观性质与宏观性质之间的联系。而统计热力学则是从物质的微观结构和基本运动特性出发,运用统计的方法,推导出系统的宏观性质,和变化的可能方向。 统计力学的研究方法是微观的方法,它根据统计单位(微粒)的力学性质如速度、动量、位置、振动、转动等,用统计的方法来推求系统的热力学性质,例如压力、热容、熵等热力学函数。统计力学建立了体系的微观性质和宏观性质之间的联系。从这个意义上,统计力学又可称为统计热力学。 相对于热力学,统计力学对系统的认识更深刻,它不但可以确定系统的性质,变化的方向和限度,而且还能确定系统的性质的微观根源,这一点要比热力学要深刻。对于简单系统,应用统计热力学的方法进行处理,其结果是令人满意的。当然统计热力学也有自身的局限性,由于统计力学要从微观粒子的基本运动特性出发,确定系统的状态,这就有一个对微观粒子的运动行为的认识问题。由于人们对于物质结构的认识不断深化,不断地修改充实物质结构的模型,所对统计理论和统计方法也要随之修改,所以统计理论是一种不断发展和完善的。同时模型本身也有近似性,所以由此得到的结论也有近似性。从历史的发展来看,最早是由玻兹曼(Boltzmann)以经典力学为基础建立的统计方法,称为经典统计热力学。1900 年普朗克(Planck)提出了量子论,麦克斯韦(Maxwell)将能量量子
气体热力学动力学化学平衡练习及答案 第一章2008-1-4 气体热力学动力学化学平衡练习 一、选择题 1. H2(g) + O2(g) H2O(l) 的Q p与Q V之差(kJ·mol-1)是………………………() (A) -3.7 (B) 3.7 (C) 1.2 (D) -1.2 2. 某基元反应2A + B = C + D,若其反应速率表示式可以是: (1) d(C) / d t = k1(A)2(B) 或(2) -d(A) / d t = k2(A)2(B) 或(3) 加催化剂后d(C) / d t = k3(A)2(B) 则这些速率常数k之间的关系是…………………………………………………………() (A) k1 = k2 = k3(B) k11k21k3 (C) k1 = k21k3(D) k1 = k31k2 3. 反应H2(g) + Br2(g) 2HBr(g) 的K c = 1.86。若将3 mol H2,4 mol Br2和5 mol HBr 放在10 dm3烧瓶中,则……………………………………………………………………() (A) 反应将向生成更多的HBr方向进行(B) 反应向消耗H2的方向进行 (C) 反应已经达到平衡(D) 反应向生成更多Br2的方向进行 4. 如果体系经过一系列变化,最后又变到初始状态,则体系的………………………() (A) Q= 0 W= 0 ΔU = 0 ΔH= 0 (B) Q1 0 W1 0 ΔU= 0 ΔH= Q (C) Q= WΔU= Q- WΔH= 0 (D) Q1WΔU= Q- WΔH= 0 5. 某化学反应的速率常数的单位是(时间)-1,则反应是………………………………() (A) 零级反应(B) 三级反应(C) 二级反应(D) 一级反应 6. 已知N2(g) + 3H2(g) 2NH3(g);N2(g) + H2(g) NH3(g) 和 N2(g) + H2(g) 2/3NH3(g) 的平衡常数分别为K1、K2和K3,则它们的关系是…() (A) K1= K2= K3(B) K1= (K2)2= (K3)3 (C) K1= K2= K3(D) K1= (K2)1/2= (K3)1/3 7. 对于一个确定的化学反应来说,下列说法中正确的是………………………………() (A) 越负,反应速率越快(B) 越负,反应速率越快 (C) 活化能越大,反应速率越快(D) 活化能越小,反应速率越快 8. 下列说法不正确的是…………………………………………………………………() (A) 基元反应的反应级数等于反应分子数 (B) 反应级数为分数的反应一定是非基元反应 (C) 吸热反应一定是活化能较高的反应,放热反应一定是活化能较低的反应 (D) 温度升高,有效碰撞的概率增大,反应速率增大 9. 化合物A有三种不同的水合物,它们的脱水反应的K p分别为: A·3H2O(s) = A·2H2O(s) + H2O(g) K p1 A·2H2O(s) = A·H2O(s) + H2O(g) K p2 A·H2O(s) = A(s) + H2O(g) K p3 为了使A·2H2O晶体保持稳定(不发生风化与潮解) ,容器中水蒸气压力应为…()
第6章 化学平衡热力学 6.1 重要概念和方法 1.化字平衡的概念 在一定温度和压力下,若化学反应系统不伴随混合过程,化学反应开始后会一直进行直至反应物完全转化成产物。如果反应过程中存在物质的混合过程,由于混合熵?mix S 的存在,使得反应不能进行到底,而最终获得平衡混合物。 对于等温等压下的化学反应 ∑=B ν0B B 此式表明:①在等温等压条件下,Gibbs 函数据与化学势判据没有区别;②在一定温度及压力下,G =G(ξ),即反应过程中系统的G 随变当达化学平衡时G 具有最小值;②在一定温度及压力下,?r G m =f(ξ),表明在反应过中?r G m 具有即时性,当达平衡位置时?r G m =0。 p T B B B m r G G ,??????????==?∑ξμν 2.化学反应方向和限度的判断 化学反应等温式表明,?r G m 的正负取决于J 与K Θ的相对大小,即 ?????=><ΘΘΘ化学平衡反应逆向进行 反应正向进行K K K J 3.化学反应的J 和K Θ 参与反应的各种物质的活度积J 与反应系统的温度、压力及组成有关,即在等温等压下着反应进行J 值不断变化;平衡常数K Θ用于描述平衡位置,它只是温度的函数,即在反应过程中及K Θ不随组成而变化。当达化学平衡时 此式表明,K Θ值等于平衡时的活度积这便是平衡常数的物理意义。用此式可由平衡组成求取平衡常数。反之,也可由K Θ值计算平衡组成。 B ()B eq B eq a J K ν∏==Θ 4.K Θ的具体形式 在热力学中,不同的物质常选择不同的标准状态。对于同一种物质,也常用不同习惯选择标准状态。因此,在不同情况下活度a B 具有不同的意义,因而K Θ也就具有不同的表达形式: (1) 对气相反应 B B eq B p f K ν∏??? ?????=ΘΘ若气体可近似视为理想气体,则上式为 B B eq B p p K ν∏????????=ΘΘ (2) 对理想溶液反应 ()B B eq B x K ν∏=Θ(3) 对理想稀薄溶液反应 ()B B eq B x K ν∏=ΘB B eq B b b K ν∏ ????????=ΘΘ或