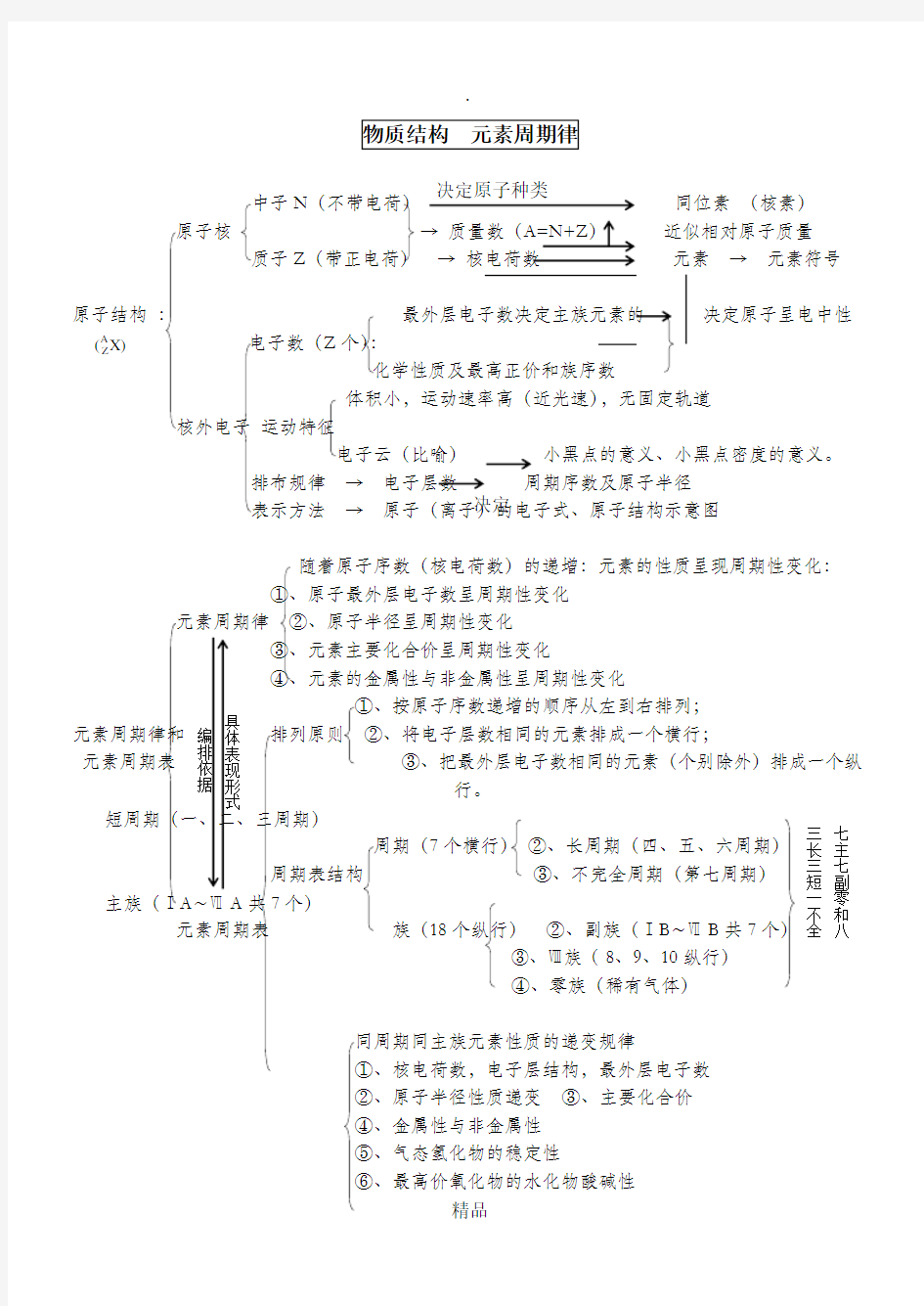

中子N (不带电荷) 同位素 (核素)
原子核 → 质量数(A=N+Z ) 近似相对原子质量
质子Z (带正电荷) → 核电荷数 元素 → 元素符号
原子结构 : 决定原子呈电中性 电子数(Z 个): 化学性质及最高正价和族序数 体积小,运动速率高(近光速),无固定轨道
核外电子 运动特征
电子云(比喻) 小黑点的意义、小黑点密度的意义。
排布规律 → 电子层数 周期序数及原子半径
表示方法 → 原子(离子)的电子式、原子结构示意图
随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化:
①、原子最外层电子数呈周期性变化
元素周期律 ②、原子半径呈周期性变化
③、元素主要化合价呈周期性变化
④、元素的金属性与非金属性呈周期性变化
①、按原子序数递增的顺序从左到右排列; 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵
行。 短周期(一、二、三周期) 7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) 主族(ⅠA ~ⅦA 共7个) 元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行)
④、零族(稀有气体)
同周期同主族元素性质的递变规律
①、核电荷数,电子层结构,最外层电子数
②、原子半径性质递变 ③、主要化合价
④、金属性与非金属性
⑤、气态氢化物的稳定性
⑥、最高价氧化物的水化物酸碱性
决定原子种类 决定 编排依据 具体表现形式 X)
(A Z 七主
七副
零和八
三长三
短一不全
电子层数:相同条件下,电子层越多,半径越大。
判断的依据核电荷数相同条件下,核电荷数越多,半径越小。
最外层电子数相同条件下,最外层电子数越多,半径越大。微粒半径的比较1、同周期元素的原子半径随核电荷数的增大而减小(稀
有气体除外)如:
Na>Mg>Al>Si>P>S>Cl.
2、同主族元素的原子半径随核电荷数的增大而增大。如:
Li 具体规律:3、同主族元素的离子半径随核电荷数的增大而增大。如: F-- 4、电子层结构相同的离子半径随核电荷数的增大而减小。如: F-> Na+>Mg2+>Al3+ 5、同一元素不同价态的微粒半径,价态越高离子半径越小。如 Fe>Fe2+>Fe3+ ①与水反应置换氢的难易 ②最高价氧化物的水化物碱性强弱 金属性强弱③单质的还原性或离子的氧化性(电解中在阴极上 得电子的先后) ④互相置换反应 依据:⑤原电池反应中正负极 ①与H2化合的难易及氢化物的稳定性 元素的非金属性强弱②最高价氧化物的水化物酸性强弱 金属性或非金属③单质的氧化性或离子的还原性 性强弱的判断④互相置换反应 ①、同周期元素的金属性,随荷电荷数的增加而减小,如:Na>Mg>Al; 非金属性,随荷电荷数的增加而增大,如:Si 规律:②、同主族元素的金属性,随荷电荷数的增加而增大,如: Li F>Cl>Br>I。 ③、金属活动性顺序表: K>Ca>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au 定义:以12C原子质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它比较所得的值。其国际单位制(SI)单位为一,符号为1 (单位1一般不写) 原子质量:指原子的真实质量,也称绝对质量, 是通过精密的实验测得的。如:一个Cl2分子 的m(Cl2)=2.657×10-26kg。 核素的相对原子质量:各核素的质量与12C的质量的1/12的比值。 一种元素有几种同位素,就应有几种不同 的核素的相对原子质量, 相对原子质量诸量比较:如35Cl为34.969,37Cl为36.966。(原子量)核素的近似相对原子质量:是对核素的相对原子质量取近似整数 值,数值上与该核素的质量数相 等。如:35Cl为35,37Cl为37。 元素的相对原子质量:是按该元素各种天然同位素原子所占的原 子百分比算出的平均值。如: Ar(Cl)=Ar(35Cl)×a% + Ar(37Cl)×b% 元素的近似相对原子质量:用元素同位素的质量数代替同位素相 对原子质量与其丰度的乘积之和。 注意:①、核素相对原子质量不是元素的相对原子质量。 ②、通常可以用元素近似相对原子质量代替元素相对原子质量进行 必要的计算。 定义:核电荷数相同,中子数不同的核素,互称为同位素。 (即:同种元素的 不同原子或核素) 同位素 ①、结构上,质子数相同而中子数不同; 特点②、性质上,化学性质几乎完全相同,只是某些物理性质略有不同; ③、存在上,在天然存在的某种元素里,不论是游离态还是化合态,同位素的原子(个数不是质量)百分含量一般是不变的(即丰度一定)。 1、定义:相邻的两个或多个原子之间强烈的相互作用。 ①、定义:阴阳离子间通过静电作用所形成的化学键 ②、存在:离子化合物(NaCl 、NaOH 、Na 2O 2等);离子晶体。 ①、定义:原子间通过共用电子对所形成的化学键。 ②、存在:共价化合物,非金属单质、离子化合物中 (如:NaOH 、Na 2O 2); 共价键 分子、原子、离子晶体。 2、分类 极性键 共价化 合物 化学键 非极性键 非 金属单质 ③、分类:离子键 共用电子对是否偏移 不同原子间 相同原子 分子的极 双方提供:共价键 单方提供:配位键 如:NH 4+、H 3O + 金属键:金属阳离子与自由电子之间的相互作用。存在于金属单质、金 属晶体中。 3、键参数 键长 键角 4、表示方式:电子式、结构式、结构简式(后两者适用于共价键) 定义:把分子聚集在一起的作用力 分子间作用力(范德瓦尔斯力):影响因素:大小与相对分子质量有关。 作用:对物质的熔点、沸点等有影响。 ①、定义:分子之间的一种比较强的相互作用。 ②、形成条件:第二周期的吸引电子能力强的N 、O 、F 与H 之间(NH 3、H 2O ) ③、对物质性质的影响:使物质熔沸点升高。 ④、氢键的形成及表示方式:F -—H ···F -—H ···F -— 共用电子对的来源 分子的稳定性 分子的空间构型 决定 分子的极性 决定 (孤对电 H···←代表氢键。 氢键O O H H H H O H H ⑤、说明:氢键是一种分子间静电作用;它比化学键弱得多,但比 分子间作用力稍强;是一种较强的分子间作用力。 定义:从整个分子看,分子里电荷分布是对称的(正负电荷中心能重 合)的分子。 非极性分子双原子分子:只含非极性键的双原子分子如:O2、H2、Cl2等。 举例:只含非极性键的多原子分子如:O3、P4等 分子极性多原子分子:含极性键的多原子分子若几何结构对称 则为非极性分子 如:CO2、CS2(直线型)、CH4、CCl4(正四面体型) 极性分子:定义:从整个分子看,分子里电荷分布是不对称的(正负电荷 中心不能重合)的。 举例双原子分子:含极性键的双原子分子如:HCl、NO、CO 等 多原子分子:含极性键的多原子分子若几何结构不对称则为极性分子 如:NH3(三角锥型)、H2O(折线型或V 型)、H2O2 如有侵权请联系告知删除,感谢你们的配合! 高中化学元素周期律知识点规律大全 1.原子结构 [核电荷数、核内质子数及核外电子数的关系] 核电荷数=核内质子数=原子核外电子数 注意:(1) 阴离子:核外电子数=质子数+所带的电荷数 阳离子:核外电子数=质子数-所带的电荷数 (2)“核电荷数”与“电荷数”是不同的,如Cl-的核电荷数为17,电荷数为1. [质量数] 用符号A表示.将某元素原子核内的所有质子和中子的相对质量取近似整数值相加所得的整数值,叫做该原子的质量数. 说明(1)质量数(A)、质子数(Z)、中子数(N)的关系:A=Z + N. (2)符号A Z X的意义:表示元素符号为X,质量数为A,核电荷数(质子数)为Z的一个原子.例如,23 Na中,Na原子的质量数为23、质子数为11、中子数为12. 11 [原子核外电子运动的特征] (1)当电子在原子核外很小的空间内作高速运动时,没有确定的轨道,不能同时准确地测定电子在某一时刻所处的位置和运动的速度,也不能描绘出它的运动轨迹.在描述核外电子的运动时,只能指出它在原子核外空间某处出现机会的多少. (2)描述电子在原子核外空间某处出现几率多少的图像,叫做电子云.电子云图中的小黑点不表示电子数,只表示电子在核外空间出现的几率.电子云密度的大小,表明了电子在核外空间单位体积内出现几率的多少. (3)在通常状况下,氢原子的电子云呈球形对称。在离核越近的地方电子云密度越大,离核越远的地方电子云密度越小. [原子核外电子的排布规律] (1)在多电子原子里,电子是分层排布的. (2)能量最低原理:电子总是尽先排布在能量最低的电子层里,而只有当能量最低的电子层排满后,才依次进入能量较高的电子层中.因此,电子在排布时的次序为:K→L→M…… (3)各电子层容纳电子数规律:①每个电子层最多容纳2n2个电子(n=1、2……).②最外层容纳的电子数≤8个(K层为最外层时≤2个),次外层容纳的电子数≤18个,倒数第三层容纳的电子数≤32个.例如:当M层不是最外 作出图中AB杆的受力图。 A处固定铰支座 B处可动铰支座 作出图中AB、AC杆及整体的受力图。 B、C光滑面约束 A处铰链约束 DE柔性约束 作图示物系中各物体及整体的受力图。 AB杆:二力杆 E处固定端 C处铰链约束 (1)运动效应:力使物体的机械运动状态发生变化的效应。 (2)变形效应:力使物体的形状发生和尺寸改变的效应。 3、力的三要素:力的大小、方向、作用点。 4、力的表示方法: (1)力是矢量,在图示力时,常用一带箭头的线段来表示力;(注意表明力的方向和力的作用点!) (2)在书写力时,力矢量用加黑的字母或大写字母上打一横线表示,如F、G、F1等等。 5、约束的概念:对物体的运动起限制作用的装置。 6、约束力(约束反力):约束作用于被约束物体上的力。 约束力的方向总是与约束所能限制的运动方向相反。 约束力的作用点,在约束与被约束物体的接处 7、主动力:使物体产生运动或运动趋势的力。作用于被约束物体上的除约束力以外的其它力。 8、柔性约束:如绳索、链条、胶带等。 (1)约束的特点:只能限制物体原柔索伸长方向的运动。 (2)约束反力的特点:约束反力沿柔索的中心线作用,离开被约束物体。() 9、光滑接触面:物体放置在光滑的地面或搁置在光滑的槽体内。 (1)约束的特点:两物体的接触表面上的摩擦力忽略不计,视为光滑接触面约束。被约束的物体可以沿接触面滑动,但不能沿接触面的公法线方向压入接触面。 (2)约束反力的特点:光滑接触面的约束反力沿接触面的公法线,通过接触点,指向被约束物体。() 10、铰链约束:两个带有圆孔的物体,用光滑的圆柱型销钉相连接。 约束反力的特点:是方向未定的一个力;一般用一对正交的力来表示,指向假定。()11、固定铰支座 (1)约束的构造特点:把中间铰约束中的某一个构件换成支座,并与基础固定在一起,则构成了固定铰支座约束。 工程力学知识点总结 第0章 1.力学:研究物体宏观机械运动的学科。机械运动:运动效应,变形效应。 2.工程力学任务:A.分析结构的受力状态。B.研究构件的失效或破坏规律。C.分研究物体运动的几何规律D.研究力与运动的关系。 3.失效:构件在外力作用下丧失正常功能的现象称为失效。三种失效模式:强度失效、刚度失效、稳定性失效。 第1章 1.静力学:研究作用于物体上的力及其平衡的一般规律。 2.力系:是指作用于物体上的一组力。 分类:共线力系,汇交力系,平行力系,任意力系。 等效力系:如果作用在物体上的两个力系作用效果相同,则互为等效力系。 3.投影:在直角坐标系中:投影的绝对值 = 分力的大小;分力的方向与坐标轴一致时投影 为正;反之,为负。 4.分力的方位角:力与x 轴所夹的锐角α: 方向:由 Fx 、Fy 符号定。 5.刚体:是指在力的作用下,其内部任意两点之间的距离始终保持不变。(刚体是理想化模型,实际不存在) 6.力矩:度量力使物体在平面内绕一点转动的效果。 方向: 力使物体绕矩心作逆时针转动时,力矩为正;反之,为负 力矩等于0的两种情况: (1) 力等于零。(2) 力作用线过矩心。 力沿作用线移动时,力矩不会发生改变。力可以对任意点取矩。 7.力偶:由大小相等、方向相反且不共线的两个平行力组成的力系,称为力偶。(例:不能单手握方向盘,不能单手攻丝) 特点: 1.力偶不能合成为一个合力,也不能用一个力来平衡,力偶只能有力偶来平衡。 2.力偶中两个力在任一坐标轴上的投影的代数和恒为零。 3.力偶对其作用面内任一点的矩恒等于力偶矩。即:力偶对物体转动效应与矩心无关。 三要素:大小,转向,作用面。 力偶的等效:同平面内的两个力偶,如果力偶矩相等,则两力偶彼此等效。 推论1:力偶可以在作用面内任意转动和移动,而不影响它对刚体的作用。(只能在作用面内而不能脱离。) 推论2:只要保持力偶矩的大小和转向不变的条件下,可以同时改变力偶中力 和力偶臂的大小,而不改变对刚体的作用。 8.静力学四大公理 A.力的平行四边形规则(矢量合成法则):适用范围:物体。 B.二力平衡公理:适用范围:刚体 (对刚体充分必要,对变形体不充分。) 注:二力构件受力方向:沿两受力点连线。 C.加减平衡力系公理:适用范围:刚体 D.作用和反作用公理:适用范围:物体 特点:同时存在,大小相等,方向相反。 注:作用力与反作用力分别作用在两个物体上,因此,不能相互平衡。(即:作用力反作用力不是平衡力) ()O M F Fd =± 元素周期律和元素周期表易错知识点 【判断正误】 1、具有相同质子数的粒子都属于同种元素 2、符合8电子结构的分子都具有稳定的结构,不符合8电子结构的分子都不稳定 3、元素周期表中,含元素种类最多的周期是第6周期,含元素种类最多的族是ⅠA 4、第三周期元素的原子半径都比第二周期元素的原子半径要大 5、在Na2O和Na2O2组成的混合物中,阴离子与阳离子的个数比在1:1至1:2之间 6.原子量是原子质量的简称 7.由同种元素形成的简单离子,阳离子半径<原子半径、阴离子半径>原子半径 8.核外电子层结构相同的离子,核电荷数越大半径越大 9.在HF、PCl3、CO2、SF6等分子中,所有原子都满足最外层8e-结构 10.核电荷总数相同、核外电子总数也相同的两种粒子可以是: (1)原子和原子;(2)原子和分子;(3)分子和分子;(4)原子和离子;(5)分子和离子;(6)阴离子和阳离子;(7)阳离子和阳离子 11.元素周期表中,每一周期所具有的元素种数满足2n2(n是自然数) 12.位于同一周期的两元素的原子形成的离子所带负电荷越多,非金属性越强 13.非金属最低价的阴离子,只能失电子而不能再得电子,所以同族非金属最低价阴离子越向下,还原性越强 14.同一主族从上到下元素的非金属性逐渐减弱,所以HF.HCl.HBr.HI的酸性逐渐减弱15.Ⅰ A族的氢和钾,它们可以形成离子化合物KH,其中有K+离子和H-离子。 16.所有微粒均由质子、中子、电子构成17.同种元素的不同核素化学性质基本相同,物理性质不同。 18.同一周期主族元素原子最外层电子排布都是1→8个电子 19.所有主族元素的最高正价都等于该元素所在的主族序数 20.IA族元素都是碱金属; 21.原子及其离子的核外电子层数都等于该元素所在的周期数 22.ⅠA族元素的金属性比ⅡA族元素的金属性强 23.气态氢化物与其最高价氧化物对应水化物酸碱性相反,相互反应生成离子化合物的元素是N(对) 24.通过5R-+RO3-+6H+=3R2+3H2O,可以判断R元素位于第ⅤA族。 25.元素周期表第18列是0族,第8.9.10列为第ⅧB族 26.HClO的结构式为H-Cl-O 27.原子核外各层电子数相等的元素一定是非金属元素 28.-和b Y m+两种简单离子(a,b均小于18),已知a X n-比b Y m+多两个电子层,则X一定是含3个电子层的元素 29.m个质子,n个中子,该元素的相对原子质量为m+n 30元素X,Y的原子序数相差2,则X与Y可能形成共价化合物XY 31非金属元素含氧酸的酸性从左到右依次增强 化学键易错知识点 【判断正误】 1.熔融状态下能导电的化合物一定是离子化合物;溶解在水中不能电离的化合物通常是共价化合物,但溶解在水中能电离的化合物可能是共价化合物也可能是离子化合物 2.离子化合物中一定含有离子键,有离子键的化合物不一定是离子化合物; 3.共价化合物中一定含有共价键,含有共价键的化合物不一定是共价化合物; 4.共价键和离子键都只有存在于化合物中 5.熔融状态下能导电的化合物一定为离子化合物 6.离子键只能由金属原子与非金属原子之间形成 6.共价键只能由非金属元素的原子之间形成 7.活泼金属元素和活泼非金属元素之间一定形成离子键 8.任何分子内一定存在化学键 9.有的分子,例如稀有气体是单原子分子构成的,分子中没有化学键 工程力学基础知识 第1篇 静力学 1、平面汇交力系平衡的充要条件是该力系的合力等于零。即: ∑∑==0,0y x F F 2、平面汇交力系简化的依据是平行四边形法则。 3、平面汇交力系可列2个独立方程,求解2个未知量。 4、在平面问题中力对点之矩不仅与力的大小有关而且与矩心位置有关。(方向:绕矩心逆正顺负) 5、合力矩定理:平面汇交力系的合力对于平面内任一点之矩等于所有分力对于该点之矩的代数和。 6、力和力偶是静力学的两个基本要素。 7、平面力偶系的合成结果是一个力偶,汇交力系的合成结果是一个力。(注:力只能与力平衡;力偶只能与力偶平衡) 8、平面力偶系平衡的充要条件是:力偶系中各力偶矩的代数和为零。即 :∑=0i M 9、平面任意力系简化的依据是力线平移定理。 10、力线平移定理揭示了力与力偶的关系。 11、平面任意力系可列3个独立方程,求解3个未知量。 第2篇 材料力学 1、杆件的四种基本变形:轴向拉伸或压缩、剪切、扭转、弯曲 2、为使杆件能正常工作应满足(三个考虑因素):强度要求、刚度要求、稳定性要求。 3、材料力学对变形固体所做的四个基本假设:连续性假设、均匀性假设、各向同性假设、小变形假设。 4、求内力的方法为截面法。 轴向拉压部分 5、轴向拉压的受力特点:外力合力的作用线与杆的轴线重合。 轴向拉压的变形特点:杆件产生沿轴线方向的拉伸或压缩。 6、轴向拉压杆横截面上的内力为轴力(符号N F ),该力产生正应 力σ,公式为:A F N =σ,其中A 为横截面面积。 7、圣维南原理:应力分布只在力系作用区域附近有明显差别,在离开力系作用区域较远处,应力分布几乎均匀。 8、低碳钢拉伸的四个阶段:弹性阶段、屈服阶段、强化阶段、局部变形(颈缩)阶段。 9、衡量材料塑性的指标:伸长率和断面收缩率。 10、拉压杆强度计算的三类问题: (1)校核: []σσ≤??? ??=max max A F N (2)设计截面尺寸:A F A N ≥ (3)确定许可荷载:[]A F ?≤σ 11、拉压杆变形:EA Fl l =? 扭转部分 12、扭转时外力偶矩的计算公式:n P M k e 9549 =,其中k P 单位为kw ,n 单位为min r 。 13、扭矩正负号判断:右手定则(具体见教材145页)。 工程力学复习资料 一、填空题(每空1分,共16分) 1.物体的平衡是指物体相对于地面__________或作________运动的状态。 2.平面汇交力系平衡的必要与充分条件是:_____。该力系中各力构成的力多边形____。 3.一物块重600N,放在不光滑的平面上,摩擦系数f=0.3, 在左侧有一推力150N,物块有向右滑动的趋势。 F max=__________,所以此物块处于静止状态,而其 F=__________。 4.刚体在作平动过程中,其上各点的__________相同,每一 瞬时,各点具有__________的速度和加速度。 5.AB杆质量为m,长为L,曲柄O1A、O2B质量不计,且 O1A=O2B=R,O1O2=L,当φ=60°时,O1A杆绕O1轴转 动,角速度ω为常量,则该瞬时AB杆应加的惯性力大 小为__________,方向为__________ 。 6.使材料丧失正常工作能力的应力称为极限应力。工程上一 般把__________作为塑性材料的极限应力;对于脆性材 料,则把________作为极限应力。 7.__________面称为主平面。主平面上的正应力称为______________。 8.当圆环匀速转动时,环内的动应力只与材料的密度ρ和_____________有关,而与 __________无关。 二、单项选择题(在每小题的四个备选答案中,选出一个正确答案,并将正确答案的序号填在 题干的括号内。每小题3分,共18分) 1.某简支梁AB受载荷如图所示,现分别用R A、R B表示支座A、B处的约束反力,则它们的 关系为( )。 A.R A ”核外电子(Z 个) 1.微粒间数目关系 最外层电子数决定元素的化学性质 质子数(Z )=核电荷数=原子数序 原子序数:按质子数由小大到的顺序给元素排序,所得序号为元素的原子序数。 质量数(A )=质子数(Z )+中子数 4.电子总数为最外层电子数 2倍:4Be 。 4.1~20号元素组成的微粒的结构特点 元素周期律 决定原子种类 ,中子N (不带电荷), ________________________ f 原子核- 质量数(A=N+Z I 质子Z (带正电荷)丿T 核电荷数 ____________ 豪同位素 (核素) —近似相对原子质量 事元素 T 元素符号 原子结构 : (A x ) 「最外层电子数决定主族元素的■■ f 电子数(Z 个):丿 1 --- 〔化学性质及最高正价和族序数 -■ 体积小,运动速率高(近光速),无固定轨道 核外电子J 运动特征 J L 电子云(比喻)——> 小黑点的意义、小黑点密度的意义。 排布规律 T 电子层数兰J 周期序数及原子半径 ■表示方法 T 原子(离子)的电子式、原子结构示意图 决定原子呈电中性 原子(AZ X) _______ 2质子(Z 个)]——决定元素种类 原子 核卜 中子 (A-Z )个 决定同位素种类 中性原子:质子数 =核外电子数 离子:质子数 =核外电子数+ 所带电荷数 离子:质子数 =核外电子数一 所带电荷数 2. 原子表达式及其含义 X d ± 表示X 原子的质量数;Z 表示元素 X 的质子数;d 表示微粒中X 原子的个数;c ±表示微粒所带的电荷 数;±)表示微粒中X 元素的化合价。 3.原子结构的特殊性 (1~18号元素) 1. 原子核中没有中子的原子: 2 ?最外层电子数与次外层电子数的倍数关系。①最外层电子数与次外层电子数相等: 4Be 、i8Ar ; ②最外层 电子数是次外层电子数 2倍:6C ;③最外层电子数是次外层电子数 3倍:80;④最外层电子数是次外层电子数 10Ne ;⑤最外层电子数是次外层电子数 1/2倍:3Li 、14Si 。 3 ?电子层数与最外层电子数相等: i H 、 4Be 、 13Al 。 5 .次外层电子数为最外层电子数 2 倍:3Li 、 i4Si 6 .内层电子总数是最外层电子数 2 倍:3Li 、 15P 。 (1).常见的等电子体 ①2个电子的微粒。分子: He 、 H 2;离子:Li +、H -、Be 2+。 一、填空题 1.力是物体间相互的相互机械作用,这种作用能使物体的运动状态和形状发生改变。 2.力的基本计量单位是牛顿(N )或千牛顿()。 3.力对物体的作用效果取决于力的大小、方向和作用点(作用线)三要素。 4.若力F r 对某刚体的作用效果与一个力系对该刚体的作用效果相同,则称F r 为该力系的合力,力系中的每个力都是F r 的分力。 5.平衡力系是合力(主矢和主矩)为零的力系,物体在平衡力系作用下,总是保持静止或作匀速直线运动。 6.力是既有大小,又有方向的矢量,常用带有箭头的线段画出。 7.刚体是理想化的力学模型,指受力后大小和形状始终保持不变的物体。 8.若刚体受二力作用而平衡,此二力必然大小相等、方向相反、作用线重合。 9.作用力和反作用力是两物体间的相互作用,它们必然大小相等、方向相反、作用线重合,分别作用在两个不同的物体上。 10.约束力的方向总是与该约束所能限制运动的方向相反。 11.受力物体上的外力一般可分为主动力和约束力两大类。 12.柔性约束限制物体绳索伸长方向的运动,而背离被约束物体,恒为拉力。 13.光滑接触面对物体的约束力,通过接触点,沿接触面公法线方向,指向被约束 的物体,恒为压力。 14.活动铰链支座的约束力垂直于支座支承面,且通过铰链中心,其指向待定。 15.将单独表示物体简单轮廓并在其上画有全部外力的图形称为物体的受力图。在受力图上只画受力,不画施力;在画多个物体组成的系统受力图时,只画外力,不画内力。 16.合力在某坐标轴上的投影,等于其各分力在 同一轴 上投影的 代数 和,这就是合力投影定理。若有一平面汇交力系已求得x F ∑和y F ∑,则合力大小R F 。 17.画力多边形时,各分力矢量 首尾 相接,而合力矢量是从第一个分力矢量的 起点 指向最后一个分力矢量的 终点 。 18.如果平面汇交力系的合力为零,则物体在该力系作用下一定处于 平衡 状态。 19.平面汇交力系平衡时,力系中所有各力在两垂直坐标轴上投影的代数和分别等于零。 20.平面力系包括平面汇交力系、平面平行力系、平面任意力系和平面力偶系等类型。 21.力矩是力使物体绕定点转动效应的度量,它等于力的大小与力臂的乘积,其常用单位为N m ?或kN m ?。 22.力矩使物体绕定点转动的效果取决于力的大小和力臂长度两个方面。 23.力矩等于零的条件是力的大小为零或者力臂为零(即力的作用线通过矩心)。 24.力偶不能合成为一个力,力偶向任何坐标轴投影的结果均为零。 25.力偶对其作用内任一点的矩恒等于力偶矩与矩心位置无关。 26.同平面内几个力偶可以合成为一个合力偶,合力偶矩等于各分力偶矩的代数和。 27.力偶是由大小相等、方向相反、作用线不重合的两个平行力组成的特殊力系,它只对物体产生 转动 效果,不产生 移动 效果。 28.力偶没有 合力,也不能用一个力来平衡,力偶矩是转动效应的唯一度量; 29.力偶对物体的作用效应取决于力偶矩的大小、力偶的转向和作用面三个要素。 30.平面任意力系向作用面内任一点简化的结果是一个力和一个力偶。这个力称为原力系的主矢,它作用在简化中心,且等于原力系中各力的矢量和;这个力偶称为原力系对简化中心的主矩,它等于原力系中各力对简化中心的力矩的代数和。 31.平面任意力系的平衡条件是:力系的主矢和力系对任何一点的主矩分别等于零;应用平面任意力系的平衡方程,选择一个研究对象最多可以求解三个未知量。 高中化学必修2知识点归纳总结 第一章 物质结构 元素周期律 第二节 元素周期律 知识点一 原子核外电子的排布 一、电子层 1. 概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的 壳层,也称作电子层。 2. 表示方法:通常吧能量最低、离核最近的电子层叫做第一层。能量稍高、离核稍远的电子层叫做第二层, 由里往外以此类推。 二、原子核外电子的排布规律(一低三不超) 1. 能量最低原理:原子核外电子总是尽可能优先排布在能量低的电子层里,然后由里向外,一次排布在能量 逐步升高的电子层里,即电子最先排满K 层,当K 层排满后再排布在L 层,依此类推。 2. 原子核外各电子层最多容纳2n 2个电子(n 为电子层序数) 3. 原子核外最外层电子不超过8个(K 层作为最外层时,不超过2个)次外层电子不超过18个,倒数第三层 电子不超过32个。 三、原子核外各电子层的电子排布 原子核外电子的排步 层序数 1 2 3 4 5 6 7 电子层符号 K L M N O P Q 离核远近 由近到远 能量 由低到高 各层最多容纳的电子数 2×12=2 2×22=8 2×32=18 2×42=32 2×52=50 2×62=72 2×72=98 四、核外电子排布的表示方法——原子结构示意图 1.原子结构示意图: 粒子符号 2.离子结构示意图:原子通过得失电子形成离子,因此,原子结构示意图的迁移应用于表示离子的结构。 Cl- 五、元素周期表中1-20号元素原子的结构特征 1.最外层电子数和次外层电子数相等的原子有Be 、Ar 。 2. 最外层电子数和次外层电子数2倍的原子是C 。 3. 最外层电子数和次外层电子数3倍的原子是O 。 4. 最外层电子数和次外层电子数4倍的原子是Ne 。 5.次外层电子数是最外层电子数2倍的原子有Li 、Si 。 6.内层电子总数是最外层电子数2倍的原子有Li 、P 。 7.电子层数和最外层电子数相等的原子有H 、Be 、Al 。 8.电子层数是最外层电子数2倍的原子是Li 、Ca 。 9.最外层电子数是电子层数2倍的原子有He 、C 、S 。 10.最外层电子数是电子层数3倍的原子是O 。 原子核 核电荷数 电子层 电子层上的 电子数 Na 《工程力学》综合复习资料 1.已知:梁AB 与BC ,在B 处用铰链连接,A 端为固定端,C 端为可动铰链支座。 试画: 梁的分离体受力图。 2.已知:结构如图所示,受力P 。DE 为二力杆,B 为固定铰链支座,A 为可动铰链支座,C 为中间铰链连接。 试分别画出ADC 杆和BEC 杆的受力图。 3.试画出左端外伸梁的剪力图和弯矩图。(反力已求出) D E C B A P 4.已知:悬臂梁受力如图所示,横截面为矩形,高、宽关系为h=2b ,材料的许用应力〔σ〕=160MPa 。 试求:横截面的宽度b=? 5.已知:静不定结构如图所示。直杆AB 为刚性,A 处为固定铰链支座,C 、 D 处悬挂于拉杆①和②上,两杆抗拉刚度均为EA ,拉杆①长为L ,拉杆②倾斜角为α,B 处受力为P 。 试求:拉杆①和②的轴力N1 , N2 。 提示:必须先画出变形图、受力图,再写出几何条件、物理方程、补充方程和静力方程。可以不求出最后结果。 q M e =qa 2 =(11/6)qa 6.已知:一次静不定梁AB ,EI 、L 为已知,受均布力q 作用。 试求:支反座B 的反力。 提示:先画出相当系统和变形图,再写出几何条件和物理条件。 7.已知:①、②、③杆的抗拉刚度均为EA ,长L ,相距为a ,A 处受力P 。 试求:各杆轴力。 提示:此为静不定结构,先画出变形协调关系示意图及受力图,再写出几何条件、物理条件、补充方程,静立方程。 A L B q 8.已知:传动轴如图所示,C轮外力矩M c=1.2 kN m ,E轮上的紧边皮带拉力为T1,松边拉力为T2,已知 T1=2 T2,E轮直径D=40 cm ,轴的直径d=8cm,许用应力[σ]=120 Mpa 。 求:试用第三强度理论校核该轴的强度。 9.已知:梁ABC受均布力q作用,钢质压杆BD为圆截面,直径d=4 0 mm, BD杆长 L=800 mm , 两端铰链连接,稳定安全系数nst=3 , 临界应力的欧拉公式为 σcr=π2 E / λ2 ,经验公式为σcr= 304–1.12 λ, E = 2 0 0 GPa , σp=2 0 0 MPa ,σs=2 3 5 MPa 。 刚体 力的三要素:大小、方向、作用点 静力学公理:1力的平行四边形法则2二力平衡条件3加减平衡力系原理(1)力的可传性原理(2)三力平衡汇交定理4作用与反作用定律 约束:柔索约束;光滑面约束;光滑圆柱(圆柱、固定铰链、向心轴承、辊轴支座);链杆约束(二力杆) 平面汇交力系平衡的必要和充分条件是:力系的合力等于零。 平面汇交力系平衡几何条件:力多边形自行封闭 合力投影定理合力在任一轴上的投影,等于各分力在同一轴上投影的代数和。它表明了合力与分力在同一坐标轴投影时投影量之间的关系。 平面汇交力系平衡条件:∑F ix =0;∑F iy =0。2个独立平衡方程 第三章 力矩 平面力偶系 力矩M 0(F)=±Fh(逆时针为正) 合力矩定理:平面汇交力系的合力对平面上任一点力矩,等于力系中各分力对与同一点力矩的代数和。 Mo(F )=Mo(F1)+Mo(F 2)+...+Mo(F n)=∑Mo(F ) 力偶;由大小相等,方向相反,而作用线不重合的两个平行力组成的力系称为力偶 力偶矩M =±Fd(逆时针为正) 力偶的性质:性质1 力偶既无合力,也不能和一个力平衡,力偶只能用力偶来平衡。性质2 力偶对其作用面内任一点之矩恒为常数,且等于力偶矩,与矩心的位置无关。性质3 力偶可在其作用面内任意转移,而不改变它对刚体的作用效果。性质4 只要保持力偶矩的大小和转向不变,可以同时改变力偶中力的大小和力偶臂的长短, 而不改变其对刚体的作用效果。 平面力偶系平衡条件是合力偶矩等于零。 第四章 平面任意力系 力的平移定理:将力从物体上的一个作用点,移动到另外一点上,额外加上一个力偶矩,其大小等于这个力乘以2点距离,方向为移动后的力与移动前力的反向力形成的力偶的反方向 平面力向力系一点简化可得到一个作用在简化中心的主矢量和一个作用于原平面内的主矩,主矢量等于原力系中各力的矢量和,而主矩等于原力系中各力对点之矩的代数和。 平面任意力系平衡条件:∑F ix =0;∑F iy =0,∑M 0(Fi)=0。3个独立方程 平面平行力系平衡条件:∑F iy =0,∑M 0(Fi)=02个独立方程 摩擦,阻止两物体接触表面发生切向相互滑动或滚动的现象。静摩擦力,若两相互接触且相互挤压,而又相对静止的物体,在外力作用下如只具有相对滑动趋势,而又未发生相对滑动,则它们接触面之间出现的阻碍发生相对滑动的力,谓之“静摩擦力”。动摩擦力,两物体相对运动时的摩擦力。 重心是在重力场中,物体处于任何方位时所有各组成质点的重力的合力都通过的那一点。 第五章 空间力系 P53 空间力系平衡条件:6个方程。空间平行力系:3个方程 影响构件持久极限的主要因素:构件尺寸外形和表面质量。 质点的运动:点的速度dt ds v = ,加速度:切向加速度dt dv a = τ,速度大小变化;法向加速度ρ 2 v a n = , 速度方向变化,加速度2 2n a a a +=τ 刚体的基本运动角速度dt d ?ω= ,角加速度dt d ωα= ,角速度n πω2=(n 是转速,r/s) 转动刚体内各点的速度ωR v =,加速度2ωατR a R a n ==, 质心运动定理:e F ma ∑= 转动定理z z M J ∑=α,转动惯量:圆环2mR J z =;圆盘2/2 mR J z =: 元素周期律和元素周期表 作者:陆秀臣文章来源:本站原创点击数:2278 更新时间:2007-3-23 “新世纪”(鲁科版)必修2 第二节元素周期律和元素周期表 一.教材分析 (一)知识脉络 本节教材采用归纳总结的方法引导学生探索元素的性质(元素原子最外层电子排布、原子半径以及主要化合价、原子得失电子能力)和原子结构的关系从而归纳出元素周期律,揭示元素周期律的实质;再在元素周期律的基础上引导他们发现周期表中元素排布的规律,认识元素周期表的结构,了解同周期、同主族元素原子结构的特点,为下一节学习同周期元素性质的递变规律,预测同主族元素的性质奠定基础;同时,以铁元素为例,展示了元素周期表中能提供的有关元素的信息和金属与非金属的分区;最后以IIA族、VA族、过渡元素为例分析了同族元素结构与性质的异同。 (二)知识框架 (三)新教材的主要特点: 新教材通过对元素周期律的初探,利用图表(直方图、折线图)等方法分析、处理数据,增强了教材的启发性和探究性,注重学生的能力培养,如作图、处理数据能力、总结概括的能力,以及利用数据得出结论的意识。 二.教学目标 (一)知识与技能目标 1.使学生了解元素原子核外电子排布、原子半径、主要化合价的周期性变化,认识元素周期律。 2.让学生认识元素周期表的结构以及周期和族的概念,理解原子结构与元素在周期表中的位置间的关系。 3.让学生了解IIA族、VA族和过渡金属元素的某些性质和用途。 (二)过程与方法目标 1.通过对元素周期律的探究,培养学生利用各种图表(直方图、折线图)分析、处理数据的能力。 2.通过对获取的大量事实和数据等信息进行加工、分析,培养学生学归纳、概括能力、口头表达能力和交流能力。 3.通过案例的探究,激发学生主动学习的意识。并且掌握从大量的事实和数据中分析总结规律、透过现象看本质等科学抽象的方法。 (三)情感态度与价值观目标 1.学习元素周期律,能使学生初步树立“由量变到质变”、“客观事物都是相互联系和具有内部规律”“内因是事物变化的依据”等辩证唯物主义观点。 2.学习化学史知识,能使学生认识到:人类对客观存在的事物的认识是随着社会和科学的发展不断发展的;任何科学的发现都需要长期不懈地努力,才能获得成功。 三、教学重点、难点 (一)知识上重点、难点 元素周期律和元素周期表的结构。 (二)方法上重点、难点 学会用图表等方法分析、处理数据,对数据和事实进行总结、概括从而得出结论。四、教学准备 物质结构 元素周期律 中子N (不带电荷) 同位素 (核素) 原子核 → 质量数(A=N+Z ) 近似相对原子质量 质子Z (带正电荷) → 核电荷数 元素 → 元素符号 原子结构 : 最外层电子数决定主族元素的 决定原子呈电中性 电子数(Z 个): 化学性质及最高正价和族序数 体积小,运动速率高(近光速),无固定轨道 核外电子 运动特征 电子云(比喻) 小黑点的意义、小黑点密度的意义。 排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图 随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化: ① 、 原子最外层电子数呈周期性变化 元素周期律 ②、原子半径呈周期性变化 ③、元素主要化合价呈周期性变化 ④、元素的金属性与非金属性呈周期性变化 ①、按原子序数递增的顺序从左到右排列; 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。 ①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) ①、主族(ⅠA ~ⅦA 共7个) 元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体) 同周期同主族元素性质的递变规律 ①、核电荷数,电子层结构,最外层电子数 ②、原子半径 性质递变 ③、主要化合价 ④、金属性与非金属性 ⑤、气态氢化物的稳定性 ⑥、最高价氧化物的水化物酸碱性 电子层数: 相同条件下,电子层越多,半径越大。 判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。 最外层电子数 相同条件下,最外层电子数越多,半径越大。 微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl. 2、同主族元素的原子半径随核电荷数的增大而增大。如:Li 《工程力学(一)》串讲讲义 (主讲:王建省工程力学教授,Copyright 2010-2012 Prof. Wang Jianxing) 课程介绍 一、课程的设置、性质及特点 《工程力学(一)》课程,是全国高等教育自学考试机械等专业必考的一门专业课,要求掌握各种基本概念、基本理论、基本方法,包括主要的各种公式。在考试中出现的考题不难,但基本概念涉及比较广泛,学员在学习的过程中要熟练掌握各章的基本概念、公式、例题。 本课程的性质及特点: 1.一门专业基础课,且部分专科、本科专业都共同学习本课程; 2.工程力学(一)课程依据《理论力学》、《材料力学》基本内容而编写,全面介绍静力学、运动学、动力学以及材料力学。按重要性以及出题分值分布,这几部分的重要性排序依次是:材料力学、静力学、运动学、动力学。 二、教材的选用 工程力学(一)课程所选用教材是全国高等教育自学考试指定教材(机械类专业),该书由蔡怀崇、张克猛主编,机械工业出版社出版(2008年版)。 三、章节体系 依据《理论力学》、《材料力学》基本体系进行,依次是 第1篇理论力学 第1章静力学的基本概念和公理受力图 第2章平面汇交力系 第3章力矩平面力偶系 第4章平面任意力系 第5章空间力系重心 第6章点的运动 第7章刚体基本运动 第8章质点动力学基础 第9章刚体动力学基础 第10章动能定理 第2篇材料力学 第11章材料力学的基本概念 第12章轴向拉伸与压缩 第13章剪切 第14章扭转 第15章弯曲内力 第16章弯曲应力 第17章弯曲变形 第18章组合变形 第19章压杆的稳定性 第20章动载荷 第21章交变应力 考情分析 一、历年真题的分布情况 结论:在全面学习教材的基础上,掌握重点章节内容,基本概念和基本计算,根据各个章节的分数总值, 请自行给出排序结果。 二、真题结构分析 全国2010年1月自学考试工程力学(一)试题 课程代码:02159 一、单项选择题(本大题共10小题,每小题2分,共20分) 在每小题列出的四个备选项中只有一个是符合题目要求的,请将其代码填写在题后的括号内。错选、多选或未选均无分。 工程力学 第一章 在该刚体内前后任意移动, 而不改 变它对该刚体的作用。 I 白比味 在空间的位移不受任何限 H 曰*的制的物体称为自由体。 2. 非自由体:位移受到限制的物体称为非自由体。 3?约束 由周围物体所构成的、限制非自由体位移的釦生 、、亠" 注意: 物体向约束所限制的方向有运动趋势时,就会有约束力? 另外,有约束,不一定有约束力 4:讨论约束主要是分析,有哪些约束力?约束力的方向是?最终要确定约 束力的大小和方向。 5:柔性约束,约束力的数目为 1方向离开约束物体。光滑接触面约束,约 束数目1。 注意:□接触面为两个面时,约束力为分布的同向平行力系, 可用其合理表示。②若一物体以尖点与另一个物体接触,可将尖点是为小圆 弧。再者,一般考虑物体的自重,忽略杆的自重,除非题目要求考虑。 光滑圆柱铰链约束:01固定铰支座(直杆是被约束物体),约束力数目为2; 推论 (力在刚体上的可传性) 作用于刚体的力, 其作用点可以沿作用线 或对非自曲体的某些位移起限制作用 Q中间铰约束按合力讨论,有一个约束力,方向未知:安分力讨论,有 两个约束力,方向可以假设(正交) 注意:销钉和杆直接接触传递力,杆 和杆之间不直接传递力。O3可动铰支座仅限制物体在垂直与接触面方向的移动。约束力数目为1 向心推力轴承,约束力数目为2;止推轴承有三个约束力 强调:无约束的方向一定没有约束力! 平面约束: (1)柔性约束:有一个约束力,离开物体; (2)光滑接触面(线、点)约束: 有一个约束力,指向物体; (3)光滑BI柱较链约束 扎固定餃支座约束:有两个正交约束力, 方向可以假设; B.中间较约束:有两个正交约束力,方向可以假设; G可动较支座或辗轴约束: 有一个约束力,方向可以假设; 空间约束: (1)空间球较约束:有三个正交约束力, 方向可以假设; (2)向心轴承约束:有两个正交约束力, 方向可以假设; (3)向心推力轴承约束:有三个正交约束力, 方向可以假设; 第二章 矢量表达式:R = F i+F2+F. + F4= ^Y i i-↑结论:力在某轴上的投影,等于力的模乘以力与该轴正向间夹角 元素周期表与元素周期律知识点归纳 1、元素周期表共有横行,个周期。其中短周期为、、。所含元素种类为、、。长周期包括、、。所含元素种类为、、。第七周期为不完全周期,如果排满的话有种元素。 2元素周期表有个纵行个族。包括个主族,个副族,一个族,一个第Ⅷ族(包括个纵行)按从左到右的顺序把16个族排列 。过度元素共包括个纵行(第纵行到第纵行)。包括哪些族。过渡元素全为元素。又称为。 3、写出七个主族和0族元素的名称和元素符号 ⅠA族 ⅡA族 ⅢA族 ⅣA族 ⅤA族 ⅥA族 ⅦA族 0族 4.同一周期第ⅡA族和第ⅢA族原子序数之间的关系 若元素位于第二、三周期,第ⅡA族的原子序数为a,则第ⅢA族的原子序数为 若元素位于第四、五周期,第ⅡA族的原子序数为a,则第ⅢA族的原子序数为 若元素位于第六周期,第ⅡA族的原子序数为a,则第ⅢA族的原子序数为 5、同一主族上下相邻两个周期原子序数之间的关系 若A在B的上一周期,设A的原子序数为a ⑴若A、B位于第ⅠA族或ⅡA族(过度元素的左边)则B的原子序数为。 ⑵若A、B位于第ⅢA族——ⅦA族(过度元素的右边)则B的原子序数为。 。 6、微粒半径大小判断的方法 。 。 。7 与He原子电子层结构相同的简单离子。 与Ne原子电子层结构相同的简单离子。 与Ar原子电子层结构相同的简单离子。 阳离子与周期稀有气体原子的电子层结构相同。阴离子与周期稀有气体原子的电子层结构相同。 8、阴上阳下规律 9原子得电子能力强弱判断的方法 ⑴、原子得电子能力越强——单质的氧化性——元素的非金属性——阴离子的还原性——单质与氢气化和的能力——生成的气态氢化物越——最高价氧化物对应水化物的酸性。 ⑵、另外可以通过单质间的置换反应判断得电子能力的强弱 如Cl2+Na2S=2NaCl+S得电子能力Cl S 10、原子失电子能力强弱判断的方法 ⑴、原子失电子能力越强——单质的还原性——元素的金属性——阳离子的氧化性——单质与水或酸反应置换出氢的能力——最高价氧化物对应水化物的碱性。 ⑵、另外可以通过单质间的置换反应判断失电子能力的强弱 如Fe+CuSO4=FeSO4+Cu失电子能力Fe Cu 11、同一主族元素及其化合物性质的递变性: 同主族元素的原子,最外层电子数,决定同主族元素具有的化学性质。从上到下原子的核电荷数依次,原子的电子层数依次,原了半径逐渐;原子失电子能力逐渐,元素的金属性逐渐,单质的还原性逐渐,对应阳粒子的氧化性逐渐,单质与水或酸反应置换出氢气的能力逐渐,最高价氧化物对应水化物的碱性逐渐;原子得电子能力逐渐,元素的非金属性逐渐,单质的氧化性逐渐,对应阴离子的还原逐渐,单质与氢气化合的能力逐渐,最高价氧化物对应水化物的酸性逐渐。气态氢化物的稳定性逐渐。 12、同一周期元素及其化合物性质的递变性: 在同一周期中,各元素原子的核外电子层数,但从左到右核电荷数依次,最外层电子数依次,原子半径逐渐,(稀有气体元素除外)。原子失电子能力逐渐,元素的金属性逐渐,单质的还原性逐渐,对应阳粒子的氧化性逐渐,单质与水或酸反应置换出氢气的能力逐渐,最高价氧化物对应水化物的碱性逐渐。 原子得电子能力逐渐,元素的非金属性逐渐,单质的氧化性逐渐,对应阴离子的还原逐渐,单质与氢气化合的能力逐渐,最高价氧化物对应水化物的酸性逐渐,气态氢化物的稳定性逐渐。 根据原子结构、元素周期表的知识及相关条件可推算原子序数,判断元素在周期表中的位置等。 2.周期表中数字与性质的关系 1.位、构、性的关系 高三化学一轮复习导学案 元素周期律、元素周期表【基础知识回顾】 一、元素周期表: (1)编排原则 ①按原子序数递增的顺序从到、从到编排。 ②将电子层数相同的各种元素从到排成横行(周期),共有横行 ③将最外层电子数相同的元素按电子层数递增的顺序从到排成纵行,共有纵行。 (2)元素周期表的结构 ...................... (3).相互关系 原子序数=________数=________数=核外________数。 问题思考 1.(1)最外层电子数是2的元素都是第ⅡA族吗 (2)同周期第ⅡA和第ⅢA族元素的原子序数一定相差1吗 问题思考 2.观察元素周期表,确认每一纵行各代表哪一族,如:按从左右的顺序排列,第3纵列是______族,第15纵行是____族,第9纵列是____族,ⅤB族在第____纵列,ⅢA族处于____纵列等。→右的顺序排列,第3纵列是______族,第15纵行是____族,第9纵列是____族,ⅤB族在第____纵列,ⅢA族处于____纵列等。 3.若某离子最外层电子数与次外层电子数相同,则它位于元素周期表的什么位置4.电子层结构相同的离子,它们一定位于同一周期吗 二、元素的性质与原子结构 1、碱金属元素 名称和符号锂(Li)钠(Na)钾(K)铷(Rb)铯Cs 结构原子序数311193755原子结构简 图 主要化合价+1+1+1+1+1相同点 不同点 原子半径 离子半径 金属活动性 单质还原性 阳离子氧化 性 物 性 颜色和状态___________固体(_________略有金色光泽) 化学性质跟氧气反应 2Li+O2=2LiO4Na+O2=2Na2O 2Na+O2Na2O2 生成更复杂 的氧化物 生成更复杂 的氧化物 生成更复 杂的氧化 物 跟卤素反应2M+X2=2M X(M、X2表示碱金属、卤素,以下同) 与水反应2M+2H 2O=2MOH+H2 ↑反应剧烈程度:____________ 与酸反应2M+2H+=2M++H 2 ↑高中化学元素周期律知识点规律大全
工程力学材料力学_知识点_及典型例题
工程力学知识点总结(良心出品必属精品)
(完整版)元素周期律和元素周期表易错知识点
工程力学基础知识
工程力学复习汇总重点教材
完整版元素周期律知识点总结
工程力学复习要点
第一章第二节元素周期律知识点归纳总结
工程力学
工程力学公式总结
化学必修二(鲁科版)元素周期律和元素周期表
物质结构元素周期律知识点总结
工程力学(一)知识要点
工程力学重点知识总结
元素周期表与元素周期律知识点归纳(精华版)上课讲义
元素周期律元素周期表基础知识