第 20 章 s 区元素
[ 教学要求]
1、了解碱金属和碱土金属的通性。
2、掌握碱金属和碱土金属的氢化物及氧化物的性质和用途。
3、掌握碱金属和碱土金属的氢氧化物及其盐类的性质和用途。[ 教学重点]
碱金属和碱土金属的单质及其重要化合物的性质变化规律
[ 教学难点]
碱金属和碱土金属的单质及其重要化合物的性质变化规律
[ 教学时数]
4 学时
[ 教学内容]
20-1 碱金属和碱土金属的通性
20-2 碱金属和碱土金属的单质
20-3 碱金属和碱土金属的化合物
[教学方法与媒体]
讲解,ppt展示
20-1 碱金属和碱土金属的通性
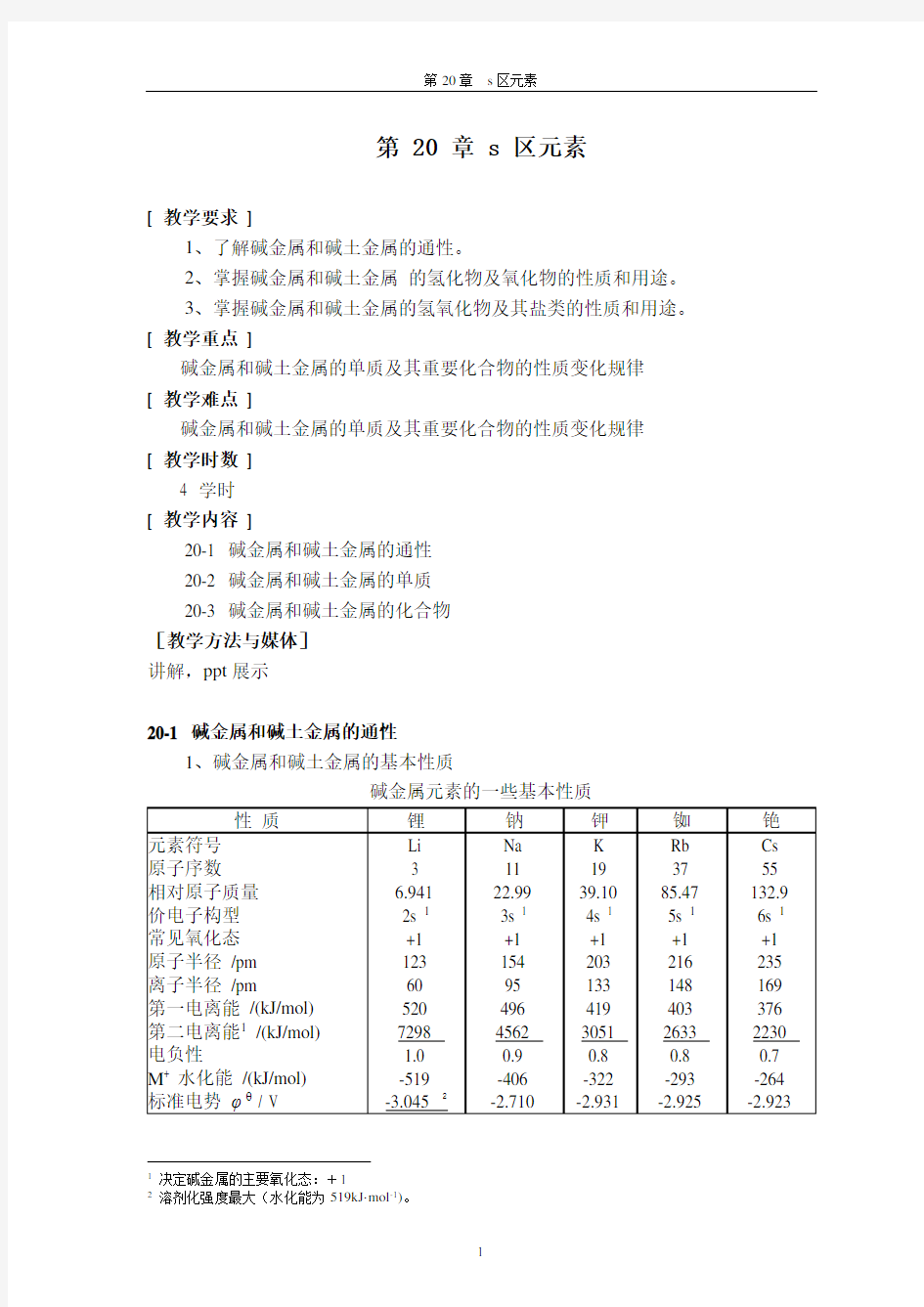
1、碱金属和碱土金属的基本性质
碱金属元素的一些基本性质
1决定碱金属的主要氧化态:+1
2溶剂化强度最大(水化能为519kJ·mol-1)。
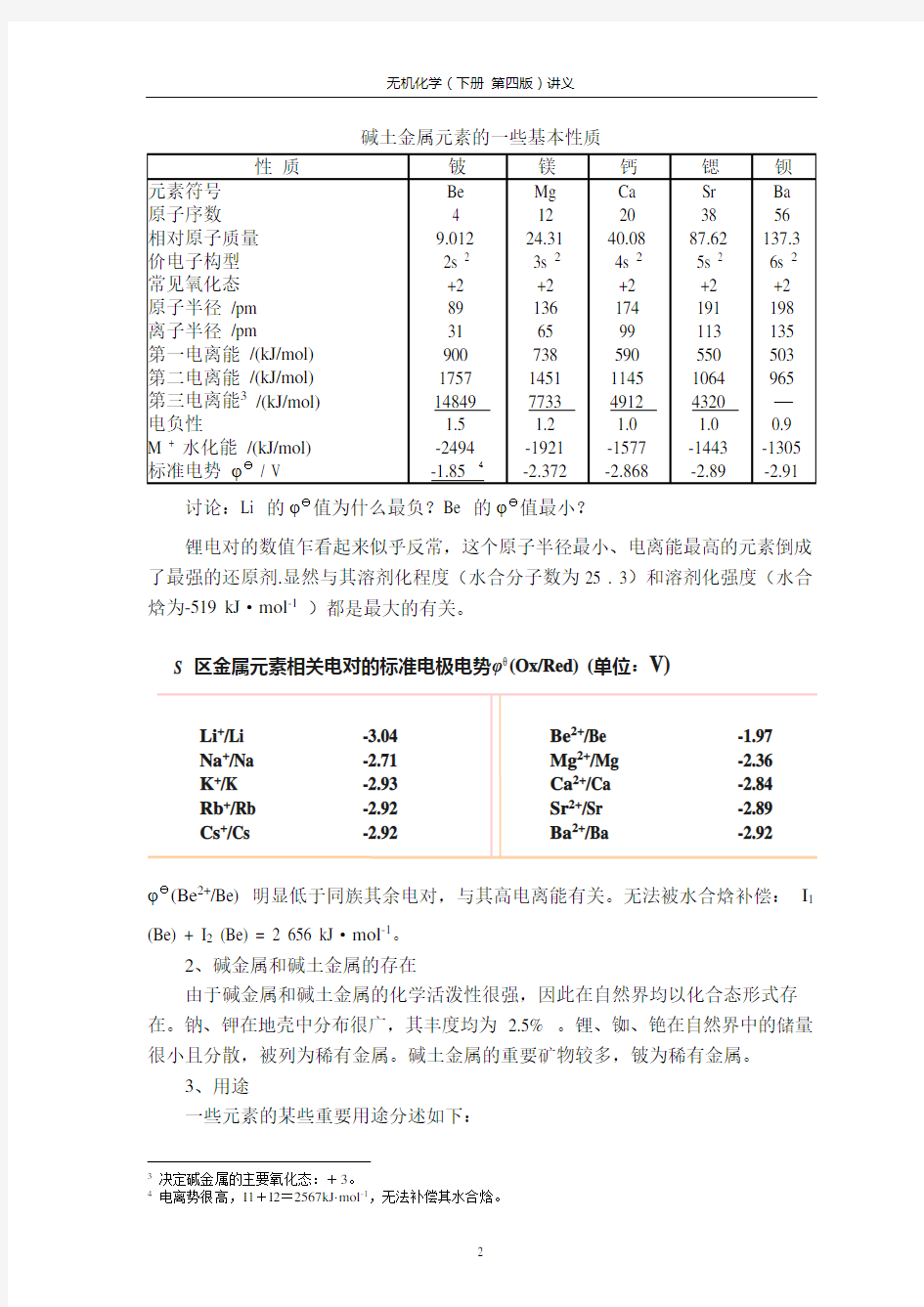
碱土金属元素的一些基本性质
讨论:Li 的φθ值为什么最负?Be 的φθ值最小?
锂电对的数值乍看起来似乎反常,这个原子半径最小、电离能最高的元素倒成了最强的还原剂.显然与其溶剂化程度(水合分子数为25 . 3)和溶剂化强度(水合焓为-519 kJ ·mol -1 )都是最大的有关。
φθ(Be 2+/Be) 明显低于同族其余电对,与其高电离能有关。无法被水合焓补偿: I 1 (Be) + I 2 (Be) = 2 656 kJ ·mol -1。
2、碱金属和碱土金属的存在
由于碱金属和碱土金属的化学活泼性很强,因此在自然界均以化合态形式存在。钠、钾在地壳中分布很广,其丰度均为 2.5% 。锂、铷、铯在自然界中的储量很小且分散,被列为稀有金属。碱土金属的重要矿物较多,铍为稀有金属。
3、用途
一些元素的某些重要用途分述如下:
3 决定碱金属的主要氧化态:+3。 4
电离势很高,I1+I2=2567kJ·mol -1,无法补偿其水合焓。
Li +/Li Na +/Na K +/K Rb +/Rb Cs +/Cs
-3.04 -2.71 -2.93 -2.92 -2.92 Be 2+/Be Mg 2+/Mg Ca 2+/Ca Sr 2+/Sr Ba 2+/Ba
-1.97 -2.36 -2.84 -2.89 -2.92
S 区金属元素相关电对的标准电极电势φ (Ox/Red) (单位:V)
⑴金属锂
①制造氢化锂、氨化锂和合成有机锂化合物,后者用做有机化学中的还原剂和催化剂;
②制造合金Al-Li(含锂3 % ),因质量轻和强度大而用于空间飞行器;
③制造高功率长效电池(用于手表、计算机、心脏起搏器等);
④同位素受中子轰击产生热核武器的主要原料氚。
⑵金属钠
①过去钠的年产量与含铅抗震剂的使用量有关;
②作为还原剂制造某些难熔的金属如铀、钍、锆等,特别是还原制
备钛:TiCl4 + 4 Na==Ti + 4 NaCl
③因具有高的导热性和低的中子吸收能力,被用做快速增殖反应堆的冷剂。
④最近被开发的新用途有制作钠电缆、钠基电池和钠硫电池等。
⑶金属钾
工业用途小,世界年产量只及钠的0.1% !主要用于制造(生氧剂)和低熔点钠钾合金(用做干燥剂和还原剂),也用做核反应堆的冷却剂。
⑷金属铯和铷
消耗量极小,由于在光照下逸出电子,因而是制造光电池的良好材料. 133Cs 厘米波的振动频率(9192631770 s-1) 在长时间内保持稳定, 因而将振动这次所需要的时间规定为SI 制的时间单位s. 利用此特性制作的铯原子钟( 测准至 1.0 ×
10-9 s ) 在空间科学的研究中用于高精度计时。1999年花费65万美元,安放在美国国家标准和技术研究所的铯原子钟2000万年内误差不超过1 s,最近由中科院研制的铯原子钟, 200万年内误差不超过1 s。
⑸金属铍
属于“轻金属”,世界铍耗量的70 % ~80 % 用来制造铍铜合金. 金属铍和铍基合金的弹性-质量比、拉伸应力和导热性都较高,因而用于各种空间飞行器.另外还用于制造氧化物陶瓷、原子能反应堆中的中子减速剂。
⑹金属镁
最轻的一种结构金属,也是用途最大的碱土金属.世界镁耗量的70 % 用来制造合金. 广泛用于航空航天事业.也用于某些金属冶炼还原剂。
20-2 碱金属和碱土金属的单质
1、物理性质
碱金属和碱土金属单质除铍为钢灰色外,其它均为银白色光泽。碱金属具有密度小、硬度小、熔点低(原子体积大、一个成键电子金属键强度较小)的特点,是典型的轻、软金属。碱金属还具有良好的导电性。碱土金属的熔点、沸点比碱金属
高,硬度(原子体积较小、2个成键电子金属键强度较大)较大,导电性低于碱金属,规律性不及碱金属强。
2、化学性质
由于碱金属和碱土金属的核外电子数较少,原子半径较大,核对价电子的吸引力较小,因此碱金属和碱土金属的化学活泼性很活泼,表现在:
⑴易与水的反应,碱金属与水反应更剧烈,产生的氢气着火燃烧。
碱金属与水氧化的反应为:
2 M(s) + 2 H2O (l) == 2 M+(aq) + 2 OH-(aq) + H2(g)
钠和钠下方的同族元素与水反应十分激烈,过程中生成的氢气能自燃。金属钠与水的反应在实验室用于干燥有机溶剂,但不能用于干燥醇!
碱土金属被水氧化的反应为:
M(s) + 2 H2O (l)==M2+(aq) + 2 OH-(aq) + H2(g)
钙、锶、钡与水的反应远不如相邻碱金属那样剧烈,镁和铍在水和空气中因生成致密的氧化物保护膜而显得十分稳定。
讨论:锂的标准电极电势比钠或钾的标准电极电势小,为什么Li 与水反应没有其它金属与水的反应激烈?
电极电势属于热力学范畴,而反应剧烈程度属于动力学范畴,两者之间并无直接的联系。
Li与水反应没有其它碱金属与水反应激烈,主要原因有:(1)锂的熔点较高,与水反应产生的热量不足以使其熔化;(2)与水反应的产物溶解度较小,一旦生成,就覆盖在金属锂的上面,阻碍反应继续进行。
⑵易氧化,生成氧化物、过氧化物、超氧化物等。
讨论1:这些氧化物的形式有什么不同?
Li2O Na2O2KO2RbO2CsO2KO3
BeO MgO CaO SrO Ba2O2
讨论2:为什么在空气中燃烧碱金属所得的产物不同?
燃烧产物可从燃烧反应的能量变化中推测。哪一个燃烧反应的?G负值最大,产物就是哪一个。例如,Na 生成Na2O、Na2O2和NaO2的?G分别是-376 kJ·mol-1, -430 kJ·mol-1和-389.2 kJ·mol-1, 因此燃烧产物就是Na2O2。
⑶与氢的反应
活泼的碱金属均能与氢在高温下直接化合,生成离子型氢化物,由于氢负离子有较大的半径(2.08),容易变形,所以它仅能存在于干态的离子型氢化物晶体中,而不能成为水溶液中的水合离子。
⑷与液氨的反应
钠能溶于液氨中生成蓝色溶液,该溶液具有导电性和顺磁性。在溶液中钠离解生成钠正离子和溶剂合电子:
Na (S) + (x+y)NH3(l) == Na(NH 3)x+ + e (NH3)y-
其中的溶剂合电子是一种很强的还原剂。有趣的是,不论溶解的是
何种金属,稀溶液都具有同一吸收波长的蓝光。这暗示各种金属的
溶液中存在着某一共同具有的物种.后来实验这个物种是氨合电子,
电子处于4~6个NH3 的“空穴”中。
⑸强还原剂
在非水体系中用作还原剂:
TiCl4+4Na==Ti+4NaCl
SiO2+2Mg==Si+2MgO
⑹铍的反常性质
Be 原子的价电子层结构为2s2 ,它的原子半径为89pm,Be 离子半径为
31pm,Be 的电负性为1.57 。铍由于原子半径和离子半径特别小(不仅小于同族的其它元素,还小于碱金属元素),电负性又相对较高(不仅高于碱金属元素,也高于同族其它各元素),所以铍形成共价键的倾向比较显著,不像同族其它元素主要形成离子型化合物。因此铍常表现出不同于同族其它元素的反常性质。
⑴铍由于表面易形成致密的保护膜而不与水作用,而同族其它金属镁、钙、锶、钡均易与水反应。
⑵氢氧化铍是两性的,而同族其它元素的氢氧化物均是中强碱或强碱性的。
⑶铍盐强烈地水解生成四面体型的离子[Be(H2O)4 ],键很强,这就削弱了O ── H 键,因此水合铍离子有失去质子的倾向:
[Be(H2O)4 ]2+── [Be(OH) (H2O)3]+ + H+
因此铍盐在纯水中是酸性的。而同族其它元素(镁除外)的盐均没有水解作用。
讨论:金属钠与水、液氨、乙醇的反应有何不同?
2 Na(s) + 2 H2O(l)===Na+ (aq) + 2 OH- (aq) + H2(g) ↑
2 Na(s) + CH3CH2OH(l)===2 CH3CH2ONa(l) + H2(g) ↑
Na(s) + (x+y) NH3 (l) ===Na+(NH3) x + e(NH3)y-
2、单质的制备
⑴、熔盐电解法
由于碱金属和碱土金属的化学活泼性很强,所以一般用电解它们熔融化合物的方法制取。
电解含58~59% (CaCl2) 的熔融NaCl:
阳极:2Cl- ===Cl2 +2e-
阴极:2 Na+ + 2 e- ===2 Na
总反应:2 NaCl(l) ===2 Na (l) + Cl2(g)
加CaCl2 的作用(助熔剂):降低熔点,减少液Na挥发;混合盐密度增大,液Na浮在熔盐表面,易于收集。
⑵、热分解法
碱金属的某些化合物加热分解能生成碱金属。
2MN3 ===2M + 3N2 (M =Na,K,Rb,Cs)
⑶、热还原法
钾、铷、铯的沸点低易挥发,在高温下用焦炭、碳化物及活泼金属做还原剂还原它们的化合物,利用它们的挥发性分离。可利用Ellingham图进行判断。
讨论:金属钾能否采用类似制钠的方法制备呢?
①金属K 与 C 电极可生成羰基化合物。
②金属K 易溶在熔盐中,难于分离。
③金属K 蒸气易从电解槽逸出,造成易燃爆环境。KO2与K会发生爆
炸。
结论:不能采用同类方法!
讨论:钾比钠活泼,为什么可以通过如下反应制备金属钾?
熔融
KCl+Na=K+NaCl
首先,钾的第一电离能(418.9 kJ·mol-1 ) 比钠的第一电离能(495.8 kJ·mol-1)小的缘故。
其次,通过计算可知固相反应的△rHm是个不大的正值,但钾的沸点(766℃)比钠的沸点(890℃)低,当反应体系的温度控制在两沸点之间,使金属钾变成气态,而金属钠和KCl 、NaCl 仍保持在液态,钾由液态变成气态, 熵值大为增加,即反应的T△rSm项变大,有利于△r Gm变成负值,反应向右进行。
第三,由于钾变成蒸气,可设法使其不断离开反应体系,让体系中其分压始终保持在较小的数值.不难预料随pK变小,△r G m向负值的方向变动,有利于反应向右进行。
第四,比较钠和钾的同类型化合物的晶格能,钠比钾高,因而钠的化合物更稳定。
20-3 碱金属和碱土金属的化合物
1、氧化物---多样性
⑴、普通氧化物
碱金属在空气中燃烧时,只有锂生成普通氧化物Li2O ,钠生成过氧化物
Na2O2,钾、铷、铯生成超氧化物MO2(M=K、Rb、Cs)。要制备除锂以外的其它碱金属的普通氧化物,必须用其它方法。
碱土金属在室温或加热时与氧化合,一般只生成普通氧化物MO 。但实际生产中常从它们的碳酸盐或硝酸盐加热分解制备。
⑵、过氧化物
过氧化物是含有过氧基(-O-O- )的化合物,除铍外,碱金属、碱土金属在一定条件下都能形成过氧化物。常见的是过氧化钠。
过氧化钠Na2O2呈强碱性,含有过氧离子,在碱性介质中过氧化钠是一种强氧化剂,常用作氧化分解矿石的熔剂。例如:
Cr2O3 + 3Na2O2 === 2Na2CrO4 + Na2O
MnO2 + Na2O2 ===Na2MnO4
Na2O2与水作用产生H2O2,H2O2立即分解放出氧气。
所以过氧化钠常用作纺织品、麦杆、羽毛等的漂白剂和氧气发生剂。
在潮湿的空气中,过氧化钠能吸收二氧化碳气并放出氧气:
2Na2O2 + 2CO2===2Na2CO3 + O2↑
因此过氧化钠广泛用于防毒面具、高空飞行和潜水艇里,吸收人们放出的二氧化碳气并供给氧气。
在酸性介质中,当遇到像高锰酸钾这样的强氧化剂时,过氧化钠就显还原性了,过氧离子被氧化成氧气单质:
5O22- + 2MnO4- + 16H+ ==2Mn2+ + 5O2↑ + 8H2O
⑶、超氧化物
超氧化钾KO2、超氧化铷RbO2和超氧化铯CsO2中都含有超氧离子,因为超氧离子中有一个未成对的电子,所以超氧化物有顺磁性并呈现出颜色。超氧化钾是橙黄色,超氧化铷是深棕色,超氧化铯是深黄色。
超氧化物都是强氧化剂,与水剧烈地反应放出氧气和过氧化氢:
2MO2+2H2O == O2↑+H2O2+2MOH (M=K、Rb、Cs)
超氧化物还能除去二氧化碳气并再生出氧气,可以用于急救器、潜水和登山等方面。
4MO2 + 2CO2 == 2M2CO3 +3O2(M=K、Rb、Cs)
⑷、臭氧化物
钾、铷、铯的氢氧化物与臭氧反应,可得臭氧化物
3KOH(S) + 2O 3(g) ==2KO 3(S) + KOH + H 2O(S) + 1/3O 2 2、氢氧化物
碱金属溶于水生成相应的氢氧化物,它们最突出的化学性质是强碱性,对纤维和皮肤有强烈的腐蚀作用,所以称它们为苛性碱。它们都是白色晶状固体,具有较低的熔点。除 LiOH 在水中的溶解度( 13g/100g 水)较小外,其余碱金属的氢氧化物都易溶于水,并放出大量的热。在空气中易吸湿潮解,所以固体 NaOH 是常用的干燥剂。它们还容易与空气中的二氧化碳作用生成碳酸盐,所以要密封保存。
碱土金属(除 BeO 和 MgO 外)溶于水生成相应的氢氧化物, Be(OH)2 为两性, Mg(OH)2 为中强碱,其它为强碱。
表1 碱金属氢氧化物的某些性质
表2 碱土金属氢氧化物的某些性质
鉴于对本区元素氢氧化物比较熟悉,这里仅介绍一些规律。 ⑴易吸水溶解;
⑵溶解度与碱性。除LiOH 外,其它碱金属氢氧化物在水中溶解度都很大。 规律:阴、阳离子半径相差较大的离子型化合物在水中溶解度较大,相近的溶解度较小,即 “相差溶解” 规律。
NaOH 和 KOH 是重要的化工基本原料,它们的水溶液和熔融物能与许多金属或非金属氧化物作用,在工业生产和科学研究上有很多重要用途。
3、氢化物(选学)
碱金属和碱土金属中的 Ca 、 Sr 、 Ba 在高温下与 H 2 反应,生成离子型的氢化物。其中以氢化钠、氢化锂为最常见。
氢化钠 NaH 是一种强还原剂,常用于有机合成中。
⑴制备:
θ
12f H (g)
1H e H (g),150kJ mol 2H -
---+→?=?2623K
2423573K 22
2Li H 2LiH
2Na H 2NaH Ca H CaH ?
-+??→+???→+????→
氢化钠虽可借助金属钠在高温下与氢气直接反应来制备,但反应不完全,产率低。取而代之的是将金属钠分散在矿物油中进行氢化合成的方法。油液分散状 NaH 虽有在制备、储存和运输中较安全之长,但却有含量不高(含氢化钠50%)、使用不便之短,在一些有机反应中需要用大量反应溶剂洗涤以除去 NaH 里的矿物油。
⑵物理性质:均为白色固体,常因混有痕量杂质而发灰。 ⑶化学性质
①强还原性: 例如,钛的冶炼
②剧烈水解:
③形成配位氢化物:
氢化铝遇水强烈水解:
LiH 非常活泼 , 是强还原剂。遇水发生激烈反应并放出大量的氢气。
LiH + H 2O = LiOH + H 2 ↑
1kg 氢化锂分解后可放出 2800L 氢气。氢化锂确是名不虚传的“制造氢气的工厂”。第二次世界大战期间,美国飞行员备有轻便的氢气源──氢化锂,作应急之用。
4、盐类 ⑴盐类性质 ①焰色反应
碱金属和碱土金属的化合物在无色火焰中燃烧时,会呈现出一定的颜色,称为焰色反应。可以用来鉴定化合物中某元素的存在,特别是在野外。
表3 碱金属和部分碱土金属的焰色
离子 Li + Na + K + Rb + Cs + Ca 2+ Sr 2+ Ba 2+ 焰色 红 黄 紫 紫红 紫红 紫红 洋红
黄绿
波长/nm
670.8
589.6
404.7
629.8
459.3
616.2
707.0 553.6
注意事项:①、烧至无色,消除干扰;②、每次一种;③、K +要通过钴玻璃。 绿色烟火配方(质量分数):Ba (ClO 3)2 38%、Ba(NO 3)2 40%、S22%
2(H /H ) 2.23V
E θ-
=-22 LiH TiO Ti 2 LiOH +??→+42
4 NaH TiCl Ti 4 NaCl 2 H +??→++22MH H O MOH H (g)+??→+2222CaH 2H O Ca(OH)2H (g)
+??→+344LiH AlCl Li[AlH ]3LiCl
+????→+无水乙醚
4232
LiAlH 4H O LiOH Al(OH) 4H +??→++
红色烟火配方(质量分数):KClO3 34%、Sr(NO3)2 45%、炭粉10%、镁粉4%、松香7%
盐类颜色:M+和M2+
一般无色或白色:阴离子无色,其化合物必为无色;若阴离子有色,则化合物有色。
②、溶解度
1)碱金属盐类:一般易溶于水,仅两类型微溶于水:
a)若干Li盐:LiF、Li2CO3、Li3PO4等
b)K+、Rb+、Cs+的大阴离子盐。
2)碱土金属盐类:
与一价大阴离子形成的盐多数易溶;与半径小、电荷高的阴离子形成的盐
较难溶。
硫酸盐和铬酸盐溶解度差别较大:阳离子半径较小的盐易溶,如BeSO4、BeCrO4;阳离子半径较大的盐难溶,如BaSO4、BaCrO4;
注意:Be盐和可溶性钡盐有毒(BaSO4除外) 。
氯化镁、硝酸镁、硫酸镁、铬酸镁、氯酸镁、高氯酸镁、醋酸镁等易溶于水,而碳酸镁、磷酸镁、草酸镁等是难溶的。
离子型盐类溶解度的一般规律是:
1)离子的电荷小、半径大的盐往往是易溶的。例如碱金属离子的电荷比碱土
金属小,半径比碱土金属大,所以碱金属的氟化物比碱土金属氟化物易溶。
2)阴离子半径较大时,盐的溶解度常随金属的原子序数的增大而减少。例如
I-、SO42-、半径较大。它们的盐的溶解度按锂到铯,铍到钡的顺序基本
减小。
3)相反,阴离子半径较小时,盐的溶解度常随金属的原子序数的增大而增大。
例如F- 、OH- 的半径较小,其盐的溶解度按锂到铯,铍到钡的顺序基本
增大。
4)一般来讲,盐中正负离子半径相差较大时,其盐的溶解度较大。相反,盐
中正负离子半径相近时,其溶解度较小。
③热稳定性
碱金属硝酸盐热稳定性差,加热分解有规律(P661)
碱土金属碳酸盐热分解有规律:
BeCO3MgCO3CaCO3SrCO3BaCO3
T分/℃<100 573 1110 1370 1570
稳定性M2CO3>MCO3
解释:M2+电荷比M+高,而离子半径又比M+小,M2+极化作用比M+强,热稳定性比相应碱金属差。
规律:含有大阴离子(如CO32-)的热不稳定性化合物的分解温度随阳离子半径的增大而增高。
分解反应M’CO3(s) = M’O(s) + CO2(g) 的热力学数据(298K):
可以用离子用极化理论来解释MCO3的分解温度.
在碳酸盐中阳离子半径愈小,即z/r值愈大,极化能力愈强,阳离子愈容易从CO32-中夺取O2-成为氧化物,热稳定性越差,分解温度愈低。
碱土金属碳酸盐的分解温度
⑵碱金属和碱土金属的常见盐类有卤化物、碳酸盐、硝酸盐、硫酸盐等
①、氯化镁
无水MgCl2的熔点987K ,沸点1685K 。氯化镁通常含有6 个分子的结晶水,为无色易潮解的六水合物MgCl2 · 6H2O ,加热时即水解生成碱式氯化镁:MgCl2·6H2O ==== Mg(OH)Cl + HCl + 5H2O
MgCl2主要用作电解生产金属镁的原料,MgCl2溶液与MgO 混合而成坚硬耐磨的镁质水泥。
②、碳酸钙CaCO3
CaCO3是白色晶体或粉状固体,密度2.72.93g · cm-3,它是天然存在的石灰石、大理石和冰洲石的主要成分。它的化学性质主要表现在以下几个方面:
(1)CaCO3加热到1098K 左右开始分解,生成氧化钙和二氧化碳气。
(2) 将二氧化碳通入石灰水,或Na2CO3溶液与石灰水反应,或碳酸钠溶液与氯化钙溶液反应,都可以得碳酸钙沉淀
(3)CaCO3不溶于水,但溶于含有二氧化碳的水中,生成碳酸氢钙Ca(HCO3)2。
这种溶有碳酸氢钙的天然水称为暂时硬水,遇热时二氧化碳被驱出,又生成碳酸钙沉淀:
Ca(HCO3)2 ==== CaCO3 ↓ + CO2↑ + H2O
石灰岩溶洞的形成就是这个道理,岩石中的碳酸钙被地下水(含有二氧化碳的水)溶解后再沉淀出来,就形成了钟乳石和石笋。
天然碳酸钙用于建筑材料,如作水泥、石灰、人造石等,还用于做陶瓷、玻璃等的原料。沉淀的碳酸钙用作医药上的解酸剂。
5、镁与锂性质的相似性
镁与第IA 主族的锂在周期表中呈对角线位置,呈现出对角线相似性。镁与锂性质上的相似性表现在以下几点:
1. 镁与锂在过量的氧气中燃烧,不形成过氧化物,只生成正常的氧化物。
2. 镁和锂的氢氧化物在加热时都可以分解为相应的氧化物。
3. 镁和锂的碳酸盐均不稳定,热分解生成相应的氧化物和放出二氧化碳气体。
4. 镁和锂的某些盐类如氟化物、碳酸盐、磷酸盐等及氢氧化物均难溶于水。
5. 镁和锂的氧化物、卤化物共价性较强,能溶于有机溶剂中,如溶于乙醇。
6. 镁离子和锂离子的水合能力均较强。
在周期表中某一元素的性质和它左上方或右下方的另一元素性质的相似性,称为对角线规则。这种相似性比较明显地表现在锂和镁、铍和铝、硼和硅三对元素之间。
对角线规则可以用离子极化的观点粗略说明:处于对角线的元素在性质上的相似性,是由于它们的离子极化力相近的缘故。离子极化力的大小取决于它的的半径、电荷和结构。例如锂离子和钠离子虽同一族,离子电荷相同,但是前者半径较小,并且Li 具有电子结构,所以它的极化力比Na+ 强得多,因而使锂的化合物与钠的化合物在性质上差别较大。由于Mg 的电荷较高,半径又小于钠离子,它的极化力与锂离子接近,于是Mg 便与它左上方的锂离子在性质上显示出相似性。由次可见,对角线关系是物质的结构和性质内在联系的一种具体表现。
本章作业:6、8、10
课后记:
第17章 碱金属和碱土金属 2. 以食盐为原料,如何制备下列物质?写出反应方程式。 Na NaOH Na 2O 2 Na 2CO 3 Na 2SO 3 Na 2S 2O 3 答:(1)电解熔融NaCl-CaCl 2混合物制备金属Na : 2 NaCl(l) ==== 2 Na(l) + Cl 2(g) (2)电解NaCl 饱和溶液制备NaOH : 2 NaCl + 2H 2O==== 2 NaOH + H 2(g) + Cl 2(g) (3)由步骤(1)中制备的 Na 在过量O 2中燃烧制备Na 2O 2 : 2Na + O 2 ==== Na 2O 2 (4)用NaCl 饱和溶液吸收NH 3和CO 2析出NaHCO 3,煅烧NaHCO 3即得到Na 2CO 3: + CO 2 ===== NaHCO 3↓+ NH 4Cl NH 3 + NaCl + H 2O ===== Na 2CO 3 + H 2O ↑+ CO 2↑ 2NaHCO 3 也可用步骤(2)制备的NaOH 溶液吸收CO 2制备Na 2CO 3: 2 NaOH + CO 2 ==== Na 2CO 3 + H 2O (5)用步骤(2)制备的NaOH 溶液吸收SO 2制备Na 2SO 3 : 2 NaOH + SO 2 ==== Na 2SO 3 + H 2O (6) 用步骤(5)制备的Na 2SO 3溶液与S 粉共煮制备Na 2S 2O 3 : 电解 Na 2SO 3 + S ==== Na 2S 2O 3 3. 碱土金属碳酸盐的热分解反应如下: MCO 3(s) === MO(s) + CO 2(g) 根据下表中分解反应的热力学数据,计算它们的分解温度,总结碱土金属碳酸盐热稳定性的变化规律并简要说明原因。 碳酸盐 MgCO 3 CaCO 3 SrCO 3 BaCO 3 Δr H o (298 )/kJ ?mol -1 117 176 238 268 Δr S o (298 )/J ?mol -1?K -1 168 148 168 168 解:根据 Δr G o(T)=Δr H o(298) - T ?Δr S o(298) = 0 得 T =Δr H o(298)/Δr S o(298) 将表中数据带入上式求得各碱土金属碳酸盐的分解温度T 如下: 燃烧 电解 加热 加热
第17章碱金属和碱土金属习题1.选择题 17-1下列氢化物中,稳定性最强的是…………………………………………..( ) (A) RbH (B) KH (C) NaH (D) LiH 17-2下列关于锂和镁性质上的相似性的说法错误的是……………………….( ) (A) 锂和镁的氢氧化物受热时,可分解为相应的氧化物 (B) 锂和镁的氟化物、碳酸盐和磷酸盐都难溶于水 (C) 锂和镁的氯化物都能溶于有机溶剂 (D) 锂和镁的固体密度都小于1g/cm3,熔点都很低 17-3下列各组化合物中,均难溶于水的是……………………………………...()(A) BaCrO4,LiF (B) Mg(OH)2,Ba(OH)2 (C) MgSO4,BaSO4(D) SrCl2,CaCl2 17-4下列氯化物在有机溶剂中溶解度最大的是……………………………….()(A) LiCl (B) NaCl (C) KCl (D) CaCl2 17-5下列碳酸盐的热稳定性顺序正确的是……………………………………. ( ) (A) BeCO3>MgCO3>CaCO3>SrCO3>BaCO3(B) BaCO3>CaCO3>K2CO3 (C) BaCO3>SrCO3>CaCO3>MgCO3>BeCO3(D) Li2CO3>NaHCO3>Na2CO3 17-6下列各金属在空气中燃烧生成的氧化物仅为普通氧化物的是…………( ) (A) K (B) Na (C) Li (D) Rb 17-7 已知Na +H2O == NaOH(aq) + 1/2H2Δr H m?=-185.77kJ·mol-1 NaH + H2O == NaOH(aq) + H2Δr H m?=-132.21 kJ·mol-1 则NaH 的生成热为………………………………………………………….( ) (A) –317.98 kJ·mol-1(B) +317.98 kJ·mol-1 (C) –53.56 kJ·mol-1(D) +53.96 kJ·mol-1 17-8下列各碳酸盐中溶解度最小的是………………………………………..( ) (A) NaHCO3(B) Na 2CO3 (C) Li2CO3(D) K2CO3 17-9 NaNO3和LiNO3都在1000K左右分解,其分解产物……………………( ) (A) 都是亚硝酸盐和O2(B) 都是氧化物和O2 (C) 都产生N2O和O2(D) 除了都有氧气外,其余产物均不同
实验二十二碱金属和碱土金属 [实验目的] 比较碱金属、碱土金属的活泼性。试验并比较碱土金属氢氧化物和盐类的溶解性。练习焰色反应并熟悉使用金属钾、钠的安全措施。 [实验用品] 仪器:烧杯、试管、小刀、镊子、坩埚、坩埚钳、离心机 固体药品:钠、钾、镁条、醋酸钠 液体药品:汞、NaCl(1mol·L-1)、KCl(lmol·L-1)、MgC12(0.5mol·L-1)、CaC12(0.5mol·L-1)、BaC12(0.5mol·L-1)、新配制的NaOH(2mol·L-1)、氨水(6mol·L-1)、NH4Cl(饱和)、 Na2CO3(0.5mol·L-1、饱和)、HCl(2mol·L-1)、HAc(2mol·L-1、6mol·L-1)、HNO3(浓)、 Na2SO4(0.5mol·L-1)、CaSO4(饱和)、K2CrO4(0.5mol·L-1)、KSb(OH)6(饱和)、 (NH4)2C2O4(饱和)、NaHC4H4O6(饱和)、AlCl3(0.5mol·L-1) 材料:铂丝(或镍铬丝)、pH试纸、钴玻璃、滤纸 [实验内容] 一、钠、钾、镁的性质 1.钠与空气中氧的作用 用镊子取一小块金属钠(绿豆大),用滤纸吸干其表面的煤油,切去表面的氧化膜,立即置于坩埚中加热。当钠开始燃烧时,停止加热。观察反应情况和产物的颜色、状态。冷却后,往坩埚中加入2ml蒸馏水使产物溶解,然后把溶液转移到一支试管中,用pH试纸测定溶液的酸碱性。再用2mol·L-1H2SO4酸化,滴加1~2滴0.01mol·L-1KMnO4溶液。观察紫色是否褪去。由此说明水溶液是有H2O2,从而推知钠在空气中燃烧是否有Na2O2生成。写出以上有关反应方程式。 现象和解释 2Na + O2Na2O2黄色粉末 Na2O2 + 2H2O == H2O2++ 2NaOH 5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O2 2、钠、钾、镁与水的作用 用镊子取一小块金属钾和金属钠,用滤纸吸干其表面的煤油,切去表面的氧化膜,立即将它们分别放入盛水的烧杯中。可将事先准备好的合适漏斗倒扣在烧杯上,以确保安全。观察两者与水反应的情况,并进行比较。反应终止后,滴入1~2滴酚酞试剂,检验溶液的酸碱性。根据反应
第10xx碱金属和碱土金属元素 一、选择题。 1.下列化合物用煤气灯火焰加热时,其分解产物不是氧化物、二氧化氮和氧气的是()(A) NaNO 3(B) Mg(NO 3)2(C) LiNO 3(D) Pb(NO 3)2 2.下列卤化物中,共价性最强的是………………………………………………………()(A) LiF(B) RbCl(C) LiI(D) BeI2 3.下列化合物中可用于干燥氢气的是…………………………………………………()(A) CaCO 3(B) Ca 3(PO 4) 2(C) CaCl 2(D) Ca(OH)24.常温下和N 2能直接起反应的金属是…………………………………………………()(A) Na(B) K(C) Be(D) Li 5.至今未发现有过氧化物的是…………………………………………………………()(A) Be(B) K,Rb,Cs (C) IIA(D) Li 6.下列各对元素中化学性质最相似的是………………………………………………()(A) Na,Mg (B) Al,Si (C) Be,Al (D) H,Li
7.下列原子中半径最大的是……………………………………………………………()(A) Ba(B) Ca(C) As(D) At 8.下列元素中具有最大第二电离能的是………………………………………………()(A) Na(B) K(C) Be(D) Li 9.下列分子中,最可能存在的氮化物是…………………………………………………() (A) Na 3N (B) K 3N (C) Li 3N (D) Ca 2N3 10.离子的水合能(绝对值)小于Na+的是…………………………………………………() (A) Li+(B) K+(C) Mg2+(D) Al3+ 11.下列碳酸盐中最易分解为氧化物的是………………………………………………() (A) CaCO 3(B) BaCO 3(C) MgCO 3(D) SrCO3 12.在下列卤化物中,共价性最强的是……………………………………………………() (A)氟化锂(B)氯化铷(C)碘化锂(D)碘化铍 13.和水反应得不到H 2O 2的是……………………………………………………………()(A) K 2O
第17章s 区金属(碱金属与碱土金属) 17-1: 写出下列反应的方程式: (1) 金属钠与H 2O ﹑Na 2O 2﹑NH 3﹑C 2H 5OH ﹑TiCl 4﹑KCl ﹑MgO ﹑NaNO 2 的 反应; (2) Na 2O 2与H 2O ﹑NaCrO 2﹑CO 2﹑Cr 2O 3﹑H 2SO 4(稀)的反应; 解:(1) 2Na + 2H 2O = 2NaOH + H 2↑ 2Na + Na 2O 2 = 2Na 2O 2Na + 2NH 3 = 2NaNH 2 + 3H 2↑ 2Na + 2C 2H 5OH = 2NaOC 2H 5 + H 2↑ Na + TiCl 4 = 4NaCl + Ti Na + KCl= K↑ + NaCl 2Na + MgO = Mg + Na 2O 6Na + 2NaNO 2 = Na 2O + N 2↑ (2) 2Na 2O 2 + 2H 2O = 4NaOH + O 2 ↑ Na 2O 2 + 2NaCrO 2 = 2Na 2CrO 4 + O 2↑ 2Na 2O 2 + 2CO 2 = 2Na 2Cr 3+ O 2↑ Na 2O 2 + Cr 2O 3 = Na 2CrO 4 Na 2O 2 + H 2SO 4 = 2Na 2SO 4 + 2H 2O 2 17-2:以重晶石为原料,如何制备 BaCl 2﹑BaCO 3﹑BaO 和 BaO 2 ?写出有关的化学反应方程式。 解: BaSO 4 + 4C===== BaS + 4CO BaS + 2HCl = BaCl 2 + H 2S BaS + CO 2 + H 2O = BaCO 3 + H 2S BaCO 3 ===== BaO + CO 2 2BaO + O 2 ===== 2BaO 17-3: 简要说明工业上生产金属钠﹑烧碱和纯碱的基本原理。 解:2NaCl ====== 2Na + Cl 2↑ (1) 加入CaCl 2作助熔剂,以熔盐电解法制金属钠 (2) 电解NaCl 水溶液可得NaOH 2NaCl + 2H 2O ===== Cl 2↑ + H 2↑ + 2NaOH (3) 用氨碱法 NaCl + NH 3 + CO 2 + H 2O = NaHCO 3↓ + NH 4Cl 2NaHCO 3===== Na 2CO 3 + H 2O↑ + CO 2↑ 17-4:含有Ca 2+﹑Mg 2+ 和SO 42-离子的粗盐如何精制成纯的食盐,以反应式表示。 解:(1) SO 42- + Ba 2+ = BaSO 4↓ 1633K 773-793K 电解 ?
第15章碱金属与碱土金属 教学要求 1.掌握碱金属、碱土金属单质的性质,了解其结构、制备、存在及用途与性质的关系。 2.掌握碱金属、碱土金属氧化物的类型及重要氧化物的性质及用途。 3.了解碱金属、碱土金属氢氧化物溶解性和碱性的变化规律。 4.掌握碱金属、碱土金属重要盐类的性质及用途,了解盐类热稳定性、溶解性的变化规律。 教学时数4学时 15-1 碱金属和碱土金属的通性 碱金属元素原子的价电子层结构为ns1。因此,碱金属元素只有+1氧化态。碱金属原子最外层只有一个电子,次外层为8电子(Li为2电子),对核电荷的屏蔽效应较强,所以这一个价电子离核校远,特别容易失去,因此,各周期元素的第一电离能以碱金属为最低。与同周期的元素比较,碱金属原子体积最大,只有一个成键电子,在固体中原子间的引力较小,所以它们的熔点、沸点、硬度、升华热都很低,并随着Li一Na—K一Rb一Cs的顺序而下降。随着原子量的增加(即原子半径增加),电离能和电负性也依次降低,见表17—1。 碱金属性质的变化一般很有规律,但由于锂原子最小,所以有些性质表现特殊。事实上,除了它们的氧化态以外,锂及其化合物的性质与本族其它碱金属差别较大,而与周期表中锂的右下角元素镁有很多相似之处。 碱金属元素在化合时,多以形成离子键为特征,但在某些情况下也显共价性。气态双原子分子,如Na2、Cs2等就是以共价键结合的。碱金属元素形成化合物时,锂的共价倾向最大,铯最小。 与碱金属元素比较,碱土金属最外层有2个s电子。次外层电子数目和排列与相邻的
碱金属元素是相同的。由于核电荷相应增加了一个单位,对电子的引力要强一些,所以碱土金属的原子半径比相邻的碱金属要小些,电离能要大些,较难失去第一个价电子。失去第二个价电子的电离能约为第一电离能的一倍。从表面上看碱土金属要失去两个电子而形成二价正离子似乎很困难,实际上生成化合物时所释放的晶格能足以使它们失去第二个电子。它们的第三电离能约为第二电离能的4—8倍,要失去第三个电子很困难,因此,它们的主要氧化数是+2而不是+1和+3。由于上述原因,所以碱土金属的金属活泼性不如碱金属。比较它们的标准电极电势数值,也可以得到同样的结论。在这两族元素中,它们的原了半径和核电荷都由上而下逐渐增大,在这里,原子半径的影响是主要的,核对外层电子的引力逐渐减弱,失去电子的倾向逐渐增大,所以它们的金属活泼性由上而下逐渐增强。 碱金属和碱土金属团体均为金属晶格,碱土金属由于核外有2个有效成键电子,原于间距离较小,金属键强度较大,因此,它们的熔点、沸点和硬度均较碱金属高,导电性却低于碱金属。碱土金属的物理性质变化不如碱金属那么有规律,这是由于碱土金属晶格类型不是完全相同的缘故。碱金属皆为体立方晶格,碱土金属中,Be、Mg为六方晶格,Ca、Sr为面心立方晶格,Ba为体立方晶格。 这两族元素的离子各有不同的味道特征,如Li+离子味甜;K+、Na+离子味咸;Ba+离子味苦。 Li+离子的极化力是碱金属中最强的,它的溶剂化作用和形成共价的趋势异常的大,有人提出有“锂键”的存在,类似于氢键,如H—F···Li—F和(LiF2)2。 15-2 碱金属和碱土金属的单质 15-2-1 存在和制备 一、存在 由于碱金属和碱土金属的化学性质很活泼,所以它们只能以化合状态存在于自然界中。在碱金属中,钠和锂在地壳中分布很广,两者的丰度都为2.5%。主要矿物有钠长石Na[AlSi3O8]、和钾长石K[A1Si3O8],光卤石KCl·MgCl2·6H 20及明矾石K2SO4·A12(SO4)3·24H2O等。海水中氯化钠的含量为2.7%,植物灰中也含有钾盐。锂的重要矿物为锂辉石Li2O·A1203 4SiO2,锂、铷和铯在自然界中储量较少且分散,被
第20章s区金属(ⅠA、ⅡA ) [教学要求] 1.掌握碱金属、碱土金属单质的性质,了解其存在、制备及用途与性质的关系。 2.掌握碱金属、碱土金属氧化物的类型及重要氧化物的性质及用途。 3.了解碱金属、碱土金属氢氧化物溶解性和碱性的变化规律。 4.掌握碱金属、碱土金属重要盐类的性质及用途,了解盐类热稳定性、溶解性的变化规律。[教学重点] 1.碱金属、碱土金属的单质、氧化物、氢氧化物、重要盐类的性质。 2.碱金属、碱土金属性质递变的规律。 [教学难点] 碱金属、碱土金属的氢氧化物性质递变规律。 [教学时数] 2学时(课堂讨论课) [主要内容] 1.碱金属、碱土金属的通性。 2.碱金属、碱土金属单质的性质、制法及用途。 3.碱金属、碱土金属的氧化物、氢氧化物、氢化物、盐类、配合物的性质。 [教学内容] 碱金属和碱土金属是周期表ⅠA族和ⅡA族元素。ⅠA族包括锂、钠、钾、铷、铯、钫六种金属元素。它们的氧化物溶于水呈碱性,所以称为碱金属。ⅡA族包括铍、镁、钙、锶、钡、镭六种金属元素。由于钙、锶、钡的氧化物在性质上介于“碱性的”和“土性的”(以前把粘土的主要成分,既难溶于水又难熔融的Al2O3称为“土”)之间。其中锂、铷、铯、铍是希有金属,钫和镭是放射性元素。钠、钾、镁、钙和钡在地壳内蕴藏较丰富,它们的单质和化合物用途广泛。 20-1 通性 1 结构:ns1-2 2 成键特征:+Ⅰ,+ Ⅱ离子型 3 I.E. χA在同周期最低。碱金属原子最外层只有一个电子,次外层为8电子(Li为2电子),对核电荷的屏蔽效应较强,所以这一个价电子离核校远,特别容易失去,因此,各周期元素的第一电离能以碱金属为最低。 4 m.p. b.p. 硬度低,且从上自下,有高到低。 导电性ⅠA>ⅡA 碱金属原子体积最大,只有一个成键电子,在固体中原子间的引力较小,所以它们的熔点、沸点、硬度、升华热都很低,并随着Li一Na—K一Rb一Cs的顺序而下降。碱金属和碱土金属团体均为金属晶格,碱土金属由于核外有2个有效成键电子,
《无机化学》第十章(碱金属和碱土金属)学习要点和练习题 一、学习要点 1、碱金属和碱土金属单质的物理性质和化学性质 2、碱金属和碱土金属单质的制备 3、碱金属的氧化物、过氧化物、超氧化物 4、碱金属和碱土金属氢氧化物的性质 5、碱金属和碱土金属盐类的性质,重点是盐的溶解性、热稳定性的比较 6、了解碱金属和碱土金属矿石和复盐的名称和分子式 二、练习题 1. 写出分子式 生石膏重晶石方解石天青石明钒 2. 根据碱金属的性质的递变规律,预测钫的下列性质:主要物理性质(密度、硬度、熔点);在空气中燃烧的主要产物;与水反应的情况;FrClO4在水中的溶解性如何? 3. 写出Na2O2和KO2的成键特征,并用分子轨道理论分析O2-,O22-的键级。 4. 市售的氢氧化钠中为什么常含有碳酸钠?如何制备纯的NaOH溶液? 5. 完成并配平下列反应式 ①TiCl4+N a→②LiNO3(分解)→ ③Mg(NO3)2(分解)→④Be+ NaOH+ H2O→ ⑤KO3+ H2O→⑥Mg3N2+ H2O→ ⑦MgCl2·6H2O(加热)→⑧Be(OH)2+ NaOH→ ⑨CaH2+ H2O→⑩Na2O2+ Na→ 6. 锂的电极电势比钠的更负,但是锂与水反应还不如钠剧烈,为什么? 7. 碱土金属比相应的碱金属熔点高,硬度大,为什么? 8. 锂及其化合物与其它碱金属及其化合物在性质上有哪些不同?为什么? 9. 碱金属(除钫外),在过量氧气中燃烧时各生成何种氧化物?各类氧化物和水作用如何?写出有关方程式。 10. 碱土金属碳酸盐分解温度递变规律如何? 11 .用化学反应方程式表示下列物质间的转换 (1)Mg→Mg2N3→Mg(OH)2→Mg(NO3)2→MgO (2)BeO→BeCl2→Be(OH)2→Be(OH)42-→BeF42- 12. 列出下列几组物质熔点由高到低的顺序:(提示:比较晶格能) ①NaF ,NaCl ,NaBr ,NaI ②BaO ,SrO ,CaO ,MgO ③NaF ,CaO 13. 某碱土金属A在空气中燃烧时火焰呈橙红色,反应产物为B和C的固体混合物。该混合物与水反应生成D溶液,并放出气体E,E可使红色石蕊试纸变蓝,将CO2气体通入D 溶液中有白色沉淀F生成。试确定各字母所代表物质的化学式,写出有关反应方程式。14. 化合物A、B、C都是某碱金属元素的化合物,等物质的量的A和C反应可以生成B,加热C也可以生成B并放出气体D,向A的浓水溶液中通入D,可以生成B的水溶液,若长时间的通入D,可以生成一些C的结晶,A的焰色反应显示为黄色。试确定各字母所代表物质的化学式,写出有关反应方程式。
第一章碱金属和碱土金属练习题 一、完成并配平下列化学反应方程式: (1)钾的氧化物和水反应: ① K2O② K2O2③ KO2④ KO3 (2) 钾的氧化物吸收CO2。 ① K2O② K2O2③ KO2④ KO3 (3)下列化合物与水反应: ① NaH② Mg3N2③ XeOF4④ BaS⑤ NaAlH4⑥ NaBH4 (4) 下列化合物受热分解: ① NaNO3② LiNO3③ Mg(NO3)2 ④ CaO2⑤ KO2 ⑥ KO3 ⑦ MgCl2·6H2O⑧CaCl2·6H2O (5) 氢化物LiH与下列化合物反应。 ① B2H6② AlCl3③ TiCl4 (6)以重晶石为主要原料制备BaCl2和BaO2; (7) 以KCl为主要原料制备KClO3和O2
二、填空。 (1)比较在水中的溶解度的大小(用“>”或“<”填空)。 ① LiF NaF ② Li2CO3 Na2CO3 ③ Na2CO3 NaHCO3 ④ CaCO3 Ca(HCO3)2 ⑤ Na2SiF6 K2SiF6 ⑥ Na2PtCl6 K2PtCl6 ⑦ NaClO4 KClO4 ⑧ CaCO3 CaSO4 ⑨ BaCO3 BaSO4 ⑩ CaCO3 CaC2O4 (2) 给出下列物质的矿物名称。 a、NaNO3 b、NaCl c、 K Cl·MgCl2·6H2O d、Be3Al2Si6O18 e、 MgCO3 f、MgCO3·CaCO3 g、CaSO4·2H2O h、CaCO3 i、Ca5(PO4)3F j、CaF2 k、SrSO4 l、 BaSO4 (3) 比较化合物的热稳定性(用“>”或“<”填空)。
新乡医学院无机化学实验课教案首页 授课教师姓名及职称: 新乡医学院化学教研室年月日
实验碱金属和碱土金属(I-II) 一、实验目的 1.了解金属镁和氢氧化镁的性质; 2.比较镁、钙、钡难溶盐的生成和性质; 3.掌握钠、钾的鉴定方法。 二、实验原理 周期系第ⅠA族元素称为碱金属元素,价电子层结构为ns1;周期系第ⅡA族元素称为碱土金属元素,价电子层结构为ns2。这两族元素是周期系中最典型的金属元素,化学性质非常活泼,其单质都是强还原剂。 除LiOH为中强碱外,碱金属氢氧化物都是易溶的强碱。碱土金属氢氧化物的碱性小于碱金属氢氧化物,在水中的溶解度也较小,都能从溶液中沉淀析出。 碱金属盐多数易溶于水,只有少数几种盐难溶(如醋酸铀酰锌钠、四苯硼酸钠等),可利用它们的难溶性来鉴定Na+、K+离子。 在碱土金属盐中,硝酸盐、卤化物(氟化物除外)、醋酸盐易溶于水;碳酸盐、硫酸盐、草酸盐、磷酸盐等难溶。可利用难溶盐的生成和溶解性的差异来鉴定Mg2+、Ca2+、Ba2+离子。 三、实验用品(略) 四、实验内容 (一)金属镁和氢氧化镁的性质 1.在2支试管中分别加入少量镁粉及蒸馏水约2mL,加热其中一支试管2~3min再分别加入酚酞指示剂1滴,观察溶液颜色变化,解释原因并写出反应式。 2.在2支试管中各加入0.1mol·L-1MgSO4溶液5滴,再分别滴加2mol·L-1NaOH溶液2~3滴,观察现象。然后在两试管中分别加入3mol·L-1NH4Cl溶液和2mol·L-1HCl数滴,观察现象并写出反应式。 (二)镁、钙、钡难溶盐的生成和性质 1.硫酸盐溶解度的比较 在3支试管中分别加入5滴0.1mol·L-1MgCl2、0.1mol·L-1CaCl2、0.1mol·L-1 BaCl2,然
第 20 章 s 区元素 [ 教学要求] 1、了解碱金属和碱土金属的通性。 2、掌握碱金属和碱土金属的氢化物及氧化物的性质和用途。 3、掌握碱金属和碱土金属的氢氧化物及其盐类的性质和用途。[ 教学重点] 碱金属和碱土金属的单质及其重要化合物的性质变化规律 [ 教学难点] 碱金属和碱土金属的单质及其重要化合物的性质变化规律 [ 教学时数] 4 学时 [ 教学内容] 20-1 碱金属和碱土金属的通性 20-2 碱金属和碱土金属的单质 20-3 碱金属和碱土金属的化合物 [教学方法与媒体] 讲解,ppt展示 20-1 碱金属和碱土金属的通性 1、碱金属和碱土金属的基本性质 碱金属元素的一些基本性质 1决定碱金属的主要氧化态:+1 2溶剂化强度最大(水化能为519kJ·mol-1)。
碱土金属元素的一些基本性质 讨论:Li 的φθ值为什么最负?Be 的φθ值最小? 锂电对的数值乍看起来似乎反常,这个原子半径最小、电离能最高的元素倒成了最强的还原剂.显然与其溶剂化程度(水合分子数为25 . 3)和溶剂化强度(水合焓为-519 kJ ·mol -1 )都是最大的有关。 φθ(Be 2+/Be) 明显低于同族其余电对,与其高电离能有关。无法被水合焓补偿: I 1 (Be) + I 2 (Be) = 2 656 kJ ·mol -1。 2、碱金属和碱土金属的存在 由于碱金属和碱土金属的化学活泼性很强,因此在自然界均以化合态形式存在。钠、钾在地壳中分布很广,其丰度均为 2.5% 。锂、铷、铯在自然界中的储量很小且分散,被列为稀有金属。碱土金属的重要矿物较多,铍为稀有金属。 3、用途 一些元素的某些重要用途分述如下: 3 决定碱金属的主要氧化态:+3。 4 电离势很高,I1+I2=2567kJ·mol -1,无法补偿其水合焓。 Li +/Li Na +/Na K +/K Rb +/Rb Cs +/Cs -3.04 -2.71 -2.93 -2.92 -2.92 Be 2+/Be Mg 2+/Mg Ca 2+/Ca Sr 2+/Sr Ba 2+/Ba -1.97 -2.36 -2.84 -2.89 -2.92 S 区金属元素相关电对的标准电极电势φ (Ox/Red) (单位:V)
第十章碱金属和碱土金属 思考题解析 1(10-1)钾和钠在地壳中的丰度相近(2.74%),但为什么海洋中钾的含量远小于钠?(参看牟保磊编.元素地球化学.26页,北京大学出版社,1999年;曹素忱编.无机化学.283页.高等教育出版社,1993年)解:(1)不少钾盐在水中的溶解度比钠盐小,又钾与土壤里的硅酸盐、硅铝酸盐结合得很牢; (2)钾是植物生长的要素,从岩石中溶解出的大部分被植物所吸收。 2(10-2)碱金属及其氢氧化物为什么不能在自然界中存在? 解:因为碱金属的化学性质活泼,可与空气中的氧、自然界中的水直接反应;碱金属的氢氧化物均为强碱,易于自然界中的酸性物质(如空气中的CO2 、雨中的硝酸等)作用生成盐,所以碱金属及其氢氧化物不能在自然界中存在。 3(10-3)金属钠着火时能否用H2O、CO2、石棉毯扑灭?为什么? 解:金属钠着火时不能用H2O、CO2扑灭,可用石棉毯扑灭。因为金属钠着火时,若用H2O灭火,钠可与水反应产生易燃易爆的H2;若用CO2灭火,钠着火是表面生成的Na2O2会与CO2作用产生助燃的O2。石棉(CaO·3MgO·4SiO2)与钠不作用,可用于扑灭钠着火。 4(10-4)为什么人们常用Na2O2作供氧剂? 解:因为Na2O2在室温下与H2O、CO2反应生成O2,即 Na2O2 + 2H2O 2NaOH + H2O2 2H2O2 2H2O + O2 2Na2O2 + 2CO22NBa2CO3 + O2 5(10-5)某地的土壤现碱性主要是由于Na2CO3引起的,加入石膏为什么有降低碱性的作用? 解:石膏为CaSO4,他虽然不容于水,但与Na2CO3作用可生成更难溶的CaCO3,则降低了由于Na2CO3水解而引起的土壤碱性。 6(10-6)盛Ba(OH)2溶液的瓶子,在空气中放置一段时间后,其内壁会被蒙上一层白色薄膜,这成薄膜是什么物质?欲除去应采用下列何种物质来洗涤,并说明理由。 水(2)盐酸(3)硫酸 解:薄膜是BaCO3,因为Ba(OH)2可与空气CO2中反应,即 Ba(OH)2+CO2BaCO3+H2O 用盐酸可将BaCO3除出,因为可发生下列反应:
碱金属和碱土金属 1.试说明为什么Be2+、Mg2+、Ca2+、Sr2+、Ba2+的水合热依次减弱? 2.某酸性BaCl2溶液中含少量FeCl3杂质。用Ba(OH)2或BaCO3调节溶液的pH值,均可把Fe3+沉淀为Fe(OH)3而除去。为什么?利用平衡移动原理进行讨论。 3.试解释为什么碱金属的液氨溶液,(1)有高的导电性;(2)是顺磁性的;(3)稀溶液呈兰色。 4.Rb2SO4的晶格能是-1729kJ·mol-1,溶解热是+24kJ·mol-1,利用这些数据求SO42-的水合热(已知Rb+的水合热为-289.5kJ·mol-1). 5.根据下图,可以由重晶石(BaSO4)作为原料,来制造金属钡及一些钡的化合物。试回答下列一些问题: C Na2CO3 C BaS BaCO3 BaSO 加热 BaO2 HCl HNO3 Ba Na2NO3 BaCl2·2H2O Ba(NO322 (1)现拟从重晶石制备BaCl2·2H2O。问应该采用哪些步骤,写出其化学方程式,并说明完成反应的理由。 (2)为何不能从BaS与硝酸作用直接制备Ba(NO3)2? (3)为何工业上不采用BaCO3直接加热分解方法来制备BaO? 6.利用下列数据计算KF和KI的晶格能。(单位kJ·mol-1) K+(g)F-(g)I-(g) 水合能(kJ·mol-1)-360.2 -486.2 -268.6 KF KI 溶解热(kJ·mol-1)-17.6 20.5 由计算结果再联系有关理论加以讨论。 7.讨论Li+、Na+、K+、Rb+、Cs+系列在水溶液的迁移率大小顺序?若在熔融盐中是否具有相同的顺序? 8.Na2O2可作为潜水密闭舱中的供氧剂,这是根据它的什么特点?写出有关反应式。 9.写出M2O、M2O2、MO2与水反应的方程式,并加以比较。 10.如何用离子势概念说明碱金属、碱土金属氢氧化物的碱性是随M+、M2+离子半径的增大增强。 11.如何证明碱金属氢化物中的氢是带负电的组分?预测CaH2、LiH与水反应的产物? 12.什么叫对角线规则?引起Li~Mg、Be~Al、B~Si三对元素性质上相似的原因是什么? 13.下列每对化合物中,哪一个在水中的溶解度可能更大些?
第十七章 碱金属碱土金属补充习题 一、选择题 1. 101AA01 在下列性质中,碱金属比碱土金属高(或大)的是( ) 2. A. 熔点 B. 沸点 C. 硬度 D. 半径 3. 101AA03 下列性质中,碱金属和碱土金属都不具有的是( ) 4. A. 与水剧烈反应 B. 与酸反应 C. 与碱反应 D. 与强还原剂反应 5. 101AA04 ⅠA,ⅡA 族元素的电离势,电负性和M 2分子中共价键的强度随着原子序数 的增加而( ) A. 逐渐增大 B. 逐渐减小 C. 无法推测 D. 变化不大 6. 101BA02 下列原子中哪一种原子第一电离势最大( ) A. Na B. Li C. Be D. Mg 7. 101BA04 碱土金属与碱金属相比较,碱土金属比相邻的碱金属多一个电子,即增加了 一个单位的核电荷,所以 A. 碱土金属原子半径比相邻的碱金属大些 B. 电离势大 C. 较易失去第一个电子 D. 比碱金属更活泼 8. 101BA07 下列元素中形成化合物时,共价倾向最小的是( ) A. Be B. Li C. Ba D. Cs 9. 102AA02 最轻的金属是以下金属中的( ) A. Be B. Li C. Na D. Mg 10. 102AA03 下列金属单质不能保存在煤油里的是( ) A. Li B. Na C. K D. Rb 11. 102AA05 金属钠应保存在( ) A. 酒精中 B. 液氨中 C. 煤油中 D. 空气中 12. 102AA09 下列金属单质表现两性的是( ) A. Li B. Mg C. Ba D. Be 102BA11 因为E ?(Na +/Na) 碱金属碱土金属习题 一、判断题: 1.价电子为ns2的元素都是碱土金属。..................................................................() 2.碱金属过氧化物的稳定性次序为Li2O2 > Na2O2 > K2O2 > Rb2O2 > Cs2O2。....() 3.热的NaOH溶液与过量的硫粉反应可生成Na2S2O3。..........................................() 4.碱金属氢氧化物碱性强弱的次序为:LiOH < NaOH < KOH < RbOH < CsOH。...() 5.N2只能与碱土金属直接作用形成氮化物。............................................................() 6.含有Ca2+、Mg2+的水叫做硬水。.........................................................................() 二、选择题: 1.下列叙述中有错误的是......................................................................................()。 (A) s区元素的单质都具有很强的还原性; (B) 在s区元素中,除了铍、镁表面因形成致密氧化物保护膜对水稳定外,其它元素在常温下都能同水反应生成氢气; (C) 由于s区元素电负性小,所以形成的化合物都是典型的离子化合物; (D) 除Be 和Mg 以外,其它s区元素的硝酸盐或氯化物都可以产生有色火焰。 2.下列物质与水反应,不产生H2O2的是......................................................()。 (A) KO2;(B) L i2 O;(C) BaO2;(D) Na2O2。 3.下列难溶钡盐中不溶于盐酸的是..............................................................()。 (A) BaCO3;(B) BaSO4;(C) BaCrO4;(D) BaSO3。 4.下列物质与水反应,不产生H2O2的是......................................................()。 (A) KO2;(B) L i2 O;(C) BaO2;(D) Na2O2。 5.下列硝酸盐分解时,产物中不含有NO2的是.....................................()。 (A) LiNO3;(B) NaNO3;(C) Be (NO3 )2;(D) Mg (NO3 )2。 6. IA族的金属与过量水反应的产物,最好的表示是( ) (A) MOH和H2 (B) M+(aq),OH-(aq)和H2 (C) MOH和H2O (D) M2O和H2 7. 下列各对元素中化学性质最相似的是( ) (A) Na,Mg (B) Al,Si (C) Be,Al (D) H,Li 8. 下列元素中具有最大的电子亲合能的是( ) (A) Na (B) Cl (C) Be (D) Li 9. 下列分子中,最可能存在的氮化物是( ) (A) Na3N (B) K2N (C) Li3N (D) Ca2N3 10. 离子的水合能(绝对值)小于Na+的是( ) (A) Li+(B) K+(C) Mg2+(D) Al3+ 11. 金属锂、钠、钙的氢化物,氮化物,碳化物( 乙炔化物)的相似点是( ) (A) 都可以和水反应,生成气态产物(B) 都可以和水反应,生成一种碱性溶液 (C) 在室温条件下,它们都是液体(D) (A)和(B) 12. 电解食盐水,在阴、阳电极上产生的是( ) (A)金属钠,氯气(B)氢气,氯气(C)氢氧化钠,氯气(D)氢氧化钠,氧气 13. 氢氧化钠熔融法分解某矿石时最合适用( ) (A) 铂坩埚(B) 石英坩埚(C) 镍坩埚(D) 瓷坩埚 14. 下列化合物最稳定的是( ) 第十七章 碱金属和碱土金属 1. 试根据碱金属和碱土金属得电子层构型说明它们化学活泼性得递变规律。 答:电子层数从上到下逐渐增多,核对最外层电子的引力逐渐减弱,因此,化学活泼性从上到 下越来越强。 2. 试比较锂和钾;锂和镁得化学性质又哪些相似点和区别。 答:氢氧化钾可溶,而氢氧化锂微溶。锂和镁具有对角线规律的相似性。 3. 金属钠是强还原剂,试写出它与下列物质得化学反应方程式: H 2O, NH 3, C 2H 5OH, Na 2O 2, NaOH, NaNO 2, MgO, TiCl 4 答:2Na+2H 2O=2NaOH+H 2 2Na+2C 2H 5OH=2C 2H 5ONa+H 2 Na+MgO=Na 2O+Mg 4Na+TiCl 4=Ti+4NaCl 2Na+2NH 3=2NaNH 2+H 2 2Na+Na 2O 2=2Na 2O 4. 写出过氧化钠和下列物质的反应式: NaCrO 2, CO 2, H 2O, H 2SO 4(稀) 答:2Na 2O 2+2CO 2=2Na 2CO 3+O 2 3Na 2O 2+2NaCrO 2+2H 2O=2Na 2CrO 4+4NaOH 5. 写出氢氧化钠和氢氧化钙的主要化学性质和用途。 答:(1)同两性金属反应; (2)同非金属硼、硅反应; (3)同卤素等非金属时,非金属发生歧化; (4)能与酸反应进行中和反应,生成盐和水; (5)与酸性氧化物反应生成盐和水。 氢氧化钠的用途是常用于矿物原料和硅酸盐试样的分解。 氢氧化钙的用途是在工业上往往是使用它的悬浮液,即石灰乳。 6. 写出以食盐为原料制备金属钠、氢氧化钠、过氧化钠、碳酸钠的过程,并写出它们的化 学反应方程式。 答: O H CO Na CO NaOH O Na O Na Cl H NaOH O H NaCl Cl Na NaCl 23222 2222222222222+→+??→?+↑ +↑+??→?+↑ +??→?点燃电解电解 7. 碱土金属的熔点比碱金属的高,硬度比碱金属的大,试说明其原因。 答:碱土金属有两个价电子,碱金属只有一个价电子,碱土金属的金属键比相应的碱金属的 金属键强,所以,碱土金属的熔点,硬度均比相应的碱金属高。 无机化学实验 实验二十二碱金属和碱土金属 [实验目的] 比较碱金属、碱土金属的活泼性。试验并比较碱土金属氢氧化物和盐类的溶解性。练习焰色反应并熟悉使用金属钾、钠的安全措施。 [实验用品] 仪器:烧杯、试管、小刀、镊子、坩埚、坩埚钳、离心机 固体药品:钠、钾、镁条、醋酸钠 液体药品:汞、NaCl(1mol·L-1)、KCl(lmol·L-1)、MgC12·L-1)、CaC12·L-1)、BaC12·L-1)、新配制的NaOH(2mol·L-1)、氨水(6mol·L-1)、NH4Cl(饱和)、Na2CO3·L-1、饱和)、HCl(2mol·L-1)、HAc(2mol·L-1、6mol·L-1)、 HNO3(浓)、Na2SO4·L-1)、CaSO4(饱和)、K2CrO4·L-1)、KSb(OH)6(饱和)、(NH4)2C2O4(饱和)、 NaHC4H4O6(饱和)、AlCl3·L-1) 材料:铂丝(或镍铬丝)、pH试纸、钴玻璃、滤纸 [实验内容] 一、钠、钾、镁的性质 1.钠与空气中氧的作用 用镊子取一小块金属钠(绿豆大),用滤纸吸干其表面的煤油,切去表面的氧化膜,立即置于坩埚中加热。当钠开始燃烧时,停止加热。观察反应情况和产物的颜色、状态。冷却后,往坩埚中加入2ml蒸馏水使产物溶解,然后把溶液转移到一支试管中,用pH试纸测定溶液的酸碱性。再用2mol·L-1H2SO4酸化,滴加1~2滴·L-1KMnO4溶液。观察紫色是否褪去。由此说明水溶液是有H2O2,从而推知钠在空气中燃烧是否有Na2O2生成。写出以上有关反应方程式。 现象和解释 2Na + O2Na2O2黄色粉末 Na2O2 + 2H2O == H2O2++ 2NaOH 5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O2 2、钠、钾、镁与水的作用 用镊子取一小块金属钾和金属钠,用滤纸吸干其表面的煤油,切去表面的氧化膜,立即将它们分别放入盛水的烧杯中。可将事先准备好的合适漏斗倒扣在烧杯上,以确保安全。观察两者与水反应的情况,并进行比较。反应终止后,滴入1~2滴酚酞试剂,检验溶液的酸碱性。根据反应进行的剧烈程度,说明钠、钾的金属活泼性。写出反应式。 第17章碱金属和碱土金属习题目录 一判断题;二选择题;三填空题;四完成反应方程式;五计算和解释 一判断题(返回目录) 1 重水是由H和18O组成的水。() 2 氢在自然界中主要以单质形式存在。() 3 由于H2是双原子分子,所以H2比He的扩散速率小。() 4 氢气是最轻的单质,所以它的熔点和沸点在所有单质中最低。() 5 因为氢分子的极化率大于氦分子的极化率,所以氢的熔点比氦高。() 6 常温下H2的化学性质不很活泼,其原因之一是H-H键键能较大。() 7 在HMn(CO)5中,H原子与Mn原子以Mn-H键相结合。() 8 在H[Cr(CO)5]2分子中存在着Cr-H-Cr氢桥键。()。 9 如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。() 10 碱金属氢化物都具有NaCl型晶体结构。() 11 H-在水溶液中不能存在。() 12 通常,s区元素只有一种稳定的氧化态。() 13 由于s区、p区元素性质活泼,它们都不能以单质的形式存在于自然界。() 14 s区元素在自然界不以单质形式存在。() 15 金属钙保存在煤油中。() 16 由于s区元素单质的密度很小,它们都可以浸在煤油中保存。() 17 碱金属熔点的高低次序为Li>Na>K>Rb>Cs。() 18 碱土金属的E(M2+/M)从Be到Ba依次变大。() 19 N2只能与碱土金属直接作用形成氮化物。() 20 在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。() 21 所有碱金属和碱土金属都能形成稳定的过氧化物。() 22 s区元素形成的化合物大多是离子型化合物。() 23 由于E(Li+/Li)最小,所以锂是金属性最强的元素。() 24 碱土金属氢化物的熔点比同周期碱金属的氢化物熔点高。() 25 碱金属的所有盐类都是无色的。()碱金属碱土金属 习题
武汉大学版无机化学课后习题答案__17_碱金属和碱土金属_
无机化学实验二十二 碱金属和碱土金属
第17章 碱金属和碱土金属习题