
第六章毛细管柱气相色谱法 第一节毛细管气相色谱仪 现代的实验室用的气相色谱仪大都既可用作填充柱气相色谱又可用作毛细管色谱仪。毛细管色谱仪应用范围广,可用于分析复杂有机物,如石油成分,天然产物,环境污染,农药残留等。图6-1是毛细管气相色谱仪示意图,与填充柱色谱仪比,毛细管色谱仪在柱前多一个分流-不分流进样器,柱后加一个尾吹气路。由于毛细管柱体积很小,柱容量很小,出峰快,所以死体积一定要小,要求瞬间注入极小量样品,因此柱前要分流。对进样技术要求高,对操作条件要求严。尾吹的目的是减小死体积和柱末端效应。毛细管柱对固定液的要求不苛刻,一般2-3根不同极性的柱子可解决大部分的分析问题。毛细管柱一般配有响应快,灵敏度高的质量型检测器。 高分辨率毛细管气相色谱仪的三要素是:要选择好的毛细管柱及最佳分析条件;按样品选择合适的毛细管进样系统;选择高性能的毛细管气相色谱仪。 图6-1 毛细管气相色谱仪示意图 第二节毛细管色谱柱 1957年,美国科学家Golay提出毛细管柱的气相色谱法。Golay称毛细管色谱柱为开管柱。因这种色谱柱中心是空的。毛细管柱是内径为Φ0.1-0.5mm左右、长度为10-300m的毛细柱,虽然每米理论板数约为2000-5000,与填充柱相当,但由于柱子很长,总柱效可高达106。 一、毛细管色谱柱组成 通常来说,一根毛细管色谱柱由管身和固定相两部分组成。管身采用熔融二氧化硅(熔融石英),通常在其表面涂上一层聚酰亚胺保护层。涂层后的熔融石英毛细管呈褐色:但是涂层后的毛细管之间
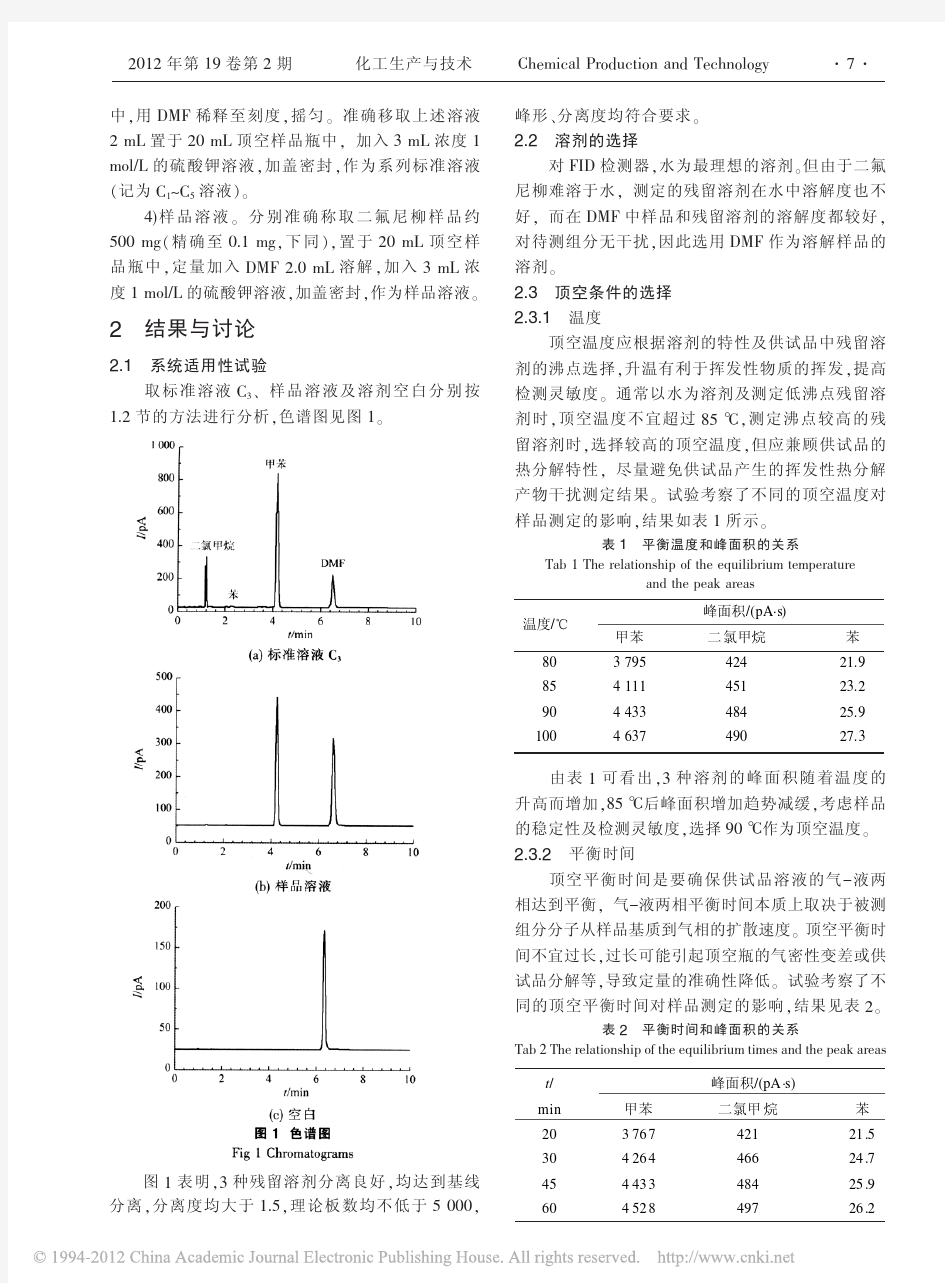
的颜色却不尽相同。色谱柱的颜色对于其色谱性能没有什么影响。经过持续的较高温度处理后.聚酰亚胺涂层管的的温度会变得比以前更深:标准的聚酰亚胺涂层管熔融石英管的温度上限为360℃,高温聚酰亚胺涂层管的温度上限为400℃。固定相种类很多,大部分的固定相是热稳定性好的聚合物,常用的有聚硅氧烷和聚乙二醇。另外还有一类是小的多孔粒子组成的聚合物或沸石(例如氧化铝、分子筛等)。 熔融石英管的内表面会用一些化学方法进行处理,尽量的减小样品和管壁之间可能存在的相互作用。所用的试剂和处理方法一般是依据将要涂在内壁上的固定相种类来确定的。硅烷化处理则是最为常用的处理方式,使用硅烷类的试剂和管壁内表面上的硅基醇基团进行反应,使其变为甲基硅烷基或苯甲基甲基硅烷基。 当实验要求更高的使用温度时,我们可以来用不锈钢毛细柱来代替熔融石英毛细柱。不锈钢毛细柱在使用温度(耐高温)及日常维护(不易折断等)的性能和指标上都优于熔融石英毛细柱。但是不锈钢材质的惰性没有熔融石英好,它可以和许多的化合物相互作用,产生反应。所以通常可以用化学方法对其进行处理,或者是在它的内壁再涂上薄薄的一层熔融石英,以增加不锈钢管的隋性:经过适当处理后,不锈钢毛细柱的惰性与熔融石英毛细柱的不相上下。 二、毛细管色谱柱固定相 (一)气-液色谱固定相 1.聚硅氧烷 聚硅氧烷有优良的稳定性, 用途广,是目前最为常用的固定相。标准的聚硅氧烷是由许多单个的硅氧烷重复联接构成,每个硅原子与两个功能基团相连,功能基团的类型和数量决定了固定相总体类型和性质,常见的四种功能基团为甲基、氰丙基、三氟丙基和苯基。最基本的聚硅氧烷是由100%甲基取代的。当有其他种类的取代基出现时,该基团的数量将由一个百分数来表示。例如:5%二苯基—95%二甲基聚硅氧烷表示其包含有5%的苯基基团和95%的甲基基团。“二”是表示每个硅原子包含有两个特定基团,但当两个特定基团完全相同时,我们有时也会省略这种叫法。如果甲基的百分数没有表征,则表示它的含量可能是100%(如50%苯基—甲基聚硅氧烷表示甲基的含量为50%)。有时我们可能对氰丙基苯基的百分含量产生错误的理解,如14%氰丙基苯基—二甲基聚硅氧烷表示的是其含有7%氰丙基和7%苯基(另有86%的甲基),因为一个氰丙基和一个苯基连接于同一个硅原子上,所以14%是一种加和的表征方式。 我们有时会用低流失来表征一类固定相。这一类固定相是在硅氧烷聚合物中链接一定数量的苯基或苯基类的基团,通常我们称之为“亚芳基”。由于它们的加入,聚合物的链接变得更加坚固稳定,保证了在较高温度时,固定相不会产生降解。也就是说,进一步降低了色谱柱的柱流失,提高了色谱柱的使用温度。与原始的非亚芳基类型的固定相相比,亚芳基固定相不仅拥有相同的分离指数,而且在色谱柱的维护等方面也有许多的调整(例如SE-52和SE-54)。尽管同类普通型和低流失型固定相的分离性能相同或极为相似,但是在某些方面还有微小的区别。另外,我们也使用一些独特低流失固定相。 2.聚乙二醇 聚乙二醇是另外一类广泛应用的固定相。有时我们称之为“WAX”或“FFAP”。聚乙二醇不像聚硅氧烷那样有多种取代基团,它是100%固定基质的聚合物。相对于聚硅氧烷,聚乙二醇固定相色谱柱的寿命较短,而且容易受温度和环境(有氧环境等)的影响。另外,聚乙二醇固定相在相应的GC实验条件下需保持液态。但由于其独特的分离性能,聚乙二醇仍是我们常用的固定相之一。
实验三气相色谱法测定残留溶剂 一、实验目的 1.通过本次实验,了解气相色谱法(GC)的原理及仪器构造; 2.掌握用气相色谱法(GC)测定3种残留溶剂(丙酮、正己烷、乙酸乙酯)的方法; 3.掌握外标一点法计算有机溶剂残留量的方法; 二、实验原理 1.气相色谱原理:利用物质的沸点、极性及吸附物质的差异来实现混合物的分离。 2. 《中国药典》法定的测定有机溶剂残留的原理与方法:不同性质的有机溶剂残留,在气相色谱中的 保留行为不同,在气相色谱柱(填充柱或毛细管柱)中获得分离后,被检测器检测产生相应信号。通过与标准对照信号的比较,即可确定残留量。 三、仪器结构 1.气路系统及其部件 气路—载气、燃气及助燃气 氮气、氢气和氦气,常用氮气。 氢气为燃气,空气助燃。 减压阀—使高压气体降低到使用压力。 净化器—除去气体中可能存在的有害物质。 稳压阀和稳流阀—保证气体流量稳定,使色谱峰特性不因气源变化而变化 2.进样系统(sample injection)与分离系统-色谱柱(capillary column) 微量注射器 使用前注意注射器针尖的光滑性,使用后及时清洗干净。 进样器 气化室经加热使样品气化,由载气带入色谱柱。为了避免气化的样品与金属接触产生分解,一般气化室均装有去活(硅烷化)的玻璃(玻璃衬管)或石英插管,并在插管内塞有少许硅烷化玻璃棉。 这样可使未气化物残留在插管内,在完成分析时取出插管更换或清洗。 色谱柱 如HP-5(5%-苯基-95%二甲基聚硅氧烷)(30m*0.25mm*0.25μm)30m是柱长,0.25mm应指内径,内径决定了色谱柱的柱容量,0.25μm不是壁厚,是液膜厚度。分析样品温度不一样,对膜厚有不同要求,温度高液膜要厚,温度低液膜要薄。
指导原则编号: 【H】G P H7-1化学药物残留溶剂研究的技术指导原则 二OO五年三月
目 录 一、概述 (1) 二、基本内容 (2) (一)残留溶剂研究的基本原则 (2) 1、确定残留溶剂的研究对象 (2) 2、确定残留溶剂时需要考虑的问题 (2) 3、残留溶剂分类及研究原则 (4) (二)研究方法的建立及方法学验证 (6) 1、研究方法的建立 (6) 2、方法学验证 (8) (三)研究结果的分析及质量标准的制定 (9) 1、残留溶剂表示方法 (9) 2、质量标准制定的一般原则及阶段性要求 (10) (四)需要关注的几个问题 (12) 1、附录中无限度规定和未收载的有机溶剂 (12) 2、未知有机挥发物 (12) 3、多种有机溶剂综合影响 (13) 4、中间体的残留溶剂 (13) 5、制剂工艺对制剂残留溶剂的影响 (14) 6、辅料残留溶剂的研究及对制剂的影响 (14) 三、参考文献 (14) 四、附录 (16) 五、著者 (17)
化学药物残留溶剂研究的技术指导原则 一、概述 药物中的残留溶剂系指在原料药或辅料的生产中、以及在制剂制备过程中使用或产生而又未能完全去除的有机溶剂。根据国际化学品安全性纲要,以及美国环境保护机构、世界卫生组织等公布的研究结果,很多有机溶剂对环境、人体都有一定的危害,因此,为保障药物的质量和用药安全,以及保护环境,需要对残留溶剂进行研究和控制。 本指导原则是在参考人用药物注册技术要求国际协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)颁布的残留溶剂研究指导原则,美国药典(the United States Pharmacopoeia,USP)、英国药典(British Pharmacopoeia, BP)、欧洲药典(European Pharmacopoeia,EP)、中国药典(Chinese Pharmacopoeia, ChP)相关内容的基础上,结合我国药物研发的特点,通过分析、研究残留溶剂问题与药物的安全性、有效性及质量可控性之间的内在关系而制定的。本指导原则总结了对残留溶剂问题的一般认识,旨在帮助药物研发者科学合理的进行残留溶剂方面的研究,也为药物评价者提供参考。 考虑到残留溶剂研究涉及的范围比较广泛,本指导原则主要对原料药的残留溶剂问题进行讨论,并以此为基础,探讨和总结药物研究过程中对残留溶剂问题的一般性原则。药物研发者可参考本指导原则对制剂和辅料的残留溶剂问题进行研究。
残留溶剂的鉴定和控制 在本章下描述的测试程序可能适用于以下几种情况: (1)原料药、辅料以及制剂中的大多数未知一类和二类溶剂的鉴定。 (2)原料药、辅料以及制剂中的一类和二类溶剂的限度测试。 (3)对于限度大于1000ppm的二类溶剂以及三类溶剂的定量测试。 一类、二类及三类溶剂在5.4残留溶剂里面都列出来了。 样品配制的三种溶剂以及顶空进样的色谱系统条件都在本章中进行了描述。本章中规定了两个色谱系统,但是系统A是优先推荐的,系统B是用于确证同一性而使用的。样品配制程序的选择主要是根据样品本身的溶解度以及需要控制的溶剂类别来确定的。 下面几种溶剂不适合用顶空进样测定:甲酰胺、2-乙氧基乙醇、2-甲氧基乙醇、乙二醇、N-甲基吡咯烷酮以及环丁砜。其他合适的程序可以用于这些溶剂的测定。 当一种方法被用于定量控制原料药中的残留溶剂,必须进行验证。 测试程序:使用顶空进样气相色谱法进行测量。 样品制备方法1:该方法主要用于易溶于水系统的残留溶剂的测定。 样品溶液(1)将0.200g样品溶于水中,用水稀释至20ml。 样品制备方法2:该方法主要用于难溶于水系统的残留溶剂的测定。 样品溶液(2)将0.200g样品溶于DMF中,用DMF稀释至20ml。 样品制备方法3:该方法主要用于控制N,N-二甲基乙酰胺以及N,N-二甲基甲酰胺的测定。 样品溶液(3)将0.200g样品溶于1,3-二甲基-咪唑啉酮中,用1,3-二甲基-咪咪唑啉酮稀释至20ml。 某些情况下,以上的几种样品配制方法都不适用的时候,所选择的样品配制方法以及顶空条件必须证明是合适的。 溶剂溶液(a)取1.0ml一类溶剂标准品,加9mlDMSO,用水稀释至100ml。取1.0ml至10.0ml水中。 相关溶液包括以下几种:苯:2ppm,四氯化碳:4ppm,1,2-二氯乙烷:5ppm,1,1-二氯乙烷:8ppm,1,1,1-三氯乙烷:10ppm。
残留溶剂的指导原则 1.介绍 本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。 药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以及在制剂制备过程中产生或使用的有机挥发性化合物,它们在工艺中不能完全除尽。在合成原料药中选择适当的溶剂可提高产量或决定药物的性质,如结晶型。纯度和溶解度。因此.有时溶剂是合成中非常关键的因素。本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂,也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作出合理的判断。 出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以符合产品规范、GMP或其他基本的质量要求。制剂所含残留溶剂的水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类,表1),除非被证明特别合理,在原药、赋形剂及制剂生产中应避免使用。一些溶剂毒性不太大(第二类,表2)应限制使用,以防止病人潜在的不良反应。使用低毒溶剂(第三类,表3)较为理想。附录1中列出了指导原则中的全部溶剂。 表中所列溶剂并非详尽无遗,其他可能使用的溶剂有待日后补充列人。第一、二类溶剂的建议限度或溶剂的分类会随着。新的安全性资料的获得而调整。含有新溶剂的新药制剂、其上市申请的安全性资料应符合本指导原则或原料药指导原则(Q3A新原料药中的杂质)或新药制剂(Q3B新药制剂中的杂质)中所述的杂质控制原则,或者符合上述三者。 2. 指导原则的范围 指导原则范围包括原料药、赋形剂或制剂中所含残留溶剂.因此,当生产或纯化过程中会出现这些溶剂时。应进行残留溶剂的检验。也只有在上述情况下,才有必要作溶剂的检查。虽然生产商可以选择性地测定制剂,但也可以从制剂中各成分的残留溶液水平来累积计算制剂中的残留溶剂。如果计算结果等于或低于本原则的建议水平,该制剂可考虑不检查残留溶剂,但如果计算结果高于建议水平则应进行检测,以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水平。果制剂生产中用到某种溶剂,也应进行测定。 本指导原则不适用于临床研究阶段的准新原料药、准赋形剂和准制剂。也不适用于已上市的药品。 本指导原则适用于所有剂型和给药途径。短期(如30天或更短)使用或局部使用时,允许存在的残留溶剂水平可以较高。应根据不同的情况评判这些溶剂水平。 有关残留溶剂的背景附加说明见附录2。 3.通则 3.1 根据危害程度对残留溶剂分类 “可耐受的日摄人量”(TDI)是国际化学品安全纲要(IPCS)用于描述毒性化合物接触限度的术语。“可接受的日摄人量”(ADI)是WHO及一些国家和国际卫生组织所用的术语。新术语“允许的日接触量”(PDE)是本指导原则中用于定义药物中可接受的有机溶剂摄人量,以避免与同一物质的ADI混淆。 本原则中残留溶剂的评价以通用名和结构列于附录1,根据它们对人体可能造成的危害分为以下三类; (1)第一类溶剂:应避兔的溶剂 为人体致癌物、疑为人体致癌物或环境危害物。 (2)第二类溶剂。应限制的溶剂 非遗传毒性动物致癌或可能导致其他不可逆毒性测神经毒性或致畸性)的试剂。 可能具其他严重的但可逆毒性的溶剂。
usp[467] 有机挥发性杂质 残留溶剂限度 残留溶剂:不得残留 Ⅰ级已知人体实验致癌物质;强烈疑似人体实验致癌物 质;环境危害物质 残留溶剂:应在限度内 Ⅱ级动物实验非生殖毒性(遗传);动物实验致癌物质或其它可能的非可逆致病因子;产生毒性如神经毒性或致畸性;其它疑似重大但可逆毒性 残留溶剂:低潜在毒性溶剂 Ⅲ级对人体存在低毒性溶剂;无人体摄入量规定(注:Ⅲ级残留溶剂 PDEs上限为≥ 50mg/天) 表 1 Ⅰ级残留溶剂 溶剂浓度限度( ppm)不良反应 苯2致癌物四氯化碳4中毒和外周脑组织损害1,2- 二氯乙烷5中毒 1,1- 二氯乙烷8中毒 1,1,1- 三氯乙烷1500环境危害 Ⅱ级残留溶剂 表 2 Ⅱ级残留溶剂 溶剂PDE(mg/天)浓度限度( ppm) 乙腈 4.1410 氯苯 3.6360 氯仿0.660 环己烷38.83880 1,2- 二氯乙烯18.71870 1,2- 二甲氧乙烷 1.0100 N,N-二甲基乙酰胺10.91090 N,N-二甲基甲酰胺8.8880 1,4- 二氧六环 3.8380 2- 乙氧基乙醇 1.6160 乙二醇 6.2620 甲酰胺 2.2220 己烷 2.9290 甲醇30.03000 2- 甲氧基乙醇0.550 甲基丁基(甲)酮 0.550 2- 己酮 甲基环己烷11.81180
二氯甲烷 6.0600 N-甲基吡咯烷酮 5.3530硝酸甲烷0.550 吡啶 2.0200环丁砜 1.6160四氢呋喃7.2720 1,2,3,4- 四氢化萘 1.0100甲苯8.9890三氯乙烯0.880 二甲苯 *21.72170 *通常含有 60%间- 二甲苯, 14%对 - 二甲苯, 9%邻- 二甲苯和 17%乙苯 Ⅲ级残留溶剂 表 3Ⅲ级残留溶剂 (GMP或其它原料药、赋形剂和药物制剂质量标准规定) 醋酸庚烷 丙酮乙酸异丁酯 苯甲醚乙酸异丙酯 正丁醇乙酸甲酯 2- 丁醇3- 甲基 -1- 丁醇 乙酸丁酯甲基乙基酮 叔丁基甲基醚甲基异丁基酮 异丙基苯2- 甲基 -1- 丙醇 二甲基亚砜戊烷 乙醇1- 戊醇 乙酸乙酯1- 丙醇 乙醚2- 丙醇 甲酸乙酯乙酸丙酯 甲酸 表 4其它残留溶剂 (缺乏足够的毒物学方面的资料) 1, 1- 二乙氧基丙烷甲基异丙基酮 1, 1- 二甲氧基甲烷甲基四氢呋喃 2, 2- 二甲氧基丙烷溶剂己烷 异辛烷三氯醋酸 异丙醚三氟醋酸 除另有规定外,样品中残留的有机挥发性杂质不得超过下表中规定限度:有机挥发性杂质限度(μ g/g ) 氯仿60 1,4- 二氧杂环己烷380 二氯甲烷600 三氯乙烷80
杂质:残留溶剂的指导原则
杂质:残留溶剂的指导原则
1.介绍 本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的 可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理 学上的可接受水平。 药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以 及在制剂制备过程中产生或使用的有机挥发性化合物, 它们在工艺中 不能完全除尽。 在合成原料药中选择适当的溶剂可提高产量或决定药 物的性质,如结晶型。纯度和溶解度。因此.有时溶剂是合成中非常 关键的因素。本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂, 也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作 出合理的判断。 出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以 符合产品规范、GMP 或其他基本的质量要求。制剂所含残留溶剂的 水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类, 表 1) ,除非被证明特别合理,在原药、赋形剂及制剂生产中应避免 使用。一些溶剂毒性不太大(第二类,表 2)应限制使用,以防止病 人潜在的不良反应。使用低毒溶剂(第三类,表 3)较为理想。附录 1 中列出了指导原则中的全部溶剂。
第 1 页 共 18 页
杂质:残留溶剂的指导原则
表中所列溶剂并非详尽无遗, 其他可能使用的溶剂有待日后补充 列人。第一、二类溶剂的建议限度或溶剂的分类会随着。新的安全性 资料的获得而调整。含有新溶剂的新药制剂、其上市申请的安全性资 料应符合本指导原则或原料药指导原则(Q3A 新原料药中的杂质) 或新药制剂(Q3B 新药制剂中的杂质)中所述的杂质控制原则,或者 符合上述三者。 2. 指导原则的范围 指导原则范围包括原料药、 赋形剂或制剂中所含残留溶剂. 因此, 当生产或纯化过程中会出现这些溶剂时。应进行残留溶剂的检验。也 只有在上述情况下,才有必要作溶剂的检查。虽然生产商可以选择性 地测定制剂, 但也可以从制剂中各成分的残留溶液水平来累积计算制 剂中的残留溶剂。如果计算结果等于或低于本原则的建议水平,该制 剂可考虑不检查残留溶剂, 但如果计算结果高于建议水平则应进行检 测, 以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水 平。果制剂生产中用到某种溶剂,也应进行测定。 本指导原则不适用于临床研究阶段的准新原料药、 准赋形剂和准 制剂。也不适用于已上市的药品。 本指导原则适用于所有剂型和给药途径。短期(如 30 天或更短) 使用或局部使用时,允许存在的残留溶剂水平可以较高。应根据不同 的情况评判这些溶剂水平。 有关残留溶剂的背景附加说明见附录 2。
第 2 页 共 18 页
USP[467]有机挥发性杂质 残留溶剂限度 Ⅰ级需避免的溶剂 已知人体实验致癌物质; 强烈疑似人体实验致癌物质;环境危害物质 Ⅱ级需被限制的溶剂 动物实验非生殖毒性(遗传);动物实验致癌物质或其它可能的非可逆致病因子;产生毒性如神经毒性或致畸性; 其它疑似重大但可逆毒性 Ⅲ级具有低潜在毒性溶剂 对人体存在低毒性溶剂;无人体摄入量规定(注:Ⅲ级残留溶剂PDEs上限为≥50mg/天) 表1 Ⅰ级残留溶剂 溶剂浓度限度(ppm)不良反应 苯 2 致癌物四氯化碳 4 中毒和外周脑组织损害1,2-二氯乙烷 5 中毒 1,1-二氯乙烷8 中毒 1,1,1-三氯乙烷1500 环境危害 Ⅱ级残留溶剂 表2 Ⅱ级残留溶剂 溶剂PDE(mg/天)浓度限度(ppm) 乙腈Acetonitrile 4.1 410 氯苯Chlorobenzene 3.6 360 氯仿Chloroform0.6 60 环己烷Cyclohexane38.8 3880 1,2-二氯乙烯 1,2-Dichloroethene 18.7 1870 1,2-二甲氧乙烷 1.0 100 N,N-二甲基乙酰胺 N,N-Dimethylacetamide 10.9 1090 N,N-二甲基甲酰胺 N,N-Dimethylformamide 8.8 880 1,4-二氧六环 1,4-Dioxane 3.8 380 2-乙氧基乙醇 1.6 160 乙二醇Ethylene glycol 6.2 620 甲酰胺Formamide 2.2 220
己烷Hexane 2.9 290 甲醇Methanol30.0 3000 2-甲氧基乙醇0.5 50 甲基丁基(甲)酮 0.5 50 2-己酮 甲基环己烷11.8 1180 二氯甲烷 6.0 600 N-甲基吡咯烷酮 5.3 530 硝酸甲烷0.5 50 吡啶 2.0 200 环丁砜 1.6 160 四氢呋喃7.2 720 1,2,3,4-四氢化萘 1.0 100 甲苯8.9 890 三氯乙烯0.8 80 二甲苯* 21.7 2170 *通常含有60%间-二甲苯,14%对-二甲苯,9%邻-二甲苯和17%乙苯 Ⅲ级残留溶剂 表3 Ⅲ级残留溶剂 (GMP或其它原料药、赋形剂和药物制剂质量标准规定) 醋酸Acetic acid 庚烷Heptane 丙酮Acetone 乙酸异丁酯 苯甲醚乙酸异丙酯 正丁醇乙酸甲酯 2-丁醇3-甲基-1-丁醇 乙酸丁酯甲基乙基酮 叔丁基甲基醚甲基异丁基酮 异丙基苯2-甲基-1-丙醇 二甲基亚砜戊烷 乙醇1-戊醇 乙酸乙酯1-丙醇 乙醚2-丙醇 甲酸乙酯乙酸丙酯 甲酸 表4 其它残留溶剂 (缺乏足够的毒物学方面的资料) 1,1-二乙氧基丙烷甲基异丙基酮 1,1-二甲氧基甲烷甲基四氢呋喃 2,2-二甲氧基丙烷溶剂己烷 异辛烷三氯醋酸 异丙醚三氟醋酸除另有规定外,样品中残留的有机挥发性杂质不得超过下表中规定限度:
毛细管气相色谱柱的选择方法 【关闭本页】【返回首页】【发布时间2004-1-14】 一、固定相的选择 1.如果不知道使用何种固定相,可以从非极性柱或弱极性柱如SPB-1或SPB-5开始试用,如效果不好,再按极性渐强的顺序选用中等极性直至高极性柱逐一尝试,直到有较令人满意的分析结果即可确定适用的柱极性。 2.低流失(“ms”)色谱柱通常更为惰性,有更高的温度上限,适用于MS检测器。3.使用能够提供满意的分离度和分析时间的极性最小的固定相,非极性固定相比极性固定相具有更长的寿命。 4.要使用和被分析物极性相近的固定相,使用这一选择方法常常是有效的,但是使用这一方法并不总是能找到最好的固定相。 5.如果被分离混合物具有不同的偶极或氢键力,改变使用具有不同偶极或氢键力(不一定要更大)的固定相后,会出现其他共流出物,所以新的固定相不一定提供更好的总分离度。 6.如果可能,要避免使用含有能使选择性检测器产生高响应值功能团的固定相,例如含有氰丙基的固定相,用NPD会产生不成比例地增大基线高度(由于柱流失)的现象。7.SPB-1或SPB-5,SPB-50,SPB-1701,和SUPELCOWAX 10以最少数量的色谱柱能覆盖最大范围的选择性。 8.PLOT柱用于在高于室温的柱温下来分析气体样品。 二、色谱柱直径的选择 1. 当需要有高柱效的色谱柱时应使用0.18-0.25mm的色谱柱。0.18mm的色谱柱很适合于泵容量低的GC/MS系统。小内径柱的容量最小而且需要最高的柱头压力。 2. 当需要样品容量大时就要使用0.32mm内径的色谱柱。与0.25mm内径柱相比, 0.32mm内径柱对不分流进样或大体积(>2μL)进样时早流出的色谱峰有较高的分离度。 3. 只有配备大口径直接进样口时,才使用0.53mm内径的色谱柱,它特别适合于高载气流速的应用,例如吹扫捕集,顶空进样。0.53mm内径色谱柱在恒定的液膜情况下具有最高的样品容量。 三、色谱柱柱长的选择 1. 当不知道最佳柱长时,尝试使用25-30m长的色谱柱。 2. 10-15m长的色谱柱适合于分离含有很容易分离的溶质混合物,或者分离为数不多的溶质混合物,较短的柱长用于直径很小的色谱柱,以便降低柱头压力。 3. 当使用其他方法(小内径柱,不同的固定液,改变柱温)不能达到分离度时,就使用50-60m长的色谱柱。它最适合于分离含有多组分的复杂混合物,长柱需要的分离时间长,费用也高。 四、色谱柱膜厚的选择 1. 0.18-0.32mm内径的色谱柱,其平均或标准膜厚在0.18-0.25μm,用于绝大多数的分析。 2. 0.45-0.53 mm内径的色谱柱,其平均或标准膜厚在0.18-1.5μm,用于绝大多数的分析。 3. 厚液膜色谱柱用于保留和分离挥发性物质(如轻溶剂,气体)。厚液膜色谱柱有更高的惰性,其柱容量也高;但厚液膜色谱柱具有较高流失性,使用温度上限也有所下降。 4. 薄液膜色谱柱用于降低高沸点物质和高分子量物质(如甾体,三甘油酸酯)的保留时间,并具有低流失性的特点;但薄液膜色谱柱的惰性较差,且柱容量较低。
气相色谱法测定聚乳酸中的单体残留(作者:__________ 单位: __________ 邮编:____________ ) 作者:李红梅王传栋,李俊起,刘阳 【摘要】测定聚乳酸中丙交酯的含量。采用毛细管气相色谱法,色谱系统为:AC20色谱柱;柱温150C ;载气为氮气;检测器为FID。在色谱条件下,测得丙交酯线性良好(丫0.99);平均回收率为 99.8%;RSD0.18%最低检测限为3.413卩g/mL,样品中丙交酯残留量符合要求。该方法灵敏、准确、可靠。 【关键词】毛细管气相色谱法;聚乳酸;丙交酯;单体残留;测定Abstract : To determine the contents of residual lactide in PLA.A Simple capillary gas chromatography method was established with FID detector. The capillary colu mn was AC20 with 150C ;the residual monomecontents were calculated by the exter nal sta ndard method.The lin earities were fairly good(丫0.99). The average recoveries were 99.8 % with RSD of 0.18%. The limit of detection was 3.413 卩g/mL. The contents of residual monomer in samples were complied with the specificati on
四、附录 16
1、残留溶剂表示方法 1.1允许日接触量 允许日接触量(permitted daily exposure, PDE)是指某一有机溶剂被允许摄入而不产生毒性的日平均最大剂量,单位为mg/天。某一具体有机溶剂的PDE值是由不产生反应量、体重调整系数、种属之间差异的系数、个体差异、短期接触急性毒性研究的可变系数等推算出的。部分有机溶剂的PDE 值见附录。由于国内目前尚未对此有系统的研究,附录中所列出的数据均是参考ICH残留溶剂研究指导原则中的数据。 1.2浓度限度 在PDE 表示方法的基础上,为了更加便于计算,引入了浓度限度(%)表示方法,其计算公式为浓度限度(%)=PDE(mg/天)9 /(1000×剂量(g/天))×100%,其中剂量初步定为10g/天。部分有机溶剂的浓度限度见附录。 1.3两种表示方法的比较 以上两种表示方法在残留溶剂研究中均可行,但需要指出的是,PDE值是绝对值,也就是说无论原料药、辅料和制剂,只要能明确各成分的溶剂残留量,以PDE值来计算是很精确的;而对于某一具体制剂来说,由于很难确定处方中各活性成分和各辅料的残留溶剂水平,因此以浓度限度来计算更为简便,只要日摄入总量不超过10g,就无需进一步计算。综合以上情况并考虑目前国内的实际情况,由于大多数药物的日摄入量不会超过10g(包括活性成分和辅料),浓度
限度表示方式是目前更为简便可行的。当然,在某些原料、辅料或制剂的残留溶剂不符合浓度限度时,可根据实际测定的各种残留溶剂量及用法用量计算实际日接触量,并与PDE值比较,如符合限量要求则也属可行。 此外,虽然本指导原则采用浓度限度的表示方式,但由于PDE 值的精确性,药物研发者可采用适当的PDE 值的方式进行残留溶剂研究。
毛细管气相色谱法条件及定量分析 指导老师:李建国 实验人:王壮 同组实验:陆潇、戈畅 实验时间:2016.4.18 一、实验目的 1.熟悉色谱分析的原理及色谱工作站的使用方法; 2、掌握气相色谱仪操作方法与氢火焰离子化检测器的原理; 3.用保留时间定性;用归一化法定量;用分离度对实验数据进行评价。 二、实验原理 不同组分在同一分离色谱柱上,在相同实验条件下有不同的保留行为,其保留时间的差异可以用来定性分析,每一组分的质量与相应色谱峰的积分面积成正比,因此可以公式计算,用归一化方法测定每一组分的质量百分含量。 1122100A is i i A A A s s ns n f A w f A f A f A =?++???+% 本实验是用气相色谱测定乙酸乙酯、乙酸丁酯及其混合试样,检测器用FID 。用色谱软件进行谱图处理和定量计算,让学生掌握用已知物对照定性、用归一化法测定混合物组分定量的实验。 混和试样的成功分离是气相色谱法定量分析的前提和基础,衡量一对色谱峰分 离的程度可用分离度:12121()2 R R t t R W W -=?+,式中1R t 、2R t 和1W 、2W 分别指两组分的保留时间和峰底宽度,R=1.5时两组分完全分离,实际中R=1.0(分离度98%)即可满足要求。 三、仪器与试剂 仪器:GC7890F 型气相色谱仪、氢火焰离子化检测器(FID )、氮气钢瓶、空气钢瓶、氢气发生器,微量注射器、3mm x 200cm 的10% SE-54不锈钢分离柱。GC5400型气相色谱仪、空气发生器、氮气发生器、氢气发生器,微量注射器、15m 毛细管分离柱。 试剂:乙酸乙酯、乙酸丁酯标准试样及其未知混合试样。 四、实验内容 1.按操作说明书使色谱仪正常运行,并调节至如下条件: 柱温:110C ? 检测器温度:120C ? 气化温度:120C ? 载气、氢气和空气流量分别为30、50和200mL/min 。 2.分别改变柱温至80、90、100、110、120C ?。每改变一次柱温,注入0.5L μ混合酯试样,记下保留时间,观察其出峰顺序和分离情况。
毛细管气相色谱法条件及定量分析 指导老师:李建国 实验人:王壮 同组实验:陆潇、戈畅 实验时间:2016.4.18 一、实验目的 1.熟悉色谱分析的原理及色谱工作站的使用方法; 2、掌握气相色谱仪操作方法与氢火焰离子化检测器的原理; 3.用保留时间定性;用归一化法定量;用分离度对实验数据进行评价。 二、实验原理 不同组分在同一分离色谱柱上,在相同实验条件下有不同的保留行为,其保留时间的差异可以用来定性分析,每一组分的质量与相应色谱峰的积分面积成正比,因此可以公式计算,用归一化方法测定每一组分的质量百分含量。 1122100A is i i A A A s s ns n f A w f A f A f A =?++???+% 本实验是用气相色谱测定乙酸乙酯、乙酸丁酯及其混合试样,检测器用FID 。用色谱软件进行谱图处理和定量计算,让学生掌握用已知物对照定性、用归一化法测定混合物组分定量的实验。 混和试样的成功分离是气相色谱法定量分析的前提和基础,衡量一对色谱峰分 离的程度可用分离度:12121()2 R R t t R W W -=?+,式中1R t 、2R t 和1W 、2W 分别指两组分的保留时间和峰底宽度,R=1.5时两组分完全分离,实际中R=1.0(分离度98%)即可满足要求。 三、仪器与试剂 仪器:GC7890F 型气相色谱仪、氢火焰离子化检测器(FID )、氮气钢瓶、空气钢瓶、氢气发生器,微量注射器、3mm x 200cm 的10% SE-54不锈钢分离柱。GC5400型气相色谱仪、空气发生器、氮气发生器、氢气发生器,微量注射器、15m 毛细管分离柱。 试剂:乙酸乙酯、乙酸丁酯标准试样及其未知混合试样。 四、实验内容 1.按操作说明书使色谱仪正常运行,并调节至如下条件: 柱温:110C ? 检测器温度:120C ? 气化温度:120C ? 载气、氢气和空气流量分别为30、50和200mL/min 。 2.分别改变柱温至80、90、100、110、120C ?。每改变一次柱温,注入0.5L μ混合
杂质:残留溶剂的指导原则 1.介绍 本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。 药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以及在制剂制备过程中产生或使用的有机挥发性化合物,它们在工艺中不能完全除尽。在合成原料药中选择适当的溶剂可提高产量或决定药物的性质,如结晶型。纯度和溶解度。因此.有时溶剂是合成中非常关键的因素。本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂,也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作出合理的判断。 出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以符合产品规范、GMP或其他基本的质量要求。制剂所含残留溶剂的水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类,表1),除非被证明特别合理,在原药、赋形剂及制剂生产中应避免使用。一些溶剂毒性不太大(第二类,表2)应限制使用,以防止病人潜在的不良反应。使用低毒溶剂(第三类,表3)较为理想。附录1中列出了指导原则中的全部溶剂。
表中所列溶剂并非详尽无遗,其他可能使用的溶剂有待日后补充列人。第一、二类溶剂的建议限度或溶剂的分类会随着。新的安全性资料的获得而调整。含有新溶剂的新药制剂、其上市申请的安全性资料应符合本指导原则或原料药指导原则(Q3A新原料药中的杂质)或新药制剂(Q3B新药制剂中的杂质)中所述的杂质控制原则,或者符合上述三者。 2. 指导原则的范围 指导原则范围包括原料药、赋形剂或制剂中所含残留溶剂.因此,当生产或纯化过程中会出现这些溶剂时。应进行残留溶剂的检验。也只有在上述情况下,才有必要作溶剂的检查。虽然生产商可以选择性地测定制剂,但也可以从制剂中各成分的残留溶液水平来累积计算制剂中的残留溶剂。如果计算结果等于或低于本原则的建议水平,该制剂可考虑不检查残留溶剂,但如果计算结果高于建议水平则应进行检测,以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水平。果制剂生产中用到某种溶剂,也应进行测定。 本指导原则不适用于临床研究阶段的准新原料药、准赋形剂和准制剂。也不适用于已上市的药品。 本指导原则适用于所有剂型和给药途径。短期(如30天或更短)使用或局部使用时,允许存在的残留溶剂水平可以较高。应根据不同的情况评判这些溶剂水平。 有关残留溶剂的背景附加说明见附录2。
第二章气相色谱柱 第一节气相色谱柱的类型 气相色谱法(gas chromatography, 简称GC)亦称气体色谱法,气相层析法。其核心即为色谱柱。 气相色谱柱有多种类型。从不同的角度出发,可按色谱柱的材料、形状、柱内径的大小和长度、固定液的化学性能等进行分类。色谱柱使用的材料通常有玻璃、石英玻璃、不锈钢和聚四氟乙烯等,根据所使用的材质分别称之为玻璃柱、石英玻璃柱、不锈钢柱和聚四氟乙烯管柱等。在毛细管色谱中目前普遍使用的是玻璃和石英玻璃柱,后者应用范围最广。对于填充柱色谱, 大多数情况下使用不锈钢柱,其形状有U型的和螺旋型的,使用U 型柱时柱效较高。按照色谱柱内径的大小和长度,又可分为填充柱和毛细管柱。前者的内径在24mm,长度为110m左右;后者内径在,长度一般在25100m。在满足分离度的情况下,为提高分离速度,现在也有人使用高柱效、薄液膜的10m短柱。 根据固定液的化学性能,色谱柱可分为非极性、极性与手性色谱分离柱等。固定液的种类繁多,极性各不相同。色谱柱对混合样品的分离能力,往往取决于固定液的极性。常用的固定液有烃类、聚硅氧烷类、醇类、醚类、酯类以及腈和腈醚类等。新近发展的手性色谱柱使用的是手性固定液,主要有手性氨基酸衍生物、手性金属配合物、冠醚、杯芳烃和环糊精衍生物等。其中以环糊精及其衍生物为色谱固定液的手性色谱柱,用于分离各种对映体十分有效,是近年来发展极为迅速且应用前景相当广阔的一种手性色谱柱。 在进行气相色谱分析时,色谱柱的选择是至关重要的。不仅要考虑被测组分的性质,实验条件例如柱温、柱压的高低,还应注意和检测器的性能相匹配。有关内容我们将在以后章节中加以详细讨论。 第二节填充气相色谱柱 填充气相色谱柱通常简称填充柱,在实际分析工作中的应用非常普遍。据资料统计,日常色谱分析工作大约有80%是采用填充柱完成的。填充柱在分离效能和分析速度方面比毛细管柱差,但填充柱的制备方法比较简单,定量分析的准确度较高,特别是在某些分析领域(例如气体分析、痕量水分析)具有独特用途。从发展上看,虽然毛细管柱有逐步取代填充柱的趋势(例如已有一些日常分析使用PLOT柱代替过去常用的气固色谱填充柱),但至少在目前一段时期内,填充柱在日常分析中仍是一种十分有价值的分析分离手段。
医药中常用有机溶剂分类及残留限度 医药中常用有机溶剂分类及残留限度 药品的残留溶剂无治疗作用并可能对人体的健康和环境造成危害,本文对国际协调大会(ICH)制订的指导原则及各国执行情况作了较为详尽的介绍。 药品的残留溶剂,又称有机挥发性杂质,是指在活性药物成分、辅料和药品生产过程中使用和产生的有机挥发性化学物质。药品还可被来自包装、运输、仓储中的有机溶剂污染。药品生产商有责任确保终产品中的任何一种残留溶剂对人体无害。 各国药监部门曾使用不同的药品残留溶剂指导原则,为此国际组织展开了协调工作。经相关程序讨论和审查后,国际协调大会的指导原则于1997年7月17日获得通过,被推荐至国际协调大会(ICH)的指导委员会采用。该指导原则要求,如果某个药品的生产或纯化过程可导致溶剂残留,就应对这个药品进行检测,并且只检测生产过程或纯化中使用或产生的那种溶剂。根据使用量的多少,可采用累加的方法计算药品中残留溶剂的量。如果累加量低于或等于指导原则中的推荐量,则该药品无需进行残留溶剂检测;如果累加量高于推荐量,则必须对该药品进行残留溶剂检测。该指导原则适用于颁布以后上市的所有剂型和给药途径,但不适用于在临床研究阶段使用的潜在新药和新辅料,也不适用于已上市的现有药物。在某些情况如短期(小于30天)或局部应用下,视具体情况,溶剂的高残留量也可接受。 按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估): 第一类溶剂 是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。在可能的情况下,应避免使用这类溶剂。如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如: 苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。
毛细管色谱法测定洛美沙星中的有机溶剂残留量 来源: 作者:王国成,陈莹,徐波 摘要:目的:建立毛细管气相色谱法测定洛美沙星中的有机溶剂残留量。方法: 用INNOWAX 毛细管气相色谱柱,FID检测器, 以22戊酮为内标进行测定。结果: 乙酸乙酯、四氢呋喃、乙醇、乙腈的线性范围分别为0~80μg/m l ( r =0.999 7)、0~11.52μg/ml( r=0.9996)、0~80μg/ml( r=0.9997) , 0~6.56 μg/ml( r= 0.9996);平均回收率分别为100.5%、100.1%、101.2%、100.1%; RSD 分别为1.30%、0.9%、1.18%和1.23% (n = 9)。结论: 本方法简单、准确、灵敏度高、重现性好, 适用于洛美沙星中有机溶剂残留量的测定。 关键词洛美沙星,毛细管气相色谱法,有机溶剂残留量 药物生产过程中残存的有机溶剂均有不同程度的毒性, 不仅对人体有害, 而且这些溶剂与药物的治疗作用无关, 原则上应愈少愈好。洛美沙星为第三代喹诺酮类广谱抗菌药, 是由日本北陆株式会社研制的第一代口服长效抗菌药。该药物在合成过程中采用了乙酸乙酯、四氢呋喃、乙醇、乙腈等有机溶剂, 故对此4种有机溶剂加以检测有利于药物质量控制。本试验采用毛细管色谱法测定洛美沙星原料药中有机溶剂的含量,方法简便,结果准确可靠。 1 仪器与试剂 Agilent6890 增强型气相色谱仪, Agilent6890 工作站。乙酸乙酯、四氢呋喃、乙醇、乙腈均为分析纯(上海化学试剂公司) , 22戊酮(内标物) 为色标试 剂(天津化学试剂一厂) , 1-甲基-2-吡咯烷酮, 溶解样品用溶剂为化学纯(上海化学试剂公司)。 2 方法与结果 2.1 色谱条件色谱柱: Agilent HP-NNOWAX (固定液为键合聚乙二醇, 30m×0.53mm,1.0μm) 毛细管柱; 气化室温度: 220℃; 程序升温: 起始温度为40℃, 保持10min, 然后以20℃/min 升温至220℃,保持4 min;载气为氮气;分流比:1∶1; 进样量2μl; 检测器温度: 氢焰离子化检测器(FID) , 240 ℃。 2.2 溶液及试样制备 2. 2. 1 内标溶液的制备精密量取色标试剂2-戊酮124.0μl (约相当于100mg) , 置100ml 量瓶中, 用1-甲基-2-吡咯烷酮稀释至刻度, 摇匀; 精密量取1m l, 置10ml容量瓶中, 用1-甲基-2-吡咯烷酮稀释至刻度, 摇匀, 作为内标溶液。 2. 2. 2 对照溶液的制备精密量取乙酸乙酯111. 1μl (约相当于100mg) , 乙醇126.6μl(约相当于100mg) 置100ml 量瓶中, 用1-甲基-2-吡咯烷酮稀释至刻度,摇匀,作为对照贮备液A; 精密量取四氢呋喃162.2μl(约相当于144m g) , 乙腈105.0μl (约相当于82mg) 置100ml量瓶中, 用1-甲基-2-吡咯烷酮稀释至刻度, 摇匀, 作为对照贮备液B。精密量取对照贮备液A 10ml 与对照贮备液B 1ml 置同一100ml 量瓶中, 用1-甲基-2-吡咯烷酮稀释至刻度, 摇匀, 作为对照贮备液。精密量取对照贮备液5ml, 置10ml 量瓶中,精密加入内标溶液 1ml, 加1-甲基-2-吡咯烷酮稀释至刻度, 摇匀, 即得对照溶液。 2. 2. 3 供试品溶液的配制取本品约0.1g, 精密称定, 置10ml 量瓶中, 精密加入内标溶液1ml, 加1-甲基-2-吡咯烷酮适量, 振摇使溶解并稀释至刻度, 摇匀,作为供试品溶液。 2.3 系统适用性试验精密量取对照品溶液2μl, 注入气相色谱仪, 记