
第一章
1、什么叫做腐蚀?
腐蚀是金属与环境间的物理化学相互作用,其结果使金属的性能发生变化,并常可导致金属、环境或由它们作为组成部分的技术体系的功能受到损伤。
2、腐蚀的各种保护方法及分类?
腐蚀依据环境介质可分为:
⑴自然环境腐蚀⑵工业环境腐蚀
依据受腐蚀材料的类型划分:
⑴金属腐蚀⑵非金属材料腐蚀
根据腐蚀的形态可分为:
⑴均匀(全面)腐蚀
⑵局部腐蚀:孔蚀、缝隙腐蚀、晶间腐蚀、应力腐蚀破坏、腐蚀疲劳、氢腐蚀破坏、选择腐蚀、磨损腐蚀、脱层腐蚀
根据腐蚀的作用原理可分为:
⑴电化学腐蚀(介质不同分类:大气腐蚀、土壤腐蚀、电解质溶液腐蚀)
⑵化学腐蚀(介质不同分类:气体腐蚀、非电解质溶液腐蚀)
另一种分类:
1)干腐蚀:在干气体(通常是在高温)或非水溶液中的腐蚀(化学腐蚀)
2)湿腐蚀:在水溶液中的腐蚀(典型电化学腐蚀)
依据腐蚀的形态可分为:
⑴普遍性腐蚀⑵局部腐蚀⑶应力腐蚀开裂(断裂)海洋防腐的各种措施:
(1)应针对具体使用工矿和环境条件合理选用相对耐腐蚀的结构材料。
(2)根据防腐蚀设计的要求可选择有机涂层、无机涂层、化学转化膜等非金属涂层,电镀、化学镀、热浸镀、喷镀、扩散镀等金属镀层以及离子注入和金属、非金属衬里等涂镀层和表面改性技术。
(3)通过干燥除湿、脱气、脱盐等措施除去环境介质中的腐蚀组分,或者向环境介质中添加有机、无机类缓蚀剂等环境(介质)处理。
(4)可根据环境介质和工矿要求采用外加电流阴极保护技术、牺牲阳极的阴极保护技术或电化学阳极保护技术等电化学保护。
(5)防腐蚀结构设计、防腐蚀强度设计、防腐蚀方法选择、耐蚀材料选择以及符合防腐蚀要求的制造工艺确定等防腐蚀设计。
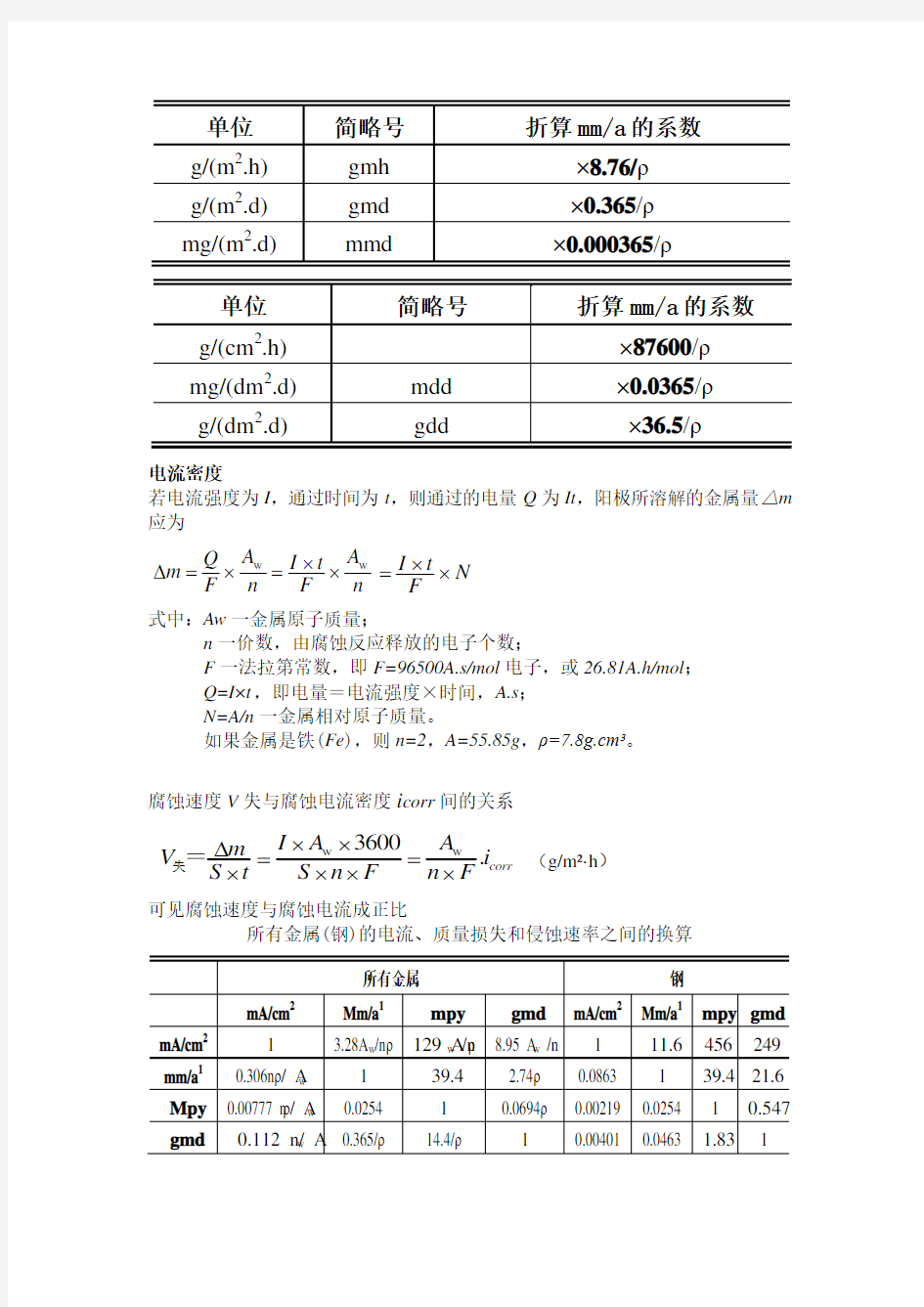
3、金属腐蚀速度评定?(重点)
式中:VL-深度腐蚀速度,mm/a;
Vˉ-质量损失表示的速度,g/m2·h;
ρ-金属的密度,g/cm3。
按深度表示腐蚀速度的单位还有mm/y(或mm/a)、英寸/年(ipy)、密尔/年(mpy)。
根据金属的密度ρ(g.cm3),由以重量变化表示的腐蚀速率可以换算成年浸蚀深度:
mm/a×2.74×ρ(g.cm3)=gmd gmd×0.365/ρ(g/cm3)=mm/a
单位 简略号 折算mm/a 的系数
g/(m 2.h) gmh ×8.76/ρ g/(m 2.d) gmd ×0.365/ρ mg/(m 2.d)
mmd
×0.000365/ρ
单位 简略号 折算mm/a 的系数
g/(cm 2.h) ×87600/ρ mg/(dm 2.d) mdd ×0.0365/ρ g/(dm 2.d)
gdd
×36.5/ρ
电流密度
若电流强度为I ,通过时间为t ,则通过的电量Q 为It ,阳极所溶解的金属量△m
应为
w w A A Q I t m F n F n ??=
?=? I t N F ?=?
式中:Aw 一金属原子质量;
n 一价数,由腐蚀反应释放的电子个数;
F 一法拉第常数,即F=96500A.s/mol 电子,或26.81A.h/mol ; Q=I×t ,即电量=电流强度×时间,A.s ; N=A/n 一金属相对原子质量。
如果金属是铁(Fe ),则n=2,A=55.85g ,ρ=7.8g.cm3。 腐蚀速度V 失与腐蚀电流密度i corr 间的关系
(g/m2
·h )
可见腐蚀速度与腐蚀电流成正比
所有金属(钢)的电流、质量损失和侵蚀速率之间的换算
所有金属 钢
mA/cm 2 Mm/a 1 mpy gmd mA/cm 2 Mm/a 1 mpy gmd
mA/cm 2 1 3.28A w /n ρ 129 A w /n ρ 8.95 A w /n
1 11.6 456 249 mm/a 1 0.306n ρ/ A w 1 39.4 2.74ρ 0.0863
1
39.4 21.6 Mpy 0.00777 n ρ/ A w 0.0254 1 0.0694ρ 0.00219 0.0254
1
0.547 gmd
0.112 n/ A w
0.365/ρ
14.4/ρ
1
0.00401 0.0463 1.83
1
w w 3600.corr I A A m V i S t S n F n F ???==????失=
第二章
1、电化学反应
(化学反应式) 式中:“Red ”代表还原剂(电子授予者); “O k ”代表氧化剂(电子接受者); “n ”是参与反应的的电子(e-)数。
式中的氧化剂和还原剂通常被称为氧化还原对,其反应称之为氧化还原反应。
当电流沿一个方向或相反方向通过电极表面时,便产生某种电化学反应,该反应被称之为电极反应。
在阳极发生的电极反应为阳极反应,恒为氧化反应,反之,阴极反应恒为还原反应。在无氧时析氢,有氧时还原氧气生成氢氧根
按照电化学定义规定,电极电位较低的电极称为负极;电极电位较高的电极称为正极。
发生氧化反应的电极称为阳极(阳极金属溶解);发生还原反应的电极称为阴极。
靠外接电源供给电流的电化学电池被称之为电解电池,本身能产生电流的电化学电池被称之为原电池。 2、原电池
所谓原电池是自身能产生电流的电化学电池,即将化学能转变成电能的装置称为原电池,它利用氧化还原反应产生电流。 3、自由能与腐蚀电池
式中:ΔG 一电化学反应系统自由能值,J/mol ;
Q 一1克离子的腐蚀产物金属离子所携带的电荷的电量; E 一驱动电压,v ;
n 一参加反应的电子数;
F 一法拉第常数,96500 C/mol 。
在标准条件下,电池反应的标准自由能ΔG0与电池的标准电位差E0直接相关。 用代数方法通过电极电位得到电池的电动势
在丹尼尔腐蚀电池中,铜(得到电子)的标准电位为0.337伏;锌(失去电子)的腐蚀电位为-0.763伏;
腐蚀电池的定义:只能导致金属材料破坏而不能对外界作功的短路原电池。 过程:
(1)阳极过程:金属溶解,以离子形式进入溶液,并把等量电子留在金属上; (2)电子转移过程:电子通过电路从阳极转移到阴极;
(3)阴极过程:溶液中的氧化剂接受从阳极流过来的电子后本身被还原。
Red k O ne +?G=Q E=-n F E ????cathode anode E E E =-=0.337--0.763=1.11v cathode anode E E E =-(
)
★腐蚀电池的种类和特点: 种类:(1)宏观腐蚀电池 大电池(宏观腐蚀电池):指阳极区和阳极区的尺寸较大,区分明显,肉眼可辩。 大电池的腐蚀形态是局部腐蚀,腐蚀破坏主要集中在阳极区。 ①以金属接触腐蚀 ②浓差电池 ③温差腐蚀电池
⑵微观腐蚀电池 微电池(微观腐蚀电池):指阳极区和阴极区尺寸小,肉眼不可分辨。
如果微电池的阴、阳极位置不断变化,腐蚀形态是全面腐蚀;如果阴、阳极位置固定不变,腐蚀形态是局部腐蚀。 ①金属化学成分不均匀引起的微电池 ②金属组织的不均匀引起的微电池
③金属表面的物理状态不均匀引起的微电池 ④金属表面膜不完整引起的微电池 腐蚀电池的特点:
(1)腐蚀电池的阳极反应是金属的氧化反应,结果造成金属材料的破坏。 (2)腐蚀电池中的反应是以最大限度的不可逆方式进行。 (3)腐蚀电池的阴、阳极短路(即短路的原电池),电池产生的电流全部消耗在内部,转变为热,不对外做功。 影响因素:
(1)微观腐蚀电池-金属方面 ? 成分不均匀
? 组织结构不均匀 ? 表面状态不均匀 ? 应力和形变不均匀 ? 热处理差异
(2)宏观腐蚀电池-环境方面 ? 金属离子浓度差异 ? 氧含量差异 ? 温度差异
(3)亚微观腐蚀电池-电极表面十分微小 4、电极电位(P15)
金属和溶液两相之间的电位差叫做电极系统的电极电位,简称电位,记为E 。 电极电位的相对值是可以进行测量的
△E =E 待测 - E 参考
5、平衡电极电位和非平衡电极电位(平衡电极电位可用Nernst 公式计算)
处于热力学平衡状态的电极体系(可逆电极),由于氧化反应和还原反应速度相等,电荷交换和物质交换都处于动态平衡之中,因而净反应速度为零,电极上没有电流流过,即外电流等于零。这时的电极电位就是平衡电极电位。
(注意此处要多一个系数2.3)
RT ()log k F
cathode anode E E E n =--
R 一表示气体常数,8.314J/(K·mol); T 一表示绝对温度(=℃+273.16℃); n 一表示参加反应的电子数;
F 一表示法拉第常数,96500 C/mol ; k 一表示反应的平衡常数。
式中:aM 、aL 、aQ 、aR 一分别表示物质M 、L 、Q 、R 校正后的压力或浓度值,称为活度。
活度aL 表示L 溶解物质等于每千克水中溶解的摩尔数(重量摩尔浓度)乘以叫做活度系数的修正因子γ。即 ai=γi[i] (mol/l)
式中:[i]一表示物质i 的摩尔浓度; γi 一表示物质i 的和活度系数。 假如L 是气体,它的活度等于它的逸度,常压时近似地等于以大气压为单位的气体压力。
对气体:aj=Pj/Po (mol/L ) 气体浓度:Cj=ajAw (g/L )
式中:Pj 一表示气体分压,Po=1atm=101KPa ;
Aw 一表示原子量(g/mol )。
纯固体的活度被人为地规定为1。同样,对于像水这样在反应中浓度始终保持恒定的物质,其活度也假设为1。 6、标准电极电位
标淮电极电位是指参加电极反应的物质部处于标准状态,即25℃,离子浓
度为1,分压为1×105 pa 时测得的电势(氢电极为参比电极):标准电极电位用 表示,可用奈恩斯特公式计算。★诺斯特公式
7、自由能(P20 例题) 反应自由能变化值△G
式中:
一为化学反应式各物质的系数,规定反应物系数取负值,生成物系数取正值;
一相应物质在给定体系中的化学位。 △G<0 自发进行; △G =0 平衡状态; △G>0 非自发过程。
......
lL mM qQ rR ++→++q r Q R i m L M a a K a a
=
0Cathode anode
0.0592-E log E E K n =-()i i i i i i i i i
G==-γμγμγμ?∑∑∑
反应物生成物()()i γi μ
8、平衡电位和标准电位 (P22 例题)
anode cathode anode anode cathode anode cathode anode E
则电位为的金属自发进行腐蚀平衡状态则电位为的金属不会自发进行腐蚀
腐蚀判断依据:
⑴用系统的标准电极电位作为判据
(2)使用金属在非标准状态下和非平衡状态下电极电位作为腐蚀倾向判据 例3 金属在同空气接触的中性介质(PH=7)时,依靠氧化还原(去极化)反应进行腐蚀,试确定金属可能发生腐蚀的可逆电位边界(介质温度25℃,空气中
氧分压 =21278.25Pa )
-2240OH 2
O H O
74()0.0592/4log(
)
(10)0.4010.0592/4log 0.805V
21278.25/101325
a E E p a
-=-?=-?=
所以只有在中性溶液中的可逆电位比0.805V 更小的金属才有可能在25℃的中性溶液中依靠氧放电的去极化作用维持电化学腐蚀过程。 9、水的电位-pH 图
在25℃,P0=1atm 大气压的标准条件下的析氢反应: 2pO 22
244O H O e OH -
++?2
22H e H +-
+→22
2
00H 0.05920.0592log[](log p a )H H H H H E E K E n
n
++
=-=-+H ()-2log
E H =-0.0592pH
对水溶液中的氧气可发生析氧反应:
高于b 线,发生析氧反应,为O 2的稳定区;低于a 线,可发生析氢反应,为H 2的稳定区;在a-b 线之间,水是稳定的。 10、铁的电位-pH 图
(1)反应只与电极电位有关,而与溶液的pH 无关;水平线代表不包含pH 值的反应,也就是既不包含H+,也不包含OHˉ。
取 =10-6mol/L ,E=0.617,得到一条水平线。
04812-0.8-1.600.8pH E ,V (S H E )
2
HFe -
24
FeO -
23Fe O Fe 2Fe +
3Fe +34
Fe O a b ①②③
④⑤⑥⑦⑧⑨免蚀
析氧且酸性化在1atm 下, 水的热力
学稳定区域
析氢且碱性化H pH loga +
=-2
2442O H e H O +-
++→2200.0592log[] 1.2290.05921O O
E E K pH =-=-22Fe e Fe +-
+→
(2)反应只与溶液的pH 有关,而与电极电位无关,垂直线包含H+或OHˉ。
pH= -0.24-1/3 log(Fe3+)取 = =10-6mol/L ,pH=1.76为一垂直线
(3)反应既与溶液的pH 有关,又与电极电位有关,斜线既包含H+、OHˉ,又包含电子。
取 =10-6mol/L ,得E=1.0832-0.1776pH 。
11、各线反应对应公式 ④线反应为
⑤线反应为
⑥线反应为 ⑦线反应为 ⑧线反应为 220
0.05921log 0.4400.0296log()Fe Fe E E a n a ++
=-=-+3223
236Fe H O Fe O H ++
+?+33log 6log()2log()62log()H Fe Fe K a a pH a +++=-=--22
60.05920.05920.728(log()log())
22Fe H E a a ++=-+22
06
()0.0592log ()Fe H a E E n a ++=-6
32
()()H K Fe ++=223
26223Fe O H e Fe H O +-+
++→+2260.05920.05920.728(log()log())22Fe H E a a ++=-+32e Fe Fe ++
+?+
233423O +2H 2e 2O +H O Fe Fe +?+342O +8H 8e 3+4H O Fe Fe +?+3+
34
2O +8H 8e 3+4H O Fe Fe +?-+
3
2HFeO +3H 2e +2H O Fe +?
⑨线反应为
11、 电位一PH 图在腐蚀中的应用
Fe 一H 2O 体系的电位Fe 一pH 图,25℃
(1)腐蚀区:在该区域内处于稳定状态的是可溶性、和离子,因此,对金属而言处于不稳定状态,可能发生腐蚀。
(2)免蚀区:在此区域内金属处于热力学稳定状态,因此不会发生腐蚀。 (3)钝化区:在此区域内的电位和pH 值条件下,生成稳定的固态氧化物,氢氧化物或盐膜,因此在此区域内金属是否遭到腐蚀,取决于所生成的固态模是否有保护性能,即看它能否进一步阻碍金属溶解。
电位-pH 图主要用途是:
1)预测反应的自发发生,从热力学判断金属腐蚀趋势。 2)估计腐蚀产物的成分。
3)预测减缓和防止腐蚀的环境因素,选择控制腐蚀的途径。
为了使铁免于腐蚀,可设法使其移出腐蚀区,具体有三种途径:
1)将铁的电极电位降低至免蚀区,即对铁施加阴极保护,也可采用牺牲阳极法,即用电位负的锌和铝合金与铁相连,构成腐蚀电偶;或用外加直流电流的负端与铁相连而正端与辅助阳极相连,构成回路,都可得到保护而免于腐蚀。 2)把铁的电位升高使之进入钝化区。这可通过阳极保护法或在溶液中添加阳极型缓蚀剂或钝化剂来实现。应当指出,这种方法只适合可钝化的金属,有时由于钝化剂加入量不足,或者阳极保护参数控制不当,金属表面保护膜不完整,反而会引起严重的局部腐蚀。
3)调整溶液的pH 值至9-13之间,也可使铁进入钝化区。应当注意如果由于某种
-+
32HFeO +3H 2e +2H O
Fe +?
原因、(如铁中有一定量的CI-离子存在)不能生成氧化膜,铁将不钝化而继续腐蚀。
12、腐蚀动力学
腐蚀电池的极化现象
阳极电压变得更正,阴极电压变得更负。当电流加之电极表面时,电极电位引起变化,其值变为E 1,这是被称为极化,通常用 表示。
极化原因及类型
电池极化实质上是指电池中两个电极分别发生极化的结果,即阳极极化和阴极极化。阳极电流电极电位向正的方向变化叫阳极极化。
原电池在通过电流时,阴极电流电极电位向负的方向移动,这种现象称为阴极极化(概念)。
产生阳极极化的原因是:
04
812-0.8-1.60
0.81.6pH E ,V
3
()Fe OH 2
()
Fe OH Fe 2
HFeO -3Fe
+
2Fe +
轻微点蚀严重点蚀钝化区均匀腐蚀不敏感
免蚀区阴极保护阳极保护
化学钝化区η01E
E -=ηi/A.cm -1E /V
E o,c
E o,a
E c
E a
E 10,c c c c E E E η=?=-接通前接通后0,a a a a
E E E η=?=-I 1E 0
A
C
I max
(1)浓差极化(扩散过电压) (2)活化极化 (3)IR 位降
与极化相反,凡是能消除或减缓极化从而增大回路中电流的作用称之为去极化,能够减少或消除极化作用的物质称为去极化剂。去极化剂是活化剂,它起加速腐蚀的作用;海水中的氧,对腐蚀电池阳极极化起去极化作用称做阳极去极化。对阴极起的去极化作用称为阴极去极化
凡是在电极上吸收电子的还原反应都能起到去极化作用。阴极去极化反应一般有下列几种类型: (1)阳离子还原反应 (2)析氢反应
(3)阴离子的还原反应 (4)中性分子的还原反应
(5)不溶性膜或沉积物的还原反应 13、腐蚀速率的图解分析法
(1)阳极极化控制:Pa >> Pc , R 可以忽略,I 取决于Pa ,如果以Sa 表示阳极控制程度,则可得:
(2)阴极极化控制:Pc >> Pa , R 可以忽略,I 取决于Pc ,如果以Sa 表示阳极控制程度,则可得:
(3)混合控制:Pc= Pa , R 可以忽略 (4)欧姆控制或电阻控制: R 很大
(1) (2) (3) (4)
14、电化学保护基本原理(两个原理) 主要有阳极保护和阴极保护两种类型 (1)阴极保护
1)可从热力学上对阴极保护进行解释
%100%100%100,0,0?-?=??
+
?
+?
?=?++=a c a R c a a R c a a E E E E E E E P P P P S a
%100%100%100,0,0?-?=
??+?+??=?++=a c c R c a c R c a c E E E E E E E P P P P S c %100%100%100,0,0?-?=??+?+??=?++=a
c R R c a R
R c a R E E E E E E E P P P P S R
从图中可以看出,当pH 为7时铁处于活化腐蚀状态,使其电位上升(阳极保护)或下降(阴极保护),都可实现保护的目的。 2)阴极保护原理也可用腐蚀电极的极化图进行解释
金属表面阳极和阴极的初始电位分别为Ea 和Ec 。金属腐蚀时,由于极化作用,阳极和阴极的电位都接近于交点c 所对应的腐蚀电位Ecorr ,与此相对应的腐蚀电流为Icorr 。在腐蚀电流作用下,金属上的阳极区不断发生溶解,导致腐
i appl i corr log 电流
E a E c E corr 电位
a b c d
e f 当结构物电位降低时,阴极保护电流
用量增加
i ′corr i c i a
04
812-0.8
-1.6
0.8
1.6
pH E ,V
3
()Fe OH 2
()Fe OH Fe
2HFeO -
3Fe +
2Fe +
轻微点蚀
严重点蚀
钝化区
均匀腐蚀
不敏感
免蚀区阴极保护
阳极保护
化学钝化区
蚀破坏。
如当腐蚀电位由于外电流b-e 的作用而从图中的Ecorr 移到a 点,此点对应的电位是结构物有阴极保护的电位值。腐蚀电流由Icorr ,降低到I′corr 。I′corr 为由阴极保护的电流密度。总的阴极电流(腐蚀电流加外电流)等于a-e 。当外电流b-e 增加时,a 点电位变得越来越负,并且腐蚀电流a-b 也变得越来越小。最后a 和Ea 重合,腐蚀电流a-b 变成零,完全保护时的外电流等于iappl 。 3)牺牲阳极保护法
如图中的电位较高的金属M1(如Fe )在未耦合前,其微阴极和微阳极的极化曲线相交于H 点上,对应于腐蚀电位E 1和自腐蚀电流I 1;电位较低的金属M 2(如Zn )具有自腐蚀电位E 2和自腐蚀电流I 2。当M 1和M 2在海水中接触时组成宏观电偶时M 2为阳极,它的腐蚀溶解提供了进一步阴极极化的电流,得电偶电位EE 和电流Ig (FK 为总阳极极化曲线)。
'
221221/()//()
g g y I I I I I I I I ==-≈很小
式中:Ig 一表示电偶电流;
I 1一表示阴极金属自腐蚀电流; I 2一表示阳极金属自腐蚀电流。
上式表明耦合后阳极金属M 2溶解增加的倍数,y 越大则腐蚀越严重。若M 2
能提供更大的电流使M 1的腐蚀电流为零,则M 2的腐蚀电流更大,接近于总的电流,这也是牺牲阳极保护法的原理。 (2)阳极保护
对腐蚀介质中的金属结构物进行阳极极化,使其表面形成钝化膜,并通电维持其钝化状态,从而显著降低腐蚀速度的保护措施称为阳极保护。
当电极发生阳极极化而电位正移时,金属由活化腐蚀区过渡到钝化稳定区,使腐蚀过程的阴极控制变为阳极控制。只有能够发生阳极钝化的情况下才适用于该方法,极化状态必须保持在钝化区。
A H K N
J
B C
D F
E 1E E E 2
Ig I 2I 1'
1I '2I 电位
LogI
在一定条件下,当金属的电位由于外加阳极电流或局部阳极电流而移向正方时,使原先活泼地溶解着的金属表面状态会发生某种突变(以氧化物膜或吸附膜形式存在),由于这种突变,而使金属溶解速度急剧下降,金属表面状态的这种突变过程称为金属的钝化。
金属钝化后所获得的耐蚀性质称为钝性。 钝化后所处的状态称为钝态。
如果电位偏移所需要的电流具有如下图所示的普遍极化行为,该金属是活化一钝化的,并能实现阳极保护。只有少数系统表现出这种行为,值得重视并可以利用。通过使金属电位偏移到它在图中所示的钝态范围的电位值,该活化一钝化金属的腐蚀速率就能被极大地减小。为使金属电位从腐蚀电位Ecorr 向阳极方向移动所需要的电流比维持电位值在钝态所必需的电流要大几个数量级。在被表示为Epp 的致钝电位时该电流将达到峰值(图)。
图中的整条阳极极化曲线被四个特征电位值(金属自腐蚀电位Ek ,m 、致钝电位Epp 、维钝电位Ep 及过钝化电位Etp )分成四个区域。
(1)A ~B 区:从Ek ,m 至Epp ,为金属的活化溶解区; (2)B ~C 区:从Epp 至Ep ,为活性-钝化过渡区;
(3)C ~D 区:从Ep 至Etp ,金属处于稳定钝态,故称为稳定钝化区; (4)D ~E 区:电位高于Etp 的区域,称为过钝化区。
为实现钝化,必须超过临界电流密度(ipp )。然后必须把阳极电位维持在钝态区,不让它回到活化区或进入过钝化区,否则在这些区域保护性的阳极膜将会受损,甚至完全破坏。它遵守这样的规律,即为产生钝化可能需要很高的电流密度(>ipp ),但要维持它只需要较小的电流密度;在钝态区,腐蚀速率相应于维钝态电流密度(ip )。
04812-0.8-1.600.81.6
pH E ,V
3
()Fe OH 2
()Fe OH Fe 2
HFeO
-3Fe +
2Fe
+
轻微点蚀
严重点蚀钝化区
均匀腐蚀不敏感
免蚀区阴极保护
阳极保护化学钝化区
由钝化曲线(图)可以看出,阳极保护的主要参数是:
①致钝电流密度或临界电流密度(ipp ),是产生钝化所需的最小阳极极化电流密度A.m2,它相当于金属阳极溶解的最大值,只有超过此值的电流部分才能形成钝化膜。极化电流密度(i )越大,转化为钝化状态所需的时间(t )越短,其间大体有如下关系:
(i-ipp)×t =常数
实际应用中要求ipp 越小越好,若太大则极化初期消耗功率大,使设备庞大而造价较高。
②维钝电流密度或稳定钝化电流密度(ip ),是钝化状态下维持电位稳定所需的电流密度(A.m2),它主要用于补充钝化膜的溶解。因此,ip 越小越好,且消耗电能少。根据电解定律可以求出钝化膜的溶解速度Km 与ip 的关系为:
Km =N×ip/26.81(g.m-2.h-l)
式中: N -钝化膜的化学当量,g ;ip -钝化膜的维钝电流密度,A.m2;26.8—电化学当量,A.h ,26.81A.h =96500C 。
③钝化(区)电位(Etp ),是使金属维持钝化状态的电位,其范围越宽越好。 应用
阳极保护已经用于储罐、工艺反应器、热交换器和盛装各种腐蚀性溶液的运输罐 。
i k E k,m
i pp
i p logi E tp
E p
低← 电位→ 高
A B
C D
M N 活化区
活化-钝化过渡区钝化区过钝化区M →M n++ne -M n++ne -→M E pp 123K i corr E corr h
维钝电流密度腐蚀电流密度E O2i max i s 自腐蚀电流密度最大电流密度
临界电流密度
二次电流密度
析氧电位
过钝化电位腐蚀电位
维钝电位
致钝电位自腐蚀电位
第三章
1、海洋大气腐蚀
按金属表面速度可将大气腐蚀分为三类:
①在空气干燥的情况下,金属表面不存在水膜的腐蚀称为干大气腐蚀; ②相对湿度足够高,金属表面存在不可见水膜,这是存在的腐蚀称为潮大气腐蚀; ③当大气相对湿度接近100%,以及当水分以雨、雪、霜滴等形式直接落在金属表面,金属表面存在肉眼可见的水膜,此时发生的腐蚀称湿大气腐蚀。
习惯上把腐蚀环境分为乡村大气、城市大气、工业大气和海洋大气或者是这些的组合。
海洋大气腐蚀的电化学特征
它是电化学腐蚀的一种特殊形式,是金属表面处于薄层的电解液下的腐蚀过程。
阳极反应:2Fe→2Fe 2++4e -; 阴极反应:O 2+2H 2O+4e -→4OH - ⑴阴极过程
大多数金属和合金的大气腐蚀析氢反应是可以忽略,2H ++2e -→H 2
在接近中性的海洋大气溶液中主要依靠氧的去极化作用,通常的反应式为:O 2+2H 2O+4e -→4OH -;过氧化氢作为一种中间介质,其反应分两步:
⑵阳极过程
海洋大气腐蚀的影响因素
在海上大气中的腐蚀不同于在海水中的腐蚀,其特点主要是腐蚀金属表面上的电解液层厚度小。海上大气腐蚀速度取决于距离海面的高度、近海距离、风速、降露周期、空气湿度,降水量、温度、太阳照射、季节、尘埃、各种污染杂质和水的聚集状态。 1、气候因素 ①水分与表面润湿时间 ②温度 ③灰尘量 ④日照时间 ⑤离海岸的距离 ⑥风向与风速 2、气体杂质 ①二氧化硫 ②氯化物 ③其他的大气污染 3、盐粒 4、金属表面因素 ①金属表面状态 ②腐蚀产物的影响 2、海洋浪花飞溅区腐蚀
在海洋环境中,海水为飞沫能够喷洒到其表面,但在海水涨潮时又不能被海水所浸没的部位一般称为浪花飞溅区。 海洋腐蚀最大发生在飞溅区的原因是什么?
(1)在浪花飞溅区,当风和海水同时作用造成强烈的海水运动时,海水的冲击会加剧飞溅区的破坏; (2)在浪花飞溅区的干湿交替过程中,钢的阴极电流比在海水中的阳极电流大; (3)在飞溅区,材料几乎经常为充分充气的海水所润湿,干湿交替。在这个区域没有生物沾污;同时,光照和浪花冲击破坏金属的保护膜,造成腐蚀最为强烈。
2222222O H O e H O OH --
++→+2222H O e OH --+→n M M ne +-
→+
在海洋环境有三个腐蚀峰值,
●一个峰值发生在平均高潮线以上的浪花飞溅区,是钢铁设施腐蚀最严重的区
域,也是最严峻的海洋腐蚀环境。这是因为在这一区域海水飞溅、干湿交替,氧的供应最充分,同时,光照和浪花冲击破坏金属的保护膜,造成腐蚀最为强烈,年平均腐蚀率为0.2~0.5毫米;
●第二个峰值通常发生在平均低潮线以下0.5~1.0米处,因其溶解氧充分、
流速较大、水温较高、海生物繁殖快等,年平均腐蚀率为0.1~0.3毫米;
●第三个峰值是发生在与海水海泥交界处下方,由于此处容易产生海泥/海水
腐蚀电池,年腐蚀率为0.03~0.07毫米。
3、海洋潮差区金属的腐蚀
随潮水涨落而干湿交替,通常有充足的氧气。较大的潮汐运动会导致侵蚀速率增大。海洋生物会在潮汐区的金属表面上寄生。这种寄生有时能使钢的表面得到部分的保护,对不锈钢则会加速局部侵蚀。
潮差区是指海水平均高潮线与平均低潮线之间的区域。该区的特点是涨潮时被水浸没、退潮时又暴露在空气中,即干湿周期性的变化。
海水线腐蚀现象
腐蚀发生在金属-海水-空气三相的相界处。随氧气的消耗,腐蚀不断进行,最后沿海面表面材料出现强烈的水线腐蚀。
4、海水全浸区的腐蚀
影响因素
⑴含盐量(盐度)
⑵电导率的影响
⑶溶解氧
⑷无机化合物
⑸有机化合物⑹pH值
⑺海水温度
⑻海水流动与停止
⑼污染海水
⑽沿海微咸水
5、海泥区对金属的腐蚀
海生物对腐蚀的影响体现在
(1)海生物附着不完整、不均匀时,腐蚀过程将局部的进行,附着层内外可能产生氧浓差电池腐蚀(腐蚀机理)。
(2)由于生物的生命活动,局部改变了海水介质的成分。
(3)某些海生物生长时能穿透海漆保护层或其它表面保护层,直接破坏了保护涂层。
影响因素
海生物的污损程度还与海洋环境有关。热带海域海生物生长壮盛,海生物污染严重。两极海域温度低,基本上不存在海生物污染。表层海水要比深海海水海生物污染严重,近岸海水海生物污损也比较严重。
海洋微生物的腐蚀机理
好氧菌引起的腐蚀,常常是由于它们产生的新陈代谢具有腐蚀性,通常这类代谢产物是酸包括无机酸和有机酸。
海洋钻井设备的的腐蚀
①钻井液②氧气③硫化氢④二氧化碳⑤盐类⑥温度
海洋采油设备的腐蚀(主要由采出水引起)
采出水对腐蚀的影响因素有:
①溶解氧②二氧化碳;③硫化氢;④细菌腐蚀;
⑤溶解盐类;⑥PH 值;⑦水温;⑧流速;⑨空泡腐蚀。 各种腐蚀的防护措施
第四章
典型失效形式:均匀腐蚀、点蚀、电偶腐蚀、缝隙腐蚀、应力腐蚀、氢脆、疲劳腐蚀、设备中的焊接腐蚀 1、(非)均匀腐蚀
均匀的表面腐蚀是指在金属表面上几乎以相同的速度所进行的腐蚀,这与在金属表面上所产生的任意形态的全面腐蚀不同。
均匀腐蚀影响因素
腐蚀速度与腐蚀机理、材料以及海水成分、通气与否、湿度以及流动速度等有关。
2、坑点腐蚀
金属表面局部区域内出现的腐蚀称为点蚀,表面的其余部分则往往无任何明显的腐蚀。
一般来说,点腐蚀是由于材料表面上形成腐蚀电池而致,它可分为差异充气电池的点腐蚀和钝化材料的点腐蚀。
坑点腐蚀影响因素
(1)对于形成充气电池的点腐蚀,若材料表面状态不均匀,例如粘着有扎制铁鳞或铁鳞受到油漆膜的保护,只要腐蚀剂稍有腐蚀性,就会由于形成充气电池而促进点腐蚀。
(2)对于钝化材料,只有超过点腐蚀临界电位时才会出现点腐蚀。 (3)从腐蚀剂角度考虑,点腐蚀电位的高低首先和引起点腐蚀的离子浓度有关。
海洋腐蝕內容及形
式电化学与生物作用
协同产生的腐蚀电化学与机械作用协同产生的腐蚀
单纯电化学腐蚀局部腐蚀
全面腐蚀(海洋大气腐蚀中的常见形态)应力腐蚀破裂沟状腐蚀异种金属电偶腐蚀、涂膜下丝状腐蚀不锈钢点饰、铝合金剥蚀、缝隙腐蚀
恒定应力下的腐蚀交变应力下的腐蚀磨损腐蚀(振动、冲刷、空泡)
腐蚀疲劳大型海生物腐蚀及污损微型海生物腐蚀和细菌腐蚀不锈钢、铝合金晶间腐蚀、铜合金脱成分腐蚀
(4)设计海洋油气装备时,特别是不锈钢部件焊接后表面应酸洗
(5)选用含钼的不锈钢可以改善耐点腐蚀、缝隙腐蚀和沉淀腐蚀的能力。(6)对于碳钢和低合金钢,可采用从腐蚀介质中除氧的办法来避免由于充气电池造成的点腐蚀,另一个防护措施是提高介质流动速度或采用钝化防护法。
3、选择性腐蚀
由于一种溶剂(通常是水)渗透合金,从具有不溶组分合金中拨出可溶组分的过程称为选择性腐蚀。黄铜在海洋大气和湿热大气中经常发生选择性腐蚀。
黄铜脱锌的机理有许多解释,目前有两种理论:一种认为是合金表面上的锌发生溶解后,内表面的锌原子经扩散抵达腐蚀后的空位继续被溶解而留下疏松的铜层;另一种则认为腐蚀时锌和铜同时溶解以离子形式进入溶液,其后铜离子又重新沉积在金属表面上。
4、晶间腐蚀
晶间腐蚀是沿晶界紧邻晶界的局部腐蚀,而晶粒本体基本上不受影响。
5、缝隙腐蚀
缝隙腐蚀通常在海水全浸区或者在浪花飞溅区最严重。一般靠氧来维持钝态的材料,在海水中都有对缝隙腐蚀敏感的倾向,不锈钢和某些铝合金对缝隙腐蚀是较敏感的。
机理
一般来说,缝隙腐蚀是由于材料表面之间形成了腐蚀了电池,引起缝隙腐蚀的腐蚀机理与点腐蚀的机理几乎完全相同。
(1)形成了充气电池的缝隙腐蚀
(2)钝化材料形成浓差电池的缝隙腐蚀
影响因素
(1)金属表面之间由于放置不合理
(2)缝隙宽度、深度以及二者之间的比
(3)对于不锈钢缝隙腐蚀发生在与绝缘体构成的缝隙内
(4)由于结构设计不合理造成的,也可能是因海洋污损生物(如藤壶或软体动物)栖居在表面所致。
6、电偶腐蚀
接触腐蚀
影响因素
金属的溶解速度主要和高电位材料(阴极)及低电位材料(阳极)之间的面积比有关,其他影响参数还包括电解液的电阻、两种材料的零电位差、电极的极化电阻及接触电偶的几何形状。
电极电位;反应动力学;几何因素;海水环境条件或本体溶液性质;质量传递;焊接、铆接和外部连接等连接方式;保护膜性质、存在针孔、溶液依从性等表面特性;主要的相、微观组织、杂质等合金组成。
热偶腐蚀
这种腐蚀起因于温度梯度所形成的原电池。
7、杂散电流腐蚀
8、电化学与生物协同腐蚀形态
摩擦腐蚀:摩擦腐蚀时两个接触面上的局部损伤,这种局部损伤是由于接触表面间振幅足够大的相对滑动所促成的
磨损腐蚀:磨损腐蚀是一种由高速和磨损所引起的加速磨损过程,常常因为固体
颗粒的存在而加速了腐蚀过程
高速流动海水的冲刷腐蚀
特点:
①海水高流速中即受到海水腐蚀,又遭到高速流动海水的机械磨损
②许多金属在低速时腐蚀速度变化不大,但到一定速度,腐蚀速度会剧增。
③海水流速增加,氧的扩散速度加快,腐蚀速度增加。这对碳钢类材料更为明显冲刷腐蚀影响因素
①许多金属如铜和钢对海水的流速很敏感。当速度超过某一临界点时,便会发生快速的侵蚀。
②当海水中有悬浮物时,则磨蚀和腐蚀所产生的交互作用,比磨蚀与腐蚀单独作用的总和还严重得多。
③海水的流速在磨蚀中起重要作用,在高速流速条件下,不仅均匀腐蚀严重,还经常出现严重的局部腐蚀。
空泡腐蚀
空泡腐蚀是快速流动的液体中的金属表面或在液体中振动的固体表面发生局部的损坏。是冲刷腐蚀的一种特定的形式。
冲击波可产生三种效应:
①使软的金属表面发生高速形变;
②使韧性差的表面层崩落;
③损坏金属的表面膜,使腐蚀加快。
8、电化学与机械作用协同腐蚀形态
海洋环境中的应力腐蚀
应力腐蚀开裂和阴极应力腐蚀开裂(氢致应力腐蚀开裂)。阴极应力开裂常叫氢脆或氢致开裂。
应力腐蚀开裂的影响因素
①冶金因素影响
②环境因素影响
③应力的影响
④细菌对硫化氢腐蚀的影响
氢脆
氢损伤是指氢进入金属内部降低金属的承载能力
海洋大气环境中氢渗透的影响因素
①干湿循环的影响
②空气污染物的影响
③腐蚀产物膜的影响
④材料受力状态的影响
疲劳腐蚀
在交变机械载荷和海水腐蚀介质对金属同时作用下,材料中主要出现穿晶裂纹。
9、油气装备腐蚀失效案例
焊缝腐蚀
导管架焊接可能出现的失效形式有焊缝金属的选择腐蚀、热影响区的选择腐蚀、晶间腐蚀、刀痕腐蚀、应力腐蚀裂纹、疲劳腐蚀裂纹等。
不锈钢的焊接腐蚀
金属腐蚀与防护试卷1 一、解释概念:(共8分,每个2分) 钝性,碱脆、SCC、缝隙腐蚀 二、填空题:(共30分,每空1分) 1.称为好氧腐蚀,中性溶液中阴极反应为,好氧腐蚀主要为控制,其过电位与电流密度的关系为。 2.在水的电位-pH图上,线?表示关系,线?表示关系,线?下方是的稳定存在区,线?上方是的稳定存在区,线?与线?之间是的稳定存在区。 3.热力系统中发生游离CO2腐蚀较严重的部位是,其腐蚀特征是,防止游离CO2腐蚀的措施是,运行中将给水的pH值控制在范围为宜。 4.凝汽器铜管在冷却水中的脱锌腐蚀有和形式。淡水作冷却水时易发生脱锌,海水作冷却水时易发生脱锌。 5.过电位越大,金属的腐蚀速度越,活化极化控制的腐蚀体系,当极化电位偏离E corr足够远时,电极电位与极化电密呈关系,活化极化控制下决定金属腐蚀速度的主要因素为、。 ) 6.为了防止热力设备发生氧腐蚀,向给水中加入,使水中氧含量达到以下,其含量应控制在,与氧的反应式为,加药点常在。 7.在腐蚀极化图上,若P c>>P a,极极化曲线比极极化曲线陡,这时E corr值偏向电位值,是控制。 三、问答题:(共24分,每小题4分) 1.说明协调磷酸盐处理原理。 2.自然界中最常见的阴极去极化剂及其反应是什么 3.锅炉发生苛性脆化的条件是什么 4.凝汽器铜管内用硫酸亚铁造膜的原理是什么 5.说明热力设备氧腐蚀的机理。 6.说明腐蚀电池的电化学历程,并说明其四个组成部分。 /
四、计算:(共24分, 每小题8分) 1.在中性溶液中,Fe +2=106-mol/L ,温度为25℃,此条件下碳钢是否发生析氢腐蚀并求出碳钢在此条件下不发生析氢腐蚀的最小pH 值。(E 0Fe 2+/Fe = - ) 2.写出V -与i corr 的关系式及V t 与i corr 的关系式,并说明式中各项的物理意义。 3.已知铜在含氧酸中和无氧酸中的电极反应及其标准电极电位: Cu = Cu 2+ + 2e E 0Cu 2+/Cu = + H 2 = 2H + + 2e E 02H +/H = 2H 2O = O 2 + 4H + + 4e E 0O 2/H 2O = + 问铜在含氧酸和无氧酸中是否发生腐蚀 五、分析:(共14分,每小题7分) 1.试用腐蚀极化图分析铁在浓HNO 3中的腐蚀速度为何比在稀HNO 3中的腐蚀速度低 { 2. 炉水协调磷酸盐-pH 控制图如图1,如何根据此图实施炉水水质控制,试分析之。 (25 15 20 pH o C) 9.809.609.409.209.008.80 2 3 4 5 6 7 8 9 10 R =2.8R =2.6 R =2.4R =2.3R =2.2R =2.1
第一章前言 1.1 国内外海洋平台事故 近30年来,海洋腐蚀向人类敲响的警钟。1980年3月,在北海艾克菲斯油田上作业的“亚历山大·基定德”号钻井平台,在8级大风掀起的高6∽8m的海浪的反复冲击下,5根巨大的桩腿中的D号桩腿因6根主撑管先后断裂而发生剪切断裂,万余吨重的平台在25min 内倾倒,使123人遇难,造成近海石油钻探史上罕见的灾难。挪威事故调查委员会检查报告表明,D号桩腿上的D-6主撑管首先断裂。该主撑管曾经开过一个直径325mm的孔,并焊上一个法兰,准备安装平台定位声纳装置,实际上后来并未安装,开裂就是从这个法兰角的6mm焊缝处开始的,裂纹在海浪与荷载的反复作用下不断扩展,最后导致平台沉没。 2010年9月7日23时,山东东营胜利油田位于渤海的作业3号修井作业平台受玛瑙台风影响(风力最大时阵风9级,浪高近4米)平台发生倾斜发生倾斜45度事故。平台上4人落水,32人被困平台。目前已有34人获救。平台设计通常都考虑台风的影响,况且又是在中国的内海-渤海,我觉得平台倒塌与海洋腐蚀应有一定的关联。 1.2 腐蚀工程 腐蚀工程包括腐蚀原理和防护技术两部分。 腐蚀原理是从热力学和动力学方面解释和论述腐蚀的原因、过程和控制。 防护技术泛指防止或延缓腐蚀损害所采用的有效措施。大体上有以下几种: ①选择材料,根据使用环境合理选用各类金属材料或非金属材料; ②电化学保护技术,主要是阴极保护技术、阳极保护技术与排流技术;③表面处理技术,如磷化、氧化、钝化及表面转化膜; ④涂层、镀层技术,主要有涂料、油脂、镀层、衬里与包覆层等; ⑤调节环境,即改善环境介质条件,如封闭式循环体系中使用缓蚀剂、调节pH值,以及脱气、除氧和脱盐等; ⑥正确设计与施工,从工程与产品设计时就应考虑腐蚀问题,如正确选材与配合,合理设计表面与几何形状,严格施工工艺,采取保护措施,特别是防止接触腐蚀、应力腐蚀、缝隙腐蚀及焊接腐蚀等。 由此可见,腐蚀工程涉及的专业知识领域很广,主要有冶金、材料、机械、表面处理、化学、
探究海洋环境污染与保 护 海洋教育研究性学习报告 课题名称:探究海洋环境污染与保护 学校: 班级: 组长: 组员: 指导老师: 联系电话: 探究海洋环境污染与保护 自上个世纪五十年代以来,随着各国社会生产力和科学技术的迅猛发展,海洋受到了来自各方面不同程度的污染和破坏,日益严重的污染给人类的生存和发展带来了极为不利的后果.下面是我关于海洋污染的研究报告。 海洋污染通常是指人类改变了海洋原来的状态,使海洋生态系统遭到破坏。有害物质进入海洋环境而造成的污染,会损害生物资源,危害人类健康,妨碍捕鱼和人类在海上的其他活动,损坏海水质量和环境质量等。 下面是造成海洋污染的几个主要原因: 1.石油 包括原油和从原油中分馏出来的溶剂油、汽油、煤油、柴油、润滑油、石蜡、沥青等等,以及经过裂化、催化而成的各种产品。每年排入海洋的石油污染物约1千万吨,主要是由工业生产,包括海上油井管道泄漏、油轮事故、船舶排污等造成 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
的,特别是一些突发性的事故,一次泄漏的石油量可达10万吨以上,这种情况的出现,大片海水被油膜覆盖,将促使海洋生物大量死亡,严重影响海产品的价值,以及其他海上活动。 2.重金属 包括汞、铜、锌、钴、镐、铬等重金属,砷、硫、磷等非金属由人类活动而进入海洋的汞,每年可达万吨,已大大超过全世界每年生产约9千吨汞的记录,这是因为煤、石油等在燃烧过程中,会使其中含有的微量汞释放出来,逸散到大气中,最终归入海洋,估计全球在这方面污染海洋的汞每年约4千吨。镉的年产量约1.5万吨,据调查镉对海洋的污染量远大于汞。 3.农药 包括有农业上大量使用含有汞、铜以及有机氯等成分的除草剂、灭虫剂,以及工业上应用的多氯酸苯等。这一类农药具有很强的毒性,进入海洋经海洋生物体的富集作用,通过食物链进入人体,产生的危害性就更大,每年因此中毒的人数多达10万人以上,人类所患的一些新型的癌症与此也有密切关系。有机物质和营养盐类:这类物质比较繁杂,包括工业排出的纤维素、糖醛、油脂;生活污水的粪便、洗
《金属腐蚀理论及腐蚀控制》 习题解答 第一章 1.根据表1中所列数据分别计算碳钢和铝两种材料在试验介质中的失重腐蚀速度V- 和年腐蚀深度V p,并进行比较,说明两种腐蚀速度表示方法的差别。 解:由题意得: (1)对碳钢在30%HNO3( 25℃)中有: Vˉ=△Wˉ/st =(18.7153-18.6739)/45×2×(20×40+20×3+40×30)×0.000001 =0.4694g/ m?h 又有d=m/v=18.7154/20×40×0.003=7.798g/cm2?h Vp=8.76Vˉ/d=8.76×0.4694/7.798=0.53mm/y 对铝在30%HNO3(25℃)中有: Vˉ=△Wˉ铝/st =(16.1820-16.1347)/2×(30×40+30×5+40×5)×45×10-6
=0.3391g/㎡?h d=m铝/v=16.1820/30×40×5×0.001=2.697g/cm3 说明:碳钢的Vˉ比铝大,而Vp比铝小,因为铝的密度比碳钢小。 (2)对不锈钢在20%HNO3( 25℃)有: 表面积S=2π×2 .0+2π×0.015×0.004=0.00179 m2 015 Vˉ=△Wˉ/st=(22.3367-22.2743)/0.00179×400=0.08715 g/ m2?h 试样体积为:V=π×1.52×0.4=2.827 cm3 d=W/V=22.3367/2.827=7.901 g/cm3 Vp=8.76Vˉ/d=8.76×0.08715/7.901=0.097mm/y 对铝有:表面积S=2π×2 .0+2π×0.02×0.005=0.00314 m2 02 Vˉ=△Wˉ/st=(16.9646-16.9151)/0.00314×20=0.7882 g/ m2?h 试样体积为:V=π×2 2×0.5=6.28 cm3 d=W/V=16.9646/6.28=2.701 g/cm3 Vp=8.76Vˉ/d=8.76×0.7882/2.701=2.56mm/y 试样在98% HNO3(85℃)时有: 对不锈钢:Vˉ=△Wˉ/st =(22.3367-22.2906)/0.00179×2=12.8771 g/ m2?h Vp=8.76Vˉ/d=8.76×12.8771/7.901=14.28mm/y 对铝:Vˉ=△Wˉ/st=(16.9646-16.9250)/0.00314×40=0.3153g/ m2?h Vp=8.76Vˉ/d=8.76×0.3153/2.701=1.02mm/y 说明:硝酸浓度温度对不锈钢和铝的腐蚀速度具有相反的影响。
盘点十大海洋腐蚀防护技术 前言 海洋工程构筑物大致分为:海岸工程(钢结构、钢筋混凝土)、近海工程(海洋平台、钻井、采油、储运)、深海工程(海洋平台、钻井、采油、储运)、海水淡化、舰船(船体、压载舱、水线以上),简称为船舶与海洋工程结构。船舶与海洋工程结构的主要失效形式包括:均匀腐蚀、点蚀、应力腐蚀、腐蚀疲劳、腐蚀/磨损、海生物(宏生物)污损、微生物腐蚀、H2S与CO2腐蚀等等。控制船舶和海洋工程结构失效的主要措施包括:涂料(涂层)、耐腐蚀材料、表面处理与改性、电化学保护(牺牲阳极、外加电流阴极保护)、缓蚀剂、结构健康监测与检测、安全评价与可靠性分析及寿命评估。 从腐蚀控制的主要类型看(表1),涂料(涂层)是最主要的控制方法、耐腐蚀材料次之,表面处理与改性是常用的腐蚀控制方法,电化学保护(牺牲阳极与外加电流)是海洋结构腐蚀控制的常用手段,缓蚀剂在介质相对固定的内部结构上经常使用,结构健康监测与检测技术是判定腐蚀防护效果、掌握腐蚀动态以及提供进一步腐蚀控制措施决策和安全评价的重要依据,腐蚀安全评价与寿命评估是保障海洋工程结构安全可靠和最初设计时的重要环节。建立全寿命周期防护理念,结合海洋工程设施的特点及预期耐用年数,在建设初期就重视防腐蚀方法,通过维修保养实现耐用期内整体成本最小化并保障安全性,是重大海洋工程结构值得重视的问题。 表1腐蚀防护方法及中国的防腐蚀费用比例 一、防腐涂料(涂层) 涂料是船舶和海洋结构腐蚀控制的首要手段。海洋涂料分为海洋防腐涂料和海洋防污涂料两大类。按防腐对象材质和腐蚀机理的不同,海洋防腐涂料又可分为
海洋钢结构防腐涂料和非钢结构防腐涂料。海洋钢结构防腐涂料主要包括船舶涂料、集装箱涂料、海上桥梁涂料和码头钢铁设施、输油管线、海上平台等大型设施的防腐涂料;非钢结构海洋防腐涂料则主要包括海洋混凝土构造物防腐涂料和其他防腐涂料。 海洋防腐蚀涂料包括车间底漆、防锈涂料、船底防污涂料、压载舱涂料、油舱涂料、海上采油平台涂料、滨海桥梁保护涂料以及相关工业设备保护涂料。海洋防腐涂料的用量大,每万吨船舶需要使用4~5万升涂料。涂料及其施工的成本在造船中占10%~15%,如果不能有效防护,整个船舶的寿命至少缩短一半,代价巨大。 海洋防腐领域应用的重防腐涂料主要有:环氧类防腐涂料、聚氨酯类防腐涂料、橡胶类防腐涂料、氟树脂防腐涂料、有机硅树脂涂料、聚脲弹性体防腐涂料以及富锌涂料等,其中环氧类防腐涂料所占的市场份额最大,具体见表2。实际上,从涂料使用的分类看,涂料可以分为:底漆、中间漆和面漆。其中,底漆主要包括富锌底漆(有机:环氧富锌;无机:硅酸乙酯)、热喷涂铝锌;中间漆主要有环氧云铁、环氧玻璃鳞片;面漆包括聚氨酯、丙烯酸树脂、乙烯树脂等。 表2我国重防腐涂料的种类与比例 我国重防腐涂料增长率较快,2012年我国涂料总产量1270万t,居世界第一位,但企业数量多,单产低。 我国涂料生产企业有上万家,但产量在5000t以上的涂料企业不足10%。美国涂料年生产总量约700万t,厂家只有400多个。日本是世界第3大涂料生产国,总产量200万t,生产企业只有167家。我国涂料公司的产值低:从企业销售额来看,我国最大的涂料公司的年销售额不足AkzoNobel(阿克苏诺贝尔)公司的1/50。此外,我国许多涂料公司的产品质量还有待进一步提高。我国虽有先进的纳米复
海洋环境污染与保护教案 王梦天 [教学目标] (一)知识与技能 1.知道海洋污染防治的主要措施,理解海洋污染防治的意义。 2.知道海洋环境保护的重要措施——建立海洋自然保护区;了解海洋自然保护区的定义、分类,以及我国海洋自然保护区的基本情况。 3.结合“中国国家级海洋自然保护区”图,归纳我国海洋自然保护区的分布特点。(二)过程与方法 收集整理有关我国近海生态环境的资料分析面临的主要问题,提出并讨论保护我国海洋生态环境的主要对策。 (三)情感态度价值观 关注现实生活中可能引起海洋污染的事件,体会海洋环境保护对于人类社会的意义,增强学生的环境保护意识。 [教学重点] 1.海洋污染防治的主要措施 2.海洋自然保护区 3.我国近岸海域海洋生态环境所面临的主要问题 [教学难点] 海洋环境保护 [教学媒体与教具] 利用网络收集资料,结合案例分析、探究导学完成教学任务。
[课时安排] 1课时 [讲授过程] 【复习提问】海洋污染的类型、来源以及危害。 【导入新课】海洋环境是人类发展的重要基础。随着海岸带的大规模开发建设,海洋环境问题日益严重,防治海洋污染,进行海洋环境保护己经成为人类社会的共识。 【板书】第三节海洋污染的防治与环境保护 一、海洋污染的防治 【案例分析】阅读课本82页材料“水质污染鱼先知”探究讨论与陆地污染相比,海洋污染有哪些独特性?在治理上有哪些难度?你有什么治理良策? 【学生回答,教师总结】1.海洋污染的危害:海洋污染不仅威胁着海洋生物的生存环境,也危及人类的健康。 2.特点:海洋污染容易,治理难 3.海洋污染的防治措施主要有: 1. 对向海洋直接排污的企业实行强化管制; 2. 加快沿海城市污水处理厂的建设,生活污水处理之后再排放入海; 3. 禁止向海洋倾倒工业废料; 4. 禁止含磷洗涤用品的销售和使用; 5. 实施垃圾分类回收和循环利用,使用可降解塑料,不把海洋作为废水排放地和垃圾填埋场等等 【启发提问】除此之外,还有哪些措施可以防治海洋污染?
化学工程与装备 2013年 第8期 180 Chemical Engineering & Equipment 2013年8月 阴极保护在海洋平台上的应用 曹永升,史勋汉,孙为志,王 沙,赵 晨 (海洋石油工程股份有限公司,天津 300451) 摘 要:本文通过分析对海洋平台所处环境的分析以及阴极保护的工作原理介绍,研究了阴极保护在海洋平台的腐蚀防护中的应用,分析了两种阴极保护的特点及其在海洋平台防腐工作中的应用情况和取得的效果。 关键词:阴极保护;海洋平台;腐蚀;防腐 1 概述 海洋平台是海上石油开采的主要装置。随着海洋石油开发逐步向深海迈进,海洋平台的体积也逐渐加大,结构日趋复杂,投资日益增高。并且海洋平台及其辅助设施都是由复杂的钢结构组成,长期受到海洋环境中着海水的侵蚀。因此,如何加强平台结构的腐蚀防护、有效地控制平台钢结构的腐蚀,提高其使用寿命、保障生产运行的安全成为人们关注的焦点。而阴极保护作为一种腐蚀防护方式,已广泛应用于各种环境的金属防腐实践中,这其中也包括海洋平台的腐蚀与防护。 2 阴极保护原理 阴极保护其实质是对阴极金属进行保护,防止金属结构的腐蚀。通常我们把金属与周围的电解质发生反应、从原子变成离子的过程称为腐蚀。腐蚀的危害性极大,世界上每年生产的钢铁中约有10%的钢铁因腐蚀而变成铁锈,大约30%的钢铁设备因为腐蚀而损坏。这样不仅造成了极大的材料浪费,还会导致停产、人生伤害和环境污染等严重的生产事故。据统计,有些国家由于金属的腐蚀造成的直接经济损失约占国民生产总值的2~4%。金属腐蚀发生的根本原因是金属热力学性质上的不稳定性造成的,即金属本身较其他某些化合物(如氧化物,氢氧化物,盐等)原子处于较高的自由能状态,使得金属极易失去电子而被氧化,这种倾向在相应条件具备时,就会发生金属由单质向化合物的转化,即发生了腐蚀。金属和金属的腐蚀主要是化学作用或电化学作用引起的,有时还包含了机械作用﹑物理作用及生物作用。 阴极保护一种用于防止金属在电介质中发生氧化还原反应的电化学保护技术,其基本原理是利用金属活性较大金属作为牺牲阳极、被保护金属作为阴极,或者是在被保护的金属表面施加一定的直流电流,从而使氧化还原反应不在阴 极金属上发生,进而达到保护阴极金属的目的。也就是利用牺牲阳极材料或辅助阳极的腐蚀来替代被保护金属结构的腐蚀,从而使被保护结构的金属的使用寿命得以延长,进而提高设备等的安全性和经济性。 根据阴极供电电流的提供方式不同,阴极保护可分为牺牲阳极保护和外加电流保护两种。 (1)牺牲阳极阴极保护。牺牲阳极阴极保护就是将电位更负,即金属活性较大的金属作为原电池的阳极,与被保护的金属相连,通过电负性金属或合金的不断溶解消耗,向被保护的金属提供保护电流,使处于电解质中的金属电子转移到被保护的金属上去,使得整个被保护的金属处于一个较负的相同的电位下,使阴极部分的金属免受腐蚀,达到保护的目的。这种保护方式简便易行,不需要提供外加电源,并且很少产生腐蚀干扰。牺牲阳极保护原理见图1。 图1 牺牲阳极保护原理图 (2)外加电流阴极保护。外加电流阴极保护就是指利用外加直流电源和辅助阳极,将外部交流电转变成低压直流电,通过辅助阳极将保护电流传递给被保护的金属,使其产生阴极极化,使被保护的金属结构电位低于周围环境电位。也就是通过给金属补充大量的电子,使被保护金属处于电子
海洋污染与海洋环境保护[课件资料] 海洋污染与海洋环境保护 二十一世纪是海洋的世纪,“海洋权益”“海权之争”……越来越成为人们耳熟能详的名词,海洋既是人类生存的基本空间,也是国际斗争的重要舞台,海洋环境是我们维护海洋权益的重要平台,因此,海洋污染与海洋环境保护就必然成为不可忽视的问题。 “海洋污染”在地理学、环境地理学上的定义是人类活动排放的污染物进入海洋中,破坏海洋生态系统,引起海水质量下降的现象。就海洋科技、海洋科学、环境海洋学学科来讲是指人类直接或间接地把物质或能量引入海洋环境,以致发生损害生物资源、危害人类健康、妨碍包括渔业在内的海洋活动、损害海水使用素质和降低或毁坏环境质量等有害影响。海洋污染改变了海洋原来的状态,损害海洋的生物资源,妨碍捕鱼和人类在海上的其他活动,使海洋生态系统遭到破坏,损坏海水质量和环境质量,最终危害人类健康。海洋污染主要发生在靠近大陆的海湾,由于密集的人口和工业,大量的废水和固体废物倾入海水,加上海岸曲折造成水流交换不畅,使得海水的温度、pH、含盐量、透明度、生物种类和数量等性状发生改变,对海洋的生态平衡构成危害。目前,海洋污染突出表现为石油污染、赤潮、有毒物质累积、塑料污染和核污染等几个方面。由于污染已造成渔场外迁、鱼群死亡、赤潮泛滥、有些滩涂养殖场荒废、一些珍贵的海生资源正在丧失。 由于海洋是一个完整的水体,海洋本身对污染物有着巨大的搬运、稀释、扩散、氧化、还原和降解等净化能力。但这种能力并不是无限的,当局部海域接受的有毒有害物质,超过它本身的自净能力时,就会造成该海域的污染。海洋污染物通过风、陆上径流、沿海工程建设、人类海上活动排放入海。根据污染物的性质和毒性,以及对海洋环境造成的危害方式,主要的污染物有农药;石油及其产品;重金属
腐蚀与防护试题 1化学腐蚀的概念、及特点 答案:化学腐蚀:介质与金属直接发生化学反应而引起的变质或损坏现象称为金属的化学腐蚀。 是一种纯氧化-还原反应过程,即腐蚀介质中的氧化剂直接与金属表面上的原子相互作用而形成腐蚀产物。在腐蚀过程中,电子的传递是在介质与金属之间直接进行的,没有腐蚀电流产生,反应速度受多项化学反应动力学控制。 归纳化学腐蚀的特点 在不电离、不导电的介质环境下 反应中没有电流产生,直接完成氧化还原反应 腐蚀速度与程度与外界电位变化无关 2、金属氧化膜具有保护作用条件,举例说明哪些金属氧化膜有保护作用,那些没有保护作用,为什么? 答案:氧化膜保护作用条件: ①氧化膜致密完整程度;②氧化膜本身化学与物理稳定性质;③氧化膜与基体结合能力;④氧化膜有足够的强度 氧化膜完整性的必要条件:PB原理:生成的氧化物的体积大于消耗掉的金属的体积,是形成致密氧化膜的前提。 PB原理的数学表示: 反应的金属体积:V M = m/ρ m-摩尔质量 氧化物的体积: V MO = m'/ ρ ' 用? = V MO/ V M = m' ρ /( m ρ ' ) 当? > 1 金属氧化膜具备完整性条件 部分金属的?值 氧化物?氧化物?氧化物? MoO3 3.4 WO3 3.4 V2O5 3.2 Nb2O5 2.7 Sb2O5 2.4 Bi2O5 2.3 Cr2O3 2.0 TiO2 1.9 MnO 1.8 FeO 1.8 Cu2O 1.7 ZnO 1.6 Ag2O 1.6 NiO 1.5 PbO2 1.4 SnO2 1.3 Al2O3 1.3 CdO 1.2 MgO 1.0 CaO 0.7 MoO3 WO3 V2O5这三种氧化物在高温下易挥发,在常温下由于?值太大会使体积膨胀,当超过金属膜的本身强度、塑性时,会发生氧化膜鼓泡、破裂、剥离、脱落。 Cr2O3 TiO2 MnO FeO Cu2O ZnO Ag2O NiO PbO2 SnO2 Al2O3 这些氧化物在一定温度范围内稳定存在,?值适中。这些金属的氧化膜致密、稳定,有较好的保护作用。 MgO CaO ?值较小,氧化膜不致密,不起保护作用。 3、电化学腐蚀的概念,与化学腐蚀的区别 答案:电化学腐蚀:金属与介质发生电化学反应而引起的变质与损坏。 与化学腐蚀比较: ①是“湿”腐蚀 ②氧化还原发生在不同部位 ③有电流产生 ④与环境电位密切相关
保护海洋演讲海洋污染的演讲稿 ----WORD文档,下载后可编辑修改---- 保护海洋演讲篇一 亲爱的老师,同学们: 大家好!今天我演讲的题目是:《走向海洋》。 《走向海洋》是我刚读过的一本书。顾名思义,这本书是介绍海洋的。其实在读这本书之前,关于大海,我只是听老师说过:大海是无边无际的,连接着天和地。海洋是一个蕴藏着大量能量的宝藏。偶尔也在电视上看到过海洋的一角。至于其他,我一无所知。 读完这本书,让我对海洋有了初步的了解,让我知道海洋占地球表面积的70.8%。四大洋是:太平洋、印度洋、大西洋和北冰洋。第一个到达南极的是阿蒙森。在各国的海洋历史上也有过重要的战争。如鸦片战争、甲午战争、八国联军侵华战争等。流传至今的历史名人还有更多,郑和,他证明了地球是圆的,麦哲伦、哥伦布发现了新大陆,还有民族英雄郑成功等等,让我知道,我们的祖国不仅有960万平方公里的土地,而且还有人民海军用生命换来的300万平方公里的蓝色国土! 这本书也告诉我海洋对人类的重要性。海洋是人类的家园,海洋是人类之母,海洋与人类息息相关。海洋是生命的摇篮,海洋是蓝色的瑰宝。究其原因,正如书中所说:海洋中有大量的淡水资源、化学资源、生物资源、矿产资源、能源资源和空间资源。 它抚养我们,但不求回报。它给了我们,但并不要求得到。难道
这种无私的精神不值得学习吗?大海是美丽而无私的。然而,我们人类却在不断地破坏美,大海的无私换来的却是我们的伤害。过度的能源开发和严重的环境污染已经使美丽的海洋伤痕累累。同学们,让我们一起行动起来保护我们的星球,不要让它再受伤害,让它永远留在这里。它愿意奉献它的一切。难道我们不应该关心它吗?正如书中所说:世界的海洋是相通的,人类的利益是共同的。让我们携起手来,让海洋世纪的钟声响起高歌,与海同行...... 我的演讲到此结束,感谢大家。 保护海洋演讲篇二 亲爱的老师、同学们: 大家好! 今天我演讲的题目是:珍惜水资源,保护海洋资源。 水是生命之源。如果地球上没有水,那么地球母亲就不会养育我们人类的后代。因为最早的原始生命最初是在海洋中形成的,并逐渐扩展到陆地上。 海洋是人类生存环境的重要组成部分。在清澈的蓝色海水下,地球上80%的生物都得到了滋养。海洋促进水流,提供氧气和能量,平衡气候。一旦我们没有水,就没有海洋。然后地球上的生命就结束了。 随着社会经济的不断发展和土地资源的短缺,人类开始了对海洋的研究和开发。因此,海洋走进了我们的生活中,给我们带来了巨大的经济财富,给我们提供了很多生活中的必需品。 因此,当前的海洋对我们的生活和世界的发展起着举足轻重的作
第23卷第6期2008年12月 中国海洋平台CHINA OFFSHORE PL A TFORM Vol.23No.6Dec.,2008 收稿日期:2008-08-26 作者简介:胡津津(19792)女,工程师,从事非金属材料研究。 文章编号:100124500(2008)0620039204海洋平台的腐蚀及防腐技术 胡津津, 石明伟 (上海船舶工艺研究所,上海200032) 摘 要:概括了海洋平台不同区域的腐蚀环境和腐蚀规律,对海洋平台重防腐涂料的选择要求及配套体 系进行简要叙述。针对海洋平台的长效防腐防护要求,介绍了几种具有长效的防腐材料和防腐技术特点,包括 海洋平台热喷涂长效防腐蚀技术、锌加保护技术、海洋平台桩腿防腐套包缚技术等,为我国对海洋平台长效防 腐防护技术的研究提供参考。 关键词:海洋平台;防腐;热喷涂;锌加技术;防腐套 中图分类号:T G 17 文献标识码:A CORROSION AN D ANTICORROSION TECHNOLOG Y IN OFFSH ORE PLATFORMS HU Jin 2jin , S H I Ming 2wei (Shanghai Ship building Technology Research Instit ute ,CSSC 200032,China ) Abstract :This paper summarizes t he corro sion environment and rules of t he different zones in off shore platforms ,also briefly int roduces t he requirement s and systems of t he an 2 ticorro sion coating.According to t he long 2term anticorro sion requirement s in off shore plat 2 forms ,t he paper int roduces several long 2term anticorro sion technology ,including t hermal spraying ,adding zinc protection and anticorrosion technology wit h platform legs wrapped etc , which will provide some references to t he research of t he long 2term anticorrosion technology in off shore platforms. K ey w ords :off shore platform ;anticorro sion ;t hermal spraying ;adding zinc technolo 2 gy ;anticorrosion wrap 海洋平台是一种海上大型工程结构物。其钢结构长期处于盐雾、潮气和海水等环境中,受到海水及海生物的侵蚀,而产生剧烈的电化学腐蚀。腐蚀严重影响海洋平台结构材料的力学性能,从而影响到海洋平台的使用安全[4]。而且由于海洋平台远离海岸,不能像船舶那样定期进坞维修保养,因此海洋平台的建造者及使用者都非常重视海洋平台的防腐问题。如何对海洋平台结构进行长效防腐,以及开发研究海洋平台结构长效防腐的新材料、新技术及新工艺都具有十分重要的意义。 1 海洋平台的腐蚀规律 1.1 海洋环境的腐蚀区域界定 海洋平台的使用环境极其恶劣,阳光暴晒、盐雾、波浪的冲击、复杂的海水体系、环境温度和湿度变化及海洋生物侵蚀等使得海洋平台腐蚀速率较快。海洋平台在不同的海洋环境下,腐蚀行为和腐蚀特点会有比
《金属材料的海洋腐蚀与防护》第一篇习题 一、填空题 1. 通常将海洋腐蚀环境分为5个区带,它们分别是:海洋大气区、浪花飞溅区、海水潮差区、海水全浸区以及海底泥土区。 2. 金属在海水中的腐蚀行为按其腐蚀速度受控制的情况分为: 控制和控制两大类。 3. 渤海的入海河流主要包括黄河、海河、辽河和滦河四条入海河流。 4. 南海北部海面12月份平均风速最大,台湾海峡及其南部海面以及巴士海峡海面由于狭管效应,是全年平均风速之冠。 5. 南海地形从周边向中央倾斜,依次分布着大陆架和岛架、大陆坡和岛坡及海盆等。 6. 在海洋环境中的金属结构件,腐蚀类型主要有均匀腐蚀、点蚀、缝隙腐蚀、冲击腐蚀、空泡腐蚀、电偶腐蚀、腐蚀疲劳等。 7. 金属结构腐蚀失效的主要原因可以归结为3个方面的原因:金属材料本身方面的原因、环境方面的原因、设计方面的原因。 8. 我国海水腐蚀试验确定的4个典型的试验点分别为黄海海域的青岛站、东海海域的舟山站和厦门站、南海海域的榆林站。 9. 在腐蚀学里,通常规定点位较低的电极为阳极,电位较高的电极为阴极。 10. 最重要最常见的两种阴极去极化反应是氢离子和氧分子阴极还原反应。 11. 多数情况下,发生氧去极化腐蚀主要由扩散过程控制。氧的扩散电流密度随溶解氧的浓度增加而增加,并与扩散层厚度成反比,流速越大,氧的扩散层厚度越小、氧的扩散电流密度越大,腐蚀增大。 12. 引起金属钝化的因素有化学及电化学两种。其中化学因素引起的钝化,一般都是有强氧化剂引起的。 13. 与腐蚀有关的微生物是细菌类,主要是硫酸盐还原菌。 14. 海水电导率以及氧在海水中的溶解度都主要取决于海水的盐度和温度两个 因素,其中任意一个因素的增加都会使海水电导率增加,氧的溶解度降低。15. 诸多海洋生物钟,与海水腐蚀关系较大的附着生物,最常见的附着生物主要有硬壳生物和无硬壳生物两种。 二、名词解释 1. 海洋飞溅区 答:在海洋环境中,海水的飞溅能够喷射洒到结构物表面,但在海水涨潮时又不能被海水所浸没的部位一般称为海洋飞溅区。 2. 海水潮差区 答:指海水平均高潮线与平均低潮线之间的区域。 3. 缝隙腐蚀 答:部件在介质中,由于金属与金属或金属与非金属之间形成特变小的缝隙,使缝隙内介质处于滞留状态引起缝内金属的加速腐蚀,这种局部腐蚀。
海洋污染源和海洋环境保护 一、造成海洋污染的途径有哪些 1、沿海工业企业直接向海洋排放污水; 2、流入海中的河流,这些河流在流经区域有企业向水体排放污水; 3、由于带有污染物的废气排放到大气中,形成酸雨后,造成降雨进入海中; 4、过度捕捞,破坏了海洋的生态平衡; 5、运输船只抛弃废弃物、污染物泄露,有机物泄露; 6、对海洋地下矿物开采造成的泄露、遗漏等 二、防止海洋污染的方法 自上个世纪五十年代以来,随着各国社会生产力和科学技术的迅猛发展,海洋受到了来自各方面不同程度的污染和破坏,日益严重的污染给人类的生存和发展带来了极为不利的后果。据不完全统计,1999年我国共发生较大渔业污染损害事故947起,造成直接经济损失约5亿元;2000年发生较大渔业污染损害事故1120起,造成直接经济损失约5.6亿元。海洋渔业污染损害事故据不完全统计,1999年我国共发生较大突发性海洋渔业污染损害事故104起,造成直接经济损失约2.7亿元,其中特大渔业污染损害事故(经济损失在1000万元以上)3起,重大渔业污染损害事故(经济损失在100万元以上)12起。2000年共发生较大渔业污染损害事故120余起,造成直接经济损失约3亿元,其中特大渔业污染损害事故4起,重大渔业污染损害事故11起。日益严重的污染给生态环境带来了极为不利的后果,
这一问题引起了有关国际组织及各国的政府的极大关注。为防止、控制和减少污染,在一些国家和国际组织的努力下,国际社会先后制定了一系列公约,它们对防止、控制和减少污染起到了积极的作用。虽然,沿海各国政府及国际组织,针对本国实际情况制订了相应的法律,国际社会也针对世界海洋污染制订了一系列的国际公约,但是,海洋环境污染的形势还是非常严重。造成污染的原因是多种多样的,如,空气污染、躁音污染、淡水污染等。本文只就造成海洋污染的原因对策作一探讨。 (一)、造成污染的原因 1、船舶造成的污染 何谓船舶造成的污染,是指因船舶操纵、海上事故及经由船舶进行海上倾倒致使各类有害物质进入海洋,海洋生态系统平衡遭到破坏。船舶造成污染的特征:(1)经由船舶将各类污染物质引入海洋。(2)污染物质进入海洋是由于人为因素而不是自然因素,也就是说污染行为在主观上表现为人的故意或过失。(如:洗舱污水、机舱污水未经处理排入海洋)(3)污染物进入海洋后,造成或可能造成海洋生态系统的破坏。 船舶造成的污染主要表现为:(1)船舶操作污染源,这种污染的产生主要是船舶工作人员的故意或过失造成的。如:有的船舶工作人员故意的将含有有害物质的洗舱污水排入海洋,船舶机舱工作人员故意将含有污油的机舱污水未经处理排入海洋,还有的由于工作责任心不强错开伐门将燃油排入海洋。(2)海上事故污染源,船舶由于
1.材料腐蚀的定义:腐蚀是材料受环境介质的化学、电化学和物理作用产生的损坏或变质现象。腐蚀包括化学、电化学与机械因素或生物因素的共同作用。 2.腐蚀的特点:自发性/铁腐蚀变成以水和氧化铁为主的腐蚀产物,这些腐蚀产物在结构或形态上和自然界天然存在的铁矿石类似,或者说处于同一能量等级自发性只代表反应倾向,不等于实际反应速度 普遍性/ 元素周期表中约有三、四十种金属元素,除了金和铂金可能以纯金属单体形式天然存在之外,其它金属都以它们的化合物(氧化物、硫化物)形式存在 隐蔽性/ 应力腐蚀断裂管道:表面光亮如新,几乎不存在均匀腐蚀迹象,金相显微镜下,可观察到管道内部布满细微裂纹 3.按材料腐蚀形态如何分类:全面腐蚀<均匀和不均匀腐蚀> 局部腐蚀{ 点蚀(孔蚀、)缝隙腐蚀及丝状腐蚀、电偶腐蚀(接触腐蚀)晶间腐蚀}选择性腐蚀 4.按材料腐蚀机理如何分类:化学腐蚀、电化学腐蚀、物理溶解腐蚀 5.按材料腐蚀环境如何分类:自然环境腐蚀、工业环境腐蚀、生物环境腐蚀 1、名词解释 物理腐蚀:是指金属由于单纯的物理溶解作用而引起的破坏 电化学腐蚀:就是金属和电解质组成两个电极,组成腐蚀原电池。 电极电位:金属-溶液界面上建立了双电层,使得金属与溶液间产生电位差,这种电位差称为电极电位(绝对电极电位) 非平衡电极电位:(在生产实际中,与金属接触的溶液大部分不是金属自身离子的溶液)当电极反应不处于平衡状态,电极系统的电位称为非平衡电位。 平衡电极电位:水合金属离子能够回到金属中去,水合-金属化过程速率相等且又可逆,这时的电极电位。 标准电极电位:金属在25℃浸于自身离子活度为1mol/L的溶液中,分压为1×105Pa时的平衡电极电位 极化:电流流过电极表面,电极就会失去平衡,并引起电位的变化 去极化:能降低电极极化的因素称为去极化因素 过电位:是电极的电位差值,为一个电极反应偏离平衡时的电极电位与这个电极反应的平衡电位的差值。 活化极化:设电极反应的阻力主要来自电子转移步骤,液相传质容易进行,这种电极反应称为受活化极化控制的电极反应。 浓差极化:当电极反应的阻力主要来自液相传质步骤,电子转移步骤容易进行时,电极反应受浓度极化控制。 吸氧腐蚀:是指金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀。 析氢腐蚀:以氢离子还原反应为阴极过程的金属腐蚀 钝化化学腐蚀:当金属处于一定条件时,介质中的组分或是直接同金属表面的原子相结合或是与溶解生成的金属离子相结合,在金属表面形成具有阻止金属溶解能力并使金属保持在很低的溶解速度的钝化膜。 2、电位-pH图在腐蚀研究中的应用与其局限性是什么?电位—pH图中汇集了金属腐蚀体系的热力学数据,并且指出了金属在不同pH 或不同电位下可能出现的情况,提示人们可借助于控制电位或改变pH 到防止金属腐蚀的目的。1. 绘制电位pH 图时,是以金属与溶液中的离子之间,溶液中的离子与含有这些离子的腐蚀产物之间的平衡作为先决条件的,而忽略了溶液中其它离子对平衡的影响。而实际的腐蚀条件可能是远离平衡的;其它的离子
金属材料在海洋中的腐蚀与防护 摘要:沿海工业发展,海洋资源的开发和利用,离不开海上基础设施的建设。由于海洋苛刻的腐蚀环境,金属材料结构及构造物的腐蚀不可避免。为了减少腐蚀,我们必须采取相应防护,目前阴极防护技术及海洋防蚀材料的发展,已经让金属的腐蚀得到一定的控制,并且随着技术的不断深化,海洋金属的腐蚀一定会得到更好的控制。 关键词:金属材料;海洋腐蚀环境;海洋腐蚀类型;阴极保护技术;海洋防蚀材料腐蚀是金属与其所处的环境之间的化学或电化学相互作用,受材料特性和环境特性所支配,其结果,改变了金属的性质。一般设施的建设都要经过设计阶段,其中防腐蚀设计是保证工程设施使用寿命的重要步骤。沿海工业建设,海洋资源开发和海洋经济的发展离不开海洋腐蚀研究。下面介绍一下各种不同的还有腐蚀环境和影响腐蚀的因素以及腐蚀类型。 海洋腐蚀环境——海水含盐量一般在3%左右,是天然的强电解质。大多数常用的金属结构材料受海水或海洋大气的腐蚀并且材料的耐腐蚀性能随暴露条件的不同而发生很大的变化。为方便起见,通常将海洋腐蚀环境分为5个区带:海洋大气区,海洋飞溅区,海水潮差区,海水全浸区以及海底泥土区。各区环境条件及腐蚀行为见下表: 图1-1——环境的分类 图1-2反映了海洋环境条件及腐蚀行为的情况 海洋大气区----海洋大气环境的腐蚀性,随温度的升高而加强。温度越搞腐蚀性越强。 海洋大气的腐蚀往往受多种因素的影响,是各种不同因素相互作用引起的,包括水分的影响,尘埃的影响,二氧化硫的影响及盐粒的影响等。
1.水分的影响---对大气腐蚀产生重要影响的是表面水分的含量,它直接影响到金属的腐蚀速度和腐蚀机理。根据实验结果,钢、铜、锌等金属在相对湿度50%~70%以下的空气中腐蚀轻微。金属表面所覆盖水膜的厚度和腐蚀度之间的关系如下图示。在Ⅰ区域中,水分子层或不完整的单分子层,腐蚀反应基本是氧化反应,常温下腐蚀速度很低;在Ⅱ区的水分子尽管用肉眼看不见,但其厚度有数10个水分子层甚至100个水分子层,次部分发生金属在水溶液中的电化学腐蚀,一般大气中的腐蚀是在该状态中发生的,随着水膜层厚度的增加腐蚀速度变大;在Ⅲ区水分子的存在可以用肉眼看见,水分子层厚度1微米以上存在的金属表面腐蚀,由于通过水层氧的扩散量所控制,所以腐蚀速度变低,在Ⅳ区域内与浸渍在水溶液中金属的腐蚀相类似。 图1-2为金属表面上水层厚度和腐蚀速度之间的关系 2.尘埃的影响---从大气中,尘埃并附着在金属表面的尘埃与腐蚀性有着密切的关系。附着的尘埃在金属表面上持续一段时间,就会引起腐蚀,尤其易引起点蚀。3.二氧化硫的影响--- S02 的平均浓度在严重污染的地带可达(0.01~0.1)*10^(-4)%,但是S02一般是溶解在金属表面的水分中,在锈层中一般含有FeSO4 的浓度及季节变化而变动。下图表示铁和铝的5个月的晶体,其数量随着S0 2 浓度的关系。其腐蚀原理可用电化学反应解释 的腐蚀量和S0 2 阳极反应:Fe→Fe2+ + 2e- 阴极反应:H O + O2 + 2e- →2OH- 2 Fe2+和OH-相结合生成Fe(OH)2沉淀物,这是大气腐蚀的第一阶段;随着Fe(OH)2的氧化而生成各种氧化物,这是大气腐蚀的第二阶段。
海洋腐蚀与防护前沿技术及国内外研究动态、发展趋势 海洋腐蚀的经济损失每年至少三千亿,并大幅递增。海洋经济投入越多,海洋防腐课题越迫切,所以,有人把海洋防腐材料纳入海洋经济中的新兴产业和新材料,却很少反映到具体的报告和表述中。腐蚀问题首先是一个经济问题。腐蚀是一种悄悄进行的破坏,但它的破坏力比地震、火灾、水灾、台风等自然灾害所造成损失更为严重。世界各国对腐蚀工作都非常重视。据统计,每年因腐蚀所造成的经济损失约占国民经济生产总值的2%-4%。1969年英国因腐蚀而造成的损失为13.65亿英磅;美国2001年的腐蚀直接损失为国民生产总值的3.1%,约合2760亿美元。这一调查结果当时震惊了全世界。据最新报道,我国在能源、交通、建筑、机械、化工、基础建设、水利和军事设施等典型的行业和企业,每年由于腐蚀所造成的损失可达5000亿元以上,约占GDP的5%。腐蚀所造成的经济损失除直接损失外还包括停工停产、设备维修、产品降级、效率降低等一系列间接损失。 和上面说的相比,海洋腐蚀尤为严重。海洋环境腐蚀与防护研究主要是研究钢铁材料在海洋环境中发生的一系列化学和电化学反应 而劣化的自然现象,其目的就是有效地防止腐蚀,降低腐蚀损失,提高钢铁设施的使用效能。基于对腐蚀所造成的危害及损失的分析,专家将研究目标锁定在海洋环境腐蚀与防护研究上,开展了一系列研究,并取得了一系列研究成果。他们认为:如果防护措施到位,至少每年可以避免25-30%的损失,也就是说每年至少可以减少损失1300亿元。我国有1800公里的海岸线,有相当于我国陆地国土面积1/3的海洋区域。海洋的开发利用在国民经济中占的比重越来越重要。目前已有100余座开采石油的钢桩平台屹立在海上,同时大量船舶及海底输油管线为海上开采石油服务。目前已经探明,中国海上石油资源量
海洋经济发展与海洋环境保护问题 摘要:随着沿海经济的迅猛发展,近海海域遭到越来越严重的污染,使海域环境质量明显下降,生态环境日趋恶化,并对生物资源和人体健康产生有害影响。海洋经济的发展还面临严酷的海洋自然环境,精确预报海洋灾害的发生、发展和应该采取何种防灾减灾工程措施,也成为严重关注的环境问题。为了开发海洋资源,需要在海上进行各类工程建设,大规模的工程建设和海洋环境之间的相互作用也将是开发海洋中的一个应引起特别关注的重要问题。为了适应我国海洋经济的快速发展,针对我国重大的海洋环境与保护问题,重点开展研究方面的课题大体上有三类。第一类课题是海洋环境特征对各类污染物作用的机理和规律研究,第二类课题是海洋工程设施防灾、抗灾和减灾研究,第三类课题是海洋工程及海洋环境工程与海洋环境的相互作用及防治措施与对策。 关键词海洋环境污染海洋灾害海洋工程与海洋环境相互作用 随着沿海经济的迅猛发展,近海海域遭到越来越严重的污染,使海域环境质量明显下降,生态环境日趋恶化,并对生物资源和人体健康产生有害影响。近海水域的污染已成为世界各国,特别是象我国这样具有相当长的海岸线和众多海湾的国家所共同关心的环境问题。海洋经济的发展还面临严酷的海洋自然环境,海洋灾害直接影响着海洋经济的发展规模、速度和效益,精确预报海洋灾害的发生、发展和应该采取何种防灾、抗灾和减灾工程措施,也成为严重关注的环境问题。为了开发海洋中的空间、矿产、渔业、能源等物质资源,需要在海上进行各类工程建设,在目前科技日益发展的情况下,工程建设的规模日益巨大,这些大规模的工程建设和海洋环境之间的相互作用也将是开发海洋中的一个应引起特别关注的重要问题。为了适应我国海洋经济的快速发展,海洋环境的日益恶化,海洋灾害的频发和海洋工程向大型化发展,近海石油气田的开发,以及海岸带开发过程中的后效问题的研究需要,针对我国重大海洋环境与保护问题开展研究是十分必要和迫切的。 在这方面,重点需要开展的研究课题大体上有三类。第一类课题是海洋环境特征对各类污染物作用的机理和规律研究,第二类课题是海洋工程设施防灾、抗灾和减灾研究,第三类课题是海洋工程及海洋环境工程与海洋环境的相互作用吸防治措施与对策。 一、海洋环境特征对各类污染物的作用机理和规律研究 以海洋流体动力对各类污染物迁移、扩散、转化规律的研究为基础,考虑各种自然环境因素(浪、流、风、光、温度、湿度)、物理因素(扩散、挥发、沉降、吸附、释放)、化学因素、生物因素的作用,揭示污染物在海洋复杂条件下的运动及演变规律,并建立海洋水质预测预报模型。此外,近年来,在我国沿海海域,赤潮频发严重。因此,除了加强赤潮的监测和预报外,也应加强在建立赤潮生长机理和发展规律方面的研究工作。 此项研究应通过现场观测、物理模型实验和数学模拟研究相结合的方法来进行。由于现场观测工作耗资巨大,且受到许多客观条件的限制,所获得的数据往往有许多综合因素的共同作用,很难将其中的单因素影响分离出来,因此,往往只能用它来作为对某一水质预测预报模型进行检验其可行性和精度的一个实例。 用数学模拟方法来建立海洋水质预测预报模型是一个较为有效的方法。目前,在这方面国内外已有不少水质预测预报模型,这些水质预测预报模型大体上都基于以下几方面的模型:水流数学模型;波浪数学模型;液流相互作用模型;近海海域污染物迁移转化数学模型。在水流数学模型研究方面,对于较大范围的海域,通常可采用深度平均的潮流教学模型,对