
蛋白质纯化
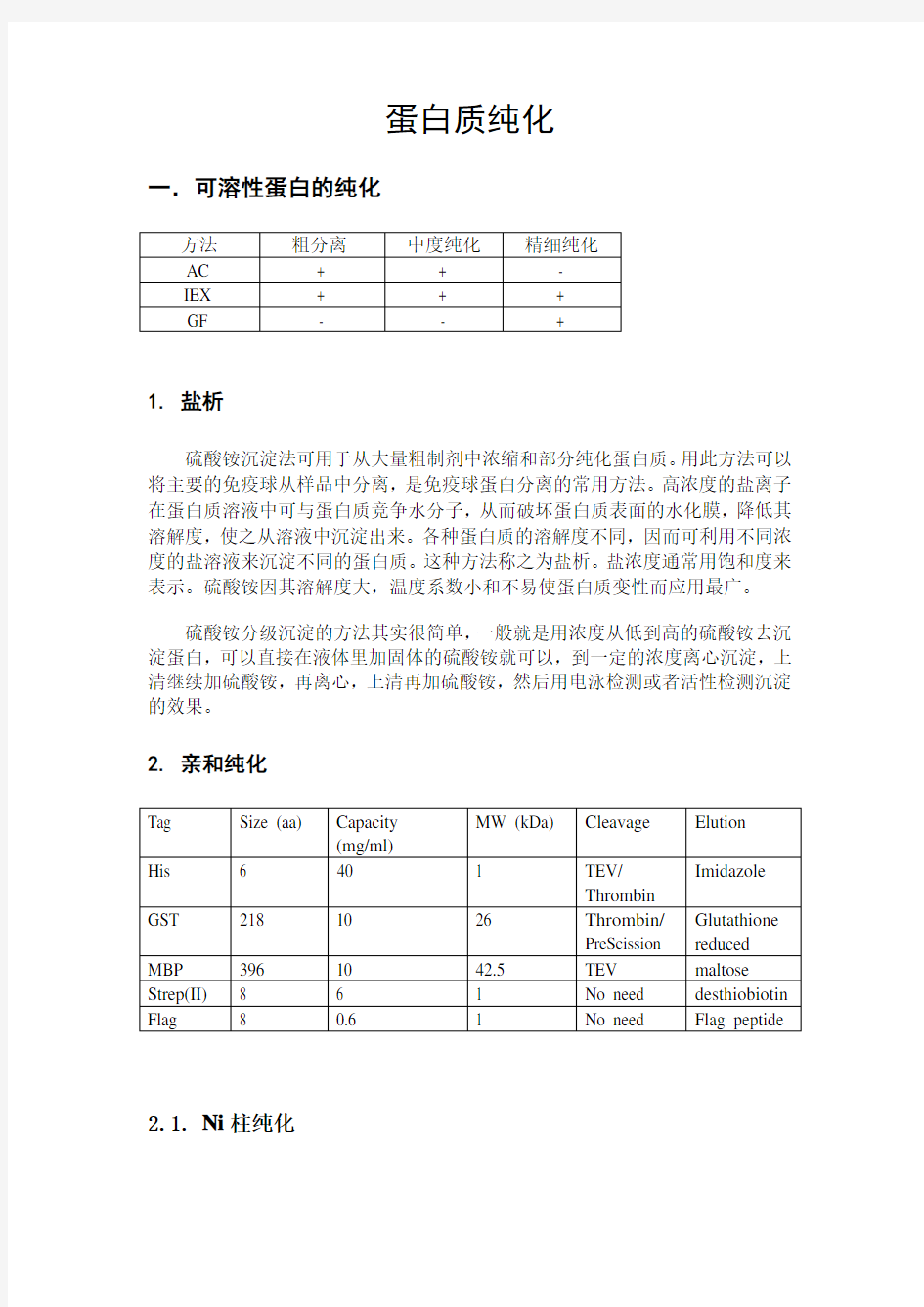
一.可溶性蛋白的纯化
1. 盐析
硫酸铵沉淀法可用于从大量粗制剂中浓缩和部分纯化蛋白质。用此方法可以将主要的免疫球从样品中分离,是免疫球蛋白分离的常用方法。高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来。各种蛋白质的溶解度不同,因而可利用不同浓度的盐溶液来沉淀不同的蛋白质。这种方法称之为盐析。盐浓度通常用饱和度来表示。硫酸铵因其溶解度大,温度系数小和不易使蛋白质变性而应用最广。
硫酸铵分级沉淀的方法其实很简单,一般就是用浓度从低到高的硫酸铵去沉淀蛋白,可以直接在液体里加固体的硫酸铵就可以,到一定的浓度离心沉淀,上清继续加硫酸铵,再离心,上清再加硫酸铵,然后用电泳检测或者活性检测沉淀的效果。
2. 亲和纯化
2.1. Ni柱纯化
2.1.1.Ni柱纯化操作流程
1. 蛋白质上清与Ni柱填料在4℃下进行充分旋转混合(≥60 min);也可以让上清液缓慢流经Ni柱(≥6 sec/drop)。
2. 上清与填料混合后,低速离心(≤ 500 x g),吸去大部分上清,然后将填料悬起,加入柱子中。也可以直接上柱。
3. 上样后先用5-10 柱体积(CV)的lysis buffer冲洗不结合的杂蛋白,然后再用低浓度的咪唑洗去弱结合的杂蛋白。在不知道清洗条件时可以进行咪唑浓度梯度洗脱(如10,20,30,40,50 mM),然后在纯度和得率之间选择最合适的咪唑浓度来进行清洗。
4. 清洗结束后,用高浓度咪唑(如200 mM)洗脱目的蛋白质。
5. 洗脱下来的目的蛋白质除电泳留样外,透析除去咪唑,并换成下一步所需的buffer。
6. 一般情况下his tag不需要切除。当需要切除时:
的蛋白质最少1)TEV:咪唑对其没有影响,可以在洗脱后直接酶切。100 OD
280
的TEV切过夜,温度20或4℃(20℃的效率是4℃的三倍)。
可用1 OD
280
2) Thrombin:必须先除去咪唑才能进行酶切。在1 x PBS中,10 U/mg蛋白质,4或20℃酶切过夜。可适当加大酶量或延长酶切时间。
2.1.2.Ni柱纯化注意事项
1.新的Ni柱填料存放于20%乙醇中(体积约为1:1)。在取用前,请先估算目的蛋白质的量,再决定取用的填料体积(Qiagen的Ni-NTA Superflow最大结合能力为30 mg protein/ml beads)。填料用量不要大大超过所需量,不然会结合较多的杂蛋白,难以清洗干净。
O冲洗,除去乙醇。再2.新填料使用前,要先进行处理和平衡。填料先用ddH
2
用至少5 CV的buffer进行平衡。
3. 在使用前后,要注意不能让填料放干,不然会影响纯化的效果。
O清洗,3. 每次使用结束后,填料用高浓度咪唑(如500 mM)清洗,再用ddH
2
最后保存在20%乙醇中。
4. 不推荐Ni柱在柱酶切,这样效率很低。
5. 多次使用后填料需再生。再生步骤为:5 CV H
O→ 3 CV 2% SDS→ 1 CV
2
25% EtOH→ 1CV50% EtOH→ 1 CV75% EtOH→ 5 CV100% EtOH→1 CV
O→ 5 CV 100 75% EtOH→ 1CV 50% EtOH→ 1 CV 25% EtOH→ 1 CV H
2
mM EDTA,pH8.0 →H2O→ 2 CV100 mM NiSO4→ 2 CV H2O→20% EtOH。
2.1.
3. Q & A
1. 目的蛋白质挂柱能力差?
可能是由于所用buffer中含有过多的detergent或还原剂如 -ME等。Ni柱填料和试剂兼容性请查阅手册。还可能是由于蛋白质折叠不正常,或折叠时将his tag 包裹在内所致。可以采用的方法是:1)控制破菌条件,不可以过于剧烈;2)改变buffer条件,可能有利于蛋白质折叠稳定;3)将his tag构建到蛋白质另一端。
2. 杂蛋白很多,无法清洗干净?
解决方案有:采用更高浓度的咪唑进行清洗;在破菌或结合时加入少量咪唑(如10 mM);减少填料使用量。
3. 蛋白质洗脱不下来?
解决方案有:采用更高浓度的咪唑进行洗脱;更换buffer。
4. 蛋白质发生降解?
更换蛋白质抑制剂,或多种抑制剂混合使用;截取其它truncates。
2.2. GST柱纯化
2.2.1.GST柱纯化操作流程
1. 蛋白质上清与GST填料在4℃下进行充分旋转混合,或可以让上清液缓慢流经GST柱(≥6 sec/drop);
2. 在充分混合后,将混有填料的上清load上柱子;
3. 用大量的lysis buffer(1 x PBS)清洗GST柱,至没有杂蛋白流出(用bradford 检测);
4. 新鲜配制洗脱液:50 mM Tris-HCl, 10 mM reduced glutathione, pH 8.0。将5-10CV的洗脱液加到柱子上,静置一段时间(如10 min),再缓慢流出(≥6 sec/drop)。
5. 洗脱后酶切:洗脱后的GST融合蛋白质溶液先透析除去reduced glutathione,然后加入PreScission或Thrombin进行酶切。
6. 在柱酶切:在洗脱之前,吸取beads,500 x g离心5 min,弃上清。然后加入酶液,进行酶切。
PreScission:酶切buffer:50 mM Tris-HCl, 150 mM NaCl, 1 mM EDTA, 1 mM DTT, pH 7.5。
10 U/mg protein,5℃酶切4 hr。可适当加大酶量或延长酶切时间。
Thrombin:在1 x PBS中,10 U/mg protein,4或20 ℃酶切过夜。
酶切结束后,用3-5 CV的1 x PBS冲洗柱子,收集目的蛋白质。最后用洗脱液清洗beads上残余的GST和GST融合蛋白。
2.2.2.GST柱纯化注意事项
1.GE的Glutathion Sepharose 4B Fast Flow最大结合能力为10 mg protein/ml beads。
2. GST填料使用前用至少5 CV的buffer平衡,buffer的pH范围为:6.5—8.0。
3. GST填料机械强度较差,所以在混合时要注意控制力度和时间。
O 4. 洗脱后,GST填料可用6 M盐酸胍或8 M尿素清洗,再生。然后用ddH
2
清洗后浸泡在20%乙醇中。
2.2.3.Q & A
1. 目的蛋白质挂柱能力差?
解决方案有:1)保证充分混匀;2)检测蛋白质溶液的pH值是否在合适范围内;3)检查蛋白质溶液是否加入过多的DTT(> 1 mM)。
2. 目的蛋白质无法洗脱?
提高reduced glutathione浓度,但注意不要改变pH值;延长洗脱时间,并不定期吹打;在洗脱液中加入一些非离子型detergents如0.1% Triton X-100。
3. GST切不下来?
一般情况下,洗脱后酶切比在柱酶切效率高,所以选择洗脱后酶切;可以提高酶的用量,升高酶切温度,延长酶切时间;更换相应载体,用另一种酶进行酶切。
2.3. IgG纯化
纯化操作流程如下:
2.3.1.制备单克隆抗体
1. 购来F1代小鼠,或Bib/c小鼠,饲养一周;
2. 腹腔注射Plaston 200 ul/只,饲养10天;
3. 将特定细胞注入腹腔;
4. 一周起观察小鼠腹水的产生的情况,随时采集腹水。
2.3.2.硫酸铵沉淀
1. 取来的腹水用生理盐水以1:1比例稀释;
2. 稀释后腹水用滤纸过滤,去除脂蛋白及杂质,得到澄清的上清溶液;
3. 在上清中缓慢地边搅拌边加入等体积硫酸铵饱和溶液(4 ℃下操作);
4. 随硫酸铵加入量的增加,溶液逐渐变混浊,加完后再搅拌10 min左右,4 ℃过夜;
5. 将放置过夜的悬浊液4 ℃,7000 rpm离心20 min,弃上清,得到乳白色沉淀;
6. 用适量50%硫酸铵重悬沉淀,重复以上操作一次,沉淀-30 ℃保存备用。
2.3.3.亲和层析
1. 将经20mM PBS,pH7.4透析过夜的腹水与ProteinA 混合过夜;
2. 将混合过夜的样品上柱,收集流出液;
3. 用20mM PBS,pH7.4 buffer洗柱子,约10个柱体积;
4. 用0.1M甘氨酸pH3.0洗脱,洗脱前预先在每个EP管中加入50 ul中和溶液(2M Tris)。
5. OD280读数;
6. 亲和力好的,将流出液与ProteinA重新混合,4 ℃过夜,准备第二次、第三次纯化;亲和力不理想的,将流出液再与ProteinG 混合,4 ℃过夜;
7.电泳鉴定。
2.3.4.IgG的Fab片段的获得
2.3.4.1.木瓜蛋白酶酶切方法
1. 酶切体系如下:
0.5 M EDTA 1 ul
1 M cystine 100 ul
10 mg/ml papain 6 ul
酶切缓冲液1767 ul
(0.1 M NaAc,1 mM EDTA,用醋酸调pH值至5.5)
37 ℃激活10 min;
2. 在上述酶切反应体系中加入16 mg/ml的mAb共126 ul,反应总体积为2 ml,将反应液于37 ℃酶切5 hrs;
3. 封闭:避光加入92 mg/ml Iodoacetamide (IIA) (碘乙酰酶)326 ul ,避光反应40 min ;
4. 透析:对20 mM Tris-HCl ,pH 8.9,更换2次。
2.3.4.2.阴离子交换柱(5 ml Q FF 柱)纯化Fab 片段
阴离子交接缓冲液:
Buffer A :20 mM Tris-HCl ,pH 8.9;
Buffer B :20 mM Tris-HCl ,pH 8.9,1 M Nacl (含0.02% NaN 3)。 以
50 min 时间梯度达至100% buffer B ;
约4分钟后开始出现蛋白峰,其中峰1为Fab ,如下图所示。
PEAK I PEAK II PEAK II
PEAK I
3. 凝胶过滤
3.1. 操作流程(配合AKTA操作)
1. 在使用分子筛之前,请先确定目的蛋白质在过分子筛的buffer中是稳定的。如果目的蛋白质所处的buffer和过分子筛的buffer有所不同时,请确定在溶液改变过程中目的蛋白质不会发生沉淀。否则,不可以进行凝胶过滤操作。
2. 根据蛋白质的分子量大小、总量、总体积和实验目的,选择合适的分子筛进行实验。24 ml分子筛价格较高且使用寿命较短,所以它仅用于定性分析或蛋白质提取困难且总量较少时的纯化,不可以用于大规模纯化。
3. 使用者用自己的账户登录,将分子筛分子筛连接到AKTA上,先后用新鲜配
O和buffer平衡柱子(至少1.5 CV),至基线走平。
置并除气的ddH
2
4. 蛋白质样品上样前必须高速离心13000 rpm x 10 min,取上清上样。
5. 在出峰时进行样品的收集。收集前要注意收集臂的摆放位置,收集时也要注意是否发生跳管等现象,如果发生,请跟管理员联系。
6. 蛋白质样品流出后,请继续用buffer走到1.5 CV,然后再用ddH
O和20%乙
2
醇清洗柱子。
7. 请随时注意所用溶液是否足够。建议设置pause time或end time,以防溶液使用光,空气进入分子筛。
8. 在清洗结束后,将分子筛柱从AKTA上卸下来,然后退出账户,收拾好仪器和台面,并进行登记。
3.2. 注意事项
1. 使用分子筛柱子前,务必看清分子筛使用条例和各参数设置,尤其是Alarm pressure和flowrate。(为保证分子筛重复性和使用寿命,使用时不得大于下表规定的flowrate)
O和20%乙醇清2. 每次使用后,除非当天有人接着使用,否则必须先后用ddH
2
洗柱子(至少1.5 CV),二者均为新鲜配制,并过滤、除气(24小时以内配的)。
O 3. 每一根柱子,每使用10次之后,由第10次的使用者进行处理:在用ddH
2
O 洗后,用胰酶(最高浓度为5%)清洗1 CV后,浸泡过夜,然后再先后用ddH
2
和20%乙醇清洗至少1.5 CV。
4. 每个使用者必须在该分子筛柱所属的组以及AKTA所属的组的登记本上分别登记。登记时,请记录分子筛柱最后的流速、压力值和所处的溶液。实验中如果遇到任何不正常的现象,也请清楚地记录下来或告知管理员。
5. 原则上24ml分子筛每使用20次需更换筛内顶部过滤膜。如果发现24ml分子筛顶部出现水柱,必须立即告知管理员更换筛内顶部过滤膜。
3.3. Q & A
1. 如何用分子筛测定蛋白质的分子量?
24 ml分子筛可以用于分子量大小的测定。如果仅用于参考,可以根据自己蛋白质出峰的峰尖位置在《080807体积排阻法.xls》中查询。如果需要精确的测定,必须在对目的蛋白质操作前,自己进行蛋白markers的标定。标定的方法请参考《080807体积排阻法.xls》。
2. 蛋白质上样后没有蛋白质流出?
确定蛋白质样品和所有操作是否正确;检查管道连接是否正确,接头是否漏液等。
3. 蛋白质没有有效分离?
可能蛋白质状态不佳,形成多种聚集状态火和杂蛋白非特异结合。可以尝试更换不同的buffer,让蛋白质状态更加稳定。
4. 离子交换
4.1. 填料的选择
分辨率由低到高:Sepharose→Sepharose Fast Flow→Source30 →Source15 →Monobead
选择方法:
1. 在纯化的不同阶段(粗中精)选择不同分辨率的填料(低到高);
2. 如果目的蛋白质pI未知:使用强离子交换剂检测其选择性;
3. 如果目的蛋白质pI已知:buffer的pH值高于pI时选阴离子,反之选阳离子交换剂。
4.2. 操作流程(配合AKTA操作)
1. 准备缓冲液:buffer A,buffer B(A containing 1 M NaCl),分别放入A,B泵头;
2. 上样前,用5-10 CV的buffer A平衡柱子;
3. 上样:用不高于0.2 ml/min的流速上样;
4. 上样后清洗:用5-10 CV的buffer A清洗柱子;
5. 梯度洗脱:初次实验时,线性梯度0-100% B in 10-20 CV;根据目的蛋白质出峰位置以及各峰的分布情况,可台阶式拉梯度,优化纯化效果;
6. 高盐清洗:用100% B清洗5 CV,以除去紧密结合的蛋白质;
O和20%乙醇清洗,竹子保存在7. 最后用buffer A清洗10 CV,再分别用ddH
2
20%乙醇中。
4.3. 注意事项
1.离子交换是结合技术,样品体积无关。样品可采用低浓度、慢流速的方法上样,也可以反复多次上样,以便目的蛋白质能充分结合;
2. 选择合适的pH值buffer,如果纯化效果不理想,可尝试改变pH值;
3. 选择得到可接受分辨率的最陡梯度,和最快流速,以减少分离时间;
4.4. Q & A
1. 蛋白质在上样过程中流出?
可能原因有:填料选择不合适,尝试其他填料的交换柱;上样流速过快,可降低流速或多次重复上样;样品浓度太高,可增大样品体积以减小浓度。
2.目的蛋白质形成多个峰流出?
可能是蛋白质状态不均一所致。高分辨率的离子交换技术可以用于不同修饰状态如磷酸化的蛋白质。目的蛋白质形成多个峰,可能是分离出不同修饰状态的蛋白质。
二.变复性
1. 在柱复性
1.细胞裂解液18,000 rpm于4 ℃离心15 min,收集沉淀。
2. 在破菌buffer中补加低浓度的尿素(300-400 mM)或盐酸胍(200-300 mM),将沉淀重悬混匀,18,000 rpm于4 ℃离心15 min,收集沉淀。重复操作一次。
3. 用8 M尿素或者6 M盐酸胍溶液溶解沉淀(其中加入适当的缓冲液,保持pH 8.0),还可其中补加适量DTT和NaCl等(不可含EDTA)。沉淀完全溶解后,18,000 rpm于4 ℃离心15 min,收集上清。
4.下面的步骤在AKTA上进行,复性溶液的具体成分每个蛋白需要进行摸索:利用HiTrap Chelating HP柱子。先0.1 M Ni2SO4 3 CV 上镍,用变性溶液平衡好柱子。
5.上样:收集的上清0.3 ml/min上柱。
6.洗涤:分别用不含咪唑和含低浓度咪唑的变性溶液洗柱子,去除杂蛋白。7.复性:梯度加入不含变性剂的溶液。AKTA拉线性梯度,40-50 min到达100% 不含变性剂的溶液。
8.洗脱:加入高浓度咪唑的不含变性剂的溶液洗脱复性好的蛋白。
9.处理柱子:用6 M 盐酸胍,0.5 M EDTA溶液洗脱沉淀在柱子上的未复性蛋白。
2. 透析复性与稀释复性
2.1.透析复性主要操作步骤如下:
1.细胞裂解液18,000 rpm于4 ℃离心15 min,收集沉淀。
2.在破菌buffer中补加低浓度的尿素(300-400 mM)或盐酸胍(200-300 mM),将沉淀重悬混匀,18,000 rpm于4 ℃离心15 min,收集沉淀。重复操作一次。
3.用8 M尿素或者6 M盐酸胍溶解沉淀,还可其中补加适量DTT、EDTA和NaCl等。沉淀完全溶解后,18,000 rpm于4 ℃离心15 min,收集上清。
4. 将变性蛋白于4 ℃透析至不含有变性剂的缓冲液中,每3 hr以上更换一次透析液,直至变性剂完全透析除去。
5. 将复性好的蛋白18,000 rpm于4 ℃离心15 min,收集上清,检测目的蛋白的浓度与纯度,并利用离子交换、凝胶过滤层析等方法进一步纯化。
2.2.稀释复性主要操作步骤如下:
1.包涵体的洗涤和溶解与透析复性相同,最终获得变性的包涵体。并检测变性蛋白溶液的浓度,稀释到5 mg/ml以下。
2. 于4 ℃将变性蛋白溶液逐滴加入复性缓冲液中,变性蛋白溶液与复性缓冲液的体积比最好能达到1:30-1:50,甚至1:100。加入变性蛋白溶液时速度不可太快,最好边加边用磁力搅拌器搅拌复性缓冲液,防止蛋白迅速聚集沉淀。多数情况下,复性缓冲液中都含有0.5 M精氨酸,适量的氧化-还原剂(如GSH-GSSG,半胱氨酸-胱氨酸),EDTA,pH值一般是9左右。
3. 将复性蛋白在4 ℃混合过夜,将上清浓缩至小体积后进行下一步的纯化。2.3. Q & A
1. 目的蛋白在复性的过程沉淀,上清中没有目的蛋白?
这是在变复性中最常遇到的问题。如果是透析,可以尝试用小体积含有一定浓度变性剂的缓冲液进行透析,梯度降低变性剂的浓度,以减少因缓冲液变化过大导致蛋白迅速沉淀。同样的,在稀释复性时,也可以复性缓冲液中加入一定量的变性剂(如0.6 M盐酸胍),当浓缩至较小体积时再透析或者利用中空膜系统更换至没有变性剂的缓冲液中。
三.蛋白质修饰
1. 还原性甲基化
1.1.方法原理:
将蛋白中表面的赖氨酸进行甲基化修饰,有利于稳定蛋白构象,更有利于蛋白晶体生长。
1.2. 适用情况:
蛋白状态很好,进行结晶条件筛选时大部分为分相或澄清的情况。
1.3. 方法:
1. 将纯化好的蛋白(纯度比较高,最好是亲和纯化以后用分子筛等其他方法进一步纯化好的蛋白)采取透析的方法用甲基化反应缓冲液(50 mM HEPES at pH 7.5, 250 mM NaCl) 稀释成1 mg/ml(或者是更低的浓度).
2. 每毫升蛋白溶液中加入20 μl 1M 新鲜配置的dimethylamine-borane complex (ABC; Fluka) 和40 μl 1M 新鲜配置的formaldehyde (Fluka), 放置
4 °C votex反应2 hr.
3. 再向每毫升蛋白溶液中加入20 μl 1M 新鲜配置的dimethylamine-borane complex (ABC; Fluka) 和40 μl 1M 新鲜配置的formaldehyde (Fluka), 放置
4 °C votex反应2 hr.
4. 最后向每毫升蛋白溶液中加入10 μl 1M 新鲜配置的
dimethylamine-borane complex (ABC; Fluka),放置4 °C votex反应过夜.
5. 将可溶的甲基化蛋白用分子筛的方法进行纯化,分子筛平衡用的缓冲液(20 mM Tris-HCl at pH 7.5, 200 mM NaCl)可以终止甲基化反应的发生,收集蛋白样品,浓缩筛板。
2. 烷基化
巯基具有很强的亲核性,是酶分子中最容易反应的侧链基团。在许多酶中是活性中心的催化基团。烷基化试剂是一种重要的巯基修饰试剂,特别是碘乙酸
(Iodoacetic acid,IAA)、碘乙酰胺(IAM)。碘乙酸可使巯基羧甲基化,防止游离的半胱氨酸降解或形成链间二硫键。
具体操作步骤如下:蛋白先透析至1X PBS或性质接近的缓冲液中,加入10 mM半胱氨酸还原硫基,室温反应约半小时。直接在反应液中加入20 mM碘乙酸,避光室温反应半小时进行烷基化,之后可透析至下步实验所需buffer。在进行烷基化的过程中,要注意蛋白浓度不可过高(本人使用时为<1 mg/ml),否则在加碘乙酸进行烷基化时很容易发生沉淀。如果发现加入碘乙酸后,出现大量沉淀,可以尝试降低蛋白浓度,或者尝试其他方法。
3. 磷酸化
假设蛋白A需要进行磷酸化修饰,并且鉴定磷酸化A的激酶B,如果需要在体外用B磷酸化A,需要先将两个蛋白分别纯化出来,将A和B按照一定的比例(比如10:1)混合,同时加入ATP和Mg2+,孵育一定的时间,再利用A和B理化性质的差异,将B除去,得到磷酸化的A,通过Western Blotting和质谱鉴定磷酸化的特异性。以PDK1磷酸化S6K1为例,
先分别纯化PDK1-KD和S6K1-KD,PDK1-KD带有His Tag,而S6K1-KD 切掉His Tag,将S6K1-KD和PDK1-KD按照10:1的比例混合,同时加入5mM ATP和2mM MgCl2,4℃孵育72小时后,过Ni柱,S6K1-KD在穿流液中。通过Western Blotting和质谱鉴定S6K1-KD是否发生特异位点的磷酸化修饰。
四.仪器的使用
1. AKTA
1.1. AKTA使用权限
1. 每位进行AKTA操作的同学必须先受过培训,而且经管理员认可并为其设立帐户后,才可以独立操作AKTA。
2. 每个使用者在操作AKTA时,请登录自己的账户,并在实验完成后退出。
3. 每个使用者在实验结束后请收拾台面,并在登记本上登记。
4. 如果使其他小组的仪器,必须先获得该组管理员的许可。
5. 在AKTA使用过程中遇到任何问题或故障,请跟管理员联系。
1.2. AKTA操作说明
1. AKTA仪器开机:先开AKTA电源,等待AKTA完全启动后,再开电脑。关机:先退出union软件,再关闭电脑,最后关闭AKTA电源。在AKTA关开电源之间,请至少等待15秒钟。
2. 使用者登录账户后,仪器连接纯化柱前,请先用高流速如5或10 ml/min冲洗,以便除去管道系统的气泡、残留溶液或盐分等。如果系统压力过高,可能是在线过滤膜堵了,请进行更换。
3. 先设定Alarm pressure和flowrate,等各项指标稳定(基线走平)后,再连接纯化柱。
4. 接连纯化柱前,先确定管道内有液体滴出。先将管道与上端接口连接,但不要拧紧,再将下端接口拧松,然后将上端拧紧,最后将下端与管道连接并拧紧。同样,卸纯化柱时,先将盖帽与下端接口连接,不要拧紧,再将上端接口拧松,然后将下端拧紧,最后将上端与盖帽连接并拧紧。
5. 上样前loop的清洗:小体积的loop在线清洗,大的如10 ml,50 ml的loop 可以拆开清洗。如果不会使用,请跟管理员联系。
6. 上样的针头末端为平头,不同于普通医用针头,决不能混用。上样后,不可以将针头悬挂在上样口,以免损坏上样接头。如果针头堵塞,可用细金属丝(与针头一起配置的)进行疏通。
7. 收集器的转盘不能强行转动。请先将止动阀(一个2 cm高,黑色橡胶外套的圆柱体,紧靠转盘)拉开,同时转动转盘,调至合适位置。
8. 收集器使用时,收集臂管道口下侧的垂直竖线放置在接收管相切的地方。在不用的时候,收集臂请放置在空闲位置(第一组指向圆心,其他组远离转盘)。
9. 在实验结束时,请确保泵的吸口浸在20%乙醇中,所有管道也处于乙醇溶液中。
10. 1、3组AKTA上有一个100 ml黑该瓶,内装20%乙醇,用于泵的润洗。请及时更换乙醇溶液,以免长菌。
11.所有使用者在使用结束后,请收拾好仪器和台面,所有配件放回原处,最后做好登记。
2. 中空膜系统
2.1. 使用前柱子处理
1. 新柱
新购买的滤柱,必须清洗之后才能使用,特别是超滤滤柱。
超滤柱要用纯水或者含有100 ppm NaOCl冲洗90 min,洗完后洗掉NaOCl,才能处理样品。微滤柱要用纯水或者含有100 ppm NaOCl冲洗10 min,洗完后洗掉NaOCl,才能处理样品。清洗完毕后,必须测初始水通量,并作好记录(压力要适中,10-15 psi)。如果水通量与上次使用相比,变小很多,则说明滤柱可能已经被堵了,请先处理好滤柱后再上样品。
2. 用过的滤柱
滤柱用前须除掉保藏液,用纯水或者含有100ppmNaOCl(即在纯水中加入几滴八四消毒液)洗到透过液中性即可。再用实验所用缓冲液润洗滤柱5-10分钟。
3. 利用超滤浓缩样品或改换样品缓冲液
推荐流速:1-1.5L/min/ft2(4M滤柱,1.2-2L/min/ft2)
推荐过膜压力(TMP):超滤, 20-30psi;微滤,3-10psi
如果浓缩大体积样品,则将样品全部加入样品管中,既循环又透过一段时间,至样品体积达到实验需求。如果需要更换缓冲液,则通过进样管吸入新的缓冲液,既循环又透过至加入的缓冲液体积是样品体积的4-5倍以上。在浓缩或更换缓冲液时,蛋白可能发生沉淀或聚集导致压力增高,必须时常观察膜压力的大小,通过调节管道上的阀门,控制膜压力为20-30 psi。
4.滤柱清洗
先用缓冲液只循环不透过清洗5-10 min,既循环又透过清洗10-20 min。再用0.1-0.5 M NaOH只循环不透过清洗15-20 min,既循环又透过30-40 min。清洗完毕后进行水通量测定,与初始水通量比较,约接近越好。如果水通量变小很多,说明蛋白沉集在滤柱上,可尝试延长NaOH清洗时间,并在0.1-0.5 M NaOH中加入100 ppm NaOCl(几滴八四消毒液)进行清洗。如果没有明显效果,还尝试用稍热的含100 ppm NaOCl的0.1-0.5 M NaOH进行清洗。
5. 滤柱保藏
3周内用:0.1MNaOH保存。
3周内不用:定时更换新鲜的0.1MNaOH保存。
蛋白质纯化的方法 蛋白质的分离纯化方法很多,主要有: (一)根据蛋白质溶解度不同的分离方法 1、蛋白质的盐析 中性盐对蛋白质的溶解度有显著影响,一般在低盐浓度下随着盐浓度升高,蛋白质的溶解度增加,此称盐溶;当盐浓度继续升高时,蛋白质的溶解度不同程度下降并先后析出,这种现象称盐析,将大量盐加到蛋白质溶液中,高浓度的盐离子(如硫酸铵的SO4和NH4)有很强的水化力,可夺取蛋白质分子的水化层,使之“失水”,于是蛋白质胶粒凝结并沉淀析出。盐析时若溶液pH在蛋白质等电点则效果更好。由于各种蛋白质分子颗粒大小、亲水程度不同,故盐析所需的盐浓度也不一样,因此调节混合蛋白质溶液中的中性盐浓度可使各种蛋白质分段沉淀。 影响盐析的因素有:(1)温度:除对温度敏感的蛋白质在低温(4度)操作外,一般可在室温中进行。一般温度低蛋白质溶介度降低。但有的蛋白质(如血红蛋白、肌红蛋白、清蛋白)在较高的温度(25度)比0度时溶解度低,更容易盐析。(2)pH值:大多数蛋白质在等电点时在浓盐溶液中的溶介度最低。(3)蛋白质浓度:蛋白质浓度高时,欲分离的蛋白质常常夹杂着其他蛋白质地一起沉淀出来(共沉现象)。因此在盐析前血清要加等量生理盐水稀释,使蛋白质含量在2.5-3.0%。 蛋白质盐析常用的中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。其中应用最多的硫酸铵,它的优点是温度系数小而溶解度大(25度时饱和溶液为4.1M,即767克/升;0度时饱和溶解度为3.9M,即676克/升),在这一溶解度范围内,许多蛋白质和酶都可以盐析出来;另外硫酸铵分段盐析效果也比其他盐好,不易引起蛋白质变性。硫酸铵溶液的pH常在4.5-5.5之间,当用其他pH值进行盐析时,需用硫酸或氨水调节。 蛋白质在用盐析沉淀分离后,需要将蛋白质中的盐除去,常用的办法是透析,即把蛋白质溶液装入秀析袋内(常用的是玻璃纸),用缓冲液进行透析,并不断的更换缓冲液,因透析所需时间较长,所以最好在低温中进行。此外也可用葡萄糖凝胶G-25或G-50过柱的办法除盐,所用的时间就比较短。
蛋白质分离纯化的一般程序可分为以下几个步骤: (一)材料的预处理及细胞破碎 分离提纯某一种蛋白质时,首先要把蛋白质从组织或细胞中释放出来并保持原来的天然状态,不丧失活性。所以要采用适当的方法将组织和细胞破碎。常用的破碎组织细胞的方法有: 1. 机械破碎法 这种方法是利用机械力的剪切作用,使细胞破碎。常用设备有,高速组织捣碎机、匀浆器、研钵等。 2. 渗透破碎法 这种方法是在低渗条件使细胞溶胀而破碎。 3. 反复冻融法 生物组织经冻结后,细胞内液结冰膨胀而使细胞胀破。这种方法简单方便,但要注意那些对温度变化敏感的蛋白质不宜采用此法。 4. 超声波法 使用超声波震荡器使细胞膜上所受张力不均而使细胞破碎。 5. 酶法 如用溶菌酶破坏微生物细胞等。 (二)蛋白质的抽提 通常选择适当的缓冲液溶剂把蛋白质提取出来。抽提所用缓冲液的pH、离子强度、组成成分等条件的选择应根据欲制备的蛋白质的性质而定。如膜蛋白的抽提,抽提缓冲液中一般要加入表面活性剂(十二烷基磺酸钠、tritonX-100 等),使膜结构破坏,利于蛋白质与膜分离。在抽提过程中,应注意温度,避免剧烈搅拌等,以防止蛋白质的变性。(三)蛋白质粗制品的获得选用适当的方法将所要的蛋白质与其它杂蛋白分离开来。比较方便的有效方法是根据蛋白质溶解度的差异进行的分离。常用的有下列几种方法: 1.等电点沉淀法不同蛋白质的等电点不同,可用等电点沉淀法使它们相互分离。 2.盐析法 不同蛋白质盐析所需要的盐饱和度不同,所以可通过调节盐浓度将目的蛋白沉淀析出。被盐析沉淀下来的蛋白质仍保持其天然性质,并能再度溶解而不变性。 3.有机溶剂沉淀法 中性有机溶剂如乙醇、丙酮,它们的介电常数比水低。能使大多数球状蛋白质在水溶液中的溶解度降低,进而从溶液中沉淀出来,因此可用来沉淀蛋白质。此外,有机溶剂会破坏蛋白质表面的水化层,促使蛋白质分子变得不稳定而析出。由于有机溶剂会使蛋白质变性,使用该法时,要注意在低温下操作,选择合适的有机溶剂浓度。 (四)样品的进一步分离纯化
蛋白质分离纯化 How to detect, analyze and prepare?
Different purposes, different protocols Detective/analytical level: nanogram(ng) or picogram(pg) Preparative level: milligram (mg)
Protein detection/analysis: 1, Hybridization: Western blot 2, Immunological Techniques: Elisa & Co-IP 3, electrophoresis SDS PAGE, 2-D gel, CE, IEF 4, chromatography: HPLC, FPLC, 5, Spectrometry: DLS, NMR, Mass-Spect, LC-MS 6, X-ray crystallography …
Western blot: Protein-protein This method is dependent on the use of a high-quality antibody directed against a desired protein. Southern blot: DNA-DNA (Edward Southern. Detection of specific sequences among DNA fragments separated by gel electrophoresis. J Mol Biol. 1975 Nov 5;98(3):503-17) Northern blot: DNA-RNA
含组氨酸标签的蛋白的诱导表达及纯化 一.用IPTG诱导启动子在大肠杆菌中表达克隆化基因 所需特殊试剂:1M IPTG 1.将目的基因与IPTG诱导表达载体连接,构成重组质粒并转化相应的 表达用的大肠杆菌。将转化体铺于含相应抗生素的LB平板,37℃培养 过夜。通过酶切序列分析等筛选带有插入片段的转化体。 2.分别挑取对照菌和重组菌1个菌落,接种于1ml含有相应抗生素的LB 培养液中,37℃通气培养过夜。 3.取100微升过夜培养物接种于5ml含有相应抗生素的LB培养液中(各 10份),适当的温度(20-37℃)震荡培养4小时,至对数中期(A550 =0.1-1.0)。 4.对照菌和重组菌各取1ml未经诱导的培养物于离心管中,剩余培养物 中加入IPTG至终浓度分别为0.5,1.0,1.5,2.5,3.0,3.5,4.0,4.5, 5.0mM相同的温度继续通气培养。 5.在诱导的1,2,3,4,5个小时取1ml样品于Ep管中。 细菌的生长速率严重影响外源蛋白的表达,因此必须对接种菌量,诱 导前细菌生长时间和诱导后细菌密度进行控制。生长过度或过速会加 重细菌合成系统的负担,导致包涵体的形成。生长温度可能是影响大 肠杆菌高度表达目的蛋白的最重要因素。低温培养能在一定程度上抑 制包涵体的形成。IPTG的浓度对表达水平的影响也非常大。所以通过 试验确定最佳的培养条件是很必要的。 6.将所有样本室温最高速度离心1分钟,弃上清,沉淀重悬于100微升 1×SDS蛋白上样缓冲液中,100℃加热5分钟,室温最高速度离心1 分钟,取15微升样品上样于SDS聚丙烯酰胺凝胶,用SDS-PAGE 观察表达产物条带,从而确定优化的培养条件。 二.大量表达靶蛋白 1.取保存的重组大肠杆菌菌液150微升接种于30毫升含相应抗生素的 LB培养液中,在100毫升锥形瓶中,300rpm,37℃通气过夜培养。
蛋白质纯化的方法选择 随着分子生物学的发展,越来越多的科研人员熟练掌握了分子生物学的各种试验技术,并研制成套试剂盒,使基因克隆表达变得越来越容易。但分子生物学的上游工作往往并非是最终目的,分子克隆与表达的关键是要拿到纯的表达产物,以研究其生物学作用,或者大量生产出可用于疾病治疗的生物制品。相对与上游工作来说,分子克隆的下游工作显得更难,蛋白纯化工作非常复杂,除了要保证纯度外,蛋白产品还必须保持其生物学活性。纯化工艺必须能够每次都能产生相同数量和质量的蛋白,重复性良好。这就要求应用适应性非常强的方法而不是用能得到纯蛋白的最好方法去纯化蛋白。在实验室条件下的好方法却可能在大规模生产应用中失败,因为后者要求规模化,且在每日的应用中要有很好的重复性。本文综述了蛋白质纯化的基本原则和各种蛋白纯化技术的原理、优点及局限性,以期对蛋白纯化的方法选择及整体方案的制定提供一定的指导。 1、蛋白纯化的一般原则 蛋白纯化要利用不同蛋白间内在的相似性与差异,利用各种蛋白间的相似性来除去非蛋白物质的污染,而利用各蛋白质的差异将目的蛋白从其他蛋白中纯化出来。每种蛋白间的大小、形状、电荷、疏水性、溶解度和生物学活性都会有差异,利用这些差异可将蛋白从混合物如大肠杆菌裂解物中提取出来得到重组蛋白。蛋白的纯化大致分为粗分离阶段和精细纯化阶段二个阶段。粗分离阶段主要将目的蛋白和其他细胞成分如DNA、RNA等分开,由于此时样本体积大、成分杂,要求所用的树脂高容量、高流速,颗粒大、粒径分布宽.并可以迅速将蛋白与污染物分开,防止目的蛋白被降解。精细纯化阶段则需要更高的分辨率,此阶段是要把目的蛋白与那些大小及理化性质接近的蛋白区分开来,要用更小的树脂颗粒以提高分辨率,常用离子交换柱和疏水柱,应用时要综合考虑树脂的选择性和柱效两个因素。选择性树脂与目的蛋白结合的特异性,柱效则是指各蛋白成分逐个从树脂上集中洗脱的能力,洗脱峰越窄,柱效越好。仅有好的选择性,洗脱峰太宽,蛋白照样不能有效分离。 2、各种蛋白纯化方法及其优、缺点 2.1 蛋白沉淀蛋白能溶于水是因为其表面有亲水性氨基酸,在蛋白质的等电点处若溶液的离子强度特别高或者特别低,蛋白则倾向于从溶液中析出。硫酸铵是沉淀蛋白最常用的盐,因为它在冷的缓冲液中溶解性好,冷的缓冲液有利于保持目的蛋白的活性。硫酸铵分馏常用作试验室蛋白纯化的第一步,它可以初步粗提蛋白质,去除非蛋白成分。蛋白质在硫酸铵沉淀中较稳定,可以短期在这种状态下保存中间产物,当前蛋白质纯化多采用这种办法进行粗分离翻。在规模化生产上硫酸铵沉淀方法仍存在一些问题,硫酸铵对不锈钢器具的腐蚀性很强。其他的盐如硫酸钠不存在这种问题,但其纯化效果不如硫酸铵。除了盐析外蛋白还可以用多聚物如PEG和防冻剂沉淀出来,PEG是一种惰性物质,同硫酸铵一样对蛋白有稳定效果,在缓慢搅拌下逐渐提高冷的蛋白溶液中的PEG浓度,蛋白沉淀可通过离心或过滤获得,蛋白可在这种状态下长期保存而不损坏。蛋白沉淀对蛋白纯化来说并不是多么好的方法,因为它只能达到几倍的纯化效果,而我们在达到目的前需要上千倍的纯化。其好处是可以把蛋白从混杂有蛋白酶和其他有害杂质的培养基及细胞裂解物中解脱出来。 2.2 缓冲液的更换虽然更换缓冲液不能提高蛋白纯度,但它却在蛋白纯化方案中起着极其重要的作用。不同的蛋白纯化方法需要不同pH及不同离子强度的缓冲液。假如你用硫酸铵将蛋白沉淀出来,毫无疑问蛋白是处在高盐环境中,需要想办法脱盐,可用的方法有利用半透膜透析,通过勤换透析液体去除盐分,此法尚可,但需几个小时,通常要过夜,也难以用于大规模纯化中。新型的设备将透析膜夹在两个板中间,板的一侧加缓冲液,另一侧加需脱盐的蛋白溶液,并在蛋白溶液一侧通过泵加压,可以使两侧溶液在数小时内达到平衡,若增加对蛋白溶液的压力,还可迫使水分和盐更多通过透析膜进入透析液达到对蛋白浓缩的目的。也有出售的脱盐柱,柱内的填料是小孔径的颗粒,蛋白分子不能进入孔内,先于高浓度盐离子从柱中流出,从而使二者分离。蛋白纯化的每一步都会造成目的蛋白的丢失,缓冲液平衡的步骤尤甚。蛋白会结合在任何它能接触的表面上,剪切力、起泡沫和离子强度的快速变化很容易让蛋白失活。 2.3 离子交换色谱这是在所有的蛋白纯化与浓缩方法中最有效方法。基于蛋白与离子交换树脂间的相互电荷作用,通过选择不同的缓冲液,同一种蛋白既可以和阴离子交换树脂(能结合带负电荷的分子)结合,也可以和阳离子交换树脂结合。树脂所用的带电基团有四种:二乙基氨基乙基用于弱的阴离子交换树脂;羧甲基用于弱的阳离子交换树脂;季铵用于强阴离子交换树脂;甲基磺酸酯用于强阳离子交换树脂。蛋白质由氨基酸组成,氨基酸在不同的pH环境中所带总电荷不同。大多数蛋白在生理pH(pH6~8)下带负电荷,需用阴离子交换柱纯化,极端的pH下蛋白会变性失活.应尽量避免。由于在某个特定的pH下不同的蛋白所带电荷数不同,与树脂的结合力也不同,随着缓冲液中盐浓度的增加或pH的变化,蛋白按结合力的强弱被依次洗脱。在工业化生产中更多地是改变盐浓度而不是去改变pH值,因为前者更容易控制。在实验室中几乎总是用盐浓度梯度去洗脱离子交换柱,利用泵的辅助可以使流入柱的缓冲液中盐浓度平稳地上升,当离子强度能够中和蛋白的电荷时,蛋白就被从柱上洗脱下来。但在工业生产中盐浓度很难精确控制,所以常用分步洗脱而不足连续升高的盐梯度。与排阻层析相比,离子交换特异性更好,有更多的参数可以调整以获得最优的纯化效果,树脂也比较便宜。值得一提的是,即便是用最精确控制的条件,仅用离子交换单一的方法也得不到纯的蛋白,还需要其他的纯化步骤。
Protocol 蛋白质纯化方法(镍柱) 柱前操作 1.IPTG诱导后,收菌,8000rpm/min(r/m)离心10min; 2.用Binding Buffer(BB)溶解(每100ml原菌液加BB 20ml),超声裂解30min(工作:5s,停止:5s),1500r/m离心10min,去除杂质; 3.取上清,12000r/m离心20min, 得包涵体; 4.用含2M尿素的BB洗包涵体,12000r/m离心20min,(上清做电泳);??? 5.用含6M尿素的BB溶解包涵体,12000r/m离心20min,(上清做电泳); 6.对照电泳结果,将上清或包涵体溶解液上柱; 平衡柱子(柱体积:V) 7. 3V(3倍柱体积)ddH2O(洗乙醇); 8. 5V Charge Buffer(CB); ??? 9. 3V BB; 柱层析 10.上样; 11. 10V Washing Buffer(WB); 12. 6V Elute Buffer(EB); 13.分管收集,每管1~2ml. 各种缓冲液配方 1. 8×BB: 4M NaCl, 160mM Tris-HCl, 40mM imidazole(咪唑),pH=7.9 1000ml NaCl: 58.44×4=233.76g Tris-HCl: 121.14×160×10-3=19.3824g Imidazole: 68.08×40×10-3=2.7232g 2. 8×CB: 400mM NiSO4 1000ml NiSO4: 262.8×400×10-3=105.12g 3. 8×WB: 4M NaCl, 160mM Tris-HCl, 480mM imidazole, pH=7.9 1000ml NaCl: 233.76g, Tris-HCl:19.3824g, Imidazole: 32.6784g 4. 4×EB: 2M NaCl, 80mM Tris-HCl, 4M imidazole, pH=7.9 1000ml NaCl: 118.688g, Tris-HCl:9.6912g, Imidazole: 272.32g 5. 6M 尿素 1000ml 尿素:60.06×6=360.36g
蛋白质的分离纯化方法 2.1根据分子大小不同进行分离纯化 蛋白质是一种大分子物质,并且不同蛋白质的分子大小不同,因此可以利用一些较简单的方法使蛋白 质和小分子物质分开,并使蛋白质混合物也得到分离。根据蛋白质分子大小不同进行分离的方法主要有透析、超滤、离心和凝胶过滤等。透析和超滤是分离蛋白质时常用的方法。透析是将待分离的混合物放入半透膜制成的透析袋中,再浸入透析液进行分离。超滤是利用离心力或压力强行使水和其它小分子通过半透膜,而蛋白质被截留在半透膜上的过程。这两种方法都可以将蛋白质大分子与以无机盐为主的小分子分开。它们经常和盐析、盐溶方法联合使用,在进行盐析或盐溶后可以利用这两种方法除去引入的无机盐。由于超滤过程中,滤膜表面容易被吸附的蛋白质堵塞,以致超滤速度减慢,截流物质的分子量也越来越小。所以在使用超滤方法时要选择合适的滤膜,也可以选择切向流过滤得到更理想的效果离心也是经常和其它方法联合使用的一种分离蛋白质的方法。当蛋白质和杂质的溶解度不同时可以利用离心的方法将它们分开。例如,在从大米渣中提取蛋白质的实验中,加入纤维素酶和α-淀粉酶进行预处理后,再用离心的方法将有用物质与分解掉的杂质进行初步分离[3]。使蛋白质在具有密度梯度的介质中离心的方法称为密度梯度(区带)离心。常用的密度梯度有蔗糖梯度、聚蔗糖梯度和其它合成材料的密度梯度。可以根据所需密度和渗透压的范围选择合适的密度梯度。密度梯度离心曾用于纯化苏云金芽孢杆菌伴孢晶体蛋白,得到的产品纯度高但产量偏低。蒋辰等[6]通过比较不同密度梯度介质的分离效果,利用溴化钠密度梯度得到了高纯度的苏云金芽孢杆菌伴孢晶体蛋白。凝胶过滤也称凝胶渗透层析,是根据蛋白质分子大小不同分离蛋白质最有效的方法之一。凝胶过滤的原理是当不同蛋白质流经凝胶层析柱时,比凝胶珠孔径大的分子不能进入珠内网状结构,而被排阻在凝胶珠之外,随着溶剂在凝胶珠之间的空隙向下运动并最先流出柱外;反之,比凝胶珠孔径小的分子后流出柱外。目前常用的凝胶有交联葡聚糖凝胶、聚丙烯酰胺凝胶和琼脂糖凝胶等。在甘露糖蛋白提纯的过程中使用凝胶过滤方法可以得到很好的效果,纯度鉴定证明产品为分子量约为32 kDa、成分是多糖∶蛋白质(88∶12)、多糖为甘露糖的单一均匀糖蛋白[1]。凝胶过滤在抗凝血蛋白的提取过程中也被用来除去大多数杂蛋白及小分子的杂质[7]。 2.2 根据溶解度不同进行分离纯化 影响蛋白质溶解度的外部条件有很多,比如溶液的pH值、离子强度、介电常数和温度等。但在同一条件下,不同的蛋白质因其分子结构的不同而有不同的溶解度,根据蛋白质分子结构的特点,适当地改变外部条件,就可以选择性地控制蛋白质混合物中某一成分的溶解度,达到分离纯化蛋白质的目的。常用的方法有等电点沉淀和pH值调节、蛋白质的盐溶和盐析、有机溶剂法、双水相萃取法、反胶团萃取法等。 等电点沉淀和pH值调节是最常用的方法。每种蛋白质都有自己的等电点,而且在等电点时溶解度最
捕获阶段:目标是澄清、浓缩和稳定目标蛋白。中度纯化阶段:目标是除去大多数大量杂质,如其它蛋白、核酸、内毒素和病毒等。精制阶段:除去残余的痕量杂质和必须去除的杂质。分离方法的选择根据蛋白质的特殊性质采用不同的分离方法:蛋白质的性质方法电荷(等电点)离子交换(IEX)分子量凝胶过滤(GF)疏水性疏水(HIC)反相(RPC)特异性结合亲和(AC)每一种方法都有分辨率、处理量、速度和回收率之间的平衡。分辨率:由选择的方法和层析介质生成窄峰的能力来实现。总的来说,当杂质和目标蛋白性质相似时,在纯化的最后阶段分辨率是重要因素。处理量:一般指在纯化过程中目标蛋白的上样量。如上样体积、浓度等。速度:在初纯化中是重要因素,此时杂质如蛋白酶必须尽快除去。回收率:随着纯化的进行渐趋重要,因为纯化产物的价值在增加。在三阶段纯化策略中每一种方法的适用性见下表:技术主要特点捕获中度纯化精制样品起始状态样品最终状态IEX高分辨率高容量高速度低离子强度样品体积不限高离子强度或pH改变。样品浓缩HIC 分辨率好容量好高速度高离子强度样品体积不限低离子强度样品浓缩AC高分辨率高容量高速度结合条件特殊样品体积不限洗脱条件特殊样品浓缩GF高分辨率(使用Supedex)样品体积(<总柱体积的5%)和流速范围有限制缓冲液更换(如果需要)样品稀释RPC高分辨率需要有机溶剂在有机溶剂中,有损失生物活性的风险提示:1、通过组和各种方法使纯化步骤之间的样品处理减至最少,以避免需要调节样品。第一个步骤的产物的洗脱条件应适宜于下一个步骤的起始条件。2、硫酸铵沉淀是常用的样品澄清和浓缩方法,所以HIC是捕获阶段的理想方法。3、 GF很适宜在由浓缩效应的方法(IEX、 HIC、 AC)后使用,凝胶过滤对上样体积有限制,但不受缓冲液条件的影响。4、在捕获阶段选择对目标蛋白具有最高选择性或/和处理量的方法5、如果对目标蛋白的性质了解甚少的情况下,可采用IEX-HIC-GF的方法组合作为标准方案。6、只要目标蛋白耐受的情况下,可以考虑采用RPC 方法用于精制阶段。注:应该指出,三阶段纯化策略不是说所有的策略都必须是三个纯化步骤。所用的步骤数目取决于纯度要求和蛋白的最终用途。 蛋白质的蛋白质特性与分离纯化技术的选择 摘要:蛋白质的一级、二级、三级和四级结构决定了它的物理、化学、生物化学、物理化学和生物学性质,综述了不同蛋白质之间的性质存在差异或者改变条件是使之具有差异,利用一种同时多种性质差异,在兼顾收率和纯度的情况下,选择蛋白质提纯的方法。 关键词:蛋白质分离纯化 前言: 蛋白质在组织或细胞中一般都是以复杂的混合物形式存在,每种类型的细胞都含有成千种不同的蛋白质。蛋白质的分离和提纯工作是一项艰巨而繁重的任务,到目前为止,还没有一个单独的或一套现成的方法能把任何一种蛋白质从复杂的混合物中提取出来,但对任何一种蛋白质都有可能选择一套适当的分离提纯程序来获取高纯度的制品。
(二)利用溶解度差别 影响蛋白质溶解度的外部因素有:1、溶液的pH;2、离子强度;3、介电常数;4、温度。但在同一的特定外部条件下,不同蛋白质具有不同的溶解度。 1、等电点沉淀:原理:蛋白质处于等电点时,其净电荷为零,由于相邻蛋白质分子之间没有静电斥力而趋于聚集沉淀。因此在其他条件相同时,他的溶解度达到最低点。在等电点之上或者之下时,蛋白质分子携带同种符号的净电荷而互相排斥,阻止了单个分子聚集成沉淀,因此溶解度较大。不同蛋白质具有不同的等电点,利用蛋白质在等电点时的溶解度最低的原理,可以把蛋白质混合物分开。当pH被调到蛋白质混合物中其中一种蛋白质的等电点时,这种蛋白质大部分和全部被沉淀下来,那些等电点高于或低于该pH的蛋白质则仍留在溶液中。这样沉淀出来的蛋白质保持着天然的构象,能重新溶解于适当的pH和一定浓度的盐溶液中。 5、盐析与盐溶:原理:低浓度时,中性盐可以增加蛋白质溶解度这种现象称为盐溶.盐溶作用主要是由于蛋白质分子吸附某种盐类离子后,带电层使蛋白质分子彼此排斥,而蛋白质与水分子之间的相互作用却加强,因而溶解度增高。球蛋白溶液在透析过程中往往沉淀析出,这就是因为透析除去了盐类离子,使蛋白质分子之间的相互吸引增加,引起蛋白质分子的凝集并沉淀。当溶液的离子强度增加到一定程度时,蛋白质溶解程度开始下降。当离子强度增加到足够高时,例如饱和或半饱和程度,很多蛋白质可以从水中沉淀出来,这种现象称为盐析。盐析作用主要是由于大量中性盐的加入使水的活度降低,原来溶液中的大部分甚至全部的自由水转变为盐离子的水化水。此时那些被迫与蛋白质表面的疏水集团接触并掩盖他们的水分子成为下一步最自由的可利用的水分子,因此被移去以溶剂化盐离子,留下暴露出来的疏水基团。蛋白质疏水表面进一步暴露,由于疏水作用蛋白质聚集而沉淀。 盐析沉淀的蛋白质保持着他的天然构象,能再溶解。盐析的中性盐以硫酸铵为最佳,在水中的溶解度很高,而溶解度的温度系数较低。 3、有机溶剂分级分离法:与水互溶的有机溶剂(甲醇、乙醇和丙酮等)能使蛋白质在水中的溶解度显著降低。在室温下有机溶剂会引起蛋白质变性,如果预先将有机溶剂冷却到-40°C以下,然后在不断搅拌下逐滴加入有机溶剂,以防局部浓度过高,那么变性可以得到很大程度缓解。蛋白质在有机溶剂中的溶解度也随温度、pH和离子强度而变化。在一定温度、pH和离子强度条件下,引起蛋白质沉淀的有机溶剂的浓度不同,因此控制有机溶剂浓度也可以分
蛋白质纯化与结晶的原理 获得蛋白质的晶体结构的第一个瓶颈,就是制备大量纯化的蛋白质(>10 mg),其浓度通常在10 mg/ml 以上,并以此为基础进行结晶条件的筛选。运用重组基因的技术,将特定基因以选殖(clone)的方式嵌入表现载体(expression vector)内,此一载体通常具有易于调控的特性。之后再将带有特定基因的载体送入可快速生长的菌体中,如大肠杆菌(Escherichia coli),在菌体快速生长的同时,也大量生产表现载体上的基因所解译出之蛋白质。一般而言纯度越高的蛋白质比较有机会形成晶体,因此纯化蛋白质的步骤就成为一个重要的决定因素。 在取得高纯度的蛋白质溶液后,接下来就是晶体的培养。蛋白质晶体与其他化合物晶体的形成类似,是在饱和溶液中慢慢产生的,每一种蛋白质养晶的条件皆有所差异,影响晶体形成的变量很多,包含化学上的变量,如酸碱度、沈淀剂种类、离子浓度、蛋白质浓度等;物理上的变数,如溶液达成过饱和状态的速率、温度等;及生化上的变数,如蛋白质所需的金属离子或抑制剂、蛋白质的聚合状态、等电点等,皆是养晶时的测试条件。截至目前为止,并无一套理论可以预
测结晶的条件,所以必须不断测试各种养晶溶液的组合后,才可能得到一颗完美的单一晶体(图一) 。 蛋白质晶体的培养,通常是利用气相扩散法(Vapor Diffusion Method) 的原理来达成;也就是将含有高浓度的蛋白质(10-50 mg/ml)溶液加入适当的溶剂,慢慢降低蛋白质的溶解度,使其接近自发性的沈淀状态时,蛋白质分子将在整齐的堆栈下形成晶体。举例来说,我们将蛋白质溶于低浓度(~1.0 M) 的硫酸铵溶液中,将它放置于一密闭含有高浓度(~2.0 M)硫酸铵溶液的容器中,由气相平衡,可以缓慢提高蛋白质溶液中硫酸铵的浓度,进而达成结晶的目的(图二)。 蛋白质晶体在外观上与其他晶体并无明显不同之处,但在晶体的内部,却有很大的差异。一般而言,蛋白质晶体除了蛋白质分子外,其他的空间则充满约40 %至60 %之间的水溶液,其液态的成分不仅使晶体易碎,也容易使蛋白质分子在晶格排列上有不规则的情形出现,造成晶体处理时的困难及绕射数据上的搜集不易等缺点。但也由于高含水量的特性,让蛋白质分子在晶体内与水溶液中的状态,极为相似。所以由晶体所解出的蛋白质结构,基本上可视为自然状态下的结构。
蛋白质的提取与纯化 一,蛋白质的提取 大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。 (一)水溶液提取法 稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大、是提取蛋白质最常用的溶剂,通常用量是原材料体积的1-5倍,提取时需要均匀的搅拌,以利于蛋白质的溶解。提取的温度要视有效成份性质而定。一方面,多数蛋白质的溶解度随着温度的升高而增大,因此,温度高利于溶解,缩短提取时间。但另一方面,温度升高会使蛋白质变性失活,因此,基于这一点考虑提取蛋白质和酶时一般采用低温(5度以下)操作。为了避免蛋白质提以过程中的降解,可加入蛋白水解酶抑制剂(如二异丙基氟磷酸,碘乙酸等)。 下面着重讨论提取液的pH值和盐浓度的选择。 1、pH值 蛋白质,酶是具有等电点的两性电解质,提取液的pH值应选择在偏离等电点两侧的pH 范围内。用稀酸或稀碱提取时,应防止过酸或过碱而引起蛋白质可解离基团发生变化,从而导致蛋白质构象的不可逆变化,一般来说,碱性蛋白质用偏酸性的提取液提取,而酸性蛋白质用偏碱性的提取液。 2、盐浓度 稀浓度可促进蛋白质的溶,称为盐溶作用。同时稀盐溶液因盐离子与蛋白质部分结合,具有保护蛋白质不易变性的优点,因此在提取液中加入少量NaCl等
中性盐,一般以0.15摩尔。升浓度为宜。缓冲液常采用0.02-0.05M磷酸盐和碳酸盐等渗盐溶液。 (二)有机溶剂提取法 一些和脂质结合比较牢固或分子中非极性侧链较多的蛋白质和酶,不溶于水、稀盐溶液、稀酸或稀碱中,可用乙醇、丙酮和丁醇等有机溶剂,它们具的一定的亲水性,还有较强的亲脂性、是理想的提脂蛋白的提取液。但必须在低温下操作。丁醇提取法对提取一些与脂质结合紧密的蛋白质和酶特别优越,一是因为丁醇亲脂性强,特别是溶解磷脂的能力强;二是丁醇兼具亲水性,在溶解度范围内(度为10%,40度为6.6%)不会引起酶的变性失活。另外,丁醇提取法的pH及温度选择范围较广,也适用于动植物及微生物材料。 二、蛋白质的分离纯化 蛋白质的分离纯化方法很多,主要有: (一)根据蛋白质溶解度不同的分离方法 1、蛋白质的盐析 中性盐对蛋白质的溶解度有显著影响,一般在低盐浓度下随着盐浓度升高,蛋白质的溶解度增加,此称盐溶;当盐浓度继续升高时,蛋白质的溶解度不同程度下降并先后析出,这种现象称盐析,将大量盐加到蛋白质溶液中,高浓度的盐离子(如硫酸铵的SO4和NH4)有很强的水化力,可夺取蛋白质分子的水化层,使之“失水”,于是蛋白质胶粒凝结并沉淀析出。盐析时若溶液pH在蛋白质等电点则效果更好。由于各种蛋白质分子颗粒大小、亲水程度不同,故盐析所需的盐浓度也不一样,因此调节混合蛋白质溶液中的中性盐浓度可使各种蛋白质分段沉淀。
分离纯化某一特定蛋白质的一般程序可以分为前处理、粗分级、细分级三步。 1.前处理:分离纯化某种蛋白质,首先要把蛋白质从原来的组织或细胞中以溶解的状态释放出来并保持原来的天然状态(如果做不到呢?比如蛋白以包涵体形式存在),不丢失生物活性。为此,动物材料应先提出结缔组织和脂肪组织,种子材料应先去壳甚至去种皮以免手单宁等物质的污染,油料种子最好先用低沸点(为什么呢)的有机溶剂如乙醚等脱脂。然后根据不同的情况,选择适当的方法,将组织和细胞破碎。动物组织和细胞可用电动捣碎机或匀浆机破碎或用超声波处理破碎。植物组织和细胞由于具有纤维素、半纤维素和果胶等物质组成的细胞壁,一般需要用石英砂或玻璃粉和适当的提取液一起研磨的方法或用纤维素酶处理也能达到目的。细菌细胞的破碎比较麻烦,因为整个细菌细胞壁的骨架实际上是一个借共价键连接而成的肽聚糖囊状大分子,非常坚韧。破碎细菌细胞壁的常用方法有超声波破碎,与砂研磨、高压挤压或溶菌酶处理等。组织和细胞破碎后,选择适当的缓冲液把所要的蛋白提取出来。细胞碎片等不溶物用离心或过滤的方法除去。 如果所要的蛋白主要集中在某一细胞组分,如细胞核、染色体、核糖体或可溶性细胞质等,则可利用差速离心的方法将它们分开,收集该细胞组分作为下步纯化的材料。如果碰上所要蛋白是与细胞膜或膜质细胞器结合的,则必须利用超声波或去污剂使膜结构解聚,然后用适当介质提取。 2. 粗分级分离:当蛋白质提取液(有时还杂有核酸、多糖之类)获得后,选用一套适当的方法,将所要的蛋白与其他杂蛋白分离开来。一般这一步的分离用盐析、等电点沉淀和有机溶剂分级分离等方法。这些方法的特点是简便、处理量大,既能除去大量杂质,又能浓缩蛋白溶液。有些蛋白提取液体积较大,又不适于用沉淀或盐析法浓缩,则可采用超过滤、凝胶过滤、冷冻真空干燥或其他方法进行浓缩。 3.细分级分离:样品经粗分级分离以后,一般体积较小,杂蛋白大部分已被除去。进一步纯化,一般使用层析法包括凝胶过滤、离子交换层析、吸附层析以及亲和层析等。必要时还可选择电泳法,包括区带电泳、等电点聚焦等作为最后的纯化步骤。用于细分级分离的方法一般规模较小,但分辨率很高。 结晶是蛋白质分离纯化的最后步骤。尽管结晶过程并不能保证蛋白一定是均一的,但是只有某种蛋白在溶液中数量上占有优势时才能形成结晶。结晶过程本身也伴随着一定程度的纯化,而重结晶又可除去少量夹杂的蛋白。由于结晶过程中从未发现过变性蛋白,因此蛋白的结晶不仅是纯度的一个标志,也是断定制品处于天然状态的有力指标。 蛋白质分离纯化的方法: 一、根据分子大小不同的纯化方法 1、透析和超过滤 2、密度梯度离心 3、凝胶过滤 二、利用溶解度差别的纯化方法 1、等电点沉淀和pH控制 2、蛋白质的盐析和盐溶 3、有机溶剂分级分离法 4、温度对蛋白质浓度的影响 三、根据电荷不同的纯化方法
蛋白质的纯化原理 一)根据蛋白质溶解度不同的分离方法 1、蛋白质的盐析 中性盐对蛋白质的溶解度有显著影响,一般在低盐浓度下随着盐浓度升高,蛋白质的溶解度增加,此称盐溶;当盐浓度继续升高时,蛋白质的溶解度不同程度下降并先后析出,这种现象称盐析,将大量盐加到蛋白质溶液中,高浓度的盐离子(如硫酸铵的SO4和NH4)有很强的水化力,可夺取蛋白质分子的水化层,使之“失水”,于是蛋白质胶粒凝结并沉淀析出。盐析时若溶液pH在蛋白质等电点则效果更好。由于各种蛋白质分子颗粒大小、亲水程度不同,故盐析所需的盐浓度也不一样,因此调节混合蛋白质溶液中的中性盐浓度可使各种蛋白质分段沉淀。 影响盐析的因素有:(1)温度:除对温度敏感的蛋白质在低温(4度)操作外,一般可在室温中进行。一般温度低蛋白质溶介度降低。但有的蛋白质(如血红蛋白、肌红蛋白、清蛋白)在较高的温度(25度)比0度时溶解度低,更容易盐析。(2)pH值:大多数蛋白质在等电点时在浓盐溶液中的溶介度最低。(3)蛋白质浓度:蛋白质浓度高时,欲分离的蛋白质常常夹杂着其他蛋白质地一起沉淀出来(共沉现象)。因此在盐析前血清要加等量生理盐水稀释,使蛋白质含量在2.5-3.0%。 蛋白质盐析常用的中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。其中应用最多的硫酸铵,它的优点是温度系数小而溶解度大(25度时饱和溶液为4.1M,即767克/升;0度时饱和溶解度为3.9M,即676克/升),在这一溶解度范围内,许多蛋白质和酶都可以盐析出来;另外硫酸铵分段盐析效果也比其他盐好,不易引起蛋白质变性。硫酸铵溶液的pH常在4.5-5.5之间,当用其他pH值进行盐析时,需用硫酸或氨水调节。 蛋白质在用盐析沉淀分离后,需要将蛋白质中的盐除去,常用的办法是透析,即把蛋白质溶液装入秀析袋内(常用的是玻璃纸),用缓冲液进行透析,并不断的更换缓冲液,因透析所需时间较长,所以最好在低温中进行。此外也可用葡萄糖凝胶G-25或G-50过柱的办法除盐,所用的时间就比较短。 2、等电点沉淀法 蛋白质在静电状态时颗粒之间的静电斥力最小,因而溶解度也最小,各种蛋白质的等电点有差别,可利用调节溶液的pH达到某一蛋白质的等电点使之沉淀,但此法很少单独使用,可与盐析法结合用。 3、低温有机溶剂沉淀法 用与水可混溶的有机溶剂,甲醇,乙醇或丙酮,可使多数蛋白质溶解度降低并析出,此法分辨力比盐析高,但蛋白质较易变性,应在低温下进行。 (二)根据蛋白质分子大小的差别的分离方法 1、透析与超滤 透析法是利用半透膜将分子大小不同的蛋白质分开。 超滤法是利用高压力或离心力,强使水和其他小的溶质分子通过半透膜,而蛋白质留在膜上,可选择不同孔径的泸膜截留不同分子量的蛋白质。 2、凝胶过滤法 也称分子排阻层析或分子筛层析,这是根据分子大小分离蛋白质混合物最有效的方法之一。柱中最常用的填充材料是葡萄糖凝胶(Sephadex ged)和琼脂糖凝胶(agarose gel)。 (三)根据蛋白质带电性质进行分离 蛋白质在不同pH环境中带电性质和电荷数量不同,可将其分开。 1、电泳法 各种蛋白质在同一pH条件下,因分子量和电荷数量不同而在电场中的迁移率不同而得以分开。值得重视的是等电聚焦电泳,这是利用一种两性电解质作为载体,电泳时两性电解质形成一个由正极到负极逐渐增加的pH梯度,当带一定电荷的蛋白质在其中泳动时,到达各自等电点的pH位置就停止,此法可用于分析和制备各种蛋白质。
组氨酸(His)标签蛋白的纯化 His-Tag融合蛋白是目前最常见的表达方式,而且很成熟,它的优点是表达方便而且基本不影响蛋白的活性,无论是表达的蛋白是可溶性的或者包涵体都可以用固定金属离子亲和色谱(IMAC)纯化。 IMAC(Immobilized Metal-ion affinity chromatography)是Porath et 年用固定IDA作为配基的填料螯合过渡金属铜、镍、钴或锌离子,可以吸附纯化表面带组氨酸、色氨酸或半胱氨酸残基的蛋白,1987年Smith et al. 发现带有几个组氨酸或色氨酸小肽和螯合金属离子的IDA-sephadex G-25作用力更强,此前在1986年他和他的合作者用Ni2+-IDA-sephadex G-25亲和纯化在氨基端带组氨酸和色氨酸的胰岛素原。同年1987年Hochuli et al.发现带有相连组氨酸的多肽和Ni2+-NTA填料作用力更强于普通的肽,1988年他第一次用这样的方法纯化了带六个组氨酸标签的多肽,无论是在天然还是变性条件下一次亲和纯化都得到很好效果,此后表达带六个组氨酸标签的蛋白配合IMAC变得非常普遍,相对而言,不带标签的蛋白纯化就非常困难,所以表达带六个组氨酸标签的蛋白配合IMAC 纯化变成最常用而且最有效的研究蛋白结构和功能的有力手段。1986年Porath et al.还发现Fe3+-IDA-sephadex G-25可以用于磷酸化蛋白的纯化,而后发现Ga3+-IDA也有同样的效果,这样螯合这两种金属离子的填料就有效用于磷酸化多肽的富集和纯化,同时IMAC也可以用于纯化各种和金属离子结合的多肽,应用非常广泛。 Ni柱中的氯化镍可以与有HIs(组蛋白)标签的蛋白结合,也可以与咪唑结合。 步骤是:过柱子前可以选择Ni柱重生,也就是往柱子里倒氯化镍,一个柱长体积就行了,然后平衡柱子,拿你自己的buffer,给蛋白提供最适的环境,我一般平衡4个柱长,然后蛋白上样,你可以让他自己挂,这样挂柱子的效果好一些,如果流速太慢,可以加个恒流泵,但是一定不能太快,太快挂柱效果差,当然你也可以选择循环挂柱,就是恒流泵的一头接你装蛋白的烧杯,从柱子中留下来的液体还用同一个烧杯接回去。挂完之后,按理想来讲,你的蛋白在Ni柱中与Ni就结合了,杂蛋白多数在烧杯里,留下来了,当然肯定有少量杂蛋白也挂上了,这时候你要,拿咪唑和你的buffer配,一般从0 20mM 40mM。。。。100mM 这样洗脱(当你不知道你的蛋白大概在什么时候出来的时候)我指的是咪唑的终浓度。咪唑加入之后,会和蛋白争夺与Ni的结合位点,杂蛋白、你的目的蛋白,会在不同的浓度被洗脱下来,洗完之后,你可以用400mM咪唑洗柱子,清理一切蛋白,然后平衡几次,是否选择重生你自己定咯~然后放上20%乙醇保存柱子就可以咯~过的蛋白用不同的管子收下,然后SDS-page检测在哪个管子里。 市面常见的商品化IMAC用于带六个组氨酸标签蛋白的配基有以下几种: 一、组氨酸(His)标签蛋白的纯化步骤: 大肠杆菌的破碎方法: 1)收集培养发酵液,4度7000-8000g离心10分钟,收集沉淀的菌体(如果不是马上破碎可以放-70度冷冻,但是最好能保存成小块或者薄片,这样好用。) 2)取1-2克菌体加10ml破碎缓冲液(的50mM磷酸缓冲液含NaCl,ml溶菌酶,1mM PMSF,1mM MgCl2,ml Benzonase,其中的菌酶,1mM PMSF,ml Benzonase现加)在冰上混合45分钟,如果pH不在7-8,需要用NaOH一边搅拌一边滴加.如果溶菌酶10mg/ml混合时间可以缩短到10分钟.
蛋白质的分离纯化方法 根据分子大小不同进行分离纯化 蛋白质是一种大分子物质,并且不同蛋白质的分子大小不同,因此可以利用一些较简单的方法使蛋白 质和小分子物质分开,并使蛋白质混合物也得到分离。根据蛋白质分子大小不同进行分离的方法主要有透析、超滤、离心和凝胶过滤等。透析和超滤是分离蛋白质时常用的方法。透析是将待分离的混合物放入半透膜制成的透析袋中,再浸入透析液进行分离。超滤是利用离心力或压力强行使水和其它小分子通过半透膜,而蛋白质被截留在半透膜上的过程。这两种方法都可以将蛋白质大分子与以无机盐为主的小分子分开。它们经常和盐析、盐溶方法联合使用,在进行盐析或盐溶后可以利用这两种方法除去引入的无机盐。由于超滤过程中,滤膜表面容易被吸附的蛋白质堵塞,以致超滤速度减慢,截流物质的分子量也越来越小。所以在使用超滤方法时要选择合适的滤膜,也可以选择切向流过滤得到更理想的效果离心也是经常和其它方法联合使用的一种分离蛋白质的方法。当蛋白质和杂质的溶解度不同时可以利用离心的方法将它们分开。例如,在从大米渣中提取蛋白质的实验中,加入纤维素酶和α-淀粉酶进行预处理后,再用离心的方法将有 用物质与分解掉的杂质进行初步分离[3]。使蛋白质在具有密度梯度的介质中离心的方法称为密度梯度(区带)离心。常用的密度梯度有蔗糖梯度、聚蔗糖梯度和其它合成材料的密度梯度。可以根据所需密度和渗透压的范围选择合适的密度梯度。密度梯度离心曾用于纯化苏云金芽孢杆菌伴孢晶体蛋白,得到的产品纯度高但产量偏低。蒋辰等[6]通过比较不同密度梯度介质的分离效果,利用溴化钠密度梯度得到了高纯度的苏云金芽孢杆菌伴孢晶体蛋白。凝胶过滤也称凝胶渗透层析,是根据蛋白质分子大小不同分离蛋白质最有效的方法之一。凝胶过滤的原理是当不同蛋白质流经凝胶层析柱时,比凝胶珠孔径大的分子不能进入珠内网状结构,而被排阻在凝胶珠之外,随着溶剂在凝胶珠之间的空隙向下运动并最先流出柱外;反之,比凝胶珠孔径小的分子后流出柱外。目前常用的凝胶有交联葡聚糖凝胶、聚丙烯酰胺凝胶和琼脂糖凝胶等。在甘露糖蛋白提纯的过程中使用凝胶过滤方法可以得到很好的效果,纯度鉴定证明产品为分子量约为32 kDa、成分是多糖∶蛋白质(88∶12)、多糖为甘露糖的单一均匀糖蛋白[1]。凝胶过滤在抗凝血蛋白的提取过程中也被用来除去大多数杂蛋白及小分子的杂质[7]。 根据溶解度不同进行分离纯化 影响蛋白质溶解度的外部条件有很多,比如溶液的pH值、离子强度、介电常数和温度等。但在同一条件下,不同的蛋白质因其分子结构的不同而有不同的溶解度,根据蛋白质分子结构的特点,适当地改变外部条件,就可以选择性地控制蛋白质混合物中某一成分的溶解度,达到分离纯化蛋白质的目的。常用的方法有等电点沉淀和pH值调节、蛋白质的盐溶和盐析、有机溶剂法、双水相萃取法、反胶团萃取法等。 等电点沉淀和pH值调节是最常用的方法。每种蛋白质都有自己的等电点,而且在等电点时溶解度最
分离纯化蛋白质的方法及原理 (一)利用分子大小 1、透析:原理:利用蛋白质分子不能透过半透膜的性质,使蛋白质和其他小分子物质如无机盐、单糖、水等分开。 方法:将待提纯蛋白质放在透析袋中放在蒸馏水中进行 涉及的问题: 如何加快透析过程 (1)加大浓度差,及时更换透析液 (2)利用磁力搅拌器 常用的半透膜:玻璃纸、火棉和其他材料合成 2、超过滤:原理:利用压力和离心力,强行使其他小分子和水通过半透膜,而蛋白质留在膜上 3、凝胶过滤层析:原理:当不同分子大小的蛋白质混合物流进凝胶层析柱时,比凝胶网孔大的分子不能进入珠内网状结构,排阻在凝胶珠以外,在凝胶珠缝隙间隙中向下移动。而比孔小的分子不同程度地进入凝胶珠内,这样由于不同大小分子所经历的路径不同而到分离。 结果:大分子先被洗脱下来,小分子后被洗脱下来 (二)利用溶解度差别 4、等电点沉淀:原理:不同蛋白质具有不同的等电点,当蛋白质混合物调到其中一种蛋白质的等电点时,这种蛋白质大部分和全部被沉淀下来.。 5、盐析与盐溶:原理:低浓度时,中性盐可以增加蛋白质溶解度这种现象称为盐溶.当离子强度增加,足够高时,例如饱和或半饱和程度,很多蛋白质可以从水中沉淀出来,这种现象称为盐析
(三)根据电荷不同 6、SDS-PAGE 全称十二烷基硫酸钠—聚丙烯酰胺凝胶电泳 原理:通过加热和SDS可以使蛋白质变性,多亚基的蛋白质也解离为单亚基,处理后的样品中肽链是处于无二硫键连接的,分离的状态。电泳时SDS-蛋白质复合物在凝胶中的迁移率不再受蛋白质原有电荷和形状的影响,而主要取决于蛋白质分子量。所以SDS-PAGE常用来分析蛋白质的纯度和大致测定蛋白质的分子量。 7、离子交换层析:原理:氨基酸分离常用阳离子交换树脂,树脂被处理成钠型,将混合氨基酸上柱,氨基酸主要以阳离子形式存在,在树脂上与钠离子发生交换,而被挂在树脂上。 氨基酸在树脂上结合的牢固程度取决于氨基酸与树脂之间的亲和力,决定亲和力的因素有:(1)主要是静电吸引力(2)氨基酸侧链同树脂之间的疏水作用氨基酸与阳离子交换树脂间的静电引力大小次序依次是: 碱性氨基酸R2+>中性氨基酸R+>酸性氨基酸R0。 因此洗脱顺序应该是: 酸性氨基酸中性氨基酸碱性氨基酸 为使氨基酸从树脂上洗脱下来采用逐步提高pH和盐浓度的方法