
文件管理SOP
变更记载:
文件管理SOP
1目的:建立文件的设计、起草、审核、批准、替换或撤销、复制、分发、培训、执行、归档、变更、保存和销毁操作程序。
2适用范围
本标准适用于文件系统整个生命周期的控制。
3职责
文件编制者:依照该程序有关规定设计、起草制订文件。
各级生产质量管理人员:执行该程序的有关规定。
QA质量管理员:按该程序的有关规定进行归档、复制、保存、借阅、回收和销毁文件。
质量部QA监督检查本程序的执行情况。
4内容
4.1文件的设计
文件设计时,文件的内容应当与药品生产许可、药品注册等相关要求一致,并有助于追溯
每批产品的历史情况。
4.2文件的起草
421 文件起草的时间要求
生产开工前、新产品投产前、新设备安装前;引进新处方或新方法前;处方或方法有重大变更时;验证前和验证后;组织机构职能变动时;文件编制质量改进时;使用中发现问题时;接受GMP佥查认证或质量审计后;文件的定期复审时;有关法律、法规修订后(如中国药典、药品生产质量管理规范等)
4.2.2文件起草的基本要求
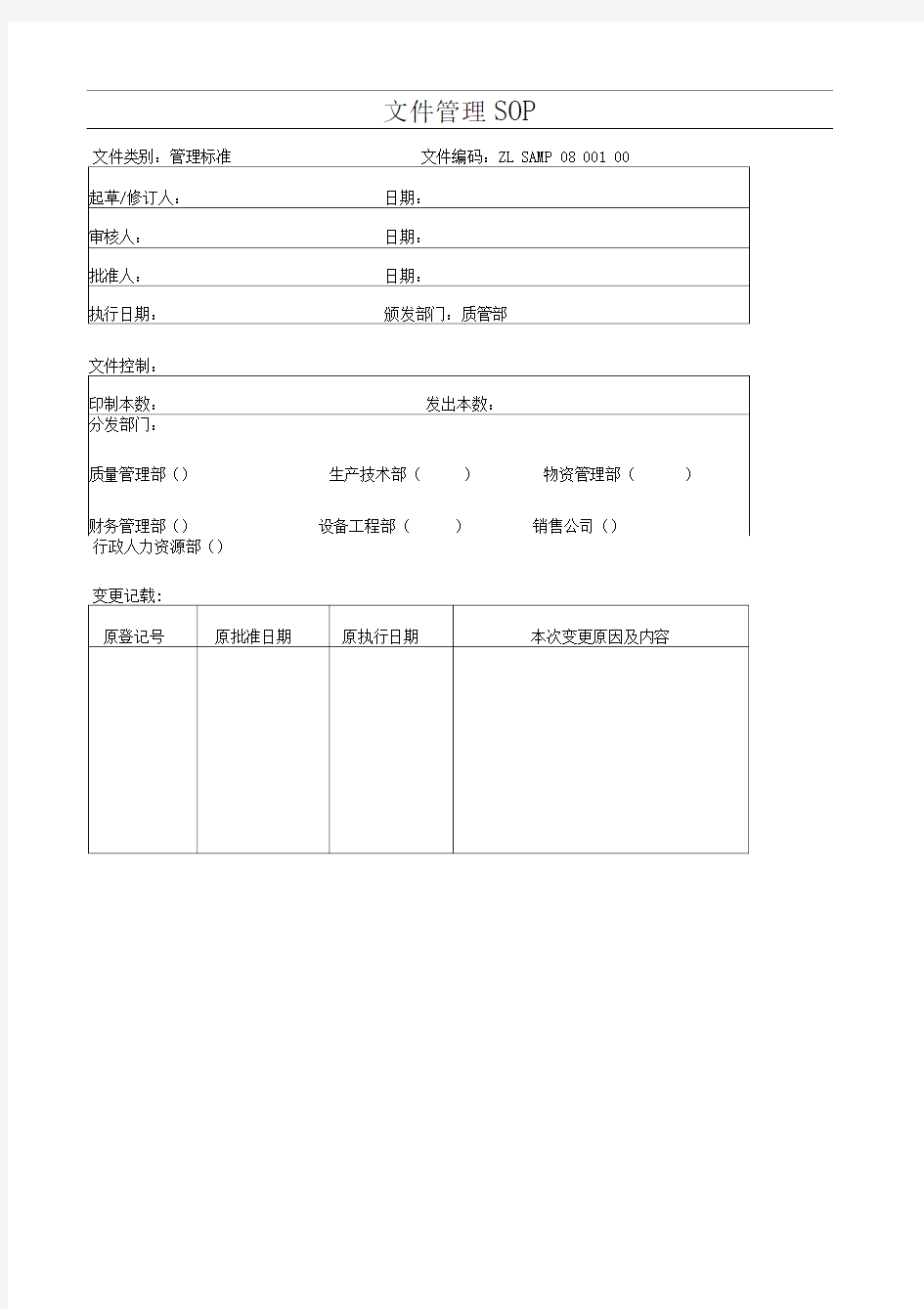
4.2.2.1文件应当标明题目、种类、目的以及文件编号和版本。
4.2.2.2文件的标题应能清楚地说明文件的性质。
4.2.3文件使用的语言确切、清晰、易懂、不能模棱两可。填写内容时应有足够的空格。文
件的起草、修订、审核、批准的责任应明确,有责任人签名并注明日期。文件的起草:
4.2.3.1起草:由文件主要使用部门起草,以保证内容的全面性和准确性。并由起草人根据实际使用需要或会稿确定文件分发部门及分发份数。
423.2起草人向质量部QA质量管理员申请文件编号。
文件格式及内容要
4.2.3.3.1 标准类文件格式和内容要求
?标准类文件正常格式和内容要求
页眉:公司名称、文件名称、文件编号。
标题:文件的名称。
首页:起草人、审核人、批准人签名和日期,拷贝号,制定(变更)原因及目的,分发部门及份数。
目的:文件制定的目的。
适用范围:该文件的适用范围。
职责:确定与标准直接相关人员或部门的责任。
内容:管理标准的正文内容包括管理职能、管理内容与要求;操作标准的正文内容包括工作内容与要求、责任与权限;技术标准的正文内容包括药品生产技术活动中的工艺、技术、质量等项目及有关参数。相关文件:与该文件相关联的其它文件,除文件名称外,需列岀文件编号,修定号可不列岀。
补充说明(如工艺规程)、附录,附加说明。
页脚:第几页共几页(居中排列)。
举例如:
文件管理程序
文件管理程序1.目的:规定文件的分类、编号、管理方法。
2?适用范围
本标准适用于*******杯有限公司(以下和其它文件中简称为“本公司”)药品生产质量
管理的所有文件的管理
3.职责
质量部QA负责文件的编码管理。
QA质量管理员:按该程序的有关规定进行文件管理
4、内容
5、相关文件
?确认、验证文件格式和内容要求
除首页外,其它与标准类文件正常格式和内容要求相同
首页表头如下:
********* 有限公司XX 工艺验证方案SC-TS-09-C001-00
42332 标准类文件的层次划分及实例
注:段以下不再用x?X划分,用“ ?”等项目符号表示细分项。编号采用计算机的自动编号功能,便于文件的