(完整)初中化学溶解性表.doc
- 格式:doc
- 大小:367.54 KB
- 文档页数:6
化学溶解性表Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈Na2O+2HNO3=2NaNO3+H2O 白色固体溶解Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2O NaOH+HNO3=NaNO3+ H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2O Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2O2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理3NaOH + H3PO4=3H2O + Na3PO4BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理3NH3+H3PO4=(NH4)3PO4Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理2NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO22NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成。

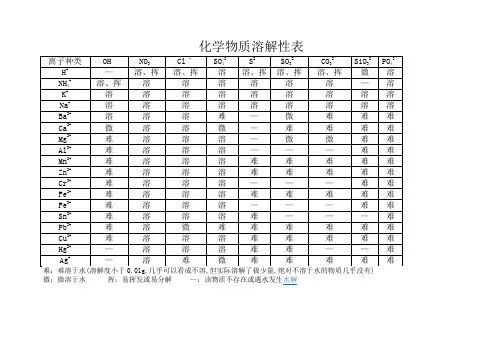
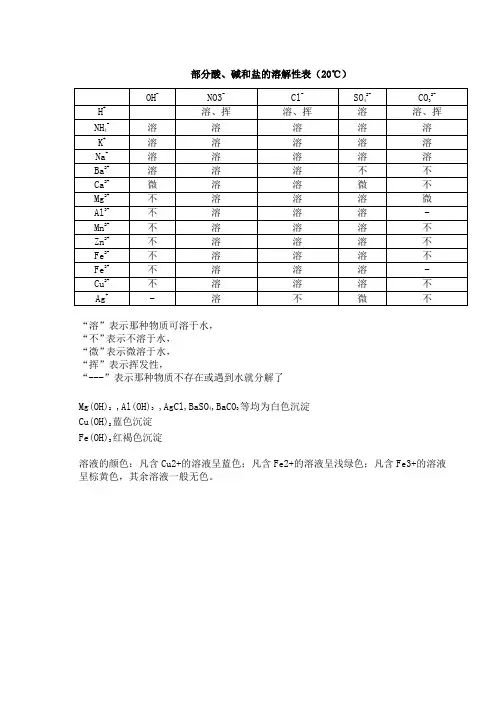
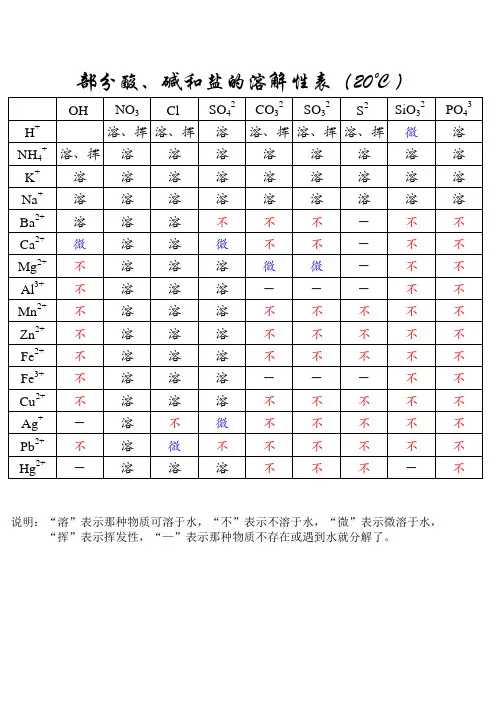
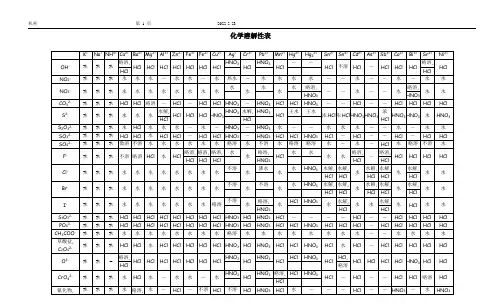
酸碱盐的溶解性表OH(-1 ) NO3(-Cl(-1)SO4(-CO3(-PO4(-1)2)2)3)H(+1)溶、挥溶、挥溶溶、挥溶K(+1)溶溶溶溶溶溶Na(+1)溶溶溶溶溶溶NH4(+ 溶、挥溶溶溶溶溶1)Ba(+2)溶溶溶不不不Ca(+2)微溶溶微不不Mg(+2)不溶溶溶微不Al(+3)不溶溶溶---不Zn(+2)不溶溶溶不不Fe(+2)不溶溶溶不不Fe(+3)不溶溶溶不不Cu(+2)不溶溶溶---不Ag(+1) ---溶不微不不说明:此为 20℃时的状况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“ --- ”表示那种物质不存在或碰到水就分解了背诵口诀1.钾钠铵盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶钡不溶硝酸盐遇水影无踪碳酸盐除钾钠铵都不溶钾钠钡钙碱可溶红褐铁,蓝絮铜其余积淀白色呈注: 1. 初顶用够了,红褐铁,代表铁盐积淀为红褐色【f e(oh)2 氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。
2. 氯化银【不溶酸】,碳酸钙,碳酸钡,硫酸钡【不溶酸】,氢氧化铝,氢氧化镁,为白色积淀。
氢氧化铁(红褐色)氢氧化铜(蓝色)说明【】内为前一物质的特色2.钾钠铵盐全都溶碳酸除镁是微溶其余全都不可以溶AgCl、 BaSO4酸也不溶磷酸盐,更不溶一、氧气的性质:(1)单质与氧气的反响:(化合反响)1.镁在空气中焚烧: 2Mg + O2 点燃 2MgO2.铁在氧气中焚烧: 3Fe + 2O2 点燃 Fe3O43.铜在空气中受热: 2Cu + O2 加热 2CuO4.铝在空气中焚烧: 4Al + 3O2 点燃 2Al2O35.氢气中空气中焚烧: 2H2 + O2 点燃 2H2O6.红磷在空气中焚烧(研究空气构成的实验): 4P + 5O2 点燃2P2O57.硫粉在空气中焚烧: S + O2 点燃 SO28.碳在氧气中充足焚烧: C + O2 点燃 CO29.碳在氧气中不充足焚烧: 2C + O2 点燃 2CO(2)化合物与氧气的反响:10.一氧化碳在氧气中焚烧: 2CO + O2 点燃 2CO211.甲烷在空气中焚烧: CH4 + 2O2 点燃 CO2 + 2H2O12.酒精在空气中焚烧: C2H5OH + 3O2点燃 2CO2 + 3H2O (3)氧气的根源:13.玻义耳研究空气的成分实验2HgO 加热 Hg+ O2 ↑14.加热高锰酸钾: 2KMnO4加热 K2MnO4 + MnO2 + O2↑(实验室制氧气原理 1)15.过氧化氢在二氧化锰作催化剂条件下分解反响:H2O2 MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的构成实验):2H2O 通电2H2↑+ O2 ↑17.生石灰溶于水: CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中焚烧: 2Mg + O2 点燃 2MgO20.铁和硫酸铜溶液反响: Fe + CuSO4 === FeSO4 + Cu 21.氢气复原氧化铜: H2 + CuO 加热 Cu + H2O22. 镁复原氧化铜: Mg + CuO 加热 Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23.碳在氧气中充足焚烧: C + O2 点燃 CO224.木炭复原氧化铜: C+ 2CuO高温 2Cu + CO2↑25.焦炭复原氧化铁: 3C+ 2Fe2O3 高温 4Fe + 3CO2↑(2)煤炉中发生的三个反响:(几个化合反响)26.煤炉的基层: C + O2 点燃 CO227.煤炉的中层: CO2 + C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反响(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳固而分解: H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO + CO2↑33.石灰水与二氧化碳反响(鉴识二氧化碳):Ca(OH)2 + CO2 === CaCO3↓+ H2O(4)一氧化碳的性质:34.一氧化碳复原氧化铜: CO+ CuO加热 Cu + CO235.一氧化碳的可燃性: 2CO + O2 点燃 2CO2其余反响:36.碳酸钠与稀盐酸反响(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中焚烧: CH4 + 2O2 点燃 CO2 + 2H2O38.酒精在空气中焚烧: C2H5OH + 3O2点燃 2CO2 + 3H2O 39.氢气中空气中焚烧: 2H2 + O2 点燃 2H2O六、金属(1)金属与氧气反响:40.镁在空气中焚烧: 2Mg + O2 点燃 2MgO41.铁在氧气中焚烧: 3Fe + 2O2 点燃 Fe3O442.铜在空气中受热: 2Cu + O2 加热 2CuO43.铝在空气中形成氧化膜: 4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 --------盐+氢气(置换反响)44.锌和稀硫酸 Zn + H2SO4 = ZnSO4 + H2↑45.铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2↑46.镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2↑47.铝和稀硫酸 2Al +3H2SO4 = Al2(SO4)3 +3 H2 ↑48.锌和稀盐酸 Zn + 2HCl == ZnCl2 + H2 ↑49.铁和稀盐酸 Fe + 2HCl == FeCl2 + H2 ↑50.镁和稀盐酸 Mg+ 2HCl == MgCl2 + H2 ↑51.铝和稀盐酸 2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) -------新金属+新盐52.铁和硫酸铜溶液反响: Fe + CuSO4 == FeSO4 + Cu53.锌和硫酸铜溶液反响: Zn + CuSO4 ==ZnSO4 + Cu54.铜和硝酸汞溶液反响: Cu + Hg(NO3)2 == Cu(NO3)2 + Hg (3)金属铁的治炼原理:55.3CO+ 2Fe2O3高温 4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 --------盐+氢气(见上)(2)酸 + 金属氧化物 --------盐+水56.氧化铁和稀盐酸反响: Fe2O3 + 6HCl ==2FeCl3 + 3H2O57.氧化铁和稀硫酸反响: Fe2O3+ 3H2SO4== Fe2(SO4)3 + 3H2O58.氧化铜和稀盐酸反响: CuO + 2HCl ==CuCl2 + H2O59.氧化铜和稀硫酸反响: CuO + H2SO4 == CuSO4 + H2O (3)酸 + 碱 --------盐+水(中和反响)60.盐酸和烧碱起反响: HCl + NaOH == NaCl +H2O61.盐酸和氢氧化钙反响: 2HCl + Ca(OH)2 == CaCl2 + 2H2O62.氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反响: H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸 + 盐 --------另一种酸+另一种盐64.大理石与稀盐酸反响: CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反响 : Na2CO3+ 2HCl == 2NaCl + H2O+ CO2↑66.碳酸氢钠与稀盐酸反响: NaHCO3+ HCl== NaCl + H2O+ CO2↑67.硫酸和氯化钡溶液反响: H2SO4+ BaCl2 == BaSO4↓+2HCl 2、碱的化学性质(1)碱 + 非金属氧化物 --------盐+水68.苛性钠裸露在空气中变质: 2NaOH + CO2 == Na2CO3 + H2O69.苛性钠汲取二氧化硫气体: 2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠汲取三氧化硫气体: 2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质: Ca(OH)2 + CO2 == CaCO3↓+ H2O 72. 消石灰汲取二氧化硫: Ca(OH)2 + SO2 == CaSO3 ↓+ H2O (2)碱+酸--------盐+水(中和反响,方程式见上)(3)碱 + 盐 --------另一种碱 + 另一种盐73.氢氧化钙与碳酸钠: Ca(OH)2 + Na2CO3 == CaCO3↓+2NaOH 3、盐的化学性质(1)盐(溶液) + 金属单质 -------另一种金属+另一种盐74. 铁和硫酸铜溶液反响: Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸--------另一种酸+另一种盐75.碳酸钠与稀盐酸反响 : Na2CO3+ 2HCl == 2NaCl + H2O+ CO2↑碳酸氢钠与稀盐酸反响: NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐 + 碱 --------另一种碱+另一种盐76. 氢氧化钙与碳酸钠: Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐 + 盐 -----两种新盐77.氯化钠溶液和硝酸银溶液: NaCl + AgNO3== AgCl↓ + NaNO3 78.硫酸钠和氯化钡: Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl钾钠硝铵均可溶,盐酸盐不溶AgCl,硫酸盐不溶 BaSO4,碳酸盐能溶钾钠铵,钾钠钙钡可溶碱。
《酸、碱、盐溶解性表》兴山县古夫镇初级中学袁书宏设计思路:常见酸、碱、盐的溶解性表是中学化学教学和学习一张十分重要的工具表,酸、碱、盐溶解性表提供的信息十分丰富:认识初中化学常见的阴离子、阳离子、酸根离子、金属离子,认识阴、阳离子两两结合构成的常见化合物——酸、碱、盐、氧化物,可溶性的酸、碱、盐在溶液中解离出的阴、阳离子,查常见酸、碱、盐的溶解性,多角度对酸、碱、盐分类,离子的性质等信息。
新课的教学中,学生对酸、碱、盐溶解性表只经历了初步接触和识记→初步应用。
人教版初中化学《酸和碱》、《盐化肥》两个单元教材内容起点低、落点高,知识点多,涉及面广,综合性强、易混淆易忘记、应用更难等特点,导致学生学习酸、碱、盐知识时觉得乱,心里没信心,错误率高。
仔细分析学生错误的原因,关键是学生在学习酸碱盐的内容时,对以下几个难点没有掌握好:①酸、碱、盐概念的理解;②酸、碱、盐的分类;③复分解反应实质的掌握和应用;④常见物质的检验。
这些问题的解决在溶解性表中都有很好的体现,因此,对酸、碱、盐的溶解性表要进行专题学习,全面理解溶解性表提供的信息,加深记忆,扩大应用,使它更好的为教学服务,突破学生在学习酸、碱、盐知识时的难点。
通过对溶解性表的全面认识和理解,还可以帮学生建立离子观、物质观、分类观等化学基本观念,用化学知识和化学观念解决实际问题,逐步形成化学思想。
教学目标:1.认识常见的离子,建立离子观,从离子的观点加深对酸碱盐的概念。
2.从多角度对酸碱盐分类,建立分类观。
3.根据溶液中离子的反应规律,记住酸碱盐溶解性表,能用酸碱盐的溶解性表解决实际问题。
教学过程:板书设计:《酸、碱和盐溶解性表》一、认识酸、碱、盐1.酸→H++ 酸根离子2.碱→金属离子 + OH-3.盐→金属离子 + 酸根离子二、溶液中离子间的反应规律NH4+Ba2+ CO32Mg2+Ca2-Al3+Zn2+OH-H+CO32-Zn2+Fe2+Fe3+Fe2+Cu2+Ag+ Cl-附:检测反馈酸碱盐溶解性表是学习化学的重要工具,下表列出了部分酸碱盐在20℃的溶解性,我能完成下列各题:1.查:Ba(OH)2溶解性是;2.写:按要求写出下列物质的化学式①一种挥发性的酸;②不溶于水的碱;③微溶于水的盐。
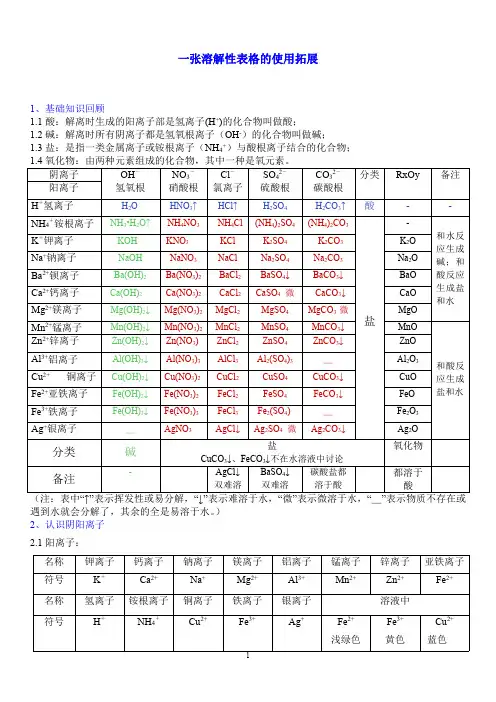
1、化合物 阴离子 - OH 阳离子 氢氧根 H+ H2O 氢离子 水 + NH4·H2O↑ NH4 铵根离子 氨水 K+ KOH 钾离子 氢氧化钾 Na+ NaOH 钠离子 氢氧化钠 Ba2+ Ba(OH)2 钡离子 氢氧化钡 Ca2+ Ca(OH)2 钙离子 氢氧化钙 2+ Mg(OH)2↓ Mg 镁离子 氢氧化镁 2+ Mn(OH)2↓ Mn 锰离子 氢氧化锰 Zn2+ Zn(OH)2↓ 锌离子 氢氧化锌 Al 3+ Al(OH) 3↓ 铝离子 氢氧化铝 Cu2+ Cu(OH)2↓ 铜离子 氢氧化铜 Fe2+ Fe(OH)2↓ 亚铁 离子 氢氧化亚铁 Fe3+ Fe(OH)3↓ 铁离子 氢氧化铁 Ag+ _ - Cl - 2- 2- NO3 SO4 CO3
硝酸根 氯离子 硫酸根 碳酸根
HNO3、↑ HCl、↑ H2SO4 H2CO3、↑ 硝酸 盐酸 硫酸 碳酸 NH4NO3 NH4Cl (NH4) 2SO4 (NH4) 2CO3
硝酸铵 氯化铵 硫酸铵 碳酸铵 KNO3 KCl K2SO4 K2CO3
硝酸钾 氯化钾 硫酸钾 碳酸钾
NaNO3 NaCl Na2 SO4 Na2CO3
硝酸钠 氯化钠 硫酸钠 碳酸钠
Ba(NO3) 2 BaCl2 BaSO4↓ BaCO3↓
硝酸钡 氯化钡 硫酸钡 碳酸钡 Ca(NO3) 2 CaCl2 CaSO4微 CaCO3↓
硝酸钙 氯化钙 硫酸钙 碳酸钙 Mg(NO3) 2 MgCl2 MgSO4 MgCO3微
硝酸镁 氯化镁 硫酸镁 碳酸镁 Mn(NO3) 2 MnCl2 MnSO4 MnCO3↓
硝酸锰 氯化锰 硫酸锰 碳酸锰 Zn(NO3) 2 ZnCl 2 ZnSO4 ZnCO3↓
硝酸锌 氯化锌 硫酸锌 碳酸锌 Al(NO 3) 3 AlCl 3 Al 2(SO4) 3 _
硝酸铝 氯化铝 硫酸铝 _ Cu (NO3) 2 CuCl2 CuSO4 CuCO3↓
硝酸铜 氯化铜 硫酸铜 碳酸铜 Fe(NO3) 2 FeCl 2 FeSO4 FeCO3↓
硝酸亚铁 氯化亚铁 硫酸 亚铁 碳酸亚铁 Fe(NO3) 3 FeCl 3 Fe2(SO4) 3 _
硝酸铁 氯化铁 硫酸铁 _ AgNO3 AgCl ↓ Ag2SO4 微 Ag2CO3↓
分 O2- 类 氧离子 → H2O 酸 水
↓ _ 盐 _
K2O 氧化钾 Na2O 氧化钠 BaO 氧化钡 CaO 氧化钙 MgO 氧化镁 MnO 氧化锰 ZnO 氧化锌 Al 2O3
氧化铝
CuO 氧化铜 FeO 氧化亚铁 Fe2O3
氧化铁
Ag2O 银离子 _ 分类 碱 (注:表中“↑”表示挥发性,了,其余的全是易溶于水。 ) 硝酸银 氯化银 硫酸银 碳酸银 氧化银 →盐 氧化物 “↓”表示不溶于水, “微”表示微溶于水, “_”表示物质不存在或遇到水就会分解
K Ca Na Mg Al Zn Fe Sn 金属单 钾 钙 钠 镁 铝 锌 铁 锡 质 Pb Cu Hg Ag Pt Au Mn Ni
铅 铜 汞 银 铂 金 锰 镍 2 、 H2 O2 N 2 F2 Cl 2 Br 2 I 2 O
3
单质 非金属 氢气 氧气 氮气 氟气 氯气 溴 碘 臭氧
单质 P S C Si B
磷 硫 碳 硅 硼
稀有气体 He Ne Ar Kr Xe 氦 氖 氩 氪 氙
第 1 页 共 6 页 1. 2Mg+O点燃或 2MgO 化学反应现象: 剧烈燃烧 . 耀眼白光 . 生成白色固体 . 放热 . 产生大量白烟 应用: 白色信号弹
2. 2Hg+O 点燃或 2HgO 化学反应现象: 银白液体、生成红色固体
应用: 拉瓦锡实验 3. 4Al+3O2 2Al 2O3 化学反应现象: 银白金属变为白色固体
4. 3Fe+2O 点燃 Fe3O4
化学反应现象: 剧烈燃烧、火星四射、生成黑色固体、放出大量热
点燃 5. C+O2 CO
2
化学反应现象: 剧烈燃烧、白光、放热、使石灰水变浑浊
6. S+O2 点燃 SO2 化学反应现象: 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰 . 氧气中蓝紫色火焰 7. 2H2+O2 点燃 2H2O 化学反应现象: 淡蓝火焰、放热、生成使无水 CuSO4变蓝的液体(水)
应用: 高能燃料 8. 4P+5O2 点燃 2P2O5
化学反应现象: 剧烈燃烧、大量白烟、放热、生成白色固体
应用: 证明空气中氧气含量 9. CH4+2O2 点燃 2H2O+CO2 化学反应现象: 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水 CuSO4变蓝的液体(水)
应用: 甲烷和天然气的燃烧 10. 2KClO3 MnO2 2KCl +3O 2↑ 化学反应现象: 生成使带火星的木条复燃的气体
应用: 实验室制备氧气 11. 2KMnO4 K 2MnO4+MnO2+O2↑
化学反应现象: 紫色变为黑色、生成使带火星木条复燃的气体
应用: 实验室制备氧气 12. 2HgO 2Hg+O↑
化学反应现象: 红色变为银白、生成使带火星木条复燃的气体
应用: 拉瓦锡实验 13. 2H2O通电 2H2↑ +O2↑ 化学反应现象: 水通电分解为氢气和氧气 应用: 电解水 14. Cu2(OH)2CO3 2CuO+HO+CO2↑ 化学反应现象: 绿色变黑色、试管壁有液体、使石灰水变浑浊气体
应用: 铜绿加热 15. NH4HCO3 NH3↑ + H2O +CO2↑
化学反应现象: 白色固体消失、管壁有液体、使石灰水变浑浊气体
应用: 碳酸氢铵长期暴露空气中会消失 16. Zn+H2SO4=ZnSO4+H2↑
化学反应现象: 有大量气泡产生、锌粒逐渐溶解
应用: 实验室制备氢气 17. Fe+H2SO4=FeSO4+H2↑
化学反应现象: 有大量气泡产生、金属颗粒逐渐溶解
第 2 页 共 6 页 18. Mg+H2SO4 =MgSO4+H2↑
化学反应现象: 有大量气泡产生、金属颗粒逐渐溶解
19. 2Al+3H2SO4=Al 2(SO4) 3+3H2 ↑
化学反应现象: 有大量气泡产生、金属颗粒逐渐溶解
20. Fe2O3+3H2 2Fe+3H2O
化学反应现象: 红色逐渐变为银白色、试管壁有液体
应用: 冶炼金属、利用氢气的还原性 21. 2Na+Cl2 或点燃 2NaCl
化学反应现象: 剧烈燃烧、黄色火焰
应用: 离子化合物的形成、 22. H2+Cl 2 点燃或光照 2HCl
化学反应现象: 点燃苍白色火焰、瓶口白雾
应用: 共价化合物的形成、制备盐酸 23. CuSO4+2NaOH=Cu(OH)↓ +Na2SO
4
化学反应现象: 蓝色沉淀生成、上部为澄清溶液
应用: 质量守恒定律实验 24. 2C +O2 点燃 2CO
应用: 煤炉中常见反应、空气污染物之一、煤气中毒原因 25. 2CO+O点燃 2CO
化学反应现象: 蓝色火焰
应用: 煤气燃烧 26. C + CuO 高温 2Cu+ CO2↑
化学反应现象: 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体
应用: 冶炼金属 高温
27. 2Fe2O3+3C 4Fe+ 3CO2↑
应用: 冶炼金属 28. C + CO2 高温 2CO 29. CO2 + H 2O = H 2CO3 化学反应现象: 碳酸使石蕊变红
应用: 证明碳酸的酸性 30. H CO CO↑ + H O
2 3 2 2 化学反应现象: 石蕊红色褪去
31. Ca(OH)2+CO2= CaCO3↓+ H 2O 化学反应现象: 澄清石灰水变浑浊
应用: 应用 CO2检验和石灰浆粉刷墙壁 32. CaCO3+H2O+CO2= Ca(HCO3)
2
化学反应现象: 白色沉淀逐渐溶解
应用: 溶洞的形成,石头的风化 33. Ca(HCO3) 2 CaCO3↓+H2O+CO2↑
化学反应现象: 白色沉淀、产生使澄清石灰水变浑浊的气体
应用: 水垢形成 . 钟乳石的形成 34. 2NaHCO3 Na2CO3+H2O+CO2↑ 化学反应现象: 产生使澄清石灰水变浑浊的气体 应用: 小苏打蒸馒头 35. CaCO3 高温 CaO+ CO2↑
应用: 工业制备二氧化碳和生石灰 第 3 页 共 6 页