
绪言 化学使世界变得更加绚丽多彩
1、 化学是研究物质的组成、结构、性质及变化规律的科学。 化 原子论:道尔顿
2、学 分子学说:阿伏加德罗
史 元素周期律和元素周期表:门捷列夫
3、物质是由原子和分子构成的,分子的破裂和原子的重新组合是化学变化的基础。
4、 化学研究范涛:能源、材料、生命科学、环境保护、信息等。
5、 用高分子薄膜做的鸟笼:隔水、透气
第一单元 走进化学世界
物理变化:没有生成其他物质的变化,如石蜡熔化、水的三态变化、灯泡发光等。
化学变化:生成了其他物质的变化,如燃烧、钢铁生锈、食物腐败、呼吸作用、光合作用等。
物理性质:物质不需要发生化学变化就能表现出来的性质,它包括颜色、状态、气味、熔点、沸
点、硬度、密度、溶解性、导电导热性、延展性等。
化学性质:物质在化学变化中表现出来的性质,如可燃性、还原性、氧化性、酸性、碱性等。
外焰:最亮,温度最高。(与外面氧气接触较大) 火焰
内焰:最暗,温度最低。(与外面氧气接触较小)
文字表达式:二氧化碳水氧气石蜡点燃
+??→
?+ 石蜡燃烧
表示的意义:石蜡和氧气在点燃的条件下变化生成水和二氧化碳
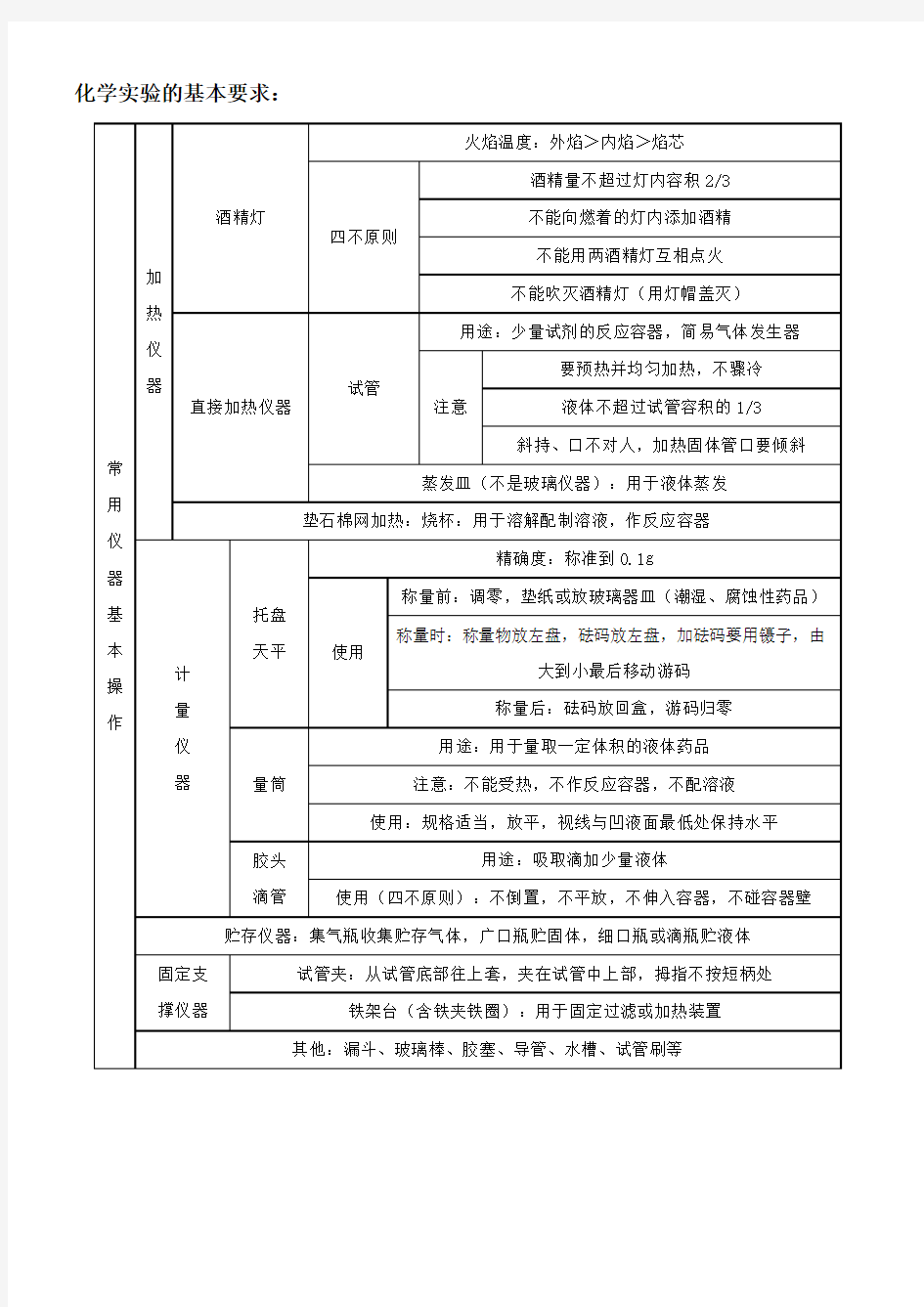
化学实验的基本要求:
常用危险化学品标志
初中气体的收集方法
原因:气体的密度比空气大
向上排空气法:要求:气体没有毒性
排空气法
向下排空气法:原因:气体的密度比空气小
要求:气体没有毒性
要求:气体必须是不易溶于水也不与水反应
排水法
优点:收集到的气体较纯
用此装置可以来测量生成CO2气体的体积,其中在水面上放一层植物油的目的是防止
二氧化碳溶于水并与水反应,植物油上方原有的空气对实验结果无影响.
多功能瓶
1、当瓶子正放时如图1:
收集密度比空气大的气体,气体应从a端导管通入;收集密度比空气小的气体,气体应从b端导管通入。
2、当瓶子倒放时如图2:
收集密度比空气大的气体,气体应从b端导管通入;收集密度比空气小的气体,气体应从a 端导管通入。
3、当瓶子装满水集气时若收集气体,气体都应从a端通入,水被从b端排除。
4、当用做气体洗气或气体干燥时,气体应从长导管通入即“长进短出”。
气体收集时导管的选择:
①:当用排空气法收集时:气体与空气密度的比较,当气体的密度大于空气时,则将气体送入下方;当气体的密
度小于空气时,则将气体送入上方。口诀:“上轻下重,看管口”
注:要比较某气体与空气的密度时,可用其相对分子质量,空气的平均相对分子质量为29,若某气体的相对分
②当用排水法收集气体时,则气体总是从短的导管进入。
注:此方法与气体洗气装置易混。气体的洗气装置总是从长的导管(即浸入液体的导管)进入。
第二单元我们周围的空气
方法:分离液态空气法 (注:给制取属于物理变化) 步骤: 工业上: 氧气的制取
原理:利用氮气和氧气沸点不同,采用蒸发的方法,将液气分开
实验室: 高锰酸钾:
过氧化氢:
氯酸钾:
现象:蜡烛火焰自下而上依次熄灭
2co 的性质: ① 结论:2co 密度比空气大,
不支持燃烧,也不能燃烧 现象:软塑料瓶变瘪了
原因:气体体积减少,造成瓶内压强减少, ② 大气压使软塑料瓶变瘪 结论:2co 能溶于水 现象:澄清石灰水变浑浊
③ 反应方程式:O H CaCO OH Ca CO 2322)(+↓=+ 结论:2co 能使澄清石灰水变浑浊 原理:
收集方法:向上排空气法 CO 2的制取 发生装置:固液不加热型
所需药品:块状大理石(或石灰石)和稀盐酸
性质:无色无味,化学性质很不活泼。
氦气(He ):液氦可以用于超低温冷却,氦气常用于飞船或广告气球中的充入气体。 氖气(Ne ):用于霓虹灯、水银灯、航标灯 氩气(Ar ):用于填充灯泡,也用作焊接的保护气, 氪气(Kr ):用于准分子激光、电光源、窗口绝缘、离子推进力、医疗和科研等方面。 用氪气充填的灯有:白炽灯、荧光灯、闪光弧光灯、碘灯等。 氙气(Xe ):用于准分子激光、电光源、窗口绝缘、离子推进力、医疗和科研等方面。 氙的发光强度能超过太阳光的发光强度。一只300W 的长弧氙灯,其亮度就 像一个“小太阳”(含量最小) 氡气(Rn ):自然界中的氡是由镭衰变产生,是人类所接触到的唯一气体放射性元素。
其他气体:
物理性质:无色无味气体,密度比空气略小,难溶于水
性质
化学性质:①有毒性,②可燃性;③还原性
①取样点燃,有蓝色火焰,用一干冷烧杯罩在火焰上方,烧杯上没有水珠,将 检验: 烧杯倒扣入澄清石灰水,石灰水变浑浊
②通入新鲜的鸡血,鸡血变成暗红色
反应方程式
物理性质:无色无味气体,密度比空气小,难溶于水 性质
化学性质:①可燃性(燃烧时发出淡蓝色火焰); ②还原性:
危险:混有一定量的空气或氧气的氢气遇明火会发生爆炸
验纯:用试管收集一试管氢气,然后用燃着的木条放到试管口点燃,如果听到尖锐爆鸣声,
则表明氢气不纯,若声音很小则表示气体较纯。
(若气体不纯,则用试管重新收集氢气,应用手指堵住试管口一段时间后,收集)
反应方程式
物理性质:无色无味气体,密度比空气小,极难溶于水
性质 化学性质:可燃性(燃烧时发出明亮的蓝色火焰); 俗名:天然气、沼气、坑气、瓦斯、可燃冰 用途:可做燃料
物理性质:无色,刺激性气味,有毒,密度比空气大 性质 )
(co 一氧化碳)(2
H 氢气世界上最轻的气体
)(4CH 沼气二氧化硫
粉尘(固体小颗粒)
对空气造成污染的物质二氧化硫(SO2)
有害气体一氧化碳(CO)
二氧化氮(NO2)
主要计入空气污染指数项目:SO2、CO、NO2、PM2.5、O3、可吸入颗粒物等
空气质量0~50 51~100 101~150 151~200 201~250 250~300 300~ 空气质量分级标准优良轻微污染轻度污染中度污染中度重污染重度
①加强空气质量的监测
②减少化石燃料的使用
合理建议③开发利用新能源
④改进发动机的改造,使燃料充分燃烧
⑤减少汽车尾气的排放,强制安置汽车尾气的净化装置
⑥对工业产生的废气进行综合处理达标排放
①绿色出行,出行时多步行或骑自行车,少乘坐私家车
自己能做得到的
SO2:SO2+H2O=H2SO3; H2SO3 +O2 = H2SO4
酸雨的产生过程NO2:NO2+H2O=2HNO3
酸雨①酸雨可导致土壤酸化。
酸雨的危害:②酸雨能腐蚀建筑物。
③酸化地下水,饮用后对人体有害。
第三单元物质构成的奥秘
构成:物质是由微观粒子构成的
物质由分子构成:气态非金属单质、非金属氧化物、有机物(如蛋白质等)构成物质的粒子:由原子构成:金属类、稀有气体、固态非金属单质(如:C、S、Si等)
由离子构成:酸、碱、盐
作用:分子是保持其化学性质的最小粒子
分子的运动:分子总是不断运动着的,温度越高,分子能量增大,分子的运动速率就越快
分子实验:
结论:分子总是不断运动着的。浓氨水具有挥发性。
注:二氧化氮和空气的位置不能颠倒
作用:原子是化学变化中的最小粒子
原子质量:原子的质量主要集中在原子核,电子是质量
最小的
化学变化的实质:反应物分子分裂成原子,原子再重新组合,构成新的分子
分子和原子的区别:在化学变化中,分子可分,原子不可分。
物质的构成:
原子中:核电荷数==质子数==核外电子数==原子核所带电荷数目==原子序数
原子不同原子的区别:核内质子数不同
内部原子不显电性的原因:由于原子核内质子所带电荷与核外电子的电荷数量相等,电性相反注:有的原子内部没有中子。如氢原子
核外电子是分层排布的
稀有气体:最外层电子数为8(氦为2)
规律金属:最外层电子数<4
原子核外电子非金属:8>最外层电子数≥4
的排布每层电子数有2n2个(n为该层的层数数)
电子数
的规律注意:最外层电子数最多是8个,次层最多排18个
原子的化学性质相似的是:最外层电子数相同的原子。
原子的质量主要集中在原子核上,原子的体积决定于核外电子的活动空间
质量相对原子质量:原子的质量与C12原子的质量的1/12的比值
相对原子质量≈质子数+中子数
阴离子:带负电的原子叫阴离子
离子:阳离子:带正电的原子叫阳离子
物质的组成:元素
物质物质的构成:分子、原子、离子
宏观:(物质、元素)只分种类、不分个数(如一种物质,一种元素。不可说:一个物质)
微观:可分种类,也可分个数(如:1个原子)
定义:元素是质子数(即核电荷数)相同的一类原子的总称。
①表示这种元素
元素符号的意义②表示1个原子
③表示这种物质(但某些符号无此意义,如O、N、H等)
地壳中含量前6位:氧、硅、铝、铁、钙、钠
生物细胞中前5位:氧、碳、氢、氮、钙
元素的排行:地壳中含量最多的元素:氧
地壳中含量最多的金属元素:铝
海水中含量最多的元素:氧
同一周期的各原子的结构的共同之处:各原子的电子层数相同(元素的周期数与原子的
核外电子层数相同。
元素周期表同一周期中,个原子核外电子排布的变化规律是:最外层电子数由左向右依次递增。
同一周期中,元素类型的变化情况是:从左到右由金属元素过渡到非金属元素,并以稀
有气体元素结尾
同一族中,元素的共同之处是:最外层电子数相同
化合价原则:化合物中各元素的化合价代数和为0;单质中,元素的化合价为0
一价氢氯钾钠银,铵根氢氧硝酸根
口诀:二价氧钙钡镁锌,还有硫酸碳酸根
化合价三铝四硅五价磷,一二铜,二三铁
化合价正负口诀:金属正价,酸根负,铵根硅碳是特殊。
化学式:元素符号+数字(注:金属单质、固体非金属单质、稀有气体直接用元素符号
表示)
化学式①表示一种物质
②表示物质的组成元素
意义③表示物质的一个分子(或原子)
④表示物质的构成
第四单元自然界的水
静置沉淀除去比水密度大的难溶于水的固体
1.沉淀加絮凝剂沉淀(加明矾)
工业上水的净化 2.过滤:除去水中的难溶固体
3.吸附(用活性炭)除去水中可溶物体,也可除去水中的色素、气味(臭味)
4.消毒(漂白粉,最常见的消毒剂,二氧化氯最新型的消毒剂)【化学变化】
仪器:带铁圈的铁架台、漏斗、玻璃棒、烧杯
一贴:滤纸紧贴在漏斗的内壁上
两低:滤纸的边缘应略低于漏斗的边缘
操作所倒入的滤液的液面应略低于滤纸的边缘
实验室水的净化漏斗的下端要紧靠在烧杯的内壁上
(过滤)三靠玻璃板要轻轻地考在三层滤纸一侧
盛放滤液的烧杯嘴要靠在玻璃棒的中下部
过滤后液体任然浑浊的原因:一贴、二低、三靠
如图,净化水的方法是过滤和吸附
该顺序不可颠倒
1.过滤
生活中水的净化
如右图,是一种家用环保型消毒液发生器,
其中发生的主要反应是氯化钠和水在通电
2.消毒条件下反应生成氢氧化钠、氢气和氯气,
该反应的化学方程式为;
从能量变化角度看,该反应将电能转化为化学能.
①温度计的作用:测量进入支管的水蒸气的温度
②温度计的位置:温度计的水银球的上缘,要恰好与蒸馏烧杯支管接口的下缘在同一
水平线上
蒸馏水的制取③水流的方向:要与热气流的方向相反,才能达到最好的冷凝效果
④沸石(碎瓷片)的作用:防止加热是出现暴沸
特点:含较多可溶性钙、镁化合物的水
硬水加肥皂水后:泡沫少,有浮渣和沉淀
反应方程式:
现象:与电源正负两级相连的试管内汇集的气体体积比为1:2
1.水的电解往往会滴加稀硫酸的原因:增强水的导电性,加快电解速率
V m 气体口诀
要点: 2.正极: 1 8 氧气(O2)【能使带火星木条复燃】正氧,负氢水的电解负极: 2 1 氢气 (H2)【燃烧产生淡蓝色火焰】氢2,氧1
3.V(H2):V(O2)>2:1的原因:①氧气比氢气易溶于水
②氧气的化学性质比较活泼,和电极易发生剧烈
反应
结论:水是由氢元素和氧元素组成的。
能得出“水是由氢元素和氧元素组成的。”的实验是:
①氢气防在氧气中燃烧,会产生水
②氢气还原氧化铜,试管壁有小水珠生成
③将 Na 单质防入水中,有NaOH 和H2生成
注:K、Ga、Na三种金属的活动性超强,能直接与水反应,所以一般不用
它们与盐溶液反应
第四单元碳和碳的氧化物
化学性质:常温下,碳的化学性质很不活泼;高温下,很活泼
可燃性:
化学反应
还原性:
碳的使用带来的影响:造成温室效应,全球变暖。
①节约使用纸张,双面使用纸张
中学生力所能及的措施②节约用电
③节约用水
第五单元燃料及其利用
定义:可燃物与氧气发生的一种发光、放热的剧烈氧化反应,叫做燃烧。
(1)可燃物
燃烧的条件:(2)可燃物与氧气接触;
(3)温度达到着火点。
①清除可燃物/隔绝可燃物
灭火的原理:②隔绝氧气
③将温度降到着火点以下
注:着火点是很难改变的一种属性,不可写出“降低可燃物的着火点”。
①油锅着火,用锅盖盖灭将可燃物与空气(氧气)隔绝
②纸箱着火,用水扑灭将温度降到着火点以下
③扑灭森林火灾,是将大火蔓延路线前一片树木砍掉
清除可燃物
常见灭火现象④图书馆着火,用二氧化碳灭火器灭火隔绝氧气,降低温度
及其原理⑤实验室酒精着火,用湿布盖灭使温度降到着火点以下,隔绝
⑥被褥着火,用水淋灭使温度降到着火点以下
⑦熄灭酒精灯用灯帽盖灭将可燃物与空气(氧气)隔绝
注:金属着火,不可以用CO2灭火剂熄灭
爆炸:可燃物在有限空间内急速燃烧,在短时间内产生大量热和气体导致爆炸。
一切可燃性气体、粉尘、在遇到明火时都有可能发生爆炸。(也有物理变化的爆炸如车胎爆炸)。注:爆炸除具备燃烧的三个条件外,还需具备在限定空间内
如右图,利用废旧眼药水瓶,对点燃可燃性气体装置进行了
如右图设计,点燃时就可有效地防止爆炸.其原因是:
降低温度到着火点以下,防止火焰进入发生装置
冬天严寒季节有时管道煤气火焰很小,并且呈断续状态的原因是:气体遇冷凝结为液体使管道内气流不畅
图A 安装的报警器,则使用的燃气为:天然气、管道煤气、氢气
图B 安装的报警器,则使用的燃气为:液化石油气
实验题 1.气体
(1)关于二氧化碳的实验:
① 现象:蜡烛火焰自下而上依次熄灭 结论:2co 密度比空气大,
不支持燃烧,也不能燃烧
甲图中玻璃板①的目的是:防止在火焰上方的CO 2受热导致其密度变小, 使CO 2不能倒入烧杯.
① 如用乙图的实验,则会造成的后果是:乙图的倾倒方式,没用玻璃片掩盖,直接倒在 火焰的上方,由于蜡烛燃烧放热,使得气体受 热,密度变小,故CO 2不能与蜡烛火焰接触而 跑到空气去了.
如右图,玻璃板②的作用是:为避免倒入的二氧化碳把 上层蜡烛先冲灭
放置玻璃板②时,应注意:挡板放置位置,应当保证两只 蜡烛在挡板的同一侧,气体从 没有蜡烛的一侧倾倒
正确的放置位置 现象:软塑料瓶变瘪了
原因:气体体积减少,造成瓶内压强减少, 大气压使软塑料瓶变瘪 结论:CO 2能溶于水
② 操作步骤:向一个收集满CO2气体的质软的塑料瓶A 中加入约3
1
体积的水,立即 旋紧瓶盖,振荡
如右图,若要证明CO 2与NaOH 反应,则还需增加的 实验是:将NaOH 溶液换为等体积的水,再进行该实验
现象:澄清石灰水变浑浊
③ 反应方程式:O H CaCO OH Ca CO 2322)(+↓=+ 结论:2co 能使澄清石灰水变浑浊
能使澄清石灰水变浑浊的气体:CO 2、SO 2、SO 3 2co
的
性
质
①