
变桨控制系统紧急电源用铅酸蓄电池
与用超级电容对比
王洪阳
摘要:变桨控制及后备紧急电源系统是大型变速变桨距风电机组电气控制的主要组成部分,对机组安全运行具有十分重要的作用。本文针对风机变桨控制系统采用超级电容作为紧急电源与采用铅酸蓄电池作为紧急电源进行了比较分析。
一、引言
AA风电场一期工程采用X电风能EX93-2000型风机,二期阿月风电场采用X 电风能EX96-2000型风机,三期李家坝风电场采用DF2500-110型风机;其中X 电风能风机采用铅酸蓄电池作为变桨控制后备紧急电源,三期D电风机采用超级电容作为变桨控制后备紧急电源;紧急电源的作用是在风机故障或其他紧急情况时直接提供收桨电源,确保风机的安全。根据蓄电池和超级电容相关知识,结合本风场实际运行情况,对采用蓄电池与采用超级电容作为变桨控制紧急电源进行对比与分析。
二、蓄电池与超级电容对比
1、功能简介
蓄电池是较为传统的储能电池,按正极材料可分以下几类:铅酸蓄电池、镍氢电池、镍锌电池、锂电池等。目前,蓄电池在电力行业和轨道交通上,主要作为后备和紧急电源使用;作为主要供能装置常用于短距离的电动车、公交、有轨电车等领域。
超级电容又叫双电层电容器,是20世纪七八十年代发展起来的一种新型储能装置,结构上同普通电解电容非常相似。由于采用活性炭多孔电极和电解质组成了双电层结构,加上极小的电极间隙,可以获得超大的容量。目前正处于快速发展阶段,主要用作备用电源和提供峰值功率。
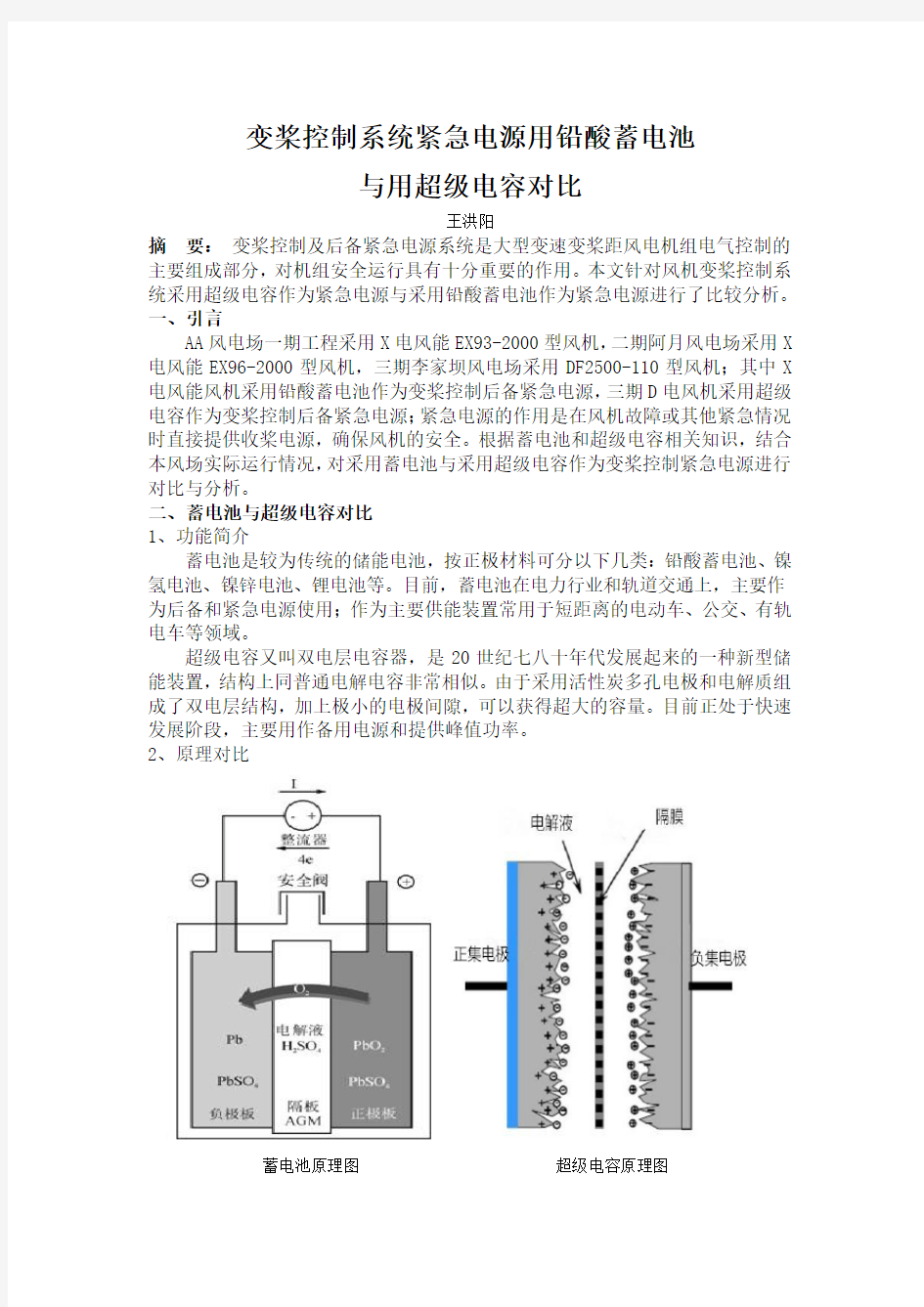
2、原理对比
蓄电池原理图超级电容原理图
铅酸蓄电池在放电时,正极的活性物质二氧化铅和负极的活性物质金属铅都与硫酸电解液反应,生成硫酸铅,在电化学上把这种反应叫做“双硫酸盐化反应”。在蓄电池刚放电结束时,正、负极活性物质转化成的硫酸铅是一种结构疏松、晶体细密的结晶物,活性程度非常高。蓄电池充电过程中,正、负极疏松细密的硫酸铅,在外界充电电流的作用下会重新还原成二氧化铅和金属铅,蓄电池又处于充足电的状态。正是这种可逆转的电化学反应,使蓄电池实现了储存电能和释放电能的功能。
超级电容充电时,当外电压加到超级电容器的两个极板上时,与普通电容器一样,极板的正电极存储正电荷,负极板存储负电荷,在超级电容器两个人极板上的电荷产生的电场作用下,电解液与电极间的界面上形成相反的电荷,以平衡电解液的内电场,正电荷与负电荷吸附在两个极板上。放电时,正、负极板上的电荷被外电路泄放,当两极板间电势低于电解液的氧化还原电极电位时,电解液界面上的电荷响应减少,但不会脱离电解液。由此可以看出:超级电容器的充放电过程始终是物理过程,没有化学反应。因此性能较稳定,与利用化学反应的蓄电池不同。
3、优点缺点对比
蓄电池优点:
1)单体电压高、能量密度高,适当的重量和体积能带来较大的能量输出。
2)在额定充放电倍率,使用次数和循环寿命较长。
3)采用了无害和环保材料,环境公害很低。
4)目前市场价格较低。
蓄电池缺点:
1)大电流充放电特性不理想。
2)对过充过放耐受性差,需要精细的管理保护系统。
3)受温度影响大,高温下性能恶化并直接影响蓄电池的容量。
4)存在爆炸的风险,如高温、大电流等情况。需要多重保护机制。
超级电容优点:
1)储存电容量大,功率密度大,短时大功率充放电能力强。
2)物理能量转换,充放电时间短,效率高。
3)充放电循环次数可达50万次,长使用寿命。
4)具有很宽的工作温度范围。
超级电容缺点:
1)单体电压低,能量密度低。相比蓄电池,在同样容量输出下,需要大量并串联,必然带来体积和重量的急剧增加。
2)串联使用需要采取必要的均压控制电路,均压控制电路的设计直接影响超级电容中后期的使用寿命。
3)目前价格较高。
4、参数对比(以AA风电场一、二期风机蓄电池和三期风机超级电容为例)
参数铅酸蓄电池超级电容
体积每柜4组,每组6个,体积
较大
每柜6组,每组10个,体
积适中
重量每柜电池重67.2kg每柜电容重33kg 充电方式单体循环充电整组串联充电
单体标称电压12V 1.5V
温度要求工作范围:-25℃~+45℃
(25℃最优)
工作范围:-40℃~+70℃
充放电时间循环充满电4-6小时整组数十秒可充满功率密度
(W/kg)
低,50-200 W/kg高,1000-2000W/kg
能量密度高20~100 Wh/kg 低,约为蓄电池的1/10,3-15 Wh/kg
循环寿命3-5年(大倍率充放电或
过放电对寿命影响较大)
6-7年
荷电保持能力存在低自放电几乎不存在自放电使用维护电池密封免维护彻底免维护
5、故障率统计对比
统计AA风电场2014年6、7、8月风机故障发现:一、二期工程安装X电风能风机共计31台,变桨系统故障151台次,其中直接由电池充电管理单元及电池引发故障合计31台次,更换电池充电管理单元8个,更换蓄电池51块;
三期工程安装D电风机19台,变桨系统故障共计34次,未发生充电单元和电容故障;
三、分析
根据AA风场实际运行情况,蓄电池组的体积和重量均大于超级电容组;X 电风能风机蓄电池采用单体循环充电,整组电池充满大概需要4-6个小时,而D 电风机超级电容采取串联充电,充电时间在1分钟以内,远远低于蓄电池充电时间。
一期风机变桨蓄电池运行两年以后,蓄电池和充电管理单元的故障就逐渐增多,运行临近三年已出现大部分电池电压、容量下降的情况,证明蓄电池在我风场风机上的使用寿命就只有三年。如果更换新电池组,一台风机需更换电池72块,电池净重量就有210Kg,在机舱有限的作业环境中大大增加维护人员的工作难度和强度;
从我风场6、7、8月运行情况分析,X电风机蓄电池及充电管理单元的故障率远高于D电风机超级电容及充电管理单元故障率;X电风机更换蓄电池及充电器的数量也维持在较高水平,而D电风机超级电容和充电器故障次数基本为零,真正实现免维护。单从备用电源方面来说,采用超级电容作为备用电源就大大提高了风机的可利用率。
从经济角度来分析,超级电容的使用寿命是蓄电池使用寿命的两倍以上,而成本却不到蓄电池寿命的1.7倍,而且蓄电池较高的故障率必然造成较多的停机损失,每三年更换一次蓄电池更是需要长时间的停机。所以超级电容一次投入的成本虽然高于蓄电池,但是从长远的运行来看,超级电容带来的经济利益是远远
高于蓄电池的。
四、总结
通过以上对比分析我们可以看出,采用超级电容作为紧急变桨控制后备电源是完全能满足风机变桨控制需要的,不但节约了机舱有限的空间,还降低了轮毂的重量,在运行过程中降低了风机变桨系统的故障率,减少维护成本和维护工作量。在超级电容应用技术日益成熟的现在,推广超级电容作为变桨控制系统后备紧急电源是一种提高风机变桨系统可利用率、增加发电量、降低维护成本的有效措施。
希望通过本文的介绍,能为公司在以后风电机组备用电源选型或改造时提供参考。同时推广到其他设备的选型也是同样的道理,在风电行业迅猛发展的时期,激烈的市场竞争促使部分风电机组厂商通过价格优势来占领市场,但是所谓的价格优势往往是通过使用一些较为便宜的代替产品以次充好,虽然整机的价格是下降了,但是作为我们业主单位来说,在长期的运行过程中,较高的故障率,较高的度电维护成本都是无形的经济负担,不但不能真正的节约成本,相反会增加运行维护成本,降低企业的盈利能力。所以在设备选型时,不能只以价格来衡量,而是要综合考虑机组设备的整体质量及长期运行的可靠性。
高考总复习原电池和化学电源 【考纲要求】 1.了解原电池的工作原理。 2.能写出原电池的电极反应式和反应的总方程式。 3.能根据氧化还原反应方程式设计简单的原电池。 4.能根据原电池原理进行简单计算。 5.熟悉常见的化学电源(一次电池、二次电池和燃料电池),能分析常见化学电池工作原理,了解废旧电池回收的意义。 【考点梳理】 考点一、原电池的概念 1.能量的转化 原电池:将化学能转变为电能的装置。 电能是现代社会应用最广泛、使用最方便、污染最小的一种二次能源,又称电力。2.工作原理 设计一种装置,使氧化还原反应所释放的能量直接转变为电能,即将氧化反应和还原反应分别在两个不同的区域进行,并使电子转移经过导线,在一定条件下形成电流。 电子从负极(较活泼金属)流向正极(较不活泼金属或碳棒),负极发生氧化反应,正极发生还原反应。 电极电极材料反应类型电子流动方向 负极还原性较强的金属氧化反应负极向外电路提供电子 正极还原性较弱的金属还原反应正极从外电路得到电子 以下是锌铜原电池装置示意图: 要点诠释:盐桥的作用 a.组成:将热的饱和KCl或NH4NO3琼胶溶液倒入U形管中(不能产生裂隙),即可得到盐桥。将冷却后的U形管浸泡在KCl饱和溶液或NH4NO3饱和溶液中备用。 b.作用:(1)使整个装置构成通路,代替两溶液直接接触。(2)平衡电荷。 在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+变为Cu,使得SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。 由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或CuSO4溶液中的Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
开关电源一次滤波大电解电容 开关电源决定一次侧滤波电容,主要影响电源的性能参数为输出低频交流纹波与保持时间. 滤波电容越大,电容器上的Vin(min)越高,可以输出较大功率的电源,但相对价格也提高了。 输入电解电容计算方法(举例说明): 1.因输出电压12V 输出电流2A, 故输出功率:Pout=Vo*Io=1 2.0V*2A=24W 。 2.设定变压器的转换效率约为80%,则输出功率为24W 的电源其输入功率:Pin=Pout/效率=W W 30% 8024=. 3.因输入最小交流电压为90VAC ,则其直流输出电压为: Vin=90*2=127Vdc 故负载直流电流为:I=Vin Pin =A Vac W 236.012730= (若电源的等级要求较高时, 可考虑如下参数进行推算; 因输入最小交流电压为90VAC ,则其最低输出直流电压为: Vin(min)=90*2-30(直流纹波电压)=97Vdc ,故最大负载直流电流为:I MAX =(min)Vin Pin =A Vac W 309.09730=) 4.设计允许30V PP 的直流纹波电压V ?,并且电容要维持电压的时间为半周期t (即半周期的工频率交流电压在约是8ms ,T=f 1=60 1=0.0167S=16.7 ms )则:C=uF V t I 9.6230 10*8*236.0*3 ==?- 62uH 在常用电容47-82uH 之间,因考虑成本问题。 故实际选择电容量47uF. 5.因最大输入交流电压为264Vac ,则最高直流电压为:V=264*2=373VDC. 实际选用通用型耐压400Vdc 的电解电容,此电压等级,电容有95%的裕度. 6.电容器的承受的纹波电流值决定电容器的温升,进而决定电容器的寿命.(电容器的最大纹波电流值与其体积,材质有关.体积越大散热越好耐受纹波电流值越高)故在选用电容器要考虑实际纹波电流值<电容器的最大纹波电流值. 7.开关源元器件温升一般较高,通常选用105℃电容器,在特殊情况无法克服温升时可选用125℃电容器. 故选用47uF,400v, 105℃电解电容器可以满足要求(在实际使用时还考虑安装机构尺寸,体种大小,散热环境好坏等)
原电池、化学电源跟踪测试 一、选择题 1.下列关于原电池的叙述正确的是 A. 构成原电池的正极和负极必须是两种不同的金属 B. 原电池是化学能转变为电能的装置 C. 在原电池中,电子流出的一极是负极,该电极被还原 D. 原电池放电时,电流的方向是从负极到正极 2.镍镉(Ni —Cd )可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行: Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H 2O 由此可知,该电池放电时的负极材料是 A .Cd(OH)2 B .Ni(OH)2 C .Cd D .NiO(OH) 3.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 A .两烧杯中铜片表面均无气泡产生 B .甲中铜片是正极,乙中铜片是负极 C .两烧杯中溶液的pH 均增大 D .产生气泡的速度甲比乙慢 4.下列各变化中属于原电池反应的是 A .在空气中金属铝表面迅速氧化形成保护层 B .镀锌铁表面有划损时,也能阻止铁被氧化 C .红热的铁丝与冷水接触,表面形成蓝黑色保护层 D .浓硝酸比稀硝酸更能氧化金属铜 5.已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确.. 的是 A .充电时作阳极,放电时作负极 B .充电时作阳极,放电时作正极 C .充电时作阴极,放电时作负极 D .充电时作阴极,放电时作正极 6.下列事实能说明Al 的金属活动性比Cu 强的是 A . 常温下将铝和铜用导线连接组成原电池放入到氢氧化钠溶液中 B . 常温下将铝和铜用导线连接组成原电池放入到稀盐酸溶液中 C . 与氯气反应时,铝失去3个电子,而铜失去2个电子 D . 常温下,铝在浓硝酸中钝化而铜不发生钝化 充电 放电
开关电源设计技巧连载十六:推挽式变压器开关电源储能滤波电感、电容参数的计算 1-8-1-3.推挽式变压器开关电源储能滤波电感、电容参数的计算 图1-33中,储能滤波电感和储能滤波电容参数的计算,与图1-2的串联式开关电源中储能滤波电感和储能滤波电容参数的计算方法很相似。 根据图1-33和图1-34,我们把整流输出电压uo和LC滤波电路的电压uc、电流iL画出如图1-35,以便用来计算推挽式变压器开关电源储能滤波电感、电容的参数。 图1-35-a)是整流输出电压uo的波形图。实线表示控制开关K1接通时,推挽式变压器开关电源开关变压器次级线圈N3绕组输出电压经整流后的波形;虚线表示控制开关K2接通时,推挽式变压器开关电源开关变压器次级线圈N3绕组输出电压经整流后的波形。Up表示整流输出峰值电压(正激输出电压),Up-表示整流输出最低电压(反激输出电压),Ua表示整流输出电压的平均值。 图1-35-b)是滤波电容器两端电压的波形图,或滤波电路输出电压的波形图。Uo表示输出电压,或滤波电容器两端电压的平均值;ΔUc表示电容充电电压增量,2ΔUc等于输出电压纹波。
1-8-1-3-1.推挽式变压器开关电源储能滤波电感参数的计算 在图1-33中,当控制开关K1接通时,输入电压Ui通过控制开关K1加到开关变压器线圈N1绕组的两端,在控制开关K1接通Ton期间,开关变压器线圈N3绕组输出一个幅度为Up(半波平均值)的正激电压uo,然后加到储能滤波电感L 和储能滤波电容C组成的滤波电路上,在此期间储能滤波电感L两端的电压eL 为: 式中:Ui为输入电压,Uo为直流输出电压,即:Uo为滤波电容两端电压uc的平均值。 在此顺便说明:由于电容两端的电压变化增量ΔU相对于输出电压Uo来说非常小,为了简单,我们这里把Uo当成常量来处理。 对(1-136)式进行积分得:
常见化学电源及电极反应式的书写 一、常见化学电源:(大体可分为三类) 1、燃料电池: (1)氢氧燃料电池:2H2+O2=2H2O 当电解质溶液呈酸性时; 负极:2H2-4e-=4H+正极:O2+4e-+4H+=2H2O 当电解质溶液呈碱性时;电解质溶液为KOH溶液, 负极:2H2-4e-+4OH-=4H2O 正极:O2+4e-+2H2O=4OH- (2)甲烷燃料电池:用金属铂作电极, 用KOH溶液作电解质溶液。 负极:CH4+ 10 OH--8e-==CO3 2- +7H2O 正极: 2O2+ 4H2O +8e- == 8OH- 总反应式为:CH4+ 2O2+2KOH==K2CO3+ 3H2O 用酸液作电解质溶液 负极:CH4 + 2H2O - 8e- = CO2 + 8H+ 正极:2O2 + 8H+ + 8e- = 4H2O 总反应:CH4 + 2O2 = CO2 + 2H2O (3)甲醇燃料电池:强碱作为电解质溶液 负极:2CH4O + 16OH--12e-==2CO3 2- +12H2O 正极: 3O2+ 6H2O +12e- == 12OH- 总反应式为:2CH4O + 3O2+4OH-==2CO3 2- + 6H2O (4)熔融盐燃料电池:该电池用Li2CO3和的Na2CO3熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气, 负极:2CO+2CO3 2- -4e-==4CO2正极:O2 + 2CO2+4e- ==2CO3 2- 总反应式为:2CO +O2==2CO2 (5)固体氧化物燃料电池:固体氧化锆—氧化钇为电解质, 这种固体电解质在高温下允许O 2-在其间通过。 负极:2H2+ 2O2--4e- = 2H2O 正极: O2+4e- = 2O 2- 总反应式为:2H2 + O2= 2H2O 2、蓄电池:
2018——2019学年高二化学期末复习原电池和化学电源专题复习 1银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其工作 示意图如下。下列说法不正确的是() A.K+向正极移动 B.Ag2O 电极发生还原反应 C.Zn 电极的电极反应式:Zn-2e-+2OH-===Zn(OH)2 D.放电前后电解质溶液的碱性保持不变 答案 D 2.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法正确的是() A.Zn为电池的负极 B.正极反应式为:2FeO2-4+10H++6e-===Fe2O3+5H2O C.该电池放电过程中电解质溶液浓度不变 D.电池工作时OH-向正极迁移 答案 A 3.如图是某同学学习原电池后整理的学习笔记,错误的是() A.①电子流动方向 B.②电流方向 C.③电极反应 D.④溶液中离子移动方向 答案 B 4.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4) +K2SO4+8H2O设计如下原电池,盐桥中装有用饱和Na2SO4溶液浸泡过的琼脂。下列说法正3 确的是()
A.b电极上发生的反应:Fe2+-e-===Fe3+ B.a电极上发生氧化反应:MnO-4+8H++5e-===Mn2++4H2O C.外电路电子的流向是从a到b D.电池工作时,盐桥中的SO2-4移向甲烧杯 答案 A 5.一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)===Ag(s)+Cl(AgCl)[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-―→Cl -(aq),若将光源移除,电池会立即恢复至初始状态。下列说法正确的是() A.光照时,电流由铂流向银 B.光照时,Pt 电极发生的反应为2Cl-+2e-===Cl2 C.光照时,Cl-向Ag电极移动 D.光照时,电池总反应:AgCl (s)+Cu+(aq)===Ag(s)+Cu2+(aq)+Cl-(aq) 6.一种锂铜可充电电池,工作原理如下图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(Li+交换膜)隔开。下列说法不正确的是() A.陶瓷片允许Li+通过,不允许水分子通过 B.放电时,N极为电池的正极 C.充电时,阳极反应为:Cu-2e-===Cu2+ D.充电时,接线柱A应与外接电源的正极相连
化学原电池和化学电源教案 要点一原电池原理 1.原电池概念:利用________反应原理将________能转化为________能的装置。 2 ______ ,铜片上有② ______ 电极Cu ______ ⑤ 电子⑦____ 3.原电池形成的条件 (1)两个活泼性不同的电极: 相对活泼的金属作________, 较不活泼的金属或能导电的非金属作________; (2)________溶液; (3)形成________回路; (4)能自发发生氧化还原反应。 盐桥的作用是什么? 1.(双选题)下列装置不可以组成原电池的是() 2.(2014·潮州市高二期末考)用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是() A.电子通过盐桥从乙池流向甲池 B.铜导线替换盐桥,原电池将不能继续工作 C.开始时,银片上发生的反应是:Ag-e-===Ag+ D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
3.下列反应可用于设计原电池的是() A.H2SO4+2NaOH===Na2SO4+2H2O B.2FeCl3+Fe===3FeCl2 C.Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑ D.NaCl+AgNO3===NaNO3+AgCl↓ 例2如右图装置,电流表G发生偏转,同时a极逐渐变粗,b极逐渐变细,c为电解质溶液,则a、b、c可以是下列各组中的() A.a是Zn,b是Cu,c为稀H2SO4 B.a是Cu,b是Zn,c为稀H2SO4 C.a是Fe,b是Ag,c为AgNO3溶液 D.a是Ag,b是Fe,c为AgNO3溶液 4.将Al片和Cu片用导线连接,一组插入浓硝酸中,一组插入稀氢氧化钠溶液中,分别形成原电池。在这两个原电池中,负极分别为() A.Al片、Cu片B.Cu片、Al片 C.Al片、Al片D.Cu片、Cu片 例3利用反应Zn+2FeCl3===ZnCl2+2FeCl2设计一个原电池。在下图方格内画出实验装置图,并指出正极材料为________,电极反应式为____________________;负极材料为________,电极反应式为________________________________________________________________________。 5.选择适宜的材料和试剂设计一个原电池,以便完成下列反应:2FeCl3+Cu===2FeCl2+CuCl2。画出原电池的示意图并写出电极反应。 要点一化学电池 化学电池是将________能变成________能的装置。 1.化学电池的分类 化学电池 2.优点 (1)化学电池的______________较高,供能稳定可靠。 (2)可以制成各种形状和大小、不同容量和电压的电池及电池组。 例1碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。下列说法错误的是() A.电池工作时,锌失去电子 B.电池负极的电极反应式为Zn-2e-+2OH-===Zn(OH)2 C.电池工作时,电子由正极通过外电路流向负极 D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g 1.(2013·海南卷)Mg—AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg===Mg2++2Ag+2Cl-。有关该电池的说法正确的是() A.Mg为电池的正极 B.负极反应为AgCl+e-===Ag+Cl- C.不能被KCl溶液激活 D.可用于海上应急照明供电 要点二一次电池 一次电池的电解质溶液制成________,不流动,也叫做干电池。 1.特点 一次电池不能充电,不能反复使用。
开关电源中X电容和Y电容设计规则 开关电源的X电容设计准则: 参考AD1118X电容放置原则: 1.共模扼流圈前:105/275VA CMKP/X2 2.共模扼流圈后:474/275VA CMKP/X2 参考MWSP200-12X电容放置原则: 1.共模扼流圈前:1uF/275VA CMKP/X2 2.共模扼流圈后:0.33uF/275VA CMKP/X2 参考MWS145-12X电容放置原则: 1.共模扼流圈前:0.22uF/MKP-X2-250VA C/275VA CGS-L 2.共模扼流圈后:0.1uF/MKP-X2-250VA C/275VA CGS-L 一般两级X电容,前一级用0.47uF第二级用0.1uF;单级则用0.47uF.目前还没有比较方便的计算方法。电容容量的大小和电源的功率无直接关系) 开关电源的Y电容设计准则: 大地=PGNDorCHGND 参考AD1118Y电容放置原则: 1.市电输入L/N线对大地:2颗472/250VY2 2.市电经过一级共模扼流圈后的两线对大地:2颗472/250V 3.整流桥输出的低压端(变压器初级低压端)对大地:1颗222/250V 4.6组低压直流输出88V1对大地:各1颗103/1KVY1 5.6组低压输出辅助电源AGND变压器次级低压端)对大地:共用1颗103/1KVY1 6.变压器初级低压端对变压器次级低压端:共用1颗103/1kVY1
参考AD1043设计: 1.市电输入L/N线对大地:2颗222/250VY2 2.市电经过1级共模扼流圈后的两线对大地:2颗472/250VY2 参考康殊电子的设计: 1.市电输入L/N线对大地:2颗102/250VY2 2.市电经过2级共模扼流圈后的两线对大地:2颗102/250VY2 3.整流桥输出的低压端(变压器初级低压端无线数传模块)对大地:1颗332/250VY2 4.12V低压直流输出对大地:1颗223/1KVDISCY1 5.变压器初级低压端对变压器次级低压端:222/250VY1 参考MWS-145-12设计: 1.市电经过1级共模扼流圈后的两线对大地:2颗222/2kVY1 2.整流桥输出的低压端(变压器初级低压端)对大地:1颗222/2kVY1 3.12V低压直流输出GND对大地:1颗103/1KVY1 参考MWS-200-12设计: 1.市电输入L/N线对大地:2颗472/250VY2未上) 2.市电经过1级共模扼流圈后的两线对大地:2颗472/250VY2 2.整流桥输出的低压端(变压器初级低压端)对大地:1颗222/250VY2 3.PFC输出高压端对变压器初级地:1颗103/2kVY1 4.12V低压直流输出对大地:1颗103/1KVY1 5.12V低压直流输出GND对大地:1颗203/1KVY1 根据上述说明,Y电容设计规则如下:可适当选择) 1.市电输入L/N线对大地:2颗222/250VY2
原电池及化学电源 一、原电池:把能转化为能的装置。 1、基本原电池: 电池总反应 电极反应式: 负极(电极):反应 正极(电极):反应 2、盐桥原电池:将反应Cu+2Fe3+=Cu2++2Fe2+设计成一个盐桥原电池 电池总反应 负极(电极):反应 正极(电极):反应 盐桥的作用是什么 3.原电池中的基本关系 负极: 电子、反应 (1)电极 正极: 电子、反应 (2)三个流向 电子由极流向极电流由极流向极阳离子移动向 阴离子移动向 4. (1)(2) (3)(4) 练习:书写如下电池反应的电池方程式和电极方程式 Al----Mg和稀硫酸 负极:正极: 总式 Fe----Cu和浓硝酸 负极:正极: 总式 Al----Mg氢氧化钠溶液 负极:正极: 总式 二、化学电源 1.二次电池(铅蓄电池) 正极:负极:电解质溶液为: 电池反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O 负极:正极: 铅蓄电池的充电过程(电解池)总反应: 阳极:阴极:
2. 燃料电池(氢氧燃料电池) 总反应: 酸性电解质正极:负极: 碱性电解质正极:负极: 3.甲烷燃料电池 酸性电解质总反应: 正极:负极: 碱性电解质总反应: 正极:负极: 1、有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易被 腐蚀;将A、D分别投入到等浓度的盐酸中,D比A反应剧烈;将铜浸入B的盐溶液中无明显变化;将铜浸入C的盐溶液中,有金属C析出。据此可推知它们的金属活动性由强到弱的顺序为() A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C 2、100mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成 氢气的总量,可采用的方法是() A、加入适量的6mol·L-1的盐酸B.加入数滴氯化铜溶液 C.加入适量蒸馏水D.加入适量的氯化钠溶液 3.碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。锌锰电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+2H2O(l)=Zn(OH)2(s)+2Mn2OOH (s)。下列说法错误的是() A.电池负极的电极反应式为Zn-2e-+2 OH-=Zn(OH)2 B.电池工作时,电子由正极通过外电路流向负极 C.电池工作时,锌失去电子 D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g 4.镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是()。 A.电池总反应为Mg+H2O2===Mg(OH)2 B.正极发生的电极反应为H2O2+2H++2e-===2H2O C.工作时,正极周围海水的pH减小 D.电池工作时,溶液中的H+向负极移动 5.控制适合的条件,将反应2Fe3++2I-2Fe2++I 2设计 成如下图所示的原电池。下列判断不正确的是( ) A.反应开始时,乙中石墨电极上发生氧化反应 B.反应开始时,甲中石墨电极上Fe3+被还原 C.电流计读数为零时,反应达到化学平衡状态 D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
原电池化学电源专题训练及答案 一、选择题(本题包括6小题,每题7分,共42分) 1.如图为氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( ) A.b处通入H2 B.该装置将化学能最终转化为电能 C.通入H2的电极发生反应:2H2-4e-4H+ D.a处为电池负极,发生氧化反应 【解析】选D。由电子流向可知a为负极通入H2, b为正极通入O2,发生还原反应,A错误、D正确;该装置将化学能最终转化为光能,B错误;电解质为KOH溶液,电极反应式中不能含有H+,C错误。 【加固训练】 各式各样电池的迅速发展是化学对人类的一项重大贡献。下列有关电池的 叙述正确的是( ) A.手机上用的锂离子电池可以用KOH溶液作电解液 B.锌锰干电池中,锌电极是负极 C.氢氧燃料电池工作时氢气在负极上被还原 D.太阳能电池的主要材料是高纯度的二氧化硅 【解析】选B。锂能与水反应,不能用水溶液作电解液,A错误;锌锰干电池中锌失去电子生成Zn2+为负极,B正确;氢氧燃料电池工作时氢气在负极被氧化,C错误;太阳能电池的主要材料为硅,D错误。 2.(2018·哈尔滨模拟)“便携式乙醇测量仪”运用燃料电池的工作原理。在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为CH3CH2OH-2e-X+2H+。下列说法中正确的是( ) A.另一极的电极反应式为O2+4e-+2H2O4OH- B.电池内部H+向负极移动 C.电池总反应为2CH3CH2OH+O22CH3CHO+2H2O D.乙醇在正极发生反应,电子经过外电路流向负极 【解析】选C。在酸性环境中,正极反应式为O2+4e-+4H+2H2O,A错误;氢离子为阳离子,应由负极向正极移动,B错误;根据元素守恒,可确定X为CH3CHO,电池总反应为2CH3CH2OH+O22CH3CHO+2H2O,C正确;乙醇被氧化,应在负极发生氧化反应,D错误。 3.某学习小组的同学查阅相关资料知氧化性:Cr2错误!未找到引用源。>Fe3+,设计了盐桥式的原电池,如图,盐桥中装有琼脂与饱和K2SO4溶液。下列叙述中正确的是( ) A.甲烧杯的溶液中发生还原反应 B.乙烧杯中发生的电极反应为2Cr3++7H2O-6e-Cr2错误!未找到引用源。+14H+ C.外电路的电流方向是从b到a D.电池工作时,盐桥中的S错误!未找到引用源。移向乙烧杯 【解析】选C。因为氧化性:Cr2错误!未找到引用源。>Fe3+,所以该原电池反应是Cr2错误!未找到引用源。将Fe2+氧化为Fe3+,所以甲烧杯发生氧化反应,A错误;乙烧杯发生还原反应,电极反应为Cr2错误!未找到引用源。 +6e-+14H+2Cr3++7H2O,B错误;根据以上分析,a是负极,b是正极,则电流方向是从正极向负极流动,C正确;原电池中的阴离子向负极移动,所以S错误!未找到引用源。向甲烧杯移动,D错误。 4.大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池(NiMH电池)正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的是( )
开关电源始终无输出的故障检修技巧 1、开关电源始终无电压输出的原因 这种情况是由于开关电源未产生振荡所致,进一步证明的方法是;测开关电源整流滤波电容关机后的电压,若为300V之后缓慢下降,则说明开关电源确未产生振荡。开关电源未产生振荡的原因有: 1).开关管集电极未得到足够的工作电压。 2).开关管基极未得到启动电压。 3).开关管正反馈电路元件失效。: 2、检修方法与步骤 1).测开关管集电极电压为0或低于市电1.4倍,检查交流220V输入电路及整流滤波电路,若集电极电压正常,则检查开关管b极电压 2).测开关管b极电压或者在关机瞬间,用指针万用表R x 1欧挡,黑笔接b极,红笔接整流滤波电容负极(热地),听电源有启动声音,说明电源振荡电路正常,仅缺乏启动电压,是启动电阻开路或铜皮断。若无启动声,在测be结后,迅速将表转到电压档,测c极电压是否快速泄放。若是,说明开关管及其放电回路均正常,正反馈电路存在故障,包括反馈电阻、电容、续流二极管、正反馈绕组及其开关管故障。若c极电压仍不泄放,说明开关管及其回路有开路故障或b极有短路接地故障 二、开关电源瞬间有电压输出的故障检修技巧 1、瞬间有电压输出故障原因 开关电源在加电的初始产生了振荡,但后来由于过压过流保护引起停振,或开关机接口电路加电初为开机状态,但随着CPU清零的结束而转入待机状态。 其原因有: 1).开关电源因故造成输出电压过高而引起保护停振。 2).负载过流而引起过流保护动作。 3).保护电路本身误动作。 4).遥控系统因故障而执行待机指令。 其中2、3、4项适用于带有副电源的机器。 2.故障判断的方法与检修步骤 1).假负载法: 脱开行负载,在B+输出端接上假负载,监测B+电压(应先将电压表接到位,开机后即关机)。如果高于正常值十几伏以上,可判断故障是由开关电源输出过压,并击穿行输出管所致,或电源本身的保护电路动作关断电源。应对控制开关电源输出电压的脉宽调制电路和振荡定时电容进行检查(后面将专门讲述)。 若开关电源B+正常,则变换负载或改变市电压观察B+是否稳定输出,对于直接取样电源可空载,以便更好地判断开关电源的稳定性能,若确认其良好,则故障系负载过流或保护电路动作所引起。
质子交换膜的研究进展 摘要:质子交换膜一直以来都是质子交换膜燃料电池中的研究重点,在过去的几十年间质子交换膜的种类不断增加,其性能也不断提高。目前,质子交换膜种类主要分为以下几种:(1)全氟磺酸(PFSA)型质子交换膜及其改性膜;(2)磺化聚合物质子交换膜;(3)磷酸掺杂聚合物膜;(4)基于聚苯并咪唑的质子交换膜,本文对这几种质子交换膜的研究进展进行了综述。 关键词:质子交换膜;改性;研究进展。 Research progress of proton exchange membrane Abstract:proton exchange membrane has always been a research focus in proton exchange membrane fuel cell.In the past decades,the number of proton exchange membrane has increased and its performance has been improved constantly.At present,the types of proton exchange membrane are mainly divided into the following types:(1)perfluorosulfonic acid(PFSA)proton exchange membrane and its modified membrane;(2)sulfonated polymer proton exchange membrane;(3)phosphoric doped polymer film;(4)based on the proton exchange membrane of polybenzimidazole,this paper reviews the research progress of these several proton exchange membranes. Keywords:proton exchange membrane;The modification;Research progress.
考纲要求 1.理解原电池的构成、工作原理及应用,能书写电极反应和总反应方程式。2.了解常见化学电源的种类及其工作原理。 考点一原电池的工作原理 1.概念和反应本质 原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。 2.原电池的构成条件 (1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。 (2)二看两电极:一般是活泼性不同的两电极。 (3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液中。 3.工作原理 以锌铜原电池为例
(1)反应原理 电极名称负极正极 电极材料锌片铜片 电极反应Zn-2e-===Zn2+Cu2++2e-===Cu 反应类型氧化反应还原反应 电子流向由Zn片沿导线流向Cu片 盐桥中 盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极 离子移向 (2) ①盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。 ②盐桥的作用:a.连接内电路,形成闭合回路;b.平衡电荷,使原电池不断产生电流。深度思考 正误判断,正确的打“√”,错误的打“×” (1)在原电池中,发生氧化反应的一极一定是负极( ) (2)在原电池中,负极材料的活泼性一定比正极材料强( ) (3)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应( ) (4)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生( ) (5)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动( ) (6)两种活泼性不同的金属组成原电池的两极,活泼金属一定作负极( )
开关电源中的X电容和Y电容 一直以来开关电源电路的”电磁干扰”就是一个重要的解决结点。从原理来讲电磁干扰主要来自于两个方面:即传导干扰和辐射干扰。 传导干扰是由于电路中寄生参数的存在,以及开关电源中调频开关器件的开通与判断,使得开关电源在市电交流输入端产生较大共模干扰和差模干扰。 辐射干扰是指由于导体中电流的变化会在其周围空间中产生变化的磁场,而变化的磁场又产生变化的电场,这一变化电流的幅值和频率决定其产生的电磁的大小以及其作用范围。因此,则又分为近场干扰和远场干扰。 为了减轻和抵制这些电磁干扰对电网以及电子设备产生的危害,工程技术人员在电路设计时X和Y电容的方法。X电容抵制差模干扰,Y电容抵制共模干扰,X电容和Y电容同属于安规电容。当安规电容器失效后,不会产生电击,不会危及人身安全。安规电容通常用于抗干扰电路中,起滤波的作用。 安规电容的放电和普通电容不一样,普通电容在外部电源断开后电荷会保留很长时间。如果用手触摸就会被电到,而安规电容则没这个问题。因此,对于安规电容的Y电容,其电容量必须受到限制,在额定频率及额定电压作用下,控制Y电容的容量,从而达到渡过Y电容的漏电流的大小对系统EMC(Electro Magnet Compathilty的缩写,意为电磁兼容性”)性能的影响。根据GJB-151规定Y电容的容量应不大于0.1UF,Y电容除符合相应的电网电压耐压外,还要求这种电容器在电气和机械性能方面有足够的安全裕量,避免在极端恶劣环境条件下使用时出现击穿短路现象,Y电容的耐压性能对保护人身安全,具有非常重要的意义。 由于X电容和Y电容在电路中所处的安装位置不一样。因此各自的安全等级有较大的差别。具体可参见等级表: X电容分类
1.(2020·全国高考真题)一种高性能的--3-24VB +16OH -11e =VO +2B(O A .负载通过0.04 mol 电子时,有 B .正极区溶液的pH 降低、负极 C .电池总反应为224VB 11O ++ D .电流由复合碳电极经负载、【答案】B 【解析】根据图示的电池结构,左侧干所示,右侧空气中的氧气发生得池的总反应方程式为4VB 2+11O 电子时,正极也通过0.04mol 电子标况下为0.224L ,A 正确;B .反极区OH -浓度减小pH 降低,B 错误+43-4VO ,C 正确;D .电池中,电性能的碱性硼化钒(VB 2)—空气电池如下图所示,- 422B(OH)+4H O 该电池工作时,下列说法错误的是时,有0.224 L(标准状况)O 2参与反应 、负极区溶液的pH 升高 3244 1O 20OH 6H O 8B(OH)4VO --- ++=+载、VB 2电极、KOH 溶液回到复合碳电极 左侧VB 2发生失电子的反应生成3-4VO 和B(OH),反 发生得电子的反应生成OH -,反应的电极方程式为11O 2+20OH -+6H 2O=8-4B(OH)+43-4VO ,据此分析。电子,根据正极的电极方程式,通过0.04mol 电子消.反应过程中正极生成大量的OH -使正极区pH 升高 错误;C . 根据分析,电池的总反应为4VB 2+11O 2+20中,电子由VB 2 电极经负载流向复合碳电极,电流流专题31 化学电源之燃料电池 其中在VB 2电极发生反应:的是 - 4),反应的电极方程式如题式为O 2+4e -+2H 2O=4OH -,电析。 A .当负极通过0.04mol 电子消耗0.01mol 氧气,在 升高,负极消耗OH -使负+20OH -+6H 2O=8- 4B(OH)电流流向与电子流向相反,化学电源之燃料电池
2020年03月09日高二化学上学期原电池化学电源练习题学校:___________ 注意事项: 2、请将答案正确填写在答题卡上 第1卷 一、单选题 1.两种元素可以形成AB2型共价化合物的是( ) A.无中子的原子与最外层有6个电子的短周期元素的原子 B.核电荷数分别为12和17的元素 C.ⅣA族和ⅥA族原子半径最小的元素 D.最高正价都为奇数的两种短周期元素 2.已知X、Y为短周期元素,两元素形成化合物XY2,已知其原子序数分别为a和b,则a不可能为( ) A.b-4 B.b-5 C.b+6 D.b+8 3.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: 下列说法正确的是( ) A.CO和O生成 CO是吸热反应 2 B.在该过程中,CO断键形成C和O C.CO和O生成了具有极性共价键的 CO 2 D.状态I→状态III表示CO与 O反应的过程 2 4.大气中CO2含量的增加会加剧“温室效应”。下列活动会导致大气中CO2含量增加的是( ) A.燃烧煤炭供热 B.利用风力发电 C.增加植被面积 D.节约用电用水 5.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中●和○代表不同元素的原子。关于此反应说法错误的是( )
A.一定属于吸热反应 B.一定属于可逆反应 C.一定属于氧化还原反应 D.一定属于分解反应 6.将编号为① ② ③ ④ 的四种金属片两两相连浸入稀硫酸中都可构成原电池,① ② 相连时,外电路电流从② 流向① ;① ③ 相连时,③为正极;② ④ 相连时,②上有气泡逸出;③ ④ 相连时,③的质量减少。 据此判断这四种金属活动性由强到弱的顺序是( ) A.①③②④ B.①③④② C.③④②① D.③①②④ 7.Mg-AgCl 电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( ) A.负极反应式为-2+=Mg e Mg -2 B.正极反应式为+-Ag +e =Ag C.电池放电时-Cl 由正极向负极迁移 D.负极会发生副反应()222Mg+2H O =Mg OH +H ↑ 8.图1是铜锌原电池示意图。图2中,x 轴表示实验时流入正极的电子的物质的量,y 轴表示( ) A.铜棒的质量 B.c (Zn 2+) C.c (H +) D. () 2-4c SO 9.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( ) A.铜电极上发生氧化反应 B.电池工作一段时间后,甲池的24(SO )c - 减小 C.电池工作一段时间后,乙池溶液的总质量增加 D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 10.下面的能源中属于二次能源的是( )
反激式开关电源输出滤波电容器的选择 陈永真 1.反激式开关电源输出整流滤波电路工作状态分析 反激式开关电源输出整流滤波电路原理上是最简单的。但是,由于反激式开关电源的能量传递必须通过变压器转换实现,变压器的初次级两侧的开关(MOSFET 或整流二极管)均工作在电流断续状态。在相同输出功率条件下,反激式开关电源的开关流过的电流峰值和有效值大于正激式、桥式、推挽式开关电源。为了获得更低的输出电压尖峰,通常的反激式开关电源工作在电感电流(变压器储能)断续状态,这就进一步增加了开关元件的电流额定。 开关电源的电路拓扑对输出整流滤波电容器影响也是非常大的,由于反激式开关电源的输出电流断续性,其交流分量需要由输出整流滤波电容器吸收,当电感电流断续时输出整流滤波电容器的需要吸收的纹波电流相对最大。 对应的输出整流二极管的电流波形如图1,输出滤波电容器的电流波形如图2。**2recM on O I t I T = 图1 反激式开关电源的输出整流二极管的电流波形 图2 输出滤波电容器的电流波形 由图1可以得到流过输出整流二极管电流峰值与平均值、有效值的关系为如下。 流过输出整流器的峰值电流与平均值电流的关系: 根据电荷相等,可以得到: **2recM on O I t I T = (1) 可以得到整流二极管电流的峰值: max 2D I I O recM ?= (2) 流过输出整流器的有效值电流与峰值电流的关系: 3*max D I I recM recrms = (3) 流过整流器的有效值电流与平均值电流的关系:
O recrms I D I *32max = (4) 式中:I recM 、I recrms 、I O 、D max 分别为流过输出整流器的峰值电流、有效值电流、平均值电流和输出整流二极管的最大导通占空比。 流过输出滤波电容器的电流有效值略小于流过输出整流器的有效值电流。 式(2)、(3)、(4)表明,随着输出整流器导通占空比的减小,相同输出电流平均值对应的峰值电流、有效值电流随占空比的减小而增加。 在大多数情况下,反激式开关电源工作在变压器电流临界或断续状态。在变压器电流临界状态下,初级侧开关管导通占空比与输出整流器导通占空比相加为1。 在大多数情况下,反激式开关电源的输出整流器的最大导通占空比约为0.5。这样,流过输出整流器的电流峰值与输出平均值电流之间的关系为: O O O recM I I D I I 45.022=?=?= (4) 有效值电流与输出电流平均值的关系为: O recM recM recrms I I I D I *631*35.0*3=== (5) 2.设计实例与分析 某反激式开关电源的技术参数为:电路图拓扑:反激式;输入电压:85V ac~264V ac 工作频率:65kHz ;输出:12V/5A ;纹波电压:50mV ;CLC 滤波。 (1)第一级滤波电容器的选择 对于输出电流5A 对应的峰值电流为20A 、有效值电流为14.14A ,其中大部分流入滤波电容器。按最高温度的纹波电流2倍选用电容器,滤波电容器的纹波电流之和至少要7A 。 25V/1000μF 低ESR 铝电解电容器的额定纹波电流约为1A ,需要7只并联。如果非要5只并联甚至4只并联,也是可以运行的,但是不具有长期可靠性。 25℃温度下,25V/1000μF 低ESR 铝电解电容器的ESR 约为0.09Ω。7只并联对应的ESR 为129mΩ、5只并联为180mΩ、4只并联为225mΩ。由电流变化在ESR 上产生的峰值电压分别为2.59V 、3.60V 、4.50V 。除此之外,滤波电容器的ESL 还会在整流二极管开通时由于电流的跃变而产生感生电势,这个感生电势同样会加到滤波电容器上,因此,滤波电容器上的峰值电压将不只是上述的2.59V 、3.60V 、4.50V 。其电压波形如图3。 图3 第一级滤波电容器的电压波形 很显然,2.59V 、3.60V 、4.50V 是不能满足设计要求的,需要在第一级滤波电容器后面加上一级LC 低通滤波器。 (2)第二极LC 低通滤波器的设计与参数选择
燃料电池、高能电池、海洋电池和锂电池的相关知识 流水斯夫整理 一、化学电源和燃料电池的概念 1.化学电源:又称化学电池,是一种能将化学能直接转变成电能的装置。这种装置通过化学反应,消耗某种物质,输出电能。 2.燃料电池:燃料电池是直接将燃烧反应的化学能转化为电能的装置。因为原料都是燃料和氧气,燃料和氧气发生化学反应的产物与相应的燃料燃烧的产物相同,即化学方程式相同,所以称为燃料电池。 3.高能电池:具有高“比能量”和高“比功率”的电池称为高能电池。所谓“比能量”和“比功率”是指电池的单位质量或单位体积计算电池所能提供的电能和功率。因为电池的体积小,产品形状象纽扣,也称为“纽扣”电池。 4.海洋电池:以铝-空气-海水为能源的新型电池,称之为海洋电池。1991年,由我国首创。 5.锂电池:锂电池(Lithium battery)是指电化学体系中含有锂(包括金属锂、锂合金和锂离子、锂聚合物等)的电池。 二、化学电源的分类和燃料电池的分类 1.化学电源的种类: (1)按照其使用性质可分为四类:干电池、蓄电池、燃料电池、锂电池。 (2)按电池中电解质性质分为:碱性电池、酸性电池、中性电池。 2.燃料电池的分类: (1)按电解质种类,燃料电池(Fuel Cell, FC)分为碱性燃料电池(AFC)、磷酸型燃料电池(PAFC)、熔融碳酸盐燃料电池(MCFC)、固体氧化物燃料电池(SOFC)及质子交换膜燃料电池(PEMFC)等。其中属于碱性燃料电池的只有AFC一种,而其余的燃料电池属于酸性燃料电池或中性燃料电池。 (2)按燃料类型,燃料电池(Fuel Cell, FC)分为氢气、甲醇、甲烷、乙烷、甲苯、丁烯、丁烷等。 (3)按工作温度,燃料电池(Fuel Cell, FC)分为低温型(温度低于200℃)、中温型(温度为200~750℃)、高温型(温度高于750℃)。 (4)按结构类型,燃料电池(Fuel Cell, FC)分为管状燃料电池、平板型燃料电池和单片型。