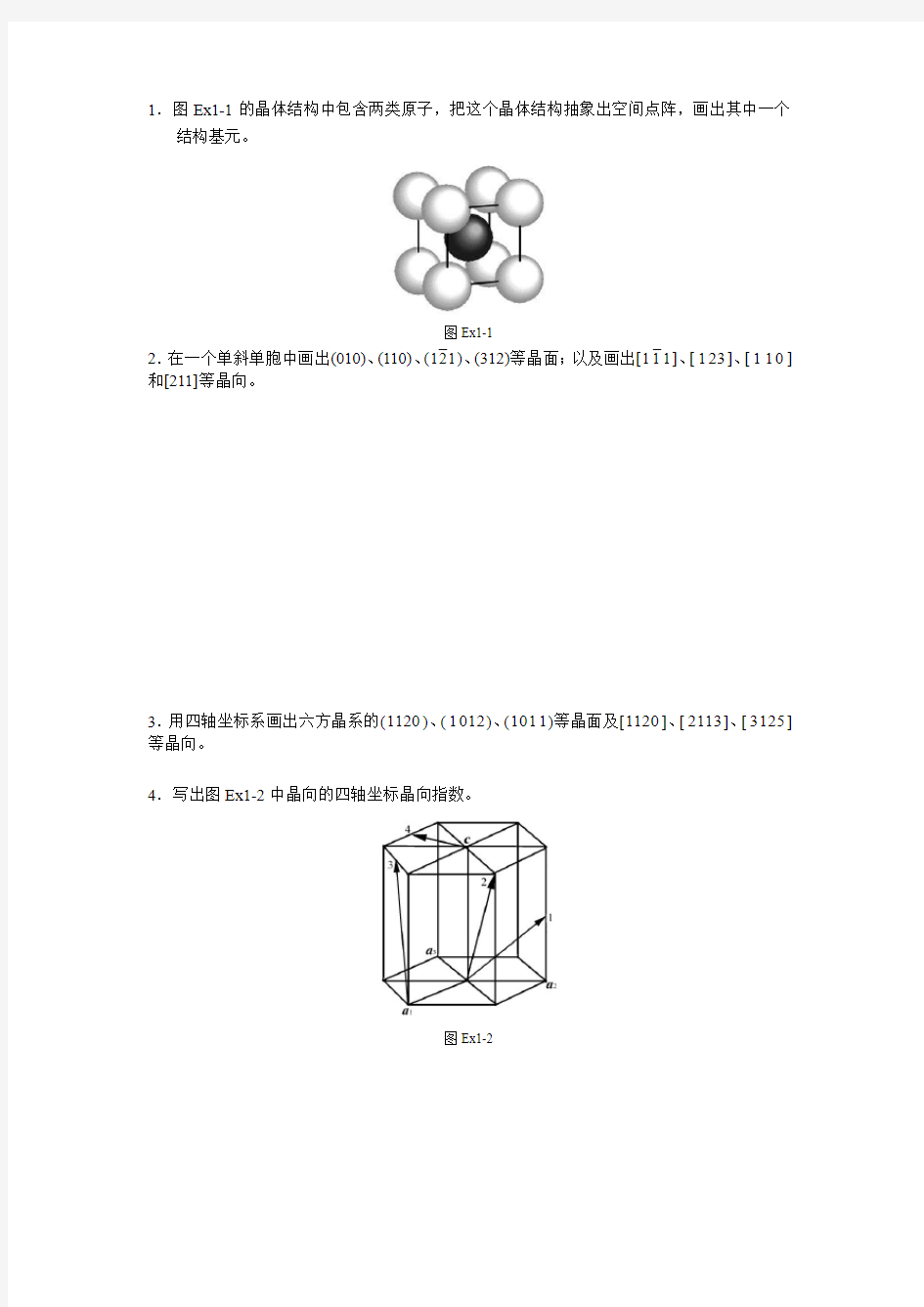

1.图Ex1-1的晶体结构中包含两类原子,把这个晶体结构抽象出空间点阵,画出其中一个
结构基元。
图Ex1-1
2.在一个单斜单胞中画出(010)、(110)、(121)、(312)等晶面;以及画出[111]、[231]、[011]和[211]等晶向。
3.用四轴坐标系画出六方晶系的(0211)、(0121)、(1110)等晶面及[0211]、[1132]、[1253]等晶向。
4.写出图Ex1-2中晶向的四轴坐标晶向指数。
图Ex1-2
5.晶面:(234)、(120)、(111)、(241)、(122)、(143)、(101)、(010)和(234)中有哪些面属于同一个晶带?求出该晶带轴。
6.计算面心立方、体心立方结构的(100)、(110)、(111)、(112)晶面的面密度,计算密排六方结构的(0001)、(1010)晶面的面密度。
7.氢原子溶解在铝中形成什么类型固溶体?它应存在于点阵的什么位置?为什么?
8.铜的密度为8.96g/cm 3。①计算铜的点阵常数和原子半径。②测得x(Au)=40%的Cu--Au 固溶体点阵常数a=0.3795nm ,密度为14.213g/cm 3,计算说明这合金是什么类型的固溶体。
9.纯铁在912°C 由BCC 结构转变为FCC 结构,体积减少1.06%,根据FCC 结构的原子半径计算BCC 结构的原子半径。它们的相对变化为多少?如果假定转变前后原子半径不变,计算转变后的体积变化。这些结果说明了什么?
金属和金属材料 课题1 金属材料 一、几种常见的金属 知识点1:金属材料 1.下列物质属于金属材料的是 A.铁B.氧化铁C.氢氧化铁D.生铁 2.金属材料在人类活动中已得到越来越广泛的应用,下列性质属于金属共性的是()A.硬度很大、熔点很高B.有良好的导电性、传热性 C.是银白色的固体D.易与酸反应产生氢气 知识点2:金属的物理性质和用途 1.回答下列有关金属性质的问题: (1)油罐车的尾部经常有一条铁链拖到地面上,这是利用铁的__________性; (2)铁和铝都可以用来制作炊具,这是利用它们的__________性; (3)用金属钨做白炽灯的灯丝,这是利用了钨的__________; (4)铝能制成很薄的铝箔,这是利用铝的__________性; (5)金属纽扣表面涂的“银粉”实际上是__________粉; (6)体温计中液态的“银”是__________; (7)热水瓶胆壁的金属是__________; (8)为何铁制锅铲需要加上木柄或塑料柄__________; (9)联合国卫生组织为什么推荐使用中国的铁锅__________; (10)选择铸造硬币的金属材料要考虑哪些因素____________________。 2.下列说法正确的是() A.铝是人类最早利用的金属材料 B.铜是目前世界年产量最高的金属 C.大多数金属元素在自然界中以单质形式存在 D.日常使用的金属材料大多数是合金 二、合金 知识点:合金 1.下列有关合金的叙述,正确的是()
①合金中至少含两种金属;②合金中的元素以化合物形式存在; ③合金中一定含有金属;④合金一定是混合物;⑤生铁是含杂质较多的铁合金; ⑥合金的强度和硬度一般比组成它们的纯金属更高,抗腐蚀性能等也更好. A.①②③④⑤⑥B.①②C.①③④D.③④⑤⑥ 2.所谓合金,就是不同种金属(或金属与非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点判断,其中不能形成合金的是() Na Cu Al Fe 熔点(℃)97.5 1083 660 1535 沸点(℃)883 2595 2200 3000 A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na 3.世界卫生组织把铝确定为食品污染源之一。在下列应用中,不提倡使用铝的是()①制铝合金门窗②用铝箔包装食品③制炊具④制银色涂料⑤制相框⑥制电线.A.③⑥B.①⑥C.②③D.③④⑥ 4.一种金属由于其密度小、延展性好、耐腐蚀性强,它和它的合金在航空、航海和化学工业中正逐步取代铝和铝合金而被广泛使用,该金属是() A.镁B.锌C.钛D.铜 5.通过下列实验可以得出的结论,其中不合理的是() A.甲实验中黄铜片能在铜片上刻画出痕迹,说明黄铜的硬度比铜片大 B.乙实验既可以说明分子在不停地运动着,又可以说明氨水显碱性 C.丙实验既可以将粗盐提纯,又可以说明氯化钠的溶解度随温度的升高而增大 D.丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性
第二章金属与合金的晶体结构 第一节纯金属的晶体结构 一、晶体结构的基本知识 1、晶体与非晶体 晶体——原子规则排列的集合体 非晶体——原子无规则堆积的集合体 晶体特征:固定的熔点,各向异性 2、晶格与晶胞 晶格:把晶体中原子看成几何点,用假象的直线连接后得到的三维格架晶胞:晶格中能全面反映原子排列规律的最小几何单元 3、晶面与晶向晶格常数:晶胞的棱边长度 晶面:晶格中各方位的原子面 晶向:任意两个原子连线所指的方向 第二节纯金属的实际晶体结构 α-Fe [100] E=135000N/mm2 [111] E=290000 N/mm2 实际测定 E=210000 N/mm2 一、多晶体结构 单晶体:各部分位向完全一致的晶体(各向异性)多晶体:许多位向不同的单晶体的聚合体(各向同性)晶粒:多晶体中外形不规则的小晶体晶界:晶粒之间的界面 二、晶体缺陷 1、点缺陷——空位和间隙原子 点缺陷→导致晶格畸变→强度↑,硬度↑ 空位和间隙原子都处于运动和变化之中,是原子扩散主 要方式之一。温度↑,空位↑ 2、线缺陷——位错 位错——整排原子有规律错排位错密度ρ=L / V (cm-2)
增加或减小,可以提高强度 3、面缺陷——晶界、亚晶界晶界处:晶格畸变→强度高 原子能量高→熔点低,易腐蚀,原子扩散快 晶粒细→晶界面积大→强度高 亚晶界:晶粒内小位向差(1-2°)的晶块(亚晶粒亚结构)边界 第三节合金的晶体结构合金的基本概念 合金:由两种或两种以上金属,或金属与非金属组成,具有金属性质的物质。 组元:组成合金的基本物质。 相:结构相同,成分相近,与其它部分有界面分开的部分 单相合金:固态下由一个固相组成的合金 多相合金:固态下由两个以上固相组成的合金 组织:相的聚合体。 ( 单相组织,多相组织,) 二、合金的相结构 合金相结构——固溶体和金属化合物。 1、固溶体 固溶体:一种元素的原子溶入另一种元素中形成的合金相。溶剂——保持原晶体结构的元素溶质——失去原晶体结构的元素 有限固溶体:溶解度有一定限度——有限互溶 无限固溶体:溶解度无一定限度——无限互溶(晶体结构相同原子直径相近)固溶体分类: 置换固溶体:溶质原子占据溶剂晶格的某些结点 间隙固溶体:溶质原子处于溶剂晶格的间隙中 固溶强化——溶质溶入固溶体,导致晶格畸变,引起强度和硬度升高 (仍保持良好的塑性和韧性) 2、金属化合物 特征: ?有金属性质 ?晶体结构不同于任何组元 ?成分可用分子式表示Fe3C 性能:硬,脆,熔点高 弥散强化(第二相强化): 当金属化合物以细小颗粒均布于固溶体上, 可使合金的强度↑↑,硬度↑↑,耐磨性↑↑ 调整合金性能的途径: ?改善固溶体溶解度 ?改变化合物形状、数量、大小、分布
第三章 二元合金的相结构与结晶 (一)填空题 1 合金的定义是两种或两种以上的金属(或金属与非金属)熔合而成具有金属特性的物质。 2.合金中的组元是指 组成合金最基本的、独立的物质 。 3.固溶体的定义是 在固态条件下,一种组元“组分”溶解了其它组元而形成的单相晶态固体 4.Cr 、V 在γ-Fe 中将形成 置换 固溶体。C 、N 则形成 间隙 固溶体。 5.和间隙原子相比,置换原子的固溶强化效果要 差 些。 6.当固溶体合金结晶后出现枝晶偏析时,先结晶出的树枝主轴含有较多的高熔点组元。 7.共晶反应的特征是 由一定成分的恶液相同时结晶出成分一定的两个固相 ,其反应式为 L →a+β 8.匀晶反应的特征是 ,其反应式为 9.共析反应的特征是 ,其反应式为 10.合金固溶体按溶质原子溶入方式可以分为置换固溶体和间隙固溶体,按原子溶入量可以分为 有限固溶体 和 无限固溶体 11.合金的相结构有 固溶体 和 金属化合物 两种,前者具有较高的 塑性变形 性能,适合于做 基体 相;后者有较高的 高硬度 性能,适合于做 增强 相 12.看图4—1,请写出反应式和相区: ABC 包晶反应 B A C L γα?+ ;DEF 共晶反应 F D C L βγ+? ;GHI 共析反应 I G H βαγ+? ; ① L +α ;② γα+ ;③βα+ ;④ βγ+ ;⑤ L +γ ;⑥ β+L ; 13.相的定义是 ,组织的定义是 14.间隙固溶体的晶体结构与溶剂的晶格类型 相同,而间隙相的晶体结构与 溶剂组元晶体结构 不同。 15.根据图4—2填出: 水平线反应式 E C D βαγ+? ;有限固溶体 βα、 、 无限固溶体 γ 。 液相线 ,固相线 , 固溶线 CF 、 EG
第二章作业 2-1 常见的金属晶体结构有哪几种它们的原子排列和晶格常数有什么特点 V、Mg、Zn 各属何种结构答:常见晶体结构有 3 种:⑴体心立方:-Fe、Cr、V ⑵面心立方:-Fe、Al、Cu、Ni ⑶密排六方:Mg、Zn -Fe、-Fe、Al、Cu、Ni、Cr、 2---7 为何单晶体具有各向异性,而多晶体在一般情况下不显示出各向异性答:因为单晶体内各个方向上原子排列密度不同,造成原子间结合力不同,因而表现出各向异性;而多晶体是由很多个单晶体所组成,它在各个方向上的力相互抵消平衡,因而表现各向同性。第三章作业3-2 如果其它条件相同,试比较在下列铸造条件下,所得铸件晶粒的大小;⑴金属模浇注与砂模浇注;⑵高温浇注与低温浇注;⑶铸成薄壁件与铸成厚壁件;⑷浇注时采用振动与不采用振动;⑸厚大铸件的表面部分与中心部分。答:晶粒大小:⑴金属模浇注的晶粒小⑵低温浇注的晶粒小⑶铸成薄壁件的晶粒小⑷采用振动的晶粒小⑸厚大铸件表面部分的晶粒小第四章作业 4-4 在常温下为什么细晶粒金属强度高,且塑性、韧性也好试用多晶体塑性变形的特点予以解释。答:晶粒细小而均匀,不仅常温下强度较高,而且塑性和韧性也较好,即强韧性好。原因是:(1)强度高:Hall-Petch 公式。晶界越多,越难滑移。(2)塑性好:晶粒越多,变形均匀而分散,减少应力集中。(3)韧性好:晶粒越细,晶界越曲折,裂纹越不易传播。 4-6 生产中加工长的精密细杠(或轴)时,常在半精加工后,将将丝杠吊挂起来并用木锤沿全长轻击几遍在吊挂 7~15 天,然后再精加工。试解释这样做的目的及其原因答:这叫时效处理一般是在工件热处理之后进行原因用木锤轻击是为了尽快消除工件内部应力减少成品形变应力吊起来,是细长工件的一种存放形式吊个7 天,让工件释放应力的时间,轴越粗放的时间越长。 4-8 钨在1000℃变形加工,锡在室温下变形加工,请说明它们是热加工还是冷加工(钨熔点是3410℃,锡熔点是232℃)答:W、Sn 的最低再结晶温度分别为: TR(W) =(~×(3410+273)-273 =(1200~1568)(℃)>1000℃ TR(Sn) =(~×(232+273)-273 =(-71~-20)(℃) <25℃ 所以 W 在1000℃时为冷加工,Sn 在室温下为热加工 4-9 用下列三种方法制造齿轮,哪一种比较理想为什么(1)用厚钢板切出圆饼,再加工成齿轮;(2)由粗钢棒切下圆饼,再加工成齿轮;(3)由圆棒锻成圆饼,再加工成齿轮。答:齿轮的材料、加工与加工工艺有一定的原则,同时也要根据实际情况具体而定,总的原则是满足使用要求;加工便当;性价比最佳。对齿轮而言,要看是干什么用的齿轮,对于精度要求不高的,使用频率不高,强度也没什么要求的,方法 1、2 都可以,用方法 3 反倒是画蛇添足了。对于精密传动齿轮和高速运转齿轮及对强度和可靠性要求高的齿轮,方法 3 就是合理的。经过锻造的齿坯,金属内部晶粒更加细化,内应力均匀,材料的杂质更少,相对材料的强度也有所提高,经过锻造的毛坯加工的齿轮精度稳定,强度更好。 4-10 用一冷拔钢丝绳吊装一大型工件入炉,并随工件一起加热到1000℃,保温后再次吊装工件时钢丝绳发生断裂,试分析原因答:由于冷拔钢丝在生产过程中受到挤压作用产生了加工硬化使钢丝本身具有一定的强度和硬度,那么再吊重物时才有足够的强度,当将钢丝绳和工件放置在1000℃炉内进行加热和保温后,等于对钢丝绳进行了回复和再结晶处理,所以使钢丝绳的性能大大下降,所以再吊重物时发生断裂。 4-11 在室温下对铅板进行弯折,越弯越硬,而稍隔一段时间再行弯折,铅板又像最初一样柔软这是什么原因答:铅板在室温下的加工属于热加工,加工硬化的同时伴随回复和再结晶过程。越弯越硬是由于位错大量增加而引起的加工硬化造成,而过一段时间又会变软是因为室温对于铅已经是再结晶温度以上,所以伴随着回复和再结晶过程,等轴的没有变形晶粒取代了变形晶粒,硬度和塑性又恢复到了未变形之前。第五章作业 5-3 一次渗碳体、二次渗碳体、三次渗碳体、共晶渗碳体、共析渗碳体异同答:一次渗碳体:由液相中直接析出来的渗碳体称为一次渗碳体。二次渗碳体:从 A 中析出的渗碳体称为二次渗碳体。三次渗碳体:从 F 中析出的渗碳体称为三次渗碳体共晶渗碳体:经共晶反应生成的渗碳体即莱氏体中的渗碳体称为共晶渗碳体共析渗碳体:经共析反应生成的渗碳体即珠光体中的渗
【第八单元金属和金属材料同步练习】 一、选择题 1.下列物质中属于纯净物的是() A.草木灰 B.生铁 C.氧化铁 D.石灰水 2.地壳中含量最多的金属元素() A.铁 B.氧 C.硅 D.铝 3.下列物质中不能由金属与盐酸直接反应制得的是() A.氯化镁B.氯化锌 C.氯化铁D.氯化铝 4.盐酸与生铁反应,当生铁反应完毕后,烧杯里留有少量黑色物质,其主要物质为( )A.氧化铁 B.四氧化三铁C.碳D.铁粉 5.不锈钢中除了铁之外,其余的两种主要的金属元素是() A.镍、铬 B.锰、铬 C.铬、钨 D.锰、钨 6.铁在一定条件下容易生锈,下列有关铁生锈的叙述错误的是() A.铁生锈一定伴随着物理变化 B.铁生锈时,铁发生了缓慢氧化 C.铁生锈的本质就是铁与氧气反应生成氧化铁D.铁生锈时,会有难以察觉的热量放出7.将铁片插入下列溶液中,片刻后取出,溶液质量减少的是() A.盐酸 B.硫酸铜 C.稀硫酸D.硫酸亚铁 8.某不纯的铁块5.6g,与足量的盐酸反应,全部溶解,放出氢气为0.21g,则铁块中可能含有的杂质是() A.铜 B.锌 C.碳
D.镁 9.还原铁的某氧化物2.16g,可以得到1.68g。则该种铁的氧化物的化学式为() A.FeO B.Fe2O3 C.Fe3O4 D.FeCO3 10.将燃着的镁伸入盛有二氧化碳的集气瓶中,镁带剧烈燃烧,发生的反应方程式为2Mg+CO2错误!2MgO+C,下列叙述错误的是() A.该反应中镁发生了氧化反应 B.该反应中二氧化碳是还原剂 C.该反应属于置换反应D.镁着火时不能用二氧化碳灭火剂扑灭 二、填空题 11.日常生活中,用于铁栏杆外层涂料的“银粉”大多是金属______________;包装糖果、香烟的银白色金属薄片__________;家用热水瓶内胆壁的银色金属是_________;温度计中填充的金属是______________;灯泡里做灯丝的金属是____________;青铜是一种合金,除含有铜外还含有的一种金属是_______________;铝表面有一层致密而结实的薄膜,其主要成分是________________;孔雀石的主要成分为________________;黄铁矿的主要成分为_____________;赤铜矿的主要成分为_______________。(填对应的化学式) 12.怎样用化学方法除去下列物质中的少量杂质(括号内为杂质),用化学方程式表示。(1)Cu(Fe)____________________________________________________________; (2)FeSO4(CuSO4)_____________________________________________________; (3)CaCl2(CaCO3)______________________________________________________; (4)H2(CO2)_________________________________________________
第三章 二元合金的相结构与结晶 (一)填空题 1 合金的定义是两种或两种以上的金属(或金属与非金属)熔合而成具有金属特性的物质。 2.合金中的组元是指 组成合金最基本的、独立的物质 。 3.固溶体的定义是 在固态条件下,一种组元“组分”溶解了其它组元而形成的单相晶态固体 4.Cr 、V 在γ-Fe 中将形成 置换 固溶体。C 、N 则形成 间隙 固溶体。 5.和间隙原子相比,置换原子的固溶强化效果要 差 些。 6.当固溶体合金结晶后出现枝晶偏析时,先结晶出的树枝主轴含有较多的高熔点组元。 7.共晶反应的特征是 由一定成分的恶液相同时结晶出成分一定的两个固相 ,其反应式为 L →a+β 8.匀晶反应的特征是 ,其反应式为 9.共析反应的特征是 ,其反应式为 10.合金固溶体按溶质原子溶入方式可以分为置换固溶体和间隙固溶体,按原子溶入量可以分为 有限固溶体 和 无限固溶体 11.合金的相结构有 固溶体 和 金属化合物 两种,前者具有较高的 塑性变形 性能,适合于做 基体 相;后者有较高的 高硬度 性能,适合于做 增强 相 12.看图4—1,请写出反应式和相区: ABC 包晶反应 B A C L γα?+ ;DEF 共晶反应 F D C L βγ+? ;GHI 共析反应 I G H βαγ+? ; ① L +α ;② γα+ ;③βα+ ;④ βγ+ ;⑤ L +γ ;⑥ β+L ; 13.相的定义是 ,组织的定义是 14.间隙固溶体的晶体结构与溶剂的晶格类型 相同,而间隙相的晶体结构与 溶剂组元晶体结构 不同。 15.根据图4—2填出: 水平线反应式 E C D βαγ+? ;有限固溶体 βα、 、 无限固溶体 γ 。 液相线 ,固相线 , 固溶线 CF 、 EG
金属和金属材料测试题及答案(word) 一、金属和金属材料选择题 1.垃圾分类从我做起。金属饮料罐属于() A.可回收物 B.有害垃圾C.厨余垃圾D.其他垃圾 【答案】A 【解析】 【详解】 A、可回收物是指各种废弃金属、金属制品、塑料等可回收的垃圾,金属饮料罐属于可回收垃圾,故选项正确。 B、有害垃圾是指造成环境污染或危害人体健康的物质,金属饮料罐属于可回收垃圾,故选项错误。 C、厨余垃圾用于回收各种厨房垃圾,金属饮料罐属于可回收垃圾,故选项错误。 D、其它垃圾是指可回收垃圾、厨余垃圾、有害垃圾之外的其它垃圾,金属饮料罐属于可回收垃圾,故选项错误。 故选:A。 【点睛】 本题难度不大,了解垃圾物质的分类、各个标志所代表的含义是正确解答本题的关键。 2.有X、Y、Z三种金属,X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应;如果把Y与Z分别放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化,根据以上事实,判断X、Y、Z三种金属的活动性由弱到强的顺序正确的是 A.X Y Z B.X Z Y C.Z Y X D.Y Z X 【答案】B 【解析】 有X、Y、Z三种金属,X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应,说明X的金属活动性最强。把Y和Z分别放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化,说明Z的金属活动性比银强,Y的金属活动性比银弱,即Z>Ag>Y;则X、Y、Z三种金属的活动性由强至弱的顺序为X>Z>Y。故选B。 点睛:在金属活动性顺序中,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定三种金属活动性由强到弱的顺序。 3.下列图像分别与选项中的操作相对应,其中合理的是()
初中化学金属和金属材料单元测试题及答案
————————————————————————————————作者:————————————————————————————————日期:
人教版初中化学 第八单元金属和金属材料单元测试题(一) 可能用到的相对原子质量:H:1 O:16 C: 12 S:32 Cu: 64 Fe: 56 Ca: 40 Mg:24 Zn:65 Al:27 第Ⅰ卷(选择题共45分) 一.选择题:(每小题3分,15小题,共45分) 1. 下列说法不正确的是:( ) A.回收一个铝饮料罐比制造一个新饮料罐要贵 B.回收铝饮料罐可以节约金属资源 C.回收铝饮料罐可以节约能源 D.回收铝饮料罐可以减少对环境的污染 2. 下列物质中,铁元素化合价最低的是 ( ) A.Fe B.Fe 2O 3 C.FeO D.FeS 3. 铁钉放入稀盐酸中,一段时间后可能观察到 ( ) A.溶液由蓝色变成浅绿色 B.铁钉表面有气泡逸出 C.溶液由无色变成蓝色 D.溶液的质量增大 4. 下列物品或装饰品,不易受酸雨腐蚀的是:( ) A. 大理石华表 B. 铝合金窗框 C. 铁栏杆 D. 塑料制品 5. 芜湖铁画是中国工艺美术百花园中的一朵奇葩,至今已有三百多年的历史。 下列关于铁画生锈与防护的描述中不正确的是:( ) A.悬挂在干燥的环境中 B. 经常清扫表面的灰尘可以防 止生锈 C. 表面涂漆防止生锈 D. 生锈时主要生成四氧化三 铁 6. 如图所示是X 、Y、Z三种金属在容器中的反应现象,下列说法正确的是 ( ) A.X 、Y、Z三种金属均发生了置换反应 B.三种金属的活动性顺序是X>Y>Z C.若Z能从金属Y的盐溶液里置换出Y, 则三种金属的活动性顺序是X>Z>Y D.若X为金属镁,则Z可能是铁 7. (2008年南通市)若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列 反应不正确的是 A.Mn + H 2SO 4 = MnSO 4 + H 2 ↑ B.Mg + MnSO 4 = MgSO 4 + Mn C.Fe + MnSO 4 = FeSO 4 + Mn D.Mn + CuSO 4 = MnSO 4 + Cu 8. 国家建设部、化工部等有关部门规定,新建小区户外给水管必须使用塑料管,新建建筑不得再使用传统铸铁排水管。国家推广使用塑料建材的主要目的是( ) A.保护金属资源 B.金属易腐蚀,而塑料使用时间长C.塑料密度小,减少房屋的自身重量 D.降低成本
金属和金属材料 1.下列有关合金的说法错误的是( ) A.生铁是一种铁的单质 B .黄铜的硬度比纯铜的硬度大 C.钢是一种混合物 D .焊锡的熔点比纯锡的熔点低 2.下列物质不属于合金的是( ) A.生铁 B .钢 C .黄铜 D .C60 3. 下列环境中,铁钉表面最容易产生铁锈的是( ) A.在稀盐酸中 B .在潮湿的空气中 C .在干燥的空气中 D .浸没在植物油中4. 下列属于置换反应的是( ) A.HCl+NaOH===NaCl+H2O B.2KMnO 4==△=== K2MnO4+MnO2+O2↑ C.H2+CuO==△=== Cu+H2O D.2Mg +O2=点==燃== 2MgO 5. 下列四个实验中只需要完成三个就可以证明Zn、Cu、Ag 三种金属的活动性顺序,其中不必进行的实验是( ) A.将锌片放入稀硫酸 B .将铜片放入稀硫酸C.将铜片放入硝酸银溶液 D .将锌片放入硝酸银溶液 6. 以下实验能比较出铜和银的金属活动性强弱的是( ) A.测定两金属的密度 B .铜片放入硝酸银溶液中 C.将两种金属相互刻画 D .铜片、银片分别放入稀硫酸中 7. 将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是( ) A.滤出的固体中一定含有银和铜,一定不含
镁B.滤出的固体中一定含有银,可能含有 铜和镁 C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜 D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜 8. 把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的甲、乙两种金属,反应后金属都没有剩余,产生H2 的质量随时间变化的趋势如图所示。下列说法正确的是( ) A.反应消耗等质量的金属 B .甲的反应速度比乙快 C.反应消耗等质量的硫酸 D .甲的活动性比乙强 9. 金属M与AgNO3溶液反应的化学方程式为M + 2AgNO3 M(NO3) 2+2Ag。下列说法不正确的是( ) A.该反应属于置换反应 B. 金属M可能是铝 C.M的金属活动性比Ag 强 D. 反应前后M的化合价改变 10. 将一根洁净的铁钉放入稀硫酸中, 下列预测可能不正确的是( ) A.铁钉表面将产生气泡 B. 铁钉表面将很快出现铁锈 C.溶液由无色变为浅绿色 D. 溶液质量将增加 11. 利用铝合金代替铝制钥匙,主要利用铝合金的大.
金属和金属材料练习题经典 一、金属和金属材料选择题 1.下列关于金属资源的说法中,你不赞成的是() A.地球上除少数不活泼金属如金、银等有单质形式存在外其他都以化合物形式存在B.地球上的金属资源是取之不尽的 C.防止金属锈蚀、回收利用废旧金属可以保护金属资源和环境 D.合理开采矿物、寻找金属代用品都是保护金属资源的有效途径 【答案】B 【解析】 试题分析:根据已有的知识进行分析,不活泼金属以单质存在,活泼金属以化合物存在,金属资源并不是取之不及用之不竭的,回收利用废旧金属有利于保护金属资源。 A、在金属活动顺序表中,金、银等金属的活动性极弱,在常温或高温时不与氧气反应,它们以单质形式存在于地壳中,故A正确; B、矿物的贮存有限,而且不能再生,所以不是取之不尽用之不竭的,故B错误; C、每年因腐蚀而报废的金属材料相当于年产量的20%-40%,所以防止金属腐蚀可以保护金属。废旧电池中含有汞等重金属,如果将废旧电池任意丢弃,汞等重金属渗出会造成地下水和土壤的污染,威胁人类健康,如果将汞等重金属回收利用,不仅可以节约金属资源,还可以减少对环境的污染,故C正确; D、随着科学技术的发展,新材料层出不穷,如用塑料代替钢等,可以减少对金属的使用,故D正确。故选B 考点:本题考查金属活动性顺序及其应用,金属资源的保护,金属的回收利用及其重要性点评:保护金属资源的有效途径是依据金属活动顺序表,依据金属的活泼性不同,采取合适的保护措施。 2.下列图象能正确反映对应变化关系的是() Mg、Zn、Fe与稀盐酸反应等质量等质量分数的 盐酸与足量的镁粉、 锌粉 将铜片加入一定量 的硝酸银溶液中 向一定质量的氯化锌 和盐酸溶液中加入锌 粒 A.A B.B C.C D.D
金属和金属材料单元练习题(含答案)(word) 一、金属和金属材料选择题 1.某同学为了探究甲、乙、丙三种金属的活动性强弱,做了如下实验。则三种金属的活动性顺序是( ) A.甲>乙>丙B.乙>甲>丙C.丙>甲>乙D.丙>乙>甲 【答案】B 【解析】 【分析】 【详解】 位于氢前面的金属能置换出酸中的氢,把甲、乙、丙三种金属分别加入稀硫酸中,甲、乙表面有气泡产生,丙无明显变化,说明甲、乙的金属活动性比氢强,丙的金属活动性比氢弱,即甲、乙>H>丙。位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,再把甲放入到乙的硫酸盐溶液中,无明显现象,说明甲的金属活动性比乙弱,即乙>甲。故三种金属的活动性顺序是乙>甲>丙,故选B。 2.以下实验能比较出铜和银的金属活动性强弱的是() A.测定两金属的密度 B.铜片放入硝酸银溶液中 C.将两种金属相互刻画 D.铜片、银片分别放入稀硫酸中 【答案】B 【解析】 试题分析:比较金属活动性强弱要通过化学变化且出明显现象才能表现出来,A.测定两金属的密度,不能比较出铜和银的金属活动性强弱;B.铜片放入硝酸银溶液中能比较出铜和银的金属活动性强弱,因为金属铜能置换出金属银;C.将两种金属相互刻画不能比较出铜和银的金属活动性强弱;D.铜片、银片分别放入稀硫酸中,二者多无明显现象,不能比较出铜和银的金属活动性强弱;故答案选择B 考点:金属活动性顺序 3.下列图像分别与选项中的操作相对应,其中合理的是()
A.向一定量的稀硫酸中加入锌粒 B.向氢氧化钠溶液中滴加稀盐酸 C.向一定量的CuSO4溶液中加NaOH溶液 D.加热一定质量的KClO3和MnO2混合物制O2 【答案】C 【解析】 【分析】 【详解】 A、向一定量的稀硫酸中加入锌粒,氢气的质量应不断增大至一定值,反应速率不断变缓,选项A不正确; B、向氢氧化钠溶液中滴加稀盐酸,pH值应由大逐渐变小,选项B不正确; C、向一定量的CuSO4溶液中加NaOH溶液,沉淀质量不断增大至一定值,选项C正确; D、加热一定质量的KClO3和MnO2混合物制O2,反应完成后容器中有催化剂MnO2剩余,选项D不正确; 故选C。 4.如图所示的四个图象,能正确反映对应变化关系的是()
金属和金属材料专题练习(word)1 一、金属和金属材料选择题 1.垃圾分类从我做起。金属饮料罐属于() A.可回收物 B.有害垃圾C.厨余垃圾D.其他垃圾 【答案】A 【解析】 【详解】 A、可回收物是指各种废弃金属、金属制品、塑料等可回收的垃圾,金属饮料罐属于可回收垃圾,故选项正确。 B、有害垃圾是指造成环境污染或危害人体健康的物质,金属饮料罐属于可回收垃圾,故选项错误。 C、厨余垃圾用于回收各种厨房垃圾,金属饮料罐属于可回收垃圾,故选项错误。 D、其它垃圾是指可回收垃圾、厨余垃圾、有害垃圾之外的其它垃圾,金属饮料罐属于可回收垃圾,故选项错误。 故选:A。 【点睛】 本题难度不大,了解垃圾物质的分类、各个标志所代表的含义是正确解答本题的关键。 2.为防止家中菜刀生锈,小风设计了如下方案: ①每天用汽油擦拭一遍②用完后保存在盐水中③擦干后用植物油涂抹④用干布把它擦干,悬挂⑤用食醋涂抹⑥用酱油涂抹。请选出你认为合理的方案() A.①②③④⑥⑦ B.②③④ C.③④ D.⑤⑥⑦ 【答案】C 【解析】 【详解】 ①菜刀擦汽油,会导致菜刀无法使用,故①错误; ②用完后保存在盐水中,盐水能加快铁的锈蚀,故②错误; ③擦干后用植物油涂抹,擦植物油不影响继续使用,故③正确; ④用干布把它擦干,这样在干燥的情况也不会生锈,故④正确; ⑤用食醋涂抹,会导致生锈加快,故⑤错误; ⑥用酱油涂抹,盐的存在会加速生锈,故⑥错误。防止家中菜刀生锈合理的方案是③④。故选C。 【点睛】 铁生锈的条件是铁与氧气和水同时接触,酸性溶液、盐溶液能促进铁生锈。解答本题要掌
握铁生锈的条件,只有这样才能找出防止铁生锈的方法。 3.2018年10月27我国大飞机C919首次飞回故乡南昌。C919机壳采用了先进的铝锂合金材料,下列有关铝锂合金的说法错误的是 A.铝锂合金是一种化合物B.铝锂合金的硬度比纯锂的硬度大 C.铝锂合金的密度较小D.铝锂合金属于金属材料 【答案】A 【解析】 【详解】 A、铝锂合金是合金,合金都是混合物,符合题意; B、合金的硬度一般比组成它的纯金属更高,故铝锂合金的硬度比纯锂的硬度大,不符合题意; C、合金的硬度大,密度小,铝锂合金的密度较小,不符合题意; D、铝锂合金属于金属材料,不符合题意。故选A。 【点睛】 合金的性质主要是:合金的强度和硬度一般比组成它的纯金属更高,抗腐蚀性能等也比组成它的纯金属更好;但是,大多数合金的熔点比它的纯金属的熔点低,导电、导热性能比它的纯金属差;总之,合金的性能主要决定于合金的成分。 4.下列反应中属于置换反应的是() A.CO+CuO Cu+CO2 B.CaO + H2O=Ca(OH) 2 C.Zn+CuSO4=ZnSO4+Cu D.SO2+2NaOH=Na2SO3+H2O 【答案】C 【解析】 【分析】 【详解】 一种单质和一种化合物反应生成另一种单质和另一种化合物的反应属于置换反应, C项属于置换反应。故选C。 5.有三种金属X、Y、Z,它们与酸或盐溶液可以发生如下反应:①Y+X(NO3)2═Y (NO3)2+X;②X+H2SO4═XSO4+H2↑;③Z不与盐酸反应.则该三种金属的活动性顺序为() A.X>Y>Z B.Y>X>Z C.Z>X>Y D.Z>Y>X 【答案】B 【解析】 【详解】
金属和金属材料 一、选择题 1.下列金属单质不能与稀盐酸反应放出氢气的是() A.Cu B.Zn C.Mg D.Fe 【答案】A 2.材料与人类生活紧密相关,下列物品所用的材料不属于金属材料的是()A.钛合金人造骨B.灯泡里的灯丝 C.钻石D.黄金饰品 【答案】C 3.下列属于置换反应的是() A.2CO+O22CO2 B.H2CO3H2O+CO2↑ C.NaOH+HCl NaCl+H2O D.2Al+6HCl2AlCl3+3H2↑ 【答案】D 4.下列物质不能由金属直接与稀盐酸或稀硫酸反应制得的是()A.ZnCl2B.Fe2(SO4)3 C.AlCl3D.MgSO4 【答案】B 5.下列防锈措施不合理的是() A.钢管存放在干燥的地方 B.用盐水清洗菜刀 C.及时清除铁制品表面的锈渍 D.在铁管表面镀上一层不易锈蚀的金属 【答案】B 6.下列关于金属材料的说法中正确的是() A.铝制品表面应常用钢刷擦洗 B.可用铁桶盛装农药波尔多液 C.焊锡(锡铅合金)的熔点低,常用来焊接金属
D.钢因为比生铁的含碳量高,所以应用范围更广 【答案】C 7.化学世界绚丽多彩,下列实验中有关颜色的描述不正确的是() A.硫粉在氧气中燃烧出现蓝紫色火焰 B.将铁钉加入到稀硫酸中,溶液由无色变为黄色 C.对木炭和氧化铜的粉末加强热会出现红色物质 D.将铜片放入硝酸银溶液,溶液由无色变为蓝色 【答案】B 8.下列指定反应的化学方程式正确的是() A.铁丝在氧气中燃烧:4Fe+3O22Fe2O3 B.铜与稀盐酸反应:Cu+2HCl CuCl2+H2↑ C.常温下铝表面氧化膜的生成:Al+O2Al2O3 D.常温下铜锈蚀形成铜绿:2Cu+CO2+O2+H2O Cu2(OH)2CO3 【答案】D 9.有X、Y、Z三种金属,X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化。根据以上实验事实,判断X、Y、Z三种金属的活动性由强弱的顺序正确的是() A.X、Y、Z B.X、Z、Y C.Y、Z、X D.Z、Y、X 【答案】B 10.化学小组为探究铝、铜、银三种金属的活动性顺序,设计了如图所示实验方案。 下列说法不正确的是() A.由实验甲可知金属活动性:Al>Cu B.由实验乙可知金属活动性:Cu>Ag C.由实验甲、乙、丙可知金属活动性:Al>Cu>Ag
淮安信息职业技术学院教案首页 一、章节:第二章纯金属与合金的晶体结构 第一节纯金属的晶体结构第二节纯金属的实际晶体结构第三节合金的晶体结构 二、教学目的:使学生了解纯金属与合金的晶体结构,晶胞、晶格、合金的基本概念,了解固溶体与金属化合物。 三、教学方法: 讲授法。 四、教学重点: 晶胞、晶格、合金的基本概念,了解固溶体与金属化合物。 五、教学难点: 晶胞、晶格、合金的基本概念,了解固溶体与金属化合物。 六、使用教具: 挂图。 七、课后作业: P17:1、2、6。 八、课后小结:
第二章纯金属与合金的晶体结构 第一节纯金属的晶体结构 一、晶体结构的基本知识 1.晶体与非晶体 晶体内部的原子按一定几何形状作有规则地重复排列,如金钢石、石墨及固态金属与合金。而非晶体内部的原子无规律地规律地堆积在一起,如沥青、玻璃、松香等。 晶体具有固定的熔点和各向异性的特征,而非晶体没有固定的熔点,且各向同性。 2.晶体管格与晶胞 为便于分析晶体中原子排列规律,可将原子近似地看成一个点,并用假想的线条将各原子中心连接起来,便形成一个空间格子。 晶格——抽象的、用于描述原子在晶体中的规则排列方式的空间几何图形。结点——晶格中直线的交点。 晶胞——晶格是由一些最基本的几何单元周期重复排列而成的,这种最基本的几何单元称为晶胞。
晶胞大小和形状可用晶胞的三条棱长a、b、c(单位,1A=108cm)和棱边夹角来描述,其中a、b、c称为晶格常数。 各种晶体由于其晶格类型和晶格常数不同,故呈现出不同的物理、化学及力学性能。 二、常见的晶格类型 1.体心立方晶格 体心立方晶格的晶胞为一立方体,立方体的八个顶角各排列着一个原子,立方体的中心有一个原子。其晶格常数a=b=c。属于这种晶格类型的金属有α铁、铬、钨、钼、钒等。 2.面心立方晶格 面心立方晶格的晶胞也是一个立方体,立方体的八个顶角和六个面的中心各排列一个原子。属于这种晶格类型的金属有γ铁、铝、铜墙铁壁、镍、金、银等。 3.密排六方晶格 密排六方晶格的晶胞是一个六方柱体,柱体的十二个顶角和上、下中心各排列着一个原子,在上、下面之间还有三个原子。属于这种晶格类型的金属有镁、锌、铍等、α-Ti。 晶格类型不同,原子排列的致密度也不同。体心立方晶格的致
Chapter Outline ?金属的晶体结构 ?密排面堆积方式 ?晶体结构间隙 ?固溶体 ?中间相结构
常见金属的晶体结构 面心立方结构(A1)face-centred cubic lattice 体心立方结构(A2) body-centred cubic lat tice 密排立方结构(A3)hexagonal close-packed lattice A B A ?金属键无饱和性和方向性,使其晶 体结构倾向于最紧密堆垛。 ?将原子看作刚性球,构成相互接触 圆球模型,更确切表示原子排列。 ?面心原子shared by 2 cells: 6 x 1/2 = 3?顶角原子shared by 8 cells: 8 x 1/8 = 1 面心立方结构金属:γ-Fe, Al, Cu, Ni, Au, Ag 和Pt 等。 面心立方结构 ?结构符号A1,Pearson 符号c F4。 ?每个晶胞含4个原子。(0,1/2,1/2)● (0,0,0) ●(1/2,1/2,0)●●(1/2,0,1/2)
配位数与致密度 面心立方结构的致密度η为?致密度η是衡量原子堆垛紧密程度的,为晶胞中原子所占体积(V a )与晶胞体积(V )的比值:η=V a / V ?面心立方晶胞面对角线为原子半径的4倍,即()r 24/=a ?配位数(Coordination Number——CN )是晶体结构中每个原子的最近邻原子数目。a/2 2密排面{111}密排方向 <110> ?面心立方结构的配位数为12,最近 原子间距离为?结构符号A2,Pearson 符号c I2?每个晶胞含2个原子 体心立方结构 ?体心立方结构的金属包括:α-Fe, Cr, W, Mo, V 和Nb 等。 ?体心立方结构配位数为8,原子间距a/23?还有6个次近邻原子,间距为a ,相差15.5%。?体心配位数也表示为CN=8+6。 体心立方结构的致密度η为 体心立方晶胞体对角线为原子半径的4倍,即()r 34/=a 体心原子shared by 0 cells: 1 x 1 = 1 顶角原子shared by 8 cells: 8 x 1/8 = 1 (1/2 1/2 1/2)●(000)●密排面{110} 密排方向<111>
第八章复习金属和金属材料单元练习 一、选择题 1.国际因特网上报道:“目前世界上有20万人患有缺铁性贫血.”我国政府将启动“酱油补铁工程”.这里的铁是指() A.铁元素B.铁单质 C.四氧化三铁D.三氧化二铁 2.铝的抗腐蚀能力强的原因是() A.铝在常温下不与氧气反应 B.铝的化学性质不活泼 C.铝的表面容易形成一层致密的氧化物薄膜 D.铝有较强的还原性 3.铜粉中含有少量的铁粉,最佳的除铁办法是() A.加入足量稀硫酸,过滤B.在空气中灼烧 C.高温下加热并通入氢气D.加入足量硫酸铜溶液,过滤 4.在茶缸和脸盆等铁制品表面烧制搪瓷的目的是() A.增大硬度防止撞坏B.增大厚度防止磨损 C.防止铁生锈且美观D.美观和杀菌消毒 5.如下图所示,在盛水的试管中放一根洁净的铁钉,用带U型管的胶塞塞紧,U型管内液面处于同一高度.数天后观察U型管内的水面() A.a比b高 B.b比a高 C.一样高 D.U型管中的水从b管中全部溢出 6.在天平的左右两个托盘上,各放一质量相等的烧杯,其中盛有等质量的稀硫酸,天平平衡,如果分别将下列四组中的两种物质放入左右两个烧杯内,充分反应后,天平仍保持平衡的是()
A.等质量的锌和铜 B.等质量的铁和铜 C.等质量的锌和铁(反应后烧杯中两种金属均有剩余) D.等质量的锌和铁(反应后烧杯内酸都有剩余) 7.我国是世界文明发达最早的国家之一,如冶铁、炼钢、湿法炼铜都是我国劳动人民发明的,它们最早发现的朝代依次是() A.春秋、战国、宋代B.宋代、战国、春秋 C.宋代、春秋、战国D.春秋、宋代、战国 8.生铁和稀盐酸反应后会留有残渣,残渣的主要成分是() A.氯化亚铁B.三氧化二铁 C.碳D.铁 9.将一枚洁净的铁钉浸入稀硫酸中,下列叙述:①铁钉表面产生气泡②液体由无色逐渐变为浅绿色③铁钉的质量减轻④液体的质量减轻.其中正确的是() A.②③B.①②④ C.①②③D.①②③④ 10.利用下列各组物质之间的反应,能够验证Fe、Cu、Ag三种金属活动性顺序的是() A.Fe、CuCl2溶液、Ag B.FeCl2溶液、CuCl2溶液、Ag C.FeCl2溶液、Cu、Ag D.Fe、CuCl2溶液、AgNO3溶液 二、填空题 1.用铁桶盛装硫酸铜溶液时,铁桶很快出现漏洞是因为______________________,反应方程式为______________________. 2.生铁和钢都是铁的合金,它们的性能不同,用途也不同.在你所知的物品中,______________________是由生铁制成的;______________________是由钢制成的.3.迎香港回归,在《南京条约》议约地——南京下关区静海寺敲响了“警世钟”,铸造该钟采用的主要金属材料是___________________,此金属的优点是____________________________. 4.高层建筑都采用铝合金门窗而不采用钢门钢窗,铁制的舰船外面需涂油漆而铝合金制的飞机却不用,解释两个事例的原因:①_________________;②______________________.5.如下图所示,在杠杆的两端分别挂着质量相同的铜球和锌球,这时杠杆平衡.然后将两球分别浸没在稀H2SO4和CuSO4溶液中一段时间. (1)杠杆向________(左或右)倾斜. (2)________(左或右)杯中溶液密度大. 6.盛放在油罐车内的石油产品,振荡可以产生静电容易引起火灾.所以在石油罐车尾部有一条拖地铁链,这是利用铁____________________的性质. 7.现有A、B、C三种金属,已知A能将C从它的溶液中置换出来,B能与盐酸或稀硫酸反应产生氢气,A不能与盐酸或稀硫酸反应.则这三种金属活动性由强到弱的顺序是
金属和金属材料练习题(含答案)(word) 一、金属和金属材料选择题 1.人体内含量最高的金属元素是() A.铁 B.锌 C.钾 D.钙 【答案】D 【解析】 人体内含量最高的金属元素是钙,故选D。 2.往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生.根据上述现象分析,你认为下面结论错误的是 A.滤渣一定有Fe粉B.滤渣一定有Cu粉 C.滤液中一定有Fe2+D.滤液中一定有Ag+、Cu2+ 【答案】D 【解析】 【分析】 【详解】 根据金属活动性顺序的应用:位于前面的金属能把位于后面的金属从化合物的溶液中置换出来。由于铁位于银和铜的前面,故铁能与硝酸银、硝酸铜发生置换反应,由于银的活动性比铜弱,故铁先与硝酸银反应,把硝酸银中的银完全置换出来以后再与硝酸铜发生置换反应。向反应的滤渣中加入稀盐酸,产生了大量的气泡,说明铁过量,即铁已经把硝酸银中的银和硝酸铜中的铜完全置换出来了,故滤渣的成分是银、铜、铁,滤液的成分是硝酸亚铁。故选D。 3.以下实验能比较出铜和银的金属活动性强弱的是() A.测定两金属的密度 B.铜片放入硝酸银溶液中 C.将两种金属相互刻画 D.铜片、银片分别放入稀硫酸中 【答案】B 【解析】 试题分析:比较金属活动性强弱要通过化学变化且出明显现象才能表现出来,A.测定两金属的密度,不能比较出铜和银的金属活动性强弱;B.铜片放入硝酸银溶液中能比较出铜和银的金属活动性强弱,因为金属铜能置换出金属银;C.将两种金属相互刻画不能比较出铜和银的金属活动性强弱;D.铜片、银片分别放入稀硫酸中,二者多无明显现象,不能比较出铜和银的金属活动性强弱;故答案选择B 考点:金属活动性顺序