
物质的检验与鉴别
一、知识精讲
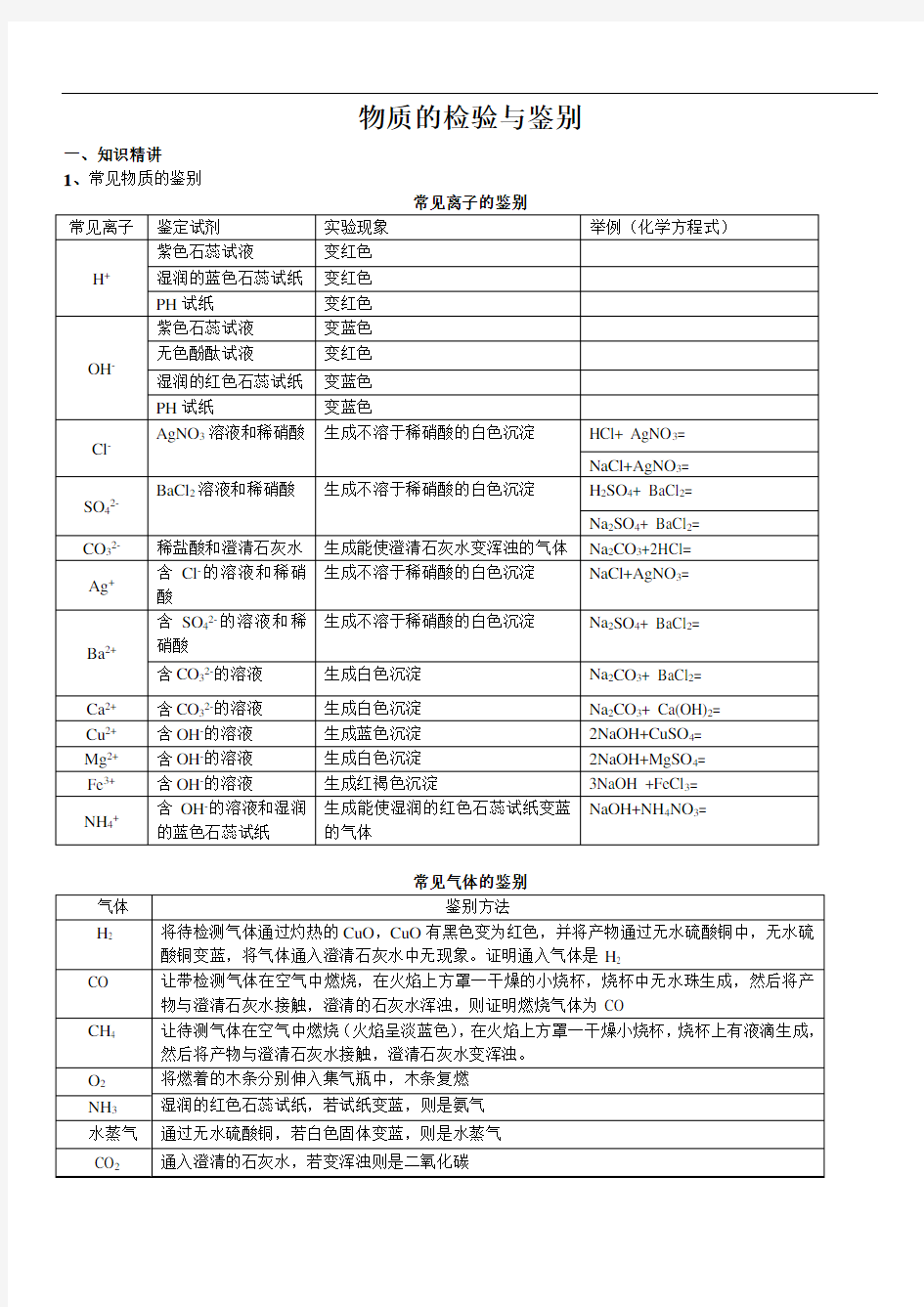
1、常见物质的鉴别
A. 几种溶液含不同阳离子时,常选用Ba(OH)2溶液或NaOH溶液做鉴别试剂。
B. 几种溶液含不同阴离子时,常选用强酸做鉴别试剂。
C. 几种溶液酸碱性不同时,常选用紫色石蕊做鉴别试剂。
D. 几种物质是金属或金属氧化物时,常选用稀强酸做鉴别试剂。
E. 一种试剂与四种溶液反应时,多数是有沉淀、有气体,既有沉淀又有气体、沉淀颜色不同,无明显现象。
F. 当给定的一种试剂不能鉴别出被检物时,可从已鉴别出的物质中找出一种试剂再鉴别。
④不同试剂的鉴别:
A. 观察法:根据物理性质中颜色、气味、状态、溶解性等进行鉴别。
B. 热分解法:根据不同物质的热稳定性,利用产物的不同性质特征进行鉴别。
C. 相互作用法:根据两两混合后的不同现象进行鉴别。
一、一次鉴别问题
只用一种试剂的鉴别题:
根据待鉴别的几种物质性质特点,加一种试剂,使各自出现明显不同的现象加以鉴别。
思路:
(1)如果待检验的物质之间有明显的酸碱性差异时,可选用适当的指示剂或PH试纸检验。
如:用一种试剂检验盐酸、氯化钠、碳酸钠三种溶液,这种试剂是紫色石蕊试液。
(2)如果待检验的物质之间有较明显的溶解性差异和溶解时的热效应差异,则可用加水使其溶解来检验。
如:用一种试剂检验:氯化钠、氯化铵、氢氧化钠、氯化银四种固体物质,这种试剂就是水。
(3)如果待检验的物质含有相同的阴离子或大多数相同的阴离子时,可选用加强碱溶液来检验。
如:用一种试剂检验:氯化铵、氯化钠、氯化铁和氯化镁四种溶液,这种试剂就是氢氧化钠溶液。
(4)如果被鉴别的物质中含有相同或大多数相同的阳离子时,可选择强酸为试剂进行鉴别。
如:用一种试剂鉴别氯化钠、碳酸钠、亚硫酸钠三种溶液,这就是盐酸或稀硫酸。
(5)如果被鉴别的物质为金属单质和金属氧化物时,可选择强酸为试剂进行鉴别。
如:用一种试剂鉴别铁、铜、氧化铁、氧化铜四种固体物质,这种试剂是稀盐酸(或稀硫酸)。
(6)如果被鉴别的物质有几种含有相同的阳离子,有几种含有相同的阴离子,则要分别考虑区别不同阳离子需要何种离子,区别不同阴离子需要何种离子,然后将这两种离子合起来组成一种试剂。
如:用一种试剂鉴别硝酸银、碳酸钠、亚硫酸钠、硝酸钡四种物质,这种试剂是盐酸。
因为四种物质中,硝酸银和硝酸钡的阳离子不同,。区别银离子和钡离子可用氯离子;
碳酸钠和亚硫酸钠的阴离子不同,区别亚硫酸根离子和碳酸根离子可用氢离子,合起来,
这种试剂就是盐酸。
还有另一种比较快速地找出试剂的方法。就是将所用试剂的离子重新组成新试剂,如果组合后的试剂答案中有,则一般地就可以认为用这一种试剂可以把这种物质区别开。
只用一种外加试剂的物质鉴别
1、现有NaCl、H2SO4、NaOH三种无色溶液,如只用一种试剂经一步实验就能将它们加以鉴别,则该试剂可用()
A.AgNO3溶液B.BaCl2溶液C.石蕊试液D.酚酞试液
2、为鉴别氢氧化钠溶液、水和稀硫酸,最简便的方法是分别滴入()
A.碳酸钠溶液B.氯化钡溶液C.紫色石蕊试液D.无色酚酞试液
3、若将碳酸钠、硝酸银、硫酸钾三种无色溶液一次鉴别出来,应选用()
A.氯化钡溶液B.氢氧化钠溶液C.稀硝酸D.稀盐酸
4、可以用来一次鉴别出KOH溶液、NaCl溶液和盐酸的物质是()
A.硝酸银溶液B.酚酞试液C.pH试纸D.氯化钡溶液
5、只用一种试剂就可鉴别H2SO4、NaOH和Ca(OH)2三种溶液,这种试剂是()
A.碳酸钠溶液B.氯化钡溶液C.石蕊试液D.酚酞试液
6、只用一种试剂区别Na2SO4、KOH、AgNO3三种无色溶液时,可选用的试剂是()
A.FeCl3B.盐酸C.BaCl2 D.Cu(NO3)2
7、只用一种试剂区别Ba(NO3)2、NaCl、KOH三种无色溶液时,可选用的试剂是()
A.碳酸钠溶液B.盐酸C.硫酸D.硫酸铜溶液
8、两支试管中,一只装有盐酸,另一只装有硫酸,鉴别时最好加入( )
A.AgNO3溶液B.石蕊试液C.BaCl2溶液D.酚酞试液
9、以下各组物质各有三种无色溶液,其中只用酚酞试液不可以将它们区分开来的是( )
A.NaOH、H2SO4、NaCl B.Ba(OH)2、H2SO4、HCl
C.Ca(OH)2、HCl、KNO3D.NaOH、H2SO4、KOH
10、实验室要鉴别氢氧化钠溶液和氢氧化钙溶液,可使用的方法是()
A.加入盐酸B.加入碳酸钠溶液
C.滴入酚酞试液D.通入二氧化碳气体
11、下列各组溶液中,只用酚酞试液和CO2通入稀溶液间的相互反应就能鉴别的是()
A.KNO3、NaCl、NaOH B.NaOH、KOH、HCl
C.H2SO4、HCl、NaOH D.NaOH、H2SO4、NaCl
12、下列各组物质的溶液,只须用氯化钡溶液就能鉴别出来的是()
A.Na2SO4、AgNO3、HNO3B.Na2CO3、CuSO4、NaCl
C.Na2CO3、Na2SO4、HCl D.KNO3、AgNO3、HNO3
13、只用酚酞试液就可以将组内三种物质的溶液区别开来的是()
A.BaCl2、NaOH、MgCl2B.KOH、HCl、H2SO4
C.HCl、HNO3、Ba(OH)2D.NaOH、HCl、NaCl
14、只用一种试剂就能将Na2CO3NH4Cl 、NaCl 三种溶液区分开来的是()
A、澄清石灰水
B、CaCl2溶液
C、NaOH溶液
D、稀盐酸
15、只用一种试剂就可将Ba(OH)2、稀硫酸、KOH三种溶液鉴别出来的是()
A、K2CO3溶液
B、NaCl溶液
C、石蕊试液
D、酚酞试液
16、欲鉴别石灰水、稀盐酸、蒸馏水三瓶失去标签的无色液体,提供的试剂有:①纯碱溶液②紫色石蕊③酚酞
试液。只用一种试剂可将它们鉴别出来的是()
A、只有①
B、只有②
C、①或②
D、①或②或③
17、利用无色酚酞可以鉴别的一组溶液是()
A、BaCl2、H2SO4、HCl
B、NaOH 、KOH 、HCl
C、H2SO4、Na2CO3、HCl
D、NaCl、NaOH 、HCl
18、只用一种试剂就能将(NH4)2SO4、NH4Cl、NaCl、Na2SO4四种溶液区分开来,这种试剂是()
A、AgNO3溶液
B、BaCl2溶液
C、NaOH溶液
D、Ba(OH)2溶液
19、用一种试剂区别硫酸铜、氯化镁、氯化铁、氯化钠四种物质,这种试剂是()
A、硝酸银
B、氢氧化钠
C、氯化钡
D、盐酸
20、要鉴别NaCl、MgCl2、酚酞三瓶无色溶液,可选用下列试剂中的()
A、AgNO3溶液
B、HCl溶液
C、石蕊试液
D、NaOH溶液
二、组内鉴别题型
不用任何试剂鉴别多种物质的思路:
根据待鉴别物质中,某一物质的特性和其它物质有不同的颜色、气味等,先将其确定,然后利用该物质和待鉴别的其它物质间的相互反应而将其它物质一一鉴别。
(1)从被鉴别的物质的物理性质上找突破口:
①闻气味。如不用任何试剂鉴别氨水、硫酸钾、氯化镁、碳酸钠四种溶液。可先闻气味,氨水
有强烈的刺激性气味,首先识别出氨水,然后以氨水为试剂,分别加入到另外三种
溶液中,有白色沉淀产生的是氯化镁,再以氯化镁为试剂分别加到剩余的两种溶液
中,产生白色沉淀的为碳酸钠,不反应的为硫酸钾。
②看颜色。如不用任何试剂鉴别硝酸铵、氯化钡、硫酸铜、氢氧化钠四种溶液。首先观察出显
蓝色的是硫酸铜溶液,以硫酸铜为试剂分别加到另外三种溶液中,产生蓝色沉淀的是
氢氧化钠溶液,产生大量白色沉淀的是氯化钡溶液,无现象产生的是硝酸铵溶液。
(1)加热法:
如,不用任何试剂鉴别碳酸氢钠、碳酸氢铵、高锰酸钾、碳酸钠四种固体物质,即可加热法。加热时,碳酸氢铵完全分解成二氧化碳、氨气、水蒸气,试管内无任何残留物;碳酸氢钠受热分解有气体产生,试管内留有白色固体碳酸钠;高锰酸钾受热分解产生氧气,可使带火星的木条复燃,试管内留有黑色固
体;碳酸钠受热时不分解,无现象产生。
(2)两两混合列表分析法:
将待鉴别的物质分别编号,分别以一种物质作为试剂加入到其它物质中去,将产生的现象列表分析。
根据每种物质所产生的不同现象,可确定物质的名称。
如:不用任何试剂鉴别氯化钡、硝酸银、碳酸钠、盐酸四种溶液,
组内鉴别题型
1、下面的四组溶液中,不用加其它任何试剂,只需组内物质相互反应,就能加以鉴别的()
A、NaCl、Na2CO3、HCl、KNO3
B、Na2SO4、Ba(NO3)2、K2CO3、KNO3
C、NaOH、CuSO4、NaCl、Ba(NO3)2
D、FeCl3、NaOH、Na2SO4、KCl
2、下列各组稀溶液中,利用组内物质相互反应,就能加以鉴别的是( )
A、Na2CO3、H2SO4、HCl、KNO3
B、CuSO4、KOH、NaCl、NaOH
C、Na2SO4、Na2CO3、BaCl2、HNO3
D、NaNO3、MgCl2、KCl、Ba(OH)2
3、下列各组溶液中,不用加其它试剂就不能鉴别出来的是()
A、CuSO4、BaCl2、HNO3、NaOH
B、Na2SO4、BaCl2、Na2CO3、HCl ,
C、AgNO3、NaNO3、NaCl、HCl
D、FeCl3、NaOH、HNO3、Na2SO4,
4、下列各种物质的溶液,不另加试剂就无法一一鉴别的是()
A、CuSO4 HCl、NaOH、MgSO4
B、Na2CO3、HCl、BaCl2、K2SO4
C、HCl、CaCl2、NaOH、KNO3
D、NH4NO3、H2SO4、NaOH、MgCl2
5、下列各组溶液,不用其它试剂就能区别出来的是()
A、NaOH、HCl、NaCl
B、Na2CO3、HCl、BaCl2
C、Na2CO3、Na2SO4、BaCl2
D、AgNO3、HCl、NaCl
6、下列各组物质的溶液,不用另加试剂就可以鉴别出来的是(不可加热,且用化学方法)()
A、Na2SO4、BaCl2、NaNO3、KNO3
B、CuSO4、NaOH、NaNO3、KCl
C、NaCl、AgNO3、HCl、NaNO3
D、K2CO3、K2SO4、H2SO4、Ba(NO3)2
7、下列几组溶液不用其它任何试剂就可以鉴别的是()
A、CaCl2、KNO3、Na2CO3、KCl
B、NaCl、BaCl2、Na2CO3、HCl.
C、Na2SO4、Ba(OH)2、Na2CO3、NaNO3
D、HNO3、Na2CO3、MgCl2、Ba(OH)2
8、有四种失去标签的溶液,它们的溶质分别是:①Ba(NO3)2②AgNO3③NaCl④CuCl2,不用其它试剂就可以将它们
加以鉴别,则鉴别出来的先后顺序可能是()
A.④②③①B.①③②④C.④①②③D.②③①④
9、不用其它试剂,用最简捷的方法鉴别下列五种溶液:① NaOH ② MgSO4 ③ FeCl3 ④ Ba(NO3)2 ⑤ KCl,
则正确的鉴别顺序为()
A.②④③①⑤B.③②④①⑤C.①③②④⑤D.③①②④⑤
10、下列各组溶液,不另选用其它试剂就可以鉴别的是()
A.CuSO4、NaOH、MgCl2 B.Na2CO3、BaCl2、Ca(OH)2
C.Ba(NO3)2、Na2CO3、HNO3D.NaOH、H2SO4、KOH
11、下列各组物质的溶液,不另加试剂就能鉴别的是()
A.HCl、H2SO4、Na2CO3、BaCl2B.Na2SO4、K2CO3、KNO3、BaCl2
C.NaCl、MgCl2、NaOH、CuSO4D.NaCl、AgNO3、CaCl2、NaNO3
12、下列各组物质的溶液,根据观察到的现象,不加任何试剂将它们两两混合就能将其一一区别开来的是()
A.H2SO4、Na2SO4、Ca(NO3)2、Na2CO3B.K2SO4、BaCl2、KNO3、Na2CO3
C.H2SO4、NaCl、Ba(NO3)2、Ba(OH)2D.FeCl3、NaCl、NaNO3、AgNO3
13、下列各组物质的溶液,不另加试剂,就能鉴别的组别是()
A.NaOH、Na2SO4、BaCl2、Na2CO3B.NaOH、CuSO4、KNO3、HCl
C.NaOH、CuSO4、BaCl2、NaCl D.Na2CO3、NaCl、BaCl2、KCl
(2014包头)下列各组溶液,不加其他试剂就能鉴别的是( )
A.K2SO4、BaCl2、Na2CO3、HCl B.HNO3、Na2CO3、Ca(NO3)2、HCl
C.CuCl2、K2SO4、NaNO3、NaOH D.AgN03、KCl、NaCl、HNO3
三、鉴别顺序问题。
1、按下列添加试剂的先后顺序,即可将稀盐酸、稀硫酸、硫酸钾、氢氧化钠和硝酸钾五种无色溶液鉴别开来的是
()
A、石蕊试液、AgNO3溶液、HNO3
B、BaCl2溶液、酚酞试液、AgNO3溶液
C、石蕊试液、BaCl2溶液
D、酚酞试液、BaCl2溶液、AgNO3溶液
2、不用其它任何试剂鉴别下列5种物质的溶液:① NaOH ② MgSO4③Ba(NO3)2④ Cu(NO3)2⑤ KNO3,被鉴别出来
的正确顺序是()
A、⑤④③②①
B、④③①②⑤
C、④①②③⑤
D、②③①④⑤
3、下列溶液,不用外加试剂(可组内结合)鉴别出来的先后顺序是( )
①氯化铁②硝酸钾③氯化镁④氢氧化钠
A、①②③④
B、①④③②
C、④①②③
D、①③④②
4、现有①NaOH ②Al2(SO4)3③Ba(NO3)2④FeCl3⑤NaCl 五种溶液,不用其它试剂,要用最简便的方法,被鉴别出
来的物质顺序是()
A、①②③④⑤
B、④①②③⑤
C、②③①④⑤
D、④⑤②③①
5、有下列五瓶失去标签的溶液,它们分别为:①Ba(NO3)2②KCl③NaOH④CuSO4⑤Na2SO4,如不用任何其它试剂(包
括试纸),用最简便的方法将它们一一鉴别开来,则鉴别的先后顺序可能为(有几种写几种)
⑴⑵
⑶⑷
答案:④①③⑤②;④①③②⑤;④③①⑤②;④③①②⑤
6、不用其它试剂,利用相互反应就能鉴别出来的有。
①CuSO4、BaCl2、NaOH、NaCl ②K2SO4、Na2CO3、BaCl2、HNO3
③HCl、NaCl、AgNO3、HNO3④CuSO4、NaOH、KCl、NaNO3
⑤MgCl2、NaOH、HCl、FeCl3⑥Na2CO3、浓盐酸、AgNO3
⑦NaNO3、Na2CO3、BaCl2、H2SO4
答案:①②⑤⑥⑦
(2014包头)鉴别下列各组物质的方法中,有错误的是( )
选项需要鉴别的物质方法一方法二
A 黄金和黄铜(Zn—Cu合金)在空气中灼烧滴加稀盐酸
B 食盐水和碳酸溶液测定溶液PH值滴加食醋
C 水和双氧水观察颜色加入少量二氧化锰
D 烧碱溶液和澄清石灰水通入二氧化碳滴加碳酸钠浓溶液
四、用多种外加试剂的物质鉴别
解答鉴别题的步骤
一般按如下程序:(1)取少许溶液(固体取少许配成溶液)。(2)加入少量试剂。(3)观察实验现象。(4)判断检验结论。
(5)写出反应的化学方程式。
例如①某溶液中滴入Ba(NO3)2溶液后,生成白色沉淀,再加稀HNO3,沉淀不溶解。则白色沉淀一定是BaSO4吗?
该溶液一定是硫酸溶液吗?
②某盐溶中滴入BaCl2溶液后,生成白色沉淀,再加稀HNO3,沉淀不溶解。则白色沉淀一定是BaSO4吗?
该盐溶液一定是硫酸盐溶液吗?
③某溶液中滴入AgNO3溶液后,生成白色沉淀,再加稀HNO3,沉淀不溶解。则白色沉淀一定是AgCl 吗?
该溶液一定是盐酸溶液吗?
1、为鉴别盐酸、硝酸、氢氧化钠、氢氧化钙四种溶液,先取出少量的四种溶液分别滴加指示剂,将溶液分为两组(每组两种溶液),然后取出其中一组溶液少量,分别加入碳酸钠溶液,有白色沉淀生成的是,无现象的是;再取另一组溶液少量,分别滴加硝酸银溶液,有白色沉淀生成的是,无现象的是;有关反应的化学方程式为。
答案:紫色石蕊溶液,氢氧化钙溶液,氢氧化钠溶液,盐酸,硝酸,化学方程式略。
2、为鉴别NaCl、稀HCl、KOH、Ba(OH)2、Na2SO4五种无色溶液先加入试剂,就能鉴别出,
余下分为两组。一组是,加入适量的
或试剂,可以区分开来,另一组是,加入适量的
或试剂可以区别开来。
答案:紫色石蕊试液,稀盐酸,氢氧化钡和氢氧化钾,硫酸或硫酸钠,氯化钠和硫酸钠,硝酸钡或氢氧化钡。3、现有一包白色粉末,其中含有CuSO4、BaCl2、NaOH、Na2CO3中的一种或几种。某化学小组为确定白色粉末的
成分,进行了如下实验:
①取一定量白色粉末,加入足量水,振荡,得到无色透明溶液;
②取少量①的溶液,加入足量盐酸,有气泡产生。
(1)该白色粉末中肯定含有?可能含有?
(2)为确定可能含有的物质是否存在,还需做什么实验?请写出简要的实验步骤
4、有一包白色粉末,可能含有Ba(OH)2、KNO3、FeCl3、Na2CO3、Na2SO4中的一种或几种。为了确定其成分,进
行如下实验:
①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀,上层清液为无色。
②过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生。
(1)据此推断,该白色粉末中一定含有;可能含有;一定不含有。
(2)写出步骤②中发生反应的的化学方程式:。
5、无色气体可能含有水蒸气、CO、CO2、HCl和H2中的一种或几种。①将混合气通过浓H2SO4后,气体体积无变
化;②再通过澄清石灰水,不浑浊,但气体体积缩小一半;③点燃导出尾气,将其通过无水CuSO4,不变色;
通入澄清石灰水变浑浊。由此推断混合气体中肯定存在(填写化学式) ,肯定不存在。
6、现有A、B、C三种物质,已知A为钠盐,B为氯化物,C为碱。经下列实验分析,结果是:
(1)A、B溶液混合后无气体或沉淀产生;(2)B、C混合产生蓝色沉淀;
(3)A、C溶液混合后出现白色沉淀,且不溶于稀HNO3。
由此推断:A 是 B 是 C 是 。
7、根据下述反应,判断未知物。
(1) A + HCl → B + H 2O + CO 2↑ (2) B + AgNO 3 → AgCl↓+ C (3) C + CuSO 4 → BaSO 4↓+ D (4) D + NaOH → E↓+ NaNO 3 (5) E → F + H 2O
已知A 是一种盐,则A ~F 的化学式为:
A 、
B 、
C 、
D 、 、
E 、
F 。
8、已知A 、B 、C 、D 、E 、F 六种物质存在下列关系:
(1) A + B → C + H 2O (2) C + KOH → D↓(蓝) + E
(3) E + BaCl 2 → F↓(不溶于稀HNO 3) + KCl (4) B + D → C + H 2O
试写出下列物质的化学式:A 、 B 、 C 、 D 、 。
五、物质鉴别的实验步骤题
1、在A 、B 、C 三支试管中,分别盛有Na 2SO 4、CuSO 4、Ba(NO 3)
2、Na 2CO 3中的一种或几种,下表是有关实验的
记录。
试推断(写化学式)A 中一定有 ;B 中一定有 ;C 中一定有 。
2、有一白色固体A 和黑色粉末B 混合加热后产生另一白色固体C 和无色、无味的气体D ,D 可使带火星的木条复
燃;把淡黄色粉末E 加热放入盛D 的集气瓶里,发出明亮的蓝紫色火焰,生成一种有刺激性气味的气体F . 由此判断:
A 是___ ___,
B 是__ ____,
C 是___ ___,
D 是___ ___,
E 是__ ____,
F 是__ ____. 答案;A 是 氯酸钾B 是 二氧化锰C 是 氯化钾D 是 氧气E 是 硫磺F 是 二氧化硫
3、有A 、B 、C 、D 四种物质,A 、B 、D 是盐,且B 为钠盐,C 为酸,把A 、B 、C 分别溶于水,向其中分别滴加
D 溶液,B 、C 产生白色沉淀,取C 、D 反应后的清液,分别滴入二种沉淀中,只有B 产生的沉淀消失,生成能使澄清石灰水变浑浊的无色无味的气体。A 溶液加HCl 生成白色沉淀,加入C 、D 反应后的清液不消失。试推断A 、B 、C 、D 分别为A 、 B 、 C 、 D 、 。
4、有失去标签的硝酸钾、碳酸钾、硝酸银、硝酸钙和盐酸五瓶溶液,将其任意编号为:A 、 B 、C 、D 、E ,进行
实验
A+B A+E B+C B+E 现象 产生沉淀 产生沉淀 产生沉淀 产生气泡
(1)试推断并写出五种溶液中溶质的化学式:
A______________ B______________ C______________ D______________ E______________
(2)写出有关反应的化学方程式: A+E :___________________________ ,B+E :____________________________。
5、a 、b 、c
反应物
a+b c+d a+d a+c b+d 现象 白色沉淀 白色沉淀 白色沉淀 白色沉淀 无色气体
(1)请用化学式填写a 是 ______ 、b 是 ______ 、c 是 ______ 、d 是 ______
(2)写出a+c 反应的离子方程式 ________________________ 。
答案:(1)AgNO 3、HCl 、BaCl 2、Na 2CO 3(2)Ag ++Cl -=AgCl↓
实 验 步 骤 A 试 管 B 试 管 C 试 管 (1)分别加足量水,振荡 无色溶液 蓝色溶液 无色溶液中有白↓ (2)向水溶液中加BaCl 2 无色溶液 白色沉淀 原白色沉淀↓不变 (3)向(2)中加稀HNO 3 无色溶液 沉淀不溶 沉淀部分溶解有气泡产生 △
物质的检验和鉴别 检验与鉴别都是用来检验物质的常用方法,都是通过化学实验,根据物质的特性反应去查出要检验的物质。因此,物质检验的关键是必须熟练掌握各物质(或离子)的特征反应,正确地选择试剂和实验方法。但是我们必须首先明白鉴定与鉴别。物质的鉴定与鉴别共同的要求是:根据物质的特有反应,选择适当的试剂,达到反应灵敏、现象明显、操作简便、结论可靠的效果。 1.检验原理 (1)依据物质的特殊性质进行检验。如物质的颜色、气味、溶解性等。 (2)依据物质间反应时所产生的特殊反应现象。即所选的试剂和被检验的物质在发 生化学反应时,必须能够产生下列现象之中的一种:①变色;②放出气体(通常指产生气体的气味或在溶液中反应时产生的气泡);③生成沉淀等。 2.常见有特殊颜色的物质 Fe2O3:红棕色Fe3O4:黑色 Fe2+:浅绿色Fe3+:黄色 Fe(OH)3:红褐色Cu:红色 CuO:黑色无水CuSO4:白色 CuSO4·5H2O:蓝色Cu2+:蓝色 Cu(OH)2:蓝色S:黄色(注:离子代表含有这种离子的溶液) 常见气体的检验 气体检验方法现象 氧气将带火星的木条插入有关容器内木条复燃 氢气点燃,在火焰上方罩一个冷而干燥的小烧杯 发出淡蓝色火焰,烧杯 水珠凝结 依次通过灼热的氧化铜和白色的无水硫酸 铜 黑色氧化铜变红,白色 蓝 二氧化碳通入澄清石灰水中澄清的石灰水变浑浊 一氧化碳点燃,在火焰上方罩一个冷而干燥的小烧 杯,再向烧杯内倒入澄清石灰水,振荡 发出淡蓝色火焰,烧杯 水珠凝结,石灰水变浑浊依次通过灼热的氧化铜和澄清石灰水 黑色氧化铜变红,澄清 变浑浊
甲烷 点燃,在火焰上方罩一个冷而干燥的小烧杯,再向烧杯内倒入澄清石灰水,振荡 发出蓝色火焰,烧杯壁上有水珠凝结,石灰水变浑浊 氮气 将点燃的木条插入有关容器内,再倒入澄清石灰水,振荡 木条马上熄灭,石灰水不变浑浊 氯化氢 将湿润的蓝色石蕊试纸放在瓶口 蓝色石蕊试纸变红 通入水里,滴入硝酸银溶液和稀硝酸 生成白色沉淀,不溶解于稀硝酸 水蒸气 通过白色的无水硫酸铜 白色无水硫酸铜变蓝 常见物质的检验 二、物质的鉴别: 根据不同质的特性,用化学方法把两种或两种以上的已知物质一一区别开。鉴别时只需利用某一特征反应,确定某物质的一部分就可达到鉴别的目的。且已知n 种,确定n-1种,则余下的既为可知。 解题的原则是:以最简单的方法,即能用物理方法尽量不用化学方法。用最少的试剂,能不用其它试剂尽量不用。取得最明显的实验现象来加以鉴别和检验。在进行实验时,步骤要严密而清晰;在进行判断时,证据要确凿。 当然在常见物质鉴别题可根据允许使用的试剂的多少分为3种类型: 1、任选试剂的鉴别题:(可用多种试剂) 2、只允许用一种试剂的鉴别题; 3、限制用被鉴物本身作试剂的鉴别题。 物质 使用试剂 现象 酸(H + ) (1)紫色石蕊试液 (2)PH 试纸 (3)加入锌粒或镁条 变红 PH <7 产生可燃性气体 碱(OH - ) 紫色石蕊试液 PH 试纸 无色酚酞试液 变蓝 PH >7 变红 硝酸银溶液和稀硝酸 生成白色沉淀,沉淀不溶于稀硝酸硫酸或可溶性硫酸盐 硝酸钡溶液和稀硝酸 生成白色沉淀,沉淀不溶于稀硝酸碳酸盐 盐酸和澄清石灰水 产生气体,气体能使澄清石灰水变铵盐 氢氧化钠,加热,湿润的红色石蕊试纸。 产生刺激性气味的气体,能使湿润蕊试纸变蓝
第一讲常见物质的检验与鉴别 1.掌握常见物质检验、分离和提纯的方法。2016,卷甲12T; 2.能对常见的物质进行鉴别。2015,卷Ⅰ26T(1)(2) 常见物质的检验[ 学生用书 P236] [ 知识梳理 ] 一、常见阳离子的检验 ①H +、② Fe3+、③ Fe2+、④ Al 3+、⑤ NH +4、⑥ Cu2+、 ⑦N a +、⑧ K +、⑨ Ag + 将上述符合相应现象的离子的代号填入下表: 试剂与方法现象被检离子产生红褐色沉淀② 产生白色沉淀→变为灰绿色→最后变为红褐色③NaOH 溶液开始生成白色沉淀→加至过量沉淀溶解④ 生成蓝色沉淀⑥NaOH 溶液并加热生成可使湿润红色石蕊试纸变蓝的气体⑤KSCN 溶液溶液呈红色②KSCN 溶液→氯水开始无明显现象,再加氯水或双氧水时溶液呈红色③盐酸→稀硝酸生成白色沉淀,且不溶于稀硝酸⑨石蕊试液溶液呈红色①焰色反应火焰呈黄色⑦
火焰呈浅紫色(透过蓝色钴玻璃)⑧二、常见阴离子的检验 ①OH -、② Cl -、③ Br-、④ I-、⑤ SO24-、⑥ SO23-、⑦ CO23-、⑧ HCO -3、⑨ SiO 23-、⑩ AlO -2将上述符合相应现象的离子的代号填入下表: 先加氯化试剂与方法现象 先产生沉淀,后溶解,生成的气体能使品红溶 被检离子品红溶液⑥ 钡溶液,液褪色 再加稀盐品红溶液,澄清先产生沉淀,后溶解,生成的气体不能使品红 ⑦酸,生成石灰水溶液褪色,但能使澄清石灰水变浑浊 的气体分无沉淀生成,生成的气体能使澄清石灰水变浑 澄清石灰水⑧ 别通入 先加氯化钡溶液,再加稀盐酸硝酸银溶液和稀硝酸 浊 产生沉淀,且不溶于稀盐酸 产生白色沉淀,且不溶于稀硝酸 产生浅黄色沉淀,且不溶于稀硝酸 产生黄色沉淀,且不溶于稀硝酸 ⑤ ② ③ ④ 续表 试剂与方法 氯水,四氯化碳 石蕊试液酸碱指示剂 酚酞试液 稀盐酸 现象 下层呈橙色 下层呈紫红色 变蓝色 变红色 生成白色胶状沉淀 生成白色絮状沉淀,盐酸过量时溶解 被检离子 ③ ④ ① ⑨ ⑩ 三、常见气体的检验1.可燃性气体的检验
初中化学常见物质的鉴 别 Company number:【0089WT-8898YT-W8CCB-BUUT-202108】
(一)初中化学物质的检验 1、 气体的检验 [1]氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.? [2]氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.? [3]二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.? [4]氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.? [5]水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气. [6]一氧化碳:在玻璃尖嘴点燃气体,在火焰上方罩一干冷小烧杯,观察烧杯内壁无水珠生成,然后将烧杯迅速倒转,往烧杯中倒入澄清的石灰水,若澄清的石灰水变浑浊,则是一氧化碳. [7] 氮气:将燃烧的木条伸入集气瓶中,木条熄灭,然后向集气瓶中倒入澄清石灰水,石灰水不变浑浊。 2、离子的检验. (1)酸液(H+):⑴用紫色石蕊试液或PH试纸 ⑵活泼金属(如:镁条、锌粒等) ⑶不溶性碱(如:氢氧化铜等) ⑷某些金属氧化物(如:铁锈) [5]碳酸盐(如:碳酸钠等) (2)碱液(OH-):⑴紫色石蕊试液或无色酚酞或PH试纸
⑵某些可溶性盐(如:硫酸铜、氯化铁) (3)盐酸和Cl-:用AgNO3溶液和稀HNO3,若产生白色沉淀,则是氯离子 (4)硫酸和SO42-:硝酸钡溶液Ba(NO3)2和稀硝酸/先滴加稀盐酸再滴入氯化钡BaCl2 区别Cl-和SO42-:先用 Ba(NO3)2溶液再用AgNO3溶液 (5)CO32-:用盐酸和石灰水 (6)铵盐(NH4+):氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口,产生使湿润的红色石蕊试纸变蓝的气体。 (7)Cu2+:用可溶性碱(如:氢氧化钠、氢氧化钙)若产生蓝色沉淀则是铜离子 (8)Fe2+:用可溶性碱(如:氢氧化钠、氢氧化钙)若产生红褐色沉淀则是铁离子 (9)Ca2+:用可溶性碳酸盐(如:碳酸钠)若产生白色沉淀则是钙离子 *相关例题 [1]如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质? [2]检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石? [3]检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。? [4]检验三瓶试液分别是稀HNO3,稀HCl,稀H2SO4?
专题复习物质的检验和鉴别1、常见物质的主要物理特性 (1)固体物质的颜色 ①白色固体:CuSO4、CaCO3、KClO3、NaCl、Ca(OH)2、CaO、MgO、P2O5等。 ②红色固体:Cu、Fe2O3。 ③黑色固体:木炭、CuO、MnO2、Fe3O4、铁粉。 ④黄色固体:S(硫黄)。 ⑤蓝色固体:CuSO4·5H2O。 (2)溶液的颜色 ①蓝色溶液:含Cu2+的溶液。 ②黄色溶液:含Fe3+的溶液。 ③浅绿色溶液:含Fe2+的溶液。 ④紫红色溶液:高锰酸钾溶液。 (3)沉淀的颜色 ①不溶于水也不溶于酸的白色沉淀是:AgCl、BaSO4。 ②不溶于水的蓝色沉淀是Cu(OH)2。 ③不溶于水的红褐色沉淀是Fe(OH)3。 (4)有刺激性气味的气体:SO2、NH3、HCl。 2、常见可燃物燃烧的主要现象 ①在氧气中:a.硫—蓝紫色火焰,产生无色有刺激性气味的气体;b.铁—火星四射,生成黑色固体;c.木炭—发出白光。 ②在空气中:a.镁带—耀眼的白光,生成白色固体;b.红磷—产生大量的“白烟”;c.硫、CO、CH4—蓝色火焰;d.H2—淡蓝色火焰。 3 物 质 检验试剂或方法或装置反应现象结论或化学方程式O2带火星的木条木条复燃氧气能支持燃烧 H2O无水CuSO4无水CuSO4由白色变 成蓝色 CuSO4+5H2O CuSO4·5H2O H2 氧化铜由黑色变成 红色,无水CuSO4变成 蓝色 H2+CuO H2O+Cu CuSO4+5H2O CuSO4·5H2O CO2澄清石灰水澄清石灰 水变浑浊 Ca(OH)2+CO2CaCO3↓+H2O CO 氧化铜由黑色变成 红色,澄清石灰水变 浑浊 CO+CuO Cu+CO2 Ca(OH)2+CO2CaCO3↓+H2O CH4点燃,在火焰上方罩一个冷而干燥的烧杯一 会儿,迅速把烧杯倒过来,向杯内注入澄清 石灰水 烧杯内壁有水珠,石 灰水变浑浊 CH4+2O2CO2+2H2O 4、常见离子的检验方法及现象 物质 检验试 剂、方法 反应现象结论或化学方程式 酸(H+) 紫色石蕊试液紫色石蕊试液变成红色 加入锌粒产生大量气泡,气体能燃烧Zn+H2SO4 ZnSO4+H2↑2H2+O2 2H2O
物质的检验与鉴别专题复习 中考类型:选择题物质检验与鉴别(必考) 中考要求:综合应用:能够分析知识之间联系和区别;能够综合运用知识解决一些简单的化学问题。能根据某些常见物质的性质进行物质的检验、鉴别和净化。 【学习目标】: 1:初步学会离子(物质)的鉴别方法 2:学会利用物质或离子的特性差异来区别物质(离子) 【学习过程】: 壱、构建动场: 现有失去标签的五瓶溶液,分别是氯化铁、硫酸铜、稀盐酸、氢氧化钙、氯化钠溶液中的一种,请同学们设计实验方案,选择适当的方法和试剂把它们区别出来。(要求现象要明显,操作要尽量简便易行) 学生活动一:小组合作交流设计方案。 学生展示:小组展示设计的实验方案、方法。 【归纳总结】:常见物质的检验、鉴别方法。
4 3 学生活动二:【自主学习】重点知识:常见离子的检验 1. 硫酸根离子(SO 2-)的检验 取少量溶液于试管中,先加入 ,观察是否有 ,再 加入 ,观察沉淀是否溶解。 2. 氯离子(Cl -)的检验 取少量溶液于试管中,先加入 ,观察是否有 ,再 加入 ,观察沉淀是否溶解。 3. 碳酸根离子(CO 2-)的检验 在试管中加入Na 2CO 3 固体,然后加入稀盐酸,并把生成的气体通入澄清石灰水,现象
3 4 , 有关的反应方程式: , 小结:碳酸根离子(CO 2-)的检验:取少量固体或溶液于试管中,先 加入 ,观察是否有 ,再把生成的气体通入澄清石 灰水,观察是否有沉淀产生。 4.铵根离子(NH + )的检验 取少量溶液于试管中, 先加入 溶液、加热,闻是否有 气味产生,在试管口放一片湿润的 ,若变 色,则含有 铵根离子。 【典型例题讲解】 1.(07 济南)下列试剂中,能把 KOH 溶液、稀硫酸、CaCl 2 溶液一次鉴 别出来的是( ) A.KCl 溶液 B. K 2CO 3 溶液 C. NaNO 3 溶液 D.稀盐酸 2. (17 济南)某无色溶液 X 是稀盐酸、稀硫酸、NaOH 溶液、Na 2CO 3 溶 液中的一种,取三份等质量的 X 溶液, 向其中分別加入酚酞试液 、
策略23物质检验、鉴别、验证题的解题方法与技巧 金点子: 物质的检验、鉴别与验证,既有相似之处,又有不同之处。 1.物质的检验:要求从两种或两种以上的物质中检验出其中的某一种或几种物质。常通过该物质的特殊性质予以确定。 2.物质的鉴别:为两种或两种以上的物质组合,通过实验予以区别、区分。常通过各种不同物质与某一种物质反应的不同现象予以区别。 3.物质的验证:为一种或一种以上的物质组合,通过实验予以确证,并能回答是还是否。对众多物质的组合,还要考虑验证的先后顺序。 聚宝盆: 1.关于未知溶液两两混合的推断题,一般采用列表法解比较简捷,若未知溶液较多,则注意从现象最明显,最容易推断的物质为突破口,然后再顺藤摸瓜推断出其他未知物质。 2.只允许用一种试剂鉴别的题目,由于限制了试剂的种类,因而也就增加了题目的难度。要熟练解答这类习题,不但要熟练地掌握各类物质的性质和它们与某物质相互反应的规律及实验现象,而且还必须有科学的解题思路。常见的解题思路有以下几种: ①若几种溶液的酸碱性不同时,可选适当的指示剂或pH试纸鉴别。 ②若几种溶液含有不同的阳离子,可考虑用强碱溶液与它们分别反应,根据生成物的颜色、稳定性,及在过量碱液中的溶解情况而加以鉴别。 ③若几种溶液中含有不同的阴离子,可考虑使用强酸,根据生成物的状态、颜色、气味等差别加以鉴别。 ④若几种物质间有的含有相同的阴离子,可考虑用既与相同的阳离子反应,又与相同的阴离子反应的试剂来鉴别。 ⑤若被鉴别物质中有能强烈水解的盐,可考虑用与之能发生双水解反应且与该组中其他物质发生不同反应的盐溶液鉴别。 ⑥鉴别有机物时,若被鉴别物质中含有醛基、羧基,应先考虑用新制得的Cu(OH)2悬浊液鉴别。被鉴别物质中含有酚的,可考虑用Fe3+利用显色反应鉴别。 经典题: 例题1 :(1996年上海高考)下列各组溶液,只要用试管和胶头滴管,不用任何试剂就 可以鉴别的是( ) A.KOH和Al2(SO4)3B.稀H2SO4和NaHCO3 C.CaCl2和Na2CO3D.Ba(OH)2和NaHSO4 方法:将选项中的物质通过互滴分析。 捷径:将一种物质的溶液滴入另一种物质的溶液,或将另一种物质的溶液滴入此种物质的溶液,只有A选项中现象不同,故A选项只要用试管和胶头滴管就能鉴别,选A。 总结:有关不用任何试剂就可以鉴别物质的试题,要注意的是也不可以用焰色反应。 例题2 :(1996年上海高考)检验氯化氢气体中是否混有Cl2,可采用的方法是( ) A.用干燥的蓝色石蕊试纸B.用干燥有色布条 C.将气体通入硝酸银溶液D.用湿润的淀粉碘化钾试纸 方法:利用两种物质的性质不同进行鉴别检验。 捷径:HClO具有漂白性,而Cl2无漂白性。选项A、B在干燥环境下,Cl2并不能转变
物质的检验、鉴别、除杂知识 点 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
初中化学物质的检验 (一)、气体的检验 1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气. 2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气. 3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳. 4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气. 5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气. 6.氯化氢:湿润的蓝色石蕊试纸,若试纸变红,则是氯化氢. 7.水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气. 8.一氧化碳:在玻璃尖嘴点燃气体,在火焰上方罩一干冷小烧杯,观察烧杯内壁无水珠生成,然后将烧杯迅速倒转,往烧杯中倒入澄清的石灰水,若澄清的石灰水变浑浊,则是一氧化碳. (二)、离子的检验 1、酸液(H+):⑴用紫色石蕊试液或PH试纸⑵活泼金属(如:镁条、锌粒等) ⑶不溶性碱(如:氢氧化铜等)⑷某些金属氧化物(如:铁锈) ⑸碳酸盐(如:碳酸钠等) 2、碱液(OH-):⑴紫色石蕊试液或无色酚酞或PH试纸 ⑵某些可溶性盐(如:硫酸铜、氯化铁) 3、氯离子(Cl-):将少量的硝酸银溶液倒入盛有少量待测液的试管中,振荡, 如果有白色沉淀生成,再加入少量的稀硝酸,如果沉淀不消失, 则证明Cl-的存在。 4、硫酸根离子(SO42-):将少量氯化钡溶液或硝酸钡溶液倒入盛有少量待测液 的试管中,振荡,如果有白色沉淀生成,再加入少量的稀硝酸, 如果沉淀不消失,则证明SO42-的存在。 5、区别Cl-和SO42-:先用 Ba(NO3)2溶液再用AgNO3溶液 6、碳酸根离子(CO32-):将少量的盐酸或硝酸倒入盛有少量待测液的试管中, 如果有无色气体放出,将此气体通入盛有少量澄清石灰水的试 管中,如果石灰水变浑,则证明原待测液中CO32-的存在。 7、铵根离子(NH4+):氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管 口,产生使湿润的红色石蕊试纸变蓝的气体。 8、Cu2+:滴加氢氧化钠溶液,若产生蓝色沉淀是铜离子。 9、Fe3+:滴加氢氧化钠溶液,若产生红褐色沉淀是铁离子。 (三)、区别天然纤维(羊毛、蚕丝)和合成纤维:灼烧法,有烧焦羽毛气味的是天然纤维。 (四)相关例题
物质的检验和鉴别 Company number:【0089WT-8898YT-W8CCB-BUUT-202108】
专题复习物质的检验和鉴别1、常见物质的主要物理特性 (1)固体物质的颜色 ①白色固体:CuSO4、CaCO3、KClO3、NaCl、Ca(OH)2、CaO、MgO、P2O5等。 ②红色固体:Cu、Fe2O3。 ③黑色固体:木炭、CuO、MnO2、Fe3O4、铁粉。 ④黄色固体:S(硫黄)。 ⑤蓝色固体:CuSO4·5H2O。 (2)溶液的颜色 ①蓝色溶液:含Cu2+的溶液。 ②黄色溶液:含Fe3+的溶液。 ③浅绿色溶液:含Fe2+的溶液。 ④紫红色溶液:高锰酸钾溶液。 (3)沉淀的颜色 ①不溶于水也不溶于酸的白色沉淀是:AgCl、BaSO4。 ②不溶于水的蓝色沉淀是Cu(OH)2。 ③不溶于水的红褐色沉淀是Fe(OH)3。 (4)有刺激性气味的气体:SO2、NH3、HCl。 2、常见可燃物燃烧的主要现象 ①在氧气中:a.硫—蓝紫色火焰,产生无色有刺激性气味的气体;b.铁—火星四射,生成黑色固体;c.木炭—发出白光。 ②在空气中:a.镁带—耀眼的白光,生成白色固体;b.红磷—产生大量的“白烟”;c.硫、CO、CH4—蓝色火焰;—淡蓝色火焰。 3 物 质 检验试剂或方法或装置反应现象结论或化学方程式O2带火星的木条木条复燃氧气能支持燃烧 H2O无水CuSO4无水CuSO4由白色 变成蓝色 CuSO4+5H2O CuSO4·5H2O H2氧化铜由黑色变成 红色,无水CuSO4变 成蓝色 H2+CuO H2O+Cu CuSO4+5H2O CuSO4·5H2O CO2澄清石灰水澄清石灰 水变浑浊 Ca(OH)2+CO2CaCO3↓+H2O CO 氧化铜由黑色变成 红色,澄清石灰水变 浑浊 CO+CuO Cu+CO2 Ca(OH)2+CO2CaCO3↓+H2O CH4点燃,在火焰上方罩一个冷而干燥的烧杯一 会儿,迅速把烧杯倒过来,向杯内注入澄清 石灰水 烧杯内壁有水珠,石 灰水变浑浊 CH4+2O2CO2+2H2O 4、常见离子的检验方法及现象 物质 检验试 剂、方法 反应现象结论或化学方程式 酸(H+)紫色石蕊试液紫色石蕊试液变成红色 加入锌粒产生大量气泡,气体能燃烧 Zn+H2SO4 ZnSO4+H2↑ 2H2+O2 2H2O 碱 (OH-)无色酚酞试液无色酚酞试液变成红色
《物质的检验鉴别》 1.下列物质可将氢氧化钠溶液与石灰水区分开的是() A.氧气 B.二氧化碳 C.紫色石蕊试液 D.酚酞 2.下列化肥中,利用其物理性质即可与其他化肥区别开来的一种是() A. 硫酸铵 B. 磷矿粉 C. 尿素 D. 硝酸钾 3.下列试剂中,能把稀硫酸、KOH溶液、CaCl 2 溶液一次性鉴别出来的是()A.KCl溶液 B.稀盐酸 C.Na 2CO 3 溶液 D.NaNO 3 溶液 4.下列四组溶液,只用紫色石蕊溶液就能鉴别的一组是()A.NaOH KOH HCl B.NaCl NaOH HCl C.H 2SO 4 HCl NaOH D.NaCl Na 2 CO 3 Na 2 SO 4 5.只用一种试剂就可鉴别NaCl、NH 4Cl、Na 2 SO 4 三种溶液。该试剂是() A.KCl溶液 B.Ba(OH) 2 溶液 C.NaOH溶液 D.NaNO 3 溶液 6.使用下列试剂能将氯化钠、碳酸钠、氯化钡三种溶液鉴别出来的是() A. 稀硫酸 B. 氯化钠溶液 C. 铁片 D. 氢氧化钠溶液 7.下列各组常见的固体物质中,用水不能区分的是() A.NaOH 和 NH 4NO 3 B.CuSO 4 和 Na 2 SO 4 C.Na 2CO 3 和 CaCO 3 D.NaCl 和 KCl 8.只用水一种试剂不能将下列各组固体物质鉴别出来的是() A.CuSO 4和MgSO 4 B.CaCO 3 和CaCl 2 C.NH 4NO 3 和NaC1 D.K 2 SO 4 和Na 2 SO 4 9.鉴别下列各组物质,所选用的试剂不正确的是() A.CO 2和CO:氢氧化溶液 B.NaOH固体和NH 4 NO 3 固体:水 C.硬水和软水:肥皂水 D.NaCl溶液和NaNO 3溶液:AgNO 3 溶液 10.用括号内的物质不能区分的一组是() A. NaCl、NaOH、NH 4NO 3 三种固体 (水) B. K 2CO 3 、Na 2 SO 4 、BaCl 2 三种溶液 (稀硫酸) C. 铁粉、碳粉、氧化铜粉末 (稀盐酸) D. NaOH、NaCl、Na 2SO 4 三种溶液 (酚酞) 11.下列实验方案合理可行的是() 选项实验目的所用试剂或操作方法 A 鉴别稀盐酸、Na 2CO 3 溶液和蒸馏分别滴加无色酚酞溶液,观察颜色
专题复习物质的检验和鉴别 复习目标:初步学会根据某些性质检验和区分一些常见的物质(考试标准要求:理解) 考情回顾:2008 年:5分,20XX年:3分20XX年:2分20XX年:2分 知识要点: 1、物质的检验和鉴别方法和思路:根据特征选试剂、分析现象定结论。 2、物质的检验和鉴别的原则: ①操作简便:能用物理方法鉴别的不用化学方法。能用一种试剂鉴别的不用多种试剂。 ②现象明显:使待检物质的现象对比度较大。 ③防止干扰:鉴别Cl-和SO42-时,只能用BaCl2溶液不能用AgNO3溶液。 3、物质检验和鉴别的步骤: ①取少量样品(有时固体样品需配成溶液);②加入试剂;③观察实验现象;④得出结论。 4、常见物质的主要物理特性 (1)固体物质的颜色 ①白色固体:CuSO4、CaCO3、KClO3、NaCl、Ca(OH)2、CaO、MgO、P2O5等。 ②红色固体:Cu、Fe2O3。 ③黑色固体:木炭、CuO、MnO2、Fe3O4、铁粉。 ④黄色固体:S(硫黄)。 ⑤蓝色固体:CuSO4·5H2O。 (2)溶液的颜色 ①蓝色溶液:含Cu2+的溶液,如:CuSO4溶液、CuCl2溶液、Cu(NO3)2溶液。 ②黄色溶液:含Fe3+的溶液,如:Fe2(SO4)3溶液、FeCl3溶液、Fe(NO3)3溶液。 ③浅绿色溶液:含Fe2+的溶液,如:FeSO4溶液、FeCl2溶液、Fe(NO3)2溶液。 ④紫红色溶液:高锰酸钾溶液。 (3)沉淀的颜色 ①不溶于水也不溶于酸的白色沉淀是:AgCl、BaSO4。 ②不溶于水的蓝色沉淀是Cu(OH)2。 ③不溶于水的红褐色沉淀是Fe(OH)3。 (4)有刺激性气味的气体:SO2、NH3、HCl。 5、常见可燃物燃烧的主要现象 ①在氧气中:a.硫—蓝紫色火焰,产生无色有刺激性气味的气体;b.铁—火星四射,生成黑色固体;c.木炭—发出白光。 ②在空气中:a.镁带—耀眼的白光,生成白色固体;b.红磷—产生大量的“白烟”;c.硫、CO、CH4—蓝色火焰;d.H2—淡蓝色火焰。 6、常见气体的检验方法及现象 物 质 检验试剂或方法或装置反应现象结论或化学方程式 O2带火星的木条木条复燃氧气能支持燃烧 H2O无水CuSO4无水CuSO4由白色 变成蓝色 CuSO4+5H2O CuSO4·5H2O H2 氧化铜由黑色变成 红色,无水CuSO4变 成蓝色 H2+CuO H2O+Cu CuSO4+5H2O CuSO4·5H2O CO2澄清石灰水澄清石灰 水变浑浊 Ca(OH)2+CO2CaCO3↓+H2O CO 氧化铜由黑色变成 红色,澄清石灰水变 浑浊 CO+CuO Cu+CO2 Ca(OH)2+CO2CaCO3↓+H2O
物质的检验与鉴别、分离与除杂专题复习 襄阳2011-2017年中考化学真题知识点考查分布一览表 一、物质的检验与鉴别 物质的检验和鉴别原理:利用物质特殊的物理性质和特殊的化学性质产生的特征现象进行鉴别,其方法是阅读、审查、分析,寻找特征现象,找到突破关键点,得出结论。 1.原则:用最简单的方法,最少的试剂和最明显的现象将物质检验和鉴别开来。 2.思路:首先依据物质特殊的物理性质进行观察、分析、判断,若不能鉴别出来,再利用物质的化学性质继续鉴别。 3.方法: ⑴物理方法 ①看颜色 沉淀:蓝色Cu(OH)2 溶液:含Cu2+的溶液呈蓝色;含Fe2+的溶液呈浅绿色;含Fe3+的溶液呈黄色 固体:黑色CuO、MnO2、Fe3O4、铁粉、碳粉红色:Cu、Fe2O3 ②闻气味:如用闻气味的方法区分白酒和白醋 ③溶解性:如用水区分氯化钙和碳酸钙,氯化钙能溶于水,而碳酸钙不溶于水 ④溶解时的吸放热现象:如:可用水区分硝酸铵固体和氢氧化钠固体,(特别提醒CaO溶于水 时与水反应,也会放热,温度升高,但是是化学方法) ⑤依据磁性区分:如:铁能被磁铁吸引 ⑵化学方法 ①常见气体的检验与鉴别 O2、CO2、H2、CO、CH4等 ②常见物质的水溶液的检验与鉴别 ⅰ.加试剂鉴别:
若物质间有明显的酸碱性差异,可选用石蕊试液、无色酚酞溶液、pH试纸鉴别。 常见离子的检验:H+、OH-、CO32-、Cl-、SO42-、Ba2+ 、NH4+等 ⅱ.不加试剂鉴别:特征现象法;两两混合法:借助产物法 4.日常生活中一些常见物质的鉴别 ①硬水和软水:用肥皂水鉴别 ②棉花、羊毛、合成纤维:点燃或灼烧 ③假黄金和黄金:加稀盐酸 ④常见化肥的鉴别:一看二闻三溶四加碱 二、物质的分离和除杂 物质的分离是将混合物中的各成分分开,得到纯净的各单一成分;物质的除杂是将混合物中的杂质除去,得到想要的物质 1.原则: ⑴不增除掉原杂质而不增加新杂质⑵不减不能减少被提纯物质的量 ⑶易分简便易行,反应后杂质易于分离 2.思路:①除去杂质;②提取原物质 3.方法 ⑴物理方法 ①过滤;②结晶; ③蒸馏;④磁铁吸引 ⑵化学方法:沉淀法、气化法、转化法、中和法、吸收法 基础练习: B1.有三瓶无色无味的气体,分别是氧气、空气、氮气,区别它们最简单的方法是( ) A.分别测定气体的密度B.分别伸入燃着的木条 C.分别滴入澄清石灰水,振荡D.分别滴入紫色石蕊试液,振荡 B2.用经济、简便的方法鉴定无水硫酸铜、碳酸钠、氢氧化镁三种白色固体粉末,应选用的一种试剂是() A. 稀盐酸?B. 紫色石蕊试液C. 水?D. 氢氧化钠溶液 B3.下列四瓶溶液:①硫酸铜;②氯化镁;③氯化钠;④氢氧化钾。不用任何其他试剂,将其鉴别出来的顺序为()
物质的检验和鉴别(教案) 一、知识点睛 1.检验和鉴别 检验:通常是指对一种物质的定性检验,根据物质的特性判断是否是该物质或是否存在该物质。 鉴别:通常指对两种或两种以上的物质进行区别,根据几种物质的不同特征区分各是什么物质。 2.气体的检验和鉴别 初中阶段涉及检验的气体: O2、CO2、H2O、CO、H2、NH3、HCl、CH4等。 注:检验气体要有明显的反应现象,而吸收气体必须尽量 完全吸收。 (1)可直接检验的气体 O2:将带火星的木条伸入集气瓶 CO2:___________________________ H2O:___________________________ NH3:___________________________ HCl:___________________________ (2)需间接检验的气体 CO:转化成CO2进行检验。 H2:转化成H2O进行检验。 CH4:转化成CO2和H2O进行检验。 注:常见转化方法 ①利用可燃性将CO、H2、CH4分别点燃。 ②利用还原性将CO、H2分别与金属氧化物反应。 (3)判断混合气体的成分或验证顺序 结合实验现象对判断出的某成分进行标记: 一定存在(√)、可能存在(不标记)、一定不存在(×)。 验证气体顺序的原则:各成分不能互相干扰。 3.固体或溶液的检验和鉴别 常考类型: (1)判断所用方法是否合理 (2)用外加试剂法 (3)不用外加试剂法 例:FeCl3、HCl、NaOH、MgCl2、NaNO3
①先根据溶液颜色确定一种物质,用它作为鉴别试剂; (如FeCl3) ②用鉴别试剂滴加其他溶液,依据不同现象进行鉴别; (如NaOH、MgCl2) ③借助组内相互反应的产物与组内的某种物质反应进行鉴别。(如HCl) (4)物质成分鉴别 对判断出的某成分进行标记(可参考气体的标记)。 (5)设计实验方案 ①思路 先根据物理性质进行鉴别,然后根据化学性质进一步判断需要加入的试 剂,分别写出对应的现象及结论。 ②操作要点 取少量物质→滴加试剂→描述现象→得出结论。 【附表】常见离子的检验 二、精讲精练 1.
专题复习常见物质的检验和鉴别 一、教学目标: ①了解检验和鉴别的区别。 ②会检验空气、O2、H2、CO2、CO等几种气体。 ③能检验H+、OH-、CO32-、Cl-、SO42-、Cu2+、Fe3+等。 ④掌握检验和鉴别一些常见物质的方法。 二、教学重点: ①掌握检验和鉴别物质的思路和方法。 ②复习归纳一些常见物质的检验和鉴别的方法。 三、教学难点: 掌握检验和鉴别物质的思路。 四、教学准备: 多媒体课件。 五、教学过程: (一)引入 [提问]同学们,现在有个任务,要求你们从班里找出我来,请问你怎样才能把我找出来呢? [学生思考并讨论] [提问]现在,我和某同学在一起,你们能区分出我们两个来吗? [学生思考并讨论] [教师]其实我们今天学习的检验和鉴别就和我们生活中辨别人是一样的。 (二)进行新课 [提问]什么是检验?什么又是鉴别呢? (学生思考) [教师]为确定物质的性质、组成、特征而进行的实验叫检验,即检查并验证。我们一般确定其组成。鉴别为审察辨别,比较才能鉴别。所以我们化学上的鉴别一般是通过比较来区分两种或多种物质。这样看来,他们有很多共同之处,共同之处是什么呢? [学生思考并讨论] [提问]他们又有什么不同呢? [学生思考并讨论] [教师]既然我们在对物质进行检验和鉴别时,都要利用到被检验或鉴别的物质与其他物质的不同特征,当然我们就要了解和掌握这些特征才能可以。下面我们一起来看一下常见物质的特点。 [复习归纳] 1、常见物质的颜色: (1)白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态) (2)黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4 (3)红色固体:Cu、Fe2O3、红磷 (4)硫为淡黄色 KMnO4为紫黑色 (5)溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。(高锰酸钾溶液为紫红色) (5)沉淀(即不溶于水的盐和碱):
专题复习物质的检验和鉴别 1、常见物质的主要物理特性 (1)固体物质的颜色 ①白色固体:CuSO4、CaCO3、KClO3、NaCl、Ca(OH)2、CaO、MgO、P2O5等。 ②红色固体:Cu、Fe2O3。 ③黑色固体:木炭、CuO、MnO2、Fe3O4、铁粉。 ④黄色固体:S(硫黄)。 ⑤蓝色固体:CuSO4·5H2O。 (2)溶液的颜色 ①蓝色溶液:含Cu2+的溶液。 ②黄色溶液:含Fe3+的溶液。 ③浅绿色溶液:含Fe2+的溶液。 ④紫红色溶液:高锰酸钾溶液。 (3)沉淀的颜色 ①不溶于水也不溶于酸的白色沉淀是:AgCl、BaSO4。 ②不溶于水的蓝色沉淀是Cu(OH)2。 ③不溶于水的红褐色沉淀是Fe(OH)3。 (4)有刺激性气味的气体:SO2、NH3、HCl。 2、常见可燃物燃烧的主要现象 ①在氧气中:a.硫—蓝紫色火焰,产生无色有刺激性气味的气体;b.铁—火星四射,生成黑色固体;c.木炭—发出白光。 ②在空气中:a.镁带—耀眼的白光,生成白色固体;b.红磷—产生大量的“白烟”;c.硫、CO、CH4—蓝色火焰;d.H2—淡蓝色火焰。 3、常见气体的检验方法及现象 物 质 检验试剂或方法或装置反应现象结论或化学方程式 O2带火星的木条木条复燃氧气能支持燃烧 H2O无水CuSO4无水CuSO4由白色 变成蓝色 CuSO4+5H2O CuSO4·5H2O H2氧化铜由黑色变成 红色,无水CuSO4变 成蓝色 H2+CuO H2O+Cu CuSO4+5H2O CuSO4·5H2O CO2澄清石灰水澄清石灰 水变浑浊 Ca(OH)2+CO2CaCO3↓+H2O CO 氧化铜由黑色变成 红色,澄清石灰水变 浑浊 CO+CuO Cu+CO2 Ca(OH)2+CO2CaCO3↓+H2O CH4点燃,在火焰上方罩一个冷而干燥的烧杯一 会儿,迅速把烧杯倒过来,向杯内注入澄清 石灰水 烧杯内壁有水珠,石 灰水变浑浊 CH4+2O2CO2+2H2O 物质 检验试 剂、方法 反应现象结论或化学方程式 酸(H+)紫色石蕊试液紫色石蕊试液变成红色
物质的检验与鉴别、分离与除杂(2015) 1.(2015?济南)下列各组物质的鉴别中,所选的鉴别试剂,不正确的是() 待鉴别的物质鉴别试剂 A 氧气、二氧化碳、空气燃着的木条 B 氯化铵固体和氯化钠固体氢氧化钠溶液 C 氢氧化钠溶液和碳酸钠溶液酚酞试液。 D 稀盐酸和稀硫酸 BaCl2溶液 2、(2015 廊坊)只用一种试剂就可鉴别NaCl、NH4Cl、Na2CO3三种溶液,该试剂是() A.KCl溶液B.Ba(OH)2 溶液。C.NaOH溶液D.NaNO3溶液 3.((2015?湖北)下列各组溶液,不用其他试剂无法鉴别的是() A. H2SO4 NaCl Na2CO3 CaCl2 B. HCl NaOH CuSO4 MgSO4 C. Na2CO3 K2SO4 BaCl2 HCl D. NaNO3 HCl CaCl2 KOH。 4、(2015河北)下列实验方案不能达到目的是() A.用Na2SO4除去NaCl中的BaCl2B.用点燃的方法鉴别涤纶和羊毛线C.用点燃的方法除去CO2中的CO. D.用水鉴别NH4NO3和NaOH固体 5、(2015?邯郸)除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是()A.CO〔CO 2〕-通过灼热的氧化铜 B.NaOH〔Ca(OH) 2〕-加入氯化钙溶液 C.CaCO 3固体〔CaO固体〕-高温煅烧 D.Cu粉〔Fe屑〕-磁铁分离。 6、(2015?广州)下列除去少量杂质的方法正确的是() A. Zn粉中含少量的ZnO:加入足量稀H2SO4充分反应后过滤 B. Cu(NO3)2溶液中含少量AgNO3:加入足量Cu屑充分反应后过滤。 C. Na2SO4溶液中含少量H2SO4:加入足量Ba(OH)2充分反应后过滤 D. CaCO3固体中含少量Na2CO3:加入足量稀HCl充分反应后过滤 7、(2013赤峰)由NaCI、CuCl2、Mg(OH)2组成的固体混合物,将其逐一进行分离,可选用的试剂是() A.水氢氧化钠溶液 B.水氢氧化钾溶液稀盐酸 C.水氢氧化钾溶液 D.水氢氧化钠溶液稀盐酸。
专题复习物质的检验和鉴别 知识归纳: 一、物质的鉴别:根据几种物质的不同性质,用实验的方法逐一区别的过程。如果只有两种物质,只要确定了一种,余下的就是另一种物质。 二、鉴别题解题思路: 1.熟悉常见物质(或离子)的特征性质和特征反应; 2. 依据被鉴别物质的性质特征,选择适当的试剂和方法; 3.同步被鉴别出的物质应有一一对应的不雷同的现象; 4. 明确要求,分清无试剂鉴别、一种试剂(一次或多次)鉴别、指定试剂鉴别等 5. 若需连续检验多种物质,要考虑加试剂的顺序、是否存在干扰物质(先验后除)等因素 6. 过程归纳为:一说操作,二说现象,三下结论 三、常见物质和离子 1、常见物质的颜色:(1)白色固体:MgO、P2O5、CaO、NaOH、Ca(OH) 2、KClO 3、KCl、Na2CO3、NaCl;铁黑色、镁为银白色(汞为银白色液态) (2)黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4 (3)红色固体:Cu、Fe2O3、红磷硫为淡黄色KMnO4为紫黑色 (4)溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。(高锰酸钾溶液为紫红色) (5)沉淀(即不溶于水的盐和碱): ①盐:白色沉淀:CaCO3、BaCO3(溶于酸)AgCl、BaSO4(也不溶于稀HNO3) ②碱:蓝色沉淀:Cu(OH)2红褐色沉淀:Fe(OH)3 2、常见离子的鉴别: 证明被鉴别物质是方法现象 H+①滴加石蕊试液,试剂变红;②加Zn、Fe等金属,产生可燃性气体;③碳酸盐,产生能使澄清石灰水变浑浊的气体;④金属氧化物:如带锈的铁钉(铁锈会退去)⑤PH试纸P H<7 OH-①滴加酚酞试液试液变红;②加Cu2+,产生蓝色沉淀; ③加Fe3+,产生红褐色沉淀④PH试纸P H>7 Cl-用硝酸银和稀硝酸(银离子会和氯离子结合成氯化银,生成沉淀,但由于碳酸银也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含氯离子了) SO42- (1)用硝酸钡和稀硝酸(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀硝酸,当没有气体生成时,所检验物质中就含硫酸根离子了) (2)用稀盐酸和氯化钡(钡离子会和硫酸根离子结合成硫酸钡,生成沉淀,但由于碳酸钡也不溶于水,所以要用稀盐酸,同时氯化银也不溶于水,因此要先加稀盐酸,这样,银离子会和氯离子结合成氯化银,生成沉淀,此时溶液中就没有银离子,再加氯化钡,生成沉淀的就只有硫酸钡了) CO32-(1)稀盐酸(当碳酸根离子遇到稀盐酸时,会生成二氧化碳和水,有气体生成时,所检验物质中就含碳酸根离子了)滴加盐酸(HNO3)产生气体通入Ca(OH)2白色沉淀 (2)加入Ca2+、Ba2+有白色沉淀产生 NH4+:碱溶液——有NH3↑。使湿润红色石蕊试纸变蓝 Ag+:用氯化钠(银离子会和氯离子结合成氯化银,生成沉淀) Fe3+:(1)溶液中呈淡黄色 (2)用氢氧化钠(铁离子和氢氧根离子结合成氢氧化铁,生成红褐色沉淀) Fe2+:溶液中呈浅绿色 Cu2+:(1)溶液中呈蓝色 (2)用氢氧化钠(铜离子会和氢氧根离子结合成氢氧化铜,生成蓝色沉淀) Ba2+:用稀硫酸(钡离子会和硫酸根离子结合成硫酸钡,生成不溶于酸沉淀)3、常见物质的鉴别: H2点燃、火焰上方罩干燥小烧杯有水珠出现CO点燃、产生的气体与石灰水反应白色沉淀 CO2石灰水变浑浊O2带水星木条复燃 H2O无水CuSO4,白色变蓝色 CH4点燃可燃,发出蓝色火焰,既有水珠,又有使澄清石灰水变浑浊的气体生成 4、物质鉴别的原则 ①操作简便:能用物理方法鉴别的不用化学方法。能用一种试剂鉴别的不用多种试剂。 ②现象明显:使待检物质的现象对比度较大。 ③防止干扰:鉴别Cl-和SO42-时,只能用BaCl2溶液不能用AgNO3溶液。 5、物质鉴别的思路和方法 ⒈根据物理性质的鉴别⑴观察法 如氯气、氧气、二氧化氮、几种气体和氢氧化铁、硫酸钡、胆矾。根据每组三种物质颜色差异而鉴别。 根据某些物质的挥发性,通过观察来鉴别。如浓盐酸和浓硫酸,浓盐酸挥发而形成酸雾,而浓硫酸不挥发。 ⑵水溶法根据物质的溶解性,溶解于水后产生现象的差异进行鉴别。 如氯化钠、硫酸钡、硫酸铜三种白色粉末可用溶解于水的方法鉴别。 NaCl、CaCO3、CuSO4、NaOH、FeCl3等固体的鉴别,可各取少许加水溶解,不溶解的是CaCO3,能溶解温度无明显变化的是NaCl,能溶解溶液呈兰色的是CuSO4,溶液呈黄色的是FeCl3,能溶解使温度明显升高的是NaOH。 HCl溶液、Na2CO3溶液、Na2SO4溶液、BaCl2溶液的鉴别,可采用将溶液两两混合的方法,其中有一种溶液能同时两次产生沉淀,则该溶液是BaCl2溶液,再可以模仿连锁法,分别鉴别出HCl溶液、Na2CO3溶液、Na2SO4溶液。 ⑶气味法根据物质气味的不同,利用嗅觉来鉴别物质的方法。如氨水、水、酒精、浓盐酸四种液体物质;硫化氢、氮、氨气三无色气体。每组物质均可用气味法鉴别。 (4)一种试剂的鉴别: A. 几种溶液含不同阳离子时,常选用Ba(OH)2溶液或NaOH溶液做鉴别试剂。 B. 几种溶液含不同阴离子时,常选用强酸做鉴别试剂。 C. 几种溶液酸碱性不同时,常选用紫色石蕊做鉴别试剂。 D. 几种物质是金属或金属氧化物时,常选用稀强酸做鉴别试剂。 E. 一种试剂与四种溶液反应时,应是现象对比度大。多数是有沉淀、有气体,既有沉淀又有气体、沉淀颜色不同,无明显现象。 F. 当给定的一种试剂不能鉴别出被检物时,可从已鉴别出的物质中找出一种试剂再鉴别。 (5)不同试剂的鉴别: A. 观察法:根据物理性质中颜色、气味、状态、溶解性等进行鉴别。 B. 热分解法:根据不同物质的热稳定性,利用产物的不同性质特征进行鉴别。 C. 相互作用法:根据两两混合后的不同现象进行鉴别 四、典型例题: 一种物质的鉴别例题1:如何用化学方法鉴别一瓶无色溶液是盐酸? 取该试剂少量于试管中,滴加紫色石蕊试剂,溶液变,则证明溶液中含有离子,再另该试剂少量于试管中,滴加AgNO3溶液有白色沉淀产生,再滴加稀硝酸,沉淀不溶解,则证明溶液中含有离子,则原溶液是盐酸。两种物质的鉴别例题2:有两瓶失去标签的无色溶液,已知它们分别是稀盐酸和稀硫酸,如何区分? 分别取该试剂少量于试管中,滴加BaCl2溶液(或Ba(NO3)2、Ba(OH)2溶液),产生白色沉淀,再滴加稀硝酸,沉淀不溶解,则该溶液是稀硫酸,另一瓶是稀盐酸。 注:当盐酸和硫酸在一起时,要先鉴别出硫酸,因为Ag+遇SO42—得到AgSO4微溶于水,当量稍微多一点时会出现沉淀,产生混淆。 练习:有两瓶失去标签的无色溶液,已知它们分别是氢氧化钠溶液和石灰水,如何区分? 三种物质的鉴别