6APA提炼工艺简介
- 格式:wps
- 大小:20.90 KB
- 文档页数:2

收稿日期:1997-09-08,修回日期:1998-04-16。
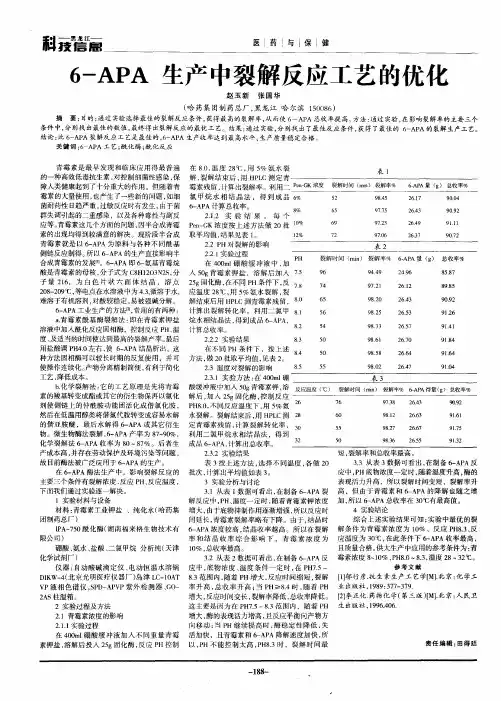
反渗透法回收结晶母液中6-APA曹学君 邬行彦(华东理工大学生化工程系 生物反应器工程国家重点实验室 上海 200237)吴 彤 金科铭(密理博中国有限公司 上海 200002)李明健 黄少坤 谭建德 董超丽(珠海丽珠(集团)合成制药厂 珠海 519030)青霉素裂解液在结晶6-A PA 后,仍残留有013%(W/V )6-APA ,生产厂每天约有15吨6-A PA 结晶母液,若能将母液中残余产品进行回收,每天可多得40kg 以上6-A PA,价值约在19200元以上,每年可得额外产值576万元以上(按300d 计)。
其经济效益十分可观。
反渗透(Reverse osmosis 简称RO)浓缩青霉素裂解液偶见报道[1,2],但RO 浓缩回收结晶母液中6-A PA 尚未见文献记载。
我们利用反渗透技术进行回收6-A PA 的实验,考察了M illipo re 公司RO 膜对产品截留率,杂质通透率,滤过通量,浓缩倍数及浓缩结晶产品质量等指标,整体实验取得了圆满成功。
1 材料与方法111 仪器设备与药品6-APA 购于华北制药厂;6-APA 结晶母液由珠海丽珠合成制药厂提供;Prolab rev erse osmosis system nanomax 50,Nanomax 95RO 膜,美国M illipore 公司;数字式自动旋光仪,上海物理光学仪器厂;电导率仪,上海第二分析仪器厂。
112 分析方法6-APA ,碘量法[3],旋光法[a]D 25=+273b (011mol/L HCl);KCl,NH 4Cl,电导率法。
113 截留率与通透率的测定6-APA 结晶母液中主要成分除6-APA 本身外,对反渗透操作影响最大的为无机盐类,即:NaCl 和K Cl 。
按实际情况分别配制013%6-APA,1mol/L NH 4Cl,0124mo l/L KCl 各4000ml,将6-APA 溶液在全循环操作模式下(如图1)测定保留液和透过液中6-APA 浓度;在浓缩20倍后再测定保留液和透过液的6-APA 浓度,计算截留率;将1mol/L NH 4Cl,0124mol/L K Cl 也进行上述全循环操作,测定保留液与透过液电导率,计算透过率。

6-氨基青霉烷酸的合成6-氨基青霉烷酸(6-Aminopenicillanic acid,简称6-APA)是一种重要的有机合成中间体,也是许多半合成青霉素类抗生素的前体。
青霉素类抗生素广泛应用于临床上,对许多细菌感染具有高效杀菌作用。
而6-APA作为青霉素类抗生素的核心结构,其合成方法的研究对于提高抗生素的产量和质量具有重要意义。
我们可以从天然产物青霉素中提取6-APA。
青霉素是一种由青霉菌属(Penicillium)产生的抗生素,其分子结构中含有β-内酰胺环。
通过对青霉素的水解反应,可以将β-内酰胺环断开,得到6-APA。
这种方法简单直接,但产量较低,且难以控制反应条件,因此不适用于工业生产。
我们可以通过合成方法来制备6-APA。
合成方法主要分为两个步骤:首先是合成青霉素的侧链,然后在侧链上引入氨基基团。
青霉素的侧链通常是由丙氨酸和天冬氨酸等氨基酸组成的。
通过化学合成的方法,可以从这些氨基酸出发,经过一系列的反应,合成出青霉素的侧链。
例如,可以通过酰氯化反应将丙氨酸和天冬氨酸转化为酰氯衍生物,然后通过缩合反应将酰氯衍生物与其他化合物连接起来,最终得到青霉素的侧链。
接下来,在合成的青霉素侧链上引入氨基基团。
最常用的方法是通过酰胺化反应,将侧链上的羧基与氨基反应,生成酰胺。
这个反应可以在碱性或中性条件下进行,产率较高。
另外,还可以通过还原反应将侧链上的羧基还原为醛基,然后与氨基反应生成酰胺。
合成得到的6-APA可以进一步用于合成各种青霉素类抗生素。
通过在6-APA的侧链上引入不同的官能团,可以合成出具有不同抗菌活性和药代动力学特性的青霉素类化合物。
例如,通过在6-APA的侧链上引入苄基和氨基甲酰基,可以合成出青霉素G;通过在6-APA 的侧链上引入丁基和氨基甲酰基,可以合成出青霉素V。
青霉素类抗生素广泛应用于医药领域,对多种细菌感染具有高效杀菌作用。
其中,青霉素G是最早发现的青霉素类抗生素之一,被广泛应用于临床。

1 目的规范阿莫西林车间生产工艺规程,使本产品生产操作过程具有一致性和保证产品质量的均一性,为该产品的生产提供技术标准。
2 范围适用于阿莫西林原料药生产的全过程。
3 责任生产部组织制订,生产车间按要求严格执行,质管部、生产部监督实施。
4 内容4.1 产品概述4.1.1 产品名称:4.1.1.1 法定名称:阿莫西林4.1.1.2 别名:羟氨苄青霉素4.1.1.3 汉语拼音:Amoxilin4.1.1.4 英文名:Amoxicillin4.1.2 产品概述:4.1.2.1 化学名称:(2S,5R,6R)-3,3-二甲基-6-[(R)-(-)-2-氨基-2-(4-羟基苯基)乙酰氨基]-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸三水合物。
4.1.2.2 分子式:C16H19N3O5S·3H2O4.1.2.3 分子量:419.464.1.2.4 结构式:4.1.2.5 理化性质本品为白色或类白色结晶性粉末;味微苦;在水中微溶,在乙醇中几乎不溶。
比旋度+290~+305℃。
4.1.2.6 用途:阿莫西林为青霉素类抗生素,具有抗菌谱广、疗效高、疗程短、安全可靠,毒副作用少、使用方便、使用成本低等特点。
对肺炎链球菌、溶血性链球菌等链球菌属、不产青霉素酶葡萄球菌、粪肠球菌等需氧革兰阳性球菌,大肠埃希菌、奇异变形杆菌、沙门菌属、流感嗜血杆菌、淋病奈瑟菌等需氧革兰阴性菌的不产β内酰胺酶菌株及幽门螺杆菌具有良好的抗菌活性。
阿莫西林通过抑制细菌细胞壁合成而发挥杀菌作用,可使细菌迅速成为球状体而溶解、破裂。
4.1.2.7 包装规格:25Kg/桶。
4.1.2.8 贮藏:遮光,密封保存。
4.2 主要原辅料、包装材料质量标准4.2.1 原辅料酰基转移酶干物质,%14.0~16.0 酶活力,u/g≥800水质符合饮用水标准,其中结晶所用水符合纯化水标准。
4.2.2 包装材料 4.2.2.1 塑料袋无色聚乙烯塑料袋为药用规格,其质量标准符合国家标准GB/T 10005—1998。

6-APA生产三种工艺的比较在上世纪五十年代初期,已发现由于产黄青霉素菌所产生的酰胺酶作用于青霉素形成了青霉素分子的核(即6-APA),后又有人断定当产黄青霉素菌发酵时,发酵液中未加入侧链前体,即可的到这个“核”。
在1958年6-APA全合成成功,1959年Robinson等分离出6-APA,以及发现许多细菌能产生水解苄青霉素成6-APA的酰化酶后,6-APA开始有可能大量生产,并提示6-APA经酰化后可能得到发酵所不能得到的和有用的青霉素衍生物,从而开拓了半合成抗菌素的新领域。
目前工业上去除青霉素侧链裂解成6-APA,主要有微生物酶催化裂解法和化学裂解法。
这两种方法各有特点,究竟采用哪种方法,决定各厂的技术优势。
但随着生物工程技术的迅速发展,采用固定化酶或固定化细胞生产6-APA,不仅工艺大为简化,经济效益明显,且可得到纯度较高的6-APA。
近年来酶法已成为生产6-APA的主流。
化学裂解法:用于工业生产的化学裂解的工艺路线是:在极低的温度下,先将青霉素的羧基转变成硅酯保护起来,再使侧链上的酰胺活化,通过形成青霉素取代亚胺醚衍生物,然后在极温和的条件下,选择性地水解断链成6-APA。
生物酶催化法在自然界中细菌、放线菌、酵母和高等真菌都可以产生青霉素酰化酶。
随着现代生物技术的发展,在酶的菌株改良、发酵自动化、酶的大规模化、酶的固定化、反应器设计、后续工艺等各个领域同时取得进展,青霉素酰化酶用于6APA的制备已经非常成熟。
固定化酶可以重复使用,容易从反应液中分离,可以有效防止对产物的蛋白污染和微生物污染等。
在反应器内加入一定量的固定化酶,把一定浓度的青霉素溶液与固定化酶在搅拌的作用下,使酶和青霉素充分接触。
在酶的催化下,青霉素不断的裂解成6-APA和苯乙酸,溶液的pH值下降,补加一定浓度的氨水使pH值维持在8.0,当pH值不在下降并维持10分钟,到达反应终点。
上述的裂解液中加入一定的甲醇,用盐酸调pH值至4.2,使6-APA结晶析出,然后过滤、干燥得到成品。

青霉素(Benzylpenicillin / Penicillin)又被称为青霉素G、peillin G、盘尼西林.以下我要教大家的制作方法是从别的地方找的,由医学专家肯定过的方法。
还是比较行的。
1。
用米磨成的汁水 + 用山芋磨成的汁水作为培养基溶液(用个小碗)2。
将青霉移植进去(青霉就是找一个已经发霉的食物,上面的霉变物质刮下来就是),等1个星期。
培养中3。
拿一个小瓦罐(市场上有的,你买玻璃杯也可以).用塑料薄膜封住顶部(不要用盖子),在薄膜上剪个小孔,拿一个漏斗,在漏斗里放医用棉花,把培养过的培养液体从棉花上倒下去.(有点像过滤)4。
在那个瓦罐里倒适量(培养液的3倍)的菜种油,搅拌吧~~5.搅拌到最后会发现,罐子里的液体有3层(你看不见的,罐子不是透明的。
)6。
这时候,你要用小勺子慢慢地把上层的油和脂弄掉!(相信你还是分的清什么是油什么是水=0=),只留下底部的水7。
将碳粉(自己弄去)加入罐子,搅拌吧~~8。
碳会吸收青霉成分,罐子里的液体会吸干.9。
取出碳,用蒸馏水(不要用其他水,否则就没用了,回污染的)洗涤碳,注意,一点点就好10.用醋加水混合水洗涤碳11。
用海草汁水洗涤12。
重复步骤3的方法(再买一个瓦罐或者玻璃杯)过滤13.将最后得到的液体分成每100CC一小杯。
等上几天(标号哦,1,2,3,。
)14。
最后一步很难哦!在你的嘘嘘中用棉花棒蘸上少许,分别滴在小杯子的中央15.等待.。
.。
16。
过1 WEEK后,如果看到有一个中央没有青霉,只有周围一环有,就制作成了17.用胶头滴管吸取环中的青霉,就是盘尼西林!!!!!!天然青霉素青霉素G生产可分为菌种发酵和提取精制两个步骤。
①菌种发酵:将产黄青霉菌接种到固体培养基上,在25℃下培养7~10天,即可得青霉菌孢子培养物。
用无菌水将孢子制成悬浮液接种到种子罐内已灭菌的培养基中,通入无菌空气、搅拌,在27℃下培养24~28h,然后将种子培养液接种到发酵罐已灭菌的含有苯乙酸前体的培养基中,通入无菌空气,搅拌,在27℃下培养7天.在发酵过程中需补入苯乙酸前体及适量的培养基。

龙源期刊网
青霉素滤液“直通”6-APA的探索性试验
作者:赵海涛
来源:《科技视界》2012年第07期
【摘要】6-氨基青霉烷酸(6-APA)俗称五侧链青霉素,是青霉素分子的母核。
目前,生产氨苄青霉素及羟氨苄青霉素均使用6-氨基青霉烷酸作为母核,其母核生产过程是由青霉素发酵液→发酵液预处理→一部萃取→碱化反萃取成盐→共沸结晶干燥→溶解→固定酰化酶裂解→萃取→6-APA结晶干燥→生产下游产品。
其生产过程操作单元多,设备庞大,操作工艺复杂。
本文探索了青霉素滤液利用Ultra-flo超滤→SUF卷式超滤→N F卷式纳滤浓缩滤液直通6-APA 生产的可行性,直通工艺将减少溶媒消耗、降低对人体的危害、减轻环保压力,并将减少单元操作,废除庞大的生产设备,对今后的青霉素系列产品的生产起着指导性作用。
【关键词】青霉素滤液;超滤;纳滤;固定酰化酶;6-APA。


6-APA生产三种工艺的比较在上世纪五十年代初期,已发现由于产黄青霉素菌所产生的酰胺酶作用于青霉素形成了青霉素分子的核(即6-APA),后又有人断定当产黄青霉素菌发酵时,发酵液中未加入侧链前体,即可的到这个“核”。
在1958年6-APA全合成成功,1959年Robinson等分离出6-APA,以及发现许多细菌能产生水解苄青霉素成6-APA的酰化酶后,6-APA开始有可能大量生产,并提示6-APA经酰化后可能得到发酵所不能得到的和有用的青霉素衍生物,从而开拓了半合成抗菌素的新领域。
目前工业上去除青霉素侧链裂解成6-APA,主要有微生物酶催化裂解法和化学裂解法。
这两种方法各有特点,究竟采用哪种方法,决定各厂的技术优势。
但随着生物工程技术的迅速发展,采用固定化酶或固定化细胞生产6-APA,不仅工艺大为简化,经济效益明显,且可得到纯度较高的6-APA。
近年来酶法已成为生产6-APA的主流。
化学裂解法:用于工业生产的化学裂解的工艺路线是:在极低的温度下,先将青霉素的羧基转变成硅酯保护起来,再使侧链上的酰胺活化,通过形成青霉素取代亚胺醚衍生物,然后在极温和的条件下,选择性地水解断链成6-APA。
生物酶催化法在自然界中细菌、放线菌、酵母和高等真菌都可以产生青霉素酰化酶。
随着现代生物技术的发展,在酶的菌株改良、发酵自动化、酶的大规模化、酶的固定化、反应器设计、后续工艺等各个领域同时取得进展,青霉素酰化酶用于6APA的制备已经非常成熟。
固定化酶可以重复使用,容易从反应液中分离,可以有效防止对产物的蛋白污染和微生物污染等。
在反应器内加入一定量的固定化酶,把一定浓度的青霉素溶液与固定化酶在搅拌的作用下,使酶和青霉素充分接触。
在酶的催化下,青霉素不断的裂解成6-APA和苯乙酸,溶液的pH值下降,补加一定浓度的氨水使pH值维持在8.0,当pH值不在下降并维持10分钟,到达反应终点。
上述的裂解液中加入一定的甲醇,用盐酸调pH值至4.2,使6-APA结晶析出,然后过滤、干燥得到成品。

6-APA 和7-ACA的生物发酵产业现状及发展趋势王丽君生命基地102班10110202摘要:半合成β-内酰胺抗生素是最常用的抗细菌剂,每年以数百吨的规模生产。
随着新β-内酰胺抗生素合成方法的改进,这种趋势在未来几年将会更加增长。
抗生素通常是通过天然抗生素(青霉素或头孢霉素C)通过水解并以不同的羧酸酰基供体链修饰而生产的,头孢菌发酵得到的头孢菌素C,头孢菌素C在酰胺键处水解得到7-ACA。
青霉素钾盐酶化裂解青霉素得到6-APA。
在传统的化学合成路线中,由于化学试剂污染严重和高能耗,人们正在探寻新的手段来提高抗生素的产量和质量,主要集中在利用生物酶催化合成的方面。
目前主要是通过基因组学、蛋白质组学和分子育种等手段,在抗生素合成中取得了重要进步。
关键词:6-APA 7-ACA 发酵产业现状酶法合成化学合成一、6-APA 和7-ACA的生物发酵现状7-ACA和头孢菌素的合成工艺主要有化学法和酶法两种。
化学半合成技术是目前通用的工艺,主要包括酰氯法和混酐法,化学法合成存在着活化、缩合、保护和去保护的过程,合成过程长、步骤多反应条件苛刻、产生大量的三废等弊端。
而酶法合成工艺与化学法相比,由于具有许多优点,如:生产工艺简单,周期短;反应条件温和,pH接近中性;高度的区域和立体选择性以及无需保护和去保护过程,割除了化学合成中所需的毒害物质;劳动环境得到改善,减少了三废的排放。
因此,用酶法实现7-ACA及头孢菌素的半合成体现了绿色环保工艺的各种优势。
以6-APA为中间体与多种化学合成有机酸进行酰化反应,可制得各种类型的半合成青霉素。
6-APA是利用微生物产生的青霉素酰化酶裂解青霉素g或v而得到。
近年来,酶固相化技术已应用于6-APA生产,简化了裂解工艺过程。
酶法合成和生物催化是未来抗生素合成的主要发展方向。
酶法合成技术始于20 世纪60 年代末70 年代初,经过30 多年的发展,目前酶缩合反应技术、产品分离以及固定化酶技术等方面取得很大的发展,配套技术日益完善,具备了大规模工业化生产的条件,全球著名的ß-内酰胺抗生素生产厂家如荷兰DSM 公司已有酶法合成的商品头孢氨苄、阿莫西林等产品面世。