
绿萝叶片和茎段离体愈伤组织培养及继代培养
三组实验设计方案
1、实验目的
(1)通过本次实验,进一步熟悉配制培养基的流程及操作中应注意的事项,学会设计和
筛选绿萝愈伤组织诱导培养基配方。
(2)通过本次实验,能够熟练掌握外植体的表面消毒技术和无菌操作技术。
(3)通过本次实验,能够熟练掌握愈伤组织继代培养的基本操作技术,进一步熟悉、规范无菌操作技术。
2、实验流程
配置绿萝叶片和茎段愈伤组织诱导培养基 接种绿萝叶片和茎段诱导愈伤组织
产生 配置绿萝叶片和茎段愈伤组织增殖培养基 接种绿萝叶片和茎段愈伤组织进行增殖 实验结果观察记录
3、实验设备及材料
(1)实验用具和仪器
冰箱、普通天平、三角瓶、移液管、量筒、烧杯、容量瓶、玻璃棒、陶瓷缸、精密pH 试纸(pH5.4~7.0)、药勺、称量纸、标签纸、封口膜、橡皮筋、棉线、电炉、高压蒸汽灭菌锅、电磁炉等。
酒精棉球、小块纱布、已灭菌滤纸、枪状镊子、手术剪、解剖刀、已灭菌培养皿、酒精灯、超净工作台、恒温培养箱、100ml 三角瓶、1000ml 搪瓷杯、50ml 量筒、1ml 、2ml 、5ml 、10ml 吸管等。
(2)药品和试剂:
MS 培养基母液配制试剂、琼脂、蔗糖、生长调节物质、蒸馏水、1mol ·L -1HCl 、1mol ·L -1
NaOH 、绿萝叶片和茎段组织诱导培养基、无菌水、75%酒精、0.1%HgCl 2,、愈伤组织继代培养基、蒸馏水等。
(3)材料:绿萝叶片和茎段
4、外植体选择
绿萝,属天南星科,是常绿藤植物。枝繁叶茂,嫩绿有光泽,有极好的观赏价值。还能吸附和去除室内空气中的甲醛、苯、三氯乙烯等污染物,是天然的“空气净化器”。叶片光滑无绒毛,用作植物组培外植体时消毒较容易。
5、培养基及配制
绿萝叶片诱导愈伤组织的培养基:MS+6-BA 3.0 mg/L+NAA 0.3 mg/L 绿萝茎段诱导愈伤组织的培养基:1/2MS+6-BA 3.0 mg/L+NAA 0.4 mg/L+2,4-D0.8 mg/L
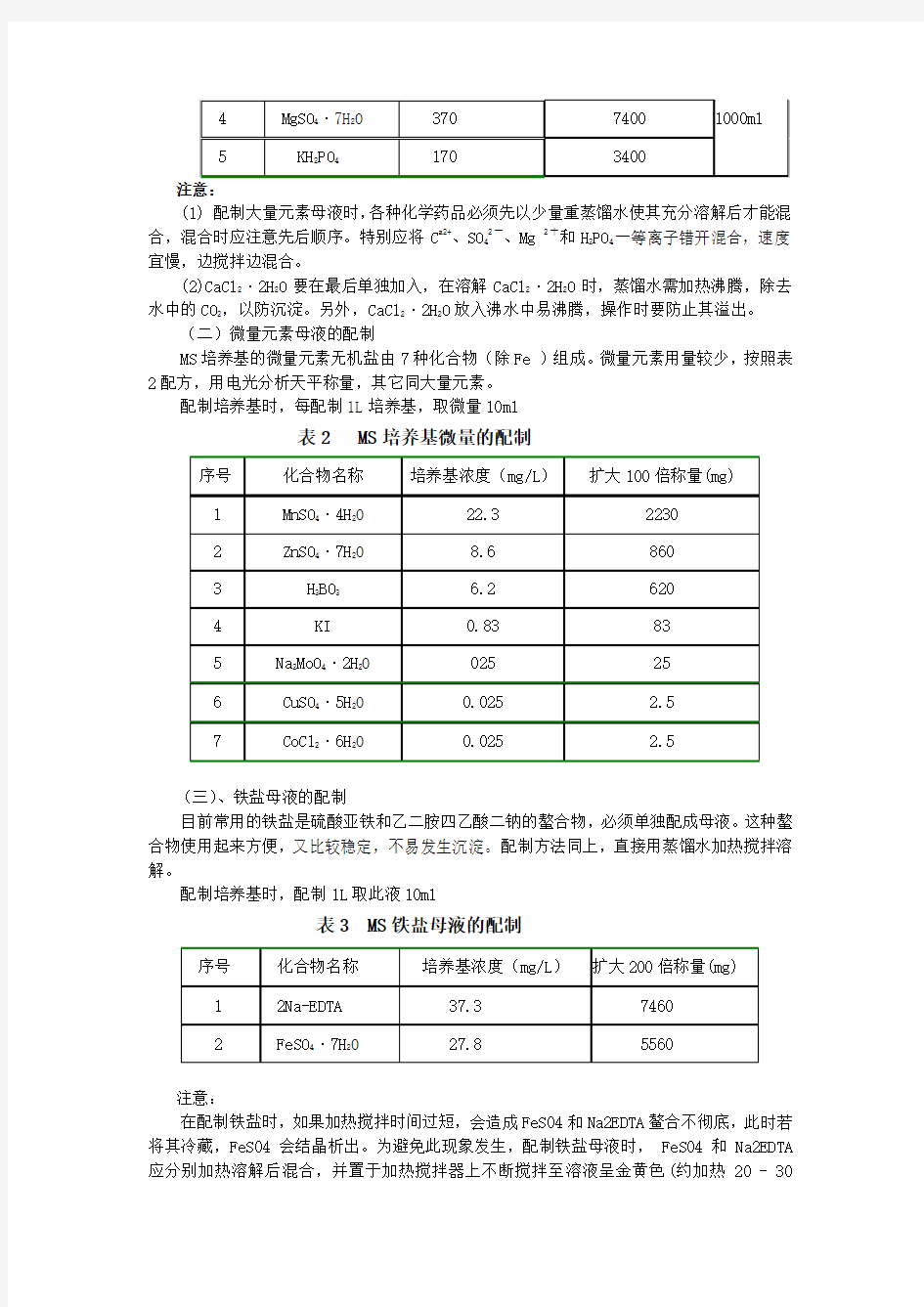
愈伤组织分化的培养基:MS+6-BA 2.0 mg/L+NAA 0.5mg/L 生根培养基:1/2MS+6-BA 0.1 mg/L+IBA 0.2mg/L (一)大量元素母液制备
表1 MS 培养基大量元素母液制备
序号 药品名称 培养基浓度(mg/L ) 扩大20称量(mg)
1 NH 4NO 3 1650 33000 蒸馏水定容
至
2 KNO
3 1900 38000 3
CaCl 2·2H 2O
440
8800
4 MgSO4·7H2O 370 7400 1000ml
5 KH2PO4170 3400
注意:
(1) 配制大量元素母液时,各种化学药品必须先以少量重蒸馏水使其充分溶解后才能混合,混合时应注意先后顺序。特别应将C a2+、SO42一、Mg 2十和H2PO4一等离子错开混合,速度宜慢,边搅拌边混合。
(2)CaCl2·2H2O要在最后单独加入,在溶解CaCl2·2H2O时,蒸馏水需加热沸腾,除去水中的CO2,以防沉淀。另外,CaCl2·2H2O放入沸水中易沸腾,操作时要防止其溢出。
(二)微量元素母液的配制
MS培养基的微量元素无机盐由7种化合物(除Fe )组成。微量元素用量较少,按照表2配方,用电光分析天平称量,其它同大量元素。
配制培养基时,每配制1L培养基,取微量10ml
表2 MS培养基微量的配制
序号化合物名称培养基浓度(mg/L)扩大100倍称量(mg)
1 MnSO4·4H2O 22.3 2230
2 ZnSO4·7H2O 8.6 860
3 H3BO3 6.2 620
4 KI 0.83 83
5 Na2MoO4·2H2O 025 25
6 CuSO4·5H2O 0.025 2.5
7 CoCl2·6H2O 0.025 2.5
(三)、铁盐母液的配制
目前常用的铁盐是硫酸亚铁和乙二胺四乙酸二钠的螯合物,必须单独配成母液。这种螯合物使用起来方便,又比较稳定,不易发生沉淀。配制方法同上,直接用蒸馏水加热搅拌溶解。
配制培养基时,配制1L取此液10ml
表3 MS铁盐母液的配制
序号化合物名称培养基浓度(mg/L)扩大200倍称量(mg)
1 2Na-EDTA 37.3 7460
2 FeSO4·7H2O 27.8 5560
注意:
在配制铁盐时,如果加热搅拌时间过短,会造成FeS04和Na2EDTA鳌合不彻底,此时若将其冷藏,FeS04会结晶析出。为避免此现象发生,配制铁盐母液时, FeS04和Na2EDTA 应分别加热溶解后混合,并置于加热搅拌器上不断搅拌至溶液呈金黄色(约加热20 - 30
min),调pH值至5 .5,室温放置冷却后,再冷藏。
(四)有机母液的配制
MS培养基的有机成分有甘氨酸、肌醇、烟酸、盐酸硫胺素和盐酸吡哆素。培养基中的有机成分原则上应分别单独配制。配制直接用蒸馏水溶解,注意称量时用电子分析天平。
表4 MS培养基有机物质母液的制备
培养基浓度
扩大倍数称量(mg) 序号化合物名称
(mg/L)
1 甘氨酸
2 100 200
2 肌醇100 100 10000
3 盐酸硫胺素(VB1) 0.
4 100 40
4 盐酸吡哆素(VB6) 0.
5 100 50
5 烟酸0.5 100 50
6、培养基的配制步骤
(1)计量
根据配制培养基的量和母液的浓度计算需要吸取母液的量,计算公式:吸取量 ml=培养基中物质的含量(mg/L)×1000ml/母液浓度(mg/L)。
(2)根据培养基配方,用量筒或移液器量取所需要的各种元素的母液。
物质加入体积或重量
大量元素母液(20×) 50ml
微量元素母液(100×) 10 ml
有机物质母液(100×) 10 ml
铁盐母液(200×) 5 ml
蔗糖30 g
琼脂 6 g
注意:
①在使用提前配制的母液时,应在量取各种母液之前,轻轻摇动盛放母液的瓶子,如果发现瓶中有沉淀、悬浮物或被微生物污染,应立即淘汰这种母液,重新进行配制。
②用量筒或移液管量取培养基母液之前,必须用所量取的母液将量筒或移液管润洗2次。
③量取母液时,最好将各种母液按将要量取的顺序写在纸上,量取1种,划掉1种,以免出错;
④移液管不能混用。
(3)称取6g琼脂,30g蔗糖备用
(4)融化
将装有各母液的量杯倒入600~700ml的蒸馏水放在电炉上,加入琼脂,边加热边用玻璃棒搅拌,直到液体呈半透明状将其取下,加入蔗糖,蒸馏水定容到1000ml。
(5)调pH
用滴管吸取物质的量浓度为1 mol/L的NaOH或HCl溶液,逐滴滴入溶化的培养基中,边滴边搅拌,并随时用精密的pH试纸(5.4~7.0)或酸度计测培养基的pH,一直到培养基的pH达到要求为止(在调制时要比目标pH值偏高0.2~0.5个单位,因为培养基在灭菌过程中由于糖等物质的降解,pH值会下降0.2~0.5个单位左右)。
注意:
调至时要用玻璃棒不停的搅拌,使其充分混合。
激素应在调节pH之前加入,因为有些激素是用酸或碱溶解的,在调节pH好之后加入会改变pH值。pH过酸或过碱对培养基均是不利的,会导致过软或过硬的结果,从而影响培养质量。
(6)分装
溶化的培养基应该趁热分装。分装时,锥形瓶中培养基的量约为锥形瓶容量的1/5~1/4。每1L培养基,可分装25~30瓶。
(7)灭菌
培养基各母液或MS培养即可高压蒸汽灭菌。
培养基中某些成分是热不稳定的,需要进行过滤灭菌。例如一些生长因子,如赤霉素(GA)、玉米素、脱落酸、尿素和某些维生素是不耐热的,不能用高压灭菌处理,通常采用过滤灭菌方法。先将除去了不耐热物质的培养基其它成分经高压灭菌后置于超净工作台上冷却至40℃,再将过滤灭菌后的该化合物按计划用量依次加入,摇匀,凝固后即可使用。
7、植物材料的表面灭菌和接种
A.操作人员洗手消毒
B.装材料的容器及玻璃棒用酒精表面消毒
C.将待消毒的绿萝材料水流冲洗20min,浸入75%的酒精中30秒,取出转入无菌水冲洗
干净。(酒精单独一个杯子装,消毒完毕转下一组使用)
D.将无菌水倒出,并倒入0.1 %HgCl2 消毒剂并计时10分钟;(同一瓶子中操作即可,但
注意不要碰到瓶口等关键部位),倒出消毒液,并用无菌水清洗4遍,保证消毒液全部清洁干净。
E.将洗净的材料用灭过菌的镊子夹出,放到干净的滤纸上吸干水分,并在滤纸上操作后续
步骤;
F.将叶片切成0.5cm×0.5cm小块(接种时,叶片背面贴着培养基),茎段切成0.5-1.0cm
小段接种到配制好的培养基中。(每瓶培养基放2-4块材料即可,材料不要过于集中) I. 封口膜封好后,培养。
培养条件:温度(25±1)℃,每天光照12 h,以下培养条件均同。
8、愈伤组织诱导分化不定芽及生根培养
(1)继代培养前的准备——接种室的消毒与灭菌,超净工作台的灭菌,接种工具的消
毒灭菌以及实验材料的准备
(2)愈伤组织继代培养
将上述培养好的愈伤组织在无菌条件下接种到愈伤组织分化的培养基:MS+6-BA 2.0 mg/L+NAA 0.5mg/L和生根培养基:1/2MS+6-BA 0.1 mg/L+IBA 0.2mg/L中,封好封口膜,25℃培养,以后每天观察愈伤组织变化以及是否有污染。
9、注意事项
(1)玻璃器皿的洗涤与消毒灭菌。
(2)天平的使用称量要准确,以保证配方中各组分的含量是准确的
(3)灭菌前检查锅内是否有足够的水,装锅不可过满。
(4)为了保证灭菌彻底,在蒸气灭菌锅增压前应先将灭菌锅内的冷空气放尽。
(5)培养基消毒灭菌时间不宜过长,也不可超过灭菌锅规定的压力范围;否则,培养基中的蔗糖、有机物质,特别是维生素类物质就会分解,导致培养基变质、变色,甚至难以凝固。当灭菌完成后,应切断电源或热源,待灭菌锅内气压接近“0”时,方可打开放气阀,拧开灭菌锅盖取出培养基。切勿为急于取出培养基而打开放气阀放气,否则锅内气压下降太快会引起减压沸腾,导致灭菌锅内各容器中的培养基溢出,造成浪费或污染,甚至烫伤工作人员。(6)操作前要洗手消毒、操作器械要灭菌,使用时可用酒精消毒和灼烧灭菌
(7)接种时和封口时在酒精灯前操作
(8)封口膜一定要绑好
植物组织培养技术 植物组织培养是指将植物体的一部分接种在合成培养基上,使其按照预定目标生 长发育成新植株。近年来,花卉组织培养及快繁脱毒技术越来越多地应用于花卉种苗 繁殖生产中。 一、组织培养在花卉产业中的应用 1.快速、大量繁殖优良品种组织培养技术已成为种苗生产的主要技术之一。经组织 培养,可增加繁殖系数,加快繁殖速度,可生产出种性纯、品质好、产花量高的生产 性用苗。在花卉育种过程中,不断的杂交、选种极大地扩展了花卉的花形与颜色,使 得花卉在各方面都越来越接近人们的需求。但在同时,也造成了花卉基因类型的高度 异质化———子代不易有均一表现。而组培苗是在母株器官、组织或细胞的基础上发展起来的,可以保持母株的全部特性(花形、花色、株形、开花习性、抗逆性等), 因而可以根据需要来选择集多种优良性状于一体的植株加以分生,从而得到大量与母 株一模一样的植株。 2.培育脱毒苗木采用组织培养技术,利用植株的分生组织不易感染病毒的原理,可 以对花卉植株的分生组织进行组织培养来繁殖苗木,防止亲代植株的病害传递给子代,从而达到脱毒的目的。 病毒病对长期应用营养繁殖(分株、扦插等)的观赏植物及其生产的危害相当严重。由于观赏植物多采用营养繁殖,如嫁接、分株、压条等方法繁殖时,病毒(及类 病毒)则通过营养体及刀具、土壤传递给后代,大大加速了病毒病的传播与积累,导 致病毒病的危害越来越严重。据统计,观赏植物的病毒已多达100多种,并且逐年有 新增病毒的报道。观赏植物因病毒病大大影响其观赏价值,表现在康乃馨、菊花、百合、风信子等的鳞茎、球茎与宿根类花卉及兰科植物等严重退化,花少且小,花朵畸形、变色,大大影响观赏价值,严重者甚至导致某些品种的灭绝,严重制约观赏植物 生产的发展,这也是我国切花品种跨不出国门的原因之一。组培快繁技术已应用到蝴蝶兰的栽培中非洲菊也可以通过组培快繁技术进行繁殖 植物组织培养脱毒的原理主要是利用茎尖分生组织不带毒或少带毒。感病植株体内的病毒分布不均匀,其数量随植株部位和年龄而异,越靠近茎尖顶端的区域,病毒 的浓度也越低。分生区域无维管束,病毒只能通过胞间连丝传递,赶不上细胞不断分 裂和活跃的生长速度,因此生长点含有病毒的数量极少,几乎检测不出病毒。因此, 茎尖培养时,切取茎尖的大小对脱毒效果有很大影响,茎尖越小效果越佳,但太小时 不易成活,过大则不能保证完全除去病毒。不同种类的植物和不同种类的病毒在茎尖
1.植物组织培养(离体培养):是指在无菌条件下,将植物体的任何一部分,培养在人工配制的培养基上,并给予合适的培养条件,使之发育形成完整植物体的过程。 2、植物组织培养的类型 (1)根据培养基的类型分为: 固体培养液体培养半液半固体培养 (2)根据培养材料(外植体类型)分为: 植株培养器官培养组织培养原生质体培养胚胎培养细胞培养 (3)按培养过程分: 初代培养继代培养生根培养 3、植物组织培养的一般工作流程 1.准备阶段:(1)查阅资料,制定培养方案;(2)清洗组培用器皿、工具; (3)配制所需试剂和培养基;(4)试剂、培养基及器皿、工具的灭菌。 2.外植体的选择与消毒; 3.初代培养; 4.继代培养; 5.生根培养; 6.炼苗移栽 4、植物细胞的全能性概念:指植物体的每个活细胞都携带有该物种的全套遗传信息,在适宜条件下,离体细胞都具有发育为一个完整植株的潜在能力。 注意:(1)活细胞(2)离体细胞(3)细胞全能性表达的难易程度取决于细胞的分化程度 5、细胞全能性的强弱表现: (1)植物细胞全能性根据细胞的性质不同由强到弱:营养生长中心>形成层>薄壁细胞>厚壁细胞(木质化细胞)>特化细胞(导管等) (2)植物细胞全能性根据所处的组织不同由强到弱:顶端分生组织>侧生分生组织>居间分生组织>薄壁组织>厚角组织>输导组织>厚壁组织 6、植物组织培养中全能性表达的条件: 1.无菌条件; 2.离体条件; 3.一定的营养物质; 4.植物生长调节物质; 5.适宜的外界条件。 7、胚性细胞的特点:未分化状态;细胞具有旺盛分裂能力;具有两极性 8、脱分化:指在一定条件下,已分化成熟的细胞、组织或器官恢复到未分化的分生状态,并进行细胞分裂形成未分化的细胞团,如愈伤组织的形成过程。 9、愈伤组织形成的三个时期: (1)诱导期又称启动期(最难)。(2)分裂期(3)分化期 10、优良愈伤组织的特征: (1)具有旺盛的增殖能力;(2)容易散碎;(3)具有高度的胚性或再分化能力,便于植株再生;(4)经过长期的继代保存而不丧失胚性。 11、再分化:指一定条件下,脱分化的细胞或组织转变为具有一定结构、执行一定功能的细胞团和组织,并进一步形成完整植株的过程,即由愈伤组织再生形成完整植株的过程。 12、植物形态建成的途径——全能性的实现途径——植物分化成苗的类型 (1)器官发生型(2)胚状体发生型(3)原球茎发生型(4)芽再生型 13、高压蒸汽灭菌锅——湿热灭菌灭菌要求:0.105 MPa的压力下,锅内温度达121℃,保持20~30min 干热灭菌:要求:160~170℃,1~2h,如有玻璃器皿则必须待温度降至50℃时,才能打开烘箱门,以防温度骤降玻璃破碎。 过滤灭菌:细菌过滤器、注射器,适用于高温高压下易分解的试剂,主要是植物生长调节物质,如IAA、GA3、ZT的灭菌。 14、培养基成分(1).大量元素:包括:N、P、K、Ca、Mg、S、Cl等。 (2)微量元素:包括Fe,B,Mn,Cu,Zn,Mo,Co等。 15、植物生长调节剂: (1)生长素类:常用吲哚乙酸(IAA)、吲哚丁酸(IBA)、萘乙酸(NAA)、 2,4-二氯苯氧乙酸(2,4-D) (2)组培中的作用:①促进细胞伸长;②促进生根;③诱导愈伤组织的形成;
植物组织培养:是指在无菌和人工控制的环境条件下,利用人工培养基,对离体的植物胚胎、器官、组织、细胞及原生质体进行培养,使其再生细胞或完整植株的技术。又称为植物离体培养 离体生态学:是指研究离体培养环境条件控制的科学,其研究对象是培养基、植物材料和人工环境条件 外植体:用于离体培养的那部分植物器官、组织或细胞 愈伤组织(callus):是指外植体因受伤或在离体培养时,其细胞进行活跃的分裂增殖而形成的一种无特定结构和功能的组织 植物组织培养的特点 1.组培技术是无菌操作技术。 2.组培材料处于完全的异养状态。 3.组培材料可以是离体状态的器官、组织、细胞或原生质体。 4.组织培养物可以形成克隆(clone,无性繁殖系),也可以进行茎芽增殖或生根 5.组培容器内的气体和环境气体可通过封口材料进行交换,相对湿度通常是几乎100%,因此,组培苗叶片表面一般都无角质层或蜡质层,且气孔保卫细胞功能缺乏,气孔始终都是张开的。 6.组培的环境温度、光照强度和时间都是人为设定的,其参数可调 植物组织培养的研究类型 组织培养 器官培养 胚胎培养 细胞培养 原生质体培养 植物组织培养的研究任务 研究离体培养条件下,细胞、组织或器官所需营养条件和环境条件,细胞、组织或器官的形态发生和代谢规律,植物脱毒方法和机理,植物特别是一些难繁植物的大量快速繁殖方法,细胞融合方法和机理,再生个体的遗传和变异,种质资源的离体保存机理和方法等 德国植物学家Schleiden和动物学家Schwann于1838-1839年提出的细胞学说 德国植物学家Haberlandt于1902年提出了植物细胞具有全能性 李继侗和沈同1933年成功培养了银杏的胚。 1952年,Morel和Martin提出了植物脱毒(virus free)技术 Guha和Maheshwari等——花药培养 Cocking等-原生质体培养
植物无糖组培快繁技术 一、无糖组培技术原理 无糖组培快繁技术是由日本千叶大学的古在丰树教授上世纪八十年代末发明。它是一种全新的植物组织培养技术,是环境控制技术和组织培养技术的有机结合。它以CO2代替糖作为植物体的碳源,利用工程技术手段调节组培微环境的空气、光照、温度、湿度等影响因子,促进植物光合作用,使组培植物由兼养型转变为自养型,从而促进植物的生长发育。 经大量实验研究证明,该项研究成果已成为世界领先技术。目前,中国、美国、英国、韩国等国家已将该项技术应用于种苗工业化生产中。该技术于1997年由国家外国专家局和昆明市科技局委托昆明市环境科学研究所从日本引进。 二、无糖组培技术优势 由于植物无糖组培以CO2代替糖作为植物体的碳源,对植物无糖组培微繁殖中的容器换气次数、光照强度、CO2浓度、培养基质、植物生长调节剂进行调节,并通过监测反馈结合植株生长特性建立符合植株生长要求的稳定供气系统和温度调控系统,从而解决了传统组织培养中存在的污染率高、植物生长发育不良、生长迟缓、生理功能紊乱、玻璃苗、畸形苗多等问题。据相关资料报道,无糖组培快繁技术与传统的植物组织培养技术相比,显著提高苗的质量和产苗率,可缩短培养周期,种苗生产综合成本降低。经大量实验研究证明,该项
研究成果已成为世界领先技术。 无糖组培生产工艺简单,流程缩短,技术和设备的集成度提高,降低了人工操作强度,更易于在规模化生产上推广应用。 三、无糖组培技术国内外研究进展 无糖组培快繁技术通过多年的试验研究和生产示范,在引进消化吸收国外先进技术的基础上,结合国情,昆明市环境科学研究所研制开发了无糖培养微繁殖生产的配套设施,获得三项专利。 目前,该项技术已初步应用于非洲菊、彩色马蹄莲、灯盏花、甘薯、葡萄、满天星等植物并获得成功。上述研究结果表明,无糖组培技术培育出的苗具有抽叶多、植株健壮、节间距短、根系发达、干物质积累多、光合自养能力强等优良的生物学性状。美国、韩国、英国、日本等国家已将该项技术应用于生产,并显示出了巨大的优势和良好的效果。 无糖组培快繁技术可解决传统组织培养中存在的诸多问题,显著提高种苗质量,缩短培养周期,提高产苗率,降低生产成本。但目前,该项技术在药用植物方面的应用研究,除云南农大王荔课题组报道外尚未见其它报道。
园艺植物组培育苗技术分析 发表时间:2018-11-14T16:23:14.937Z 来源:《建筑学研究前沿》2018年第22期作者:邓伟斌 [导读] 组培育苗,即组织培养育苗技术,其属于一种典型的生物技术,其应用范围很广。 广东美景园林建设有限公司 516000 摘要:在社会发展进程中,园林工程成为重要的项目之一,旨在为改善当前城市环境污染严重的现状,净化城市空气,为人们提供一个优质的生活环境,是促进城市可持续发展的重要举措。园林工程建设体系中,组培育苗技术不断衍生,其是园艺植物培育的一种重要途径,该种技术所产生的培育效果甚为理想。对此,在此次研究中,我们以广东地区园艺植物组培育苗技术为对象展开系统化的分析,旨在提高城市园林植物培育水平。 关键词:园艺植物;组培育苗;技术 组培育苗,即组织培养育苗技术,其属于一种典型的生物技术,其应用范围很广,其所产生的价值意义是不可替代的,其是种苗工厂化、规划化生产的主要方式。现如今,植物脱毒技术、离体快繁技术等逐步被应用到草莓、马铃薯与兰花等植物育苗之中,获取了理想的培育效果,这对于我国苗木快繁与肿瘤脱毒而言意义重大。以下我们就组织培育苗产业的基本发展现状展开分析。 一、组织育苗产业发展现状分析 关于组培育苗的研究,最早的研究起源于美国。1943年,美国的专家与学者展开了系列的分析与研究,从中发现,植物生长点周边的病毒浓度比较低,甚至很多区域根本没有病毒[1]。在此基础上,专家们利用植物的茎尖开展组织培养,获得了脱病毒苗,主要是利用脱毒苗来实现快速繁殖,进而生产出大量的脱毒种苗。1958年,我国的相关专家彭爱红等展开了研究,提出胡萝卜的韧皮部细胞培养得到了完整植株,且该植株可以开花结果,进而使得该技术逐步被应用到农业生产领域,其推广效果甚佳。 在我国,关于无病毒种苗与植物快速繁殖的研究最早开始于上世纪70年代。鉴于组织培养技术的繁殖系数比较大,且繁殖速度比较快,以获得无病毒性的植株,且获得了极高的经济效益。如今,组培育苗技术在我国得到了广泛的应用,其在育种、育苗等方面均取得了理想的效果。兰花是我国十大名花之一,其在广东地区的种植规模很大,广西省百色市乐业县与那坡县、广东省韶关市翁源县、广东省佛山市顺德区等被誉为“中国兰花之乡”。组培育苗技术在兰花种苗生产中的应用是最为典型的。1960年,茎尖组培技术研发并运用成功,获得了无病毒性的兰花组培苗,主要是借助原球茎继代培养方式来达到兰花试管苗生产的效果。目前,我国的组培技术正在逐步完善,通过应用组培技术,使得广东地区的兰花种植技术呈现商品化与规模化的态势发展,进而产生了一种新格局。我国在离体快繁育苗技术方面的研发起步比较晚,可是,发展速度还是很快的,特别是广东、广西与海南等地。当前,广东地区已然对100多种花卉观叶植物展开科学的组培,年产苗木高达500万株,其发展势头比较好。 二、园艺植物组培育苗技术 1、光自养组织培养技术 光自养组织培养技术即植物无糖组织快繁技术,其主要是在组培时,将CO2输入其中,将其作为重要的糖源,旨在为植物体生长提供所需的碳资源,经过系列的生长发育,再加之环境内各项因子的管控,能确保试管苗从兼养型逐步向自养型方向转变,进而衍生出一种生产种苗速度更快、种苗更优质的新型植物快繁技术。和传统的组培技术相比,无糖组织培养主要是将CO2作为重要的碳源,能减少糖类物质应用而产生的微生物污染问题,能实现对污染率的有效控制[2]。此外,结合植物的实际需要,需强化对组培微环境的合理化控制,其在相应条件下可以为植物的生长提供良好的生长环境,可提高植物生长速率,以确保植物可健康而茁壮的生长。同时,光自养组培主要是把多孔型无机材料视为重要的培养基质,如石沙子、纤维、成型岩棉等,这些材料不但成本低,也具有良好的透气性。据肖玉兰等专家的研究,应用此种组培技术,可大大提高小植株的生根质量。然而,在实际操作中,无糖组织培养微繁殖的试验与研究虽然成功,但是之其需要注意的问题也比较多。例如,相关人员应加深对组培苗生长环境、培养机制、生理特点等的认知,只有掌握各项条件要素,才能为无糖组织培养提供相应的参考。另外,植物材料限制问题突出。其和普通微繁殖相比,无糖组织培养要求外植体必须要具备高质量的茎和芽,若想更好的开展光合作用,促进植物健康而茁壮的成长,要求植株要具备足够的叶面积或携带子叶的体细胞胚亦可。 2、开放组织培养技术 开放组培是利用抗菌剂来代替高压灭菌与超净工作台,运用塑料杯来代替以往的组培瓶,让整个操作脱离以往组培严格无菌的环境,可在自然而开放的有菌条件下开展组织培养工作。开放组培无需作高压灭菌与超净工作台处理,仅仅是在培养基内加入抑菌剂,从而达到抑制病菌生长与蔓延的效果[3]。应用此种组培方法,其优势在于对整个组培操作过程进行简化,大大降低组培成本。然而,在实际应用过程中也遭遇了相应的问题,如植物类型不同,其应如何选择抗菌素、抗生素与防腐剂组合以及抗生素浓度、浸泡时间等问题,这些均需要通过一定的试验才可完成。 3、非试管苗快繁技术 非试管苗快繁技术主要是利用生物技术原理,将计算机控制技术作为重要的载体来打造新型育苗技术。借助计算机平台能够精确的模拟环境各要素,这为离体植物生长发育提供合适的营养、光、水、温等环境,能促进种苗健康而茁壮的成长,其为此种技术的核心点,其和以往扦插嫁接技术与新型组织培养技术具有共同之处,但是也存在着一定的差距。此种技术对果树育苗意义深远,特别是对樱桃、杏、梅、李等难以生根的果树效果明显。经过多年研究,以往的组培技术型在果树生根培养和炼苗等技术阶段存在着严重障碍。尽管很多果树品种可以完成芽增殖与培养工作,但是,仍旧无法克服生根难的问题。非试管快繁技术主要是在全光开放环境下取代了试管环境,运用蛭石、珍珠岩等透气、疏松与不含糖的无机基质[4],使用物理灭菌方式来替代以往的灭菌方法,借助叶片自身光合作用来启动生根基因,进而达到快速成苗的效果。此种技术主要是和计算机的环控技术进行有效的结合,运用离体材料的生根与光合作用来模拟最佳环境,进而满足光合自养过程的最优化。 结束语 综上所述,为打造更为和谐、健康的城市环境,政府部门必须重视园林工程建设,重视对先进园艺植物组培育苗技术的应用,从而培育出更为优质的植物苗,进而提高园艺植物组培水平。在此次研究中,结合广东地区发展实况,笔者针对园艺植物组培育苗技术的研究进
主要概念名词解释 细胞全能性:指细胞经分裂和分化后仍具有形成完整有机体的潜能或特性。 分化:指做工作使之瓦解;非特化的早期胚胎细胞获得特化细胞(如心脏、肝脏或肌肉细胞)特性的过程。 脱分化:已分化的细胞在一定因素作用下恢复细胞分裂能力,失去原有分化状态的过程。 再分化:已经脱分化的愈伤组织在一定条件下,再分化出胚状体,形成完整植株。 外植体:植物组织培养中作为离体培养材料的器官或组织的片段。 组织培养:植物组织培养概念(广义)又叫离体培养,指从植物体分离出符合需要的组织。器官或细胞,原生质体等,通过无菌 操作,在人工控制条件下进行培养以获得再生的完整植株或 生产具有经济价值的其他产品的技术。植物组织培养概念 再生植物。 愈伤组织:指植物体的局部受到创伤刺激后,在伤口表面新生的组织。 它由活的薄壁细胞组成,可起源于植物体任何器官内各种组 织的活细胞。 定芽:生长在枝上有一定位置的芽称为定芽。象顶芽、腋芽、副芽等
均在一定部位生出的芽,称为定芽. 不定芽:从叶、根、或茎节间或是离体培养的愈伤组织上等通常不形成芽的部位生出的芽,则统称为不定芽。 继代培养:指愈伤组织在培养基上生长一段时间后,营养物枯竭,水分散失,并已经积累了一些代谢产物,此时需要将这些组织 转移到新的培养基上,这种转移称为继代培养或传代培养。消毒:指杀死病原微生物、但不一定能杀死细菌芽孢的方法。 人工种子:将组织培养产生的体细胞胚和性细胞胚包裹在能提供养分的胶囊里,再在胶囊外包上一层具有保护功能和防止机械损 伤的外膜,形成一种类似于种子的结构。 褐变:饲料在加工过程中或长期贮存于湿热环境下,其所含的氨基化合物如蛋白质、氨基酸及醛、酮等与还原糖相遇,经过一系列 反应生成褐色聚合物的现象称为褐变反应,简称褐变。 污染:指自然环境中混入了对人类或其他生物有害的物质,其数量或程度达到或超出环境承载力,从而改变环境正常状态的现象。玻璃化:将某种物质转变成玻璃样无定形体(玻璃态)的过程,是一种介于液态与固态之间的状态,在此形态中没有任何的晶体结 构存在。 体胚:由体细胞发育成的胚。又称体细胞胚。 茎尖培养:把茎尖的分生组织或包括有此分生组织的茎尖分离进行无菌培养的方法。 单细胞培养:亦称游离细胞培养。是指酵母菌、细菌等单细胞生物的
国内外植物组织培养技术的差距 姓名:*** 学号:********* 指导教师:*** 专业班级:生物工程2009级1班 完成日期:2012-06-05
摘要 植物组织培养技术是农业生物技术中最早实现产业化并取得显著经济效益和社会效益的领域,在理论研究和生产实践中具有广泛的应用价值。通过对国内外植物组培的发展概况以及技术差距的分析,指出了我国植物组织培养技术的发展现状、目前存在的主要问题和应采取的措施,并对植物组织培养技术的发展作了展望。 关键词:组织培养概况差距展望 Abstract The plant tissue culture technology is agricultural biotechnology as the first realized industrialization and get a remarkable economic and social benefits of the field, in the theoretical research and production practice has wide application value. Through the domestic and international plant tissue and the development situation of the technology gap analysis, and pointed out the plant tissue culture technology's development present situation, the existing problems and the measures should be taken, and the development of plant tissue culture technology are discussed. Key words:Tissue culture situation gap looking
植物组织培养概念(广义)又叫离体培养,指从植物体分离出符合需要的组织.器官或细胞,原生质体等,通过无菌操作,在人工控制条件下进行培养以获得再生的完整植株或生产具有经济价值的其他产品的技术。植物组织培养概念(狭义)指用植物各部分组织,如形成层.薄壁组织.叶肉组织.胚乳等进行培养获得再生植株,也指在培养过程中从各器官上产生愈伤组织的培养,愈伤组织再经过再分化形成再生植物。 组织培养的步骤 一、培养基配制 配制培养基有两种方法可以选择,一是购买培养基中所有化学药品,按照需要自己配制;二是购买商品的混合好的培养基基本成分粉剂,如MS、B5等。 自己配制可以节约费用,但浪费时间、人力、且有时由于药品的质量问题,给实验带来麻烦。就目前国内的情况看,大部分还是自己配制。为了方便起见,现以MS培养基为例介绍配置培养基的主要过程。 1、配制几种母液 (1)配制MS大量元素母液 一般将大量元素分别配制成100倍的母液,使用时再分别稀释100倍。 分别称取 NH4NO3 165g KH2PO4 17g KNO3 190g CaCl2·2H2O 44g MgSO4·7H2O 37g 各自配成1L的母液。倒入1L试剂瓶中,存放于冰箱中。 (2)配制MS微量元素母液 一般将微量元素配制成100倍母液。 依次称取 KI 0.083g Na2MoO4·2H2O 0.025g H3BO3 0.62g CuSO4·5H2O 0.0025g MnSO4·H2O 1.69g CoCl2·6H2O 0.0025g ZnSO4·7H2O 0.86g 配成1L母液,倒入1L试剂瓶中,存放于冰箱中。 CuSO4·5H2O和CoCl2·6H2O 由于称取量很小,如果天平精确度没有达到万分之一,可先配成调整液。 分别称取 CuSO4·5H2O 0.05g CoCl2·6H2O 0.05g 各自配成100ml的调整液,然后取5ml就还有0.0025g的量。 (3)配制MS有机母液
《植物组培快繁技术》 康乃馨植物组织培养 实 验 设 计 小组成员:陈梅20141641044 郑莉20141641002 雷雨田20141641043
康乃馨植物组织培养 一、实验目的 掌握植物离体快速繁育原理、方法和完整过程。 二、实验原理 香石竹(学名Dianthuscaryophyllus)又名康乃馨,花色艳丽,开花时间长,装饰效果好,是世界上最畅销的切花之一,具有较高经济价值。由于病毒病侵害,常使植株矮化,花朵变小,花色产生斑点,退色甚至不开花,影响切花产 量和质量。通过茎尖分生组织培养,能够获得“无病毒”的健康植株,对于引 进的少而新的脱毒种苗,再进行一次茎尖培养,进一步降低基础苗中的病毒含量,并通过组织培养的方法快速繁殖,在短期内,就可以获得大量的脱毒试管苗,使引入材料迅速在生产上推广应用,取得明显的经济效益。 三、实验仪器与材料 仪器:超净工作台、酒精灯、电炉、烧杯、玻璃棒、镊子、解剖刀、接种盘、 纱布、记号笔、标签纸 试剂:75%乙醇、0.1%升汞、无菌水、MS培养基、IAA0.1mg/L、BA0.5mg/L、pH5.8-6.0、蔗糖、琼脂 材料:康乃馨带芽外植体材料 四、实验步骤 (一)培养基的配方 1、康乃馨的生芽培养基 MS+IAA(0.1mg/L)+BA(2.0mg/L)+NAA(0.2mg/L)+蔗糖30g/L+琼脂(8g/L) pH5.8-6.0,配制300ml,用培养瓶分装10~15瓶。另外需要制备无菌水10瓶,培养瓶每人3~4瓶。纱布、碟子若干,后二者分别用报纸包好一同灭菌。
2、康乃馨的继代培养基 MS+BA(0.3mg/L)+NAA(0.2mg/L)+蔗糖30g/L+琼脂(8g/L),pH5.8-6.0,配制300ml,用培养瓶分装10-15瓶。另外需要制备无菌水10瓶,培养瓶每人3-4瓶。纱布、碟子若干后二者分别用报纸包好一同灭菌。 3、康乃馨的生根培养基 MS+生根培养基为1/2MS+NAA(0.075mg/L)+蔗糖(30g/L)+琼脂(8g/L), pH5.8-6.0,配制0.3L,用培养瓶分装10-15瓶。另外,需要制备无菌水10瓶,每人3-4培养瓶、纱布、碟子若干后二者分别用报纸包好一同灭菌。 (二)康乃馨的生芽培养 1、无菌操作准备 将培养基、无菌水、及各种接种用具放入超净工作台,开紫外灯照射消毒20-30min,开送风开关,关紫外灯,通风10min后,打开照明日光灯。洗手、换鞋,换实验服,戴口罩,进入接种室,开启超净工作台。用纱布吸取75%酒精擦手、擦拭超净台、擦拭培养基和无菌水瓶,点燃酒精灯,镊子、解剖刀、剪刀等接种工具放入灭菌锅灭菌,待冷却后使用。 2、外植体消毒 选取康乃馨叶腋间生出的侧芽为外殖体,用自来水冲洗半小时,将材料上的泥土和灰尘及杂质冲洗干净,用解剖刀切取所需组织放入大烧杯中,用75%的酒精浸泡消毒30s,用无菌水冲洗3次,再将材料移入0.1%升汞溶液浸泡10分钟,然后在超净台内用无菌水冲洗6次。材料消毒完成。 3、外植体的制备 将消毒好的材料用无菌滤纸吸去多余的水份,然后在无菌超净工作台上的接种盘内,借助解剖刀剥离茎尖,剥取茎尖大小通常在0.3mm左右。以上操作均
蝴蝶兰植物组织培养全过程 一实验目的: 1 掌握植物细胞组织培养的原理和方法; 2了解植物组织培养的方法; 3 学习植物组织培养的原理; 4 了解不同浓度BA对蝴蝶兰生根的影响; 5了解炼苗的作用; 6掌握训化的方法步骤; 7观察蝴蝶兰组织培养到种植的全过程,并注意其中出现的问题。 二实验原理: 蝴蝶兰为兰科蝴蝶兰属植物,因花型奇特、色彩艳丽、花期长久而享有“洋兰皇后”的美誉。蝴蝶兰原产于缅甸、菲律宾、台湾、马来西亚、印度尼西亚等热带亚洲地区,具有极高的观赏和经济价值,是国际上最具商业价值的四大观赏热带兰之一。蝴蝶兰属单茎性气生兰,再生能力弱,很难进行分株繁殖,且种子无胚乳,自然条件下难以萌发,增殖系数低,难以满足日益增长的市场需求。应用植物组织培养技术进行蝴蝶兰快速繁殖可以缩短繁育周期,获得大量成株,并可以保持优良性状,维护种质资源,是蝴蝶兰快速繁殖的有效途径。在以蝴蝶兰根尖、茎尖、叶片和花梗芽为外植体诱导原球茎时,由于根尖的诱导率低,摘取茎尖会损失母株等原因,因此在蝴蝶兰组织培养中根和茎都不是诱导原球茎的理想材料。而蝴蝶兰叶片和花梗芽作为外植体诱导圆球茎时,其诱导率较高、对母株伤害不大,是较为理想的外植体材料。 三材料与用具: 蝴蝶兰的茎尖、1/ 2MS +BA2. 5 mg/L + NAA0. 2 mg/L花梗腋芽诱导培养基、1/ 2 MS + BA3. 5 mg/L + KT1. 0 mg/L + NAA0. 5 mg/L + 椰乳10 %增殖培养基、母液、量筒、烧杯、玻璃棒、移液管、无菌水、高压灭菌器、容量瓶、pH试纸、75%酒精、2%次氯酸钠、镊子、解剖刀、超净工作台、95%酒精、穴盘等。 四方法与步骤 (1)母液的配制 根据需要的母液量配制母液,配好后要贴好标签,以防弄错。标签上要注明是什么母液和母液的稀释倍数。将配好的母液进行储藏,要用的时候可以方便使用。 配制培养液时应注意:
植物组织培养 作者 摘要 关键字 植物组织培养既是一种基础性研究,又是一种极具普及意义的生物技术。它具有 耗费母株材料少,繁殖速度快,繁殖率较高,用嫩茎组织培养法可以得到无病毒植株, 减轻病毒对花卉的影响,以及定向培养植物优良品种等方面的优势。植物组织培养的 基础是植物细胞的全能性理论,它从诞生到现在经历了4个时期,即理论准备和实验 开创期;研究发展时期;生产应用时期;“克隆”生物时期(肖杰,2004)。如今植 物组织培养技术已经成为农林业中极具普及意义的生物技术之一,而芍药组织培养目 前处于理论准备和实验开创期。但是对芍药进行组织培养,应用植物激素控制分化过 程及分化数量可达到繁殖目的,并节省人力物力,是芍药批量生产的最佳方法(胡映 泉,2003)。 近年来中外学者对芍药的组织培养进行了大量的研究工作,主要集中在以种子为 外植体的组织培养方面(BrukhinvB,一994;KimYS,1995年;BuchheimJAT,1994),也利用花药(LeeB,1992)培养诱导形成单倍体植株或胚状体。众所周知,常规方法育种周期长、见效慢,极大地限制了新品种的研制与开发。 而利用植物组织培养中的花粉、花药进行单倍体育种结合温室育苗技术,可以大大缩 短育种年限,实现早期选择、提高选择效率。利用体细胞来培育新品种已成为当今育 种领域的趋势之一,对于无法结实的多倍体花卉来说,采用组织培养技术则能为其提 供一条具体的繁殖途径。对于那些产生芽变的种类来说,由于变异部位太小,难以进 行传统的扦插或嫁接繁殖,无法使这些新出现的宝贵种质保留下来;如果将发生变异 的细胞进行分离,并培养成苗则可以选育出许多新的品种,这无疑为花卉新品种的培 育提供了广阔的空间。 影响外植体污染的因素较多,除要求操作人员严格按照无菌操作程序操作外,还 与外植体的种类、取材季节、预处理方法、消毒方法、杀菌剂的使用等因素有关。在 植物组织培养中,造成污染的病原主要是霉菌、细菌和酵母菌三大类,霉菌和酵母菌 引起的污染很容易观察到,初代培养就能在外植体周围或培养基表面形成明显的菌 落,而细菌污染则存在一定的潜伏期。如果外植体培养3一5d内未表现污染症状,而 以后不断出现污染现象,表明污染主要由内生菌引起(Leifert,1990;柴向华,周俊 辉,2003)。抗生素抑菌在动物细胞培养中早己被广泛应用,在植物组织培养中尚处于开始阶 段。近年随着植物基因工程的开展,转基因过程中的除菌和抑菌越来越离不开抗菌素 所以使用抗菌素逐渐成为植物组织培养中的灭菌技术之一。在抗菌素的使用上, Falkiner(1990年)提出3个条件,即必须弄清楚要抑制菌的种类,使用的抗生素是否 对培养的植物组织有不良影响,还要确立抗生素的使用浓度、处理时间的长短。因 没有一种抗生素能对所有引起污染的微生物都有效,所以抗生素也不能完全代替灭菌 技术,最好加在培养基中,作为一种辅助防止污染的措施。 植物组织培养中外植体种类的选择以污染少、易启动为原则。带芽的外植体,如 茎尖、侧芽、带芽茎段,培养成功率高,变异率小,容易保持材料的优良特性。其中, 顶芽芽体饱满,营养丰富,侧芽较瘦弱,所以顶芽启动快,分化率高;继代培养中由 于顶端优势的作用,腋芽的生长受到抑制,生长势弱于带芽茎段。因此,用顶芽作为 外植体时,培养基中常加入细胞分裂素打破顶端优势作用,促进腋芽大量萌发,提高 繁殖系数(裘文达,1986)。据分析,外植体取材的季节以材料积累了较丰富的营养
组培的研究进展及发展趋势 植物组织培养是根据植物细胞具有全能性的原理而发展起来的一门生物技术。简要概述了植物组织培养的概念及研究进展,较全面的综述了植物组织培养新技术以及在快繁脱毒、育种、种质资源保存、次生代谢物提取、基因转化等方面的研究现状,最后展望了植物组织培养的发展趋势。 关键词:组织培养;新技术;应用现状;发展趋势 植物组织培养是20世纪之初,以植物细胞全能性为理论基础发展起来的一门新兴技术,是指在无菌条件下,将离体的植物器官、组织、细胞以及原生质体,在人工配制的环境里培养成完整的植株,也称离体培养或植物克隆。自1902年德国科学家Haberlandt提出植物细胞具有全能性理论, 到1934年美国White 等用番茄根进行离体培养证实这一观点以来,植物离体培养技术在基础理论和应用研究,已广泛应用到植物生理学、病理学、药学、遗传学、育种以及生物化学等各个研究领域, 成为生物学科中的重要研究技术和手段之一。近年来,随着科学技术的不断发展,植物组织培养新方法和新技术不断涌现,研究重点也由器官、细胞水平向分子、基因方向转移。21世纪,生物技术是最有生命力的一门学科,而植物组织培养作为一种基本的试验技术和基础的研究手段,被认为具有巨大的潜力。 一、植物组织培养新技术的研究 随着科学技术的发展和对植物组织培养技术的不断深入研究,一些新的培养方法和技术不断出现,为植物组织培养技术的不断优化和发展提供了新的途径。 1.新型光源的应用 光是植物生长发育必不可少的重要因素之一,光照长短、光质、光周期对植物的生长、形态建成、光合作用、新陈代谢以及基因表达均有调控作用。传统的组织培养光源灯普遍存在寿命短、发热量大且不均以及发光效率不理想等缺点。LED作为植物组织培养光源早在1991年就有栽培试验。研究发现, 光质比例和光照强度可调的LED 光源比通常植物组织培养使用的荧光灯更能有效地促进试管苗的光合作用和生长发育。蒋要卫利用LED作为大花蕙兰组培苗光源的研究发现, LED光源可以显著改善大花惠兰试管苗的生长状况和提高其品质。日本的田中道男等运用阴极荧光灯( CCFL)作为文心兰试管苗光源, 结果表明其地上部干、鲜重和试管苗的高度都有显著提高。另外田中道男等利用SILHOS 作为生菜组织培养光源, 获得了高质量的组织培养苗。目前LED是组织培养中最有效的人工照明光源,而CCFL等新型光源是未来发展的主要方向。 2.开放组织培养技术 传统的植物组织培养属于严格的封闭式培养,因而造成灭菌成本偏高、培养基易污染、外界环境调控难度大等缺点。而开放组织培养新技术是在外加抗菌剂的条件下,使植物组织培养脱离严格无菌的操作环境,在自然开放的有菌环境中进行,恰好弥补了这些不足。赵青华等采用开放式组培技术,在培养基中添加抑菌剂,克服了非灭菌条件下魔芋组织培养污染问题,有效地简化了实验步骤,降低了生产成本。何松林的研究表明在添加抗菌剂的开放式组培中,文心
植物组织培养复习材料 一、名词解释。 1、植物组织培养(plant tissue culture):植物的离体器官、组织或细胞在人工制备的培养基上进行无菌培养,并在人工控制的环境条件下,使其发育成完整植株的科学技术 2、脱分化(dedifferentiation):指失去分裂能力的细胞回复到分生性状态并进行分裂,形成无分化的细胞即愈伤组织的现象。 3、再分化(redifferentiation):愈伤组织形成不定芽或不定根或胚状体。 4、外植体(explant):植物组织培养过程中从活体植株上切去下来的用于离体培养的一切材料。(如器官、组织、细胞、原生质体、种子等) 5、愈伤组织(callus):原本指植物在受伤后于其伤口表面形成的一团薄壁细胞。在组培中,则指人工培养基上由外植体形成的一团无序生长的薄壁细胞。 6、器官发生:胚胎时期由胚层器官原基发育成器官的过程。包括细胞分化和器官形成。 7、胚状体发生:在植物细胞、组织或器官体外培养过程中,由一个或一些体细胞经过胚胎发生和发育过程,形成的与合子胚相类似的结构。可进一步发育成植株。 8、细胞全能性(cell totipotency):指植物的每一个细胞都携带有一完整的基因组,并具有发育成完整植株的潜在能力。 9、细胞分化:一个尚未特化的细胞发育出特征性结构和功能的过程。 10、极性:细胞(也可指器官或植株)内的一端与另一端在形态结构和生理生化上的差异。 11、试管苗:通过组织培养产生的植株。 12、看护培养:是指用一块活跃生长的愈伤组织来看护单个细胞,使其持续分裂和增殖的一种培养方法。这块愈伤组织被称为看护组织。 13、固相化培养:将细胞或原生质体固着在琼脂糖、藻(月元)酸盐或多聚赖氨酸中,然后将他们放入液体培养基中震荡培养。这种培养方法既利用了振荡培养室营养物质和气体易于交换的优点,有利用了固相化使细胞免受振荡时剪切力的作用。 14、悬浮细胞培养:将单个游离细胞或小细胞团在液体培养基中进行培养增值的技术。适用于大规模的培养,使细胞工程的基本平台。 15、植板效率=(每个平板中新形成的细胞团数/每个平板中接种的细胞数)*100 16、实验室的组成及功能:1.基本实验室(1)准备室(2)接种室(3)培养室 2.辅助实验室(1)细胞学实验室(2)摄影室及暗室(3)生化分析室(无菌操作室、化学实验室、培养室、细胞学观察室、暗室)。 17、植物种质:物亲代通过生殖细胞或体细胞传递给后代的遗传物质,植物种质资源即为携带各种不同遗传物质的植物总称。 18、玻璃化现象:指试管苗的一种生长失调症状,当植物材料进行离体繁殖时,有些培养物的嫩茎、叶片往往会出现半透明状和水渍状,这种现象称为玻璃化。其苗称为玻璃化苗。 19、基本培养基:包括大量元素和微量元素(无机盐类)、维生素和氨基酸,还有糖和水等。 20、完全培养基:在基本培养基基础上,根据各种不同试验要求,添加各种植物生长调节物质以及其他复杂有机附加物,包括有些成分尚不完全清楚的天然提取物。21、外植体褐变:在组织培养过程中,外植体向培养基中释放褐色的物质(醌类)致使培养 1
植物快繁技术/植物克隆技术/植物傻瓜克隆技术/植物非试管高效快 繁技术 减小字体增大字体作者:本站来源:本站整理发布时间: 2008-1-1 18:33:32 植物快繁技术简介 所谓植物非试管高效快繁技术也就是植物克隆技术,也有人称之为植物非试管快繁技术、植物快繁技术、植物全光照喷雾育苗技术、全光雾插技术、微材料或微组织扦插育苗技术,喷雾育苗技术、喷雾扦插育苗技术、傻瓜克隆。无论叫做植物快繁还是植物克隆其原理和方法是一样的。 植物克隆技术(植物快繁技术)的关键是喷雾,十几年前就有权威单位推广全光照喷雾育苗技术,实际上也就是后来有人称之为植物非试管高效快繁技术,而现今更多被称为植物克隆、傻瓜克隆等时髦词汇。过去开发的喷雾全套设备是机械式,成本高达数万元,且容易锈蚀和损坏,一段时间后就没人再使用,而自从引进以色列微喷(头)技术后,微喷雾问题顺利以低成本形式解决,于是植物克隆技术(植物快繁技术)得以在全国迅速推广普及。 植物快繁技术(植物克隆技术)的推广的另一障碍就是自动控制仪的问题,进口的温湿控制设备好用但价格高,所谓的农业智能化计算机系统除了价格更高之外还总是不能成熟,使用起来问题百出,经常造成育苗的失败,笔者使用两年后才不得已开发了国产育苗仪,其低廉
的价格和丰富实用的功能很快被全国同行赏识。 植物克隆技术(植物非试管高效快繁技术)现在的投入只需2000余元,大力推广植物克隆技术、植物快繁技术利国利民。 植物非试管高效快繁技术的起源、应用和进展 植物傻瓜克隆技术是20年前从国外引进,又经过我国众多农业专家花费二十余年时间,逐步完善并成熟运用于规模生产一个系统配套,用于多种经济植物大规模无性快繁产业化生产的实用技术,又称非试管快繁技术、喷雾快繁技术等。此技术是一项崭新经济植物苗木快繁技术体系,它将植物组织培养快繁苗从试管培养基中解放到田间大地,是一场无性繁殖快速育苗的革命!是现代农业生物技术研究的一大创举! 该技术育苗生产成本低,适用于国内外苗木交易市场和经济植物种苗繁殖工程。绿色快繁产业是一个永久性高效益产业,它可以带动制药产业、林纸产业、林草产业、园林绿化等其它产业,进而促进农业产业化、林业产业化、制药产业化和农业现代化的快速发展。还有利于生态城市、园林城市、森林公园、自然保护区的建设、生态环境改善、城市生态系统的改变、无性系造林、天然林保护工程、城市绿化工程以及与人们生活息息相关的如粮食作物、花卉、蔬菜、无公害蔬菜、野生蔬菜、濒危野生植物、果树、山野菜、药用植物、珍稀植物等高效经济植物以及新经济资源的开发利用。 植物快繁技术是古今中外人们十分关注的问题。从传统的扦插繁
植物组织培养的一些注意事项 一、常用培养基主要特性 1、高盐成分培养基包括MS、LS、BL、BM、ER 等培养基。其中MS 培养基应用最广泛,其钾盐、铵盐及硝酸盐含量均较高, 微量元素种类齐全, 其养分数量及比例均比较合适, 广泛用于植物的器官、花药、细胞及原生质体的培养。LS、BM、ER 培养基由MS 培养基演变而来。 2 、硝酸钾含量较高的培养基包括B5 、N6 、LH、GS 等培养基。 , 4 、低无机盐培养基大多情况下用于生根培养基。有以下几种: ①改良怀特培养基(White 1963 ) ②WS 培养基(Wolter & Skoog 1966) ③克诺普液( Knop 1965 ) 花卉培养上用得多。 ④贝尔什劳特液(Berthelot 1934) ⑤HB 培养基( Holley & Baker 1963) 此培养基在花卉脱毒培养和木本植物的茎尖培养中效果良好。其成分是大量元素比1/ 2 克诺普( Knop ) 液稍多, 微量元
素用贝尔什劳特液, 每升培养基中加0 . 5ml。 二、与培养基有关的一些细节问题 1、培养基所用药品应采用等级较高的化学纯CP(三级) 及分极纯AR(二级) , 以免杂质对培养物造成不利影响。 2、调节PH也可用精密pH试纸(应在干燥器中保存, 以免吸湿而失效)。培养基过酸的可用1mol/ L 氢氧化钠( NaOH) 来调节; 培养基过碱的可用1mol/ L 盐酸( HCl ) 来调节( 1mol/ L NaOH 的配制方法是称40gNaOH, 溶解后加入蒸馏水, 加 ) 因 , 1、取材季节的影响:大多数植物应在其生长开始的季节采样, 生长末期或已进入休眠期, 则外植体对诱导反应迟钝或无反应。 2、器官的生理状态和发育年龄:沿植物的主轴, 越向上的部分所形成的器官其生长的时间越短, 其生理年龄也越老, 越接近发育上的成熟, 越易形成花器官。反之, 越向下, 其生理年龄越小。木本植物的组织培养中, 以幼龄树的春梢嫩枝段或基部的萌条较好, 下胚轴与具有3 对~4 对真叶的嫩茎段, 生长效果也较
植物组培的应用前景 编辑 1.快速繁殖某些稀有植物或有较大经济价值的植物依靠自然条件在较短时间内繁殖稀有植物和经济价值较高的植物,受到地理环境和季节的限制,很难达到快速、高效的目的;特别对于在短时期内需要达到一定数量,才能创造应有价值的植物,时间就是效益,只有通过组织培养的方法才能满足这一要求。 用组织培养法繁殖植物,这是组织培养应用于生产的主要的和成效最大的实例。首先是在兰花上的成功应用。自Morel在1960年得到兰花组织培养苗后,很快应用于生产,形成了组织培养法繁殖兰花工业。 由于组织培养法繁殖植物的明显特点是快速,每年可以数以百万倍速度繁殖,因此对一些繁殖系数低,不能用种子繁殖的名特优植物品种的繁殖,尤为意义重大。 2、脱毒植物中有很多都带有病毒,严重影响植物的产量和品质,给农业带来灾害。特别是无性繁殖植物,如马铃薯、草莓、大蒜、康乃馨等,由于病毒是通过维管束传导的,因此利用这些植物营养器官繁殖,就会把病毒带到新的植物个体上而发生病害。但是也证明感病植株并不是每个部位都带有病毒,如茎尖生长点尚未分化成维管束的部分,可能不带病毒。若利用组织培养法进行茎尖培养,再生的植株有可能不带病毒,从而获得脱病毒的苗,再用这种苗进行繁殖,则种植的植物就不会或极少发生病毒病。 所获得的脱毒苗一定要经过鉴定,确认不带病毒才能使用。使用组织培养法获得脱毒苗已经在草莓、葡萄、康乃馨等获得成功,产生明显的经济效应。 3、植物种质资源的保存、挽救濒于灭绝的植物长期以来人们想了很多方法来保存植物,如储存果实,储存种子,储存块根、块茎、种球、鳞茎;用常温、低温、变温、低氧、充惰性气体等,这些方法在一定程度上收到了好的或比较好的效果,但仍存在许多问题。主要问题是付出的代价高,占的空间大,保存时间短,而且易受环境条件的限制。植物组织培养结合超低温保存技术,可以给植物种质保存带来一次大的飞跃。因为保存一个细胞就相当与保存一粒种子,但所占的空间仅为原来的几万分之一,而且在-193度的液氮中可以长时间保存,不像种子那样需要年年更新或经常更新。 环境的不断变化使许多种类的植物面临着灭绝的危险,而且许多种植物已经灭绝,留给人类的只是一种遗憾。如何挽救这些植物,还有许许多多的动物,已成为世人关注的问题。实践证明,通过组织培养的方法可以使一部分濒危的植物种类得到延续和保存;如果在结合超低温保存技术,就可以使这些植物得到较为永久性的保存。其实,对大多数普通植物来说,用组织培养的方法保存其种质材料,也具有十分重要的意义。因为,人们现在无法预知哪些植物会面临灭顶之灾,或许今天看似繁茂的植物,明天就可能被沙漠、洪水、大火或战争吞没。 4、通过花药和花粉培养获得单倍体植株、缩短育种年限通过花药和花粉组织培养可以获得