
1、判断下列复分解反应能否发生,能反应的写出方程式,不能反应的说明理由?
1、氢氧化钠溶液和硫酸钾溶液
2、氢氧化钾溶液和硝酸铜溶液
3、硫酸钠溶液和氯化钡溶液
4、氯化钠溶液和硝酸银溶液
5、硝酸钠溶液和硫酸化钡溶液
6、氢氧化钾溶液和稀硫酸
7、硝酸钾溶液和氯化钠溶液8、碳酸钠溶液和硝酸钾溶液
9、氯化铁溶液和氢氧化钠溶液10、碳酸钙和稀盐酸
应用一:判断物质或离子能否在溶液量共存
物质相互间不反应或离子间不能结合生成沉淀、气体、水就能在溶液量共存。
1、生成水不能大量共存:H+与OH-
2、生成气体不能大量共存:H+与CO32-、OH- 与NH4+
3、生成沉淀不能大量共存:Cl-与Ag+、SO42-与Ba2+、OH- 与 Fe3+、Cu2+、Mg2+等、
CO32-与 Ca2+、Ba2+、Ag+等
例题1:下列各组物质在溶液中能大量共存的是()
A.FeCl3、Na2SO4、HCl B.NaOH 、NaCl 、HNO3
C.MgSO4、NaNO3、KOH D.Na2CO3 、KNO3、HCl
特别提醒:注意题中隐含的其它条件,如颜色、pH等
【中考】
1、【08年宿迁】下列离子能在pH=2的无色溶液量共存的是()
A.SO42-、Fe3+、Na+、OH-
B.K+、SO42-、Cu2+、NO3-
C.Cl-、K+、SO42-、Na+
D.Ca2+、Cl-、CO32-、Na+
2、【08年】下列各组离子在水溶液中能大量共存的是()
A.Fe2+、Ca2+、CO32-、OH-
B.Na+、SO42-、Cl-、OH-
C.Ba2+、H+、Cl-、OH-
D.Ag+、NH4+、NO3-、OH-
3、【08年揭阳】下列各组物质,能共同存在于水溶液中的是()
A.BaCl2、Na2SO4、Ca(OH)2
B.MgCl2、CuSO4、NaNO3
C.AgNO3、BaCl2、K2SO4
D.CaCl2、K2CO3、NaNO3
应用二、除杂
除杂的方法:①根据溶解性②化学试剂法:将杂质变成气体或沉淀
化学试剂法除杂质遵循的原则:选用的试剂只和杂质反应,且不带入新杂质。
例题2:选用何种试剂除去NaNO3溶液中混有的少量Ba(NO3)2杂质
【分析】Ba(NO3)2和NaNO3 相比较真正的杂质是Ba2+,只需加入一种试剂既能除去Ba2+,又不带入新的杂质,它就是碳酸钠或者硫酸钠。
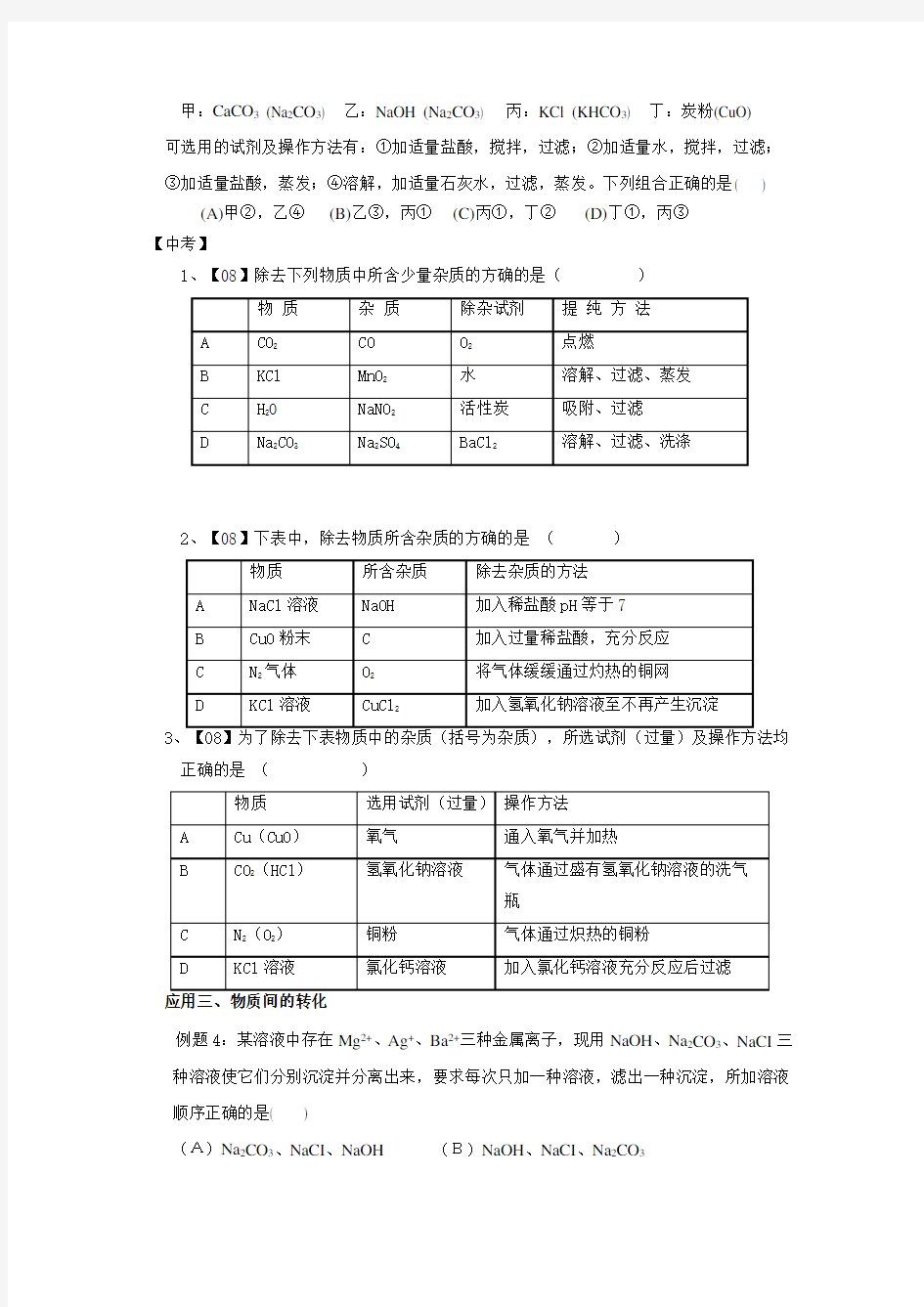
例题3:要除去下列四种物质中的少量杂质(括号的物质为杂质)
甲:CaCO3 (Na2CO3) 乙:NaOH (Na2CO3) 丙:KCl (KHCO3) 丁:炭粉(CuO)
可选用的试剂及操作方法有:①加适量盐酸,搅拌,过滤;②加适量水,搅拌,过滤;
③加适量盐酸,蒸发;④溶解,加适量石灰水,过滤,蒸发。下列组合正确的是( )
(A)甲②,乙④(B)乙③,丙①(C)丙①,丁②(D)丁①,丙③
【中考】
1、【08】除去下列物质中所含少量杂质的方确的是()
2、【08】下表中,除去物质所含杂质的方确的是()
3
正确的是()
例题4:某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCI三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是( )
(A)Na2CO3、NaCI、NaOH(B)NaOH、NaCI、Na2CO3
(C)NaCI 、NaOH 、 Na 2CO 3 (D)NaCI 、Na 2CO 3、NaOH
【中考】
1、【08】下列物质间的转化只有加入酸才能一步实现的是 ( )
A.Zn →ZnSO 4
B.CuO →CuCl 2
C.CaCO 3→CO 2
D.BaCl 2→BaSO 4
2、【08】下列各组物质能按照关系图 (→表示反应一步完成)相互转化的
是 ( )
..
) A .P →P 2O 5 B .CaCO 3→CO C .Fe →FeCl 2 D .CuO →CuSO 4
4、【08】下列物质的转化能实现的是 ( )
A.H 2SO 4 HCl
B.CO Na 2CO 3
C.Cu(OH)2 NaOH
D.NaNO 3 Ba(NO 3)2
应用四、物质的鉴别
例题4:不用其它试剂,用最简捷的方法鉴别①NaOH ② MgSO 4 ③Ba (NO 3)2 ④FeCl 3 ⑤KCl 五种溶液,则被鉴别出来的物质的正确顺序是
【分析】此类题目常常有两种解题方法:①从有特殊颜色的物质着手打开解题的入手。②从和其它物质发生反应的现象最多的物质着手。本题通过观察可选用方法①,首先通过颜色鉴别出④FeCl 3,继而用FeCl 3鉴别出①NaOH,然后用NaOH 鉴别出MgSO 4,最后用MgSO 4鉴别出Ba(NO 3)2 。
【中考】
1、【06】下列各组物质,只用组溶液相互混合的方法就能鉴别的是( )
A .K 2SO 4、BaCl 2、NaNO 3、NaCl
B .K 2SO 4、BaCl 2、Na 2CO 3、HCl
C .KOH 、Na 2SO 4、CuSO 4、MgCl 2
D .KCl 、AgNO 3、KNO 3、HCl
2、【07】现有四组物质的溶液,仅用酚酞试液及同组物质之间相互反应就能鉴别出来的是 ( )
A .NaOH Ba (OH )
2 HCl B .NaOH HCl NaCl
C .NaOH H
C1 HNO 3 D .H 2SO 4 NaCl Na 2SO 4
+NaCl +BaCl 2 +NaOH +BaCO 3
3、【07】下列各组物质,只需用组溶液相互混合,就能鉴别出来的是 ( )
A .K 2SO 4、BaCl 2、NaNO 3、NaCl
B .HCl 、Na 2CO 3、BaCl 2、Na 2SO 4
C .KOH 、Na 2SO 4、CuSO 4、HCl
D .KCl 、AgNO 3、KNO 3、NaCl
应用五、物质间的推断
例题5:a 、b 、c 、d 可能是Na 2CO 3、AgNO 3、BaCl 2、HCl 四种溶液中各一种,把它们两两混合后产生如下现象, a 、b 、c 、d
依次是( ) (A )Na 2CO 3、AgNO 3、HCl 、BaCl 2 (B )AgNO 3、Na 2CO 3、BaCl 2 、
HCl (C )HCl 、AgNO 3、BaCl 2、Na 2CO 3
(D )BaCl 2、HCl 、Na 2CO 3、AgNO 3
【中考】 1、右图是常见酸、碱、盐之间的相互转化关系。
(1)写出图中相应物质的化学式:酸 、碱 。
(2)写出图中反应②和④的化学方程式:
②
④
(3)总结化学反应的规律是我们学习化学的方法之一。请根据上图总结出
酸、碱、盐相互反应的规律(写2点) 、 。
2、已知某固体粉末是由NaCl 、Ba(NO 3)2、CuSO 4、Na 2SO 4、Na 2CO 3中的一种或几种组成,取这种粉末加足量的水,振荡后呈浑浊,再加稀盐酸,沉淀不溶解,过滤后得无色滤液,取滤液并滴加AgNO 3溶液产生白色沉淀,对原固体粉末的判断正确的是( )
A.可能含CuSO 4和Na 2CO 3
B.一定含NaCl,可能含Ba(NO 3)2、Na 2SO 4,一定不含Na 2CO 3、CuSO 4
C.一定含NaCl 、Ba(NO 3)2、Na 2SO 4,一定不含Na 2CO 3,可能含CuSO 4
D.可能含NaCl,一定含Ba(NO 3)2、Na 2SO 4,一定不含Na 2CO 3、CuSO 4
3、在我州经济大开发的进程中,要坚持开发与环保并重。某化学课外活动小组在调查一化工厂时发现该厂有甲、乙两个车间,排出的废水澄清透明,经分析分别含有三种不同的离子,共有K +、Ba 2+、Cu 2+、OH -、NO 3-、CO 32- 六种离子。
(1)将甲、乙两车间的废水按适当的比例混合,可以变废为宝,既能使废水中的Ba 2+、Cu 2+、
OH -、CO 32-
等离子转化为沉淀除去,又可以用上层清液来浇灌农田。清液中含有的溶质主要是 (填写物质的化学式)。
(2)已知甲车间废水明显呈碱性,则乙车间废水中含有的阴离子是__________________。
(3)根据以上溶解性表判断,Cu(NO 3)2和Ba(OH)2溶液 (填“能”或“不能”)发生复分 a
b c d a 一 白↓ 一 ↑
b 白↓ 一 白↓ 白↓
c 白↓
白↓
解反应。若能反应写出化学方程式;若不能反应写出理由:。
4、如图,A、B、C、D、E各代表铁、水、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质。常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。请填空:
(1)写出下列物质的化学式:A ,B ,D 。
(2)相连环物质间发生的反应,没有涉及的基本反应类型是______________________。
5.不用另加其他试剂,用最简捷的方法来鉴别下列五种溶液:①KOH
)
A. ③①⑤②④
B. ①⑤②④③
C. ③①⑤④②
D. ⑤②①③④
6..现有甲、乙两种溶液,共含有8种离子,分别为H+、Ag+、K+、Ba2+、OH-、Cl-、NO3-和CO32-,且两种溶液里所含的离子各不相同。已知向甲溶液里滴入紫色石蕊试液,溶液变成蓝色,说明甲溶液呈(填“酸性”、“碱性”或“中性”),那么乙溶液里含有的4种离子是(填离子符号)。
7.有一固体混合物,可能含有K2CO3、K2SO4、CuSO4、CaCl2、KNO3等物质中的一种或几种,将混合物溶于水,得无色溶液,当滴入硝酸钡溶液时,有白色沉淀产生,再加足量的稀硝酸沉淀部分溶解,则该混合物中一定含有____________一定不含有_______________可能含有_____________.
练习:
一、共存问题
1、分别将下列各组物质同时加到水中,能大量共存的是 ( )
A.NaCl、AgNO3、Na2SO4
B.H2SO4、NaCl、Na2CO3
C.Na2SO4、KNO3、NaOH
D.BaCl2、NaCl、KOH
2、下列各组物质,能共同存于水溶液中的是 ( )
A.BaCl2、Na2SO4、Ca(OH)2
B.MgCl2、CuSO4、NaNO3
C.AgNO3、BaCl2、K2SO4
D.CaCl2、K2CO3、NaNO3
3、下列各组离子在水溶液中能大量共存的是 ( )
A.Fe2+、Ca2+、CO32—、OH-
B.Na+、SO42—Cl—、OH-
C.Ba2+、H+、Cl—、OH—
D.Ag+、NH4+、NO3-、OH—
4、下列离子能在pH=2的无色溶液量共存的是 ( )
A.SO42-、Fe3+、Na+、OH-
B.K+、SO42-、Cu2+、NO3-
C.Cl-、K+、SO42-、Na+
D.Ca2+、Cl-、CO32-、Na+
二、无色透明溶液的判断
1、、下列能形成无色透明溶液的一组是()
A.BaCl2、Na2SO4、Ca(OH)2
B.MgCl2、CuSO4、NaNO3
C.AgNO3、BaCl2、KNO3
D.CaCl2、NaCl、KNO3
2、分别将下列各组物质同时加到水中,得到无色、透明溶液的是( )
A.HNO3、NaCl、K2SO4 B.KCl、NaOH、CuSO4
C.BaCl2、NaOH、H2SO4 D.FeCl3、Na2SO4、KCl
3、下列能形成无色透明溶液的一组是()
A.BaCl2、Na2SO4、Ca(OH)2
B.MgCl2、CuSO4、NaNO3
C.AgNO3、BaCl2、KNO3
D.CaCl2、NaCl、KNO3
三、鉴别题
1、用一种试剂一次就能将澄清石灰水、氢氧化钠溶液、稀盐酸三种无色溶液区别开来的是( )
A.无色酚酞试液
B.二氧化碳气体
C.碳酸钠溶液
D.氯化钡溶液
2、、加水能鉴别碳酸钠、碳酸钙、氢氧化钠吗?
3、现有两瓶失去标签的白色固体,分别是碳酸钠和氢氧化钠。请你对两瓶白色固体进行鉴别:
(1)鉴别它们所用的不同类别的试剂是(任选两种)、。
(2)简述其中一种鉴别的方法:
步骤是;
现象是;
结论是。
4、有几瓶失去标签的溶液分别是氢氧化钠溶液、氯化铁溶液、硫酸镁溶液、硝酸钾溶液,如果不能另选其它试剂,只用本组试剂能否将几种溶液区分开?简述方法步骤。
5、下列各组溶液中,不用其他试剂,只用组溶液相互混合的方法,就能鉴别的一组溶液是()
A、Na2SO4、BaCl2、KNO3
B、Na2CO3、BaCl2、HCl
C、NaOH、Na2SO4、KCl
D、NaCl 、AgNO3、、HCl
6、化学兴趣小组的同学对未贴标签的Na2CO3、NaOH、Ca(OH)2、稀盐酸四瓶溶液进行鉴
别。老师给他们提供的药品只有紫色石蕊试液,实验仪器只有试管和胶头滴管。
(1)甲组同学利用紫色石蕊试液鉴别四种溶液:
(2)乙组三位同学认为,不用紫色石蕊试液也能鉴别出四种溶液,他们分别选定四种待测溶液中的一种,然后分别取其他三种溶液于试管中,分别滴加各自选定的溶液。三位同学观察到的实验现象及结论记录如下:
乙组三位同学经过交流后发现同学的结论是错误的,所滴加的溶液应是
溶液,由此鉴别出了四种溶液。
四、物质的净化除杂
1、从提供的试剂中,选择一种以除去下列物质中的少量杂质(括号为杂质),仅供选用的试
剂:①稀硫酸②氯化钙溶液溶液③盐酸④澄清的石灰水
(1)把选择的试剂的代号填在相应的横线上,并写出反应方程式。
NaCl(Na2C03) ;
NaOH(Na2C03) 。
归纳化学方法除杂的原则:
2、为了除去氯化钠样品中的碳酸钠杂质,某兴趣小组将样品溶解后进行如下实验:
(1)A溶液中溶质可能为____________(只写一种);
(2)将无色溶液与沉淀B分离的操作①的方法名称是_____________;
(3)从无色溶液得到固体物质C的操作②的方法名称是____________;
(4)因为A溶液过量,此方案得到的固体物质C中混有新的杂质,为了既能除去杂质碳酸钠,
又能有效地防止新杂质的引入,可向样品溶液中加入过量的_____________后,直接进行操作②即可得到纯净的氯化钠固体。
3、粗盐提纯的主要操作步骤:、、。
三个步骤都用到了玻璃棒,作用分别是:、、
。
4、日常生活中食用的食盐大多来自海水晾晒。可得到含少量泥沙的粗盐。以下为粗盐的简要精制和除杂过程。
(1)海边的盐民多在夏天晾晒海盐。分析,夏天
有利于得到粗盐是因为。
(2)海水晾晒得到的粗盐中往往含有少量泥沙,为了除去
泥沙等不溶物,某小组设计了如图所示的实验。
在粗盐提纯的操作中,正确的操作顺序为(填序号),
其中A 、B的操作名称为,B中的玻璃棒的作用为。(3)除去泥沙后的食盐中,通常还含有氯化钙、氯化镁、硫酸镁等可溶杂质。要除去这些杂质,选择的药品和加药的顺序均正确的是(填序号)。
①Na2CO3、BaCl2、NaOH②Ba(NO3)2、NaOH、Na2CO3
③BaCl2、NaOH、K2CO3、HCl④BaCl2、NaOH、Na2CO3、HCl
(4)某小组量取了10.0mL 水,称取4.0 g粗盐,逐渐加入水中,并用玻璃棒不断搅拌,继续操作最终蒸干得3.6g精盐,则精盐的产率是。
5.实验盒中有7种没有标签的溶液,老师让化学实验小组同学鉴别这些溶液。
(1)调查研究:①实验盒中记录单上登记的7种溶液是:4KMnO 、32CO Na 、4CuSO 、NaCl 、2)OH (Ca 、NaOH 和稀盐酸,其中有颜色的是_ 溶液。 ②查阅资料:无色有刺激性气味的氯化氢气体溶于水得到盐酸。
③研究方式:从5种无色溶液中任意取出4种为一组进行鉴别。这样的组合共有_____组。
(2)提出假设:同学们从5种无色溶液中取出4种,贴上A 、B 、C 、D 标签,并且假设这一组溶液可能是32CO Na 、NaCl 、2)OH (Ca 和稀盐酸。 (3)实验探究:同学们按以下步骤进行鉴别。
第一步:取4支试管,分别加入少量的A 、B 、C 、D 溶液,然后依次加入少量盐酸,实验现象记录如下:
实验结论:C 是_______________溶液。 第二步:依据右图装置进行实验,其中夹持固定装置已略去。从长颈漏斗加入盐酸,可以观察到C 溶液中有气泡产生,A 溶液中有白色沉淀生成,B 、D 溶液均无明显变化。 实验解释:A 溶液中发生反应的化学方程式为
。
第三步:依据下图装置进行2个实验。取少量B 溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热。再取少量D 溶液倒入另一蒸发皿,加热,有白色固体析出,停止加热。 实验结论:B 是稀盐酸,D 是NaCl 溶液。
经过上述三步实验,同学们认为第5种无色溶液是NaOH 溶液。
(4)实验反思:老师引导同学们讨论了上述实验探究过程。进行了全面反思。
①老师指出:实验结论仍有不确定性。不能确定的是______________溶液;其鉴别方法是____________________________________________________________
②老师提示:鉴别出C 溶液后,不需外加试剂,就可以简便地鉴别出A 、B 溶液。请完成下列实验报告。
实验步骤 实验现象和结论