
水通道蛋白概述
水通道蛋白(Aquaporin),又名水孔蛋白,是一种位于细胞膜上的蛋白质(内在膜蛋白),在细胞膜上组成“孔道”,可控制水在细胞的进出,就像是“细胞的帮浦”一样。水通道是由约翰霍普金斯大学医学院的美国科学家彼得·阿格雷所发现,他与通过X射线晶体学技术确认钾离子通道结构的洛克斐勒大学霍华休斯医学研究中心的罗德里克·麦金农共同荣获了2003年诺贝尔化学奖。水分子经过Aquaporin时会形成单一纵列,进入弯曲狭窄的通道内,内部的偶极力与极性会帮助水分子旋转,以适当角度穿越狭窄的通道,因此Aquaporin的蛋白构形为仅能使水分子通过之原因。水通道蛋白的发现
Agre等(1988)在分离纯化红细胞膜上的Rh多肽时,发现了一个28 kD的疏水性跨膜蛋白,称为形成通道的整合膜蛋白28(channel-forming inte—gral membrane protein,CHIP28),1991年完成了其cDNA克隆(Verkman,2003)。但当时并不知道该蛋白的功能,在进行功能鉴定时,将体外转录合成的CHIP28 eDNA注入非洲爪蟾的卵母细胞中,发现在低渗溶液中,卵母细胞迅速膨胀,并于5 min内破裂。为进一步确定其功能,又将其构于蛋白磷脂体内,通过活化能及渗透系数的测定及后来的抑制剂敏感性等研究,证实其为水通道蛋白。从此确定了细胞膜上存在转运水的特异性通道蛋白,并称CHIP28为Aquaporinl(AQPl)。水通道蛋白分类
AQP0
AQP0最初称之为主体内在蛋白(major intrinsic protein,MIP),在晶状体纤维中细胞中表达丰富,与晶状体的透明度有关.hQpo的突变可能导致晶状体水肿和白内障。小鼠缺乏AQPO将患先天性自内障[61。AQP1
AQP1是1988年发现的,开始将这种蛋白称为通道形成整合蛋白(CHIP),是人的红细胞膜的一种主要蛋白。它可以使红细胞快速膨胀和收缩以适应细胞间渗透性的变化。AQP1蛋白也存在于其他组织的细胞中。AQP1及它的同系物能够让水自由通过(不必结合),但是不允许离子或是其他的小分子(包括蛋白质)通过。AQP1是由四个相同的亚基构成,每个亚基的相对分子质量为28kDa,每个亚基有六个跨膜结构域,在跨膜结构域2与3、5与6之间有一个环状结构,是水通过的通道。另外,AQP1的氨基端和羧基端的氨基酸序列是严格对称的,因此,同源跨膜区(1,4、2,5、3,6)在质膜的脂双层中的方向相反。AQP1对水的通透性受氯化汞的可逆性抑制,对汞的敏感位点是结构域5与6之间的189位的半胱氨酸。其他几种AQP1与肾功能有关。Peter Agre教授因发现水通道蛋白获得2003年诺贝尔化学奖AQPl在质膜中以四聚体的形式存在,每个单体都由6个贯穿膜两面的长a螺旋构成基本骨架,其间还有两个嵌入但不贯穿膜的短a螺旋[4]。每个单体蛋白的中空部分都形成具有高度选择性的通道,只允许水分子跨膜运输而不允许带电质子或其他离子通过,在功能上都可以作为一个独立水通道。存在位置
哺位置功能
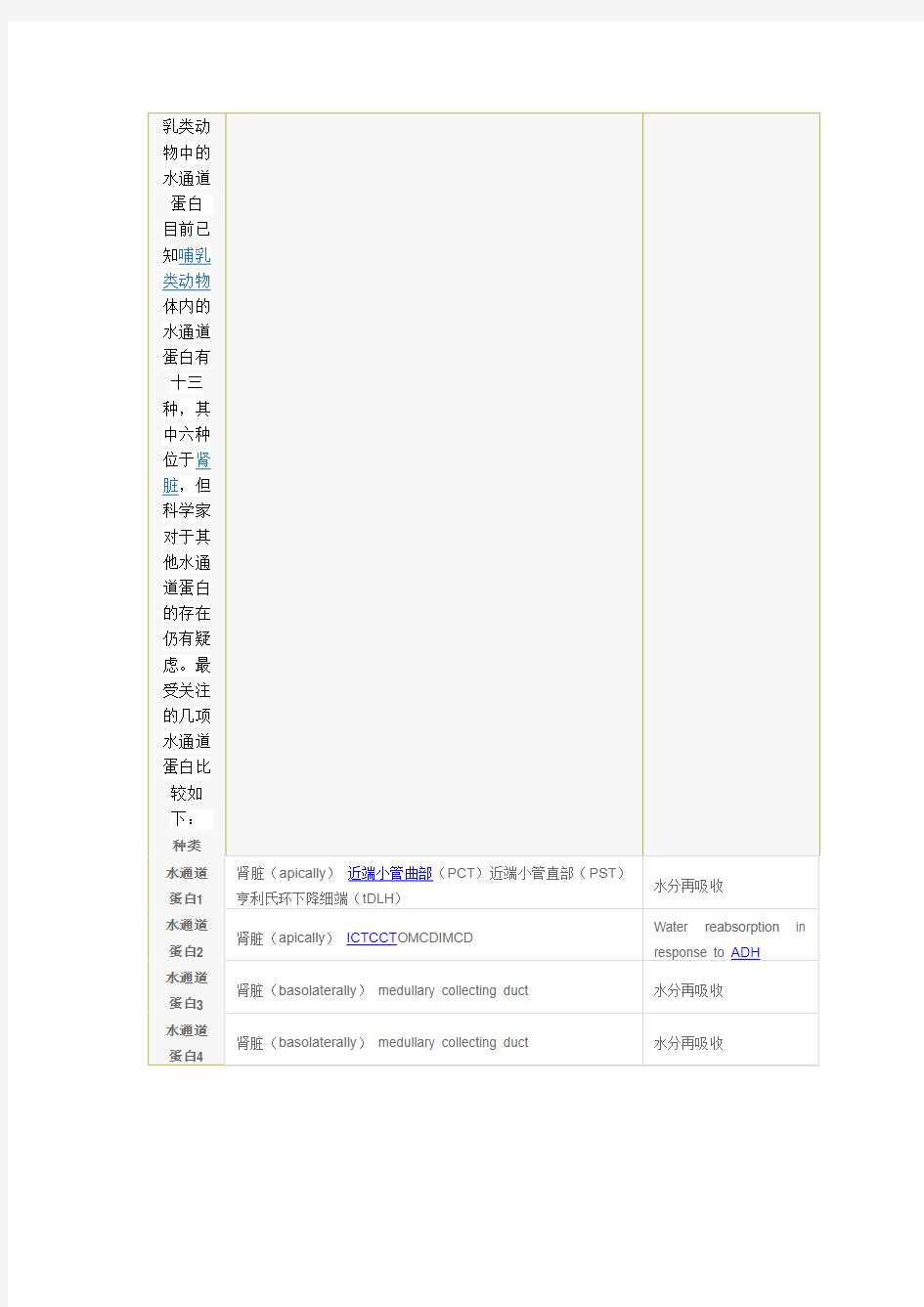
乳类动物中的水通道蛋白目前已知哺乳类动物体内的水通道蛋白有十三种,其中六种位于肾脏,但科学家对于其他水通道蛋白的存在仍有疑虑。最受关注的几项水通道蛋白比较如下:种类
水通道蛋白1 肾脏(apically)近端小管曲部(PCT)近端小管直部(PST)
亨利氏环下降细端(tDLH)
水分再吸收
水通道蛋白2 肾脏(apically)ICTCCT OMCDIMCD
Water reabsorption in
response to ADH
水通道
蛋白3
肾脏(basolaterally)medullary collecting duct 水分再吸收水通道
蛋白4
肾脏(basolaterally)medullary collecting duct 水分再吸收
水分子通道蛋白的结构与功能的关系 姓名:王国栋 院系:基础医学院中西医结合1班 学号:20141025 水分子穿越双磷脂生物膜的输运机理是生理学和细胞生物学中一个长期未能解决的重要问题。AQP1水通道蛋白的发现和鉴定使得人们确认出一个新的蛋白质家族———水通道蛋白家族。正是这一蛋白家族的存在,使得水分子可以进行快速的跨膜传输。由晶体学方法解出的哺乳动物AQP1水通道蛋白的原子结构,最终揭示了水通道蛋白只允许水分子快速传输而阻挡其他的小分子和离子(包括质子H+)的筛选输运机理。本文概述了水通道蛋白对水分子筛选传输的机理。 一、水通道蛋白的重要性 活细胞外面有一层由磷脂组成双层膜,称为双磷脂细胞膜。它将细胞的内环境物质及细胞器等与外部环境区分开。水、离子以及其他极性分子一般不能透过这层双磷脂细胞膜。但是细胞生命活动经常需要有选择性地对这些物质进行快速跨膜传输。这是通过镶嵌在细胞膜上具有输运化学物质功能的膜蛋白来实现的,不同膜蛋白具有输运不同化学物质的能力。 水是活细胞的主要组成部分。在活细胞中,水的比例占总重量的70%左右。大多数的细胞生化反应都是在水环境中进行的。水分子的跨膜输运是如何实现的是生命科学中一个非常重要的基本问题。水分子虽然可以以简单渗透扩散方式通过细胞膜,但是扩散速度非常缓慢。科学研究证明,水分子跨越细胞膜的快速输运是通过细胞膜上的一种水通道蛋(aguaporin ,AQP )实现的。一个AQP1 水通道蛋白分子每秒钟可以允许30 亿个水分子通过。水通道蛋白大量存在于动物、植物等多种生物中。在哺乳动物中,水通道蛋白大量存在于肾脏、血细胞和眼睛等器官中,对体液渗透、泌尿等生理过程非常重要。在植物当中,水通道蛋白直接参与根部水分吸收及整个植物的水平衡。由于水通道蛋白的存在,细胞才可以快速调节自身体积和内部渗透压。由此可见,水通道蛋白对于生命活动至关重要。 二、水通道蛋白的结构 蛋白质的功能是通过其结构来实现的。 要解决一个蛋白的功能机理问题,必须首先 解出它的原子结构。 AQP1 在细胞膜中以四聚体形式存在 (图1)。每个单聚体(即一个AQP1 分子) 是一个独立功能单元,中心存在一个通道管。它由6 个贯穿膜两面的长ɑ螺旋构成基本骨架,其中间有两个嵌入但不贯穿膜的短ɑ螺旋几乎顶对顶地放置着(图2)。在两个短ɑ螺旋相对的顶端各拥有一个在所有水通道家族蛋白中都保守存在的Asn-Pro-Aia (NPA )氨基酸组单元。它们使得这种顶对顶结构得以稳定存在。从两个螺旋的顶端分别延生出一条氨基酸残基松散链条分别回绕,走向各自的膜面。后面我们会看到这种短ɑ螺旋结合松散链条组成的结构单元对水通道功能非常重要。事实上,这种结构单元不仅存在于水通道蛋白中,还在其图1 水通道蛋白的投影密度图。 在双磷脂膜中,4个AOPI 水通道蛋白分子构成一个四聚体。每个水通道分子单体的中心存在一个只允许水分子通过的通道管。
水通道蛋白 水通道蛋白是介导水跨膜转运的一大 膜蛋白家族,分布于高等脊椎动物上皮细胞或内皮细胞。结构上由28-KDa 亚单位组成 四聚体,每个亚单位构成孔径约的水孔通道,在渗透压驱动下实现水双向跨膜转运【1】。目前11 种亚型已经在哺乳动物中被确定, 各种亚型的体内分布具有组织特异性,其中水通道蛋白-4 (Aquaporin 4,AQP4)以极化 形式集中分布于中枢神经系统脑毛细血管 周边的星形胶质细胞足突或室管膜细胞【2】。血脑屏障为脑内另一调控水平衡的复合体,由无窗孔的脑毛细血管内皮细胞及细胞间 紧密连接、基底膜、星形胶质细胞等组成,介于血液和中枢神经系统之间,限制血液中某些离子、大分子物质转移到脑实质,此屏障作用为维持CNS 内环境稳定、保障脑功能正常行使提供了重要保障。BBB 分化发育过程中脑毛细血管内皮细胞间紧密连接的形 成虽被认为是其成熟的标志,但BBB 生理功
能的实现有赖于各组成成分间的相互作用。近来对星形胶质细胞调控BBB 物质交换和 脑内水平衡方面的作用日益受到重视,并认为与AQP4 表达有关。 本文就AQP4 与血脑屏障发育及其完整性关系的研究进展作一综述。 分化发育过程中AQP4 的表达 目前由于对鸡胚视顶盖中血管及BBB 分化的研究已较完善,因此常被用于BBB 的研究模型。Nico 及其同事【3】采用免疫细胞化学、分子生物学技术研究了鸡胚视顶盖AQP4 在BBB 分化发育过程的动态表达。免疫电镜显示鸡胚视顶盖发育第9 d,BBB仅由不规则的内皮细胞组成,内皮细胞间紧密连接尚未形成,AQP4 未见表达。待发育至第14 d,Western blot 技术首次在约30 kDa 链附近检测出AQP4 的免疫活性,电镜下显示短的内皮细胞间紧密连接已形成,并串联构成BBB 的微血管,星形胶质细胞间断黏附于血管壁,AQP4 不连续地表达于血管周边,血管周围仍然存在小空隙。发育第20 d BBB 成熟,内皮细胞间紧密连接形成,BBB 微血管
万方数据
190生命科学第19卷 6条染色体,大鼠位于第5条染色体。CFTR分布广泛,许多器官,如肺、肝、胰腺、肠、生殖腺等的细胞膜中都有表达,尽管称为氯离子通道,但还涉及到其他一价阴离子的运输,由于生理条件下氯离子最为重要,故称为氯离子通道。 图1CFlR型氯离子通道推测的结构模型12】 MSD:跨膜结构域;NBD:核苷酸结合结构域;R:调节结构域;PKA:cAMP依赖的蛋白激酶 CFTR是一种跨膜蛋白质,较难获得理想的晶体,至今未获得完整的结构图像,但由于它属于ABC家族,而ABC家族的部分成员结构已经阐明,因此,根据序列比对推测得到了CFTR的结构(图1)。最近获得了CFTR的一般晶体结构,使用电子显微镜初步获得了它的空间结构,与真核生物另一个ABC家族成员P.糖蛋白在结构上具有相似性【51,说明了推测的合理性。现在可以肯定的是CFTR由5个功能结构域组成:两个跨膜结构域(membrane— spanningdomains,MSD)MSD1和MSD2;两个核苷酸结合结构域(nucleotide-bindingdomains,NBD)NBDl和NBD2;一个调节结构域R。这些结构域中两个MSD形成了选择性氯离子通道,两个NBD结构域调节了氯离子通道的门控性,而R基团的磷酸化控制了通道活性【:】。 2CFTR的调节机制 两个六跨膜结构域MSDl和MSD2共同构成了对氯离子具有选择性的通道,通道最狭窄部位的直径为0.53—0.60nm,在正常情况下,被其他大的阴离子或调节结构域R阻断;当胞内氯离子浓度升高激活了cAMP依赖的蛋白激酶最终可使通道打开,通过这种方式而有效调节了通道的开闭。此 外,胞外的氯离子浓度也可以影响通道的门控,它 的浓度升高也可以促进通道的打开【61。和其他ABC蛋白不同的是CFTR允许氯离子双向通透,而不是定向转运【7】。两个MSD的部分氨基酸构成了对氯离子的选择性运输,如带有正电荷K95、R134、R334、K335、R347和R1030在物种间具有高度保守性,它们的突变会影响到通道对氯离子的通透性【z】,由于CFTR完整结构还未阐明,因此对氯离 子的选择性分子机理也还未完全阐明。 C网t的门控性则主要由两个NBD来调节,对它们的研究则最为详细。NBD含有大量高度保守的序列,每一个NBD结构域都含有一个保守的磷酸结合环(被称为P环或WalkerA基序),此外还含有保守的walkerB基序和LsGGQ基序,推测这些结构域对于ATP的结合和水解发挥着重要作用【扪。 很早就发现√册的结合是通道打开所必需的[4】,ATP的结合和随后的水解有效的调节了通道的门控,而最近研究发现ADP可以抑制通道的打开【8】。NBDl和NBD2都含有ATP结合结构域,同时具有ATP酶活性,可以通过水解ATP的方式来驱动通道的打开。在这个过程中需要大量ATP,但氯离子通道主要介导的是氯离子的被动运输,因此不应该耗费太多能量,研究人员最新发现NBD除了具有ATP酶活性外,还具有腺苷酸激酶活性,腺苷酸激酶主要催化ATP+伽仰?—+2ADP的反应,因此尽管需要大量的ATP,但在生理条件下是腺苷酸激酶活性而不是ATP酶活性主要调节了门控,因此并不耗费太多能量【9】。 那么两个NBD如何在ATP的驱动下实现对氯离子通道的门控作用的呢?Ⅺdd等【101研究表明,当两个结构域单独存在时,ATP酶活性较低,而只有当两者形成二聚体才时可以有效增加酶活性,特别是Ve穆aIli等【ll】最近发现,当NBDl和NBD2独立存在时,氯离子通道关闭,当形成紧密结合的二聚体后氯离子通道打开,并且形成二聚体的过程需要ATP,因此j旧驱动的两个NBD结构域的紧密二聚体化是离子通道打开的前提【12】,从而实现将ATP水解和通道的门控作用有机结合【13】。那么形成的二聚体中两个结构域的功能是否相同呢?研究发现,两个结构域都可以和ATP结合,但只有NBD2可以水解ATP促使通道的打开,说明两个结构域通过各自的机制完成了ATP水解和门控的偶联过程【?引。 相对于ABC家族的其他成员,CFlR是唯一已 万方数据
水通道蛋白的发现及对人体的作用 刘彦成 (渭南师范学院环境与生命科学系陕西渭南 714000)摘要:水通道蛋白(aquaporin,AQP) 是一种对水专一的通道蛋白。具有介导水的跨膜转运和调节体内水代谢平衡的功能。水通道蛋白调节失控与水平衡紊乱等一系列疾病密切相关。 关键词:细胞膜;水通道蛋白(AQP);跨膜转运;疾病;调节 Abstract:The pass of water protein (aquaporin, AQP) is one kind of adding water single-minded channel protein.Has lies between leads the water the cross membrane transportation and the adjustment body domestic waters metabolism balance function.Pass of water protein adjustment out of control and level balance disorder and so on a series of disease close correlation. Key word:Cell membrane pass of water protein (AQP) cross membrane transportation disease adjusts 1 水通道蛋白的发现 1.1 细胞膜的运输方式 细胞是构成生物的基本单位,细胞与细胞之间则是通过细胞膜来沟通和实现基本的生命活动。细胞膜的主要成分为磷脂和蛋白质,其结构为磷脂双分子层,磷脂双分子层上有糖蛋白,糖蛋白所在一侧为细胞外侧。物质跨膜运输可分为自 图1 细胞膜的立体结构 由扩散(不需能量、载体),协助扩散(不需要能量、需载体),主动运输(要能量、需载体)三种。还有一些大分子物质是通过胞吞、胞吐方式通过细胞膜,它们需要能量、不要载体。另外还有一种很主要的方式就是通道蛋白。 1.2 生物膜水通道的发现【1】 长期以来对于水的运输方式研究者普遍认为主要有两种:即简单的扩散方式和借助离子通道通过磷脂双分子层。 近些年研究者发现某些细胞在低渗溶液中对水的通透性很高, 很难用简单扩散来解释。如将红细胞移入低渗溶液后,很快吸水膨胀而溶血,而水生动物的
水通道蛋白的基本结构与特异性通透机理 王晶桑建利 (北京师范大学生命科学学院北京 100875) 摘要水通道蛋白是一个具有跨膜运输水分子功能的蛋白家族。从1988 年Agre 等发现水通道蛋白起,目前在不同物种中已经发现了200 余种水通道蛋白,其中存在哺乳动物体内的有13 种。概述了水通道蛋白的结构、组织特异性分布及特异性通透机理。 关键词水通道蛋白水分跨膜转运 水分子的跨膜转运对维持不同区域的液体平衡和内环境稳态非常重要。水分子作为一种不带电荷且半径极小的极性分子,很早被证实能通过自由扩散穿透脂质双分子层。在发现水通道蛋白以前,人们一直认为这是水分子透过质膜的唯一方式。但通过实验发现,红细胞和肾小管细胞中水的通透速率之快远非简单扩散强度所能提供的,因此猜测,质膜上可能存在某种通道介导水的转运。 1 水通道蛋白的发现 1988年,Agre 等从人类红细胞膜上纯化分离分子量为32×106的Rh 多肽时,偶然鉴定到一种新的分子量为28×106的整合膜蛋白,并且通过免疫印迹发现这类蛋白也存在于肾脏的近端肾小管中[1],把它称为类通道整合膜蛋白(channel-like integralmembrane protein, CHIP28)。随后,在1991 年Agre 和Preston 成功克隆得到了CHIP28 的cDNA,通过分析其编码的氨基酸序列,发现CHIP28 含有6个跨膜区域、2个N-糖基化位点、且N 端和C 端都位于膜的胞质一侧。另外,对比CHIP28 与早期从牛晶体纤维中克隆得到的主要内源性蛋白(major intrinsicprotein,MIP)的DNA 序列,发现二者具有高度同源性。由于很早以前就证实了MIP 家族的成员蛋白参与形成允许水和其他小分子通透的膜通道,因此,推测CHIP28 可能也具有类似功能[2]。1992 年,Preston 等通过在非洲爪蟾的卵母细胞中表达CHIP28,首次证实它是一种水通道蛋白。非洲爪蟾的卵母细胞对水具有极低的渗透性,当向其中显微注射体外转录的CHIP28 的RNA后,卵母细胞在低渗溶液中迅速膨胀,并于5 min内破裂。这一现象表明注射CHIP28 的RNA 后卵母细胞膜的水通透性有了明显提高。为了进一步确定CHIP28 的功能,将提纯的CHIP28 构建在蛋白磷脂体中,构建后的蛋白磷脂体对水的通透性增长了50 倍,但对尿素却不具备通透性[3]。这些结果最终证实了CHIP28 为水通道蛋白,后来它被命名为水通道蛋白-1(aquaporin-1,AQP1)。水通道蛋白的发现,开辟了一个崭新的领域。随着更多亚型的发现,水通道蛋白相关研究成为了膜转运方向的研究热点,Agre 也因其对水通道蛋白做出的突出贡献而获得2003 年诺贝尔化学奖。 2 水通道蛋白的分子结构 水通道蛋白分布广泛,目前已在哺乳动物、两栖类、植物、酵母、细菌以及各种各样的有机体中发现水通道蛋白的存在。水通道蛋白是一类高度保守的疏水小分子膜整合蛋白,各种亚型之间蛋白序列及三维结构非常相似。哺乳动物水通道蛋白的分子大小在26×106~34×106之间,氨基酸序列同源性为19%~52%[4]。因水通道蛋白的三维结构相似,一般以AQP1的结构作为代表。AQP1 是一条由269 个氨基酸残基构成的单肽链,对比AQP1 分子前后半段的氨基酸序列,发现2 段序列具有相关性,推测AQP1在进化上可能是通过基因复制而来。单肽链
摘要 细胞离子通道的结构和功能正常是维持生命过程的基础,其基因变异和功能障碍与许多疾病的发生和发展有关.离子通道的主要类型有钾、钠、钙、氯和非选择性阳离子通道,各型又分若干亚型.离子通道的主要功能是:提高细胞内钙浓度,触发生理效应;决定细胞的兴奋性、不应性和传导性;调节血管平滑肌的舒缩活动;参与突触传递;维持细胞的正常体积.离子通道的主要研究方法为膜片钳技术、分子生物学技术、荧光探针钙图像分析技术.离子通道病是指离子通道的结构或功能异常所引起的疾病.疾病中的离子通道改变是指由于某一疾病或药物引起某一种或几种离子通道的数目、功能甚至结构变化,导致机体发生或纠正某些病理改变.从离子通道与疾病的关系角度,加强分子生物学、生物物理学、遗传学、药理学等多学科交叉深入研究,对于深入探讨某些疾病的病理生理机制、早期诊断及发现特异性治疗药物或措施等均具有十分重要的理论和实际意义. 0 引言 离子通道(ion channel)是细胞膜上的一类特殊亲水性蛋白质微孔道,是神经、肌肉细胞电活动的物质基础.随着分子生物学、膜片钳技术的发展,人们对离子通道的分子结构及特性有了更加深入的认识,并发现离子通道的功能、结构异常与许多疾病的发生和发展有关[1].近年来,对于离子通道与疾病关系的研究取得了重大进展,不仅阐明了离子通道的分子结构突变可导致某种疾病,而且还明确了某些疾病可影响某种离子通道功能甚至结构.本文论述离子通道的主要类型、功能、研究方法及其与疾病的关系. 1 离子通道的主要类型 离子通道的开放和关闭,称为门控(gating).根据门控机制的不同,将离子通道分为三大类:(1)电压门控性(voltage gated),又称电压依赖性(voltage dependent)或电压敏感性(voltage sensitive)离子通道:因膜电位变化而开启和关闭,以最容易通过的离子命名,如K+、Na+、Ca2+、Cl-通道4种主要类型,各型又分若干亚型.(2)配体门控性(ligand gated),又称化学门控性(chemical gated)离子通道:由递质与通道蛋白质受体分子上的结合位点结合而开启,以递质受体命名,如乙酰胆碱受体通道、谷氨酸受体通道、门冬氨酸受体通道等.非选择性阳离子通道(non-selective cation channels)系由配体作用于相应受体而开放,同时允许Na+、Ca2+ 或K+ 通过,属于该类.(3)机械门控性(mechanogated),又称机械敏感性(mechanosensitive)离子通道:是一类感受细胞膜表面应力变化,实现胞外机械信号向胞内转导的通道,根据通透性分为离子选择性和非离子选择性通道,根据功能作用分为张力激活型和张力失活型离子通道.此外,还有细胞器离子通道,如广泛分布于哺乳动物细胞线粒体外膜上的电压依赖性阴离子通道(voltage dependent anion channel,VDAC),位于细胞器肌质网(sarcoplasmic reticulum,SR)或内质网(endoplasmic reticulum,ER)膜上的Ryanodine受体通道、IP3受体通道. 2 离子通道的主要功能 离子通道的主要功能有:(1)提高细胞内钙浓度,从而触发肌肉收缩、细胞兴奋、腺体分泌、Ca2+依赖性离子通道开放和关闭、蛋白激酶的激活和基因表达的调节等一系列生理效应;(2)在神经、肌肉等兴奋性细胞,Na+ 和Ca2+通道主要调控去极化,K+主要调控复极化和维持静息电位,从而决定细胞的兴奋性、不应性和传导性;(3)调节血管平滑肌舒缩活动,其中有K+、Ca2+、Cl-通道和某些非选择性阳离子通道参与;(4)参与突触传递,其中有K+、Na+、Ca2+、Cl-通道和某些非选择性阳离子通道参与;(5)维持细胞正常体积,在高渗环境中,离子通道和转运系统激活使Na+、Cl-、有机溶液和水分进入细胞内而调节细胞体积增大;在低渗环境中,Na+、Cl-、有机溶液和水分流出细胞而调节细胞体积减少. 3 离子通道的主要研究方法 研究离子通道功能的最直接方法是用膜片钳技术直接测定通过离子通道的电流或测量细胞膜电位的变化.膜片钳技术是利用一个玻璃微吸管电极完成膜片或全细胞电位的监测、钳制和膜电流的记录,通过观测膜电流的变化来分析通道个体或群体的分子活动、探讨离子通道特性.分子生物学技术为离子通道的分子结构分析、基因克隆、功能表达研究提供了有力工具,对于编码离子通道亚单位的基因结构可采用基因定位克隆确定其在染色体上的定位,用逆转录-聚合酶链反应、Northern杂交等明确其在器官组织中的分布,用Western杂交检测基因表达产物等.荧光探针钙图像分析技术为检测细胞内游离钙离子浓度提供了有效
氯离子通道异常引发的肌强直(一) 【摘要】细胞膜离子通道结构和功能正常是细胞进行生理活动的基础。钠、钾离子通道在肌肉收缩中的作用一直受人关注。最近的研究表明,氯离子通道在肌肉收缩中也占有很重要的地位,甚至比钠、钾通道更具有决定性的意义。 【关键词】肌强直;CLC突变 骨骼肌的收缩的整个生理过程是以膜的电位变化为特征的兴奋过程和以肌丝滑动为基础的收缩过程,不同的离子通道共同完成这一过程(兴奋-收缩偶联)。肌强直是因为离子通道的功能异常而导致的一种疾病。它的特征是突发自主收缩后肌肉松弛延缓。这是因为离子通道的功能障碍影响了细胞膜的静息电位,从而使骨骼肌纤维浆膜过度兴奋,造成了动作电位的重复产生。 由两种基因独立编码的电压门控氯离子通道和钠离子通道的突变是形成单纯遗传性肌强直的基础。氯离子通道和钠离子通道对细胞膜的作用是相反的:氯离子通道主要是抑制细胞膜的兴奋,稳定静息电位,而钠离子通道主要是兴奋细胞膜,使之产生动作电位〔1〕。 事实上,肌强直的诱发原因是多样的:一方面可以是氯离子通道失去性功能突变降低了氯离子的电导;另一方面,也可以是钠离子通道获得性功能突变导致的多余的离子通道的开放。本文仅就氯离子通道异常所引发的肌强直做一总结论述。 1 CLC氯通道 氯离子在体内含量极为丰富多种细胞存在氯离子浓度梯度。CLC是氯通道 家族的一大类,Mw约75?110kU,均有12个跨膜区和相同的离子选择顺序 (CI->Br->l-)及较低的单位电导值。 CLC基因存在于几乎所有的生物体中,在哺乳动物中发现了9种CLC同源体。 根据它们简单的序列将CLC通道分成三组,其中CLC-0 CLC-1、CLC-Ka和CLC-Kb属于细胞跨膜通道,其他两组可能构成细胞膜内的通道〔2〕。氯离子 通道在功能和结构上与其他离子通道有很大不同,它独一无二的结构特征是双筒型构造〔3〕,CLC可能是由两种完全相同但是相互独立的protopore构成,它们能在开放一段时间后不约而同的关闭。最近的克隆CLC实验证明,这种双 筒构造实际上是同源蛋白的两种形态的分化传导通路〔4〕。相比而言,钠通道是一种蛋白四聚体,四个亚单位沿中央的孔道对称分布,其中每个亚单位在其中行使相同的功能,通道直接垂直于细胞膜表面。而氯离子通道没有这种对称性,既不垂直于膜也不弯曲于膜内。一种更远的关于不对称的推测是一些在空间上相互接近但是在蛋白质一级结构上相隔甚远的区域构成了孔道。这种特殊的构造决定了它在细胞活动中的特殊地位和作用。CLC g离子通道和其他常规 通道的不同点是在通透和门控上的相互影响。阴离子的通透需要通道的开放,这个通透过程又反馈性的调节通道的开放〔5〕。 2氯离子通道与相关疾病
腹腔注射去甲肾上腺素小鼠心肌组织形态学二容积调节性氯离子通道蛋白3表达变化及其意义陈梦青1?黄丹1?2?孙宇1?汪帅1?李春梅1 (1广东药科大学?广州510006?2湖南中医药高等专科学校) 一一摘要:目的一观察腹腔注射去甲肾上腺素(NE)小鼠心肌组织形态学二容积调节性氯离子通道蛋白3(ClC ̄3)表达变化?并探讨其意义?方法一将C57BL/6小鼠分为NE组二酚妥拉明(Phe)+NE组二对照组?NE组每天腹腔注射NE(2mg/kg)?Phe+NE组每天先腹腔注射Phe(8mg/kg)?2h后再腹腔注射NE(2mg/kg)?对照组每天腹腔注射等量生理盐水?所有药物连续注射7d后?测算各组小鼠心脏指数并观察心肌组织形态学变化?Real ̄timePCR法检测各组小鼠心肌组织中ClC ̄3和心房钠尿肽(ANF)mRNA?Westernblotting法检测各组小鼠心肌组织中ClC ̄3蛋白?结果一NE组二Phe+NE组二对照组小鼠心脏指数分别为5.22?0.46二4.80?0.23二4.61?0.25?NE组与Phe+NE组二对照组相比?P均<0.05?NE组小鼠心肌细胞和心肌肌束排列异常?心肌细胞及细胞核异常肥大二变形?细 胞核聚集?出现明显的心脏重构二心肌细胞增大现象?NE组二Phe+NE组二对照组小鼠心肌组织中ClC ̄3mRNA的相对表达量分别为0.50?0.10二1.16?0.38二1.00?0.00?ANFmRNA的相对表达量分别为2.95?1.78二1.96?0.75二1.00?0.00?ClC ̄3蛋白的相对表达量分别为0.46?0.02二0.68?0.02二0.69?0.04?NE组与Phe+NE组二对照组相比?P均<0.05?结论一NE可诱导小鼠心肌肥厚?其机制可能与其抑制ClC ̄3mRNA和蛋白的表达有关?一一关键词:心肌肥厚?去甲肾上腺素?氯离子通道?容积调节性氯离子通道蛋白3?酚妥拉明一一doi:10.3969/j.issn.1002 ̄266X.2019.12.011一一中图分类号:R541一一文献标志码:A一一文章编号:1002 ̄266X(2019)12 ̄0041 ̄03基金项目:国家自然科学基金资助项目(31500926)?广东省自然科学基金资助项目(2014A030310023)? 通信作者:李春梅(E ̄mail:gylichunmei@126.com) Changesandsignificanceofmyocardialhistomorphologyandexpressionofvolume ̄regulatedchloridechannelprotein3inmiceinjectedwithnorepinephrineintraperitoneally CHENMengqing1?HUANGDan?SUNYu?WANGShuai?LIChunmei(1GuangdongPharmaceuticalUniversity?Guangzhou510006?China)一一Abstract:Objective一Toobservethechangesandthesignificanceofmyocardialhistomorphologyandexpressionofvol ̄ume ̄regulatedchloridechannelprotein3(ClC ̄3)inmiceinjectedwithnorepinephrine(NE)byintraperitonealinjection.Methods一C57BL/6miceweredividedintotheNEgroup?phentolamine(Phe)+NEgroup?andcontrolgroup.MiceintheNE groupwereinjectedwithNE(2mg/kg)intraperitoneallydaily?miceinthePhe+NEgroupwereinjectedwithPhe(8mg/kg)daily?2hourslater?withNE?miceinthecontrolgroupweregivenintraperitonealinjectionofthesameamountofnormalsalineperday.After7daysofcontinuousinjectionofalldrugs?thecardiacindexandmyocardialmorphologicalchangesweremeas ̄ured.ClC ̄3andatrialnatriureticpeptide(ANF)weredetectedbyreal ̄timePCR?andWesternblottingwasusedtodetectClC ̄3proteininthemyocardiaofmiceineachgroup.Results一ThecardiacindexesoftheNEgroup?Phe+NEgroupandcontrolgroupwere5.22?0.46?4.80?0.23and4.61?0.25?respectively?significantdifferencewasfoundbetweenthePhe+NEgroupandcontrolgroup(P<0.05).IntheNEgroup?themyocardialcellsandmyocardialmusclebundleswereabnormallyarranged?thecardiomyocytesandnucleuswereabnormallyhypertrophiedanddeformed?andthenucleuswasaggregated?andobviouscar ̄diacremodelingandmyocardialcellenlargementoccurred.TherelativeexpressionlevelsofClC ̄3mRNAinthemyocardialtis ̄suesofNEgroup?Phe+NEgroupandcontrolgroupwere0.50?0.10?1.16?0.38and1.00?0.00?respectively.TherelativeexpressionlevelsofANFmRNAwere2.95?1.78?1.96?0.75?and1.00?0.00?andtherelativeexpressionlevelsofClC ̄3proteinwere0.46?0.02?0.68?0.02?and0.69?0.04?respectively?significantdifferenceswerefoundbetweenthePhe+NE groupandcontrolgroup(allP<0.05).Conclusion一NEcaninducemyocardialhypertrophyinmice?anditsmechanismmayberelatedtoitsinhibitionofClC ̄3mRNAandproteinexpression.14山东医药2019年第59卷第12期
载体蛋白和通道蛋白的区别 2003年诺贝尔化学奖授予了美国科学家阿格雷和麦金农,他们因研究离子通道而获奖;不仅如此,人教版必修三《稳态与环境》在18页讲述静息电位和动作电位的离子基础时也提到:静息时,由于膜主要对K+有通透性,造成K+外流,这是静息电位产生和维持的主要原因;受到刺激时,细胞膜对Na+的通透性增加,Na+内流,使兴奋部位膜内侧阳离子浓度高于外侧,表现为内正外负。上面讲的K+外流与Na+内流其实都是通过膜上的离子通道完成的。同样是必修一教材,在“物质跨膜运输的方式”一节中,提到协助扩散和主动运输都要依赖膜上的载体蛋白来完成。通道蛋白和载体蛋白都与相关物质的跨膜运输有关,那么两者到底有什么区别呢?要回答这个问题,我们先从膜转运蛋白谈起。 在细胞膜上广泛存在着膜转运蛋白(membrane transport proteins),负责无机离子和水溶性小分子的跨膜运输。膜转运蛋白分为两类:一类称为载体蛋白(carrier proteis),它既可以介导被动运输,又可以介导逆浓度或者电化学梯度的的主动运输;另一类为通道蛋白(channel proteins),只能介导顺浓度或化学梯度的被动运输(协助扩散)。 1 载体蛋白 载体蛋白是几乎所有类型的生物膜上普遍存在的多次跨膜蛋白分子。每种载体蛋白能与特定的溶质分子结合,通过一系列构象的改变介导溶质分子跨膜转运,相关模型见下图: 图1 示载体蛋白通过构想改变介导溶质(葡萄糖)被动运输的假想模 该图中膜上的载体蛋白以两种构象状态存在:状态A时溶质结合位点在膜外侧暴露;状态B时,同样的溶质结合位点在膜内侧暴露。该模型认为,两种构象状态的改变是随机发生的。假如溶质浓度在膜的外侧高,则状态A→状态B的转变比状态B→状态A的转变更常发生,因此溶质顺浓度梯度进入细胞。换句话说,物质究竟向哪个方向运输,取决于该物质在膜两侧的浓度差。除了被动运输,载体蛋白还介导逆浓度梯度的主动运输。由于运输过程向着被运输物质的自由能增加的方向进行,所以该过程不能自发进行,需要提供能量才能完成。一些离子(如Na+、K+等)在细胞内外存在着显著的差异,并且细胞能够维持这种恒定的离子梯度差,正是相关载体蛋白(如Na+,K+—ATP酶等)介导的主动运输的结果。 载体蛋白相当于结合在细胞膜上的酶,有特异性结合位点,可与底物(溶质)发生暂时的、可逆性的结合和分离,且一种特异性载体只转运一种类型的分子或离子;转运过程类似于酶与底物作用的饱和动力学曲线;既可以被底物类似物竞争性抑制,又可以被痕量的某种成分(抑制剂)非竞争性抑制以及对PH的依赖性等,因此有人
氯离子通道异常引发的肌强直(一) 【摘要】细胞膜离子通道结构和功能正常是细胞进行生理活动的基础。钠、钾离子通道在肌肉收缩中的作用一直受人关注。最近的研究表明,氯离子通道在肌肉收缩中也占有很重要的地位,甚至比钠、钾通道更具有决定性的意义。 【关键词】肌强直;CLC;突变 骨骼肌的收缩的整个生理过程是以膜的电位变化为特征的兴奋过程和以肌丝滑动为基础的收缩过程,不同的离子通道共同完成这一过程(兴奋-收缩偶联)。肌强直是因为离子通道的功能异常而导致的一种疾病。它的特征是突发自主收缩后肌肉松弛延缓。这是因为离子通道的功能障碍影响了细胞膜的静息电位,从而使骨骼肌纤维浆膜过度兴奋,造成了动作电位的重复产生。 由两种基因独立编码的电压门控氯离子通道和钠离子通道的突变是形成单纯遗传性肌强直的基础。氯离子通道和钠离子通道对细胞膜的作用是相反的:氯离子通道主要是抑制细胞膜的兴奋,稳定静息电位,而钠离子通道主要是兴奋细胞膜,使之产生动作电位〔1〕。 事实上,肌强直的诱发原因是多样的:一方面可以是氯离子通道失去性功能突变降低了氯离子的电导;另一方面,也可以是钠离子通道获得性功能突变导致的多余的离子通道的开放。本文仅就氯离子通道异常所引发的肌强直做一总结论述。 1 CLC氯通道 氯离子在体内含量极为丰富多种细胞存在氯离子浓度梯度。CLC是氯通道家族的一大类,Mw 约75~110kU, 均有12个跨膜区和相同的离子选择顺序(Cl->Br->I-) 及较低的单位电导值。 CLC基因存在于几乎所有的生物体中,在哺乳动物中发现了9种CLC同源体。根据它们简单的序列将CLC通道分成三组,其中CLC-0、CLC-1、CLC-Ka和CLC-Kb属于细胞跨膜通道,其他两组可能构成细胞膜内的通道〔2〕。氯离子通道在功能和结构上与其他离子通道有很大不同,它独一无二的结构特征是双筒型构造〔3〕,CLC可能是由两种完全相同但是相互独立的protopore构成,它们能在开放一段时间后不约而同的关闭。最近的克隆CLC实验证明,这种双筒构造实际上是同源蛋白的两种形态的分化传导通路〔4〕。相比而言,钠通道是一种蛋白四聚体,四个亚单位沿中央的孔道对称分布,其中每个亚单位在其中行使相同的功能,通道直接垂直于细胞膜表面。而氯离子通道没有这种对称性,既不垂直于膜也不弯曲于膜内。一种更远的关于不对称的推测是一些在空间上相互接近但是在蛋白质一级结构上相隔甚远的区域构成了孔道。这种特殊的构造决定了它在细胞活动中的特殊地位和作用。CLC氯离子通道和其他常规通道的不同点是在通透和门控上的相互影响。阴离子的通透需要通道的开放,这个通透过程又反馈性的调节通道的开放〔5〕。
水通道蛋白 水通道蛋白(Aquaporin),又名水孔蛋白,是一种位于细胞膜上的蛋白质(内在膜蛋白),在细胞膜上组成“孔道”,可控制水在细胞的进出,就像是“细胞的水泵”一样。 水通道是由约翰霍普金斯大学医学院的美国科学家彼得·阿格雷所发现,他与通过X射线晶体学技术确认钾离子通道结构的洛克斐勒大学霍华休斯医学研究中心的罗德里克·麦金农共同荣获了2003年诺贝尔化学奖。 水分子经过Aquaporin时会形成单一纵列,进入弯曲狭窄的通道内,内部的偶极力与极性会帮助水分子旋转,以适当角度穿越狭窄的通道,因此Aquaporin的蛋白构形为仅能使水分子通过之原因 水通道蛋白的发现 编辑 Agre等(1988)在分离纯化红细胞膜上的Rh多肽时,发现了一个28 kD的疏水性跨膜蛋白,称为形成通道的整合膜蛋白28(channel-forming inte—gral membrane protein,CHIP28),1991年完成了其cDNA克隆(Verkman,2003)。但当时并不知道该蛋白的功能,在进行功能鉴定时,将体外转录合成的CHIP28 mDNA 注入非洲爪蟾的卵母细胞中,发现在低渗溶液中,卵母细胞迅速膨胀,并于5 min 内破裂。为进一步确定其功能,又将其构于蛋白磷脂体内,通过活化能及渗透系数的测定及后来的抑制剂敏感性等研究,证实其为水通道蛋白。从此确定了细胞膜上存在转运水的特异性通道蛋白,并称CHIP28为Aquaporinl(AQPl)。 水通道蛋白分类 编辑 AQP0 AQP0最初称之为主体内在蛋白(major intrinsic protein,MIP),在晶状体纤维中细胞中表达丰富,与晶状体的透明度有关.AQpo的突变可能导致晶状体水肿和白内障。小鼠缺乏AQPO将患先天性白内障[61]。 AQP1 AQP1是1988年发现的,开始将这种蛋白称为通道形成整合蛋白(CHIP),是人的红细胞膜的一 种主要蛋白。它可以使红细胞快速膨胀和收缩以适应细胞间渗透性的变化。AQP1蛋白也存在于
离子通道蛋白和载体蛋白(离子泵)的异同 相同点:化学本质均为蛋白质、分布均在细胞的膜结构中、都有控制特定物质跨膜运输的功能 不同点: 1.通道蛋白参与的只是被动运输,在运输过程中并不与被运输的分子结合,也不会移动,并且是从高浓度向低浓度运输,所以运输时不消耗能量。 2.载体蛋白参与的有主动运输和协助扩散,在运输过程中与相应的分子结合,并且会移动。在主动运输过程中由低浓度侧向高浓度运动,且消耗代谢能量;在协助扩散过程中,由高浓度侧向低浓度侧运动,不消耗代谢能。(注;协助扩散也属于被动运输) 相关资料: 1、被动运输的通路称离子通道,主动运输的离子载体称为离子泵。生物膜对离子的通透性与多种生命活动过程密切相关。例如,感受器电位的发生,神经兴奋与传导和中枢神经系统的调控功能,心脏搏动,平滑肌蠕动,骨骼肌收缩,激素分泌,光合作用和氧化磷酸化过程中跨膜质子梯度的形成等。 离子通道依据其活化的方式不同,可分两类:一类是电压活化的通道,即通道的开放受膜电位的控制,如Na+、Ca+、Cl-和一些类型的K+通道;另一类是化学物活化的通道,即靠化学物与膜上受体相互作用而活化的通道,如Ach受体通道、氨基酸受体通道、Ca+活化的K+通道等。 2、细胞膜上存在两类主要的转运蛋白,即:载体蛋白(carrier protein)和通道蛋白(channel protein)。
载体蛋白又称做载体(carrier)、通透酶(permease)和转运器(transporter)。能够与特异性溶质结合,通过自身构象的变化,将与它结合的溶质转移到膜的另一侧。载体蛋白有的需要能量驱动,如:各类ATP驱动的离子泵;有的则不需要能量,以自由扩散的方式运输物质,如:缬氨酶素。这里要注意,之所以称为通透酶,是因为它与所运输物质之间有对应关系,特意性强。 通道蛋白与所转运物质之间的结合较弱,它能形成亲水的通道(可以想象为亲水的孔,如porin),当通道打开时能允许特定大小的溶质通过,特异性不如载体蛋白强。所有通道蛋白均以自由扩散的方式运输溶质,不消耗能量。 (我是一相关大学教师,但愿能帮到你)。 3、协助扩散(facilitated diffusion)是小分子物质经膜转运蛋白顺浓度梯度或电化学梯度跨膜的转运。膜转运蛋白可分为两类:一类是通道(channel)蛋白,另一类是载体(carrier)蛋白。(1).离子通道(ion channel) 离子通道被认为是细胞膜中一类内在蛋白构成的孔道。可为化学方式或电学方式激活,控制离子通过细胞膜顺电化学势流动。(2)载体载体也是一类内部蛋白,由载体转运的物质首先与载体蛋白的活性部位结合,结合后载体蛋白产生构象变化,将被转运物质暴露于膜的另一侧,并释放出去。由载体进行的转运可以是被动的(顺电化学势梯度),也可以是主动的(逆电化学势梯度)
水通道蛋白水通道- 从原子结构到临床医学 生物膜的透水性在生理学上是一个长期存在的问题,但负责此类蛋白质的蛋白质仍然未知,直到发现水通道蛋白1(AQP1)水通道蛋白。AQP1由渗透梯度驱动的水选择性渗透。人类AQP1的原子结构最近被定义。四聚体的每个亚基含有允许水分子单文件通过但中断氢键通过质子所需的单独水孔。已经鉴定了至少10种哺乳动物水通道蛋白,并且它们被水(水通道蛋白)或水加甘油(水甘油聚糖)选择性渗透。表达位点与临床表型密切相关,从先天性白内障到肾源性尿崩症。在植物,微生物,无脊椎动物和脊椎动物中发现超过200个水通道蛋白家族成员,并且它们对这些生物体的生理学的重要性正在被揭开。 在20世纪20年代发现脂质双层提供了当沐浴在较低或较高pH或含有毒性浓度的Ca2 +或其他溶质的细胞外液中时细胞如何维持其最佳细胞内环境的解释。从1950年代开始发现离子通道,交换剂和共转运体为溶质的跨膜运动提供了分子解释。然而,长期以来,假定水的输送是由于通过脂质双层的简单扩散。来自具有高膜渗透性的多个实验系统的观察,例如两栖膀胱和哺乳动物红细胞,表明通过脂质双层的扩散不是水跨越膜的唯一途径。虽然提出了各种解释,但直到10年前发现AQP1才能知道分子水- 特异性转运蛋白(Preston等,1999)。
现在人们普遍同意扩散和通道介导的水分运动都存在。通过所有生物膜以相对较低的速度发生扩散。水通道蛋白水通道发现于上皮细胞的一部分10至100倍的水渗透能力。值得注意的是,水通道蛋白水通道的选择性非常高,甚至质子(H3O +)被排斥。在大多数组织中,扩散是双向的,因为水进入细胞并从细胞释放,而水通道蛋白介导的体内水流则由渗透或液压梯度引导。扩散的化学抑制剂是未知的,扩散发生在高Ea(Arrhenius活化能)。相比之下,大多数哺乳动物水通道蛋白受汞的抑制,Ea等同于大量溶液中水的扩散(?5 kcal mol_1)。 水通道蛋白的发现说明了偶发性在生物学研究中的重要性,并且引起了上游流体运输过程中水如何穿过生物膜的范式的完全转变。这个话题对正常生理学以及影响人类的多种临床疾病的病理生理学非常重要。水通道蛋白在几乎每一种生物体中被鉴定出来,包括高等哺乳动物,其他脊椎动物,无脊椎动物,植物,真细菌,原细菌和其他微生物,表明这种新认可的蛋白质家族参与了整个自然界的不同生物过程。 一、发现AQP1 红细胞Rh血型抗原不知道参与水运(Heitman&Agre,2000),但是Rh的研究导致了水通道蛋白的偶然发现。用于纯化Rh多肽的生物化学技术产生污染的28kDa多肽(Agre等,1987)。基于洗涤剂中的28kDa蛋白质的相对不溶性,N-月桂酰肌氨酸,开发了产生大量蛋白质的简单纯化系统。红细胞和肾近端小管- 具有最高已知水渗透性
气道中氯离子转运通路的研究概况 晏斌林 (江西医学院2002级硕士研究生,江西南昌330006) 关键词:氯离子;转移通路;气道 中图分类号:R33 文献标识码:A 文章编号:1000-2294(2005)01-0117-02 Cl-是体内最为丰富和常见的阴离子,它参与了细胞的多种活动和功能调节过程,如细胞电活动调节、容积调节、跨上皮物质转运、细胞内PH调节,在细胞免疫应答、细胞迁移、细胞增殖和分化,细胞凋亡中都发挥一定的作用[1]。近年来关于氯离子转运通路的研究表明人类的多种疾病与Cl-转运通道的功能改变或缺失有关,因此氯离子转运通路越来越受到重视。在气道中与氯离子跨膜转运有关的通路主要有氯通道,其他则为细胞膜上的阴离子交换蛋白及转运体如:Cl-/HCO3-离子交换系,Na+-2Cl--K+共同转运体等。本文将着重介绍气道上皮细胞膜上表达的多种通道的特点以及可能的生理和病理作用。 1 呼吸道氯离子通道及其临床意义 1.1 CF T R Cl-通道 囊性纤维变性(CF)是上皮细胞对Cl-不通透引起的疾病。CF是CF T R突变引起的,CF T R还可调节外向整流氯通道,N a+通道,用cA mp刺激CF T R会导致上皮细胞N a+通道的关闭[2]。其基因已克隆,相应的蛋白CF T R(cy stic fi-bro sis transmembra ne co nductance reg ulato r)是一种氯通道[3]。 CF T R是一种磷酸化依赖性上皮细胞Cl-通道。Rior-dan等于1989年最早克隆得到其cDN A基因编码。CF T R 主要位于气道上皮顶侧膜,在跨上皮盐类转运,水分流动和离子浓度调节中发挥重要作用。 CF T R由1480个氨基酸组成,它有两个六次跨膜区(T M D)。两个核苷酸连接区(N BD)和一个调节区。跨膜区参与孔道的形成。CF T R门控特征可能受到A T P的调节[4],在第一个N BD上被水解可打开通道,在第二个N BD 上结合使通道稳定于开放状态,水解则使通道关闭,有趣的是去掉CFT R的C端(第二T M D和第二个N BD)通道的基本性质不变,这说明此突变体以二聚体的形式完成其功能,也说明第一个T M D对孔道的形成有关键性作用。此外PK A可激活CF T R。 Cl-分泌对液体和电解质转运是至关重要的,CF T R介导的Cl-分泌占主要部分,CF患者不能分泌足够的Cl-,以致于粘膜表面不能充分地与水结合,更重要的是影响粘液从腺管分泌出。CF T R功能缺陷的患者分泌的粘液与正常人很不一样,粘液包含有细菌感染产物,包括粘液脂质,肌动蛋白还有蛋白酶等[5]。它具有更多非易失性的固体成分,增加粘液的粘度。这样的改变足以缩减粘液清除率,由此造成哮喘,慢性阻塞肺气肿(COP D)等。 1.2 C LC家族 CLC蛋白构成一大类氯通道家族,分子量约为75~110 K u,均有12个跨膜区和相同的离子选择顺序(Cl->Br-> I-)及低的单位电导值,如C LC-0为10pS,CLC-1则仅为1pS[6]。该通道在哺乳动物细胞中普遍存在,已发现了九个CLC家族基因,依其同源性可分成三组:接近电鱼器官的CLC-0和肾特异性的C LC-ka,C LC-kb,功能缺失导致高钙尿症和低分子量蛋白尿症的肾结石病[7]。CLC-1是哺乳动物骨骼肌的主要氯通道,功能缺失会使肌膜动作电位复极化延缓,导致肌强直。 无处不在的C LC-2Cl-通道能促进上皮Cl-分泌,它可以被强超级化或细胞膨胀激活,可能参与细胞体积调节,防止在高于平衡电位时氯离子积累。CLC-2在细胞容积增大以及随后的Cl-和水外流而引起调节性容积,减少过程中发挥重要的作用。但即使在等渗状态下,由代谢引起的细胞内外物质交换会导致细胞容积的小幅度变化,从而也有可能引起这种通道的激活或失控[8]。CL C对SIT S、D IDS、N PP B敏感。通道激活与胞钙浓度无关,对PK的阻断剂不敏感。人们已经在人和鼠发现CLC-2位于纤毛细胞顶侧,分布位置与CF T R有重叠性,一些实验数据支持当CF T R缺陷时, CLC-2也许代偿性加强Cl-分泌[5]。 1.3 细胞内钙激活的Icl,ca(CLCA或CaCC) CLCA通道由Ca2+激活,是受细胞内钙控制的配体门控通道。在对称性Cl-浓度具有线性电流-电压关系,其离子选择顺序为I->Br->Cl-。尽管该通道的电导较低(约1.0~1.3pS)但密度很高。由于Icl,ca受细胞内Ca2+的控制,因此它的作用始终与电压依从性钙通道的激活和肌质网钙的释放密切相关,由于肾上腺受体和毒覃硷受体可增加和小细胞内瞬间电流的大小。因此这两种受体也对Icl,ca 有调节作用,Icl,ca也受N a+/Ca2+交换的调节。Icl,ca的增加可作为另一种负反馈,通过减小动作电位的初始平台电位而限制钙的内流。 CLCA Cl-通道广泛分布人类分泌器官中,CL CA1主要分布在气道上皮尤其是杯状细胞上,消化道也可见。 收稿日期:2004-09-02