化学式的书写
- 格式:doc
- 大小:43.50 KB
- 文档页数:2

化学式的正确书写方式
化学式的正确书写方式可以用以下几种方式:
1. 普通字符表示:使用化学元素的符号和数字表示化学式。
例如:H2O表示水,C6H12O6表示葡萄糖。
2. 字母下标表示:在元素的符号后面用下标表示原子的个数。
例如:CO2表示二氧化碳。
3. 括号表示:使用括号来表示化合物中某一部分的重复单元。
例如:(NH4)2SO4表示硫酸铵。
4. 中括号表示:使用中括号来表示一组原子的整体。
例如:
[Fe(H2O)6]Cl2表示六水合氯化亚铁。
5. 分子式和离子式表示:使用化合物的分子式或离子式来表示不同类型的化学式。
例如:NaCl表示氯化钠,Mg(OH)2表示氢氧化镁。
需要注意的是,在书写化学式时应注意元素符号的大写和小写、数字的下标位置和括号的使用,以确保化学式的准确和清晰。

化学表达式写法1、单质化学式的写法:首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。
稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。
金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
2、化合物化学式的写法:首先按正前负后的顺序写出组成化合物的所有元素符号,然后盲敏在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。
一定顺序通常是指:氧元素与另一元素组成的化合物,一般要把氧元素符号写在右边;氢元素与另一元素组成的化合物,一般要把氢元素符号写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素符号写在右边。
直接由离子构成的化合物,其化学式常用其离子最简单整数比表示。
注意:当某组成元素原子个数比是1时,1省略不写;氧化物化学式的书写,一般把氧的元素符号写在右方,另一种元素的符号写在左方,如CO2;由金属元素与非金属元素组成的化合物,书写其化学式时,一般把金属元素符号写在左方,非金属元素符号写在右方,如NaCl。
正负化合价代数和为零。
扩展资料:一、化学式的计算1、计算相对分子质量同种元素的相对原子质量与其原子个数相乘,不同原子的相对原子质量相加。
2、计算组成物质中各元素的质量比化学式中各元素的质量比,就是各元素的相对原子质量总和之比3、计算化合物中某元素质量公式:化合物中某元素质量=化合物质量×某元素质量分数二、读法化学式的读法,一般是从右向左读作“X化X”,如“CuO”读作氧化铜。
当一个分子中原子个数不止一个时,还要读出粒子个数,如“P₂O₅”读作五氧化二磷。
有带酸的原子团要读成“X酸X”如“CuSO₄”读作硫酸铜。
还有的要读“氢氧化X”,如“NaOH”叫氢氧化钠。
在读含铁化合物时还要注意铁的化合价,+3价读作铁(如“FeCl3”读作“氯化铁哨毙”),+2价读作亚铁(如“FeCl₂”读作“氯化亚铁”)。

化学式书写化学式书写是一项非常重要的技能,对于学习化学的学生和从事相关行业的人员来说都是必不可少的。
化学式是指用化学符号表示化学物质分子或离子构成的表示方法,它包含了化学物质中原子和分子的种类和数量,是指示化学反应和物质性质的基础。
正确书写化学式是化学学习和应用的基础,下面将详细介绍化学式书写的相关知识。
一、离子和化合物名称的表示方法离子是指带电荷的原子或原子团,常见的离子有阳离子和阴离子。
阳离子是指失去一个或多个电子的正离子,如Na+,Mg2+等;阴离子是指获得一个或多个电子的负离子,如Cl-,OH-等。
在化学式书写中,阳离子一般写在前面,阴离子写在后面,两者通过离子键连接在一起。
化合物是指由两个或两个以上不同元素构成的纯物质,一般分为离子化合物和共价化合物两种。
离子化合物通常由金属和非金属之间的化合形成,如NaCl,MgO等,它们的化学式中包含了阴离子和阳离子。
共价化合物一般由非金属之间的化合形成,如H2O,CO2等,它们化学式中的原子间是通过共价键连接起来的。
在表示离子和化合物名称时,需要注意以下几点:1. 离子式中离子的化学式应写在方框中,并在上角写上离子电荷。
2. 阴离子缩写的后面应使用“-”符号表示离子电荷,如Cl-,SO42-等。
3. 由两个非金属原子形成的分子,化学式应该按照电负性大小来写,电负性大的原子带负电,较小的原子不带电,如H2O。
4. 由金属离子和非金属离子组成的离子化合物,其中正离子写在前面,负离子写在后面,两者间用一根水平的离子键连接,如NaCl。
二、原子间化学键的表示方法原子间化学键是指两个或两个以上原子间的结合方式,通常分为离子键、共价键和金属键三种。
离子键是指由阴离子和阳离子之间的静电吸引力而形成的键,通常在离子化合物中出现,如NaCl,MgO等。
在化学式书写中,使用一根水平线表示离子键连接两个离子。
共价键是指由两个原子共享一个或多个电子而形成的键,通常出现在分子中。

化学式的书写要想正确地书写化学式,就必须掌握一定的规则,那么,化学式的书写有哪些规则呢?下面分别从单质和化合物的角度进行阐述,供同学们学习时参考。
一、单质化学式的书写1.用元素符号表示:(1)所有金属。
化学式如Cu Fe Mg Hg 、、、等。
(2)所有稀有气体。
如He Ne Ar 、、等。
(3)固态的非金属单质。
如S 、P 、C 等。
2.双原子分子:(1)液态的非金属单质。
如Br 2等。
(2)气态的非金属单质(除稀有气体单质)。
如O N H 222、、 、Cl 2等。
说明:绝大多数单质的书写符号上述规则,但也有一些特别的,如臭氧,作为一种气态的非金属单质,它的化学式为O 3;在常温下碘为固态的非金属单质,它的化学式为I 2。
二、化合物化学式的书写书写规则:正价符号左,负价符号右,化合价,标上方,先约简,后交叉,原子个数标右下。
1、氧化物(从右向左读作“氧化某”,有的还要读出原子个数)氧化镁 氧化钙 二氧化硫 三氧化二铝 氧化钠2、氯化物(从右向左读作“氯化某”)氯化氢 氯化钾 氯化钡 氯化镁 氯化钙3、酸 (以氢氧元素以外的元素名称读作“某酸”) H+酸根硫酸 磷酸 碳酸 硝酸4、氢氧化物 (从右向左读作“氢氧化某”) 金属符号+氢氧根 R (OH )n 氢氧化钠 氢氧化钙 氢氧化铜 氢氧化钡5、某酸某 (从右向左酸根读作某酸,再读金属名称,读作“某酸某”)金属+酸根硫酸钾 硝酸钾 磷酸钙 碳酸钠 高锰酸钾 氯酸钾6、含有铵根 (从右向左读作“某化铵”或“某酸铵”)氯化铵 硝酸铵 硫酸铵7、金属有可变化合价,高价按常规读法,低价读作“亚某”硫酸铜 硫酸铁 硫酸亚铁 氧化铁 氧化亚铁8、铁的氧化物:氧化铁(三氧化二铁) 氧化亚铁 四氧化三铁9、特殊情况,氨气(N .H 3)负价在左边,在N .H 4N .O 3中铵根中的氮-3价,硝酸根中的氮+5价。

初中化学知识点解析化学式的写法与命名规则在初中化学学习中,化学式是我们学习的重要内容之一。
化学式有助于我们理解化学元素的组合、化合物的构成以及化学反应的发生。
本文将解析化学式的写法与命名规则,帮助大家更好地掌握初中化学知识。
一、化学式的写法化学式是用化学符号和数字表示化学元素的种类和相对数量。
常见的化学符号有元素的拉丁名或拉丁字母的缩写形式,例如氢元素的符号是H,氧元素的符号是O。
那么如何正确地书写化学式呢?1. 电离状态:当某个元素以离子形式存在时,需要在元素符号右上方加上对应的电荷数。
例如,氢离子的化学式为H+,氯离子的化学式为Cl-。
2. 反应物与生成物:在化学反应中,反应物和生成物的化学式一般通过“+”连接。
例如,氧气和氢气反应生成水的化学式为:O2 + H2 → H2O。
3. 分子表示法:当分子中存在多个相同的原子时,可以用小写字母和数字表示,以表示原子的数量。
例如,二氧化碳的化学式为CO2,表示一个碳原子和两个氧原子。
二、化学式的命名规则除了正确书写化学式,初中化学也涉及了化合物的命名规则。
下面是一些常见的化学式命名规则:1. 二元化合物:由两种非金属元素组成的化合物叫做二元化合物。
命名时,通常先写金属元素的名称,后写非金属元素的名称,并将非金属元素的名称末尾改为“-ide”。
例如,氯气和氢气反应生成盐酸,化学式为HCl,其中H为氢元素,Cl为氯元素。
由于氯是非金属元素,所以将其名称末尾的“氯”改为“氯化”,最终得到盐酸的名称。
2. 多元化合物:由三种或三种以上元素组成的化合物叫做多元化合物。
命名时,先写离子式中阳离子的名称,后写阴离子的名称,并将阴离子名称末尾改为“-ide”。
例如,氢氧化钠的化学式为NaOH,其中Na为钠元素,OH为氢氧根离子。
将钠的名称命名为“氢氧化钠”。
3. 酸的命名:酸是含有氢阳离子的化合物。
命名时,先写酸性离子的名称,后写“酸”。
例如,盐酸的化学式为HCl,其中Cl为氢离子。

化学式的书写规则首先我们要知道什么是化学式.化学式就是用元素符号来表示物质组成的式子。
书写化学式要遵循哪些原则.首先要符合事实,也就是说你写出的化学式要事实存在。
然后化学式要遵循元素化合价代数和为零,你写出的化学式中各个元素的化合价乘以右下角标,再求和,要等于零.化学式可按照物质的不同分为:单质和化合物两大类。
下面将逐一说明.单质化学式是最容易写的,因为单质就是有一种元素构成的物质。
化学式的书写方法是写出构成该单质的元素符号,再在右下角写上数字(代表一个分子由几个原子组成的,“1”全部省略。
).一般单质可以分为两类:金属单质和非金属单质.金属单质的化学式就是金属元素的符号,如:Cu、Fe、Mg、Hg 等。
非金属单质分为单原子分子、双原子分子和多原子分子。
单原子分子有稀有气体和一般的固体单质(不作说明情况下,固体单质一般作为单原子.)如:He、Ne、Ar,S、P、C等.双原子分子和多原子分子可以放在一起。
一般气体(除稀有气体)和液体大多是双原子的,多原子的较少。
如O2、N2、H2、Cl2,Br2等。
多原子的一般有:臭氧(O3)等.化合物种类较多。
一般分为:氧化物、酸、碱、盐。
氧化物的书写规则较简单。
氧化物的读法一般是几氧化几某。
如何书写化学式呢?首先把氧元素写在右边,“某"写在左边。
再把几几分别写在对应元素的右下角.如:三氧化二铁(Fe2O3),氧化镁(MgO),一氧化碳(CO)等.无论是金属氧化物还是非金属氧化物,都是如此。
有时不说几氧化几某,而是直接说氧化某.这就要求你熟练掌握元素的化合价。
如:氧化铁,即三氧化二铁(Fe2O3);氧化亚铁,即一氧化铁(FeO).酸碱盐的化学式书写规则可以与氧化物对比.酸类一般有某酸,亚某酸。
还有一些不是常见的,如偏某酸(中学化学中一般就是偏铝酸);高某酸、次某酸(一般就是指高氯酸、氯酸、次氯酸)等。
酸就是由氢离子和酸根组成的.一般形式是HxM (M代表酸根)。

化学式的书写规则
一、单质化学式的写法
首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。
稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。
金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
二、化合物化学式的写法
首先按正前负后的顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。
一定顺序通常是指:氧元素与另一元素组成的化合物,一般要把氧元素符号写在右边;氢元素与另一元素组成的化合物,一般要把氢元素符号写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素符号写在右边。
直接由离子构成的化合物,其化学式常用其离子最简单整数比表示。

【化学方程式的书写原则】1)必须以客观事实为依据,不能凭空臆造事实上不存在的物质和化学反应.2)遵守质量守恒定律,使等号两边原子的种类和数目必须相等.2.化学方程式的书写步骤:书写化学方程式要按一定步骤进行,避免出现一些不必要的错误,如漏掉反应条件和“↑”“↓”等.书写化学方程式的一般步骤可概括为:“一写,二配,三注”(以高锰酸钾受热分解为例)【化学方程式的书写步骤】1)写:根据事实写出反应物和生成物的化学式(左反、右生),并在反应物和生成物之间画一条短线.2)配:配平化学方程式的目的是使等号两边的原子种类与数目相等,遵守质量守恒定律,配平后要加以检查.3)注:注明化学反应发生的条件(点燃、加热等),标出生成物状态(气体,沉淀等),把短线改成等号.【书写化学方程式的注意事项】1)化学反应的常见条件有“点燃”、“加热”(常用“△”表示)“高温”,“催化剂”等,写在等号上方;2)如果反应物没有气体而生成物中有气体,在气体物质的化学式右边要注“↑”;3)溶液中的反应如果生成物是固体,在固体物质化学式右边注“↓”.【书写化学方程式的口诀】左写反应物,右写生成物;写准化学式,系数(化学计量数)要配平;中间连等号,条件要注明;生成气体和沉淀,要用“↑”“↓”来标明.【化学方程式的配平】配平化学方程式就是在化学式前面配上适当的化学计量数使式子左、右两边的每一种元素的原子数目相等.常用的配平方法有最小公倍数法、观察法、奇数配偶法、归一法及得失电子守恒法.1)最小公倍数法:这种方法适合于常见的难度不大的化学方程式.例如在KClO3→KCl+O2↑这个反应式中右边氧原子个数为2,左边是3,则最小公倍数为6,因此KClO3前系数应配 2,O2前配 3,式子变为:2KClO3→2KCl+3O2↑,由于左边钾原子和氯原子数变为2个,则KCl 前应配系数2,短线改为等号,标明条件即可:2KClO32KCl+3O2↑(反应条件为二氧化锰催化和加热.“MnO2”写在等号上方;“△”写在等号下方)2)奇偶配平法:这种方法适用于化学方程式两边某一元素多次出现,并且两边的该元素原子总数有一奇一偶,例如:C2H2+O2→CO2+H2O,此方程式配平先从出现次数最多的氧原子配起.O2内有2个氧原子,无论化学式前系数为几,氧原子总数应为偶数.故右边H₂O的系数应配2(若推出其它的分子系数出现分数则可配4),由此推知C2H2前2,式子变为:2C2H2+O2→CO2+2H2O,由此可知CO2前系数应为4,最后配单质O2为5,把短线改为等号,写明条件即可:2C2H2+5O2=4CO2+2H2O3)3)观察法:有时方程式中会出现一种化学式比较复杂的物质,我们可通过这个复杂的分子去推其他化学式的系数,例如:Fe+H2O──Fe3O4+H2,Fe3O4化学式较复杂,显然,Fe3O4中Fe来源于单质Fe,O来自于H2O,则Fe前配3,H2O前配4,则式子为:3Fe+4H2O=Fe3O4+H2由此推出H2系数为4,写明条件,短线改为等号即可:3Fe+4H2O(g)Fe3O4+4H2↑4)归一法(或待定系数法):找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数.若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法.5)得失电子守恒法:电子得失法的原理是:氧化还原反应中,还原剂失去电子的总数必须等于氧化剂获得电子的总数.根据这一规则,可以配平氧化还原反应方程式.下面是配平的具体方法:1°从反应式里找出氧化剂和还原剂,并标明被氧化元素或还原元素的原子在反应前后化合价发生变化的情况,以便确定它们的电子得失数.2°使得失电子数相等,由此确定氧化剂和还原剂等有关物质化学式的系数.3°由已得的系数,判定其它物质的系数,由此得配平的反应式.。

各种化学式的书写一、单质化学式的书写1. 金属单质- 金属单质由原子直接构成,其化学式直接用元素符号表示。
例如:- 铁:Fe。
铁原子直接构成铁这种物质,所以其化学式为Fe。
- 铜:Cu。
同理,铜原子构成铜单质,化学式为Cu。
- 镁:Mg。
镁单质由镁原子组成,化学式为Mg。
2. 稀有气体单质- 稀有气体也是由原子直接构成的,其化学式也用元素符号表示。
例如:- 氦气:He。
氦气由氦原子组成,化学式为He。
- 氖气:Ne。
氖气分子就是氖原子,化学式为Ne。
- 氩气:Ar。
氩气由氩原子构成,化学式为Ar。
3. 部分固态非金属单质- 像碳、硅等固态非金属单质由原子直接构成,化学式用元素符号表示。
- 碳:C。
有金刚石、石墨等不同形态,但都是由碳原子构成,化学式为C。
- 硅:Si。
硅单质由硅原子组成,化学式为Si。
4. 气态非金属单质(除稀有气体外)- 一般是双原子分子,在元素符号右下角写上“2”。
- 氢气:H₂。
氢气分子由两个氢原子组成,所以化学式为H₂。
- 氧气:O₂。
氧气分子是由两个氧原子构成的,化学式为O₂。
- 氮气:N₂。
氮气分子由两个氮原子组成,化学式为N₂。
二、化合物化学式的书写1. 氧化物- 氧化物是由两种元素组成,其中一种是氧元素的化合物。
书写时,一般氧元素写在右边。
- 氧化镁:MgO。
镁元素显 + 2价,氧元素显 - 2价,根据化合物中正负化合价代数和为零的原则,化学式为MgO。
- 二氧化碳:CO₂。
碳元素显+4价,氧元素显 - 2价,为了使化合价代数和为零,一个碳原子和两个氧原子结合,化学式为CO₂。
- 四氧化三铁:Fe₃O₄。
其中铁元素有+2价和+3价两种价态,根据化合价规则得出其化学式为Fe₃O₄。
2. 酸- 酸是在水溶液中电离出的阳离子全部是氢离子(H⁺)的化合物。
- 盐酸:HCl。
盐酸在水中电离出H⁺和Cl⁻,化学式为HCl。
- 硫酸:H₂SO₄。
硫酸根离子(SO₄²⁻)显 - 2价,氢离子显+1价,为了使化合价代数和为零,需要两个氢离子,所以化学式为H₂SO₄。

化学式的书写一、书写化学式应遵循的原则1. “一大二小”原则:化学式是用元素符号表示物质组成的式子,因此在书写各元素符号时要符合“一大二小”原则:元素符号若只有一个字母,则用大写;若有两个字母,则第一个字母大写,第二个字母小写。
2. “先后”原则:化合物是由不同种元素组成的纯净物,这不同种元素在组成化合物时,其书写有着先后关系,通常是:正价在前,负价在后。
具体对各类物质来说,氧化物:另一种元素写在前,氧元素写在后;酸:氢元素写在前,酸根写在后;碱:金属元素写在前,氢氧根写在后;盐:金属元素写在前,酸根离子写在后。
3. “右下角”原则:在书写化学式时,表示组成的各元素的原子个数要写在相应的元素符号的右下角,即右下角原则。
在书写时要注意:(1)不含原子团时,右下角直接写原子数目;(2)含原子团时,要先将原子团用小括号括起来,然后再在右下角写上原子团的数目;(3)当原子或原子团的数目为“1”时,“1”省略不写,原子团也不用括号括起。
4. “符合实际”原则:任何物质的化学式都是通过实验测定物质的组成(元素的种类和各元素的原子个数)而得出的。
任何纯净物都有固定的组成,这是客观存在的,书写化学式时要符合实际,不能主观臆造化学式。
二、根据化合价书写化学式的一般规律(1)先读后写,后读先写。
如:氯化钠NaCl,氧化镁MgO,二氧化碳CO 2(2)金属前,非金属后;氧化物中氧在后,原子个数不能漏。
如氧化铁F e2O3具体应结合元素或原子团的化合价采用“交叉法”书写。
如以氧化镁、氧化铝为例:(1)先结合MgO AlO( 2)再标价(3)对交叉Mg2O2 Al2O3(4)约简它MgO Al2O3(5)再检查(+2)×1+(-2)×1=0 (+3)×2+(-2)×3=0以上步骤可概括为:一排顺序二标价,价数交叉写右下,约简价数做角码,化合价规则去检查。
对于较复杂的化学式,其中含有两个或两个以上的原子团,书写这部分时要添加括号,将原子团个数写在括号右下角。
常见物质化学式的书写一、水(H2O)水是生命之源,它由氢原子和氧原子组成。
我们常说的水分子的化学式是H2O,其中H代表氢原子,O代表氧原子。
水分子是由两个氢原子和一个氧原子通过共价键连接而成的。
它的分子式可以简单地表示为H2O,其中2表示氢原子的个数。
二、二氧化碳(CO2)二氧化碳是一种常见的气体,它由一个碳原子和两个氧原子组成。
它的化学式是CO2,其中C代表碳原子,O代表氧原子。
二氧化碳分子是由碳原子和氧原子通过双键连接而成的。
它的分子式可以简单地表示为CO2,其中2表示氧原子的个数。
三、氧气(O2)氧气是一种无色、无味的气体,它是地球大气中最常见的元素之一。
氧气分子由两个氧原子组成,化学式为O2。
氧气分子是由两个氧原子通过双键连接而成的。
它的分子式可以简单地表示为O2,其中2表示氧原子的个数。
四、氮气(N2)氮气是一种常见的气体,它是地球大气中的主要成分之一。
氮气分子由两个氮原子组成,化学式为N2。
氮气分子是由两个氮原子通过三键连接而成的。
它的分子式可以简单地表示为N2,其中2表示氮原子的个数。
五、一氧化碳(CO)一氧化碳是一种无色、无味的气体,它是一种有毒气体。
一氧化碳分子由一个碳原子和一个氧原子组成,化学式为CO。
一氧化碳分子是由碳原子和氧原子通过双键连接而成的。
它的分子式可以简单地表示为CO。
六、盐酸(HCl)盐酸是一种常见的无机酸,它是一种强酸。
盐酸分子由一个氢原子和一个氯原子组成,化学式为HCl。
盐酸分子是由氢原子和氯原子通过单键连接而成的。
它的分子式可以简单地表示为HCl。
七、硫酸(H2SO4)硫酸是一种常见的无机酸,它是一种强酸。
硫酸分子由两个氢原子、一个硫原子和四个氧原子组成,化学式为H2SO4。
硫酸分子是由氢原子、硫原子和氧原子通过共价键连接而成的。
它的分子式可以简单地表示为H2SO4。
八、乙醇(C2H5OH)乙醇是一种常见的有机化合物,它是酒精的主要成分。
乙醇分子由两个碳原子、六个氢原子和一个氧原子组成,化学式为C2H5OH。
书写化学方程式的步骤
书写化学方程式的原则:
①以客观事实为依据;
②遵循质量守恒定律
书写化学方程式的步骤:
“写”、“配”、“注”“等”.
“反应物”→“──”→“反应条件”→“生成物”→“↑或↓”→“配平”→“──改为══”.
常见的反应条件:点燃、加热(△)、高温、催化剂等.
“↑”“↓”的使用范围:在反应物中无气体参加反应,如果在生成物中有气体,则在气体物质的化学式的右边注“↑”;在溶液中进行的无固体参加的反应,如果生成物中有固体,则在固体物质的化学式右边注“↓”. 例赤热的铁跟水蒸气反应生成四氧化三铁和氢气.
H2O+Fe——Fe3O4+H2
显然,Fe3O4里的三个铁原子来自反应物里的铁原子,而Fe3O4里的四个氧原
子又来自反应物水蒸气分子里的氧原子.因此,在反应物水蒸气化学式前必须写一化学计量数4,而铁原子前必须写一化学计量数3.
4H2O+3Fe——Fe3O4+H2
不难看出,在生成物氢的化学式前写一化学计量数4,才能使化学方程式配平.然后注明反应条件.
4H2O+3Fe==高温== Fe3O4+4H2
也就是,
观察法配平化学方程式
有氢以氢作标准,无氢以氧为准绳;
调整只能改系数,原子各等就配平.
氢氧全无找一价,变单成双求配平;
配平系数现分数,全式乘2必平整.。
化学式的命名和写法化学式是表示化学元素及其物质组成的符号集合。
在化学领域中,准确地命名和书写化学式是非常重要的,因为它们能够清晰地传达元素和物质的信息。
本文将介绍化学式的命名规则和书写方法。
一、元素符号的命名和书写规则化学元素由拉丁文单词的首字母或前两个字母组成的符号表示。
元素符号必须以大写字母开头,如果有第二个字母,必须使用小写字母。
一些元素符号与其拉丁文名称不同,如钾的符号为K(来自拉丁文的"kalium"),而不是P(来自拉丁文的"potassium")。
二、离子式的命名和书写规则离子是带有电荷的原子或原子团。
离子式包括阳离子和阴离子的符号。
正离子采用元素符号表示,而负离子添加词尾来标记其状态。
有时需要使用括号来指示复杂离子的组成。
1. 单原子离子:单原子阳离子直接采用元素符号表示,例如,氢离子为H+。
单负原子离子使用元素符号后加上"-ide"词尾,例如,氯离子为Cl-。
2. 多原子离子:正多原子离子则使用原子团的名称,例如,氨离子为NH4+。
负多原子离子也使用原子团的名称,但需要在外部添加括号,例如,硫酸根离子为(SO4)2-。
三、分子化合物的命名和书写规则分子化合物是由共用电子对结合而成的物质。
它们由原子符号和表示共享电子对的线表示。
1. 共价键的命名和书写:共价键由电子对共享而成。
在化学式中,原子符号按照化合物的几何结构排列,并用线表示共价键。
例如,二氧化碳的化学式为CO2。
2. 水合物的命名和书写:水合物是含有水分子的化合物。
在化学式中,水分子的数量使用"x"表示。
例如,硫酸铜的化学式为CuSO4·xH2O。
四、无机盐的命名和书写规则无机盐是由阳离子和阴离子组成的化合物。
在无机盐的化学式中,阳离子和阴离子的符号按照各自的电荷平衡组合在一起。
例如,氯化钠的化学式为NaCl。
五、有机化合物的命名和书写规则有机化合物是碳基化合物,它们通常由碳、氢和其他原子组成。
学习方法报社全新课标理念,优质课程资源化学式的书写及意义山东尹萍萍化学式就是用元素符号和数字的组合来表示物质组成的式子。
能够准确书写化学式、了解化学式的意义,可以为我们今后的学习打下良好的基础。
一、化学式的书写1.单质的书写。
对于稀有气体、金属和大多数固态非金属单质习惯上用元素符号表示化学式。
如氖气写为Ne,铁写为Fe,碳写为C。
非金属气体单质的化学式是在元素符号右下角写上1个表示分子中所含原子数的数字,如氧气写为O2。
2. 化合物的书写。
书写化合物的化学式时,先要知道这种化合物由哪些元素组成及这些元素原子间的个数比,并把个数比标在相应元素符号的右下角,数字为“1”时可省略。
如二氧化碳分子中碳、氧原子的个数比为1︰2,故化学式为CO2。
并且一般遵循“金属(元素)在前,非金属(元素)在后,氧化物中氧(元素)在右”的原则,如氯化钠写为NaCl。
如果知道组成一种化合物的元素(或根)的化合价,可以依据化合价写出这种物质的化学式。
书写时应注意“正价元素在前,负价元素在后,正负价代数和为零”,如C为+4价,O为—2价,其组成化合物的化学式为CO2。
特例:在同一种物质里,同一元素也可显不同的化合价,如NH4NO3中N的化合价从左到右分别为-3、+5。
通常正价元素在左,负价元素在右,但是NH3(氨气)、CH4(甲烷)中,正价在右,负价在左。
二、化学式的意义一般来说,化学式有四个意义,宏观和微观各有两个:宏观:①表示一种物质化学式的意义②表示这种物质由哪些元素组成微观:③表示这种物质的1个分子④表示这种物质的1个分子由哪些原子构成宏观:①表示氢气这种物质②表示氢气由氢元素组成如:H2的意义微观:③表示1个氢分子④表示1个氢分子由2个氢原子构成学习这部分时,一定要把化学式的意义与前面学过的元素符号的意义对比记忆。
如H 为氢的元素符号,宏观可表示氢元素,微观可表示1个氢原子。
而对于那些用元素符号表示化学式的物质(即上面提到的稀有气体单质、金属单质和固态非金属单质),它们化学式具有三个意义,宏观可表示一种元素和一种物质,微观可表示一个原子。
化学式书写规律口诀
(原创版)
目录
一、化学式书写规律口诀的意义
二、化学式书写规律口诀的内容
三、如何运用化学式书写规律口诀
四、化学式书写规律口诀的实际应用
正文
一、化学式书写规律口诀的意义
化学式书写规律口诀是帮助我们记忆和掌握化学式书写规律的一种方法,它可以让我们更轻松地理解和运用化学式书写的规则,从而提高我们的学习效率。
二、化学式书写规律口诀的内容
化学式书写规律口诀主要包括以下几个方面:
1."先读后写,后读先写":这是指在书写化学式时,先读取元素符号和原子量,然后根据化合价和原子量的关系确定原子个数,最后写出化学式。
而在读取化学式时,先读取化学式中的原子个数,然后根据原子个数和化合价确定元素符号和原子量。
2."正负化合价,交叉写右下":这是指在书写离子式时,正负化合价的符号要交叉写在离子式的右下角。
3."原子个数,约简到最简":这是指在书写化学式时,原子个数应该约简到最简,即只写出各元素原子个数的最小公倍数。
三、如何运用化学式书写规律口诀
在实际的学习中,我们可以通过以下几种方式来运用化学式书写规律
口诀:
1.结合实例,理解口诀的含义和应用。
2.通过练习,熟练掌握口诀的使用方法。
3.在学习中,不断总结和归纳,将口诀与实际应用结合起来。
四、化学式书写规律口诀的实际应用
化学式书写规律口诀在实际的学习和应用中,可以帮助我们更准确地书写化学式,提高我们的学习和工作效率。
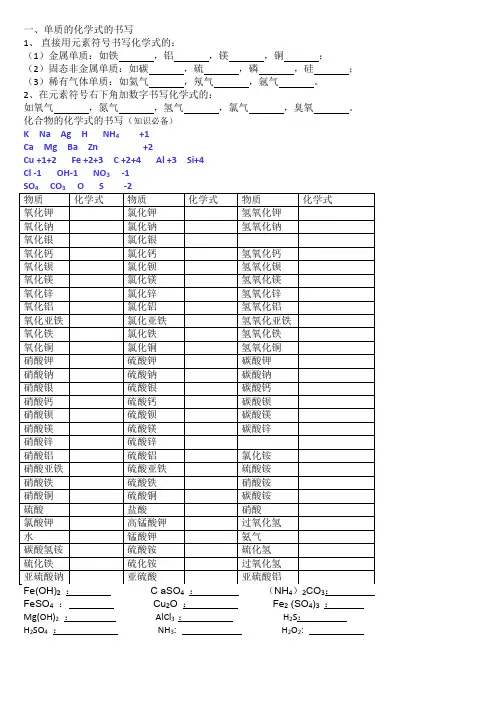
《化学式的书写》
(一)单质化学式的书写
1、直接用元素符号表示化学式:金属,非金属固体,稀有气体。
2、在元素符号的右下角加“2”。
氢气、氧气、氮气、氯气
(二)常见元素及原子团化合价
一价钾钠氯氢银;二价氧钙钡镁锌。
NO3- 硝酸根Cl-盐酸根ClO3-氯酸根三铝四硅五氮磷;二三铁二四碳,SO42-硫酸根SO32-亚硫酸根CO32-碳酸根二四六硫要记清PO43-磷酸根MnO4- 高锰酸根MnO42-锰酸根
NH4+铵根OH- 氢氧根
(三)化合物化学式的写法
1、读出原子个数的物质根据读法写——反写反读。
例如:
二氧化碳二氧化硫四氧化三铁五氧化二磷
2、没有读出原子个数的根据化合价书写。
口决:一定组成,二标价,去号约分、再交叉。
怎样定组成?
“某化某”:由两种元素组成(从后往前说)。
如氧化铜、氯化钠。
“某酸某”:由某元素和某酸根组成。
如碳酸钙、硫酸钾。
“某酸”:由氢元素和某酸根组成。
如硫酸、碳酸。
“氢氧化某”:由某元素和氢氧根组成。
如氢氧化钙、氢氧化钠。
3、特殊物质化学式的书写
水过氧化氢大理石、石灰石的主要成分高锰酸钾锰酸钾生石灰
氯酸钾尿素碳酸氢铵熟石灰盐酸石灰水的溶质
甲烷碱式碳酸铜酒精
反复练习——读出下列物质
HNO3MnO2Fe(OH)3ZnSO4 MgCO3H2SO4 Zn(OH)2 CuSO4 P2O5ZnCO3H2CO3HCl Al(OH)3ZnCl2 K2SO4Na2CO3 Cu(NO3)2 H2O2 H2O MgO KCl AgNO3K2MnO4H2 Fe AgCl Ca(NO3)2KMnO4 O2CaCO3
重点突破——用交叉法写出下列物质的化学式。
1
2、先说出下列物质的组成,再写出下列物质的化学式
氯化铵氢氧化钠硝酸硫酸钠碳酸钙
氯化亚铁氢氧化钙硫酸铵碳酸钾碳酸
氢氧化铁硫酸铝碳酸钡氢氧化铝硫酸钙
氯化钙氯化铝硝酸钠硝酸铝氯化银
氯化锌硝酸铵硝酸汞氧化铁
强化过关——写出下列物质的化学式
氢气高锰酸钾硫酸钡碳酸钠铁
氯化铵氢氧化钠硝酸硫酸钠二氧化碳
氯化亚铁五氧化二磷硫酸铵碳酸钾氮气
氢氧化铁硫酸铝尿素氢氧化铝碱式碳酸铜
碳酸镁镁氯化钡硝酸钾硝酸钡
二氧化锰氯化铝硝酸钠硫酸钙氯化银
氯化锌硝酸铵碳氧化铁氢氧化亚铁
硫酸氯化氢氢氧化钙碳酸钙澄清的石灰水
碳酸氯化钠四氧化三铁碳酸钡二氧化氮
氯化钙过氧化氢硝酸铝碳酸氢铵硝酸汞
硫酸钙水氢氧化钡干冰氯化铵
写出下列物质的化学式,每个4分。
氢气高锰酸钾硫酸钡碳酸钠铁
氯化亚铁五氧化二磷硫酸铵碳酸钾氮气
氯化锌硝酸铵碳氧化铁氢氧化亚铁硫酸氯化氢氢氧化钙碳酸钙澄清的石灰水硫酸钙水氢氧化钡干冰氯化铵。