
固態光學實習
二、反射光譜量測原理及實驗
1. 原理
1-1.反射率與固態物理光學特性之關係
光學常數是用來表徵固態宏觀光學性質物理量,折射率n 和散射係數?是兩個基本的光學常數,二者分別構成複數折射率n 的實部與虛部。另外,複介電係數ε(εr ,εi )和複光電導率σ(σr ,σi )也叫做光學常數,它們都與(n ,?)有關。實際上光學常數並非真正意義上的常數,而是人射光頻率的函數,光學常數的這種頻率依賴性叫做色散關係。
這些色散關係可以以簡單的物理模型出發推導出來。光強(反射、透射、散射、輻射等)的射散就是所謂的光譜。
勞倫茲(Lorentz )射散觀念是基於阻尼諧振子近似,適用於絕緣體和半導體。為簡單起見,設所觀測的對象為均勻、各向同性的固體,在一階近似下,光與物質的相互作用,也就是固體對光的響應可以看成阻尼諧振子系統在入射光作用下的受激振蕩。諧振子之間相互作用,用阻尼系數γ來表徵,並且假設固體中只有一種共振振蕩頻率為ω0質量為m 的諧振子,因此只需要考慮以座標X 表示的諧振子在光波作用下的運動。系統受到的作用力有:與位移成正比的彈性恢復力-mw 02
x ,與速度成正比的阻尼力'
x m γ-,以及電磁場驅動力).exp(0*t i E e ω-,
其中是*e 諧振子的有效電荷,在這些作用力之下,一個諧振子的運動方程式可以表示為
).exp(0*2
0'
'
't i E e x m x m x m ωωγ-=++ (1)
可以得到諧振子在光波作用下的位移)(ωx
).exp(/)(02
20*t i E i m e x ωγωωωω---= (2) 由電極化強度P 的定義知道 E x Ne p χε0*==,可以得到
2
2222
02202)()
()(1)(ω
γωωωωωωχωε+--=+=p r r (3) 2
2222
02)()()(ω
γωωγω
ωωχωε+-==p i i (4)
2
2222
03
2*0)()/()()(ωγωωγωωωεεωσ+-==m Ne i r (5) )()()(22ωεωκωr n =- (6) )()()(2ωεωκωr n = (7)
其中02*2
/εωm Ne p ≡,為電漿頻率。光學常數隨頻率變化曲線叫做色散曲線。
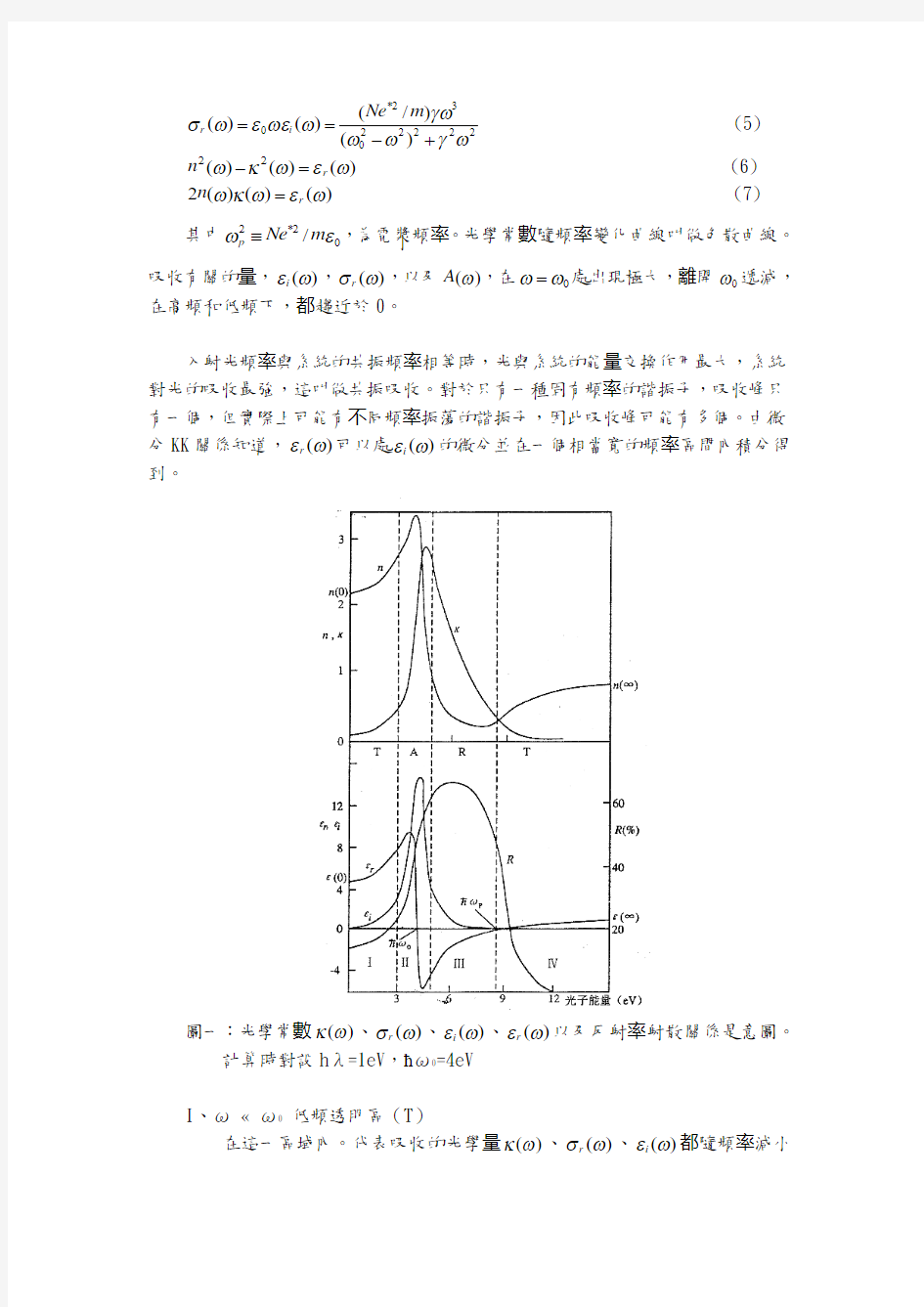
吸收有關的量,)(ωεi ,)(ωσr ,以及)(ωA ,在0ωω=處出現極大,離開0ω遞減,在高頻和低頻下,都趨近於0。
入射光頻率與系統的共振頻率相等時,光與系統的能量交換作用最大,系統對光的吸收最強,這叫做共振吸收。對於只有一種固有頻率的諧振子,吸收峰只有一個,但實際上可能有不同頻率振蕩的諧振子,因此吸收峰可能有多個。由微分KK 關係知道,)(ωεr 可以處)(ωεi 的微分並在一個相當寬的頻率區間內積分得到。
圖一:光學常數)(ωκ、)(ωσr 、)(ωεi 、)(ωεr 以及反射率射散關係是意圖。
計算時對設h λ=1eV ,?ω0=4eV
I 、ω ? ω0 低頻透明區(T )
在這一區域內。代表吸收的光學量)(ωκ、)(ωσr 、)(ωεi 都隨頻率減小
而趨近於0,折射率為靜態的)0(n 隨頻率的增加而增大,呈正常色散,固體是透明的。
II 、ω ≈ ω0 共振吸收區(A )
在這一頻域內,代表吸收的光學量 )(ωσr 、)(ωεi 達到極大值。在該區
內,折射率由正常射散轉變為反常射散,即頻率的增加而增少。
III 、ω0 < ω < ωp 金屬反射區(R )
在這一頻域內,0)(<ωεr 。以波方程式不難看出,對於實的ω,0)(<ωεr 意味著波方程式k 為虛數,有就是說,此頻域內光不能在固體中傳播;由式(3)看出,在這一頻域內)()(ωωκn >>,實際上n 趨近於0。
IV 、ω ? ω0 高頻透明區(T )
在這一頻域內,代表固體吸收的量都趨近於0,折射率隨頻率的變化為正常色散固體再次轉變為透明的。
單晶體的)(ωn ,)(ωκ實驗射散曲線如下圖
圖二:單晶體的)(ωn ,)(ωκ的射散曲線
1-2. kramers-kronig relation 的推導
任何複變函數α(w ),只要滿足三個要求,就會滿足K-K Relation (w 是實數): (a )α(w )的極點都要在實軸下方。
(b )在複w-平面之上半部沿著一無限大半圓形對α(w )/w 積分時為零。在
∣w ∣→∞時,α(w )均勻的→0。
(c )對α(w )=α,(w )+i α,,(w )而言,α,(w )為偶函數,α,,(w )為奇函數。 若對一個滿足上述3條件的複變函數α(z )(z 是複變數)再複平面上取一個迴路積分
()
Z
d ?w
-z z α=()
ds
?w
-s s 1
α+()
Z
d ?w
-z z 2
α+()
ds
?w
-s s 3
α+()
Z
d ?w
-z z 4
α=0
(因為沒有包到極點,故整個積分為0)
由(b )知()
Z
d ?w -z z 4α=0
而再看()
Z
d ?w
-z z 2
α而z =w +ue i θ,dz =iue i θ d θ代入
故()
Z
d ?w
-z z 2
α=θαπ
θ
θ
θd ue
iue ue w i i i ?
+0
)(=θαπ
θid ue w i ?+0
)(
在u →0下,α(w +ue i θ)→α(w ) independent of θ
故上式積分=α(w )i (-π) 故()
ds
?w
-s s 1
α+()
ds ?w
-s s 3
α=p
ds w s s ?∞
-)
(α=πi α
(w )
表示積分避開奇異點(主值積分)
而α(w )=α,(w )+i α,,(w )代入左式 α(s )=α,(s )+i α,,(s ) 代入右式
α,
(w )+i α,,
(w )=ds w s p i s ?∞∞--)(,1απ+ds w
s p i i s ?∞
∞--)
(,,απ
=ds w
s p i s ?∞∞--)(,1απ+ds w s p s ?∞
∞--)(,,1απ
比較實部→α,
(w )=
ds w s p s ?
∞
∞
--)
(,,1
απ
,而α
,,(s )
是奇函數
比較虛部→α
,,(w )
=
ds w s p s ?
∞
∞
---)
(,1
απ
,而α,
(s )是偶函數
由→α,
(w )=
ds w
s p s ?
∞
-0
)
(,,1
απ
+
ds w s p s ?
∞
--0
)
(,,1
απ
=
ds w
s p s ?
∞
-0)
(,,1
απ
+
ds w s p s ?
∞
---0
)
(,,1
απ
,又α,,(-s )
=-α,,(s )
=
ds w
s p s ?
∞
-0)
(,,1
απ
+
ds w
s p s ?
∞
+0
)
(,,1
απ
=ds w s w s p s )(,
,0)11(
1
απ?∞
++-=ds w s s p s ?∞
-02
2)(,,2απ#
由→α
,,(w )
=
ds w s p s ?
∞
∞---)
(,1
απ
=ds w s p s ?∞
--0
)
(,1
απ-ds w s p s ?∞--0
)
(,1
απ =
ds w
s p s ?
∞
--0)
(,1
απ
-
ds w s p s ?
∞
---0
)
(,1
απ
,又α,(-s )=α,
(s )
=ds w s p s ?∞
--0)(,
1
απ+ds w s p s ?∞
+0)
(,1
απ=ds w s w s p s )(,0)1
1(1απ?∞
+---
=ds w s p w
s ?
∞
--
2
2)
(,2απ
#
故至此導出了K-K Relation
w 是實數
1-3 折射率之實部虛部n(w) ,k(w)之獲得
)(w r =i r i w ir r e R +=θ)(乃是一個複變函數,雖滿足K-K Relation 的3個要求,但因為反射係數本身不好測量,故)(w r 的實部和虛部關係對實驗上沒實際用途,能直接測到的是反射率R (w) ,故我們只要找出R (w)和θ(w)的關係,再由)(w r =
θi w e R )(就可以得出反射係數)(w r ,進而知道n 、k 等光學係數。
故考慮一複變函數)(2
1
)
()(ln ln w w w i R r θ+=代入K-K Relation
比照α(w )=α,(w )+i α,,(w ),故知α,(w )=)(ln 2
1
w R ,α,,(w )=θ(w)
代入K-K Relation
故α,,
(w )=ds w s p w
s ?∞
--0
2
2)
(,2απ
s s d w s R
p w
?∞
--022)(ln 212π=故得出了θ(w)和R (w)的關係式#
考慮真空中一電磁波射向介電函數ε,磁導常數μ=1的介質,其反射係數)(w r =
1
1
++-+ik n ik n
而反射率R (w) =*
rr =2
22
2)1()1(k n k n +++- ------------(a) 故)(w r =
1
1
++-+ik n ik n =θi w e R )(=)sin (cos )(θθi R w + ------------(b)
利用(a) (b)聯立,經過一些代數運算導出
故由θ(w) ,R (w)代入上兩式即得n (w) ,k (w) #
1-4 介電函數之實部虛部ε1,ε2之獲得
由晶體的複數折射率N (w)
=ik n +=ε
兩邊平方ε21222εεi ink k n +=+-=,比較實部需部得
由n (w) ,k (w)代入,故可得)(2)(1,w w εε
故由一開始的R (w) ,我們成功的得到n (w) ,k (w) ,)(1w ε,)(2w ε至此分析完成#
1-5 加入微擾項形式之K-K relation 推導
在我們後來的實驗中,因為在用程式模擬)(w θ=s s d w s R p w
?
∞
--
2
2)(ln π
的過程中,
碰到奇點常會使)(w θ發散(無窮大值)。因此我們發展了一套微擾項形式的K-K relatinon ,使此改良過的K-K relatinon 在用程式模擬時不至於發散。
我們由3-1的p
ds w s s ?∞
∞
--)
(α=πi α
(w )
出發,α(s )仍是一個複變函數,我們在
分母加一個複數微擾項i Γ,來避免分母為零(故我們可以積過奇點所以把p 拿
掉),但又因為加的是複數故不會影響實部積分的值,所以p
ds w s s ?∞
∞
--)
(α=
ds i w s s ?∞
∞
-Γ
+-)
(α=
ds w s i w s s ?
∞
∞
-Γ+-Γ
+-2
2)()()(α=
ds w s w s s ?∞
∞
-Γ
+--2
2
)()
()
(α+ds w s i ?∞
∞-Γ
+-Γ
2
2)( 故α(w )=
ds w s w s i s ?∞
∞
-Γ
+--2
2
)()
()
(1
απ
+ds w s ?∞
∞
-Γ+-Γ
2
2)(1
π, α(w )=α,(w )+i α,,(w )代入左式,α(s )=α,(s )+i α,,(s ) 代入右式
α(w )=α,
(w )+i α,,
(w )=
ds w s w s i s ?∞
∞
-Γ+--2
2
)(,)
()
(1
απ
+
ds w s w s i i s ?∞
∞
-Γ+--2
2
)(,,)
()
(απ
+
ds w s ?∞∞-Γ
+-Γ2
2)(1
π=ds w s w s i s ?∞
∞
-Γ
+--2
2
)(,)
()
(1
απ+
ds w s w s s ?
∞
∞
-Γ
+-Γ
+-2
2
)(,,)()(1
απ
在此我們只要比較虛部即可(因為知道到時候的虛部就是我們要的θ(w))
ds w s w s s ?∞
Γ+---
2
2
)(,)
()
(1
απds w s w s s ?∞
-Γ
+---
2
2
)(,)
()
(1
απ
=ds w s w s s ?∞
Γ
+---
02
2
)(,)()
(1
απds w s w s s ?∞
-Γ
+-----02
2
)(,)()
(1
απ,又α,(-s )=α,
(s ) =ds w s w s s ?∞
Γ+---
2
2)(,)()
(1
απ+
ds w s w s s ?∞
Γ
+++0
2
2
)(,)
()
(1
απ
=
s s d w s w s w s w s )(,
02
222])()([
1
απ
?∞
Γ
+++-Γ+--- =s s d ws w s w w ws ws )(,
022*******])
2()(2224[1
απ?∞
-Γ++Γ----
此為加了複數微擾項後的K-K relatinon
故)(2
1
)
()(ln ln w w w i R r θ+=帶入上式
不會有θ(w)發散的情形,只要適當的選取Γ值(事實上Γ的大小與θ(w)的半
高寬有關)。
1-6. GaAs 及Silicon 的反射光譜與n(ω), κ(ω)
有金屬般光澤之有毒固體砷與稀有金屬鎵化合之砷化鎵(GaAs )目前備受電子業界矚目,因其電子高速性遠超過今日第一流的半導體元件材料矽,並且具有矽所缺乏的EL (電光)轉換功能,所以材料公司競相製造其結晶;IC 公司也競相開發其應用元件。
矽乃單一元素構成的單體半導體;砷化鎵乃二種元素結合的化合物半導體。化合物半導體可以由元素週期表之3-5族、2-6族、1-7族各元素組成,亦即為雙方原子的價電子和為8之元素間的組合。
下表列出矽與砷化鎵在物理性質上的一些比較: (表三 矽與砷化鎵之比較)
{表四:比較GaAs 及Silicon的反射光譜與n( )}
2、實習設備架設及實驗步驟:
進行反射率量測的實驗架構如下:
注意:
這是測量GaAs和Silicon等樣本反射率時的儀器架設,由於經費有限為了使反射光譜與螢光光譜共用一台光譜儀,因此光譜儀的位置放在偵測器的位置上。所以鎢燈或Xe燈光先打Sample再以光譜儀分光,因為不是先分光在打,導致測到的光譜在同樣一個位置(波長)的兩倍處,會測到強度,就是second order 的問題。故我們在取光譜時都格外小心,要先得知入射光源的範圍,然後在scan 時故意避開在它兩倍處以免取到假光譜。
3. 實驗步驟:
3-1、測量背景光的光譜圖
1.開啟鎢燈當光源,調整電壓至適當值(我們都用5V)熱機一段時間,讓
強度穩定。
2.開啟PMT的高壓,調至負750~950V之間,打開軟體,Restart光譜儀,
使光柵轉回初始位置。
3.參照穿透時候的儀器架設,利用透鏡使光聚焦讓鎢燈直接打入光譜儀,
用白紙確認入射光有打入光譜儀的狹縫。
4.用軟體設定好參數(slit大小,存檔位置)以△λ=2nm當間距,掃描
400~880nm的光強度譜圖(因為鎢燈在此範圍強度最強,故實驗做出來
也最精準),須注意光強度太大時會損害PMT,須隨時調整slit大小來
控制。
5.將此結果當成背景
3-2、測量GaAs及Si的反射光譜圖
1.同上1.
2.步驟。
2.參照測反射時候的儀器架設,取用純的樣本(GaAs或Si先用水沖洗,
在用丙酮浸泡去油漬,最後用噴氣機吹乾),將樣本用雙面膠黏在載玻
片上,以樣品夾夾住載玻片,將樣品夾放入基座,利用透鏡使鎢燈聚焦
打在樣本上,旋轉基座以控制入射光和反射光成90度角,轉動基座底
部的旋鈕來控制反射光的水平位置,用白紙確認反射光有打入光譜儀的
狹縫。
3.用軟體設定好參數,以△λ=2nm當間距,掃描400~880nm的光強度譜
圖,須注意控制光強度不至於強過背景。
4.得樣品的反射強度圖譜。
3-3、GaAs及Si的反射率圖譜,計算n(w)、k(w)
1.利用軟體將反射光譜除以背景,即得400?880nm範圍GaAs及Si的反
射率圖譜為R (λ)。
2. 將此反射率圖譜R (λ)利用軟體的開啟”File/Import/Export ”,找到ASCII_XY ,按下”Export ”,選取你要的檔案,即可轉成prn 文字檔,代入MATHEMATICA 先轉成R (w )再做)(w θ=
s s d R ws w s w s w )(02
22223
22ln ])
2()(2)(2[21?∞
-Γ++-Γ--π 的程式模擬,適當的選取Γ(大約在w 的數量及範圍~1014),運算得θ(w)。 3. θ(w) ,R (w)代入())
()()()
(cos 211w w w w R R R n θω-+-=
,
())
()()()
()(cos 21sin 2w w w w w R R R θθωκ-+=
運算得n (w )、k (w )(以上2.3.步驟參照4-3-1
實驗數值分析流程)
3-4、計算ε1(w )、ε2(w )、σ1(w)
1. 將所得之n (w )、k (w ),代入n 2-k 2=ε1,2nk =ε2,計算得ε1、ε2(以上步驟參照4-3-2實驗數值分析流程)。
2. 將所得的ε2(w)代入σ1(w)=π
ε4)(2w
w ?,得σ1(w)。
4、討論
1. 在進行反射率實驗時常會出現的問題有何?該如何避免?
2. 在撰寫程式時,如何設計能讓所量到的資料擷取至程式內直接算出結果?
3. KK relation 利用微擾的方式來設計程式,請問他的限制在哪裡,並如何最佳化。
4. 比較你所得到GaAs 與Si 的結果,說明其各種譜線的物理意義。
附錄:A. 程式撰寫
我們可經由量測反測率得到反射率R(λ) 對應於波長λ的圖譜,亦可將兩組數列資料R(λ)及λ轉換成記事本的型式,進而套入Mathematica 運算軟體,最後得到n(ω)與κ(ω)的圖譜。
A-1. θ部分
經由儀器偵測,我們可直接測得
首先運用 提取數據成串列(ReadList ) 的功能,將記事本的資料提到Mathematica 裡頭,然後代入λ
ππωc
f 22=
=,於是我們就得到了ω的串列
經由()()[]()[]()
?∞
-Γ++-Γ--
=0
2
2
22
2
3
2
2
2ln 2221
ds s s s R s ωωωωπ
ωθ,不過我們在此實驗中取數據是從波長400nm 至880nm ,所以我們採用累加的方式,
即 ()()[]()[]()
∑
==-Γ++?-Γ--
=880
400
2
2
22
2
3
2
2
2ln 2221
ωωωωωωπ
ωθds s s s R s =(
)
[]
()[
]
()()
[]
()[
]
()??
?
???????+??-Γ++?-Γ-+??-Γ++-Γ--........2ln 222ln .22.2140240222224024023224024004002222400400322400ds s s s R s ds s s s R s ωωωωωωωωπ
得到
這是 ()()[]()[]()
∑
==-Γ++?-Γ--
=880
400
2
2
22
2
3
2
2
2ln 2221
ωωωωωωπ
ωθds s s s R s 的程式語法
在此要注意一點的是,因為我們之前測得的R(ω)值都有其對應的λ值,而我們取的λ值是從400nm 至880nm ,間隔為2nm ,於是採用數列運算Table 指令,將我們欲套進去的數值代入,進於得到cos θ(ω)。
w 皆以i
9
^10*8^10*3**2π來替換,即
為了解說簡潔,將上式以θ(ω)表示 所以餘弦值為cos[θ(ω)] λi λ400 λ880 d λ
A-2 實部n(ω)部分
我們在此會用到的式子為 ()()()()()
ωθωωωωcos 211R R R n -+-=
其中R(ω)為一已測得串列,而cos θ(ω)是藉由先前寫出的θ(ω)來做進階處理得到n 的串列後,使用ColumnForm 指令將其轉成行列,進而提取至記事本,用Origin 製成ω-n(ω)的圖表。
A-3 虛部κ(ω)部分
()(
)()()()()
ωθωωωθωωκcos 21sin 2R R R -+=
程式寫法與n(ω)相仿,只是分子分母會有很多項。同樣,為了寫法簡潔,θ部分都以θ(ω)表示。
總語法如下
以上,我們得到了n 及κ兩排行列。接著我們一個值一個值對應ω做圖。使用的軟體為Origin 。
A-4 介電函數之實部部分
()221κωε-=n
先前已設定好n 為折射率的串列,k 為消光係數的串列
接著將
e1.prn 數據,套入繪圖軟體,得之。
A-5 介電函數之虛部部分
()κωεn 22=
接著將e2.prn 數據,套入繪圖軟體,得之。
A-6 導電率
π
ω
εσ42*=
接著將eins.prn 數據,套入繪圖軟體,得之。
氢原子光谱 摘 要:本实验用光栅光谱仪对氢原子光谱进行测量,测得了氢原子光谱巴尔末线系的波长,求出了里德伯常数。最后对本实验进行了讨论。 关键词:氢原子光谱,里德伯常数,巴尔末线系,光栅光谱仪 1. 引言 光谱线系的规律与原子结构有内在的联系,因此,原子光谱是研究原子结构的一种重要方法。1885年巴尔末总结了人们对氢光谱测量的结果,发现了氢光谱的规律,提出了著名的巴尔末公式,氢光谱规律的发现为玻尔理论的建立提供了坚实的实验基础,对原子物理学和量子力学的发展起过重要作用。1932年尤里根据里德伯常数随原子核质量不同而变化的规律,对重氢赖曼线系进行摄谱分析,发现氢的同位素氘的存在。通过巴尔末公式求得的里德伯常数是物理学中少数几个最精确的常数之一,成为检验原子理论可靠性的标准和测量其他基本物理常数的依据。 2. 氢原子光谱 氢原子光谱是最简单、最典型的原子光谱。用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可得到线状氢原子光谱。瑞士物理学家巴尔末根据实验结果给出氢原子光谱在可见光区域的经验公式 (1) 式中λH 为氢原子谱线在真空中的波长。 λ0=364.57nm是一经验常数。 n取3,4,5等整数。 若用波数表示,则上式变为 (2) 式中RH 称为氢的里德伯常数。 根据玻尔理论,对氢和类氢原子的里德伯常数的计算,得 (3) 式中M为原子核质量,m为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,ε0为真空 42 2 0-=n n H λλ??? ??-==22 1211~n R v H H H λ)/1()4(23202 42M m ch z me R z += πεπ
一、基本原理 1.原子吸收光谱的产生 众所周知,任何元素的原子都是由原子核和绕核运动的电子组成,原子核外电子按其能量的高低分层分布而形成不同的能级。因此,一个原子核可以具有多种能级状态。能量最低的能级状态称为基态能级(E 0=0),其余能级称为激发态能级,而能最低的激发态则称为第一激发态。正常情况下,原子处于基态,核外电子在各自能量最低的轨道上运动。如果将一定外界能量如光能提供给该基态原子,当外界光能量E 恰好等于该基态原子中基态和某一较高能级之间的能级差△E 时,该原子将吸收这一特征波长的光,外层电子由基态跃迁到相应的激发态,而产生原子吸收光谱。电子跃迁到较高能级以后处于激发态,但激发态电子是不稳定的,大约经过10-8秒以后,激发态电子将返回基态或其它较低能级,并将电子跃迁时所吸收的能量以光的形式释放出去,这个过程称原子发射光谱。可见原子吸收光谱过程吸收辐射能量,而原子发射光谱过程则释放辐射能量。核外电子从基态跃迁至第一激发态所吸收的谱线称为共振吸收线,简称共振线。电子从第一激发态返回基态时所发射的谱线称为第一共振发射线。由于基态与第一激发态之间的能级差最小,电子跃迁几率最大,故共振吸收线最易产生。对多数元素来讲,它是所有吸收线中最灵敏的,在原子吸收光谱分析中通常以共振线为吸收线。 2.原子吸收光谱分析原理 2.1谱线变宽及其原因 原子吸收光谱分析的波长区域在近紫外区。其分析原理是将光源辐射出的待测元素的特征光谱通过样品的蒸汽中被待测元素的基态原子吸收后,测定发射光谱被减弱的程度,进而求得样品中待测元素的含量,它符合吸收定律: ()0k l I I e νν-= (1.1) 0log 0.434I K l A I ν ν=-=- (1.2) 其中:K v 为一定频率的光吸收系数,K v 不是常数,而是与谱线频率或波长有关,I v 为透射光强度,I 0为发射光强度。
紫外可见漫反射光谱基本原理 前言: 1、紫外可见光谱利用的哪个波段的光? 紫外光的波长范围为:10-400 nm; 可见光的波长范围:400-760 nm; 波长大于760 nm为红外光。波长在10-200 nm范围内的称为远紫外光,波长在200-400 nm的为近紫外光。而对于紫外可见光谱仪而言,人们一般利用近紫外光与可见光,一般测试范围为200-800 nm、 2、紫外可见漫反射光谱可以做什么? 紫外可见漫反射(UV-Vis DRS)可用于研究固体样品的光吸收性能,催化剂表面过渡金属离子及其配合物的结构、氧化状态、配位状态、配位对称性等。 备注:这里不作详细展开,我们后面会结合实例进行分析。 3、漫反射就是什么? 当光束入射至粉末状的晶面层时,一部分光在表层各晶粒面产生镜面反射(specular reflection);另一部分光则折射入表层晶粒的内部,经部分吸收后射至内部晶粒界面,再发生反射、折射吸收。如此多次重复,最后由粉末表层朝各个方向反射出来,这种辐射称为漫反射光(diffuse reflection)。 4、紫外可见光谱的基本原理 对于紫外可见光谱而言,不论就是紫外可见吸收还就是紫外可见漫反射,其产生的根本原因多为电子跃迁、 有机物的电子跃迁包括n-π,π-π跃迁等将放在紫外可见分光分度法中来介绍。 对于无机物而言:
a、在过渡金属离子-配位体体系中,一方就是电子给予体,另一方为电子接受体。在光激发下,发生电荷转移,电子吸收某能量光子从给予体转移到接受体,在紫外区产生吸收光谱。其中,电荷从金属(Metal)向配体(Ligand)进行转移,称为MLCT;反之,电荷从配体向金属转移,称为LMCT、 b、当过渡金属离子本身吸收光子激发发生内部d轨道内的跃迁(d-d)跃迁,引起配位场吸收带,需要能量较低,表现为在可见光区或近红外区的吸收光谱。 c、贵金属的表面等离子体共振: 贵金属可瞧作自由电子体系,由导带电子决定其光学与电学性质。在金属等离子体理论中,若等离子体内部受到某种电磁扰动而使其一些区域电荷密度不为零,就会产生静电回复力,使其电荷分布发生振荡,当电磁波的频率与等离子体振荡频率相同时,就会产生共振。这种共振,在宏观上就表现为金属纳米粒子对光的吸收。金属的表面等离子体共振就是决定金属纳米颗粒光学性质的重要因素。由于金属粒子内部等离子体共振激发或由于带间吸收,它们在紫外可见光区域具有吸收谱带。 5、紫外可见漫反射光谱的测试方法——积分球法 积分球又称为光通球,就是一个中空的完整球壳, 其典型功能就就是收集光。积分球内壁涂白色漫反射层(一般为MgO或者BaSO4),且球内壁各点漫反射均匀。光源S在球壁上任意一点B上产生的光照度就是由多次反射光产生的光照度叠加而成的。
原子吸收光谱定量分析实验报告班级:环科10-1 姓名:王强学号:2010012127 一、实验目的: 1.了解石墨炉原子吸收分光光度计的使用方法。 2.了解石墨炉原子吸收分光光度计进样方法及技术关键。 3.学会以石墨炉原子吸收分光光度法进行元素定量分析的方法。 二、实验原理: 在原子吸收分光光度分析中,火焰原子吸收和石墨炉原子吸收是目前使用最多、应用范围最广的两种方法。相对而言,前者虽然具有振作简单、重现性好等优点而得到广泛应用,但该法由于雾化效率低、火焰的稀释作用降低了基态原子浓度、基态原子在火焰的原子化区停留时间短等因素限制了测定灵敏度的提高以及样品使用量大等方面的原因,对于来源困难、鹭或数量很少的试样及固态样品的直接分析,受到很大的限制。石墨炉原子化法由于很好地克服了上述不足,近年来得到迅速的发展。 石墨炉原子吸收方法是利用电能使石墨炉中的石墨管温度上升至2000 ~ 3000 ℃的高温,从而使待测试样完全蒸发、充分的原子化,并且基态原子在原子化区停留时间长,所以灵敏度要比火焰原子吸收方法高几个数量级。样品用量也少,仅 5 ~ 100 uL。还能直接分析固体样品。该方法的缺点是干扰较多、精密度不如火焰法好、仪器较昂贵、操作较复杂等。 本实验采用标准曲线法,待测水样品用微量分液器注入,经过干
燥、灰化、原子化等过程对样品中的痕量镉进行分析。 三、仪器和试剂: 1.仪器 由北京瑞利分析仪器公司生产的WFX-120型原子吸收分光光度计。 镉元素空心阴极灯 容量瓶 50 mL(5只)微量分液器0.5 ~ 2.5 mL及5 ~ 50 uL 2.试剂 100 ng/mL镉标准溶液(1%硝酸介质) 2 mol/L硝酸溶液 四、实验步骤: 1.测定条件 分析线波长:228.8 nm 灯电流:3 mA 狭缝宽度:0.2 nm 干燥温度、时间:100℃、15 s 灰化温度、时间:400℃、10 s 原子化温度、时间:2200℃、3 s 净化温度、时间:2200℃、2 s 保护气流量:100 mL/min 2.溶液的配制 取4只50 mL容量瓶,分别加入0 mL、0.125 mL、0.250 mL、0.500 mL浓度为100 ng/mL的镉标准溶液,再各添加2.5 mL硝酸溶液(2 mol/L),然后以Milli-Q去离子水稀释至刻度,摇匀,供原子吸收测
氢原子光谱 一.实验目的 1.熟悉光栅光谱仪的性能和用法 2.用光栅光谱仪测量氢原子光谱巴尔末系数的波长,求里德伯常数 二.实验原理 氢原子光谱是最简单、最典型的原子光谱。用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可得到线状氢原子光谱。瑞士物理学家巴尔末根据实验结果给出氢原子光谱在可见光区域的经验公式 2 024 H n n λλ=- (1) 式中H λ为氢原子谱线在真空中的波长。0364.57nm λ=是一经验常数。n 取3,4,5等整数。 若用波数表示,则上式变为 221 112H H R n νλ?? = =- ??? (2) 式中H R 称为氢的里德伯常数。 根据玻尔理论,对氢和类氢原子的里德伯常数的计算,得 () () 242 2 3 0241/Z me Z R ch m M ππε= + (3) 式中M 为原子核质量,m 为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,0ε为真空介电常数,Z 为原子序数。 当M →∞时,由上式可得出相当于原子核不动时的里德伯常数(普适的里德伯常数)
() 242 2 3 024me Z R ch ππε∞= (4) 所以 () 1/Z R R m M ∞ = + (5) 对于氢,有 () 1/H H R R m M ∞ =+ (6) 这里H M 是氢原子核的质量。 由此可知,通过实验测得氢的巴尔末线系的前几条谱线j 的波长,借助(6)式可求得氢的里德伯常数。 里德伯常数R ∞是重要的基本物理常数之一,对它的精密测量在科学上有重要意义,目前它的推荐值为()=10973731.56854983/R m ∞ 表1为氢的巴尔末线系的前四条波长表 表1 氢的巴尔末线系波长 值得注意的是,计算H R 和R ∞时,应该用氢谱线在真空中的波长,而实验是在空气中进行的,所以应将空气中的波长转换成真空中的波长。即1λλλ?真空空气=+,氢巴尔末线系前6条谱线的修正值如表2所示。 表2 真空—空气波长修正值
附红外吸收光谱(IR)的基本原理及应用 一、红外吸收光谱的历史 太阳光透过三棱镜时,能够分解成红、橙、黄、绿、蓝、紫的光谱带;1800年,发现在红光的外面,温度会升高。这样就发现了具有热效应的红外线。红外线和可见光一样,具有反射、色散、衍射、干涉、偏振等性质;它的传播速度和可见光一样,只是波长不同,是电磁波总谱中的一部分。(图一)、波长范围在0.7微米到大约1000微米左右。红外区又可以进一步划分为近红外区<0.7到2微米,基频红外区(也称指纹区,2至25微米)和远红外区(25微米至1000微米)三个部分。 1881年以后,人们发现了物质对不同波长的红外线具有不同程度的吸收,二十世纪初,测量了各种无机物和有机物对红外辐射的吸收情况,并提出了物质吸收的辐射波长与化学结构的关系,逐渐积累了大量的资料;与此同时,分子的振动――转动光谱的研究逐步深入,确立了物质分子对红外光吸收的基本理论,为红外光谱学奠定了基础。1940年以后,红外光谱成为化学和物理研究的重要工具。今年来,干涉仪、计算机和激光光源和红外光谱相结合,诞生了计算机-红外分光光度计、傅立叶红外光谱仪和激光红外光谱仪,开创了崭新的红外光谱领域,促进了红外理论的发展和红外光谱的应用。 二、红外吸收的本质 物质处于不停的运动状态之中,分子经光照射后,就吸收了光能,运动状态从基态跃迁到高能态的激发态。分子的运动能量是量子化的,它不能占有任意的能量,被分子吸收的光子,其能量等于分子动能的两种能量级之差,否则不能被吸收。 分子所吸收的能量可由下式表示: E=hυ=hc/λ 式中,E为光子的能量,h为普朗克常数,υ为光子的频率,c为光速,λ为波长。由此可见,光子的能量与频率成正比,与波长成反比。 分子吸收光子以后,依光子能量的大小,可以引起转动、振动和电子能阶的跃迁,红外光谱就是由于分子的振动和转动引起的,又称振-转光谱。
氢原子跃迁与氢原子光谱 玻尔原子理论第三条假设的“跃迁’指出:原子从一个定态(设能量为En )跃迁到 )时.它輻射和吸收一定频率的光于.光子能量由这两个定态另一种定态(没能量为E K 能量差决定,即hυ=En-Ek 若原于原来处于能级较大的定态——激发态.这时原子处于不稳定的能量状态,一有机会让会释放能量.回到能量较小的激发态或基态(能级最小的定态).这一过程放出的能量以放出光于的形式实现的,这就是原于发光原因。可见原子发光与能级跃迁有必然联系。对于氢原子它们对应关系如上图所示,从图可知当电子从n=3、4、5、6这四个激发态跃迁到n=2的激发态时,可得到可见光区域的氢原子光增,其波长"入"用下列公式计算 hc/入=E (1/n2-1/n2) 1 其中n=3,4,5,6.相应波长依次为: h α=656.3nm,hβ=486.1nm,hδ=434.1nm,hγ=410.1nm. 它们属于可见光,颜色分别为红、蓝、紫、紫。组成谱线叫巴耳末线系;若从n>1的激发态 跃迁到基态,放出一系列光子组成谱线在紫外区,肉眼无法观测,叫赖曼线系.....。 当原子处于基态或能级较低的激发态向高能级跃迁,必须吸收能量。这能量来源有
两种途径。 其一、吸收光子能量、光子实质上是一种不连续的能量状态。光的发射与吸收都是一份一份的,每一份能量E=hυ叫光子能量.光子能量不能被分割的。因此原子所吸收的光子只有满足hυ=En-Ek时,才能被原子吸收,从En定态跃迁到Ek定态。若不满足hυ=En-Ek的光子均不被吸收,原子也就无法跃迁。 例如用能量为123eV的光子去照射一群处于基态的氢原子.下列关于氢原子跃迁的说法中正确的是() 1)原子能跃迁到n=2的轨道上;2)原子能跃迁到n=3的轨道; 4)原子能跃迁到n=4的轨道上;3)原子不能跃迁。 通过计算可知E 1-E 2 =10.2eV<I2.3ev;E 3 -E 1 =12.09ev<12.3eV,E 4 一E 1 =12.75eV >12.3eV,即任意两定态能级差均不等于12.3eV.此光子原子无法吸收。答案D)正确。 其二、吸收电子碰撞能量。夫兰克——赫兹实验指出:当电子速度达到一定数值时,与原子碰撞是非弹性的,电子把一份份能量传给原子,使原子从一个较低能级跃迁到较高能级,原子从电子处获得能量只能等于两定态能量差。电子与光子不同.其能量不是一份一份的只要人射电子能量大于或等于两定态能量差. 均可使原子发生能级跃迁。 例如,已知汞原子可能能级如下图所示,一个自由电子总能量为9.0电子伏与处 于基态的汞原子发生碰撞,已知碰撞过程中不计汞原子动能变化,则电子剩余能量为()(A)0.2eV;(B)1.4eV(C)2.3eV(D)5.5eV. 因为E 2-E 1 =4.9ev<9.0eV,E 3 -E 1 =7.7eV<9.0ev,E 4 -E 1 =8.8ev<9.0ev. 满足人射电子能量大于两定态能量差 .处于基态汞原子分别吸收电子部分能量跃迁到n= 2、3.4能级,而电子剩余能量分别为4.1ev,1.3ev,0.2ev,只选项(A)正确。 摘自《物理园地》
激光拉曼光谱实验报告 摘要:本实验研究了用半导体激光器泵浦的3Nd + :4YVO 晶体并倍频后得到的532nm 激 光作为激发光源照射液体样品的4CCL 分子而得到的拉曼光谱,谱线很好地吻合了理论分析的4CCL 分子4种振动模式,且频率的实验值与标准值比误差低于2%。又利用偏振片及半波片获得与入射光偏振方向垂直及平行的出射光,确定了各振动的退偏度,分别为、、、,和标准值0和比较偏大。 关键词:拉曼散射、分子振动、退偏 一, 引言 1928年,印度物理学家拉曼()和克利希南()实验发现,当光穿过液体苯时被分子散射的光发生频率变化,这种现象称为拉曼散射。几乎与此同时,苏联物理学家兰斯别而格()和曼杰尔斯达姆()也在晶体石英样品中发现了类似现象。在散射光谱中,频率与入射光频率0υ相同的成分称为瑞利散射,频率对称分布在0υ两侧的谱线或谱带01υυ±即为拉曼光谱,其中频率较小的成分01υυ-又称为斯托克斯线,频率较大的成分01υυ+又称为反斯托克斯线。这种新的散射谱线与散射体中分子的震动和转动,或晶格的振动等有关。 拉曼效应是单色光与分子或晶体物质作用时产生的一种非弹性散射现象。拉曼谱线的数目,位移的大小,谱线的长度直接与试样分子振动或转动能级有关。因此,与红外吸收光谱类似,对拉曼光谱的研究,也可以得到有关分子振动或转动的信息。目前拉曼光谱分析技术已广泛应用于物质的鉴定,分子结构的研究谱线特征。 20世纪60年代激光的问世促进了拉曼光谱学的发展。由于激光极高的单色亮度,它很快被用到拉曼光谱中作为激发光源。而且基于新激光技术在拉曼光谱学中的使用,发展了共振拉曼、受激拉曼散射和番斯托克斯拉曼散射等新的实验技术和手段。 拉曼光谱分析技术是以拉曼效应为基础建立起来的分子结构表征技术,其信号来源于分子的振动和转动。它提供快速、简单、可重复、且更重要的是无损伤的定性定量分析,无需样品准备,样品可直接通过光纤探头或者通过玻璃、石英、和光纤测量。拉曼光谱的分析方向有定性分析、结构分析和定量分析。
普通高中课程标准实验教科书—物理(选修3-5) 新课标要求 1.内容标准 (1)了解人类探索原子结构的历史以及有关经典实验。 例1 用录像片或计算机模拟,演示α粒子散射实验。 (2)通过对氢原子光谱的分析,了解原子的能级结构。 例2 了解光谱分析在科学技术中的应用。 2.活动建议 观看有关原子结构的科普影片。 新课程学习 18.3 氢原子光谱 ★新课标要求 (一)知识与技能 1.了解光谱的定义和分类。 2.了解氢原子光谱的实验规律,知道巴耳末系。 3.了解经典原子理论的困难。 (二)过程与方法 通过本节的学习,感受科学发展与进步的坎坷。 (三)情感、态度与价值观 培养我们探究科学、认识科学的能力,提高自主学习的意识。 ★教学重点 氢原子光谱的实验规律 ★教学难点 经典理论的困难 ★教学方法 教师启发、引导,学生讨论、交流。 ★教学用具: 投影片,多媒体辅助教学设备 ★课时安排 1 课时
★教学过程 (一)引入新课 讲述: 粒子散射实验使人们认识到原子具有核式结构,但电子在核外如何运动呢?它的能量怎样变化呢?通过这节课的学习我们就来进一步了解有关的实验事实。 (二)进行新课 1.光谱(结合课件展示) 早在17世纪,牛顿就发现了日光通过三棱镜后的色散现 象,并把实验中得到的彩色光带叫做光谱。 (如图所示) 讲述: 光谱是电磁辐射(不论是在可见光区域还是在不可见光区 域)的波长成分和强度分布的记录。有时只是波长成分的记录。 (1)发射光谱 物体发光直接产生的光谱叫做发射光谱。 发射光谱可分为两类:连续光谱和线光谱。 引导学生阅读教材,回答什么是连续光谱和线光谱? 学生回答:连续分布的包含有从红光到紫光各种色光的光谱叫做连续光谱。只含有一些不连续的亮线的光谱叫做线光谱。线光谱中的亮线叫谱线,各条谱线对应不同波长的光。 教师讲述:炽热的固体、液体和高压气体的发射光谱是连续光谱。例如白炽灯丝发出的光、烛焰、炽热的钢水发出的光都形成连续光谱。如图所示。 稀薄气体或金属的蒸气的发射光谱是线光谱。线光谱是由游离状态的原子发射的,所以也叫原子的光谱。实践证明,原子不同,发射的线光谱也不同,每种原子只能发出具有本身特征的某些波长的光,因此线光谱的谱线也叫原子的特征谱线。如图所示。 (2)吸收光谱 教师:高温物体发出的白光(其中包含连续分布的一切波长的光)通过物质时,某些波长的光被物质吸收后产生的光谱,叫做吸收光谱。各种原子的吸收光谱中的每一条暗线都跟该种原子的原子的发射光谱中的一条明线相对应。这表明,低温气体原子吸收的光,恰好就是这种原子在高温时发出的光。因此吸收光谱中的暗谱线,也是原子的特征谱线。太阳的光
实验2 氢原子光谱的观察与测定 每一种原子都有其特定的线状光谱线。氢原子的光谱线最为简单,且具有明显的规律。测定氢原子可见光谱线的波长对认识原子的分离能级、以及由于能级间的跃迁而产生的光辐射的规律起着重要作用。本实验用读谱仪测量氢原子可见谱线的波长,并通过巴耳末公式推算出氢原子的里德伯常数。 【实验目的】 (1)观察氢原子的可见光谱。 (2)了解读谱仪的结构,掌握读谱仪的调节与使用方法。 (3)通过测量氢原子可见光谱线的波长,验证巴耳末公式的正确性。 (4)准确测定氢原子的里德伯常数。 (5)理解曲线拟合法的意义。 【仪器用具】 WPL —2型读谱仪,氢谱光源,氦氖谱光源,会聚透镜。 【仪器介绍】 整个实验的装置简图如图1所示。 读谱仪是由棱镜摄谱仪改进设计而成。它是利用棱镜分光在物镜上观察光谱的光学仪器。其结构大致可以分为三部分:平行光管系统、色散系统、接收系统。 (1)平行光管系统 平行光管系统包括入射狭缝和入射物镜。入射物镜的作用是使入射狭缝发出的光线变成平行光,所以入射狭缝应放在入射物镜的焦平面上。 (2)色散系统 色散系统实际上就是一个恒偏向棱镜,如图2所示。 它的作用是将光束分解,使不同波长的单色光束沿不同 的方向射出。符合最小偏向角条件的单色光,其入射光束和出射光束的夹角为900。 (3)接收系统 接收系统由出射物镜及放在该物镜焦平面上的目镜组成。不同方向的单色光束经出射物镜聚焦,在其焦平面上得到连续或不连续的依照波长次序排列的入射狭缝的单色像,即光谱。调节光谱的位置时,可以使用水平方向左右移动的手轮、丝杠、滑块、导轨和支架,还包括读出目镜位置用的标尺和100分度的手轮刻度。 手轮转一圈平移mm 1,每分度mm 01.0,要求估读到 1.0分度。目境内的叉丝用来对准被测谱线的中心。 【实验原理】 图 1 图2
实验31(A )原子发射光谱观测分析 【实验目的】 1. 学会使用光学多通道分析器的方法 2. 通过对钠原子光谱的研究了解碱金属原子光谱的一般规律 3. 加深对碱金属原子中外层电子与原子核相互作用以及自旋与轨道运动相互作用的了解 【实验仪器】 光学多通道分析器、光学平台、汞灯、钠灯、计算机 【原理概述】 钠属碱金属原子类,碱金属原子和氢原子一样,都只有一个价电子。但在碱金属原子中除了一个价电子外,还有内封闭壳层的电子,这些内封壳层电子与原子核构成原子实。价电子是在原子核和内部电子共同组成的力场中运动。原子实作用于价电子的电场与点电荷的电场有显著的不同。特别是当价电子轨道贯穿原子实时(称贯穿轨道),这种差别就更为突出。因此,碱金属原子光谱线公式为: ()()2 22*12*2 11~l l n R n R n n R μμν--'-'=???? ??-=' 其中ν ~为光谱线的波数;R 为里德堡常数。 n '与n 分别为始态和终态的主量子数 *2n 与*1n 分别为始态和终态的有效量子数 l '与l 分别为该量子数决定之能级的轨道量子数 l ''μ与l μ分别为始态和终态的量子缺(也称量子改正数,量子亏损) 根据就的波尔理论,在电子轨道愈接近原子中心的地方,μ的数值愈大。当轨道是贯穿轨道实,μ得数值还要大些。因为这时作用在电子上的原子核的有效电荷Z eff 有很大程度的改变。在非常靠近原子核的地方,全部核电荷作用在电子上。而距离很远的,原子核被周围电子屏蔽,以致有效核电荷1→eff Z 。因此s 项的μ值最大,而对p 项来说就小一些,对于d 来说还更小,由此类推。因而量子缺μ的大小直接反映原子实作用于价电子的电场与点电荷近似偏离的大小 对于钠原子光谱分如下四个线系 主线系:s np 3~→=ν 锐线系:p ns 3~→=ν 漫线系:p nd 3~→=ν 基线系:d nf 3~→=ν
吸收光谱简介 纯白光为一连续的从红色到紫色的光谱,但当白光穿过一个有色宝石,一定颜色或波长可被宝石所吸收,这导致该白光光谱中有一处或几处间断,这些间断以暗线或暗带形式出现。许多宝石显示出在可见光谱中吸收带或线的特征样式,其完整的样式被称为"吸收光谱"。吸收光谱 处于基态和低激发态的原子或分子吸收具有连续分布的某些波长的光而跃迁到各激发态,形成了按波长排列的暗线或暗带组成的光谱。 吸收光谱是温度很高的光源发出来的白光,通过温度较低的蒸汽或气体后产生的,如让高温光源发出的白光,通过温度较低的钠的蒸汽就能生成钠的吸收光谱。这个光谱背景是明亮的连续光谱。而在钠的标识谱线的位置上出现了暗线。通过大量实验观察总结出一条规律,即每一种元素的吸收光谱里暗线的位置跟他们明线光谱的位置是互相重合的。也就是每种元素所发射的光的频率跟它所吸收的光频率是相同的。 太阳光谱是一种吸收光谱,是因为太阳发出的光穿过温度比太阳本身低得多的太阳大气层,而在这大气层里存在着从太阳里蒸发出来的许多元素的气体,太阳光穿过它们的时候跟这些元素的标识谱线相同的光都被这些气体吸收掉了。因此我们看到的太阳光谱是在连续光谱的背景上分布着许多条暗线。这些暗线是德国物理学家夫琅和费首先发现的称为夫琅和费线。 吸收光谱高温物体发出的白光(其中包含连续分布的一切波长的光)通过物质时,某些波长的光被物质吸收后产生的光谱,叫做吸收光谱。例如,让弧光灯发出的白光通过温度较低的钠气(在酒精灯的灯心上放一些食盐,食盐受热分解就会产生钠气),然后用分光镜来观察,就会看到在连续光谱的背景中有两条挨得很近的暗线(见彩图8.分光镜的分辨本领不够高时,只能看见一条暗线).这就是钠原子的吸收光谱.值得注意的是,各种原子的吸收光谱中的每一条暗线都跟该种原子的发射光谱中的一条明线相对应.这表明,低温气体原子吸收的光,恰好就是这种原子在高温时发出的光.因此,吸收光谱中的谱线(暗线),也是原子的特征谱线,只是通常在吸收光谱中看到的特征谱线比明线光谱中的少 光谱分析 光谱分析由于每种原子都有自己的特征谱线,因此可以根据光谱来鉴别物质和确定它的化学组成.这种方法叫做光谱分析.做光谱分析时,可以利用发射光谱,也可以利用吸收光谱.这种方法的优点是非常灵敏而且迅速.某种元素在物质中的含量达10-10克,就可以从光谱中发现它的特征谱线,因而能够把它检查出来.光谱分析在科学技术中有广泛的应用.例如,在检查半导体材料硅和锗是不是达到了高纯度的要求时,就要用到光谱分析.在历史上,光谱分析还帮助人们发现了许多新元素.例如,铷和铯就是从光谱中看到了以前所不知道的特征谱线而被发现的.光谱分
实验二十 钠原子光谱 引言 研究元素的原子光谱,可以了解原子的内部结构,认识原子内部电子的运动,并导致电子自旋的发现。钠原子是一个多电子原子,原子序数为11,既有稳定的满内壳层,又有自由电子,既存在着原子核和电子的相互作用,又存在着电子之间的相互作用,还有电子自旋运动与轨道运动的相互作用,其光谱结构比较简单,即可用吸收光谱,也可用发射光谱进行研究,在激光光谱日益发展的今天,钠光谱仍是深入研究的对象之一。 一、实验目的 1、WGD-8型组合光栅光谱仪拍摄钠原子光谱的实验方法; 2、测定钠光谱线的波长,通过里德伯关系计算钠原子能级和量子亏损,并绘出能级图。 二、实验原理 在原子物理中,氢原子光谱的规律告诉我们:当原子在主量子数为2n 与1n 的上下两能级间跃迁时,它们的谱线波数可以用两光谱项之差表示: 22 21~n R n R ?=ν, (1) 式中R 为里德伯常量(109 677.581?cm ).当21=n ,2n =3,4,5,…,则为巴尔末线系。 对于只有一个价电子的碱金属原子(Li ,Na ,K ,…),其价电子是在核和内层电子所组成的原子实的库仑场中运动,和氢原子有点类似。但是,由于原子实的存在,价电子处在不同量子态时,或者按轨道模型的描述,处于不同的轨道时,它和原子实的相互作用是不同的。因为价电子处于不同轨道时,它们的轨道在原子实中贯穿的程度不同,所受到的作用不同。还有,价电子处于不同轨道时,引起原子实极化的程度也不同。这二者都要影响原子的能量。即使电子所处轨道的主量子数n 相同而轨道量子数l 不同,原子的能量也是不同的,因此原子的能量与价电子所处轨道的量子数n 、l 都有关,轨道贯穿和原子实极化都使原子的能量减少,量子数l 越小,轨道进入原子实部分越多,原子实的极化也越显著,因而原子的能量减少得越多。与主量子数n
紫外吸收光谱的基本原理,应用与其特点 紫外吸收光谱的基本原理 吸收光谱的产生 许多无色透明的有机化合物,虽不吸收可见光,但往往能吸收紫外光。如果用一束具有连续波长的紫外光照射有机化合物,这时紫外光中某些波长的光辐射就可以被该化合物的分子所吸收,若将不同波长的吸收光度记录下来,就可获的该化合物的紫外吸收光谱. 紫外光谱的表示方法 通常以波长λ为横轴、吸光度A(百分透光率T%)为纵轴作图,就可获的该化合物的紫外吸收光谱图。 吸光度A,表示单色光通过某一样品时被吸收的程度A=log(I0/I1), I0入射光强度,I1透过光强度; 透光率也称透射率T,为透过光强度I1与入射光强度I0之比值,T= I1/I0透光率T与吸光度A的关系为A=log(1/T) 根据朗伯-比尔定律,吸光度A与溶液浓度c成正比A=εbc ε为摩尔吸光系数,它是浓度为1mol/L的溶液在1cm的吸收池中,在一定波长下测得的吸光度,它表示物质对光能的吸收强度,是各种物质在一定波长下的特征常数,因而是检定化合物的重要数据;c为物质的浓度,单位为mol/L;b为液层厚度,单位为cm。 在紫外吸收光谱中常以吸收带最大吸收处波长λmax和该波长下的摩尔吸收系数εmax来表征化合物吸收特征。吸收光谱反映了物质分子对不同波长紫外光的吸收能力。吸收带的许多无色透明的有机化合物,虽不吸收可见光,但往往能吸收紫外光。如果用一束具有连续波长的紫外光照射有机化合物,这时紫外光中某些波长的光辐射就可以被该化合物的分子所吸收,若将不同波长的吸收光度记录下来,就可获的该化合物的紫外吸收光谱. 通常以波长λ为横轴、吸光度A(百分透光率T%)为纵轴作图,就可获的该化合物的紫外吸收光谱图。 吸光度A,表示单色光通过某一样品时被吸收的程度A=log(I0/I1), I0入射光强度,I1透过光强度; 透光率也称透射率T,为透过光强度I1与入射光强度I0之比值,T= I1/I0透光率T与吸光度A的关系为A=log(1/T) 根据朗伯-比尔定律,吸光度A与溶液浓度c成正比A=εbc ε为摩尔吸光系数,它是浓度为1mol/L的溶液在1cm的吸收池中,在一定波长下测得的吸光度,它表示物质对光能的吸收强度,是各种物质在一定波长下的特征常数,因而是检定化合物的重要数据;c为物质的浓度,单位为mol/L;b为液层厚度,单位为cm。 在紫外吸收光谱中常以吸收带最大吸收处波长λmax和该波长下的摩尔吸收系数εmax来表征化合物吸收特征。吸收光谱反映了物质分子对不同波长紫外光的吸收能力。吸收带的形状、λmax和εmax与吸光分子的结构有密切的关系。各种有机化合形状、λmax 和εmax与吸光分子的结构有密切的关系。各种有机化合物的λmax和εmax都有定值,同类化合物的εmax比较接近,处于一个范围。 紫外吸收光谱是由分子中价电子能级跃迁所产生的。由于电子能级跃迁往往要引起分子中核的运动状态的变化,因此在电子跃迁的同时,总是伴随着分子的振动能级和转动能级的跃迁。考虑跃迁前的基态分子并不是全是处于最低振动和转动能级,而是分布在若干不同的
红外光谱实验报告 一、实验原理: 1、红外光谱法特点: 由于许多化合物在红外区域产生特征光谱,因此红外光谱法广 泛应用于这些物质的定性和定量分析,特别是对聚合物的定性 分析,用其他化学和物理方法较为困难,而红外光谱法简便易 行,特别适用于聚合物分析。 2、红外光谱的产生和表示 红外光谱定义:分子吸收红外光引起的振动能级跃迁和转动能级跃 迁而产生的吸收信号。 分子发生振动能级跃迁需要的能量对应光波的红外区域分类为: i.近红外区:10000-4000cm-1 ⅱ.中红外区:4000-400cm-1——最为常用,大多数化合物的化键振 动能级的跃迁发生在这一区域。 ⅲ.远红外区:400-10cm-1 产生红外吸收光谱的必要条件: 1)分子振动:只有在振动过程中产生偶极矩变化时才能吸收红外辐射。 ⅰ.双原子分子的振动:(一种振动方式)理想状态模型——把两个 原子看做由弹簧连接的两个质点,用此来 描述即伸缩振动;
图1 双原子分子的振动模型 ⅱ.多原子分子的振动:(简正振动,依据键长和键角变化分两大类) 伸缩振动:对称伸缩振动 反对称伸缩振动 弯曲振动:面内弯曲:剪切式振动 (变形振动)平面摇摆振动 面外弯曲振动:扭曲振动 非平面摇摆振动 ※同一种键型,不对称伸缩振动频率大于对称伸缩振动频率,伸缩振动频率大于弯曲振动频率。 ※当振动频率和入射光的频率一致时,入射光就被吸收,因而同一基团基本上总是相对稳定地在某一特定范围内出现吸收峰。ⅲ.分子振动频率: 基频吸收(强吸收峰):基态到第一激发态所产生分子振动 的振动频率。 倍频吸收(弱吸收峰):基态到第二激发态,比基频高一倍 处弱吸收,振动频率约为基频两倍。 组频吸收(复合频吸收):多分子振动间相互作用,2个或
原子吸收光谱分析实验 一、目的要求 1.了解原子吸收光谱仪的基本构造、原理及方法; 2.了解利用原子吸收光谱仪进行测试实验条件的选择; 3.掌握原子吸收光谱分析样品的预处理方法; 4.学会应用原子吸收光谱分析定量测量样品中的常/微量元素含量。 二、实验原理 1、原子吸收光谱分析的原理 当光源发射的某一特征波长的辐射通过原子蒸气时,被原子中的外层电子选择性地吸收,透过原子蒸气的入射辐射强度减弱,其减弱程度与蒸气相中该元素的基态原子浓度成正比。 当实验条件一定时,蒸气相中的原子浓度与试样中该元素的含量(浓度)成正比。因此,入射辐射减弱的程度与该元素的含量(浓度)成正比。 朗伯—比尔吸收定律:cL 1lg lg 0K T I I A === 式中:A —吸光度 I —透射原子蒸气吸收层的透射辐射强度 I 0—入射辐射强度 L —原子吸收层的厚度 K —吸收系数 c —样品溶液中被测元素的浓度 原子吸收光谱分析法就是根据物质产生的原子蒸气对特定波长光的吸收作用来进行定量分析的。 2、原子吸收光谱仪的结构及其原理
原子吸收光谱分析法所使用的仪器称为原子吸收光谱仪或原子吸收分光光度计,一般由四部分构成,即光源、原子化系统、分光系统和检测显示系统组成。 图4-1 原子吸收光谱仪结构示意图 (1)光源 光源的作用是辐射待测元素的特征谱线,以供测量之用。要测出待测元素的特征谱线和峰值吸收,就需要光源辐射出的特征谱线宽度必须很窄,目前空心阴极灯是最能满足要求的理想的锐线光源。 (2)原子化系统 样品的原子化作为原子吸收光谱测试的主要环节,在很大的程度上影响待测样品中元素的灵敏度、干扰、准确度等。目前原子化技术有火焰原子化和非火焰原子化两类。常用的原子化器有混合型火焰原子化器、电热石墨炉原子化器、阴极溅射原子化器和石英炉原子化器等。 (3)分光系统 分光系统的作用是把待测元素的共振线(实际上是分析线)与其他谱线分离出来,只让待测元素的共振线能通过。该系统主要由色散元件(常用的是光栅),入射和出射狭缝,反射镜等组元素组成,其中色散原件(光栅、棱镜)是分光系统中的关键部件。 (4)检测显示系统 检测显示系统主要由检测器,放大镜和对数变换器及显示装置组成。检测器
第十八章原子结构 新课标要求 1.内容标准 (1)了解人类探索原子结构的历史以及有关经典实验。 例1 用录像片或计算机模拟,演示α粒子散射实验。 (2)通过对氢原子光谱的分析,了解原子的能级结构。 例2 了解光谱分析在科学技术中的应用。 2.活动建议 观看有关原子结构的科普影片。 新课程学习 18.3 氢原子光谱 ★新课标要求 (一)知识与技能 1.了解光谱的定义和分类。 2.了解氢原子光谱的实验规律,知道巴耳末系。 3.了解经典原子理论的困难。 (二)过程与方法 通过本节的学习,感受科学发展与进步的坎坷。 (三)情感、态度与价值观 培养我们探究科学、认识科学的能力,提高自主学习的意识。 ★教学重点 氢原子光谱的实验规律 ★教学难点 经典理论的困难 ★教学方法
教师启发、引导,学生讨论、交流。 ★教学用具: 投影片,多媒体辅助教学设备 ★课时安排 1 课时 ★教学过程 (一)引入新课 讲述: 粒子散射实验使人们认识到原子具有核式结构,但电子在核外如何运动呢?它的能量怎样变化呢?通过这节课的学习我们就来进一步了解有关的实验事实。 (二)进行新课 1.光谱(结合课件展示) 早在17世纪,牛顿就发现了日光通过三棱镜后的色散现 象,并把实验中得到的彩色光带叫做光谱。 (如图所示) 讲述: 光谱是电磁辐射(不论是在可见光区域还是在不可见光区 域)的波长成分和强度分布的记录。有时只是波长成分的记录。 (1)发射光谱 物体发光直接产生的光谱叫做发射光谱。 发射光谱可分为两类:连续光谱和明线光谱。 引导学生阅读教材,回答什么是连续光谱和明线光谱? 学生回答:连续分布的包含有从红光到紫光各种色光的光谱叫做连续光谱。只含有一些不连续的亮线的光谱叫做明线光谱。明线光谱中的亮线叫谱线,各条谱线对应不同波长的光。 教师讲述:炽热的固体、液体和高压气体的发射光谱是连续光谱。例如白炽灯丝发出的光、烛焰、炽热的钢水发出的光都形成连续光谱。如图所示。 稀薄气体或金属的蒸气的发射光谱是明线光谱。明线光谱是由游离状态的原子发射的,所以也叫原子的光谱。实践证明,原子不同,发射的明线光谱也不同,每种原子只能发出具有本身特征的某些波长的光,因此明线光谱的谱线也叫原子的特征谱线。如图所示。
氢原子光谱和里德伯常量测定
摘要: 本文详细地介绍了氢原子光谱和里德伯常量实验的实验要求、实验原理、仪器介绍、实验内容和数据处理,并从钠黄双线无法区分的现象触发定量地分析了此现象的原因和由此产生的误差,结合光谱不够锐亮和望远镜转动带来的误差提出了创新的实验方案。从理论上论证了实验方案的可行性,总结了基础物理实验的经验感想。 关键字:氢原子光谱里德伯常量钠黄双线 Abstract: This paper introduced the hydrogen atoms spectrum and Rydberg constant experiment from experimental requirements, experimental principle, instruments required, content and Data processing. Considering that the wavelength difference of Na-light double yellow line is indistinguishable from human eyes, we analyze the cause of this phenomenon and the resulting errors quantitatively and propose an innovate experiment method combined with inadequate sharpness and lightness of the spectrum as well as the errors brought during the turning of telescope. We verify the feasibility of this method In theory and summarizes the experience and understanding of basic physics experiment. Key words: hydrogen atoms spectrum, Rydberg constant, Na-light double yellow line
原子吸收光谱实验报告 一、实验目的 1. 学习原子吸收光谱分析法的基本原理; 2.了解火焰原子吸收分光光度计的基本结构,并掌握其使用方法; 3.掌握以标准曲线法测定自来水中钙、镁含量的方法。 二、实验原理 1.原子吸收光谱分析基本原理 原子吸收光谱法(AAS)是基于:由待测元素空心阴极灯发射出一定强度和波长的特征谱线的光,当它通过含有待测元素的基态原子蒸汽时,原子蒸汽对这一波长的光产生吸收,未被吸收的特征谱线的光经单色器分光后,照射到光电检测器上被检测,根据该特征谱线光强度被吸收的程度,即可测得试样中待测元素的含量。 火焰原子吸收光谱法是利用火焰的热能,使试样中待测元素转化为基态原子的方法。常用的火焰为空气—乙炔火焰,其绝对分析灵敏度可达10-9g,可用于常见的30多种元素的分析,应用最为广泛。 2.标准曲线法基本原理 在一定浓度范围内,被测元素的浓度(c)、入射光强(I0)和透射光强(I)符合Lambert-Beer定律:I=I0×(10-abc)(式中a为被测组分对某一波长光的吸收系数,b为光经过的火焰的长度)。根据上述关系,配制已知浓度的标准溶液系列,在一定的仪器条件下,依次测定其吸光度,以加入的标准溶液的浓度为横坐标,相应的吸光度为纵坐标,绘制标准曲线。试样经适当处理后,在与测量标准曲线吸光度相同的实验条件下测量其吸光度,在标准曲线上即可查出试样溶液中被测元素的含量,再换算成原始试样中被测元素的含量。 三、仪器与试剂 1. 仪器、设备: TAS-990型原子吸收分光光度计;钙、镁空心阴极灯;无油空气压缩机;乙炔钢瓶;容量瓶、移液管等。 2.试剂 碳酸镁、无水碳酸钙、1mol?L-1盐酸溶液、蒸馏水 3.标准溶液配制 (1)钙标准贮备液(1000μg?mL-1)准确称取已在110℃下烘干2h的无水碳酸钙0.6250g于100mL烧杯中,用少量蒸馏水润湿,盖上表面皿,滴加1mol?L-1盐酸溶液,至完全溶解,
原子吸收光谱法 原子吸收光谱(Atomic Absorption Spectroscopy,AAS),又称原子分光光度法,就是基于待测元素的基态原子蒸汽对其特征谱线的吸收,由特征谱线的特征性与谱线被减弱的程度对待测元素进行定性定量分析的一种仪器分析的方法。 中文名 原子吸收光谱法 外文名 Atomic Absorption Spectroscopy 光线范围 紫外光与可见光 出现时间 上世纪50年代 简称 AAS 测定方法 标准曲线法、标准加入法 别名 原子吸收分光光度法 基本原理 原子吸收光谱法(AAS)就是利用气态原子可以吸收一定波长的光辐射,使原子中外层的电子从基态跃迁到激发态的现象而建立的。由于各种原子中电子的能级不同,将有选择性地共振吸收一定波长的辐射光,这个共振吸收波长恰好等于该原子受激发后发射光谱的波长。当光源发射的某一特征波长的光通过原子蒸气时,即入射辐射的频率等于原子中的电子由基态跃迁到较高能态(一般情况下都就是第一激发态)所需要的能量频率时,原子中的外层电子将选择性地吸收其同种元素所发射的特征谱线,使入射光减弱。特征谱线因吸收而减弱的程度称吸光度A,在线性范围内与被测元素的含量成正比: A=KC 式中K为常数;C为试样浓度;K包含了所有的常数。此式就就是原子吸收光谱法进行定量分析的理论基础 由于原子能级就是量子化的,因此,在所有的情况下,原子对辐射的吸收都就是有选择性的。由于各元素的原子结构与外层电子的排布不同,元素从基态跃迁至第一激发态时吸收的能量不同,因而各元素的共振吸收线具有不同的特征。由此可作为元素定性的依据,而吸收辐射的强度可作为定量的依据。AAS现已成为无机元素定量分析应用最广泛的一种分析方法。该法主要适用样品中微量及痕量组分分析。