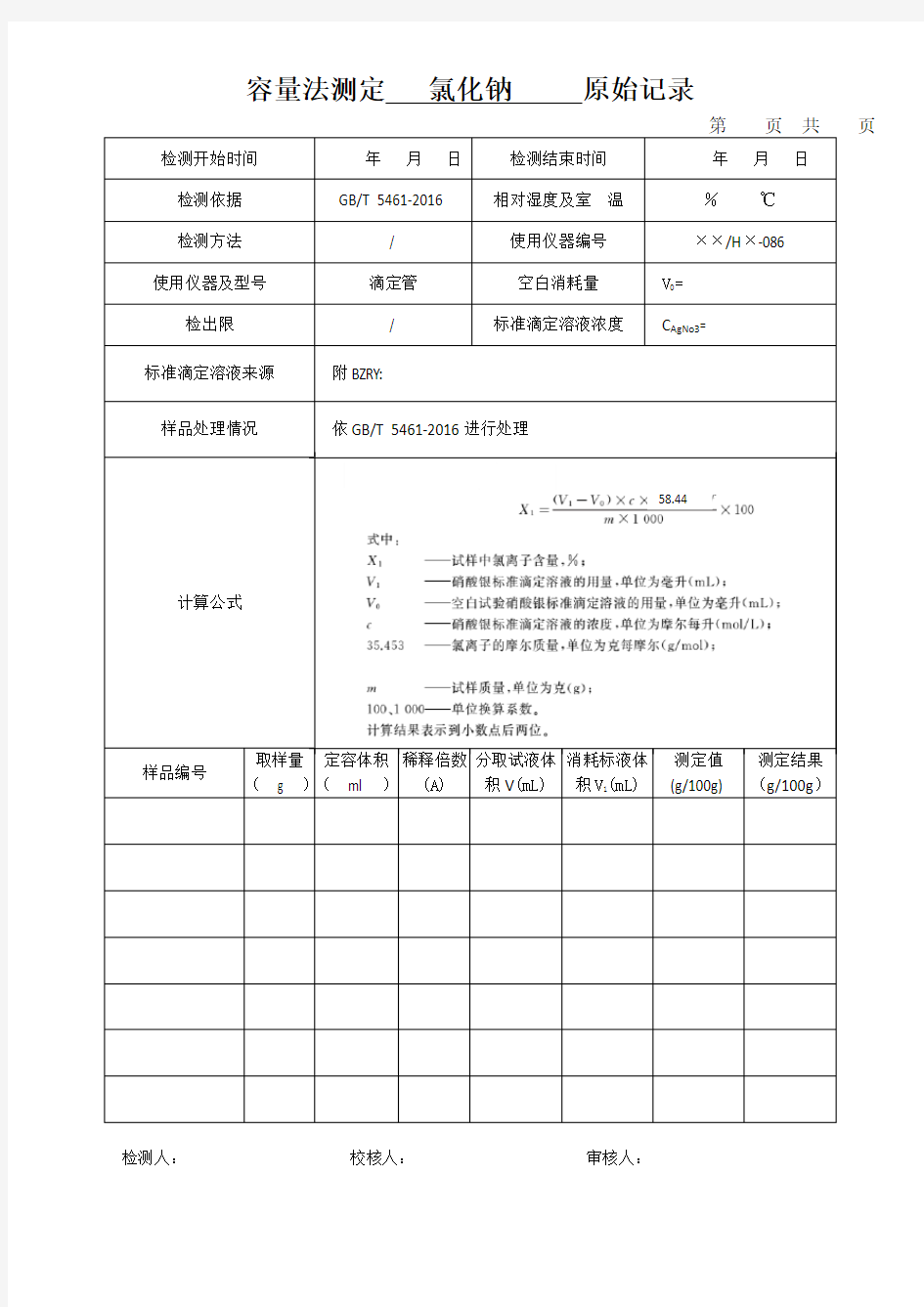
容量法测定氯化钠原始记录
页
58.44
定容体积稀释倍数分取试液体消耗标液体测定值测定结果
检测人:校核人:审核人:
实验五:空气中甲醛的测定(酚试剂分光光度法) 实验目的: 掌握甲醛测定方法; 熟练掌握大气采样器和分光光度计的使用; 实验原理: 甲醛的测定方法:分光光度法、气相色谱法、酚试剂分光光度法、乙酰丙酮分光光度法; 空气中的甲醛与3-甲基2-苯并噻唑酮腙酚试剂反应生成嗪,嗪在酸性溶液中被高铁离子氧化形成蓝绿色化合物,颜色深浅与甲醛含量成正比,物质的最大吸收波长为630nm,通过比色定量。当采样体积为10L时最低检出质量浓度为0.01mg/m3。 实验仪器: 分光光度计(在630nm测定);大气采样器;具塞比色管(10ml);分析天平;滴定管;容量瓶;量筒;移液管等 1、吸收液原液:称量0.10g酚试剂[C6H4SN(CH3)C:NNH2·HCl,简称NBTH],加水溶解,倾于100ml具塞量筒中,加水到刻度。放冰箱中保存,可稳定三天。吸收液:量取吸收原液5ml,加95ml水,即为吸收液。采样时,临用现配。 2、1%硫酸铁铵溶液 3、碘溶液[C(1/2I2)=0.1000mol/L] 4、1mol/L氢氧化钠溶液 5、0.5mol/L硫酸溶液:取28ml浓硫酸缓慢加入水中,冷却后,稀释至1000ml。 6、硫代硫酸钠标准溶液[C(Na2S2O3)=0.1000mol/L] 0.5%淀粉溶液:将0.5g可溶性淀粉,用少量水调成糊状后,再加入100ml沸水,并煎沸2~3min至溶液透明确。 7、甲醛标准贮备溶液:取2.8ml含量为36~38%甲醛溶液,放入1L容量瓶中,加水稀释至刻度。此溶液1ml约相当于1mg甲醛。其准确浓度用下述碘量法标定。 实验步骤: 1、样品采集:用一个内装5ml吸收液的大型气泡吸收管,以0.5L/min流量,采气10L。并记录采样点的温度和大气压力。采样后样品在室温下应在24h内分析。 2、甲醛标准贮备溶液的标定:精确量取20.00ml待标定的甲醛标准贮备溶液,置于250ml 碘量瓶中。加入20.00ml[C(1/2I2)=0.1000mol/L]碘溶液和15ml 1mol/L氢氧化钠溶液,放置15min,加入0.5mol/L硫酸溶液,再放置15min,用[C(Na2S2O3)=0.1000mol/L]硫代硫酸钠溶液滴定,至溶液呈现淡黄色时,加入1ml 5%淀粉溶液继续滴定至恰使兰色褪去为止,记录所用硫代硫酸钠溶液体积(V2),ml。同时用水作试剂空白滴定,记录空白滴定所用硫化硫酸钠标准溶液的体积(V1),ml。甲醛溶液的浓度用公式(1)计算:甲醛溶液浓度(mg/ml)=(V1-V2)×N×15/20 (1) 式中:V1――试剂空白消耗[C(Na2S2O3)=0.1000mol/L]硫代硫酸钠溶液的体积,ml; V2――甲醛标准贮备溶液消耗[C(Na2S2O3)=0.1000mol/L]硫代硫酸钠溶液的体积,ml;N――硫代硫酸钠溶液的准确当量浓度; 15――甲醛的当量; 20――所取甲醛标准贮备溶液的体积,ml。 二次平行滴定,误差应小于0.05ml,否则重新标定。 绘制标准曲线: 用1.00μg/ml甲醛标准溶液,按下表制各标准色列管
实验分光光度法测定铁 The following text is amended on 12 November 2020.
实验十四邻二氮菲分光光度法测定铁的含量 一、实验目的 1.学习吸光光度法测量波长的选择方法; 2.掌握邻二氮菲分光光度法测定铁的原理及方法; 3. 掌握分光光度计的使用方法。 二、实验原理 分光光度法是根据物质对光选择性吸收而进行分析的方法,分光光度法用于定量分析的理论基础是朗伯比尔定律,其数学表达式为:A=εb C 邻二氮菲(又称邻菲罗啉)是测定微量铁的较好试剂,在pH=2~9的条件下,二价铁离子与试剂生成极稳定的橙红色配合物。摩尔吸光系数ε=11000 L·mol-1·cm-1。在显色前,用盐酸羟胺把Fe3+还原为Fe2+。 2Fe3++2NH 2OHHCl→2Fe2++N 2 +4H++2H 2 O+2Cl- Fe2+ + Phen = Fe2+ - Phen (橘红色) 用邻二氮菲测定时,有很多元素干扰测定,须预先进行掩蔽或分离,如钴、镍、铜、铅与试剂形成有色配合物;钨、铂、镉、汞与试剂生成沉淀,还有些金属离子如锡、铅、铋则在邻二氮菲铁配合物形成的pH范围内发生水解;因此当这些离子共存时,应注意消除它们的干扰作用。 三、仪器与试剂 1.醋酸钠:l mol·L-1; 2.盐酸:6 mol·L-1; 3.盐酸羟胺:10%(用时配制); 4.邻二氮菲(%):邻二氮菲溶解在100mL1:1乙醇溶液中; 5.铁标准溶液。 (1)100μg·mL-1铁标准溶液:准确称取(NH 4) 2 Fe(SO 4 ) 2 ·12H 2 0于烧杯中, 加入20 mL 6 mol·L-1盐酸及少量水,移至1L容量瓶中,以水稀释至刻度,摇匀. 6.仪器:7200型分光光度计及l cm比色皿。 四、实验步骤 1.系列标准溶液配制 (1)用移液管吸取10mL100μg·mL-1铁标准溶液于100mL容量瓶中,加入2mL 6 mol·L-1盐酸溶液, 以水稀释至刻度,摇匀. 此溶液Fe3+浓度为10μg·mL-1. (2) 标准曲线的绘制: 取50 mL比色管6个,用吸量管分别加入0 mL,2 mL,4 mL, 6 mL, 8 mL和10 mL10μg·mL-l铁标准溶液,各加l mL盐酸羟胺,摇匀; 经再加2mL邻二氮菲溶液, 5 mL醋酸钠溶液,摇匀, 以水稀释至刻度,摇匀后放置 10min。 2.吸收曲线的绘制 取上述标准溶液中的一个, 在分光光度计上,用l cm比色皿,以水为参比溶液,用不同的波长,从440~560 nm,每隔10 nm测定一次吸光度,在最大吸收波长
紫外-可见分光光度法 一、单项选择题 1.可见光的波长范围是 A、760~1000nm B、400~760nm C、200~400nm D、小于400nm E、大于760nm 2.下列关于光波的叙述,正确的是 A、只具有波动性 B、只具有粒子性 C、具有波粒二象性 D、其能量大小于波长成正比 E、传播速度与介质无关 3.两种是互补色关系的单色光,按一定的强度比例混合可成为 A、白光 B、红色光 C、黄色光 D、蓝色光 E、紫色光 4.测定Fe3+含量时,加入KSCN显色剂,生成的配合物是红色的,则此配合物吸收了白光中的 A、红光 B、绿光 C、紫光 D、蓝光 E、青光 5.紫外-可见分光光度计的波长范围是 A、200~1000nm B、400~760nm C、1000nm以上 D、200~760nm E、200nm以下 6.紫外-可见分光光度法测定的灵敏度高,准确度好,一般其相对误差在 A、不超过±0.1% B、1%~5% C、5%~20% D、5%~10% E、0.1%~1% 7.在分光光度分析中,透过光强度(I t)与入射光强度(I0)之比,即I t / I0称为 A、吸光度 B、透光率 C、吸光系数 D、光密度 E、消光度8.当入射光的强度(I0)一定时,溶液吸收光的强度(I a)越小,则溶液透过光的强度(I t) A、越大 B、越小 C、保持不变 D、等于0 E、以上都不正确9.朗伯-比尔定律,即光的吸收定律,表述了光的吸光度与 A、溶液浓度的关系 B、溶液液层厚度的关系 C、波长的关系 D、溶液的浓度与液层厚度的关系 E、溶液温度的关系 10.符合光的吸收定律的物质,与吸光系数无关的因素是 A、入射光的波长 B、吸光物质的性质 C、溶液的温度 D、溶剂的性质 E、在稀溶液条件下,溶液的浓度 11.在吸收光谱曲线上,如果其他条件都不变,只改变溶液的浓度,则最大吸收波长的位置和峰的
艾科锐公司化学基础知识考试题 分光光度法 科室姓名成绩时间 一、单项选择题(20分) 1、一束___通过有色溶液时,溶液的吸光度与浓度和液层厚度的乘积成正比。(B ) A、平行可见光 B、平行单色光 C、白光 D、紫外光 2、________互为补色。(A ) A、黄与蓝 B、红与绿 C、橙与青 D、紫与青蓝 3、摩尔吸光系数很大,则说明_____(C ) A、该物质的浓度很大 B、光通过该物质溶液的光程长 C、该物质对某波长光的吸收能力强 D、测定该物质的方法的灵敏度低。 4、下述操作中正确的是_____。(C ) A、比色皿外壁有水珠 B、手捏比色皿的磨光面 C、手捏比色皿的毛面 D、用报纸去擦比色皿外壁的水 5、用邻菲罗啉法测定锅炉水中的铁,pH需控制在4~6之间,通常选择____缓冲溶液较合适。(D ) A、邻苯二甲酸氢钾 B、NH3—NH4Cl C、NaHCO3—Na2CO3 D、HAc—NaAc 6、紫外-可见分光光度法的适合检测波长范围是_______。(C ) A、400~760nm; B、200~400nm C、200~760nm D、200~1000nm 7、邻二氮菲分光光度法测水中微量铁的试样中,参比溶液是采用_____。(B ) A、溶液参比; B、空白溶液; C、样品参比; D、褪色参比 8、722型分光光度计适用于________。(A ) A、可见光区 B、紫外光区 C、红外光区 D、都适用 9、722型分光光度计不能测定________。(C ) A、单组分溶液 B、多组分溶液 C、吸收光波长>800nm的溶液 D、较浓的溶液 10、下列说法正确的是________。(B ) A、透射比与浓度成直线关系; B、摩尔吸光系数随波长而改变; C、摩尔吸光系数随被测溶液的浓度而改变; D、光学玻璃吸收池适用于紫外光区 11、控制适当的吸光度范围的途径不可以是(C ) A、调整称样量 B、控制溶液的浓度 C、改变光源 D、改变定容体积12.双波长分光光度计与单波长分光光度计的主要区别在于(B ) A. 光源的种类及个数 B. 单色器的个数 C. 吸收池的个数 D. 检测器的个数 比尔定律的范围内,溶液的浓度、最大吸收波长、吸光度三者-在符合朗伯特13.的关系是(B ) A. 增加、增加、增加 B. 减小、不变、减小 C. 减小、增加、减小 D. 增加、不变、减小
原料进厂检验记录表 年月日编号物料名称料号数量 采购单号 供应商 检验项目抽样数不良数验收单号 备 及格 注 不及格 □全批 说 □分批交货 明 结 果□接受□退货□扣款□检验不良品退回 格式编呈:主管:检验员 原材料检验记录表 原料名称:多样性生物活性肽 序号抽样过程 批次号抽样日期标准要求应抽组数实抽组数实测结果试验结 论
有效物质含量 YCL2016011601 2016.01.16 2 2≥98% 有效物质含量 ≥98% 2YCL20160626012016.06.2211 有效物质含量 ≥98% 3YCL20161011012016.10.1133有效物质含量 =99.27% 合格 有效物质含量 =98.65% 合格 有效物质含量 =99.14% 合格 最终结论:合格 检验员:李强 原材料检验记录表02 原料名称:枯草芽孢杆菌 序号抽样过程试验结 论
有效活菌数 ≥ 200 亿 /g ( % ); 有效活菌数 = 水分 ≤8% 8( 250.24 亿/g (% ); 1 YCL2016012201 2016.01.22 2 2 水分 =6.83% 8(% ) 有效活菌数 ≥ 有效活菌数 = 2 YCL2016111501 200 亿 /g ( % ); 3 278.36 亿/g (% ); 2016.11.15 3 水分 ≤8% 水分 =6.98% 8( 合格 合格 最终结论: 合格 检验员:李强 原材料检验记录表 03 原料名称: 生物酶制剂 序号 抽样过程 试验结 论
1YCL20160214012016.02.14酶活力≥ 5万33酶活力=6.82万 2YCL20160715012016.07.15酶活力≥ 5万22酶活力=5.97万YCL20161220012016.12.20酶活力≥ 5万33酶活力=6.64万合格 合格合格 最终结论:合格 检验员:李强 原材料检验记录表04 原料名称:氨基酸
常用生化实验技术:分光光度法有色溶液对光线有选择性的吸收作用,不同物质由于其分子结构不同,对不同波长光线的吸收能力也不同,因此,每种物质都具有其特异的吸收光谱。有些无色溶液,虽对可见光无吸收作用,但所含物质可以吸收特定波长的紫外线或红外线。分光光度法主要是指利用物质特有的吸收光谱来鉴定物质性质及含量的技术,其理论依据是Lambert和Beer定律。 分光光度法是比色法的发展。比色法只限于在可见光区,分光光度法则可以扩展到紫外光区和红外光区。比色法用的单色光通过滤光片产生,谱带宽度为40~120nm,精度不高,而分光光度法则要求近于真正单色光,其光谱带宽最大不超过3~5nm,在紫外光区可到l nm以下。单色光通过棱镜或光栅产生,具有较高的精度。 一、光的基本知识 光是由光量子组成的,具有二重性,即不连续的微粒性和连续的波动性。波长和频率是光的波动性的特征,可用下式表示: λ=C/υ 式中λ为波长,具有相同的振动相位的相邻两点间的距离叫波长。υ为频率,即每秒钟振动次数。c为光速,等于299 770±4km/s。光属于电磁波。 自然界中存在各种不同波长的电磁波,列成表l-l所示的波谱图。分光光度法所使用的光谱范围在200nm~10μm (1μm=1 000nm)之间。其中200~400nm为紫外光区,400~760nm为可见光区,760~10 000 nm为红外光区。 二、朗伯一比尔(1ambert—Beer)定律 朗伯—比尔定律是比色分析的基本原理,这个定律是讨论有色溶液对单色光的吸收程度与溶液的浓度及液层厚度间的定量关系。此定律是由朗伯定律和比尔定律归纳而得。 1.朗伯定律一束单色光通过溶液后,由于溶液吸收了一部分光能,光的强度就要减弱:若溶液浓度不变,则溶液的厚度愈大(即光在溶液中所经过的途径愈长),光的强度减低也愈显著。 设光线通过溶液前的强度为Io(入射光的强度),通过液层厚为L溶液后.光的强度为I t(透过光的强度),则 表示透过光的强度是入射光强度的几分之几,称为透光度(transmittance),用T表示。透光度随溶液厚度的增
实验一紫外分光光度法测定苯甲酸 一、实验目的 学习、了解紫外分光光度法原理 了解紫外分光光度计的结构和使用方法 二、实验原理 当辐射能(光)通过吸光物质时,物质的分子对辐射能选择性的吸收而得到的光谱称为分子吸收光谱。分子吸收光谱的产生与物质的分子结构、物质所在状态、溶剂和溶液的PH等因素有关。分子吸收光谱的强度与吸光物质的浓度有关。表示物质对光的吸收程度,通常采用“吸光度”这一概念来量度。 根据朗伯-比尔定律,在一定的条件下,吸光物质的吸光度A 与该物质的浓度C和液层厚度成正比。即A= LC 因此,只要选择一定的波长测定溶液的吸光度,即可求出该溶液浓度,这就是紫外-可见分光光度计的基本原理。 在碱性条件下,苯甲酸形成苯甲酸盐,对紫外光有选择性吸收,其吸收光谱的最大吸收波长为225nm。因此,采用紫外分光光度计测定苯甲酸在225nm处的吸收度就能进行定量分析。 三、仪器与主要试剂 TU-1810紫外可见分光光度计1cm石英比色皿 0.1M氢氧化钠溶液 苯甲酸(AR) 四、实验步骤 1、苯甲酸标准溶液的制备 称取苯甲酸(105℃烘干)100mg,用0.1M氢氧化钠溶液100ml溶解后,转入1000ml容量瓶中,用蒸馏水稀释至刻度.此溶液1ml含0.1mg 苯甲酸. 2、制作苯甲酸吸收曲线,选择最大吸收波长 ①移取苯甲酸标准溶液4.00ml于50ml容量瓶中,用0.01M氢氧化钠溶液定容,摇匀,此溶液1ml含苯甲酸8ug. 以氘灯为光源,用0.01M氢氧化钠溶液作为参比,改变测量波长(从210-240nm)测量8ug/ml苯甲酸的吸光度. ②以波长为横坐标,吸光度为纵坐标,绘制苯甲酸的紫外吸收曲线,并找出最大的吸收波长 (是否是225nm). 3﹑样品的测定 ①取10.00ml苯甲酸样品,放入50ml容量瓶中,用0.01M氢氧化钠
检验原始记录规 1 围 本规规定了检验原始记录(以下简称原始记录)的基本要求、格式和填写要求。 2 术语 2.1 测定值 测定时,从仪器仪表或量具上读取的数值。 2.2 给定值 为了得到测定值而按标准规定给出的标准试剂(或试样)特性的量值。 2.3 计算值 由给定值和测定值经计算公式,按有效数字运算规则计算所得到的数值。 2.4 灭菌 用物理或化学的方法杀灭传播媒介上所有的微生物,使其达到无菌。 2.5 消毒 用物理或化学的方法杀灭或清除传播媒介上的病原微生物,使其达到无害化。 3 基本要求 3.1 原始记录的容应包括与检验有关的一切资料、数据和现象,完整地记 录全过程。 3.2 每一样品的原始记录应给出足够的信息以保证检验能够再现。 3.3 原始记录要格式化,每类样品应有固定的格式。 3.4 多个产品的同一检验项目的原始记录不准集中填写。
3.5 填写原始记录最好用钢笔(蓝色或黑色),也可使用碳素笔,禁止用铅笔。 3.6 字迹清晰、端正,尤其是0到9这10个阿拉伯数字和计量单位的书写。 3.7 改正错误的时要用“杠改法”(在需要改正的地方用红色笔划一横杠,在其右上方进行修改),并加盖改正人本人印章或签字确认。 3.8 记录应卷面整齐、洁净。同一页中不准使用两色或两色以上的墨水。 3.9 原始记录不允许重新抄写整理,要保持原始记录的原始属性。 3.10 对因检测、填写或其他原因造成得失误,使原始记录出现多处错误或卷面不洁欲作废的原始记录,不准撕毁废弃,应加盖“作废”(红色)章,仍与重新填写的原始记录一起存档。 4 填写要求 4.1 样品编号 样品编号为样品唯一性标识号,由业务室负责编写,原始记录样品编号应与检验报告及送样单编号一致。 4.2 共页第页 4.2.1 原始记录总页数等于手填原始记录页数与仪器设备自动记录页数之和。 4.2.2 手填写的原始记录应采用A4幅面纸,并算为1页:仪器设备自动记录纸不小于32开为1页;如小于32开,要粘贴在A4幅面原始记录纸上。 4.2.3 从第1起,按顺序排列。 4.3 检验项目 检验项目名称应与产品检验标准中规定的名称一致。如果一个检验项目需引用另一个检验项目的数据,在检验项目栏应填写两个检验项目名称;本栏还可填
UV-2550紫外分光光度计的使用和分光光度法测定对苯二酚姓名:XXX 专业:有机化学学号:312070303004 时间:2012.10.21 1.目的 (1)了解UV-2550紫外光谱仪的基本使用方法。 (2)了解测定对苯二酚的紫外光谱实验方法。 2. 试剂和仪器 2.1试剂: 标准溶液0.10m g/mL,准确称取0.25g对苯二酚溶于250ml容量瓶中,用水稀释至刻度,从中取出10ml于100ml容量瓶中,用水稀释至刻度,摇匀;pH=4.1的乙酸-乙酸钠缓冲溶液。 2.2 仪器: UV-2550型分光光度计。 3. 实验步骤 3.1 测量波长的选择 用吸量管吸取5.0ml对苯二酚标准溶液于25ml容量瓶中,加入0.5ml pH=4.1的乙酸-乙酸钠缓冲溶液,用二次蒸馏水定容,振荡混匀。15分钟后用1cm比色皿,275-330nm波长范围, 进行扫描。从吸收曲线上读出对苯二酚的最大吸收波长λmax。 3.2 对苯二酚含量的测定 (1)标准曲线的制作 在6个25ml容量瓶中,用吸量管分别加入0,1.0, 2.0, 3.0,4.0,5.0ml 对苯二酚标准溶液,加入0.5ml pH=4.1的乙酸-乙酸钠缓冲溶液,用二次蒸馏水定容,振荡混匀。用1cm比色皿,以试剂空白为参比溶液,在最大吸收波长处,用光度模块作标准曲线。 (2)试样中对苯二酚含量的测定 准确吸取一定体积的样品于40ml容量瓶中,加入0.5ml pH=4.1乙酸-乙酸钠,用水稀释至刻度,摇匀。在光度模块中直接读出试样中对苯二酚含量。 4. 实验结果 4.1 测量波长的选择 从吸收曲线上读出对苯二酚的最大吸收波长λmax=288.80。 见图1 吸收曲线 4.2 对苯二酚含量的测定 (1)标准曲线的制作 见图2 标准曲线 (2)试样中对苯二酚含量的测定 对苯二酚含量0.354 相对误差为11.5%
实验2 荧光分光光度计实验 一、实验目的 1、了解发光材料的激发和发射过程; 2、掌握用荧光分光光度计测量发光材料激发光谱和发射光谱的测量方法。 二、仪器用具 F-4600荧光分光光度计,发光材料 三、实验原理 光吸收和辐射与发光材料中的能级结构密切相关。紫外光激发荧光粉发光是研究发光材料发生性能和发光中心在基质晶格中能级结构的重要手段。本实验采用F-4600荧光分光光度计来研究发光材料的激发光谱和发射光谱。 F-4600荧光分光光度计的光学系统从功能上划分为两大部分,即激光光路和发射检测光路。激发光路将光源发出的光分解为单色光输出,照射到发光材料上激发荧光粉发光。发光材料发出的光进入发射光检测光路,被分解为单色光照射到光电倍增管上,光电倍增管输出信号的强度与照射到其上面的光强度呈正比。 由氙弧灯发出的光变色单色光后,即为荧光物质的激发光。被测的荧光物质在激发光照射下所发出的荧光,经过单色器变成单色荧光粉后照射于测样品用的光电倍增管上,由其所发生的光电流经过放大器放大输到记录仪,将激发光单色器的光栅,固定在最适当的激发光波长处,而让荧光单色器凸轮转动,将各波长的荧光强度讯号输出至记录仪上,所记录的光谱即发射光谱,简称荧光光谱。 当测绘荧光激发光谱时,将激发光单色器的光栅固定在最适当的荧光波长处,而让激发光单色口的凸轮转动,将各波长的激发光讯号输出至记录仪上,所记录的光谱即激发光谱。 四、实验内容 按实验要求,连接好计算机后开始实验。首先测试发射光谱,设置激发波长460nm,得到该样品的发射光谱,即
峰值波长出现在540nm左右。 加入1个310nm长波通型滤波片, 在测试激发光谱,输入检测波长540nm,得到激发光谱: 利用检测波长波长460nm,得到发射光谱:
分光光度法实验 邻二氮菲分光光度法测定铁(条件实验) 光度法测定试样中铁含量 一、要求目的 1.掌握分光光度计和吸量管的使用方法。 2.学习如何选择分光光度分析的实验条件。 3.掌握分光光度法测定铁的原理及方法。 4.通过本次实验,应掌握初步设计分光光度分析方法的步骤。 二、实验原理 在pH为2-9的溶液中,Fe2+与邻二氮菲(phen)生成稳定的橘红色络合物Fe(Phen)32+: 其lgβ3=21.3,摩尔吸光系数ε508=1.1×104L.mol-1cm-1。当铁为+3价时,可用盐酸羟还原:2Fe3++2NH2OH?HCl=2Fe2++N2↑+4H++2H2O+2Cl- Cu2+,Co2+,Ni2+,Cd2+,Hg2+,Mn2+,Zn2+等离子也能与Phen生成稳定络合物,在少量情况下,不影响Fe2+的测定,量大时可用EDTA掩蔽或预先分离。 吸光光度法的实验条件,如测量波长,溶液酸度,显色剂用量、显色时间、温度、溶剂以及共存离子干扰及其消除等,都是通过实验来确定的。本实验在测定试样中铁含量之前,先做部分条件试验,以便初学者掌握确定实验条件的方法。 条件试验的简单方法是:变动某实验条件,固定其余条件,测得一系列吸光度值,绘制吸光度-某实验条件的曲线,根据曲线确定某实验条件的适宜值或适宜范围。 三、注意事项 1.使用721B或722型分光光度计,提前布置学生预习P147~154,在每台仪器前附上一张 “使用方法”,要求学生看后才操作。另外,还要预习P128~131中吸量管的使用方法。 2.一般两位学生共用一台仪器,合作做实验,但实验报告各自写,提前通知学生自备坐标 纸。两个实验作完后一起交报告。暂不统一评分标准,由各组自行综合考虑,原则上条件试验应与预期基本相符,相对误差5%以内为合格。 3.用高级卫生纸作代用品擦干比色皿。要求学生实验完毕洗净比色皿,并将比色皿浸泡在 HNO溶液的烧杯中。 盛有15%的 3 4.实验分为两个步骤:用两个单元时间完成 a)分光光度法测定铁的条件实验 b)邻二氮菲分光光度法测定微量铁
1.1 了解紫外可见分光光度计的食用方法及基本结构 1.2 掌握用紫外可见分光光光度法进行定性分析和定量分析的方法 2.实验原理 2.1 定性分析 不同物质的分子结构不同,因此各种物质各有其特征的紫外可见光吸收光谱。以波长为横坐标,吸光度为纵坐标作图,得到的曲线称为吸收光谱曲线,他能清楚的描述该物质对不同波长光的吸收情况。光吸收程度最大处叫做最大吸收波长,用λmax表示。浓度不同时,光吸收曲线的形状相同,最大吸收波长不变,只是相应的吸光度大小不同。说明吸收曲线的形状只与物质的本性有关,而与物质的浓度无关。因此,我们可以利用吸收曲线对物质进行定性分析。 2.2 定量分析 根据朗伯-比尔定律:A=εbc,式中A—吸光度,ε—摩尔吸光系数,b—液层厚度cm,c—浓度,mol/L 当液层厚度b固定时,吸光度正比于浓度,因此可采用标准曲线法对物质进行定量分析。通常选择最大吸收波长进行定量分析,以提高分析灵敏度和消除干扰影响。 3.仪器及试剂 3.1 仪器及配件 UV1800PC型紫外可见分光光度计,1cm石英比色池 3.2 试剂 3.2.1 虾青素标准溶液 3.2.1.1 标准储备液(浓度为1.0mg/mL) 称取10mg 虾青素标准品溶于二甲基亚砜(DMSO),定容至10mL,摇匀,避光-20℃保存。 3.2.1.2 标准系列溶液的配制 用移液管分别量取0.5,1.0,2.0,3.0mL标准储备液,分别用50mL容量瓶定容,稀释溶剂为无水乙醇,定容之后摇匀,避光放置。 3.2.2 未知浓度的虾青素样品溶液。 4.实验内容 4.1 不同浓度的虾青素溶液吸收曲线的比较。 4.2 标准曲线的制作。 4.3 样品溶液的测定。 5.仪器操作步骤 5.1 开机,自检,预热20分钟 5.2 放置样品 将配好的样品转入比色池,比色池要用蒸馏水和待测溶液润洗,溶液装至比色池的1/2~2/3左右。装好后用纸巾吸干比色池表面的液体,将比色池放入样品槽中,注意比色池透光面要对住样品槽有孔的一边。 5.3 全波长扫描 将不同浓度的标准品依次转入比色池中进行全波长扫描,比较其吸收曲线和最大吸收峰
目的:制订紫外-可见分光光度法操作规程,明确其检查法的操作。 依据:《中华人民共和国药典》2010年版; 《中国药品检验标准操作规范》2010年版。 范围:紫外-可见分光光度法的操作 责任:质检室主任、化验员。 内容: 1简述: 紫外分光光度法是通过被测物质在紫外光区或可见光区的特定波长处或一定波长范围内光的吸收度,对该物质进行定性和定量分析的方法。本法在药品检验中主要用于药品的鉴别、检查和含量测定。 定量分析通常选择物质的最大吸收波长处测出吸收度,然后用对照品或吸收系数求算出被测物质的含量,多用于制剂的含量测定;对已知物质定性可用吸收峰波长或吸光度比值作为鉴别方法;若该物质本身在紫外光区无吸收,而其杂质在紫外光区有相当强度的吸收,或杂质的吸收峰处该物质无吸收,则可用本法作杂质检查。 物质对紫外辐射的吸收是由于分子中原子的外层电子跃迁所产生的,因此,紫外吸收主要决定于分子的电子结构,故紫外光谱又称电子光谱。有机化合物分子结构中如含有共轭体系、芳香环等发色基团,均可在近紫外区(200~400nm)或可见光区(400~850nm)产生吸收。通常使用的紫外-可见分光光度计的工作波长范围为190~900nm。
紫外吸收光谱为物质对紫外区辐射的能量吸收图。朗伯-比尔(Lambert -Beer )定律为光的吸收定律,它是紫外分光光度法定量分析的依据,其数学表达式为: Ecl T A ==1lg 式中: A 为吸光度 T 为透光率 E 为吸收系数 c 为溶液浓度 l 为光路长度 如溶液的浓度(c )为1%(g /ml ),光路长度(l )为lcm ,相应的吸光度即为吸收系数,以1%cm 1E 表示。若溶液的浓度(c )为摩尔浓度(mo1/L ) ,光路长度为lcm 时,则相应有吸收系数为摩尔吸收系数,以ε表示。 2仪器: 紫外-可见分光光度计主要由光源、单色器、样品室、检测器、显示系统和数据处理系统等部分组成。 为了满足紫外-可见光区全波长范围的测定,仪器备有两种光源,即氘灯和碘钨灯,前者用于紫外区,后者用于可见光区。 单色器通常由进光狭缝、出光狭缝、平行光装置、色散元件、聚焦透镜或反射镜等组成。色散元件有棱镜和光栅两种,棱镜多用天然石英或熔融硅石制成,对200~400nm 波长光的色散能力很强,对600nm 以上波长的光色散能力较差,棱镜色散所得的光谱为非匀排光谱。光栅系将反射或透射光经衍射而达到色散作用,故常称为衍射光栅,光栅光谱是按波长作线性排列,故为匀排光谱,双光束仪器多用光栅为色散原件。 检测器有光电管和光电倍增管两种。 紫外-可见分光光度计依据其结构和测量操作方式的不同可分为单光束和双光束分光光度计两类。单光束分光光度计有些仍为手工操作,即固定在某一波长,分别测量比较空白、样品或参比的透光率或吸光度,操作比较费事,用于绘制吸收光谱图时很不方便,但适用于单波长的含量测定。双光束
紫外分光光度法测定有机物实验方法 紫外分光光度法测定未知物 1.仪器 1.1紫外分光光度计(T6);配石英比色皿(1cm):4个; 1.2容量瓶(100mL、50mL):各10只; 1.3吸量管(1mL、2mL、5mL、10mL):各1支; 1.4移液管(20mL、25mL、50mL):各1支。 2.试剂 2.1标准溶液(1mg/mL):从维生素C、水杨酸、糖精钠、苯甲酸四种物质中任取其中两种,分别配成1mg/mL的标准溶液,作为储备液。 2.2未知液:浓度约为40~60ug/mL。其必为给出的两种标准物质中的一种。 3.实验操作 3.1 吸收池配套性检查 石英吸收池在220nm装蒸馏水,以一个吸收池为参比,调节τ为100%,测定其余吸收池的透射比,其偏差应小于0.5%,可配成一套使用,记录其余比色皿的吸光度值作为校正值。 说明:参赛选手可以自由选择使用比色皿的个数(大赛提供4个)。 3.2 未知物的定性分析 将两种标准储备液和未知液均配成浓度约为10ug/mL的待测溶液(配制方法由选手自定)。以蒸馏水为参比,于波长200~350nm范围内测定三种溶液吸光度,并作吸收曲线。根据吸收曲线的形状确定未知物,并从曲线上确定最大吸收波长作为定量测定时的测量波长。 四种标准物质溶液的吸收曲线参见附图。 3.3 未知物的定量分析 根据未知液吸收曲线上最大吸收波长处的吸光度,确定未知液的稀释倍数,并配制待测溶液。合理配制标准系列溶液(推荐:标准储备液先稀释10倍 (100ug/mL),然后再配制成所需浓度),于最大吸收波长处分别测出其吸光度。然后以浓度为横坐标,以相应的吸光度为纵坐标绘制标准曲线。根据待测溶液的吸光度,从标准曲线上查出未知样品的浓度。未知样要平行测定两次。 推荐方法 3.3.1维生素C含量的测定:准确吸取1mg/mL的维生素C标准储备液10mL,在100mL容量瓶中定容(此溶液的浓度为100ug/mL)。再分别准确移取0、1、2、4、6、8、10mL上述溶液,在50mL容量瓶中定容(浓度分别为0、2、4、8、12、16、20ug/mL)。准确移取10mL维生素C未知液,在50mL容量瓶中定容,于最
实验八分光光度法条件实验及测定微量铁(5学时)* 一、目的 1、学习如何选择吸咣光度分析的实验条件。 2、掌握用吸光光度法测定铁的原理及方法。 3、掌握分光光度计的使用方法。 二、原理 1、光度法测定的条件:分光光度法测定物质含量时应注意的条件主要是显色反应的条件和测定吸光度的条件。显色反应的条件有显色剂的用量,介质的酸度、显色时温度、显色时间及干扰物质的消除方法等;测量吸光度的条件包括入射光波长的选择、吸光度范围和参比溶液等。 2、二氮杂菲-亚铁络合物:邻二氮杂菲是测定微量铁的一种较好的试剂。在pH=2~9的条件下Fe2+离子与邻二氮杂菲生成稳定的橘红色络合物,此络合物=21.3, 摩尔吸光系数ε510=1.1×104 的lgK 稳 在显色前,首先用盐酸羟胺把Fe3+离子还原为Fe2+离子,其反应式如下: 2 Fe3++2NH2OH·HCl→2 Fe2++N2+2H2O+4H++2Cl- 测定时,控制溶液酸度在pH=5左右较为适宜。酸度过高,反应进行较慢;酸度太低,则Fe2+离子水解,影响显色。 Bi3+,Cd2+,Hg2+,Ag+,Zn2+等离子与显色剂生成沉淀,Ca2+,Cu2+,Ni2+等离子与显色剂形成有色络合物。因此当这些离子共存时,应注意它们的干扰作用。 三、试剂 100μg/mL的铁标准溶液:准确称取0.864g分析纯的NH4Fe(SO4)2·12H2O ,置于一烧杯中,以30mL 2mol/L HCl 溶液溶解后移入1000 mL 容量瓶中,以水稀释至刻度,摇匀。 10 μg/mL的铁标准液:由100μg/mL的铁标准溶液准确移取稀释10倍而成。 盐酸羟胺固体及10%溶液(因其不稳定,需临时用时配),0.1%邻二氮杂菲(新配制),1mol/LNaAc溶液。
实验十四邻二氮菲分光光度法测定铁的含量 一、实验目的 1.学习吸光光度法测量波长的选择方法; 2.掌握邻二氮菲分光光度法测定铁的原理及方法; 3. 掌握分光光度计的使用方法。 二、实验原理 分光光度法是根据物质对光选择性吸收而进行分析的方法,分光光度法用于定量分析的理论基础是朗伯比尔定律,其数学表达式为:A=ε b C 邻二氮菲(又称邻菲罗啉)是测定微量铁的较好试剂,在pH=2~9的条件下,二价铁离子与试剂生成极稳定的橙红色配合物。摩尔吸光系数ε=11000 L·mol-1·cm-1。在显色前,用盐酸羟胺把Fe3+还原为Fe2+。 2Fe3++2NH2OHHCl→2Fe2++N2+4H++2H2O+2Cl- Fe2+ + Phen = Fe2+ - Phen (橘红色) 用邻二氮菲测定时,有很多元素干扰测定,须预先进行掩蔽或分离,如钴、镍、铜、铅与试剂形成有色配合物;钨、铂、镉、汞与试剂生成沉淀,还有些金属离子如锡、铅、铋则在邻二氮菲铁配合物形成的pH范围内发生水解;因此当这些离子共存时,应注意消除它们的干扰作用。 三、仪器与试剂 1.醋酸钠:l mol·L-1; 2.盐酸:6 mol·L-1; 3.盐酸羟胺:10%(用时配制); 4.邻二氮菲(0.15%):0.l5g邻二氮菲溶解在100mL1:1乙醇溶液中; 5.铁标准溶液。 (1)100μg·mL-1铁标准溶液:准确称取0.8634g(NH4)2 Fe(SO4)2·12H20于烧杯中,加入20 mL 6 mol·L-1盐酸及少量水,移至1L容量瓶中,以水稀释至刻度,摇匀. 6.仪器:7200型分光光度计及l cm比色皿。 四、实验步骤 1.系列标准溶液配制 (1)用移液管吸取10mL100μg·mL-1铁标准溶液于100mL容量瓶中,加入2mL 6 mol·L-1盐酸溶液, 以水稀释至刻度,摇匀. 此溶液Fe3+浓度为10μg·mL-1. (2) 标准曲线的绘制: 取50 mL比色管6个,用吸量管分别加入0 mL,2 mL,4 mL, 6 mL, 8 mL和10 mL10μg·mL-l铁标准溶液,各加l mL盐酸羟胺,摇匀; 经再加2mL 邻二氮菲溶液, 5 mL醋酸钠溶液,摇匀, 以水稀释至刻度,摇匀后放置10min。 2.吸收曲线的绘制 取上述标准溶液中的一个, 在分光光度计上,用l cm比色皿,以水为参比溶液,用不同的波长,从440~560 nm,每隔10 nm测定一次吸光度,在最大吸收波长处每隔5nm测定一次吸光度。然后以波长为横坐标,吸光度为纵坐标绘制吸收曲线,从吸收曲线上确定进行测定铁的适宜波长(即最大吸收波长)。
分析化学实验报告 实验题目: 邻二氮杂菲分光光度法测定铁 学院: 专业:食品科学与工程 班级: 姓名: 学号: 同组者姓名:
一.实验目的 1.了解分光光度法测定物质含量的一般条件及其选定方法 2.掌握邻二氮杂菲分光光度法测定铁的方法 3.了解722型分光光度计的构造和使用方法 二.实验原理 1.光度法测定的条件:分光光度法测定物质含量时应注意的条件主要是 显色反应的条件和测量吸光度的条件。显色反应的条件有显色剂用量、介质的酸 度、显色时溶液温度、显色时间及干扰物质的消除方法等;测量吸光度的条件包括应选择的入射光波长,吸光度范围和参比溶液等。 2.在PH=2-9的条件下,Fe 2+与邻二氮杂菲(o-ph )生成极稳定的橘红色配合物,反应式如下: 此配合物的lgK 稳 =21.3 摩尔吸收系数ε 510 =1.1×104 在显色前,首先用盐酸羟胺把Fe 2+ 还原成Fe 3+.其反应式如下: 2Fe 3+ +2NH 2 OH · HC1 =2Fe 2+ +N 2 ↑+2H 2 O+4H + +2C1- 测定时,控制溶液酸度在PH=5左右较为适宜。酸度过高时,反应进行较慢;酸度太低,则Fe 2+水解,影响显色。 三、实验仪器 分光光度计、容量瓶、移液管、洗瓶 N N N N N N N N Fe + Fe 2+ 3 2+
四、实验步骤 1.条件实验 (1)吸收曲线的测绘准确吸取20 μg·mL-1铁标准溶液5 mL于50 mL容量瓶中,加入5%盐酸羟胺溶液1 mL,摇匀,加入1 mol·L-1NaOAc溶液5 mL和0.1%邻二氮杂菲溶液3 mL。以水稀释至刻度,摇匀。放置10 min,在722型分光光度计上,用1 cm比色皿,以水为参比溶液,波长从570 nm到430 nm为止,每隔10 nm测定一次吸光度。如图1所示,其最大吸收波长为510 nm,故该实验选择测定波长为510 nm。 (2)邻二氮杂菲-亚铁配合物的稳定性 用上面溶液继续进行测定,其方法是在最大吸收波长510 nm处,每隔一定时间测定其吸光度,及再加入显色剂后立即测定一次吸光度,经10、20、30、120 min 后,再各测一次吸光度。 (3)显色剂浓度实验取50 mL容量瓶7只,编号。每只容量瓶中准确加入20 ug·mL-1铁标准溶液5 mL以及1mL5%盐酸羟胺溶液,经2 min后。再加入5 mL1 mol·L-1NaOAc溶液,然后分别加入0.1%邻二氮杂菲溶液0.3mL、0.6mL、1.0 mL、1.5 mL、2.00 mL、3.0 mL和4.0 mL,用水稀释至刻度,摇匀,在分光光度计上,用最大吸收波长510 nm、1 cm比色皿,以水为参比,测定上述溶液的吸光度。 2.铁含量的测定 (1)标准曲线的绘制 取50mL容量瓶6只,编号。分别吸取20 μg·mL-1铁标准溶液2.0mL、4.0 mL、6.0 mL、8.0 mL和10.0 mL于5只容量瓶中,另一只容量瓶中不加标准溶液(配制空白溶液,作参比)。然后各加5%盐酸羟胺溶液,摇匀,经2 min后,再各加5 mL1 mol·L-1NaAc溶液及3 mL1 g·L-1邻二氮杂菲溶液,以水稀释至刻度线,摇匀。放置10 min,在分光光度计上,用1 cm比色皿,在510 nm处,测定各溶液的吸光度。以铁含量为横坐标,吸光度为纵坐标,绘制标准曲线。(2)未知液中铁含量的测定 吸取5ml未知液代替标准溶液,其他步骤均同上测定吸光度。由未知液的吸光度在标准曲线上查出5ml未知液中的铁含量,然后以每毫升未知液中含铁多少微克表示结果。 五、记录与计算
实验九分光光度计的使用 【目的】 了解分光光度法的基本原理,熟悉721分光光度计的操作方法,为今后使用该仪器奠定基础。 【原理】 有色溶液颜色的深浅与其中呈色物的含量成正比关系。在定量分析中,利用比较有色物质溶液的颜色深浅来测定物质含量的分析方法称比色法。被测物质中,有的本身就是有色物质,但多数被测物质本身无色或颜色很浅,须加入某些化学试剂使测物质与之发生反应生成有色物质。 物质的颜色是由于物质吸收某种波长的光线以后,通过或反射出某种颜色的结果。当一定波长的单色光通过该物质的溶液时,该物质都能有一定程度的吸光作用,单位体积内的溶液中该物质的质点数越多,对光线吸收越多。因此,利用物质对一定波长光线吸收的程度测定物质含量的方法,称为分光光度法。 分光光度法依据Lambert-Beer定律。设一束单色光I0射入溶液,由于部分光线被溶液吸收,通过的光线为I t,则I t/I0之比为透光度,若透光度T(%)。则 T= I t/I0×100% (1) 透光度(T)的倒数(1/T)反映了物质对光的吸收程度。在实际应用时,取(1/T)的对数值,做为吸光度用A表示,即 A=Lg(1/T)=-LgT (2) 吸收度(A)又称消光度(E)或光密度(OD)。 根据Lambert-Beer定律推导,当一束平行单色光通过均匀、无散射现象的溶液时,在单色光强度、溶液温度等条件不变条件下,溶液对光的吸收度(A)与溶液的浓度(C)及液层厚度(L)的乘积成正比。即 A=KCL (3) 在实际比色时,标准溶液与被测溶液使用相同的比色杯,即液层厚度(L)相同。K 为常数。测定同一种物质时,K标=K测。所以,将比简化为仅是溶液对光吸收度(A)与其浓度(C)之间的关系。即溶液的浓度越大,吸光度越大。 可以通过测定吸光度求知某一溶液的浓度。 设:测定管的吸光度和浓度分别为A测和C测,标准管吸光度和浓度分别为A标和C标,
邻二氮菲分光光度法测定微量铁 一、实验目的 ⒈学习确定实验条件的方法,掌握邻二氮菲分光光度法测定微量铁的方法原理; ⒉掌握721型分光光度计的使用方法,并了解此仪器的主要构造。 二、实验原理 ⒈确定适宜的条件的原因:在可见光分光光度法的测定中,通常是将被测物与显色剂反应,使之生成有色物质,然后测其吸光度,进而求得被测物质的含量。因此,显色条件的完全程度和吸光度的测量条件都会影响到测量结果的准确性。为了使测定有较高的灵敏度和准确性,必须选择适宜的显色反应条件和仪器测量条件。通常所研究的显色反应条件有显色温度和时间,显色剂用量,显色液酸度,干扰物质的影响因素及消除等,但主要是测量波长和参比溶液的选择。对显色剂用量和测量波长的选择是该实验的内容。 ⒉如何确定适宜的条件:条件试验的一般步骤为改变其中一个因素,暂时固定其他因素,显色后测量相应溶液吸光度,通过吸光度与变化因素的曲线来确定适宜的条件。 ⒊本试验测定工业盐酸中铁含量的原理:根据朗伯-比耳定律:A=εbc。 当入射光波长λ及光程b一定时,在一定浓度范围内,有色物质的吸光度A与 该物质的浓度c成正比。只要绘出以吸光度A为纵坐标,浓度c为横坐标的标 准曲线,测出试液的吸光度,就可以由标准曲线查得对应的浓度值,即工业盐酸中铁的含量。 ⒋邻二氮菲法的优点:用分光光度法测定试样中的微量铁,目前一般采用邻
二氮菲法,该法具有高灵敏度、高选择性,且稳定性好,干扰易消除等优点。 ⒌邻二氮菲法简介:邻二氮菲为显色剂,选择测定微量铁的适宜条件和测 量条件,并用于工业盐酸中铁的测定。 ⒍邻二氮菲可测定试样中铁的总量的条件和依据:邻二氮菲亦称邻菲咯啉 (简写phen),是光度法测定铁的优良试剂。在pH=2~9的范围内,邻二氮菲与二价铁生成稳定的桔红色配合物((Fe(phen)3)2+)。 = 21.3,摩尔吸光系数ε510 = 1.1×104 L·mol-1·cm-1,而Fe3+能与邻此配合物的lgK 稳 二氮菲生成3∶1配合物,呈淡蓝色,lgK 稳=14.1。所以在加入显色剂之前,应用盐酸羟胺(NH2OH·HCl)将Fe3+还原为Fe2+,其反应式如下: 2 Fe3+ + 2 NH2OH·HCl → 2Fe2+ + N2 + H2O + 4H+ + 2Cl- 测定时控制溶液的酸度为pH≈5较为适宜,用邻二氮菲可测定试样中铁的总量。 三、仪器试剂 ⒈仪器:721型分光光度计;1cm吸收池;10mL 吸量管;50mL 比色管(7个)。 ⒉试剂:1.0×10-3 mol·L-1铁标准溶液;100μg·mL-1铁标准溶液;0.15% 邻二氮菲水溶液;10%盐酸羟胺溶液(新配);1mol·L-1乙酸钠溶液;1 mol·L-1 NaOH溶液;6 mol·L-1 HCl(工业盐酸试样)。 四、实验步骤