
实验八 旋转圆盘电极法测定电极过程动力学参数
王法星 11210220045
同组人: 肖时英 王春 邓陶丽
一、目的要求
1.了解圆盘电极在旋转时的特点,掌握该实验的基本原理。 2.测定Fe(CN)64-/Fe(CN)63-体系中反应粒子的扩散系数(D )、交换电流密度(i 0)、阴极反应传递系数(α)和阳极反应传递系数(β)。
二、 实验原理
旋转圆盘电极的结构是将圆柱电极材料镶嵌在聚四氟乙烯棒中,一端呈圆盘状的平面作为反应面,,另一端则连接马达。当电极经马达带动以一定速率旋转时,在电极附近的液体必定会发生流动。在一定条件下,旋转圆盘电极附近的液体处于层流状态时,液体的流动可以分解成三个方向:
1. 由于电极旋转而产生的离心力,使液体在径向以V 径速度向外流动;
2. 由于液体的粘滞性,在旋转圆盘电极的平面以一定的角速度转动时,液体就要以 V 切速度向圆盘的切向流动;
3. 由于电极附近的液体向外流动,使电极中心区的液体压力下降,从而使得电极表面较远的液体以V 轴速度向中心流动。
根据流体动力学的计算,可以得出液体处于层流时,上述流动速度的数学表达式为:
V r F()ωξ=径 (1)
V r G()ωξ=切 (2)
V H()νωξ=轴 (3)
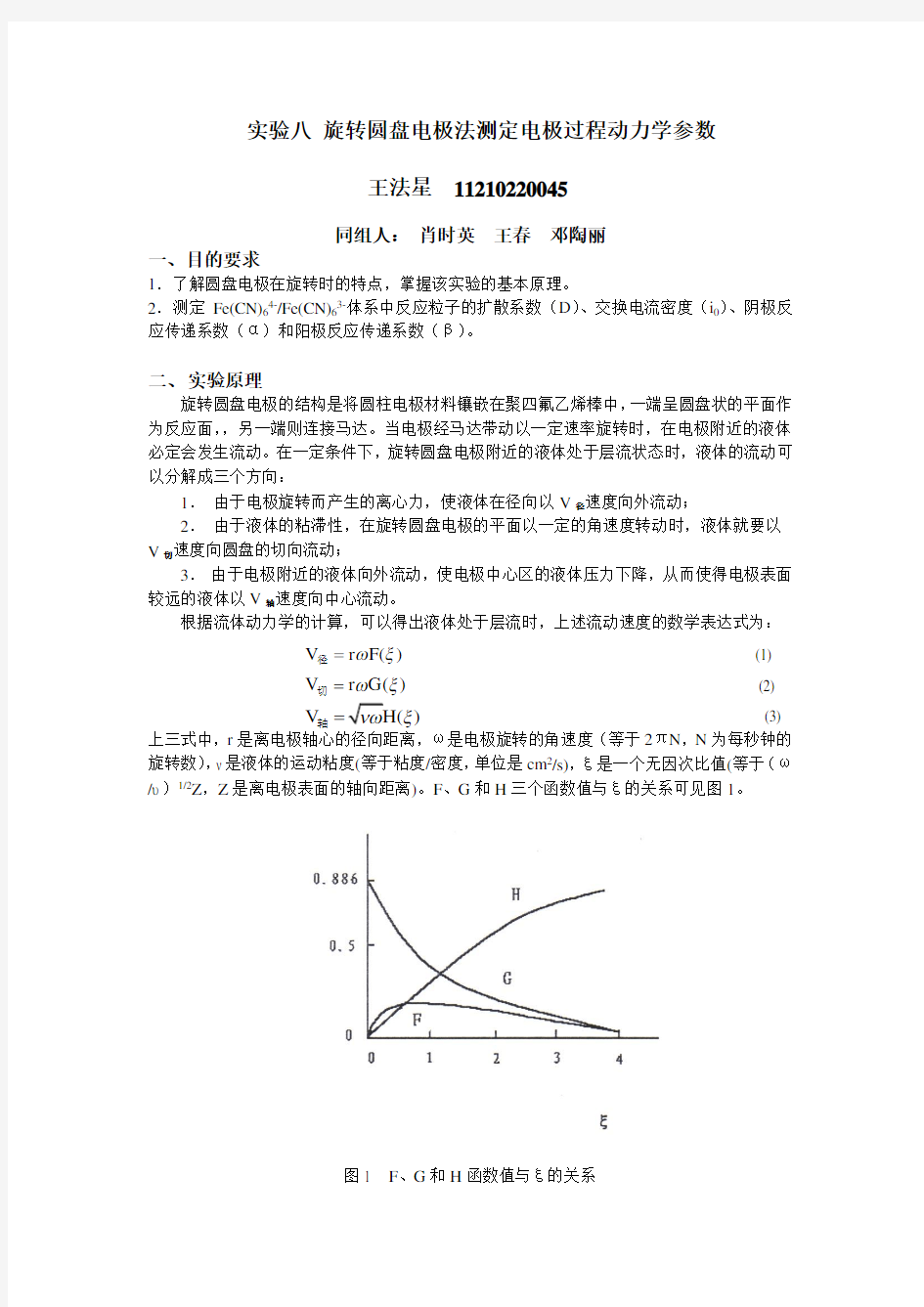
上三式中,r 是离电极轴心的径向距离,ω是电极旋转的角速度(等于2πN ,N 为每秒钟的旋转数),ν是液体的运动粘度(等于粘度/密度,单位是cm 2/s),ξ是一个无因次比值(等于(ω/υ)1/2Z ,Z 是离电极表面的轴向距离)。F 、G 和H 三个函数值与ξ的关系可见图1。
图1 F 、G 和H 函数值与ξ的关系
从图1可知,当ξ=3.6时,F 、G 函数值已接近于零,而H 函数则接近定值(-0.866),在此情况下,V 径=V 初=0。人们通常将ξ=0.36时所对应的Z 值,定义为流体动力学层的边界厚度,用δPr 表示,即
Pr 3.6
ν
δω
= (4) 当Z>δPr 时,液体基本上只作轴向流动,在Z>>δPr 时,
V 0.866νω=-轴 (5)
当Z<δPr 时,液体在径向和切向的流速都不可忽略。由于圆盘旋转时,其边缘区液体
流动情况复杂,所以圆盘必须处在整个圆盘的中心,圆盘的半径也要比电极的大好几倍,以忽略边缘效应对研究电极下液体流动的影响。
如果对旋转圆盘电极进行阶跃恒电位极化,电极表面进行的电极反应可表示为:
O + ne = R (6) 在大量支持电解质存在的条件下,反应物质的输送既包含了因浓差而引起的扩散作用,也包含了由于电极旋转而产生的对流作用。在稳态时,与电极表面距离相同的各处浓度不因时间而变化,即dC/dt=0,也就是说,对于只考虑一维扩散和对流情况时,有
22d C dC D V 0dZ dZ
-=轴 (7) 式中D 为反应粒子的扩散系数。
当只考虑电极表面附近的情况时,可以假定ξ<<1,则
3/21/2V 0.51Z ων-=-轴 (8)
根据边界条件:Z →∞时,C=C b (C b 为反应粒子的体浓度);Z =0时,C=C σ
(反应粒子在电极表面处的浓度),可求出微分方程的解:
3/21/2b
1/3
3D C 0.8934C ()0.51
σ
ων-= (9)
这就是旋转圆盘电极在恒电位极化时,电极表面处的浓度、体浓度及电极转速等参数的关系式。
根据C σ=(dC/dZ)z=0及电极的扩散电流密度(i d )与电极表面的浓度关系式i d =nFD(dC/dZ)z=0,可得到,
b b d 1/31/61/2
d
nFD(C C )nFD(C C )
i 1.61D σσνωδ---== (10) 此处,令δd =1.61D 1/3ν1/6ω-1/2,并称δd 为扩散层特征厚度,将δd 与δpr 相比较,得
1/3d Pr D
0.45()δδν
= (11)
尤其值得注意的是,旋转圆盘电极的δd 数值大小只与D 、ν和ω有关,与研究体系的C b 无关。在扩散层内,特别是在靠近电极表面处,反应粒子的浓度与Z 值成线性关系,同稳态扩散相似。在旋转圆盘电极表面进行反应时,其表面附近有一层均匀、稳定的扩散层,电极上的电流分布也比较均匀和稳定。这是旋转圆盘电极的重要特性。基于这种特性,当旋转圆盘电极作为研究电极时,可以很方便的利用线性电位扫描法测得一定转速下的η-i 形式
的极化曲线。这种极化曲线的形状与多方面的因素有关。通常情况下,电化学反应的速率常数K 随极化电位的增加而有规律地变化,电极过程的速率也由单纯电荷传递,或电荷传递与扩散混合控制转化成单纯的扩散控制,反应电流也相应地达到一个极限值(i l d )。此时电极
上的电荷传递速度极快,可以认为C σ
=0,则(10)式变成极限扩散电流的表达式:
b
l d
1/31/61/2
nFDC i 1.61D νω
-= (12) 当我们从不同转速的η-i 极化曲线上读取相应的i d l 值,进而从i d l -ω1/2直线关系的斜率中,根据已知的反应粒子的浓度和反应时的电子得失数,可以求得反应粒子的扩散系数D 。 在这种实验条件下,对于某一新的电极反应,若知道反应粒子的扩散系数,可从i d l -ω1/2或i d l -C b 的直线斜率中求得电极反应的电子得失数n 。
旋转圆盘电极法也可以用来研究扩散和电荷传递混合控制过程的动力学。电荷传递过程仍以式(6)表示。按过电位的大小可分为两种情况处理。
(1) 过电位较大,可略去逆过程时,电荷传递速度为:
D i nFK C σ
→
=- (13)
式中 为正向反应的速度常数。稳态时,i=i D =i d ,通过式(10)和(13),可以得出C σ
的表示式,从而导出:
b
O
2/31/61/2
nFK C i 1+1.61K D νω→
→
----=
(14)
式中C o b 为氧化态物质的体浓度。显然,在ω→∞时,(14)式就变成了(13)式,即,提高转速可使扩散在混合控制中所起的作用相应减少。
(2) 过电位较小,逆向过程不能忽略时:
D R O i i i nF(K C K C )σ
σ←→←
→
=-=- (15)
在稳态时,O 和R 的扩散电流密度绝对值相同,而方向相反,根据上述思维推导,可得到:
1/6
2/3-2/3-1/2O
R b b b b O R O R 1.61(K D K D )11i nF(K C K C )nF(K C K C )
νω→
←
-→←→
←
+-=+-- (16) 在给定的极化电位较小时,从不同转速的η-i 极化曲线上读取相应的i 值,并作-1/i-ω
-1/2图,从线形的斜率、截距可求出给定极化电位时的电化学反应速率常数 和 。
在较小的电位范围内,给定不同的极化电位值,便可测定相应的 和 。再根据反应速率常数和极化电位的关系式:
0b
O i nF
ln K ln
nFC RT αη→
=- (17) 0b
R i nF
ln K ln
nFC RT
βη←
=+ (18) 便可求出交换电流密度i 0、阴极反应传递系数α和阳极反应传递系数β。
通常情况下,水溶液中的ν=10-2cm 2 s -1,D 在10-5
~10-6cm 2 s -1范围内。
K
ρ
K σK ρ
K σK
ρ
三、 仪器和试剂
旋转圆盘铂电极及其配件(直径0.5厘米);CHI660电化学工作站;辅助电极(铂丝);参比电极(铂片);K 4Fe(CN)6(AR);K 3Fe(CN)6(AR);KCl(AR);重蒸水。
四、 实验步骤
1.打开所有仪器的电源开关,预热。
2.配制0.01mol/L K 4Fe(CN)6、0.01mol/L K 3Fe(CN)6和1mol/L KCl 溶液。
3.清洗电极,接好测量线路,分别装好辅助电极和参比电极:红色夹子接辅助电极,黄色夹子接研究电极,白色夹子接参比电极。
通过计算机使CHI 仪器进入Windows 工作界面,在工具栏里选中“T ”(实验技术),再选中“Linear Sweep V oltammetry ”(线性电位扫描法),然后在工具栏里选中“参数设定”(在“T ”的右边),在弹出的对话框中设定:Init E 0.5V; Final E -0.5V; Scan Rate 0.002V/s; Sample Interval 0.001V; Quiet Time 100s; Sensitivity 1E-3A 。参数设定完毕,点击“OK ”键后将转速控制器的转速调为2500转/分钟,等转速稳定后再点击工具栏中的运行键。此时,仪器开始运行,屏幕上即时显示极化时间值(即在初始电势下的极化时间),100秒后显示当时的工作状况和电流随电势的变化曲线。扫描结束后点击工具栏中的“Graphics ”,填上所用的参比电极及必要的注解,然后在“Graph Option ”中电击“Present Data Plot ”显示完整的实验结果。保存该实验结果。
4.分别将转速调为2000、1500、1000和500转/分,按照上述步骤分别测量,即可获得一组极限扩散电流曲线。 5.打开“参数设定”窗口,设置参数如下:Init E 0.015V; Final E -0.015V; Scan Rate 0.002V/s; Sample Interval 0.001V; Quiet Time 100s; Sensitivity 1E-4A 。再按照上述方法分别测定转速分别为2500、2000、1500、1000和500转/分时电荷传递步骤控制时的电流曲线。
五、 数据处理
1.求算Fe(CN)64-和Fe(CN)63-的扩散系数D R 和D O
-0.4
-0.2
0.0
0.2
0.4
0.6
-0.0012
-0.0008-0.00040.0000
0.0004
0.00080.0012
C u r r e n t /A
Potential/V vs Pt
500 1000 1500 2000 2500
图2 极限扩散电流曲线图
由所测不同转速下的极限扩散电流曲线上读取各转速对应的阴阳极极限电流密度数值如下表所示:
转速(转/分) 500 1000 1500 2000 2500 ω1/2
((弧度/秒)1/2
) 7.23601 10.23327 12.53314 14.47203 16.18022 阴极电流密度(mA/cm 2) -0.5674 -0.7948 -0.9712 -1.14
-1.3 阳极电流密度(mA/cm 2)
0.7187
1.01
1.22
1.41
1.56
根据实验原理部分的公式(12),作阴极极限扩散电流密度i l d ~ω1/2图如下:
6
8
10
12
14
16
-1.4
-1.2
-1.0
-0.8
-0.6
i l d / m A .
c m
-2ω1/2
其斜率数值大小为-0.09423,将n=1, F=96485 C/mol, ν=10-2 cm 2/s, C b =10-5 mol/mL 代入公式(12), 可得D O =6.24E-7 cm 2/s ,即0.01mol/L 的Fe(CN)63-离子在水溶液中的扩散系数为6.24E-7 cm 2/s 。
同理,作阳极极限扩散电流密度i l d ~ω1/2的图如下:
6
8
10
12
14
16
0.60.8
1.0
1.2
1.4
1.6
ω
1/2
i l d / m A .
c m
-2
其斜率数值大小为0.08141,用与上面同样方法求得D R =5.01E-7 cm 2/s ,即0.01mol/L 的
Fe(CN)64-离子在水溶液中的扩散系数为5.01E-7 cm 2/s 。
2.求算交换电流密度i 0,阴极反应传递系数α和阳极反应传递系数β。
由前面实验原理部分可知要想求得i 0、α和β的值,需使电极过程在较小过电位下进行,选择几组不同电位下的i 植,根据公式(16)以-1/i 对ω-1/2直线拟合,求得不同极化电位下的 和 值。然后根据公式(17)和(18)以ln 和ln 进行直线拟合,由直线截距求得i 0,并取平均值,从斜率求得α和β的值。
-0.08
-0.04
0.00
0.04
0.08
-0.0004
-0.0002
0.0000
0.0002
0.0004
C u r r e n t /A
Potential/V vs Pt
500 1000 1500 2000 2500
由所测电荷传递步骤控制时的电流曲线读得不同转速,不同电位下的电流密度如下表所示:
电流密度 (A/cm 2) 转速(转/分)
500 1000 1500 2000 2500 电 位 (V)
-0.009 -9.168E-5 -1.20116E-4 -1.4048E-4 -1.6019E-4 -1.74616E-4 -0.006 -6.172E-5 -8.1096E-5 -9.468E-5 -1.0615E-4 -1.13016E-4 -0.003 -3.117E-5 -4.0966E-5 -4.783E-5 -5.421E-5 -5.5266E-5 0.003 3.139E-5 4.1284E-5 4.805E-5 5.24E-5 5.2044E-5 0.006 6.297E-5 8.2654E-5 9.612E-5 1.0571E-4 1.07784E-4 0.009
9.46E-5
1.23984E-4
1.4432E-4
1.5961E-4
1.64984E-4
分别作(a) -0.009V 、(b) -0.006V 、(c) -0.003V 、(d) 0.003V 、(e) 0.006V 和(f) 0.009V 时的-1/i ~ω-1/2图如下,
K σK σK
ρK ρ
0.06
0.07
0.08
0.09
0.100.11
0.12
0.13
0.14
-35000
-30000-25000-20000-15000-10000-500005000
1000015000200002500030000
35000- i -1/ A -1.
c m 2
ω
-1/2
a b c d e f
读得各电位下-1/i ~ω-1/2图的截距和斜率数值,利用公式(16)求得各电位下的电化学反应速率常数数值如下:
电位 -0.009V -0.006V -0.003V 0.003V 0.006V 0.009V (cm s -1) 0.000948 0.00395 0.0111 0.00994 0.00370 0.00233 (cm s -1) 0.00289
0.00530
0.0127
0.00938
0.00262
0.000645
然后,分别以ln 和ln 分别对η进行线性拟合,求得斜率和截距后,取T=290K ,利用公式(17)和(18)求得阴极反应传递系数α=0.74,阳极反应传递系数β=0.26,对求得的交换电流密度取平均值后得i 0=5.72mA/cm 2。
六、思考题
1. 研究电极在静止和旋转时的平衡电位相同吗?为什么?
研究电极在静止和旋转时的平衡电位是不同的。这是因为***G nE F=-RTlnK ?=-,式中各代“*”的参数依次为所研究电极反应的平衡吉布斯自由能、平衡电位和平衡反应常数,平衡电位的大小与反应平衡常数的大小有关。而反应的平衡常数等于产物的活度积除以反应物的活度积,研究电极在静止和旋转时表面物种的活度系数是不同的,这就导致研究电极在静止和旋转时所研究电极反应的平衡常数不同,也就造成了研究电极在静止和旋转时的平衡电位不同。相对来说,研究电极在旋转时,表面物种的活度系数更接近于1,平衡电位也就更接近理论值。
2. 实验中测得的扩散系数准确度与哪些实验条件相关?
实验中测得的扩散系数的准确度与旋转圆盘电极的转速准确度、函数记录仪读取极限电流的准确度、实验温度、所配置溶液浓度以及电流值读数的准确度有关。 3. 为什么氧化态扩散系数大于还原态?
由于Fe(CN)63-所带电荷较Fe(CN)64-的少,相应的所受的静电吸引较差所致。
K σK
ρ
K ρK σ