08届高三化学无机框图题专项训练
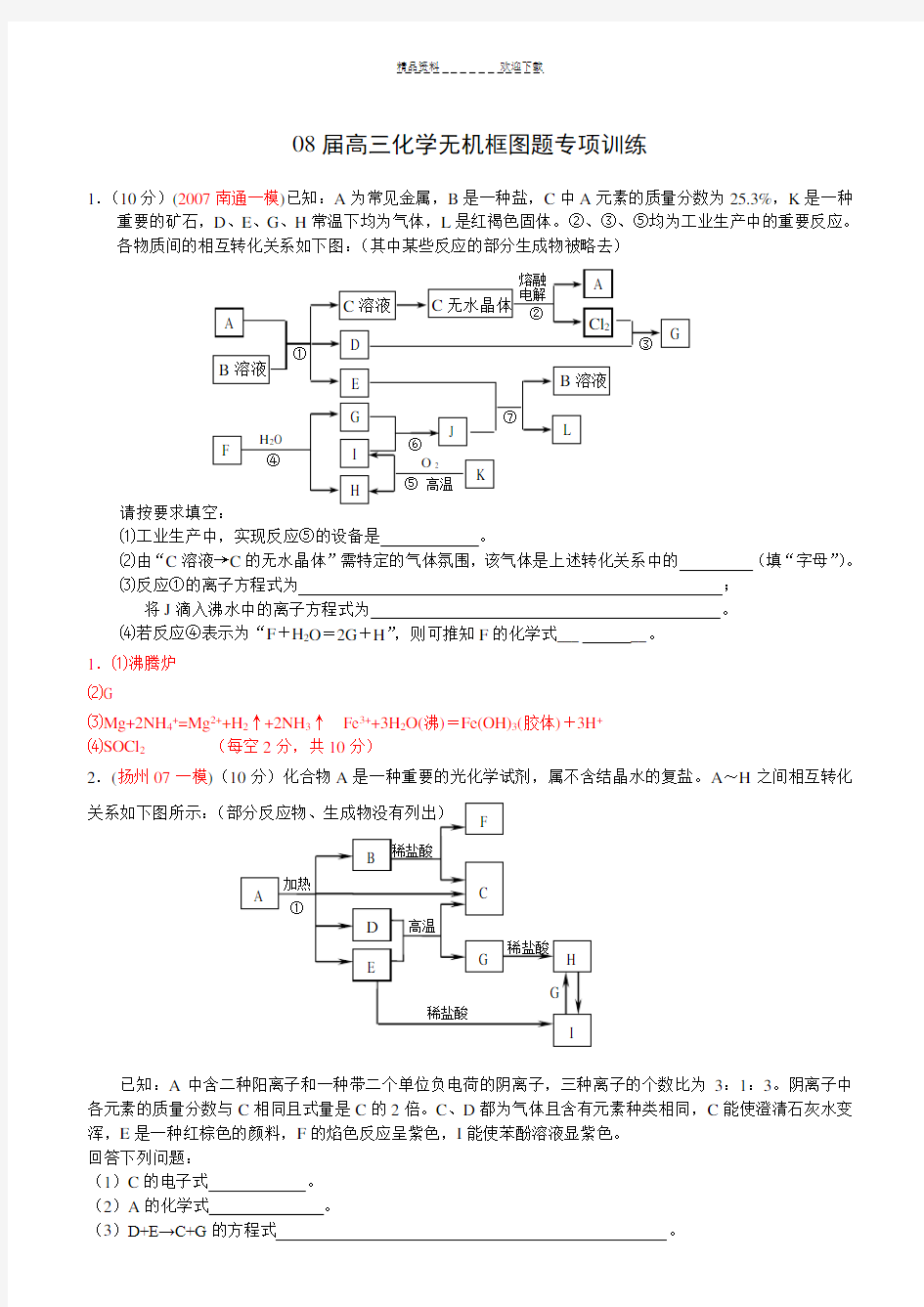
1.(10分)(2007南通一模)已知:A为常见金属,B是一种盐,C中A元素的质量分数为25.3%,K是一种重要的矿石,D、E、G、H常温下均为气体,L是红褐色固体。②、③、⑤均为工业生产中的重要反应。
各物质间的相互转化关系如下图:(其中某些反应的部分生成物被略去)
⑴工业生产中,实现反应⑤的设备是。
⑵由“C溶液→C的无水晶体”需特定的气体氛围,该气体是上述转化关系中的(填“字母”)。
⑶反应①的离子方程式为
;
将J滴入沸水中的离子方程式为。
⑷若反应④表示为“F+H2O=2G+H”,则可推知F的化学式___ __。
1.⑴沸腾炉
⑵G
⑶Mg+2NH4+=Mg2++H2↑+2NH3↑Fe3++3H2O(沸)=Fe(OH)3(胶体)+3H+
⑷SOCl2(每空2分,共10分)
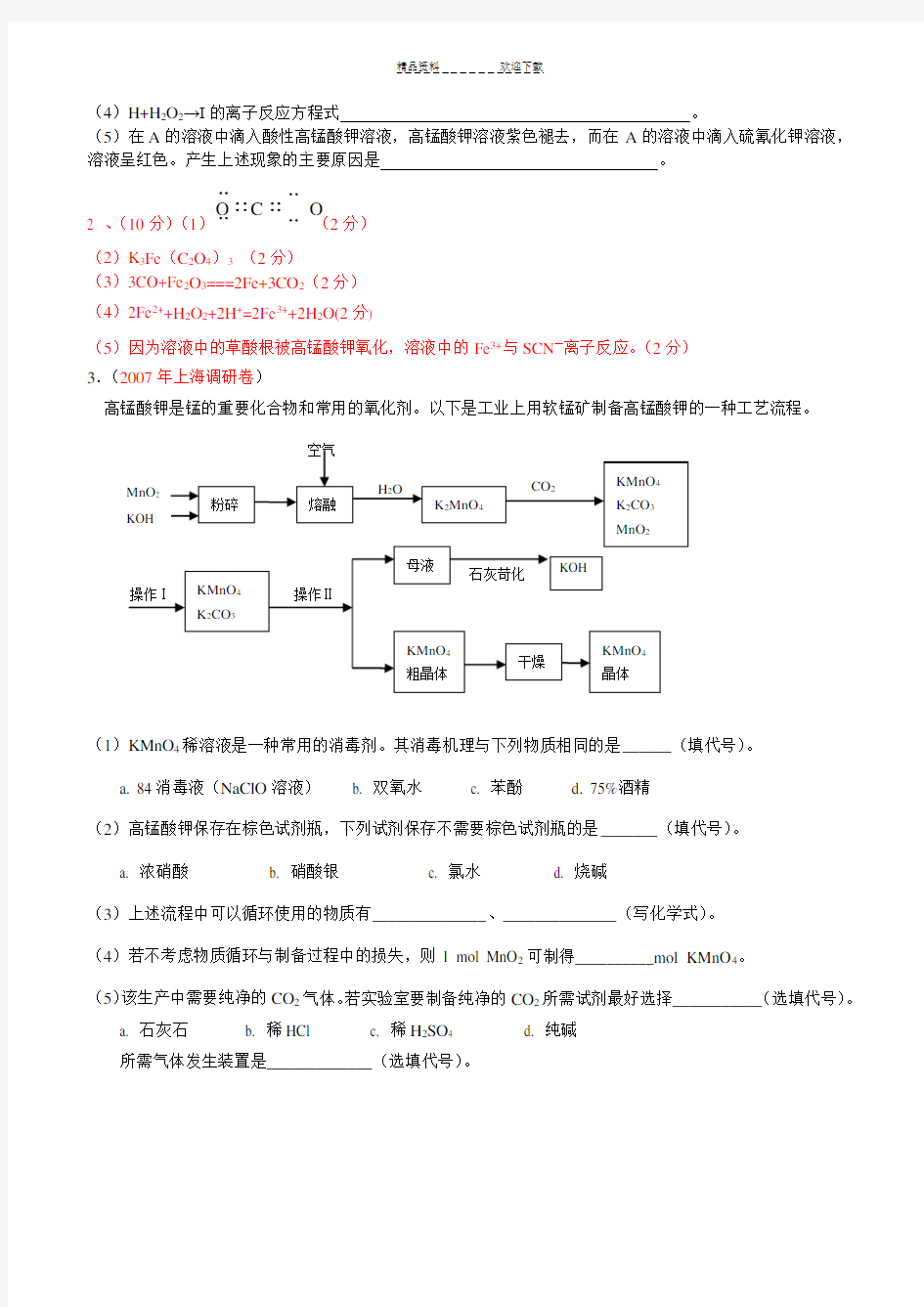
2.(扬州07一模)(10分)化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A~H之间相互转化关系如下图所示:
已知:A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且式量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使苯酚溶液显紫色。
回答下列问题:
(1)C的电子式。
(2)A的化学式。
(3)D+E→C+G的方程式。
(4)H+H2O2→I的离子反应方程式。
(5)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是。
2 、(10分)(1)
C O
O
(2分)
(2)K3Fe(C2O4)3(2分)
(3)3CO+Fe2O3===2Fe+3CO2(2分)
(4)2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(5)因为溶液中的草酸根被高锰酸钾氧化,溶液中的Fe3+与SCN—离子反应。(2分)
3.(2007年上海调研卷)
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液)
b. 双氧水
c. 苯酚
d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸
b. 硝酸银
c. 氯水
d. 烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a. 石灰石
b. 稀HCl
c. 稀H2SO4
d. 纯碱
所需气体发生装置是_____________(选填代号)。
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO 4和K 2CO 3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO 4粗晶体的。 3.(12分)
(1)ab (2分);(2)d (1分);(3)MnO 2;KOH (2分);(4)3
2
(1分); (5)cd (2分);A (1分);
(6)过滤(1分);溶解度(1分);浓缩结晶(只填“结晶”不给分)(1分)
4.(8分)(盐城市07二模)江苏省东部沿海有954 km 的海岸线,合理开发和利用海洋资源对江苏经济发展意义重大。下图是部分元素的单质及其化合物的转化关系图(有关反应条件及部分反应物
或生成物已略去)。已知:A 是海水中的重要资源;C 、D 、F 是单质,其中C 、D 在常温常压下是气体;反应②是化工生产中的重要反应,生成物E 是84消毒液的有效成份;J 、K 均为不溶于水的物质,其中J 为红褐色。
请按要求填空:
(1)反应①的离子方程式(请注明反应条件) 。 (2)B 的电子式____;E 的化学式____。
(3)③的化学方程式 。
(4)D 被誉为很有发展前途的未来燃料。你所了解的实现该目标尚存在的实际问题有 (列举一条)。
5.(8分) (常州市2006—2007学年高三第一学期期末调研). 已知A 是由两种中学常见元素组成的化合物,H 、D 为白色沉淀,E 的焰色反应为黄色。A~H 各物质之间的关系如图(反应中部分产物已略去,除气体间的反应外,其余反应均在溶液中进行...........
)。
⑴X 的化学式为________________; ⑵写出反应①、②的离子方程式:
① 。 ② 。 ⑶用电子式表示G 的形成过程:
_________________________________________ 。 5.(8分)⑴NaOH (每空2分,方程式不配平不给分,条件不写扣
1分)
⑵①2Al 3++6Cl -
+6H 2O 3H 2↑+3Cl 2↑+2Al(OH)3↓
②Al 3++3AlO 2-
+6H 2O =4Al(OH)3↓ ⑶H +Cl
H Cl
6.(10分)(2006~2007学年第一学期期末调研考试高三化学试题)由短周期元素组成的10种物质A ~J 间有下图所示的转化关系。已知A 、B 为同周期相邻元素的单质,其余均为化合物;通常状况下A 为固体,B 、D 为气体,F 为液体;A 和G 的浓溶液加热时反应生成D 和F ;J 在光照时有I 生成。试回答:
⑴工业生产中实现“D+O 2 → E ”转化的设备是 。
⑵反应①的离子方程式为 。 ⑶足量铁与G 的热的浓溶液反应所得气体是 。
⑷在一定条件下,9g 液态F 吸收49gE 气体生成液态G 时放出热量65.15kJ ,则表示该反应的热化学方程式为 。
⑸C 是一种重要的化工产品,为易挥发樱桃红色液体。若反应②中G 和A 的物质的量之比为1∶2,则C 的电子式为 。
6.⑴接触室 ⑵HClO + SO 2 + H 2O = 3H + + SO 42—
+ Cl
—
⑶SO 2和H 2 ⑷SO 3(g)+ H 2O(l)=H 2SO 4(l);△H =-130.3kJ/mol ⑸ (每空2分,共10分)
7.(10分)(07南通市九校联考)已知下图所示各物质的转化关系中,某些反应部分产物已被省去。其中反应②用于常见金属
H 无色。
试回答下列问题:
⑴溶液A为(写名称),B的电子式。
⑵反应①的离子方程式;
反应③的离子方程式。
⑶有同学认为M也可由溶液J、溶液K各自加热灼烧获得,试判断这种说法是否正确?
(填“是”或“否”),理由是。
7.(10分)盐酸(1分)
(2分)
2Cl―+2H2O Cl2↑+H2↑+2OH-(2分)
2Al+2H2O+2OH-=2AlO2-+3H2↑(2分)
否(1分)
AlCl3、NaAlO2溶液加热蒸干、灼烧,前者获得Al2O3、后者得到的仍是NaAlO2(2分)
8.(10分)物质A~K的转化关系如下图所示,已知A是由两种元素组成的化合物;B是非金属单质;J是金属单质。H的相对分子质量比D大16(部分反应物、生成物未列出)。
依据上述信息,回答下列问题:
Ⅰ.若A为固体,F是盐,反应①是工业上制取K的重要反应,反应②为化合反应。
⑴G的电子式是__________。
⑵工业上反应①在(填工业设备名称)中进行。
⑶反应①的化学方程式为。
Ⅱ.若A为气体,E为活泼金属单质,且K与“Ⅰ”中的K不同。
⑷物质A的分子式是____________。
⑸反应②的离子方程式为____________________________________________。
8.(1) (2) 沸腾炉
(3)4FeS2+11O 22Fe2O3+8SO2
(4) NH3(5) 2Al+2OH-+2H2O=2AlO2-+3H2↑(本题共10分,每空2分)
无机推断 1、磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成: 请回答: (1)A的组成元素为_________(用元素符号表示),化学式为______。 (2)溶液C可溶解铜片,例举该反应的一个实际应用____________。 (3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体的电子式为____。写出该反应的离子方程式___________。 (4)写出F→G反应的化学方程式_______________。 2、电镀工业中往往产生大量的有毒废水,必须经过严格处理后才可以排放.某种含A离子(阴离子)废水在排放前的处理过程如下: 已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g?L﹣1的气体E 1.12L. (1)E的结构式 (2)沉淀D的化学式 (3)写出沉淀D在氧气中灼烧发生的化学方程式 (4)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理 (5)反应①为制得某种元素的低价X离子,试从氧化还原反应的角度分析,是否可以用Na2SO3溶液来代替B溶液,说明理由. 3、为探究不溶性盐X(仅含四种元素)的组成和性质,设计并完成如下实验: 已知,各步反应所需试剂均过量,请回答: (1)X的化学式为。 (2)写出X与稀硫酸反应的离子方程式。
(3)红色固体B的硫酸盐溶液与纯碱溶液反应能得到X,该反应的化学方程式为 。 4、为探究固体A的组成和性质,设计实验并完成如下转化。 已知:X由两种化合物组成,若将X通入品红溶液,溶液褪色。若将X通入足量双氧水中,X可全部被吸收且只得到一种强酸,再稀释到1000mL,测得溶液的PH=1。在溶液2中滴加KSCN溶液,溶液呈血红色。请回答:(1)固体A的化学式。 (2)写出反应①的化学方程式。 (3)写出反应④中生成A的离子方程式。 5、某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验: 另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题: (1)画出白色沉淀1中金属元素的原子结构示意图_______, (2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为________________________。(3)白色沉淀2在空气中变成红褐色沉淀的原因是__________________________(用化学反应方程式表示)。(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_________________________________________,并设计实验方案验证该反应的产物_______。 6、某含氧物质X仅含三种元素,在198℃以下比较稳定,温度高时易分解.,某研究小组设计并完成如下实验:
“无机推断题”题眼总结 解决无机框图推断题的关键在于寻求“特殊”的题眼,即特殊结构、特殊现象、特殊性质、特殊用途和特殊转化关系等,下面对此进行总结。 一、特征反应 1.与碱(NaOH )反应产生气体 (1)?? ? ? ???↑+=++↑+=++↑??→?- 232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质 (2)铵盐:O H NH NH 23 4 +↑?→?+ 碱 2.与酸反应产生气体 (1)? ? ?? ?? ???????????????????↑↑??→?↑???→??????↑↑??→?↑↑???→??? ???↑↑??→?↑?? ?→?↑ ??→?22222222223 4 23 4 23 42NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓 (2)() () () ??? ????↑?→?↑?→?↑?→?+++ - -- ---2323222323SO HSO SO S H HS S CO HCO CO H H H 化合物 3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H + =S ↓+SO 2↑+H 2O 4.与水反应产生气体 (1)单质???? ?↑ +=+↑+=+22222422222O HF O H F H NaOH O H Na (2)化合物()()()? ???? ??↑ +=+↑ +↓=+↑ +↓=+↑+=+22222232323222322222326233422H C OH Ca O H CaC S H OH Al O H S Al NH OH Mg O H N Mg O NaOH O H O Na
专题一 无机框图题专题复习 一、高考展望: 无机框图推断是对常见元素的单质及其重要化合物相互关系的考查,它融元素化合物、基本理论、计算于一体。侧重考查学生思维的能力和综合应用的能力,在历届高考中具有较好的区分度和选拔能力。一般氯、硫、氧、氮、碳、钠、铝、铁元素及化合物之间的转化是这类题的热点。解决这类考题,首先要读懂题意和图意,找准突破口(题眼),从自己的记忆中搜寻出典型的反应,事物或模型,然后大胆推测,只要符合框图关系的答案都是正确的。由于框图推断较好地考查了学生的直接思维品质,在高考中继续出现是理所当然。 二题眼归类: (一)、特征反应: 1.与碱反应产生气体: Al 、Si H 2 ⑴单质: 2Al+2NaOH+2H 2O == 2NaAlO 2+3H 2↑ Si+2NaOH+H 2O == Na 2SiO 3+2H 2↑ ⑵铵盐:NH 4+ NH 3 ↑ 2 H 2 ⑴单质 2↑、CO 2↑ NO 2↑、CO 2↑ 2↑ 2↑、NO 2↑ CO 32-(HCO 3- ) CO 2↑ ⑵化合物: S 2-(HS - ) H 2S ↑ SO 32-(HSO 3- SO 2 ↑ 3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32- +2H +== S ↓+SO 2↑+H 2O 4.与水反应产生气体: 2Na +2H 2O == 2NaOH +H 2↑ ⑴单质: 2F 2+2H 2O == 4HF +O 2↑ 2Na 2O 2+2H 2O == 4NaOH +O 2↑ Mg 3N 2+3H 2O == 3M g (O H )2↓+2NH 3↑ Al 2S 3+6H 2O == 2A l (O H )3↓+3H 2S ↑ CaC 2+2H 2O == C a (O H )2+C 2H 2↑ 5.既能酸反应,又能与碱反应: OH OH - 、△ 金属 2↑ 2↑、NO ↑ 非金属 C S H + H + H + ⑵化合物:
化学试题无机框图推断题 1. A 、B 、C 、D 是四种常见单质,其对应元素的原子序数依次增大,其中B 、D 属于常见金属,其余均为常见化合物,J 是一种黑色固体,I 的浓溶液具有还原性,从A —J 的所有物质之间有如下的转化关系: (1)B 元素和C 元素的简单离子半径大小关系是(用离子符号表示):________________; (2)写出下列反应的化学方程式: I+F→:___________________; B→A+G: ______________________; (3)由E 的饱和溶液滴入沸水中形成透明液体,再将此液体装入U 型管,并在U 型管的两 端插入电极,接通直流电,在阳极端可观察到的现象是___________________________________; (4)将适量J 加入酸化的H 2O 2的溶液中,J 溶解生成它的+2价离子,该反应的离子方程式 是_______; (5)向含0.1 mol G 的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g ,则加入盐酸 体积为 (mL )。 2.已知化合物A 与B 、丙与丁的元素组成相同,且四种物质中都含有同一种元素。A 与B 在常温下均呈液态。D 与F 都为固体单质,且D 、 F 与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生。(相关转化部分反应条件和生成物未标出)。 (I )A 的结构式 , E 与F 的反应是 (填反应名称),在工业生产中 此反应有什么用途? 、 。 (II )若反应①除生成甲外,还生成丙,写出过量D 与甲稀溶液反应的离子方程式: (III )若A 与丙可以化合生成甲;甲与D 加热条件下可以生成三种化合物乙、丙、B ,乙、 丙、B 常温下又可以反应生成甲和另一化合物X 。 (3)写出下列方程式 ②: ③: (4)将含有1.2molX 的水溶液调至中性,通入足量C 充分反应,生成红褐色沉淀且溶液 呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为 。 3.合金A 由4种单质组成,经过一系列反应分别进入了沉淀或气体中. 试回答: (1)合金A 由哪4种元素的单质组成?_________、________、________、_________。 (2)写出固体B 、溶液C 、沉淀D 和气体E 、F 有关组成的化学式: B_________、C_________、D_________、E_________、F_________。 (3)写出合金A 中的有关组成与过量烧碱溶液反应生成无色气体E 的化学反应方程式: A 的水溶液 B C MnO 2 丁 甲 D G F E 丙 乙 B ② ③ ①
第二轮复习无机推断题专题讲座 [命题趋向] 推理能力是高考测试的五项能力之一。《考试大纲》中对推理能力是这样界定的:“通常根据已知的知识和题目给定的事实和条件,抽象、归纳相关信息,对自然科学问题进行逻辑推理和论证,得出正确的结论或做出正确的判断,并能把推理过程正确地表达出来”。 无机物质推断题既可以综合考查元素化合物方面的基础知识、还可联系到化学基础理论、化学基本计算、化学实验现象等等,另外无机物质推断题可以较好地测试推断能力,所以近几年的高考试题中,无机物质推断题成了每年高考中考查推理能力的保留题型。分析今高考中物质推断题,主要可分成以下三类:选择型推断题、文字叙述型推断题、框图型推断题。 从推理能力考查的特点分析,高考无机推断题中主要表现了以下几个特点: ①单信息、多信息并重。同一道推断题中,有的结论只要分析单个信息就可以得出,有的结论需要同时综合多条信息才能得出。 ②正向、逆向、统摄三种形式的推理并重。有些结论的得出过程中,需要正向、逆向、统摄等三种推理形式。 ③定性、定量分析并重。推断过程中既需要定性分析、又需要定量分析。 ④计算和逻辑推理(讨论)并重。 [知识体系和复习重点] 《考试大纲》中对元素化合物知识的综合要求较高,具体要求如下: ①了解在生活和生产中常见无机化合物的性质和用途。 ②能够运用无机化合物各部分知识进行综合推断,解决有关的综合问题。 ③能够综合运用无机化合物、有机化合物知识进行综合分析,解决有关的综合问题。[知识指津] 无机物的相互反应(见下图所示) (1)无机物间能否反应,主要决定于反应物的性质及反应时的客观条件。左边所示的无机物间的相互反应指其主要性质而言,至于各个具体物质间能否反应,还有一些具
教学资料范本 2020高考化学一轮综合复习第四章非金属及其化合物专题讲座新型无机 框图推断题的解题策略练习-精装版 编辑:__________________ 时间:__________________
【精选】20xx最新高考化学一轮综合复习第四章非金属及其化合物专题讲座新型无机框图推断题的解题策略练习 无论推断题属于哪种形式,均遵循这样的推断思路:迅速浏览、整体扫描、产生印象、寻找“突破口”,突破点由点到面、随时检验,注意联系、大胆假设、全面分析(正推或逆推),验证确认.解题的关键是仔细审题,依物质的特性或特征转化来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断.我们可以将推断题的解题方法及推理过程表示如下: 推断题结论―→验证 1.熟记典型物质的性质和用途 (1)金属及其化合物:Na、Na2O2、Na2CO3、NaHCO3、Al、Al2O3、Al(OH)3、FeCl3等. (2)非金属及其化合物:CO2、SiO2、Cl2、HClO、SO2、H2SO4、NO2、NH3、HNO3等. 2.重要物质的物理性质 (1)有色气体:NO2(红棕色)、Cl2(黄绿色);无色、刺激性气味的气体:SO2、NH3、HCl. (2)溶液中的有色物质:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)、MnO[紫(红)色].Br2在水中显黄(橙)色,在有机溶剂中显橙(红)色;I2在水中显黄(褐)色,在有机溶剂中显紫(红)色.
(3)有色固体:(淡)黄(棕)色固体:Na2O2、S、FeS2、FeCl3;黑色固体:MnO2、C、CuO、FeO、Fe3O4;紫(黑)色固体:KMnO4、I2;(紫)红色固体:Cu. (4)有色沉淀:①白色沉淀:H2SiO3、AgCl、BaSO4(不溶于酸)、BaSO3、Mg(OH)2、Al(OH)3、BaCO3、CaCO3、CaSO4、MgCO3等;②红褐色沉淀:Fe(OH)3;③蓝色沉淀:Cu(OH)2;④黑(褐)色沉淀:CuS、FeS. 3.既能与强酸溶液反应又能与强碱溶液反应的物质 (1)金属单质:Al. (2)两性物质:两性氧化物如Al2O3,两性氢氧化物如Al(OH)3,以及氨基酸等. (3)弱酸弱碱盐:如(NH4)2CO3、CH3COONH4等. (4)弱酸的酸式盐:如NaHCO3、Ca(HCO3)2、NaHSO3等. 4.熟悉常见的转化关系 (1)直线型转化关系 ABC ①X为O2 Na―→Na2O―→Na2O2 N2―→NO―→NO2或NH3―→NO―→NO2 S―→SO2―→SO3或H2S―→SO2―→SO3 C―→CO―→CO2或CH4―→CO―→CO2 醇―→醛―→羧酸 ②X为CO2 NaOHNa2CO3NaHCO3 ③X为强酸,如HCl NaAlO2Al(OH)3AlCl3
无机框架推断题 高考无机推断题中主要表现了以下几个特点: ①单信息、多信息并重。同一道推断题中,有的结论只要分析单个信息就可以得出,有的结论需要同时综合多条信息才能得出。 ②正向、逆向、统摄三种形式的推理并重。有些结论的得出过程中,需要正向、逆向、统摄等三种推理形式。 ③定性、定量分析并重。推断过程中既需要定性分析、又需要定量分析。 ④计算和逻辑推理(讨论)并重。 [知识体系和复习重点] ①了解在生活和生产中常见无机化合物的性质和用途。 ②能够运用无机化合物各部分知识进行综合推断,解决有关的综合问题。 ③能够综合运用无机化合物、有机化合物知识进行综合分析,解决有关的综合问题。 无机物的相互反应(见下图所示) (1)无机物间能否反应,主要决定于反应物的性质及反应时的客观条件。左边所示的无机物间的相互反应指其主要性质而言,至于各个具体物质间能否反应,还有一些具体条件要加以考虑。 (2)对于氧化物要注意以下问题: ①氧化物不一定能直接与水作用生成对应的酸或碱; ②金属氧化物有可能是碱性氧化物也有可能是酸性氧化物或两性氧化物,一般有“高价酸,低价碱”的说法,即高价的是酸性氧化物,而低价的是碱性氧化物,如Mn 2O 7是酸性氧化物,而MnO 则是碱性氧化物; ③酸性氧化物也叫酸酐,但酸酐不一定是氧化物,如有机酸酸酐就不是氧化物。 (3)还有一些特殊的反应比较重要,应结合具体物质的性质,加以理解记忆。如 ①HClO HCl O H Cl 22+=+ ②O H NaClO NaCl 2NaOH Cl 22++=+ ③C 2MgO CO 2Mg 2+=+ ④2222H 2NaAlO O 2H 2NaOH 2Al +=++ ⑤NO 2HNO O H 3NO 322+=+ ⑥多元弱酸的正盐与自己的酸反应,生成相应酸式盐: 322322NaHCO O H CO CO Na =++ ⑦弱酸的酸式盐与强碱反应,生成正盐:O H CO Na NaOH NaHCO 2323+=+
“无机框图题”专题复习 一、特征反应 1.与碱反应产生气体 (1)??? ????↑+=++↑+=++↑??→?- 232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质 (2)铵盐:O H NH NH 234+↑?→?+碱 2.与酸反应产生气体 (1)?????? ???????????????????↑↑??→?↑???→??????↑↑??→?↑↑???→??????↑↑?? →?↑???→?↑??→?2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓 (2)()()() ???????↑?→?↑?→?↑?→?+++------2323222323SO HSO SO S H HS S CO HCO CO H H H 化合物 3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H + =S ↓+SO 2↑+H 2O 4.与水反应产生气体 (1)单质?????↑ +=+↑+=+22222422222O HF O H F H NaOH O H Na (2)化合物()()()??? ????↑+=+↑ +↓=+↑+↓=+↑+=+22222232323222322222326233422H C OH Ca O H CaC S H OH Al O H S Al NH OH Mg O H N Mg O NaOH O H O Na 5.强烈双水解()()()()()?? ???↓??→?↓+↑?? →?↓+↑??→?-----+32322323233222OH Al AlO OH Al S H HS S OH Al CO HCO CO Al O H O H O H 与 6.既能酸反应,又能与碱反应 (1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
1.下图为某些物质之间的变化关系(未注明用量的物质间均按恰好充分反应处理) 已知A的焰色反应呈黄色,常温下,甲为能使湿润的红色石蕊试纸变蓝的气体,乙为可燃性气体,甲、乙分子中质子数相等。 (1) A的化学式是;乙的化学式是。 (2) X是一种纯净物,X的化学式是;C中含有、。(填化学式) (3)能否确定B为何种物质?如果能,写出B的化学式;如果不能,请说明理由 。 2.甲、乙、丙为短周期元素形成的常见单质,A、B、C、D、E、F、G、X均为常见的化合物。B、X的式量(分子量)相同,E的式量比D大16,在一定条件下各物质之间相互转化如下图所示: (1) X的电子式是,G的化学式是。 (2)上述物质中能与水发生反应(不考虑单纯的盐的水解)且反应中水既不是氧化剂也不是还原剂的物质的代号是。 (3)反应“D+丙”的化学方程式是。 (4)写出X与D在稀硫酸中反应的离子方程式。 3.甲、乙、丙三种常见的单质,X、Y、Z三种常见的化合物,它们在一定条件 下的相互转化关系如下: 请填写以下空白: (1)在X、Y、Z三种化合物中肯定含有乙、丙两种元素的化合物 是。 (2)在X、Z两种化合物的正价元素的化合价中,是。 A.前者高 B.后者高 C.不一定 原因是。 (3)当X为两种非金属元素组成的化合物时,写出X跟甲反应的化学方程式。写出丙跟乙反应的化学方程式。 (4)当X为金属元素与非金属元素组成的化合物时,写出X跟甲反应的化学方程式。写出丙跟乙反应的化学方程式。 4.有X、Y、Z三种单质,常温下X是固体,Y是液体,Z是气体。它们之间的反应关系如下图所示:
请填写下列空白: (1)据此推断X、Y、Z的化学式:X 、Y 、Z 。 (2) X是常见的单质,它是主族元素,还是副族元素,其理由是:。 (3)写出C+Y → A的离子方程式:。 5.根据以下反应关系图,回答下列问题: (1) A溶液所含溶质是:________________________; (2) A溶液跟B溶液反应的化学方程式是:_______________________________; (3) G转变为E的离子方程式是:__________________________________________。 6.甲、乙两种物质是常见的短周期元素的单质,其有关物质性质如图,其中C为白色沉淀,D为气体。 (1)若D为酸性气体,则A的化学式为。 (2)若D为碱性气体,则A的化学式为。 (3)若由两种元素组成的化合物M发生水解反应只生成两种酸N和P,则下列 有关说法中,正确的是。 A. M可能由两种非金属元素组成 B. N、P均一定为一元酸 C. M一定含有金属元素 D.此反应可能为氧化还原反应 E.生成物中的无氧酸和含氧酸并存 7、X、Y、Z、W为常见的4种单质。常温下,X是固体,Y是液体,Z是无色气 体,W为黄绿色气体。其反应关系如下,其中B的溶液显强酸性。 (1)根据反应推断X、Y、Z的化学式:__________、__________、 __________。 (2)指出X元素在元素周期表中的位置:__________。 (3)写出A溶于水后加入X的离子方程式:__________。 (4)写出C与过量W反应的离子方程式:__________。 8.A、B、C是所学过的三种单质,A、B、C及其它物质之间的反 应关系如下图所示。其中,B、D、E、F的水溶液呈酸性。
无机推断框图题 框图题融元素化合物、基本理论、计算于一体,使之成为一个完整的知识网,侧重于考查学生思维能力和综合应用能力。无机框图推断是无机化合物知识的综合考查,氯、硫、氮、铝、铁、钠元素及化合物之间的转化是框图题的热点。平时注意题眼的归纳,是解框图题的基础。 题眼一:常见气体归纳为三、三、三、五,即三种单质(H2、O2、Cl2),三种氢化物(HCl、H2S、NH3)、三种有机物(CH4、C2H2、C2H4)、五种氧化物(CO、CO2、NO、NO2、SO2)。 题眼二:气体溶解性归纳:难溶于水:H2、N2、CO、NO、CH4、C2H4;微溶于水:O2、C2H2;较易溶于水:Cl2(1:1)H2S(1:2.6)、SO2(1:40);极易溶于水:HF、HCl、HBr、HI、NH3。 题眼三:常见物质色态归纳:F2(黄绿色)、NO2(红棕色);Fe2+(浅绿色)、Fe3+(棕黄色),Cu2+(蓝色),MnO4-(紫色),事实证明过渡元素化合物有色为多。 题眼四:根据框图中同一元素化合价的变化为主线,即A→B→C→………型归纳:主要有C→CO→CO2;H2S→S→SO2→SO3(H2SO4);NH3→N2→NO→NO2→HNO3;Cl-→Cl2→ClO-→ClO3-;Fe→Fe2+→Fe3+。这里还有一个题眼,如有物质发生下列转化关系:A→B→C,A为无机物单质时,A可能为C、N、S、Na等,A 为有机物时,A可能为乙烯或醇类等。 题眼五:有些框图题只告诉我们单质及化合物之间的变化,无其他有效信息,我们可从反应类型加以归纳。在短周期中,属单质+化合物→单质+化合物(置换反应)类型的有: (1)单质同主族:2Na+2H2O=2NaOH+H2↑;2C+SiO2=Si+2CO;2H2S+O2=2S+2H2O (2)单质不同主族:2F2+2H2O=4HF+O2;2Mg+CO2=2MgO+C;2Al+6HCl=2AlCl3+3H2↑;H2S+Cl2=2HCl+S;C+H2O=CO+H2; 属于化合物+化合物→单质+化合物类型有:2Na2O2+2CO2=2NaCO3+O2;2Na2O2+2HO2=4NaOH+O2↑ 2H2S+SO2=3S+2H2O NOx+NH3→N2+H2O 2NaH+2H2O=3H2+2NaOH CO+H2O=H2+CO2 题眼六:对物质特征归纳:如有两种物质基础反应有沉淀和气体生成:(1)双水解,首先考虑Al3+和S2-、HS-、CO32-等。(2)氢氧化钡和硫酸铵。遇水能放出气体的有:Na、Na2O2、CaC2、Al2S3、Mg3N2。加碱能产生气体的有:NH3(NH4+);H2(Al、Si、Zn)。加酸有沉淀的如SiO32-、AlO2-、S2O32-等。有“电解”二字条件的则联想七种类型,代表物(HCl、CuCl2、NaCl、CuSO4、NaOH、H2SO4、NaNO3)。 对于氧化物要注意以下问题: ①氧化物不一定能直接与水作用生成对应的酸或碱; ②金属氧化物有可能是碱性氧化物也有可能是酸性氧化物或两性氧化物,一般有“高价酸,低价碱”的说法,即高价的是酸性氧化物,而低价的是碱性氧化物,如Mn2O7是酸性氧化物,而MnO则是碱性氧化物; ③酸性氧化物也叫酸酐,但酸酐不一定是氧化物,如有机酸酸酐就不是氧化物。 还有一些特殊的反应比较重要,应结合具体物质的性质,加以理解记忆。如 ①Cl2+H2O——②Cl2+NaOH—— ③Mg+CO2——④Al+NaOH+H2O—— ⑤SiO2+C——⑥NO2+H2O—— ⑦多元弱酸的正盐与自己的酸反应,生成相应酸式盐:Na2CO3+CO2+H2O—— ⑧弱酸的酸式盐与强碱反应,生成正盐:NaHCO3+NaOH—— ⑨弱酸的酸式盐与强酸反应生成弱酸。
无机框图推断专题复习 一、高考展望 无机框图推断是对常见元素的单质及其重要化合物相互关系的考查,它融元素化合物、基本理论、计算于一体。侧重考查学生思维的能力和综合应用的能力,在历届高考中具有较好的区分度和选拔能力。一般氯、硫、氧、氮、碳、钠、镁、铝、铁元素及化合物之间的转化是这类题的热点。解决这类考题,首先要读懂题意和图意,找准突破口(题眼),从自己的记忆中搜寻出典型的反应,事物或模型,然后大胆推测,只要符合框图关系的答案都是正确的。由于框图推断较好地考查了学生的直接思维品质,在高考中继续出现是理所当然。 二、“无机框图题”题眼归纳 (一)特征反应 1.与碱反应产生气体 (1)?? ? ????↑+=++↑+=++↑ ??→?- 232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质 (2)铵盐:O H NH NH 234 +↑?→?+碱 2.与酸反应产生气体 (1)? ??? ?? ???????????????????↑↑??→?↑???→??????↑↑??→?↑↑???→??????↑↑??→?↑?? ?→?↑ ??→?22222222223 4 23 4 234 2NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓(2)() () () ???????↑?→?↑?→?↑?→?+++------2323222323SO HSO SO S H HS S CO HCO CO H H H 化合物 3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S↓+SO 2↑+H 2O 4.与水反应产生气体 (1)单质?????↑ +=+↑+=+2222 2422222O HF O H F H NaOH O H Na (2)化合物()()()??? ?? ??↑ +=+↑+↓=+↑+↓=+↑ +=+22222232323222322222326233422H C OH Ca O H CaC S H OH Al O H S Al NH OH Mg O H N Mg O NaOH O H O Na
突破无机推断题 一:高考化学无机推断题解题方法 推断题对于很多中学生来说是一道非常难做的题,也是一道非常容易丢分的题,专家介绍,推断题分为无机推断题和有机推断题,下面介绍高考化学无机推断题解题方法。 1、限定范围推断:主要适用于气体或离子的推断,该类题目的主要特点是在一定范围内,根据题目给出的实验现象或必要的数据进行分析,作出正确判断。在解答这种类型的无机推断题时可以采用以下三种方法: ①审明题意,明确范围,注意题目所给的限定条件; ②紧扣现象,正确判断; ③要注意数据对推断结论的影响。 2、不定范围推断:常见元素化合物的推断。在遇到这种题目时,先迅速浏览一遍,由模糊的一遍“扫描”,自然地在头脑中产生一个关于该题所涉及知识范围等方面的整体印象,然后从题中找出特殊现象或特殊性质的描述,作为解题的突破口,进而全面分析比较,作出正确判断。 3、给出微粒结构等的微粒或元素推断题。解答这种类型推断题可以采用以下几种方法来解答:①熟记元素符号,直接导出;②掌握几种关系,列式导出;③利用排布规律,逐层导出;④弄清带电原因,分析导出;⑤抓住元素特征,综合导出;⑥根据量的关系,计算导出。 4、给出混合物可能组成的框图型或叙述型推断题。解框图型或叙述型推断题一般是根据物质的转化关系,从其中一种来推知另一种(顺推或逆推),或找出现象明显、易于推断的一种物质,然后左右展开;有时需试探求解,最后验证。 5、给出物质间转化关系的代码型推断题。此类推断题的特点是用代号表示各物质的转化关系,要求“破译”出各物质的分子式或名称等,看起来较复杂,其实在解题时,只要挖掘题眼,顺藤摸瓜,便可一举攻克。 6、给出物质范围的表格型推断题。对于此类型的题可进行列表分析,对号入座;直观明快,谨防漏解。 总之,解无机推断题首先要仔细读题、审清题意。其次,找突破口或“题眼”第三,推理从突破口向外扩展,通过顺推法、逆推法、假设法得出初步结论,最后作全面检查,验证推论是否符合题意。在此,建议广大中学生不妨试一试以上高考化学无机推断题解题方法。 二、无机推断题的特点
专题讲座五 无机框图题的解题策略 1.解题策略 无论推断题属于哪种形式,均遵循这样的推断思路:迅速浏览、整体扫描、产生印象、寻找“突破口”,突破点由点到面、随时检验,注意联系、大胆假设、全面分析(正推或逆推),验证确认。解题的关键是仔细审题,依物质的特性或特征转化来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。我们可以将推断题的解题方法及推理过程表示如下: 推断题――→审题??????????明显条件隐含条件――→抓关键(突破口)?????? ????结构特征反应特征现象特征其他特征――→推断结论―→验证 2.解题“突破口” (1)物质的特殊颜色 相关知识: ①有色固体: a.红色:Cu 、Cu 2O 、Fe 2O 3; b.红褐色:Fe(OH)3; c.黄色:AgI ; d.淡黄色:S 、Na 2O 2、AgBr ; e.蓝色:Cu(OH)2; f.黑色:炭粉、CuO 、MnO 2、FeS 、CuS ; g.紫黑色:KMnO 4、I 2; h.白色:Fe(OH)2、CaCO 3、BaSO 4、AgCl 、BaSO 3。 ②有色溶液: Fe 2+(浅绿色)、Fe 3+(黄色)、Cu 2+(蓝色)、MnO -4(紫红色)、Fe 3+与SCN - (血红色)、I 2与淀粉(蓝色)等。 ③有色气体:Cl 2(黄绿色)、Br 2(g)(红棕色)、NO 2(红棕色)、I 2(g)(紫色)、O 3(淡蓝色)等。 ④火焰颜色: a.焰色反应:Na +(黄色)、K +(紫色)、Ca 2+(砖红色)等; b.蓝色:CO 在空气中燃烧;
c.淡蓝色:S 、H 2、CH 4等在空气中燃烧; d.苍白色:H 2在Cl 2中燃烧。 【例1】 (2012·四川理综,26)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。已知A 、B 为气态单质,F 是地壳中含量最多的金属元素的单质;E 、H 、I 为氧化物,E 为黑色固体,I 为红棕色气体;M 为红褐色沉淀。 请回答下列问题: (1)B 中所含元素位于周期表中第________周期________族。 (2)A 在B 中燃烧的现象是__________________________________。 (3)D +E ―→B 的反应中,被氧化与被还原的物质的物质的量之比是__________。 (4)G +J ―→M 的离子方程式是__________________________________。 (5)Y 受热分解的化学方程式是____________________________。 解析 解题的关键是利用物质的颜色进行突破。Ⅰ为红棕色气体氧化物,一定是NO 2;M 为红褐色沉淀,一定是Fe(OH)3;F 是地壳中含量最多的金属元素的单质,一定是Al ;X 电解生成三种物质,其中A 、B 是气态单质且能反应生成D ,猜测是电解NaCl 溶液,生成的H 2和Cl 2反应生成HCl ,盐酸能与黑色固体E(氧化物)反应生成气体B ,则E 应是MnO 2,B 是Cl 2,则A 是H 2。NO 2和H 2O 反应生成HNO 3(N),HNO 3和Fe(OH)3反应生成Fe(NO 3)3(Y),Fe(NO 3)3可分解生成Fe 2O 3(H),Fe 2O 3与HCl 反应生成FeCl 3(J),NaOH(C)与Al 反应生成NaAlO 2(G),Fe 3+和AlO - 2可以发生双水解反应生成Fe(OH)3(M)。 答案 (1)三 ⅦA (2)产生苍白色火焰 (3)2∶1 (4)3AlO -2+Fe 3+ +6H 2O===3Al(OH)3↓+Fe(OH)3↓ (5)4Fe(NO 3)3=====△2Fe 2O 3+12NO 2↑+3O 2↑ (2)物质的特征性质 相关知识: ①能使品红溶液褪色的气体: SO 2(加热后又恢复红色)、Cl 2(加热后不恢复红色)。 ②沉淀特殊的颜色变化: 白色沉淀先变灰绿色,再变红褐色: Fe(OH)2――————→放置于空气中Fe(OH)3。
高三化学无机框图推断题 一.选择题 1.元素X的单质及X与Y形成的化合物能按如 右图所示的关系发生转化。则X为 A.Fe B.Cu C.S D.C 2.已知甲、乙、丙、X是四种中学化学常见的物质,其转化关系如图所示,则甲和X(要求 甲和X能互换)不可能是 A.Cl2和Fe B.SO2和NaOH溶液 C.C和O2 D.AlCl3溶液和NaOH溶液 3.右图所示的6个编号分别代表下列物质中的一物质: a.Al b.Fe2O3 c.NaOH溶液 d.氢碘酸溶液 e.NH3 f.O2 。 凡是用直线相连的两种物质均能发生化学反应(已知高温下氨气 能还原氧化铁)。则图中⑤表示的物质是 A.c B. a或b C.d D.e或f 4.由短周期元素组成的中学常见物质A、B、C, D、E、X,存在下图转化关系(部分生成 物和反应条件略去)。则下列推断不正确的是 A.若D是一种强碱,则A、B、C均可与X反应生成D B.若D为NaCl,且A可与C反应生成B,则E 可能是CO2 C.若D与盐酸反应,可生成A和B,则X一定是H2O D.若D是一种强酸,则A既可以是单质,也可以是化合物 5.一定条件下进行右图所示的化学反应,已知A、B、C中 均含有同一种元素。则以下叙述中不正确 ...是 A B C D D
A .物质D 一定为非金属单质 B.若A 为日常生活中常见的烃的衍生物,则C 为CH 3COOH C.若A 为非金属单质,则C 可能为CO 2 D.若A 为某无机气态化合物,则C 可能为NO 2 6. X 、Y 、Z 、W 均为中学化学常见物质,一定条件下它们有如图所示的转化 关系(某些产物已略去),则下列说法错误.. 的是 A .若X 为HNO 3,则W 可能为Fe B .若W 为O 2,X 可能是S C .X→Z 的离子反应可能为Al 3++4OH -=AlO 2- +2H 2O D .若W 为O 2,则Z 可能为CO 2 7. A 是淡黄色固体化合物,常温下D 是无色气体,C 为常见强碱, 含有的阴、阳离子均为10电子粒子。则C 中化学键类型为 A .只有离子键 B. 即有共价键、又有金属键 C. 只有共价键 D. 即有离子键、又有共价键 8.已知A 、B 、D 、E 均为中学化学常见单质或化合物,它们之间 的关系如图所示[部分产物略去,Fe 能与足量稀HNO 3反应生成 Fe(NO 3)3]。则下列说法错误的是 A .A 、 B 、D 可能是钠及其化合物 B .A 、B 、D 可能是铁及其化合物 C .A 、B 、 D 可能是铝及其化合物 D .A 、B 、D 不可能是非金属及其化合物 9.中学化学中几种常见物质的转化关系如右图所示。已 知将D 溶液滴入沸水中可得到以F 为分散质的红褐色 胶体。则无法区别C 与D 中金属离子的试剂为 A.无水乙醇 B.酸性KMnO 4溶液 C. NH 4SCN 溶液 D.NaOH 溶液 10.已知O 为金属单质,且右图所示反应均为氧化还原反应, H I J O O H I J O O
“无机框图推断题”题眼 方法一:根据物质的特殊颜色推断 知识准备:物质颜色 1.有色固体: 白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3、铵盐,白色或黄色腊状固体:白磷 淡黄色或黄色:S 黄或浅黄、FeS2黄、AgI 黄、Au 黄、Na2O2 浅黄、AgBr 浅黄、Ag3PO4浅黄等。 红色或红棕色:Cu 紫红、Cu2O 红、Fe2O3红棕色、Fe(OH)3红褐色。 黑色:C、CuS、Cu2S 、FeS 、MnO2、FeO、Fe3O4(磁性物质)、CuO、PbS 、Ag2O棕黑 紫黑色:I2紫黑、KMnO4紫黑。 2.有色溶液: Cu2+蓝、MnO4-紫红、Fe2+浅绿、Fe3+ 棕黄、Fe(SCN)3血红、NO2-浅黄。 氯水浅黄绿色、溴水橙黄色、碘水棕黄色、溴的有机溶液橙红—红棕、I2的有机溶液紫红 3.气体小结 1、有颜色的气体:F2(淡黄绿色),Cl2(黄绿色),NO2(棕色),溴蒸气(红棕色)、I2(紫色)、O3(淡蓝色)。其余均为无色气体。 2、有刺激性的气体:HF,HCl,HBr,HI,NH3,SO2,NO2,F2,Cl2,溴蒸气。有臭鸡蛋气味的气体:H2S 3、易溶于水的气体:HF,HCl,HBr,HI,NH3,SO2和NO2。能溶于水的气体:CO2,Cl2,H2S和溴蒸气。 4、易液化的气体:NH3,SO 2,Cl2 5、有毒的气体:F2,HF,Cl2,H2S,SO2,CO,NO,NO2和溴蒸气。 6、在空气中易形成白雾的气体:HF,HCl,HBr,HI 7、常温下由于发生化学反应而不能共存的气体:H2S和SO2,H2S和Cl2,HI和Cl2,NH3和HCl,NO和O2,F2和H2 8、其水溶液呈酸性且能使紫色石蕊试液变红色的气体:HF,HCl,HBr,HI,H2S,SO2,CO2,NO2和溴蒸气。可使紫色石蕊试液先变红后褪色的气体:Cl2。可使紫色石蕊试纸变蓝且水溶液呈弱碱性的气体:NH3 9、有漂白作用的气体:Cl2(有水时)和SO2。 10、能使澄清石灰水变浑浊的气体:CO2,SO2,HF。 11、能使无水CuSO4变蓝的气体:水蒸气。 12、在空气中可燃的气体:H2,CH4,C2H2,C2H4,CO,H2S。在空气中点燃后火焰呈淡蓝色的气体:H2S,CH4,CO,H2。 13、具有氧化性的气体:F2,Cl2,溴蒸气,NO2,O2。具有还原性的气体:H2S,H2,CO,NH3,HI,HBr,HCl,NO。SO2和N2通常既可显示氧化性又可显示还原性。 14、与水可发生反应的气体:Cl2,F2,NO2,溴蒸气,CO2,SO2,NH3。其中Cl2,F2,NO2,溴蒸气和水的反应属于氧化还原反应。 15、在空气中易被氧化变色的气体:NO。 16、能使湿润的KI淀粉试纸变蓝的气体:Cl2,NO2,溴蒸气。 17、遇AgNO3溶液可产生沉淀的气体:H2S,Cl2,溴蒸气,HCl,HBr,HI,NH3。其中NH3通入AgNO3溶
高三化学(无机推断题)精选汇编 1.( 14 分)下图是无机物A ~N 在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I 是由第三周期元素组成的单质中熔点最高的金属,K 是一种红棕色气体。N 中只含有两种元素,N 可作为工业生产C 的原料。 请填写下列空白: (1)在周期表中,组成单质G 的元素位于第__________周期_______族。 (2)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________(填写序号)。 (3)反应⑩的离子方程式是:_______ ______。 (4)反应④ 的离子方程式是:___________________________________。 (5)将化合物D 与KNO 3、KOH 共融,可制得一种“绿色”环保高效净水剂K 2FeO 4 (高铁酸钾).同时还生成KNO 2和H 2O 。该反应的化学方程式是: ________________________________________________________________(6)现有1molN 参加反应,假设各步反应均完全,生成C 的质量为490g ,生成G 的质量为224g ,则反应①的化学方程式为_______________________。 1.( 14 分) ( l )四(或4 ) VIII (共1分,错一个扣1分) ( 2 )③ (1分) ( 3 ) 3Fe +2 NO 3- + 8H + + = 3Fe 2+ + 2NO ↑+4H 2O (3分) ( 4 ) 3Fe 2+ + NO 3- + 4H + + = 3Fe 3+ + NO ↑+2H 2O (3分) ( 5 ) Fe 2O 3+3KNO 3+4KOH 高温 2K 2FeO 4+3KNO 2+2H 2O (3分) (6)Fe 4S 5+8O 2高温 2Fe 2O 3+5SO 2(3分) 2.(10分)无机框图下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A 、C 、D 是常见的气体单质,F 气体极易溶于水,且液态常做致冷剂。 电解 C D E F ① ③ F B ② ④ A G A B 溶液 (1 )写出化学式F ,写出电子式G ; (2)鉴定G 中阳离子的实验方法和现象__________________________________; (3)D 单质和E 溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E 溶液反应的离子方程式和③的化学方程式 、 。 (4)工业上电解B 溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数