
第二章化学反应与能量
第二节化学能与电能
教材分析:
化学能与电能,是化学学科的理论性知识之一,以氧化还原反应原理为依托是对其本质的拓展和应用。因为学生在初中化学初步学习了“化学与能源”,在选修模块4将系统深入地学习化学反应与能量,本节为选修模块的学习奠定了基础。本节涉及到以下知识:氧化还原反应;能量的转换;原电池原理的应用;电解质溶液、金属的活泼性;物理学科的电学知识。通过本节课的学习,学生从实践到理论,以及从理论到实践的认知规律将会有很大的提高。而且原电池在实际生活、工农业生产、科学研究中应用十分广泛,因此学好本节知识,具有重要的理论意义和现实意义。
学情分析:
学生在初中的学习过程中已了解金属活动性,在必修一的学习中了解了氧化还原反应,通过对物理学科电学的学习也有一定的电学知识。因此,已经具备学习本课的的理论基础。新课程背景下要求学生自主探索,主动求知,学会收集、分析和利用各种信息及信息资源,并以此发展学生的实践能力、创新精神,合作与分享意识、社会交往能力和社会责任感。因此,在设计《化学能与电能》这节课时,我采用学案导学、分组实验和小组讨论的形式让学生自主探索问题,分析问题,解决问题,强化学生的探究意识;以实验现象激发学生的探究兴趣,引发学生通过对实验现象的观察,实验原理的分析,真正理解了原电池的本质(氧化还原反应),分析归纳构成原电池的条件。这样,学生不仅掌握了化学知识和规律,而且获得了探求知识的途径与方法。
教学目标:
知识与技能:1、了解原电池原理,能写出电极反应和电池反应方程式。
2、初步了解原电池的装置。
过程与方法:通过对化学能转化为电能的学习,体验科学探究的过程,理解科学探究的意义、基本过程和方法。
情感态度与价值观:关注化学科学对个人生活和社会发展的贡献,关注能源问题,逐步形成正确的能源观。
教学重点:认识原电池的工作原理;形成原电池的概念
教学难点:用已经学过的有关知识探究化学能转化为电能的条件和装置
教学方法:实验探究法、小组讨论
仪器用品:仪器:电流表、导线、小烧杯。
药品:稀硫酸、铜片、锌片。
学生自备:苹果(西红柿)
设计流程:
(一)课前学习:
1、旧知回顾,复习氧化还原反应
2、自主学习:能源分类及火电站工作原理
(二)课堂学习:
1、思考交流锌与稀硫酸反应电子转移情况
2、小组合作完成实验
Cu
Zn
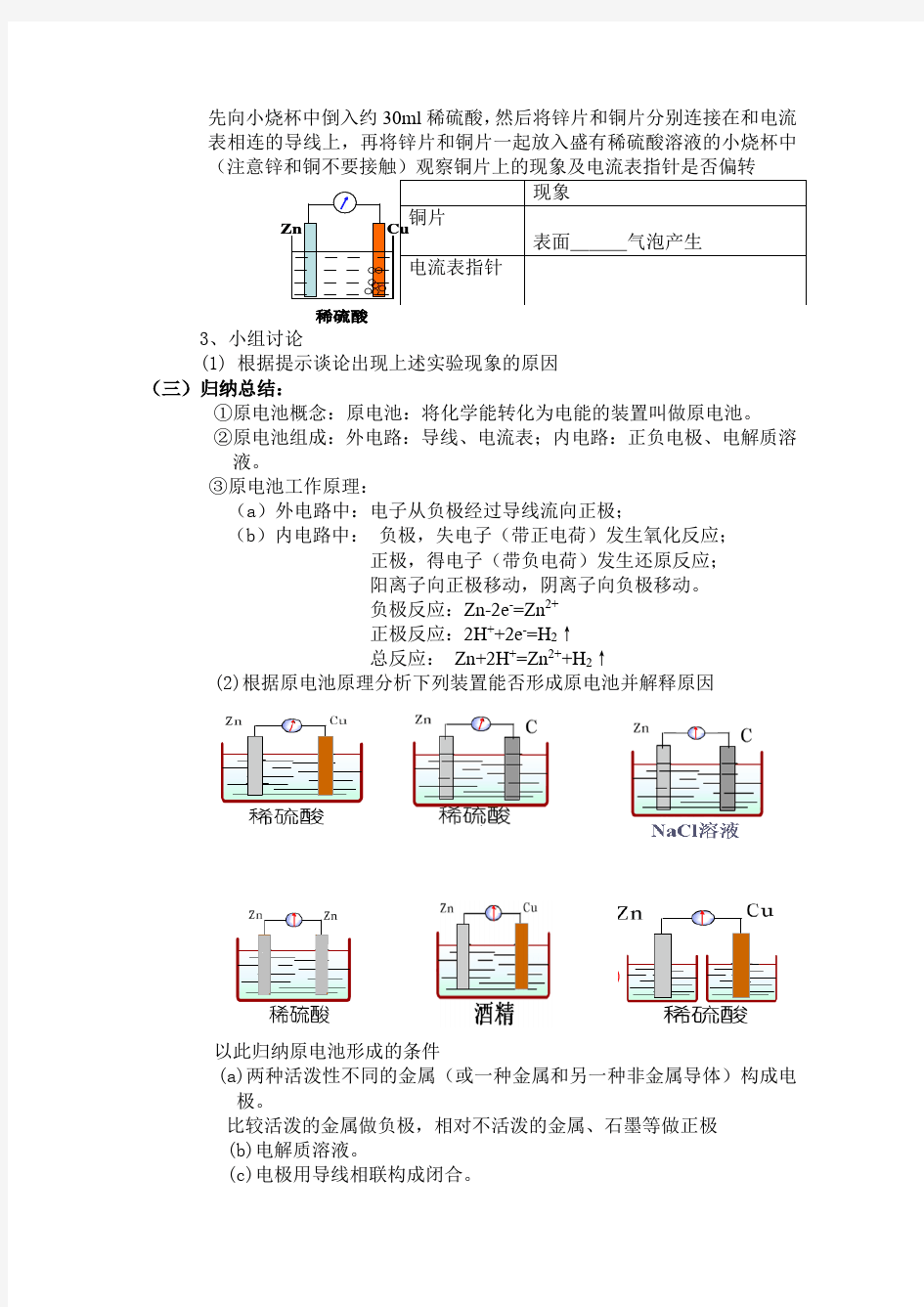
稀硫酸
先向小烧杯中倒入约30ml稀硫酸,然后将锌片和铜片分别连接在和电流表相连的导线上,再将锌片和铜片一起放入盛有稀硫酸溶液的小烧杯中
3、小组讨论
(1) 根据提示谈论出现上述实验现象的原因
(三)归纳总结:
①原电池概念:原电池:将化学能转化为电能的装置叫做原电池。
②原电池组成:外电路:导线、电流表;内电路:正负电极、电解质溶
液。
③原电池工作原理:
(a)外电路中:电子从负极经过导线流向正极;
(b)内电路中:负极,失电子(带正电荷)发生氧化反应;
正极,得电子(带负电荷)发生还原反应;
阳离子向正极移动,阴离子向负极移动。
负极反应:Zn-2e-=Zn2+
正极反应:2H++2e-=H2↑
总反应:Zn+2H+=Zn2++H2↑
(2)根据原电池原理分析下列装置能否形成原电池并解释原因
以此归纳原电池形成的条件
(a)两种活泼性不同的金属(或一种金属和另一种非金属导体)构成电
极。
比较活泼的金属做负极,相对不活泼的金属、石墨等做正极
(b)电解质溶液。
(c)电极用导线相联构成闭合。
现象
铜片
表面___气泡产生
电流表指针
(d)有一个自发的氧化还原反应。
(四)巩固练习(题见学案)
(五)趣味实验:小组合作完成水果原电池实验
(六)板书设计:
1、原电池概念:原电池:将化学能转化为电能的装置叫做原电池。
2、原电池组成:外电路:导线、电流表;内电路:正负电极、电解质
溶液。
3、原电池工作原理:
(a)外电路中:电子从负极经过导线流向正极;
(b)内电路中:负极,失电子(带正电荷)发生氧化反应;
正极,得电子(带负电荷)发生还原反应;
阳离子向正极移动,阴离子向负极移动。
负极反应:Zn-2e-=Zn2+
正极反应:2H++2e-=H2↑
总反应:Zn+2H+=Zn2++H2↑
4、原电池形成的条件
(a)两种活泼性不同的金属(或一种金属和另一种非金属导体)构成电
极。
比较活泼的金属做负极,相对不活泼的金属、石墨等做正极
(b)电解质溶液。
(c)电极用导线相联构成闭合。
(d)有一个自发的氧化还原反应。
(七)作业布置:
1、课后探究
2、课后习题
教学反思:本节课通过教师引导、学生讨论、分组实验的形式展开。激发了学生的学习兴趣,同时也锻炼了学生的动手能力,学生学习效率较高。
学生通过对原电池工作原理的讨论对很自然的就判断出原电池的
正、负极。在以后的教学中要注重学生的讨论和分组实验,激发学
生学习兴趣,提高学习效率。
附学案设计:
课前学习:
1、旧知回顾:
(1)以镁和稀硫酸反应为例分析
①该反应是否为氧化还原反应__________
②___元素的化合价升高,___电子,被___,称为___剂;
硫酸中___元素化合价降低,___电子,被___,称为___剂。
③氧化还原反应的本质__________
2、自主学习:
(1)能源的分类:一次能源__________(举例)
二次能源__________(举例)
(2)看课本40页图2-8了解火电站工作原理
燃料燃烧(___能转化为___能)→加热水使水汽化为蒸气推动蒸汽轮机(___能转化为___)→带动发电机发电(___能转化为电
Cu
Zn
稀硫酸
能)
课堂学习:
探究在不同条件下将锌片、铜片放入硫酸中出现不同现象的原因
1、思考交流
(1)根据初中所学的知识填写表格将锌片和铜片分别放入稀硫酸中锌
(2)写出锌与稀硫酸反应的化学方程式及离子方程式
(3)锌与稀硫酸的反应是氧化还原反应吗?如果是请分析①哪种物质发生氧化反应,哪种物质发生还原反应?②电子是如何转移的
2.小组合作完成实验
先向小烧杯中倒入约30ml稀硫酸,然后将锌片和铜片分别连接在和电流表相连的导线上,再将锌片和铜片一起放入盛有稀硫酸溶液的小烧杯中
3.小组讨论
(1)从电子转移的角度分析出现实验2中现象的原因(提示:溶液中的电阻远大于导线中的电阻,电子沿导线流动;离子在溶液中自由移动)
(2)根据原电池原理分析下列装置能否形成原电池并解释原因
现象原因
铜片表面___气泡产生
锌片表面___气泡产生
现象
铜片
表面___气泡产生
电流表指针
归纳总结:
化学能转化为电能
1、原电池:将_____能转化为____能的装置叫做原电池。
2、原电池的组成:外电路:________;内电路:______
_。
3、原电池工作原理:
(1)外电路中:电子从___极经过___流向___极;
(2)内电路中:负极,___电子(带___电荷)发生____
反应;
正极,___电子(带___电荷)发生____反应;
阳离子向___极移动,阴离子向___极移动。
负极反应:____________
正极反应:____________
总反应:_______________
4、原电池形成的条件:
①两种活泼性不同的____(或一种金属和另一种非金属导体)构成
电极。
比较活泼的金属做___极,相对不活泼的金属、石墨等做____极
②______溶液。
③电极用导线相联构成______。
④有一个自发的______反应。
巩固练习:
1.对于原电池的电极名称叙述有错误的是()
A.发生氧化反应的为负极
B.正极为电子流入的一极
C.比较不活泼的金属为负极
D.电流的方向由正极到负极
2、下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是()
3、比较金属的活动性强弱
原电池中,一般活动性强的金属为极,活动性弱的金属为极。例如有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极
上有气泡产生,由原电池原理可知,金属活动性A B。
4、下列关于原电池的叙述中,正确的是()
A.负极发生的电极反应是还原反应B.能将化学能转化为电能C.工作时其正极不断产生电子并经外电路流向负极
D.电极只能由两种不同的金属构成
5、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c 极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为: ( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
6、类比锌铜原电池的原理,根据如下装置图回答下列问题
现象:铜片,铁片。
电极反应:负极
正极
总反应
课后探究
7、设计原电池利用Cu+2AgNO3===Cu(NO3)2+2Ag
(1)画出装置图
(2)负极反应:
(3)正极反应:
8、收集资料,解释水果原电池形成的原因